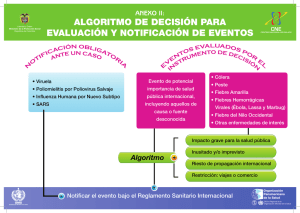
Plan Regional de Contención de Poliovirus en las
Anuncio

Documento de Trabajo Plan Regional de Contención de Poliovirus en Las Américas (GAP-III Regional) Minimizando el riesgo de restablecer la transmisión de poliovirus a partir de laboratorios y otras instalaciones en la Región de las Américas Nota de OPS: Partes del texto original del documento GAPIII de la OMS fueron eliminadas o adaptadas para alinear el plan Regional con las recomendaciones del grupo pequeño de trabajo que se reunió en abril de 2015 en Washington D.C. El Grupo Técnico Asesor sobre Enfermedades Prevenibles por Vacunación de la OPS en su XXIII reunión avalo la propuesta del Plan Regional de contención de poliovirus en la Región de las Américas. Unidad de Inmunización Integral de la Familia Departamento de Familia, Género y Curso de Vida Organización Panamericana de la Salud Washington, D.C. Julio, 2015. Grupo pequeño de trabajo Sergio Diego Luis Miguel, Consultor Bioseguridad y Biocontención, Argentina. Miguel Ángel Castro Jiménez, Grupo Colombiano de Estudios Alfa en Epidemiología, Colombia. Cristina Laura Lema, INEI – ANLIS “Carlos G. Malbran”, Argentina. Edson da Silva, FIOCRUZ, Brasil. Gloria Rey-Benito, FGL/IM, OPS Washington Coordinación y Revisión Cuauhtémoc Ruiz-Matus, FGL/IM, OPS Washington María Cristina Pedreira, FGL/IM, OPS Washington Gloria Janneth Rey-Benito, FGL/IM, OPS Washington 2 Abreviaturas IPV Vacuna inactivada contra la poliomielitis OMS Organización Mundial de la Salud OPS Organización Panamericana de la Salud OPV Vacuna oral contra la poliomielitis bOPV Vacuna bivalente oral contra la poliomielitis; contiene los serotipos 1 y 3 mOPV Vacuna monovalente oral contra la poliomielitis (tipo específica) tOPV Vacuna trivalente oral contra la poliomielitis VAPP Poliomielitis paralítica asociada con la vacuna VDPV Poliovirus derivado de la vacuna aVDPV Poliovirus ambiguo derivado de la vacuna cVDPV Poliovirus circulante derivado de la vacuna iVDPV Poliovirus derivados de la vacuna relacionado a inmunodeficiencia GAPIII Plan de acción mundial, tercera edición 3 Contenidos Abreviaturas ........................................................................................................................................ 3 Presentación........................................................................................................................................ 5 Prólogo ................................................................................................................................................ 6 LO BÁSICO DEL GAP III DE OMS Y LA ADAPTACIÓN DEL PLAN PARA LA REGIÓN DE LAS AMÉRICAS (GAP III-REGIONAL) ............................................................................................................................. 7 Introducción ........................................................................................................................................ 8 Razón fundamental ........................................................................................................................... 10 Estrategia........................................................................................................................................... 12 Eliminación del Riesgo................................................................................................................... 12 Gestión del riesgo biológico .......................................................................................................... 12 Descripción e implementación de las fases ...................................................................................... 15 Fase I: Preparación para la contención del poliovirus .................................................................. 15 Preparación para el switch (cambio) de tOPV a bOPV .............................................................. 19 Fase II: Período de contención del poliovirus tipo 2 ..................................................................... 19 Fase IIa: Contención de poliovirus salvaje (WPV) ..................................................................... 19 Fase IIb: Contención de los poliovirus OPV/Sabin tipo 2 (OPV2 / Sabin2) ................................ 20 Preparación para la Fase III ........................................................................................................... 23 Fase III: contención final de poliovirus .......................................................................................... 24 Fase IIIa (contención definitiva mejorada de todos los poliovirus salvajes) ............................. 24 Fase IIIb: Contención final de todos los poliovirus OPV/Sabin ................................................. 25 Consideraciones adicionales del GAPIII-R ......................................................................................... 29 Decisión acerca de la inclusión o no del líquido cefalorraquídeo como material potencialmente infeccioso de poliovirus. ................................................................................. 30 Bibliografía ........................................................................................................................................ 31 Definiciones ....................................................................................................................................... 32 Cronograma....................................................................................................................................... 37 ANEXOS DEL GAPIII-R ........................................................................................................................ 38 Anexo A ............................................................................................................................................. 39 Encuesta de actualización de instituciones / laboratorios que conservan material de poliovirus salvaje e identificación de instalaciones que conservan material de poliovirus vacunal o materiales potencialmene infecciosos de poliovirus. ................................................................... 39 Anexo B ............................................................................................................................................. 40 Notificación de culminación de la encuesta de actualización e inventario de las instalaciones que conservan material infeccioso o potencialmente infeccioso de poliovirus .................................. 40 4 Presentación Esta documento de trabajo, abreviado como GAPIII-R (OPS), contiene el plan de acciones propuestas para minimizar el riesgo de restablecer la circulación de los poliovirus en la Región de las Américas a partir de laboratorios y otras instalaciones, luego de alcanzar la erradicación del poliovirus salvaje y el cese de la vacunación oral contra la poliomielitis. Este es un documento concertado y adaptado para la Región por el grupo pequeño de trabajo de la Organización Panamericana de la Salud (OPS) a partir del documento “GAPIII: WHO global action plan to minimize poliovirus facility-associated risk after type-specific eradication of wild polioviruses and sequential cessation of OPV use” de la Organización Mundial de la Salud. 5 Prólogo En diciembre de 2014, la Organización Mundial de la Salud (OMS) publicó el documento “GAPIII WHO global action plan to minimize poliovirus facility-associated risk after type-specific eradication of wild polioviruses and sequential cessation of OPV use”1,2 cuyo objeto principal es socializar la estrategia global para minimizar el riesgo de restablecimiento de la circulación del virus de la polio a partir de las muestras infecciosas y potencialmente infecciosas que se encuentran almacenadas en instalaciones de diferentes sectores, incluyendo, por supuesto, los laboratorios. Las acciones que contiene GAPIII están justificadas en varias decisiones globales que inician con la Iniciativa Global para la Erradicación de la Polio en mayo de 1988 (WHA41.28) 3,4 y que se actualizan en el reciente “Plan Estratégico 2013-2018: Erradicación de la Polio & Etapa Final” 5,6. La estrategia para minimizar el riesgo de restablecer la circulación de los poliovirus asociado a instalaciones descrito en GAPIII consiste tanto en su eliminación a través de la destrucción de los materiales considerados fuente conocida o probable del virus7, excepto en instalaciones esenciales certificadas, como en el manejo adecuado del riesgo biológico en dichas instalaciones por adherencia estricta a las salvaguardias requeridas. Las razones para llevar a cabo esta tarea de eliminación y aseguramiento de contención en instalaciones apropiadas se basa en diferentes escenarios explicados más adelante. En este documento se busca abordar las acciones recomendadas por la Organización Mundial de la Salud en la guía del GAPIII para la contención de los virus de la polio, tanto salvaje como vacunal, y la lectura y recomendaciones que de ellas se hacen desde la Organización Panamericana de la Salud. Este documento contiene los términos y lineamientos abordados en el GAPIII de OMS y su adaptación en el Plan Regional para Las Américas, se incluyen los formatos de la encuesta y una propuesta de notificación de los resultados finales. Traducido al lenguaje español, el título sería: GAPIII-Plan de Acción Global de la Organización Mundial de la Salud para minimizar el riesgo de poliovirus asociado a instalaciones después de la erradicación del poliovirus salvaje y el cese secuencial del uso de vacuna oral de polio/Sabin (OPV, Oral polio vaccine) 2 Organización Mundial de la Salud. GAPIII - WHO global action plan to minimize poliovirus facility-associated risk after type-specific eradication of wild polioviruses and sequential cessation of OPV use. 29 de diciembre de 2014. http://www.polioeradication.org/Portals/0/Document/Resources/PostEradication/GAPIII_2014.pdf 3 Traducido por los autores al lenguaje español. El título original en inglés es, Global Polio Eradication Initiative, GPEI 4 Organización Mundial de la Salud. Resolución WHA41.28. Global eradication of poliomyelitis by the year 2000. Disponible en: http://www.polioeradication.org/content/publications/19880513_resolution.pdf 5 Los términos especializados mencionados en GAPIII son definidos en ese mismo documento y serán especificados en español en la sección “Anexo 1. Definiciones”. Se recomienda su lectura cuidadosa. 6 Traducido por los autores al lenguaje español. El título original en inglés es, Polio Eradication & Endgame: Strategic Plan (PEESP), 2013-2018. 7 Se hace referencia tanto a materiales infecciosos como potencialmente infecciosos para virus salvaje y de vacuna oral OPV/Sabin. Una explicación más detallada se encuentra en la sección “Anexo 1. Definiciones” (parte I). 1 6 LO BÁSICO DEL GAP III DE OMS Y LA ADAPTACIÓN DEL PLAN PARA LA REGIÓN DE LAS AMÉRICAS (GAP IIIREGIONAL) (Traducción de los aspectos más relevantes del GAPIII a partir de la versión original en inglés. Los aspectos adicionales y los referentes a bioseguridad pueden ser abordados directamente en el documento original. El contenido de este documento ha sido adaptado a las condiciones de la Región de las Américas). 7 Introducción La Iniciativa Global para la Erradicación de la Polio ha sido el mayor esfuerzo de salud pública internacional desde su lanzamiento en 1988, y ha involucrado billones de dólares americanos donados por socios, esfuerzos constantes de los gobiernos en todos sus niveles, horas incontables de servicios voluntarios e inmunización de millones de niños con la vacuna oral contra la poliomielitis (OPV). El Plan Estratégico 2013-2018: Erradicación de la Polio & Etapa Final (3) estableció el objetivo de un mundo libre de polio en 2018. Para llegar a cumplirlo se requiere: i) ii) iii) completar la erradicación para eliminar el riesgo de transmisión de poliovirus salvaje (WPV); el cese del uso de vacunas OPV para eliminar el riesgo de poliomielitis paralítica asociada con la vacuna (VAPP), infecciones crónicas por poliovirus derivados de la vacuna en personas inmunodeficientes (iVDPV), y los brotes de poliovirus circulantes derivados de vacunación (cVDPV ) (4,5); y, la aplicación de medidas seguras de manejo y contención de poliovirus para reducir al mínimo el riesgo de una reintroducción del virus desde las instalaciones en la comunidad libre de polio. El primer paso hacia el cese del uso de la OPV trivalente (tOPV) será el retiro del componente de poliovirus vacunal tipo 2 (OPV2), la cual ha causado más del 90% de los casos de cVDPV desde la erradicación del poliovirus salvaje tipo 2 (WPV2) en 1999. La OPV bivalente (bOPV, tipos 1 y 3) reemplazará a la tOPV en los programas globales de inmunización, cambio que será facilitado por la introducción de al menos una dosis de vacuna inactivada contra la poliomielitis (IPV), la cual estará compuesta por los tres tipos de virus. Para lograr proporcionar dosis de IPV adecuadas para todos aquellos países que utilizan OPV se requiere la combinación de la compra en volumen de productos de vacunas IPV existentes y la producción de opciones alternativas de IPV a bajo costo (por ejemplo, Sabin-IPV) para los países en desarrollo para que puedan cumplir sus necesidades programáticas. Hasta el cese del uso de la OPV, la bOPV será la vacuna de elección para responder a cualquier brote de los poliovirus salvajes tipo 1 (WPV1) y tipo 3 (WPV3), mientras que la OPV2 monovalente (mOPV2) lo será ante los brotes de poliovirus salvaje tipo 2. Después del cese del uso de la OPV, una combinación de mOPV específica por tipo y de IPV serán utilizadas para responder ante cualquier brote de cualquier poliovirus salvaje (WPV) o de poliovirus derivado de la vacuna (VDPV). El consenso global para cesar el uso de bOPV necesitará certeza internacional en cuanto a que: la transmisión de los poliovirus salvajes y los derivados de la vacuna ha sido interrumpida existe disponibilidad de vacunas IPV económicas, seguras y eficaces. los brotes posibles de ser detectados o emerger nuevamente cVDPV pueden ser controlados el riesgo de recirculación de poliovirus salvajes u OPV/Sabin puede ser minimizado. 8 La tercera edición del Plan de Acción Mundial (GAPIII) alinea la manipulación segura y la contención de materiales infecciosos y potencialmente infecciosos para poliovirus con la Estrategia de Etapa Final (Endgame) de la OMS y remplaza versiones previas incluyendo la segunda edición del Plan de Acción Global de la OMS para contención en laboratorios del poliovirus salvaje (6). La tercera edición del GAPIII: • Describe los plazos y requisitos que deben ser cumplidos en la preparación para la contención del poliovirus tipo 2, implementados durante todo el período de contención del poliovirus tipo 2, y aplicados en las fases posteriores a la erradicación y a la bOPV. • Aborda la contención específica por tipo de poliovirus salvaje y de OPV/Sabin, en consonancia con el objetivo de cese secuencial del uso de la OPV después de la erradicación del poliovirus salvaje tipo específico (7). • Balancea la necesidad para acceso equitativo a poliovirus (por ejemplo, para producción de vacunas) a lo largo del periodo de contención y post-erradicación del poliovirus tipo 2 contra el riesgo basado en los resultados de evaluación, modelos de consecuencia (8), y estrategias de gestión (Anexos 2 y 3 del GAPIII). • Establece el objetivo a largo plazo de minimizar el riesgo de poliomielitis asociado a instalaciones en la era post-erradicación y post bOPV mediante acceso continuo a IPV o Sabin-IPV asequibles y seguras y a través de la reducción del número de instalaciones que manipulen y almacenen poliovirus a un mínimo con funciones esenciales y que cumplan todas las salvaguardias (garantías o salvaguardas) requeridas. GAPIII es un documento en evolución, sujeto a revisiones a medida que nueva información relevante aparezca para lograr el balance apropiado entre riesgo en la comunidad y los sistemas y controles para gestionar ese riesgo. La normativa de gestión de riesgo biológico para poliovirus (Anexos 2 y 3 del GAP III) proporciona el marco para la certificación de las instalaciones con base en los principios de un sistema de gestión del riesgo biológico. La norma exige que la institución o instalación comprenda los riesgos asociados a sus actividades y gestionen tales riesgos de manera aceptable para los organismos nacionales e internacionales encargados de la supervisión del trabajo con poliovirus. Las autoridades nacionales son responsables para revisar la aplicación de estas normas y principios de gestión de riesgos a las circunstancias locales. Aunque los Anexos 2 y 3 del GAPIII son escritos específicamente para cepas existentes de poliovirus salvajes y OPV/Sabin, posiblemente emerjan nuevas cepas que se espera sean más atenuadas, menos patógenas y más seguras que las cepas de la OPV/Sabin. La evidencia será revisada por un panel de expertos científicos convocados por la OMS para considerar los controles requeridos para su contención y manipulación segura. 9 Razón fundamental Cuando la circulación de poliovirus salvaje sea interrumpida se espera que el interés en la inmunización contra la polio disminuya y la susceptibilidad de la población incremente en muchas partes del mundo. Una reintroducción del poliovirus salvaje desde una instalación llevaría a las consecuencias potencialmente graves por restablecimiento de la transmisión del poliovirus. Cuando el uso de la OPV cese, muchos países continuarán con una cobertura poblacional alta con la IPV, en otros países será subóptima, y otros podrían incluso descontinuar todas las actividades nacionales de inmunización contra la poliomielitis. Una reintroducción de una cepa OPV/Sabin desde una instalación podría llevar a una transmisión no reconocida del virus, a la reversión a cVDPV, y, similar a lo que ocurriría con polio salvaje, a las posibles consecuencias de restablecimiento de la transmisión del poliovirus (8). La mayoría de los países no tendrá necesidad de conservar poliovirus vivos en la era posterior a la erradicación y al cese definitivo de la OPV. Los riesgos asociados a instalaciones en estos países pueden ser eliminados mediante una búsqueda exhaustiva a nivel nacional y posterior destrucción de todos los materiales infecciosos y potencialmente infecciosos de poliovirus salvajes y OPV/Sabin. Algunos países albergarán un número limitado de instalaciones con poliovirus para cumplir funciones internacionales esenciales como la producción de IPV y Sabin-IPV, la producción y el almacenamiento de las existencias de mOPV, el aseguramiento de la calidad de las vacunas, la producción de reactivos de diagnóstico, las funciones de referencia y diagnostico viral, e investigación crucial. Cada una de estas instalaciones esenciales en poliovirus debería gestionar el riesgo biológico apropiadamente para minimizar el riesgo de liberación del virus a la comunidad, con procesos de certificación nacional efectivos y programas de verificación de la OMS. El riesgo de reintroducción del poliovirus puede ser minimizado mediante: i) ii) iii) ubicación de las instalaciones esenciales en áreas con niveles elevados de inmunidad poblacional; programas efectivos de la parálisis flácida aguda y de vigilancia ambiental de poliovirus; y, salud pública eficiente y con capacidad de respuesta. Las consecuencias pueden ser minimizadas aún más por trabajar solamente con cepas Sabin/OPV u otras más atenuadas, las cuales tienen tasas básicas de reproducción (R0) más bajas que los 10 poliovirus salvajes (8). Minimizar el número de instalaciones esenciales a nivel mundial disminuye aún más la magnitud del riesgo, facilita la supervisión nacional e internacional, y refuerza la probabilidad de que los estándares globales de contención puedan ser cumplidos y mantenidos exitosamente. 11 Estrategia La estrategia global para minimizar el riesgo asociado a instalaciones con poliovirus consiste en la eliminación del riesgo por destrucción de los materiales con poliovirus en todas las instalaciones, excepto aquellas esenciales certificadas, y en la gestión del riesgo biológico de éstas por adherencia estricta a las salvaguardias (garantías) requeridas. Eliminación del Riesgo La eliminación del riesgo en instalaciones no esenciales se logra por medio de la destrucción o la transferencia (traslado) a instalaciones esenciales de materiales infecciosos y potencialmente infecciosos de poliovirus salvaje y OPV/Sabin. La destrucción aplica para todos los materiales potencialmente contaminados con cualquier tipo o cepa de poliovirus salvaje o de OPV/Sabin, o donde la presencia de estos poliovirus no puede ser descartada, particularmente con respecto a existencias (stocks o reservas) de virus no evaluadas en instalaciones que en el pasado trabajaron con poliovirus (9) y en instalaciones sin este antecedente que tengan materiales clínicamente valiosos que podrían estar infectados con poliovirus o materiales OPV/Sabin. El éxito de la eliminación global de riesgo requiere que cada país prohíba efectivamente la retención y adquisición posterior de materiales de poliovirus en todas las instalaciones no esenciales siguiendo las recomendaciones mundiales (3). Gestión del riesgo biológico La gestión del riesgo biológico en las instalaciones designadas como esenciales para poliovirus se logra por medio de la implementación de los estándares internacionales, el cual: incluye requerimientos de contención específicos en polio para reducir la probabilidad de liberación del poliovirus desde las instalaciones esenciales (salvaguardias o garantías primarias) describe los requerimientos de inmunidad poblacional (salvaguardias secundarias) para minimizar las consecuencias de la liberación de los poliovirus desde las instalaciones esenciales, y, define los requerimientos ambientales específicos por sitio para las instalaciones esenciales (salvaguardias terciarias) para minimizar aún más las consecuencias de la liberación del virus. Las salvaguardias primarias de contención reducen la probabilidad de liberación accidental o maliciosa del poliovirus desde una instalación esencial y se especifican en la norma de gestión del riesgo biológico para las instalaciones esenciales de poliovirus que mantengan materiales de poliovirus salvaje, WPV (Anexo 2 del documento GAP III original) y en la norma de gestión del riesgo biológico para las instalaciones esenciales que almacenan únicamente materiales OPV/Sabin (Anexo 3 del documento GAP III original). Los elementos clave incluyen: 12 Administración de la instalación, la cual realiza evaluación de riesgo continuo y observación estricta de los procedimientos de bioseguridad y bioprotección del laboratorio, La instalación para contención, la cual incorpora principios de diseño, construcción y operación apropiados, dirigidos a riesgo biológicos identificados, La inmunización de personal de la instalación, la cual puede reducir el riesgo de infección en la instalación y transmisión intra o extramural, de producirse la infección (10; 11), La reducción en el uso de poliovirus salvaje y sustitución con cepas Sabin o aún más atenuadas cuando sea posible (10), Planes de contingencia para los casos de liberación o exposición potencial al virus, el cual especifica acciones y asigna las responsabilidades de las instalaciones, la institución, el Ministerio de Salud y otras agencias gubernamentales interesadas. Las salvaguardias secundarias, relacionadas a inmunidad poblacional, minimizan las consecuencias de una liberación del poliovirus desde una instalación esencial dentro de la comunidad y consiste de una política nacional rutinaria de inmunización infantil contra la polio y alcanzar coberturas poblacionales elevadas de acuerdo con las políticas de la OMS (3) y las estrategias de post-erradicación (12). Las salvaguardias terciarias de ubicación de la instalación minimizan las consecuencias de la liberación no intencional del poliovirus salvaje altamente transmisible mediante ubicación de las instalaciones esenciales en áreas con tasas reproductivas bajas demostradas, es decir, en áreas con sistemas de aguas residuales cerrados con un mínimo de tratamiento secundario de efluentes. Las salvaguardias primarias y secundarias son requeridas para instalaciones esenciales que manipulen y almacenen materiales de poliovirus salvaje u OPV2/Sabin2 durante el periodo de contención del poliovirus tipo 2 y después del cese del uso de la bOPV (Tabla 1). El potencial de propagación (R0) es 2 a 10 veces menor para cepas Sabin/OPV que para poliovirus salvaje, lo cual reduce el riesgo de infección en la comunidad si ocurre una violación en la contención y de sus consecuencias si la transmisión es reconocida a tiempo (11). Las salvaguardias primaria, secundaria y terciaria son requeridas para instalaciones esenciales que manipulen y almacenen materiales de poliovirus salvaje después de su erradicación (Tabla 1). La certificación nacional y su recertificación anual regular es requerida para todas las instalaciones esenciales para poliovirus. La verificación de la OMS del cumplimiento del GAPIII puede ser solicitada sobre una base regular (trianual). La certificación nacional apoyada por la verificación de la OMS promueve seguridad en cuanto a que las salvaguardias requeridas han sido cumplidas. 13 Tabla 1: Un resumen de salvaguardias de contención en GAPIII Periodo de contención de poliovirus salvajes y Sabin tipo 2 Todos los poliovirus salvajes y Sabin tipo 2 Periodo final de contención de todos los poliovirus Todos los Todos los poliovirus poliovirus salvajes OPV/Sabin Salvaguardias Primarias: prevenir infección y liberación de materiales contaminados 1 Sí Protección del operador Sí Sí Sí Descontaminación de Sí Sí materiales y equipos 3 2 2 Sí Planta de tratamiento No No efluente dedicada 4 Sí Tratamiento de gases/aire No No Salvaguardias Secundarias: inmunidad poblacional en países que hospedan la instalación 3 o más Dosis IPV 1 o más 1 o más 6 90% o más Cobertura de IPV Igual a la cobertura de Igual a la cobertura 5 DPT3 de DPT3 Salvaguardias Terciarias: ambiente y ubicación Sí Ubicación de las No No instalaciones en áreas con baja transmisión potencial (R0) de poliovirus salvaje 1. Dado que el operador se considera como una de las fuentes de liberación del poliovirus desde la instalación se requieren medidas específicas de protección, incluyendo, por ejemplo, uso de equipo de protección personal, uso de dispositivos de contención primaria y vacunación. 2. Liberación no tratada dentro de un sistema de aguas residuales cerrado con tratamiento efluente secundario en la localización de la instalación (Nota: todas las aguas residuales de las instalaciones que contengan potencialmente poliovirus vivo deberían ser inactivadas antes de la liberación a través de procedimientos de inactivación adecuados y validados. Para las instalaciones sin una planta de tratamiento efluente dedicada esto normalmente será hecho a través de la aplicación de calor o químicos como parte de un proceso de tratamiento validado. Bajo ninguna circunstancia los efluentes que puedan contener poliovirus sin tratar deberían descargarse a los drenajes, a menos que la planta de tratamiento de efluentes haya sido diseñada y validada para manejar este tipo de efluentes, actuando efectivamente como parte del sistema de contención primaria). 3. Tratamiento de efluentes de las instalaciones antes de la liberación dentro del sistema de drenaje cerrado con tratamiento de efluentes secundarios o mayor en la ubicación de la instalación. 4. Filtración HEPA de aire de salida (escape). 5. Cobertura de inmunización con difteria-tétanos-tosferina (DTP3) (18) 6. (19) 14 Descripción e implementación de las fases En la adaptación del plan de contención para Las Américas dos situaciones fueron ampliamente analizadas: i) No se ha presentado ningún caso de parálisis fláccida causada por poliovirus salvaje en aproximadamente 24 años y ii) Uso de la OPV en la mayoría de los programas de inmunización de los países de la Región. En correspondencia con el Plan de Acción Mundial, el Plan Regional se lleva a cabo en tres fases vinculadas a hitos nacionales e internacionales en la erradicación de la polio (Figura 1). Figura 1: Requerimientos de contención del GAPIII-R Fase I: Preparación para la contención del poliovirus La Fase I consta de: encuesta nacional de laboratorios o instalaciones; inventario de poliovirus salvaje, OPV/Sabin y material potencialmente infeccioso de WPV o Sabin; 15 destrucción de materiales innecesarios de poliovirus salvaje, Sabin2 y potencialmente infecciosos de WPV o Sabin2; transferencia de materiales necesarios de poliovirus salvaje, Sabin2 y potencialmente infecciosos de WPV o Sabin2 a instalaciones esenciales para poliovirus preparación para la contención de poliovirus salvaje y Sabin2 Los países deberán realizar las siguientes actividades durante la Fase I: Actividad Ejecutado Encuestar todas las instalaciones biomédicas para identificar aquellas en posesión de materiales infecciosos o potencialmente infecciosos de poliovirus salvaje y OPV/Sabin e incentivar la destrucción de todos los que no sean necesarios. La encuesta se inicia con el establecimiento de una base de datos nacional de instalaciones que incluye todas las instalaciones con los siguientes tipos de laboratorios: o poliovirus /enterovirus, o virología general, o bacteriología clínica, o parasitología, o ambientales o industriales (fabricantes de vacunas de poliovirus y de filtros microbiológicos generales), o, o cualquier otro laboratorio que manipule o almacene material infectado o potencialmente infectado con poliovirus. Desarrollar un inventario nacional de las instalaciones que manipulan y almacenan materiales de poliovirus salvaje e informarlo a la Comisión Regional de la OMS para la Certificación de la Erradicación de la Poliomielitis, RCC. El inventario nacional sirve como un registro actual de las instalaciones de poliovirus. Los inventarios nacionales se agrupan en inventarios regionales mantenidos por las oficinas regionales de la OMS. Presentar informes anuales a la Comisión de Certificación Regional sobre el estado actual del inventario nacional de las instalaciones con materiales de poliovirus. Completar encuestas e inventarios nacionales y presentar la documentación a la Comisión Regional de Certificación acerca de que los requisitos de encuesta e inventario han sido cumplidos. El Ministerio de Salud presenta el informe completo de las actividades de inventario y encuesta de la Fase I y sus documentos de soporte a la Comisión Nacional de Certificación para su revisión y aprobación antes de su presentación a la Comisión Regional de Certificación (Guía para la documentación de la calidad de las actividades de contención del poliovirus salvaje en laboratorios: encuesta de laboratorio, inventario nacional (14)). Tras la finalización de las encuestas e inventarios nacionales y en la preparación para la Fase II, todos los países deberán: Actividad Ejecutado Adoptar los objetivos internacionales (3) para la destrucción o contención oportunas de materiales de poliovirus salvaje (WPV) y OPV2/Sabin2 y decidir entre las siguientes opciones: o prohibir la retención de todos los materiales de poliovirus especificados en GAPIII en cualquier instalación luego del logro de los hitos específicos; o, 16 o prohibir la retención de todos los materiales de poliovirus especificados en GAPIII, excepto en instalaciones designadas como laboratorios esenciales certificados para poliovirus. Los países que consideren necesario tener instalaciones esenciales de contención de poliovirus deberán sopesar los riesgos y beneficios de este tipo de instalaciones en consulta con todos los ministerios pertinentes (por ejemplo, salud, educación, defensa, medio ambiente, otros) y las responsabilidades inherentes al cumplimiento de las salvaguardias primarias, secundarias, y terciarias. Ejecutado Actividad Alertar a las instalaciones biomédicas acerca de los acuerdos internacionales y políticas nacionales (Resolución A68/21, WHA 2015) relacionados a la retención de materiales de poliovirus salvaje o de OPV/Sabin para permitirles una planeación ordenada para su cumplimiento. Instruir a las instalaciones que trabajan o han trabajado con poliovirus, enterovirus, rinovirus, rotavirus o norovirus para que confirmen la identidad de todas las reservas (stocks) de virus, cepas de referencia, y derivados de tales virus en cultivos de células permisivas para poliovirus, y así, descartar la presencia de virus de la polio (10). Donde y cuando sea necesario, las reservas de virus de historia incierta o de múltiples pasajes deben ser reemplazadas con reservas, con autenticidad documentada, de una colección de cultivo internacional o de otros investigadores que utilizan técnicas de referencia apropiadas. Los laboratorios que deseen conservar las colecciones históricas de materiales clínicos deberán explorar opciones de acuerdos de almacenamiento y manipulación con las instalaciones de referencia e investigación designadas como esenciales para poliovirus. Solicitar a las instalaciones que en el inventario nacional presenten planes para el cumplimiento de las regulaciones y políticas de retención de poliovirus (A68/21, WHA 2015), incluyendo el estado de los materiales y los plazos de acción. Solicitar a las instalaciones no esenciales que no tienen la intención de conservar los materiales de poliovirus infecciosos o potencialmente infecciosos (6) que: o destruyan el material innecesario de poliovirus (materiales infecciosos y potencialmente infecciosos de poliovirus salvaje, y cualquier material OPV/Sabin); o, o transfieran todo el material de poliovirus tipo 2 a instalaciones esenciales para poliovirus. Solicitar a las instalaciones con laboratorios no esenciales que a partir de la fase II probablemente puedan investigar nuevos aislamientos con WPV, aVDPV, cVDPV o iVDPV, o nuevas muestras fecales o respiratorias procedentes de los países con uso reciente de OPV, adoptar y aplicar: o prácticas de trabajo seguro y protegido basadas en la evaluación del riesgo y la aplicación de sistemas de gestión de riesgos biológicos adecuados (2), o Una política de no retención de materiales WPV al inicio de la Fase IIa del período de contención del poliovirus salvajes y Sabin2, o Una política de no retención para materiales OPV2/Sabin2 al inicio de la Fase IIb del período de contención del poliovirus Sabin2. 17 Si poliovirus salvajes o Sabin2 se aíslan después del inicio de la Fase IIa, la institución debe notificar inmediatamente al Ministerio de Salud y la OMS, y transferir el aislamiento a una instalación esencial y certificada de poliovirus. Actividad Ejecutado Notificar a la comunidad en general del laboratorio que, de acuerdo con la Estrategia de Etapa Final (3), no se permitirá más la retención de materiales de poliovirus salvaje en la Fase IIa y la de materiales OPV2/Sabin2 en la Fase IIb, salvo en las instalaciones designadas como esenciales para poliovirus. Las instalaciones son responsables por completo del cumplimiento de las regulaciones y de las políticas nacionales (Resolución A68/21, WHA 2015), incluyendo: o la destrucción de los materiales infecciosos y potencialmente infecciosos de WPV y de cualquier material OPV2/Sabin2; o o la transferencia de dichos materiales a un centro de poliovirus esencial designado. Las instalaciones presentes en la base nacional de laboratorios biomédicos con historia de realizar actividades que las ponen en riesgo de tener materiales potencialmente infecciosos de poliovirus o stocks contaminados deben responder al Ministerio de Salud u otra autoridad nacional designada documentando la ausencia de este tipo de materiales. Los países con planes para designar instalaciones esenciales para poliovirus además deberán: Actividad Ejecutado Solicitar a instalaciones candidatas evaluar y presentar documentación que acredite el cumplimiento de las salvaguardias secundarias y terciarias, según corresponda al tipo de material (WPV2 u OPV2/Sabin2). Implementar procedimientos nacionales de certificación para evaluar el cumplimiento de las instalaciones de poliovirus esenciales en cuanto a las disposiciones de contención del poliovirus tipo 2, incluidas en las salvaguardias primarias y secundarias. La instalación esencial designada que desee manipular y almacenar materiales de poliovirus salvaje (WPV) debe estar completamente certificada antes de la Fase II. Establecer planes nacionales de contingencia para responder a la posible liberación o exposición al virus de la polio (15). Solicitar a las instalaciones candidatas a ser esenciales de poliovirus que estén planeando manipular y almacenar materiales infecciosos para WPV que, antes de la fase II, se certifiquen en la implementación de las disposiciones de contención del WPV, incluidas las salvaguardias primarias y secundarias (Anexo 2). Si no puede cumplir con los requisitos, todos los materiales WPV deben ser transferidos a una instalación que cumpla los requisitos, o, de lo contrario, deben ser destruidos. Solicitar a las instalaciones candidatas a ser esenciales de poliovirus que estén planeando manipular y almacenar materiales infecciosos para OPV2/Sabin2 (pero no WPV) que, dentro de los tres meses desde que ocurre el switch, se certifiquen en la implementación de las disposiciones de contención del OPV2/Sabin2, incluidas las salvaguardias primarias y secundarias (Anexo 2). Si no puede cumplir con los requisitos, todos los materiales 18 Actividad Ejecutado OPV2/Sabin2 deben ser transferidos a una instalación que cumpla los requisitos, o, de lo contrario, deben ser destruidos. Los países o instalaciones interesados pueden solicitar, a través de sus autoridades nacionales, la verificación OMS de las instalaciones de poliovirus esenciales, certificadas por el Ministerio de Salud u otra autoridad nacional designada, y declarar el cumplimiento total de los criterios de manejo del riesgo biológico en concordancia con los Anexos 3 y 4. Preparación para el switch (cambio) de tOPV a bOPV La Resolución A68/21, WHA 2015 sobre el cambio de tOPV a bOPV (16) proporciona detalles sobre el proceso de implementar cada paso que conduce a la retirada de la OPV2, al retiro de la tOPV no usada y a la contención de los poliovirus OPV2/Sabin2. Los países que utilicen tOPV deberán responder a la resolución A68/21, WHA 2015 con planes detallados para el cumplimiento. Todos los países deberán revisar o ampliar la base de datos de las instituciones e instalaciones de la Fase I para incluir nuevos u otros laboratorios biomédicos que podrían tener materiales infecciosos o potencialmente infecciosos de OPV2/Sabin2 de cualquier origen. Los consultorios particulares, farmacias e instituciones de salud que puedan tener viales de tOPV serán notificados a través de otros canales gubernamentales como parte del proceso de cambio de tOPV a bOPV. Los planes y acciones para prepararse para el cambio de tOPV a bOPV continuan en la fase II, como se describe a continuación. Fase II: Período de contención del poliovirus tipo 2 Fase IIa: Contención de poliovirus salvaje (WPV) La Fase IIa comienza cuando se cumplan los criterios para la preparación global de la retirada OPV2. A partir del comienzo de la Fase IIa: La manipulación y el almacenamiento de material WPV ya no se permite en instalaciones no esenciales. Los laboratorios no esenciales que puedan llegar a investigar nuevos aislamientos de WPV, aVDPV, cVDPV o iVDPV, o nuevas muestras fecales y respiratorias procedentes de los países con uso reciente de OPV deberán: o implementar prácticas de trabajo seguro y protegido basadas en la evaluación de riesgos y en sistemas adecuados de gestión de riesgos biológicos (2) o no retener cualquier material WPV para almacenamiento a largo plazo. 19 o destruir inmediatamente cualquier material WPV recién aislado, o transferirlo a un centro de poliovirus esencial certificado, después de la notificación al Ministerio de Salud u otra autoridad nacional designada y la OMS. Las instalaciones de poliovirus esenciales certificadas que manipulen o almacenen WPV en la Fase II deben implementar y ser regularmente evaluadas en sus disposiciones en “contención de WPV”, incluidas las salvaguardias primarias y secundarias, como se describe en el Anexo 2 del GAPIII. A las instalaciones que aún no han recibido certificación nacional formal de 'contención de WPV' ya no se les permite manipular y almacenar materiales WPV. Los países o instalaciones interesados pueden solicitar, a través de sus autoridades nacionales, una verificación por la OMS de las instalaciones esenciales en posesión de WPV, certificado por el Ministerio de Salud u otra autoridad nacional designada, y declarado que se cumplen con todos los criterios de gestión de riesgos biológicos en consonancia con el Anexo 4 del GAPIII. Fase IIb: Contención de los poliovirus OPV/Sabin tipo 2 (OPV2 / Sabin2) Avanzando en los preparativos para el cambio (switch) de tOPV a bOPV Actividad Ejecutado Todos los países deberán notificar a la comunidad de laboratorios acerca de los requisitos para “la contención de los poliovirus OPV2/Sabin2”. La comunidad de laboratorios ya es, o debería serlo, conocedora de las acciones faltantes vinculadas al switch. A las instalaciones se les debe recordar por escrito la fecha planeada para el cambio (switch) de tOPV a bOPV y que las políticas nacionales y regulaciones (Resolución A68/21, WHA 2015) pertenecientes a la destrucción o contención de los poliovirus OPV2/Sabin2 estarán en vigor en ese momento. Las comunicaciones desde el Ministerio de Salud u otra autoridad nacional designada a todas las instalaciones y laboratorios biomédicos deberán motivar más la destrucción de los materiales OPV/Sabin innecesarios. Los laboratorios que deseen mantener el acceso a las colecciones históricas de materiales clínicos potencialmente infecciosos de poliovirus OPV2/Sabin2 deberán explorar opciones para acuerdos en manipulación y almacenamiento con las instalaciones de investigación y referencia designadas esenciales y certificadas. La Administración global de la tOPV se detendrá (cese del uso de la OPV2) en una fecha de vigencia establecido por la Asamblea Mundial de la Salud. En la fecha efectiva para el cambio de tOPV a bOPV (por cese del uso de la OPV2), todos los países deben: Actividad Ejecutado Recuperar y destruir las existencias (suministros o stocks) de tOPV. La OMS proporcionará directrices de aplicación específicos (16) para la recogida y destrucción de las tOPV desde puntos de recolección designados, establecimientos de salud o consultas médicas privadas e instalaciones de almacenamiento sean nacionales o territoriales. 20 Actividad Ejecutado La Fase II coincide con un período de vigilancia intensa y eliminación del VDPV. Algunas de las áreas de alto riesgo pueden requerir el uso de vacunas monovalentes de OPV2 (mOPV2) de emergencia para responder a la transmisión emergente o reemergente de VDPV2. En estas zonas puede ser necesario suspender temporalmente la “contención de los poliovirus OPV2/Sabin2” hasta que se resuelva esta situación. Dentro de los seis meses del cambio (switch), todos los países deben: Actividad Ejecutado Presentar la documentación a la Comisión Regional de Certificación correspondiente y relacionada a que se han cumplido los requisitos para la contención de los poliovirus OPV2/Sabin2. La Fase IIb comienza tres meses después del cambio (switch) mundial de tOPV a bOPV. A partir del comienzo de la Fase IIb (dentro de los tres meses del switch): La manipulación y el almacenamiento de material con poliovirus OPV2/Sabin2 ya no se permite en instalaciones no esenciales. Los laboratorios no esenciales que puedan llegar a investigar nuevas muestras fecales y respiratorias procedentes de los países con uso reciente de OPV deberán o implementar prácticas de trabajo seguro y protegido basadas en la evaluación de riesgos y en sistemas adecuados de gestión de riesgos biológicos (2) o no retener cualquier material WPV u OPV2/Sabin2 para almacenamiento a largo plazo. o destruir inmediatamente cualquier material de poliovirus tipo 2 recién aislado, o transferirlo a un centro de poliovirus esencial certificado, después de la notificación al Ministerio de Salud u otra autoridad nacional designada y la OMS. Las instalaciones de poliovirus esenciales certificadas que manipulen o almacenen sólo OPV2/Sabin2 (pero no WPV) deben implementar y ser regularmente evaluadas en sus disposiciones de “contención de poliovirus OPV2/Sabin2”, incluidas las salvaguardias primaria y secundaria, como se describe en el Anexo 3 del GAPIII. Las existencias (stocks) de poliovirus Sabin de historia incierta o pasajes múltiples deben ser reemplazadas con existencias (stocks) de autenticidad documentada de una colección de cultivo internacional o de otros investigadores que utilicen técnicas de referencia apropiadas para descartar posible contaminación con WPV. A las instalaciones que aún no hayan recibido certificación nacional formal de “contención de OPV2/Sabin2” ya no se les permitirá manipular y almacenar materiales de poliovirus OPV2/Sabin2. Los países o instalaciones interesados pueden solicitar, a través de sus autoridades nacionales, una verificación por la OMS de las instalaciones esenciales en posesión de poliovirus OPV2/Sabin2, certificado por el Ministerio de Salud u otra autoridad nacional 21 designada, y declarado que se cumplen con todos los criterios de gestión de riesgos biológicos en consonancia con el Anexo 4 del GAPIII. 22 Preparación para la Fase III En preparación para la Fase IIIa (contención final de todos los poliovirus salvajes), los países con instalaciones esenciales WPV deberán además: Actividad Ejecutado Implementar los procedimientos nacionales de certificación para evaluar el cumplimiento de las disposiciones relativas a la "contención definitiva mejorada de todos los poliovirus salvajes ', incluyendo las salvaguardias primarias, secundarias y terciarias. Solicitar a las instalaciones esenciales que planean manejar y almacenar materiales infecciosos de poliovirus salvaje en la Fase III, ser certificadas y de manera regular nuevamente evaluadas (por ejemplo, anualmente) en la aplicación de la "contención definitiva mejorada de todas las disposiciones para poliovirus salvajes, incluyendo salvaguardias primaria, secundaria y terciaria (Anexo 2), antes de la fase III. Las instalaciones que fallen en su certificación nacional tendrán que suspender actividades con WPV hasta que las deficiencias se corrijan de manera satisfactoria y se otorgue la certificación nacional. Si no puede cumplir con los requisitos, todos los materiales de poliovirus salvaje, antes de la Fase III, deben ser destruidos o transferidos a un país e instalación que cumpla los requerimientos. Las instalaciones esenciales certificadas poseedoras de WPV pueden ser verificadas a través de la OMS (Anexo 4). En preparación para la Fase IIIb (contención final de todos los poliovirus OPV/Sabin), los países con instalaciones esenciales OPV/Sabin deberán además: Actividad Ejecutado Implementar procedimientos nacionales de certificación para evaluar el cumplimiento de las disposiciones relativas a la "contención final de todos los poliovirus OPV/Sabin”, incluyendo salvaguardias primarias y secundarias. Solicitar a las instalaciones esenciales que planean, en Fase III, manejar y almacenar materiales OPV/Sabin o derivados de Sabin infecciosos (pero no WPV) ser certificadas y de manera regular nuevamente evaluadas (por ejemplo, anualmente) en la aplicación de la "contención definitiva mejorada de todos los poliovirus OPVSabin”, incluyendo las salvaguardias primarias, secundarias y terciarias (Anexo 3) antes del cese de uso de la bOPV. Las instalaciones que fallen en su certificación nacional tendrán que suspender actividades con OPV/Sabin hasta que las deficiencias se corrijan de manera satisfactoria y se otorgue la certificación nacional. Si no puede cumplir con los requisitos, todos los materiales de poliovirus OPV/Sabin deben ser transferidos a un país e instalación que cumpla los 23 Actividad Ejecutado requerimientos o destruidos antes del cese del uso de la bOPV. Las instalaciones esenciales certificadas poseedoras de poliovirus OPV/Sabin pueden ser verificadas a través de la OMS (Anexo 4). Dentro de los tres meses siguientes a la declaración de la interrupción de la transmisión de todos los poliovirus salvaje, todos los países deben: Actividad Ejecutado Presentar la documentación a la Comisión Regional de Certificación de la OMS relacionada a que se han cumplido en Fase II los requerimientos de destrucción o la gestión de riesgos de todos los poliovirus salvajes. Fase III: contención final de poliovirus Fase IIIa (contención definitiva mejorada de todos los poliovirus salvajes) La Fase IIIa comenzará cuando todas las seis regiones hayan completado la certificación de erradicación del poliovirus salvaje, tres años después del aislamiento del último poliovirus salvaje. A partir del comienzo de la Fase IIIa, los laboratorios de poliovirus esenciales certificados y las instalaciones de producción de IPV que manipulen y almacenen materiales poliovirus salvaje deben: Actividad Ejecutado Implementar la "contención final mejorada de todos los poliovirus salvajes”, incluyendo las salvaguardias primarias, secundarias y terciarias. A las instalaciones que aún no hayan recibido la certificación nacional formal para la contención definitiva mejorada de todos los poliovirus salvajes ya no se les permitirá manejar y almacenar materiales de poliovirus salvaje. Los países con instalaciones esenciales en poliovirus salvaje (WPV) continuarán en: Actividad Ejecutado Implementar los procedimientos nacionales de certificación para evaluar el cumplimiento de las disposiciones relativas a la "contención definitiva mejorada de todos los poliovirus salvajes” en las instalaciones que poseen WPV, incluyendo las salvaguardias primarias, secundarias y terciarias. Solicitar a las instalaciones esenciales certificadas que manejan y almacenan materiales de poliovirus salvaje en la Fase III, ser certificadas y de manera regular nuevamente evaluadas (por ejemplo, anualmente) en la aplicación de la "contención definitiva mejorada de todas las disposiciones para poliovirus salvajes, 24 Actividad Ejecutado incluyendo salvaguardias primarias, secundarias y terciarias, con el propósito de confirmar su estado de certificación. Si no puede cumplir con los requisitos, todos los materiales de poliovirus salvaje deben ser destruidos o transferidos a un país e instalación que cumpla los requerimientos. Las instalaciones de poliovirus esenciales certificadas pueden ser verificadas por la OMS (Anexo 4 del GAPIII). Fase IIIb: Contención final de todos los poliovirus OPV/Sabin El cese global de la OPV se planea para un año después de la declaración global de la erradicación del poliovirus salvaje (WPV) A la fecha de vigencia, todos los países deben: Actividad Ejecutado Recuperar y destruir las existencias de bOPV. La OMS proporcionará directrices de aplicación específicas para la recolección y destrucción de la bOPV desde puntos designados de recolección, establecimientos de salud o consultas privadas, e instalaciones de almacenamiento nacionales y territoriales (subnacionales). La Fase IIIb comienza tres meses después del cese global de uso de la bOPV. A partir del comienzo de la Fase IIIb, los laboratorios y las instalaciones esenciales certificadas de producción de IPV-Sabin que manipulen o almacenen materiales OPV/ Sabin (pero no WPV) deben: Actividad Ejecutado Implementar la "contención final de todos los poliovirus OPV/Sabin”, incluyendo salvaguardias primaria y secundaria. A las instalaciones que aún no han recibido la certificación nacional formal para la contención final de todos los poliovirus OPV/Sabin ya no se les permitirá manejar y almacenar materiales OPV/Sabin. Los países con instalaciones esenciales en OPV/Sabin continuarán en lo siguiente: Actividad Ejecutado Implementar los procedimientos nacionales de certificación para evaluar regularmente (anual) el cumplimiento de las instalaciones que mantienen OPV/Sabin en cuanto a la "contención final de todos los poliovirus OP/Sabin”, incluyendo las salvaguardias primarias, secundarias y terciarias. 25 Actividad Ejecutado Solicitar a las instalaciones de poliovirus esenciales certificadas que manejan y almacenan OPV/Sabin o materiales derivados de Sabin (pero no poliovirus salvaje) en la Fase III ser regularmente (por ejemplo, anualmente) reevaluadas en la implementación de las disposiciones de la "contención final de todos los poliovirus OPV/Sabin”, incluyendo salvaguardias primarias y secundarias, con el fin de confirmar su estado de certificación. Si no puede cumplir con los requisitos, todos los materiales de OPV/Sabin deben ser destruidos o transferidos a un país e instalación que sí cumpla los requisitos. El almacenamiento de las existencias mOPV (componentes congelados y productos acabados, preparados de acuerdo con los requisitos internacionales (15)) y la reposición de las existencias de mOPV de viales de vacuna llenos deben llevarse a cabo en condiciones de contención adecuadas, sobre la base de una evaluación de riesgos aprobada por la autoridad competente. Las instalaciones nacionales de poliovirus esenciales certificadas pueden ser verificadas a través de la OMS (Anexo 4 del GAPIII). Dentro de los seis meses del ceso de uso de la bOPV, todos los países deberán: Actividad Ejecutado Presentar la documentación a la Comisión Regional de Certificación acerca de que se han cumplido los requisitos para 'la contención final de todos los poliovirus OPV/Sabin. 26 Tabla 2: Fases de implementación de la contención de los poliovirus Prerrequisitos Fase Inicia Fecha límite de finalización Actividades clave Fase I: Preparación para la contención I. Inventario, destrucción y preparación para la contención del poliovirus En curso Preparación mundial de retirada de la OPV2 Inventario, destrucción, preparación para la contención de poliovirus Encuesta e inventario de las instalaciones que manipulan o almacenan material infeccioso o potencialmente infeccioso de poliovirus En instalaciones no esenciales: destrucción de materiales innecesarios de poliovirus. transferencia de material necesario de poliovirus salvaje, Sabin2 y potencialmente infeccioso a instalaciones esenciales adopción de política de no retención para nuevos aislamientos de WPV/Sabin2 que deben implementarse en la Fase IIa. En instalaciones esenciales: certificación nacional Fase II: Periodo de contención del poliovirus tipo 2 Eliminación de circulación de WPV IIA: Periodo de contención del poliovirus salvaje Preparación global de retiro de la OPV2 6 x certificación regional de la erradicación del poliovirus salvaje Eliminación del cVDPV2 persistente Contención del poliovirus salvaje (WPV) Instalaciones esenciales certificadas productoras de IPV y laboratorios que mantienen WPV Manipulan y almacenan materiales WPV en “contención de WPV” Instalaciones no esenciales destrucción de material remanente innecesario de Sabin2. transferencia de material de Sabin2 necesarios a instalaciones esenciales Instalaciones no esenciales que investigan nuevos aislamientos de WPV, aVDPV, cVDPV o iVDPV; o nuevas muestras fecales o respiratorias que se originaron en países con uso reciente de OPV. 27 Prerrequisitos Fase Inicia Fecha límite de finalización Actividades clave implementar políticas de no retención destruir material de poliovirus recientemente aislado que no se necesite transferencia de material necesario de poliovirus recientemente aislados a instalaciones esenciales certificadas. La bOPV está disponible y licenciada Introducción global de la IPV IIb Contención de poliovirus OPV2/Sabin2 Dentro de los 3 meses del switch tOPV-bOPV (Post Switch tOPV-bOP) Switch global de tOPV a bOPV Dentro de los tres meses del cese global de la bOPV (el cese de la bOPV es planeado para un año después de la certificación global de la erradicación del WPV) Contención de los poliovirus OPV/Sabin tipo 2 Los laboratorios esenciales certificados que mantienen OPV/Sabin o las instalaciones de producción de OPV/Sabin: manejan y almacenan materiales OPV/Sabin según la “Contención de poliovirus OPV2/Sabin2” Fase III: Periodo de contención final del poliovirus Tres años transcurren sin aislamiento de WPV IIIa: Posterradicación 6x certificación regional de erradicación del WPV Erradicación a largo plazo (más allá del cese global de la bOPV) Contención final aumentada de todos los WPV Laboratorios esenciales certificados que mantengan WPV o instalaciones productoras de IPV: Manipular y almacenar todos los materiales WPV según “contención final de todos los poliovirus salvajes” Cese global del uso de la OPV IIIb: Cese post- bOPV Dentro de los tres meses del cese global del uso de la bOPV (planeado para un año después de la certificación global de la erradicación del WPV). Erradicación a largo plazo (más allá del cese global de la bOPV) Contención final de todos los poliovirus OPV/Sabin Laboratorios esenciales certificados que mantengan OPV/Sabin o instalaciones productoras de IPVSabin: Manipulan y almacenan todos los materiales OPV/Sabin según “contención final de todos los poliovirusOPV/Sabin” 28 Consideraciones adicionales del GAPIII-R Puntos clave a tener en cuenta: La eliminación del riesgo en instalaciones no esenciales se logra a través de la destrucción de los materiales infecciosos o potencialmente infecciosos de WPV u OPV/Sabin, o su traslado a instalaciones esenciales. La destrucción aplica a todos los tipos de materiales potencialmente contaminados con alguna cepa o tipo de OPV o WPV, donde la presencia de poliovirus no pueda ser descartada. El éxito mundial de la eliminación del riesgo necesita que cada país prohíba la retención y subsecuente adquisición de materiales de poliovirus en todas las instalaciones noesenciales. GAPIII_R establece un esquema de fases alterno buscando un equilibrio entre los plazos de trabajo final con muestras de poliovirus en la investigación, la producción y la necesidad de cumplir con los requerimientos globales. Consideración para muestras potencialmente infecciosas: Se establece una división del periodo histórico de recolección de las muestras potencialmente infecciosas en dos componentes. Figura 2: División de periodo histórico de recolección de la muestra potencialmente infecciosas de poliovirus*. *Aplica solo para muestras recolectadas en países de la Región de Las Américas. 29 NOTA: Laboratorios que conserven muestras biológicas obtenidas en países que no pertenecen a Las Américas, deberán revisar la situación del programa de erradicación de la polio en el país de origen de las muestras y aplicar los criterios de contención acorde con lo definido en el GAP III. Decisión acerca de la inclusión o no del líquido cefalorraquídeo como material potencialmente infeccioso de poliovirus. En el documento de la fase I del GAPII, el líquido cefalorraquídeo (LCR) era considerado una muestra potencialmente infecciosa, y dado que el GAPIII no lo incluye en su versión actual, el grupo de trabajo de la OPS realizó una revisión de literatura científica para evaluar su inclusión en la encuesta del inventario. Aunque se han publicado artículos que mencionan la existencia de algunos casos en los que se detectó poliovirus en LCR, se estima que la probabilidad de aislamiento o detección del poliovirus es demasiado baja y, por tanto, se acoge no incluirlo como muestra objeto de contención. Síntesis del trabajo para el cumplimiento del GAPIII-Regional: 1. Identificación de laboratorios con muestras infecciosas y potencialmente infecciosas para poliovirus, tanto salvaje como vacunal. La realización de una encuesta regional que actualice los datos de muestras infecciosas de poliovirus salvaje y muestren el panorama relacionado al almacenamiento de muestras de polio vacunal. 2. Toma de decisiones con respecto a la tenencia y disposición final de material tanto infeccioso como potencialmente infeccioso para poliovirus salvaje y vacunal 3. Designación de laboratorios esenciales e implementación de requerimientos del GAPIII.. 4. Certificación de los laboratorios esenciales. 5. Presentación del informe de actividades de contención realizadas a la Comisión Nacional de Certificación 6. Presentación del informe de actividades de contención realizadas por el país a la Comisión Regional de Certificación 30 Bibliografía Nota: Las referencias bibliográficas fueron presentadas usando la misma numeración del documento GAPIII, incluso si no fueron utilizadas en esta traducción y adaptación a la Región de las Américas. 1. World Health Organization. Meeting of the Strategic Advisory Group of Experts on immunization, October 2014 – conclusions and recommendations. Weekly epidemiological record. 2014, pp. 572-573. (no utilizada en la traducción) 2. CEN. CWA15793 - Laboratory Biorisk Management. 2011. 3. World Health Organization. Polio Eradication & Endgame Strategic Plan 2013- 2018. 2013. 4. Aylward RB et al. Risk Management in a Polio-Free World. Risk Analysis. 2006, pp. 1-17. 5. Burns CC et al. Vaccine-Derived Polioviruses. 2014. pp. S283-93. 6. World Health Organization. WHO global action plan for laboratory containment of wild polioviruses, Second edition. 2004. 7. Global Polio Eradication Initiative. Framework for national policy makers in OPV-using countries: cessation of routine oral polio vaccine (OPV) use after global polio eradication. 2005. 8. Fine PEM and Ritchie S. Consequences of release / reintroduction of polioviruses in different geographic areas after OPV cessation. Risk Analysis. 2006, pp. 1-13. 9. World Health Organization. Progress towards wild poliovirus containment in Russian Federation. Weekly epidemiological record. 2005, pp. 426-428. 10. Dowdle WR et al. Containment of polioviruses after eradication and OPV cessation: Characterizing risks to improve management. Risk Analysis 26. 2006, pp. 1449-1469. 11. Tebbens RJD et al. Risks of Paralytic Disease due to Wild or Vaccine-derived Poliovirus after Eradication. Risk Analysis. 2004, pp. 1-78. 12. World Health Organization. Inactivated poliovirus vaccine following oral poliovirus vaccine cessation. Weekly epidemiological record. 2006, pp. 137-144. 13. WHA 67/38. Poliomyelitis: intensification of the global eradication initiative. 2014. 14. US Department of Health and Human Services HHS. [Online] 2003. http://www.google.com/url?url=http://archive.hhs.gov/nvpo/polio/final_report/anne x_16/Laboratory_survey_and_inventory_quality_assessment_FINALa.doc&rct=j& frm=1&q=&esrc=s&sa=U&ei=xquZU_HIC7KX0AW9kYDYBQ&ved=0CBQQFjAA &usg=AFQjCNGJ73rCrVwITQGzDRXCZaiHIB2L3A. 15. World Health Organization. Operational framework for monovalent oral poliovirus type 2 (mOPV2) vaccine stockpile - development, deployment and replenishment (during the endgame period). 2014. 16. World Helath Organization. OPV cessation - protocol for a global coordinated switch from trivalent OPV to bivalent OPV. 2014. 17. Dowdle WR and Birmingham ME. The Biologic Principles of Poliovirus Eradication. J Infect Dis 175 (Supplement 1). 1997, pp. S286-292. 18. World Health Organization. Diphtheria-tetanus-pertussis (DTP3) immunization coverage. [Online] http://www.who.int/gho/immunization/dtp3/en/. 19. World Health Organization. Global Vaccine Action Plan 2011-2020. [Online] http://www.who.int/immunization/global_vaccine_action_plan/GVAP_doc_2011_2020/en/. 31 Definiciones La traducción mostrada a continuación respeta el orden de aparición de términos del capítulo correspondiente en GAPIII, versión en inglés. Por ese motivo, no existe un orden alfabético estricto. Las definiciones que figuran a continuación se aplican a los términos como se utilizan en la presente norma, y pueden tener diferentes significados en otros contextos. Aerosol: dispersión de partículas sólidas o líquidas de tamaño microscópico en un medio gaseoso. Auditoría: Proceso sistemático, independiente y documentado para obtener evidencia y evaluarla de manera objetiva con el fin de determinar el grado en que se cumplen los criterios de auditoría. Cámaras de seguridad biológica: Las cabinas clase II para trabajo microbiológico son recintos con apertura frontal parcial con aire conducido alrededor del operador en la rejilla frontal y un flujo laminar descendente de aire filtrado por HEPA que proporciona la protección del producto, reduciendo al mínimo la posibilidad de contaminación cruzada a lo largo de las superficies de trabajo de la cabina. Las cabinas Clase III son recintos herméticos a los gases con una ventana de vista sin apertura, con acceso de los materiales al gabinete a través de un tanque de agua o una caja de paso a través de doble puerta que es descontaminada entre usos. Tanto el aire de ingreso como de salida son filtrados por HEPA o incinerados antes del descarte. El flujo de aire se mantiene bajo presión negativa. Bioseguridad (biosafety): la bioseguridad del laboratorio describe los principios de contención, tecnologías y prácticas que se implementan para prevenir la exposición no intencional a patógenos y toxinas, o su liberación accidental. Riesgo biológico (riesgo biológico): El riesgo relacionado a la bioseguridad y la bioprotección en el que el principal peligro es un agente biológico (en el caso de esta norma, el poliovirus). Sistema de gestión del riesgo biológico: Incluye estructura organizacional, actividades de planificación, responsabilidades, prácticas, procedimientos, procesos y recursos para desarrollar, implementar, alcanzar, revisar y mantener la política de riesgos biológicos de la organización. Bioprotección (biosecurity): la bioprotección del laboratorio incluye la protección, el control y la rendición de cuentas sobre agentes biológicos y toxinas dentro de las instalaciones biológicas para evitar su acceso no autorizado, pérdida, robo, uso incorrecto, desvío, o su liberación no autorizada e intencional. CCID50: dosis infecciosa en cultivo celular, el cual infectará el 50% de las monocapas de células estimuladas con el inóculo definido. Calibración: Correlación de las lecturas de un instrumento con un estándar. Certificación: proceso sistemático y documentado para asegurar que los sistemas funcionan de conformidad con las normas de certificación disponibles o guía de validación aplicable. • Se espera que la certificación nacional a esta norma se realice una vez al año a través de los órganos de supervisión nacionales responsables. Contención: Sistema para confinar a microorganismos, organismos u otras entidades dentro de un espacio definido. Planes de contingencia: Preparación para un evento o circunstancia futura considerada como probable que ocurra, o que influya en el proceso presente. Descontaminación: Procedimiento que elimina o reduce los agentes biológicos y toxinas a un nivel seguro con respecto a la transmisión de la infección u otros efectos adversos. Diagnóstico: El análisis de las muestras para el propósito de identificar o confirmar la presencia de un agente específico. 32 Desinfección: Proceso para reducir el número de microorganismos, pero no suele ser de esporas bacterianas, sin eliminar o remover todos los organismos. Instalación: Cualquier laboratorio o unidad de producción de vacunas que es propiedad u operado por cualquier nivel de gobierno, institución académica, corporación, compañía, sociedad, asociación, firma, sociedad unipersonal u otra entidad legal. Instalación esencial: es una instalación designada por el Ministerio de Salud u otro organismo o autoridad nacional para servir en funciones criticas nacionales o internacionales que involucren manejo y almacenamiento necesarios de materiales infecciosos o potencialmente infecciosos de poliovirus en las condiciones establecidas en la presente norma. Instalación certificable: Es una instalación aprobada por el Ministerio de Salud (u otro organismo o autoridad nacional autorizada) como un postulante calificado para la certificación nacional. Fumigación: Es el proceso por el cual uno o más productos químicos se aplican en estado gaseoso a un espacio cerrado para el propósito de descontaminar la zona y los artículos en el mismo. Buenas técnicas microbiológicas: Métodos técnicos diseñados para evitar o minimizar las causas más comunes de lesiones o infecciones relacionadas al trabajo en el laboratorio (Ver Manual de Bioseguridad en el Laboratorio de la OMS, 3ª edición, 2004). Directrices (guías): principios o criterios que guían o dirigen una acción. Peligro: Cualquier fuente, situación o acto con potencial para causar daño. Filtro de detención de partículas altamente eficiente (HEPA): Un filtro capaz de eliminar al menos 99,97% de todas las partículas con un diámetro aerodinámico medio de 0,3 micras. Inactivación: Proceso de obtener un organismo inerte mediante la aplicación de calor, u otros medios. Legislación: El proceso de elaboración de las leyes. Materiales de poliovirus necesarios: Son materiales de poliovirus considerados necesarios y dignos de almacenamiento que asegurarán la continuación de las funciones internacionales esenciales, incluyendo Salk-IPV y la producción de Sabin-IPV, el desarrollo y almacenamiento de las existencias de OPV, la garantía de calidad de las vacunas, la producción de reactivos de diagnóstico, las funciones de diagnóstico de virus y de referencia y la investigación fundamental. Organización: La entidad legal responsable de la gestión de la instalación del poliovirus, tal como una universidad, empresa privada o agencia gubernamental. Penetraciones: Apertura a través de paredes, pisos o techos para permitir servicios mecánicos. Políticas: El curso o principio de acción adoptado o propuesto por la entidad gubernamental responsable. Poliovirus: Es un picornavirus que consta de tres serotipos: 1, 2, y 3. Los serotipos de poliovirus son además subdivididos en cepas salvajes (que circulan en la naturaleza) y cepas Sabin usadas para vacunas orales contra la polio (OPV). Los poliovirus usan al CD155 como el receptor celular primario. Poliovirus salvaje: • Los poliovirus salvajes son aislamientos que se sabe o se cree que han circulado persistentemente en la comunidad de forma natural. • Los poliovirus derivados de la vacuna (VDPV) son clasificados con los poliovirus salvajes y demuestran generalmente 1-15% de diferencia en la secuencia de la cepa OPV progenitora; ellos pueden haber circulado en la comunidad (cVDPV) o haberse replicado por períodos prolongados en sujetos inmunodeficientes (iVDPV) o ser ambientales ambiguos de origen desconocido (aVDPV). 33 • Las cepas atenuadas no licenciadas para su uso como vacunas vivas (Cox/Lederle y Koprowski/Wistar) se clasifican con los poliovirus salvajes debido a que sus propiedades clínicas no han sido probadas. Los materiales de poliovirus salvajes pueden ser infecciosos o potencialmente infecciosos. los materiales infecciosos de poliovirus salvaje incluyen: o Materiales clínicos de infecciones de poliovirus salvaje confirmados (incluyendo VDPV). o Muestras de aguas ambientales o aguas residuales que han dado positivo a la presencia de poliovirus salvajes. o Aislamientos de cultivos celulares y cepas de referencia de poliovirus salvaje. o Stocks semilla (material de siembra) y materiales infecciosos de la producción de la IPV. o Animales infectados o sus muestras, incluyendo los ratones transgénicos receptores de poliovirus humanos (PVR). o Los derivados producidos en el laboratorio que tienen secuencias de la cápside de poliovirus salvajes, salvo que exista prueba demostrable de que son más seguros que las cepas Sabin. La seguridad de los nuevos derivados que contienen secuencias de la cápside de los poliovirus salvaje será evaluada por un panel de expertos sobre la base de comparación con las cepas Sabin de referencia, con respecto a: el grado y la estabilidad de la atenuación; el potencial para la transmisión de persona a persona; y, la neurovirulencia en modelos animales. o ARN o ADNc de longitud completa que incluyan secuencias de la cápside derivadas de poliovirus salvaje, a menos que los virus derivados de ellos hayan mostrado, de forma demostrable, que son más seguros que las cepas Sabin. La seguridad de estos materiales que contiene secuencias de la cápside del poliovirus salvaje será evaluada por un panel de expertos convocado por la OMS, sobre la base de comparación con las cepas Sabin de referencia, con respecto a: el grado y la estabilidad de la atenuación; el potencial para la transmisión de persona a persona; y, la neurovirulencia en modelos animales. o Las células persistentemente infectadas con cepas de poliovirus cuyas secuencias de la cápside se derivan del poliovirus salvaje. Por su parte, los materiales potencialmente infecciosos de poliovirus salvaje incluyen: o Muestras fecales o de secreción respiratoria recogidos para cualquier propósito en un tiempo y área geográfica de circulación del poliovirus salvaje (incluyendo VDPV). o Los productos de estos materiales en animales o células permisivas para poliovirus. o Aislamientos de cultivo celular semejantes a enterovirus no caracterizados desde países en los que se sabe o se sospecha que han circulado poliovirus salvajes o VDPV en el momento de la recolección. o Existencias (stocks) de virus respiratorios y entéricos manipulados en condiciones donde la replicación o contaminación del poliovirus es posible. Poliovirus Sabin: Las cepas OPV/Sabin son cepas de poliovirus atenuados (aprobado para su uso en vacunas orales contra la polio por las autoridades reguladoras nacionales, principalmente cepas Sabin). Poliovirus similares a OPV: Para la red de laboratorios no involucrada en la producción, los poliovirus similares a OPV se definen como aislamientos consistentes con un periodo limitado de excreción del virus o de transmisión de persona a persona, demostrando menos del 1% de diferencia a partir de cepas OPV progenitoras para los tipos de poliovirus 1 y 3 y menos de 0,6% de diferencia a a partir de la cepa progenitora OPV del tipo 2 por homología de secuencia de VP1 completa. Los fenotipos de aislamientos similares a OPV clínicos y ambientales no necesitan ser determinados debido a que se asume que la gran mayoría es de baja virulencia. Los materiales Sabin pueden ser infecciosos o potencialmente infecciosos. El 34 fenotipo atenuado de los virus resultantes de la fabricación basada en las semillas OPV/Sabin debe ser asegurado y no puede basarse en la falta de cambios (drift, mutaciones) de la secuencia únicamente. Los materiales de OPV/Sabin pueden ser infecciosos o potencialmente infecciosos. los materiales infecciosos de poliovirus OPV/Sabin incluyen: o Aislamientos de cultivos celulares y cepas OPV/Sabin de referencia. o Stocks semilla (material de siembra) y materiales de virus vivos de la producción de la OPV. o Muestras de aguas ambientales o aguas residuales que han dado positivo a la presencia de cepas OPV/Sabin. o Muestras fecales o de secreción respiratoria que personas recientemente vacunadas con OPV. o Animales infectados o sus muestras, incluyendo los ratones transgénicos receptores de poliovirus humanos (PVR). o Los derivados producidos en el laboratorio que tienen secuencias de la cápside de las cepas OPV/Sabin. o ARN o ADNc de longitud completa que incluyan secuencias de la cápside derivadas de OPV/Sabin o Las células persistentemente infectadas con cepas de poliovirus cuyas secuencias de la cápside se derivan de OPV/Sabin. Por su parte, los materiales potencialmente infecciosos de OPV/Sabin incluyen: o Muestras fecales o de secreción respiratoria recogidos para cualquier propósito en un tiempo y área geográfica de uso de OPV. o Los productos de estos materiales en animales o células permisivas para poliovirus. o Existencias (stocks) de virus entéricos y respiratorios manipulados en condiciones donde la replicación o contaminación del poliovirus es posible. Regulación: Acción gubernamental para controlar con normas o sujetar a restricciones. Riesgo: Combinación de la probabilidad de ocurrencia de un daño y la gravedad de dicho daño. Evaluación del riesgo: Es un proceso cualitativo o semicualitativo llevado a cabo por personas con experiencia en disciplinas apropiadas y en respuesta a un peligro identificado. Tasa reproductiva (R0): Es una medida de la transmisibilidad de un patógeno que captura las características de vulnerabilidad de la comunidad y del virus calculada como el número de infecciones secundarias causadas por un solo caso índice en una población totalmente susceptible. Salvaguardias primarias: Las precauciones de contención y estipulaciones diseñadas para minimizar los riesgos de exponer o infectar poblaciones con poliovirus asociados a instalaciones. Salvaguardias secundarias: El perfil inmunitario poblacional consistente con minimizar la consecuencia de una liberación del poliovirus desde una instalación de contención esencial que consiste en una política nacional de vacunación infantil de rutina y una cobertura poblacional alta (> 90%). Salvaguardias terciarias: Las condiciones de saneamiento e higiene (normas de buena higiene personal, doméstica y ambiental y sistemas de alcantarillado cerrados con tratamiento de efluentes secundaria o superior) que minimizan el riesgo de restablecer la circulación del poliovirus salvaje altamente transmisible en el caso de reintroducción. Senior Manager (SM): El representante oficial de la institución quien tiene la autoridad general y la responsabilidad de velar por la gestión de la bioseguridad de las instalaciones. Objetos punzantes: Dispositivos utilizados en las instalaciones que son capaces de cortar/ o perforar la piel (por ejemplo, agujas, tijeras, vidrio). 35 Esterilización: Es un proceso que destruye o elimina los microorganismos y sus esporas. Estándar (norma): Es un documento que proporciona los requisitos, las especificaciones, directrices o características que pueden ser utilizadas consistentemente para asegurar que los materiales, productos, procesos y servicios son adecuados para su propósito. Validación: Es la confirmación, mediante la aportación de una evidencia objetiva, de que los requisitos para un uso o aplicación específica han sido cumplidos. Verificación: Es la confirmación, a través de la aportación de evidencia objetiva, de que los requerimientos especificados han sido cumplidos. La verificación del cumplimiento de esta norma por la OMS puede ser solicitada a las instalaciones de poliovirus esenciales certificadas (A68/21, WHA 2015). Comisión de Certificación Global OMS (GCC): El término comúnmente usado para referirse a la Comisión Mundial de la OMS para la Certificación de la Erradicación de la Poliomielitis, la cual tiene la responsabilidad de definir los parámetros y procesos mediante los cuales se certifica la erradicación de la poliomielitis, y de recibir y emitir un informe final al Director General de la OMS en que se certifique que la erradicación mundial de la poliomielitis se ha logrado. Comisión de Certificación Regional de la OMS (RCC): Es el término comúnmente utilizado para referirse a la Comisión Regional de la OMS para la Certificación de la Erradicación de la Poliomielitis, la cual ha sido establecida en cada una de las seis regiones de la OMS con la responsabilidad de certificar a la GCC que la erradicación ha sido lograda en todos los Estados Miembros de su Región. Comisión Nacional de Certificación de la OMS (NCC): Es el término comúnmente utilizado para referirse a la Comisión Nacional de la OMS para la Certificación de la Erradicación de la Poliomielitis, que se ha establecido en cada país con la responsabilidad de certificar a la RCC acerca de que la erradicación se ha logrado en todo el país. 36 Cronograma Versión: 00 2015 -Jul-31 1 de 1 CRONOGRAMA DE ACTIVIDADES DEL GAPIII-REGIONAL, 2015 - 2016 REGION DE LAS AMERICAS ACTIVIDAD A DESARROLLAR 2015 AGOSTO SEPTIEMBRE OCTUBRE 2016 NOVIEMBRE DICIEMBRE Listado de instalaciones / laboratorios que participaran en la encuesta Remisión de la encuesta a laboratorios / instituciones Inventario de laboratorios / instituciones que conservan material infeccioso o potencialmente infeccioso de poliovirus salvajes y vacunales Implementación de requisitos del GAPIII en instalaciones esenciales de poliovirus Certificación de instalaciones esenciales por autoridad nacional Destrucción, transferencia o destrucción de materiales infecciosos o potencialmente infecciosos de poliovirus salvaje Destrucción, transferencia o destrucción de materiales infecciosos o potencialmente infecciosos de poliovirus vacunales tipo 2 Informe de país sobre el inventario de instalaciones y la contención de poliovirus salvaje Informe de país sobre el inventario de instalaciones y la contención de poliovirus vacunal tipo 2 Revisión de los informes de contención de los países por la Comisión de Certificación Regional Presentación del informe de contención Regional a la Comisión de Certificación Mundial 37 ENERO FEBRERO MARZO ABRIL MAYO JUNIO JULIO AGOSTO SEPTIEMBRE ANEXOS DEL GAPIII-R 38 Anexo A Encuesta de actualización de instituciones / laboratorios que conservan material de poliovirus salvaje e identificación de instalaciones que conservan material de poliovirus vacunal o materiales potencialmene infecciosos de poliovirus. (Se entregará una copia impresa y una copia en archivo Word a cada uno de los países). 39 Anexo B Notificación de culminación de la encuesta de actualización e inventario de las instalaciones que conservan material infeccioso o potencialmente infeccioso de poliovirus Para los países que ya han realizado la actualización del inventario de instalaciones y laboratorios de interés, un ejemplo de carta de notificación sobre la información aprobada por el país, sería: Ciudad, fecha Señores UNIDAD DE INMUNIZACIÓN INTEGRAL DE LA FAMILIA Departamento de Familia, Género y Curso de Vida OPS/ país_ El Ministerio de Salud (o entidad autorizada que haga sus veces) de país informa que ya ha finalizado la encuesta de actualización de inventario de las instalaciones y laboratorios de interés que se ubican en el país. La información de la encuesta fue verificada, previa a esta remisión, por funcionarios del Ministerio (o entidad nacional encargada) que envía esta carta. La información es real, y, por tanto, refleja de manera apropiada la situación nacional actual. Cada informe individual de las instalaciones ha sido revisado y aprobado por las personas requeridas (esto es, director de la institución, de la instalación o laboratorio) y de quien llena la encuesta o quie haga sus veces). El total de laboratorios encuestados según tipo (enseñanza, investigación, producción, biomédicos, ambientales, salud pública) y dependencia institucional (Ministerios de Salud, Educación, Defensa, Ambiente, etc) se presenta en la siguiente tabla: El inventario de instalaciones que reportaron en la encuesta conservar material infeccioso de poliovirus o material potencialmente infeccioso de poliovirus y la decisión acerca de la disposición de dicho material se presenta en las siguientes tablas: 40 El país ha analizado los beneficios, riesgos y los compromisos adquiridos al definir instalaciones esenciales de poliovirus y la decisión del país ha sido la de designar las siguientes instalaciones esenciales de poliovirus, las cuales han implementado las salvaguardas descritas en el GAPIII y han sido certificadas por la autoridad nacional: 41 Los profesionales que participaron en la implementación de la encuesta, obtención del inventario de material, revisión y aprobación de este informe, son las que se describen a continuación (incluir al comité nacional y personas designadas o contratadas para tal fin) 42