diagrama cobre-niquel - Universidad Tecnológica de Pereira
Anuncio

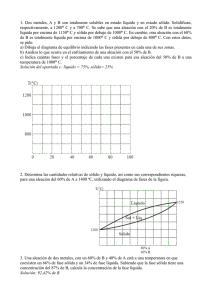
DIAGRAMA COBRE-NIQUEL - REGLA DE LA PALANCA Y LEY DE FASES DE GIBBS CONTENIDO 1. 2. 3. 4. 5. 6. 7. 8. INTRODUCCIÓN DIAGRAMA COBRE- NIQUEL REGLA DE LA PALANCA REGLA DE FASES DE GIBBS EJERCICIOS DE LA REGLA DE LA PALANCA APLIACIONES DE COBRE-NIQUEL DEFINICIONES BIBLIOGRAFÍA 1. INTRODUCCIÓN Los diagramas de fases son representaciones gráficas de las fases que están presentes en un sistema de aleación a diversas temperaturas presiones y composiciones; los diagramas de fases se construyen empelando la información recopilada en la curvas de enfriamiento. Las curvas de enfriamiento son gráficos de tiempo y temperatura generados para diversas composiciones de aleaciones y brindan información sobre las temperaturas de transición de las fases. En los diagramas de fases binarios en equilibrio temperatura-composición se indican que fases están presentes a diferentes composiciones y temperaturas para condiciones de enfriamiento o calentamiento lentos que se acercan al equilibrio; evidenciándose en el diagrama Cobre-Níquel (bifásico), el cual servirá de ejemplo para explicar lo anteriormente mencionado. Figura 1 En los diagramas bifásicos, la composición química de cada una de las dos fases se indica por la intersección de la isoterma con los límites de fase, el fragmento en peso de cada fase en una región de dos fases puede determinarse usando la regla de la palanca a lo largo de una isoterma (línea de enlace a una temperatura particular). En estos diagramas también se relaciona la regla de las fases de Gibbs, la cual establece que en el equilibrio el número de fases más los grados de libertad es igual al número de componentes más 2, P + F = C + 2 de forma abreviada, con la presión 1atm, P + F = C + 1. 2. DIAGRAMA COBRE-NIQUEL Los diagramas se compones de la aleaciones estas aleaciones Son una mezcla sólida homogénea, de uno o más metales con algunos elementos no metálicos. Se puede observar que las aleaciones están constituidas por elementos metálicos en estado elemental (estado de oxidación nulo), por ejemplo Fe, Al, Cu, Ni Pb... Para su fabricación en general se mezclan los elementos llevándolos a temperaturas tales que sus componentes fundan. Las aleaciones presentan brillo metálico y alta conductividad eléctrica y térmica, aunque usualmente menor que los metales puros. Las propiedades físicas y químicas son, en general, similares a la de los metales, sin embargo las propiedades químicas tales como dureza, ductilidad, tenacidad etc. pueden ser muy diferentes, de ahí el interés que despiertan estos materiales, que pueden tener los componentes de forma aislada. Las aleaciones no tienen una temperatura de fusión única, dependiendo de la concentración, cada metal puro funde a una temperatura, coexistiendo simultáneamente la fase líquida y fase sólida como se puede apreciar en los diagramas de fase anteriormente vistos. Actualmente de estudia en las aleaciones porque pueden presentar propiedades muy importantes en la industria y como vemos una de las aleaciones importantes utilizadas es la aleación Cu-Ni esta aleación. Los elementos como el cobre y níquel tienen solubilidad total tanto en estado líquido como sólido. En el diagrama de la figura 1 se muestra el diagrama de fases de este sistema en el que se representa la composición química de la aleación en tanto por ciento en peso en abscisas y la temperatura en °C en ordenadas. Este diagrama se ha determinado bajo condiciones de enfriamiento lento y a presión atmosférica y no tienen aplicación para aleaciones que sufren un proceso de enfriamiento rápido. El área sobre la línea superior del diagrama, línea de líquidus, corresponde a la región en la que la aleación se mantiene en fase líquida. El área por debajo de la línea inferior, línea sólidus, representa la región de estabilidad para la fase sólida. Entre ambas líneas se representa una región bifásica en la que coexisten las fases líquida y sólida. La cantidad de cada fase presente depende de la temperatura y la composición química de la aleación. FIGURA 2 Para una determinada temperatura puede obtenerse aleaciones totalmente en fase sólida, en fase (sólida + líquida) y en fase totalmente líquida según la proporción de sus componentes. De la misma manera, para una determinada proporción de la mezcla, se puede definir una temperatura por debajo de la cual toda la aleación se encuentre en fase sólida, un intervalo de temperaturas en donde la aleación se encuentre en dos fases (sólida y líquida) y una temperatura a partir de la cual toda la aleación esté líquida. El diagrama bifásico del sistema cobre-níquel (Figura 2a) quizás es el de más fácil comprensión e interpretación. Como anteriormente habíamos nombrado los ejes, el de las ordenadas que representa la temperatura, y en el de abscisas la composición en peso (abajo) y el porcentaje atómico (arriba) de la aleación de níquel. La composición varía desde el 0% en peso de Ni (100% de Cu) en el extremo izquierdo horizontal hasta el 100% en peso de Ni (0% de Cu) en el derecho. FIGURA 3 La zona líquido L es una disolución líquida homogénea compuesta por cobre y níquel. La fase α es una disolución sólida sustitucional, de átomos de cobre y de níquel, de estructura cristalina FCC. A temperaturas inferiores a 1080ºC el cobre y el níquel son mutuamente solubles en estado sólido en cualquier composición. Esto se puede explica porque Cu y Ni tienen la misma estructura cristalina (FCC), radios atómicos y electronegatividades casi idénticos y valencias muy similares, lo podemos observar en la tabla periódica. Otro concepto importante para tener en cuenta es que el sistema cobre-níquel se denomina isomorfo debido a las solubilidades totales de los dos componentes en estados sólido y líquido. Las líneas sólidas (sólidus) y líquidas (líquidus) de la (Figura 3.a), interceptan en los dos extremos de la composición y corresponden a las temperaturas de fusión de los componentes puros. Las temperaturas de fusión del cobre y del níquel puros son de 1085ºC y 1455ºC, respectivamente. El calentamiento del cobre puro significa desplazamiento vertical a lo largo del eje izquierdo de la temperatura. El cobre permanecerá sólido hasta llegar a la temperatura de fusión. La transformación sólido a líquido tiene lugar a la temperatura de fusión, que permanece constante hasta que termina la transformación. Reiterando lo anterior para otra composición distinta de la de los componentes puros, ocurre el fenómeno de la fusión en un tramo de temperaturas comprendido entre las líneas sólidas y líquidas. En este tramo permanecen en equilibrio las fases sólido y líquido. Por ejemplo, calentando una aleación de 50% en peso de Ni y 50% en peso de Cu (Figura 3.a), empieza a fundir a unos 1280ºC y la proporción de líquido aumenta al incrementar la temperatura hasta llegar a los 1320ºC, en que la aleación funde totalmente. Ahora Interpretaremos los diagramas de fases de la (Figura 3) para un mayor entendimiento. Conociendo la composición y la temperatura de equilibrio, los sistemas binarios o bifásicos suministran la siguiente información: (1) las fases presentes, (2) la composición de cada fase (3) la fracción o porcentaje de cada fase. El procedimiento empleado para realizar estas determinaciones se desarrollará en el sistema cobre-níquel. Este procedimiento se volverá relativamente fácil para conocer las fases presentes. Se localiza en el diagrama el punto definido por la temperatura y la composición y se identifican las fases presentes en este campo. Ejemplos de análisis Ejemplo 1: El punto A de la Figura 1.a representa una aleación de 60% en peso de Ni y 40% en peso de cobre a 1100ºC; puesto que este punto se encuentra en la región monofásicaα, sólo estará presente la faseα fase sólida. Ejemplo 2: Una aleación de 35% en peso de Ni y 65% en peso de Cu a 1250’C (punto B) consistirá en la fase a en equilibrio con la fase líquida. En la aleación 35% en peso Ni y 65% Cu, de la (Figura 3.b), a 1250ºC, existen las fases α y líquido. La dificultad radica en calcular la proporción de ambas. El segmento de recta de reparto se ha trazado para determinar las composiciones de las fases α y líquido. La composición global de la aleación está localizada en el punto Co de este segmento: las fracciones de las masas de las fases presentes están representadas por WL y Wα, La fracción WL se calcula mediante la regla de la palanca. Para este caso utilizaremos del ejemplo 2 el siguiente concepto nombrado como regla de la palanca, y se explicara ampliamente su definición. 3. REGLA DE LA PALANCA Esta fórmula matemática consiste en encontrar las cantidades de % de sustancia en los diagramas de fases, Estas cantidades normalmente se expresan como porcentaje del peso (% peso), y es válida para cualquier diagrama de fase binario. La regla de la palanca da a conocer la composición de las fases y es un concepto comúnmente utilizado en la determinación de la composición química “real” de una aleación en equilibrio a cualquier temperatura en una región bifásica. En regiones de una sola fase, la cantidad de la fase simple es 100%. En regiones bifásicas se deberá calcular la cantidad de cada fase. Y la técnica es hacer un balance de materiales. Para calcular las cantidades de líquido y de sólido, se construye una palanca sobre la isoterma con su punto de apoyo en la composición original de la aleación (punto dado). El brazo de la palanca, opuesto a la composición de la fase cuya cantidad se calcula se divide por la longitud total de la palanca, para obtener la cantidad de dicha fase. Consideremos el siguiente diagrama bifásico: Composición de L a T1 Líquido Temperatura Punto del estado ( ºC ) L+S Temperatura del sistema T1 Composición de S a T1 Sólido A X2 X1 Porcentaje en peso de B Composición del sistema X3 B Si como en el ejemplo del diagrama estamos a una temperatura T1 y con una composición del sistema X1% de B tendremos una mezcla de dos fases, L y S (líquido y sólido), determinaremos la composición química de cada una y sus cantidades relativas. Así: Habrá en la fase L (líquido) a T1, un X2% en peso de B y (1- X2 ) % de A. La composición de la fase S (sólido) a T1 será de un X3% de B y un (1 – X3 )% de A. Para determinar las cantidades relativas de L (líquido) y S (sólido) que hay a una temperatura y composición prefijadas usaremos la regla de la palanca: Longitud de la isoterma opuesta al líquido X3 – X1 % de líquido = = Longitud total de la isoterma X3 – X2 Para cualquier composición y temperatura Longitud de la isoterma opuesta al sólido X1 – X2 % de sólido = = Longitud total de la isoterma X3 – X2 Evidentemente: % de L + % de S = 100% Nota importante: Se puede utilizar la regla de la palanca en cualquier región bifásica de un diagrama de fases. En regiones de una fase no se usa el cálculo de la regla de la palanca puesto que la respuesta seria obvia ya que sería existente un 100% de dicha fase presente. 4. REGLA DE FASES DE GIBBS A partir de consideraciones termodinámicas, J. W. Gibbs obtuvo una ecuación que permitía calcular el número de fases que pueden coexistir en equilibrio en cualquier sistema. Esta ecuación llamada regla de las fases de Gibbs, es P+F=C+2 Donde, P = número de fases que pueden coexistir en el sistema C = número de componentes en el sistema F = grados de libertad Usualmente, un componente C es un componente, un compuesto o una solución en el sistema. F son los grados de libertad, es decir número de variables como (presión, temperatura y composición) que se pueden cambiar independientemente sin variar el número de fases en equilibrio en el sistema. Considere la aplicación de la regla de Gibbs al diagrama a continuación de fases presióntemperatura PT del agua pura ver (figura5) en el punto triple coexisten tres fases en equilibrio y como hay un componente en el sistema (agua), se puede calcular el número de grados de libertad. Figura 5 P+F=C+2 3 + F = 1 + 3, F=0 Como ninguna de las variables (presión o temperatura) se puede cambiar manteniendo el equilibrio al punto triple se le llama punto invariante. Ahora consideremos la curva de congelación solido-liquido de la (figura 3). En cualquier punto de esa línea coexisten dos fases. Así, aplicamos la regla de las fases, 2+F=1+2 F=1 Este resultado indica que hay un grado de libertad y, por tanto, una variable (P o T) puede cambiarse de forma independiente manteniendo un sistema con dos fases que coexisten. Los diagramas de fases binarios utilizados en la ciencia de los materiales son, en su mayoría, diagramas temperatura-composición, en los que la presión se mantiene constante, por lo general a 1 atm. En este caso, se tiene la regla se fases condensada, dada por P+F=C+1 Y como podemos observar el diagrama binario isomorfo de Cu y Ni de acuerdo con la regla de Gibbs (F = C – P + 1), a la temperatura de fusión de los componentes puros, el número de componentes C es 1 (ya sea Cu o Ni) y el número de fases disponible P es 2 (liquida o solida), lo cual indica que da un resultado de grado de libertad de 0 denominados anteriormente como puntos invariantes. Significaría entonces que cualquier cambio de temperatura modificara la microestructura, ya sea a solida o liquida. Por consiguiente, en las regiones monofásicas (liquida o solida), el número de componentes C es 2, y el número de fases disponibles, P es 1, lo que da un grado de libertad de F = 2. Esto significa que se puede mantener la micro-estructura del sistema en esta región mediante la variación independiente de la temperatura o composición. En la región bifásica, el número de componentes, C es de 2, y el número de fases disponibles, P es 2, lo que da un grado de libertad de F = 1. Esto significa que solo una variable (ya sea temperatura o composición) puede modificarse independientemente del tiempo que se mantiene la estructura bifásica del sistema. Si se modifica la temperatura, la composición de las fases también cambiaran. 5. Ejercicios de la regla de la palanca 1. Una aleación de cobre - níquel contiene 53% en peso de Cu y 47% de Ni y está a 1.300 °C. Utilizando la siguiente figura responder lo siguiente: a) Cuál es el porcentaje en peso de cobre en las fases sólida y líquida a esta temperatura b) Qué porcentaje en peso de la aleación es líquida, y qué porcentaje es sólida Solución: a) % Cu en fase líquida: % Cu en fase sólida: 61% Cu 43% Cu Xs = (w0 – wl) / (ws – wl) b) Se toma de referencia en este caso el Níquel w0 = 47% wl = 39% ws = 57% Xs = (47 – 39) / (57 – 39) x100% = 44%fase solida Xl = (ws – w0) / (ws – wl) = (57 – 47) / (57 – 39) x100%= 56% fase liquida 2. Tenemos 200 kg de Cu-Ni con 50% de Ni a 1300 ºC, con base al siguiente diagrama. Determine: a) Porcentaje que hay de la fase α y fase líquida b) Cuantos kilogramos c) Composición de cada fase Solución: Ni = 50% = 100 kg Cu = 50% = 100 kg Se toma de referencia el Níquel wl = 40% w0 = 50% ws = 59% a 1300 ºC Xs= (w0 – wl) / (ws – wl) Porcentaje Sólido Xl = (ws – w0) / (ws – wl) Porcentaje Líquido a) Xs = (50 – 40) / (59 – 40) = 53% fase solida Xl = (59 – 50) / (59 – 40) = 47% fase liquida b) % fase α x 200 kg = 106 kg % fase L x 200 kg = 94 kg c) De fase Sólida α Cu = 41% Ni = 59% De fase Líquida L Cu = 60% Ni = 40% 6. APLICACIONES DE LA ALEACION COBRE NIQUEL DEL DIAGRAMA ANTERIOR Debido a las propiedades de estas aleaciones como la ductilidad, tenacidad, dureza etc. de ahí el interés que despiertan estos materiales a las empresas, que pueden tener los componentes de forma aislada. Para ser utilizados en tuberías o como conductores (calor y electricidad), bujes, entre otras aplicaciones. Adicional a esto Las aleaciones de base cobre con níquel, ampliamente usadas en la operación de plantas y equipos en ambientes marinos, constituyen las aleaciones más adecuadas para la fabricación de piezas expuestas a la acción agresiva de los iones cloruros presentes en el agua de mar. 7. DEFINICIONES Equilibrio: un sistema está en equilibrio si no tiene lugar cambios microscópicos con el tiempo. Fase: una porción física homogénea y diferente de un sistema material. Diagrama de fases de equilibrio: representación gráfica de temperaturas y composiciones para las cuales varias fases son estables en el equilibrio. En la ciencia de materiales, los diagramas de fases más comunes describen a la temperatura versus composición. Sistema: una porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. Regla de las fases de Gibbs: establece que en el equilibrio del número de fases más los grados de libertad es igual al número de componentes más 2, P + F = C + 2. De forma abreviada, con la presión 1= atm, P + F = C + 1. Grados de libertad F: número de variables (temperatura composición y presión) que se pueden variar independientemente sin cambiar la fase o fases del sistema. Número de componentes de un diagrama de fases: número de elementos que constituyen el sistema del diagrama de fases. Por ejemplo Fe-Ni un sistema de dos componentes. Sistema isomorfo: un diagrama de fases en el cual solo existe una única fase sólida, esto es, hay solo una estructura en estado sólido. Líquidus: temperatura a la cual el líquido empieza a solidificarse bajo condiciones de equilibrio. Sólidus: temperatura durante la solidificación de una aleación a la cual la última parte de la fase liquida se solidifica. Regla de la palanca: los porcentajes en pesos de las fases en cualquier región de un diagrama de fases binarios se puede calcular usando esta regla si prevalecen las condiciones de equilibrio. Reacciones invariantes: transformaciones de fase en equilibrio que se suponen cero grados de libertad. 8. BIBLIOGRAFIA [1] Fundamentos de la ciencia e ingeniería de materiales. Willian F. Smith, Cuarta Ed. [2] http://cabierta.uchile.cl/revista/23/articulos/pdf/edu1.pdf [3] http://thebookshq.com/books/diagramas-de-fases-cobre-niquel.html [4] http://www.uam.es/docencia/labvfmat//labvfmat/practicas/practica1/palanca_archivos/palanca.htm [5] http://www.diquima.upm.es/docencia/tqg/docs/regla_palanca.pdf [6] http://es.wikipedia.org/wiki/N%C3%ADquel AUTOR CRISTHIAN ANDRES MARMOLEJO VELEZ COD 1112618939 ESTUDIANTES DE INGENERÍA MECÁNICA UNIVERSIDAD TECNOLOGICA DE PEREIRA FACULTDA DE INGENIERÍA MECÁNICA