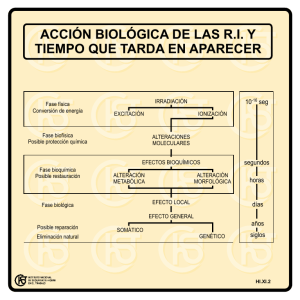
Uso de un acelerador lineal de 6 MV para la irradiación de
Anuncio

Uso de un acelerador lineal de 6 MV para la irradiación de modelos biológicos en investigación pre‐clínica 1 Tabla de Contenido 1 INTRODUCCIÓN .....................................................................................................................4 2 ANTECEDENTES.....................................................................................................................6 2.1 Aceleradores lineales de uso clínico ................................................................................................. 6 2.2 Componentes de un acelerador lineal .............................................................................................. 6 2.3 Sistema de colimación multihojas .................................................................................................... 8 2.3.1 El mMLC de BrainLAB ....................................................................................................................... 9 2.4 Radiocirugía con acelerador lineal.................................................................................................. 10 2.4.1 Modalidades de tratamiento.......................................................................................................... 11 2.4.2 Arcos circulares............................................................................................................................... 11 2.4.3 Haces conformados ........................................................................................................................ 11 2.4.4 Arcos conformados......................................................................................................................... 12 2.4.5 Intensidad Modulada (IMRT).......................................................................................................... 12 2.5 Sistemas de detección y medida de la dosis.................................................................................... 12 2.5.1 Cámara de ionización de dedal....................................................................................................... 12 2.5.1.1 Recolección de iones .............................................................................................................. 15 2.5.1.2 Medida de la exposición ......................................................................................................... 16 2.5.1.3 Medida de la Dosis.................................................................................................................. 16 2.5.2 Película Radiográfica....................................................................................................................... 16 2.5.2.1 Densidad Óptica...................................................................................................................... 17 2.5.2.2 Curvas características ............................................................................................................. 18 2.5.2.3 Medida de dosis relativa y absoluta ....................................................................................... 19 2.6 Algoritmos de cálculo de la dosis.................................................................................................... 19 2.6.1 Algoritmo de haz de lápiz diferencial ............................................................................................. 20 2.6.2 Métodos Monte Carlo .................................................................................................................... 21 2.7 Ensayos in vivo/in vitro .................................................................................................................. 22 2.7.1 La curva de sobrevida in vitro y la relación dosis‐respuesta........................................................... 24 2.8 Irradiación de modelos pre‐clínicos ................................................................................................ 25 2.8.1 Equilibrio de partícula cargada en la irradiación de cultivos celulares........................................... 26 2 3 DOSIMETRÍA, CÁLCULOS MONTE CARLO E IRRADIACIÓN DE CULTIVOS CELULARES ................................................................................................................................. 27 3.1 Dosimetría: Cálculos Monte Carlo y Medidas ................................................................................. 27 3.1.1 Medio Homogéneo......................................................................................................................... 29 3.1.2 Arreglo experimental In vitro.......................................................................................................... 29 3.2 Calibración de la película radiográfica ............................................................................................ 30 3.2.1 Calibración utilizando campos separados ...................................................................................... 30 3.3 Extrapolación de valores de dosis en la región de incremento con película radiográfica ................. 31 3.4 Técnica de irradiación In vitro: Irradiación y ensayo clonogénico.................................................... 33 3.4.1 Técnica de irradiación In vitro: Análisis de datos............................................................................ 33 3.5 Irradiación con campos de intensidad modulada en cultivos celulares............................................ 33 3.5.1 Descripción de la geometría de irradiación .................................................................................... 34 3.6 Validación del diseño experimental................................................................................................ 34 3.1 Calibración de campos contiguos con intensidad variable .............................................................. 35 4 RESULTADOS DE LA SIMULACIÓN MONTE CARLO E IRRADIACIÓN CON CAMPOS UNIFORMES............................................................................................................... 37 4.1 Validación de la simulación MC ...................................................................................................... 37 4.1 Calibración de la película radiográfica ............................................................................................ 40 4.2 Dosis en la región de incremento con película radiográfica............................................................. 41 4.3 Irradiación del cultivo celular ......................................................................................................... 43 4.4 Irradiación de la línea celular: fracción de sobrevida ...................................................................... 44 5 RESULTADOS DE LA IRRADIACIÓN CON CAMPOS DE INTENSIDAD MODULADA 46 6 CONCLUSIONES ................................................................................................................... 47 7 BIBLIOGRAFÍA..................................................................................................................... 49 3 1 Introducción La base lógica, el papel y los resultados del uso de radiación ionzante para el tratamiento de patologías cerebrales en la modalidad de múltiples sesiones con bajas dosis ha sido estudiado en detalle por numerosos investigadores. Frecuentemente, el conocimiento resultante de estos estudios no se aplica a la radiocirugía, dado que ambas técnicas difieren en varias características; ésta última es una técnica en la cual se entrega en un sólo evento de exposición una dosis alta de radiación en el blanco de interés, generalmente de volúmen pequeño y consiguiéndose fuera de la región anatómica de interés un gradiente hacia dosis bajas muy importante. El conocimiento de los efectos combinados de la terapia con radiación ionizante a altas dosis y algunos agentes radiosensibilizadores, así como de la toleracia de tejido sano bajo el efectos de estos fármacos aún presenta interrogantes importantes. Además, ésta es una situación que puede continuar, ya que actualmente se ecuentran en desarrollo diversos agentes quimoterapéuticos con posibles efectos radiosensibilizadores, con la finaldad en su mayoría de avanzar en el tratamiento del cáncer. Para predecir mejor los efectos de la radioterapia/radiocirugía, así como para optimizar estos tratamientos, tales efectos han de ser estudiados en modelos in vitro y en modelos animales en etapas pre‐ clínicas. En este trabajo se estudian métodos para determinar la dosis absorbida en estudios pre‐clínicos, en condiciones que dosimétricamente implican un reto, una vez , por las pequeñas dimensiones que típicamente encontramos en estos sistemas experimentales, es frecuente el caso de requerir el valor de dosis que corresponda a blancos localizados en regiones donde no se alcanza equilibrio electrónico de partícula cargada. Determinar la dosis de manera precisa es fundamental para poder obtener relaciones dosis‐respuesta confiables. Por otro lado, la capacidad de entregar una dosis de radiación suficientemente alta para conseguir control tumoral máximo está limitada por la dosis que el tejido sano y que los órganos de riesgo pueden tolerar. Para conseguir estos objetivos, los avances tecnológicos han llevado al uso clínico de la radioterapia con intensidad modulada (IMRT), por lo que actualmente se llevan al cabo experimentos in vitro encaminados a determinar el impacto radiobiológico de esta técnica. Así, la respuesta a la radiación puede ser comparada con modelos teóricos para luego definir si es necesario modificarlos, por lo que la medida de la respuesta de las células irradiadas como función de la distribución espacial de la dosis adquiere gran relevancia. En este trabajo también se describe el uso de patrones de IMRT generados por rayos X de 6 MV para la irradiación in vitro de líneas celulares cultivadas en 4 frascos de proliferación en placa inmersas en medio de cultivo, y la determinación de la dosis absorbida en el plano de proliferación celular. 5 2 Antecedentes 2.1 Aceleradores lineales de uso clínico El desarrollo de máquinas de alto voltaje y radioisótopos para radioterapia externa tiene sus inicios en 1945. Desde entonces se han producido cambios muy importantes en la práctica de la radioterapia, permitiendo que alrededor del mundo ahora sea posible un mejor control de muchos tipos de cáncer. Gracias a la constante evolución de la aplicación de la radiación ionizante en el tratamiento de enfermedades, hoy se tiene la expectativa de mejorar la tasa de cura con el refinamiento de estos dispositivos mediante mayor precisión mecánica y dosimétrica. Por aproximadamente dos décadas, el equipo de mayor demanda fue la Unidad de Cobalto‐60, instalándose la primera en 1950. Actualmente todavía cientos de centros cuentan con este tipo de dispositivo alrededor del mundo. Estas unidades han sido sustituidas poco a poco o complementadas con el uso de aceleradores lineales de alta energía. Cabe mencionar que en algún momento también se utilizaron las Unidades de Cesio‐137, mismas que inclusive fueron utilizadas para la irradiación experimental de ratones (Cunningham et al. 1965). 2.2 Componentes de un acelerador lineal Un acelerador lineal (linac) es un dispositivo que utiliza ondas electromagnéticas de alta energía para acelerar partículas cargadas (como electrones) y alcanzar altas energías a través de un tubo lineal. El haz de electrones de alta energía por sí mismo puede utilizarse para el tratamiento de algunas patologías, como por ejemplo tumores superficiales. Por otro lado, los electrones pueden hacerse incidir en un blanco para producir rayos X de frenado y ser utilizados en el tratamiento de tumores o regiones de interés localizadas a mayor profundidad. Los linacs utilizados en radioterapia aceleran electrones mediante ondas electromagnéticas estacionarias o viajeras de frecuencia en la región de microondas (≈3000 MHz). La diferencia entre el tipo de onda de aceleración está relacionado con la estructura del tubo. En relación con la función, la estructura que utiliza ondas viajeras requiere de una pieza terminal o carga, con la finalidad de absorber la potencia residual en la parte final de la estructura, de tal manera que se pueda prevenir la generación de una onda reflejada. La estructura que utiliza ondas estacionarias provée de máxima reflexión de las ondas electromagnéticas en ambos extremos de la región de aceleración, de tal forma que la combinación de ellas viajando en ambos sentidos da lugar a ondas estacionarias. En esta modalidad, el dispositivo de generación de microondas se encuentra dentro de la estructura mediante cavidades vecinas acopladas; este diseño es el más frecuente, y aunque es más caro, también es más eficiente. 6 Los rayos X de frenado se producen cuando los electrones inciden en un blanco de material de número atómico alto, como por ejemplo alguna aleación de tungsteno. El blanco es de grosor suficiente como para absorber la mayoría de los electrones incidentes y está asociado con un sistema de enfriamiento. Como consecuencia de la pérdida de energía de los electrones conforme penetran en el blanco, se obtiene un haz de fotones con un espectro de energía continuo. Este espectro tiene energía máxima igual a la energía de los electrones incidentes. La energía promedio del haz es aproximadamente un tercio de la energía máxima. Como se mencionó con anterioridad, en los aceleradores lineales de uso clínico también se puede utilizar el haz de electrones directamente. En la modalidad de irradiación con electrones, el haz se hace incidir en una “hoja dispersora” con la finalidad tanto de dispersar el haz como de alcanzar una fluencia uniforme a lo largo del campo de tratamiento. El grosor de la hoja es tal que la mayor parte de los electrones son dispersados en lugar de sufrir interacción por frenado. Sin embargo, una pequeña fracción de estos cede su energía para generar rayos X de frenado, lo que se convierte en contaminación del haz de electrones por fotones. En la salida del haz de radiación, se colocan dispositivos de colimación para darle alguna forma específica, con el objetivo de irradiar el volumen blanco con el haz primario y al mismo tiempo proteger el tejido circundante. Estos colimadores pueden ser bloques, cuñas, conos o dispositivos multihojas. Los aceleradores lineales de uso clínico se construyen de tal forma que la fuente de radiación colocada en el cabezal puede rotar alrededor del eje horizontal. Mientras el cabezal rota, el eje del colimador (que coincide con el eje central del haz) se mueve en un plano vertical. Al punto de intersección del eje del colimador y el eje de rotación del cabezal se le conoce como isocentro. Figura 2‐1 Figura de un acelerador lineal. Se ilustra la capacidad que tiene el cabezal de rotar alrededor del isocentro localizado dentro del paciente. 7 2.3 Sistema de colimación multihojas Los colimadores multihohjas (MLCs) se utilizan para entregar tratamientos que requieren de fluencias complejas del haz primario. Al inicio, el MLC permitió el uso de mas ángulos de tratamiento respecto de que lo que era posible en RT convencional con campos cuadrados utilizando bloques. Además hizo posible reducir significativamente la dosis a tejido sano, ya que permite conseguir a la salida del haz una forma muy cercana a la de la lesión en cada plano de incidencia del tratamiento (Figura 2‐2). El mayor potencial de este tipo de dispositivos se consigue con la radioterapia de intensidad modulada (IMRT), mediante la cual es posible alcanzar de mejor forma los objetivos terapéuticos en términos de cobertura a los blancos de tratamiento y de protección al tejido circundante cuando se trata de casos con geometrías complejas, lo que hace posible estudiar posibles escalamientos de dosis en los tratamientos. El uso de segmentos múltiples o campos pequeños están involucrados en la construcción de los mapas de fluencia, de tal forma que el uso de sistemas de cómputo se ha vuelto indispensable. Los MLCs con grosor de hojas de alrededor de 1 cm son una herramienta muy precisa para entregar tratamientos conformales y de IMRT en regiones extracraniales. Las variaciones en el diseño estándar de MLCs incluyen mini‐MLC y micro‐MLC (mMLC), que tiene hojas de hasta 3 mm de grosor proyectadas en el isocentro. La diferencia principal entre estos modelos recáe en la manera en que se sigue la divergencia natural del haz de radiación, en el número de hojas y en el grosor efectivo de las hojas en el plano del isocentro. Estas características son independientes y su configuración está determinada por el sitio en que se encuentra la patología a tratar. El MLC permite grandes aperturas, así como también el uso de diferentes técnicas de tratamiento, desde las conformales estáticas hasta la IMRT. El mMLC está diseñado para su uso en blancos pequeños y de formas irregulares, generalmente para lesiones intracraniales. Actualmente se pueden encontrar linacs dedicados al tratamiento de lesiones del sistema nervioso central. Estas máquinas tienen un dispositivo de colimación que está colocado de forma permanente a la salida de cabezal. El sistema de colimación con el que cuentan es del tipo mMLC, cuyas dimensiones son seleccionadas para conseguir un alto grado de confomación en lesiones pequeñas típicamente de localización intracranial. Uno de los equipos dedicados es el linac Novalis de 6 MV, fabricado por Varian Medical Systems en colaboración con BrainLAB (Figura 2‐4). 8 Figura 2‐2 Sistema de colimación multihojas. Mientras el haz de radiación incide desde múltiples direcciones, permite conseguir a la salida del haz una forma muy cercana a la de la lesión con la finalidad de conseguir la dosis deseada en el volumen blanco, mientras se proteje el tejido sano circundante. Figura 2‐3 Fotografía de un acelerador lineal Novalis de 6 MV para tratamientos del sistema nervioso central (Instituto Nacional de Neurología y Neurocirugía de la Ciudad de México. 2.3.1 El mMLC de BrainLAB El mMLC fabricado por la marca BrainLab, consiste de 26 pares de hojas fabricadas de tungsteno y controladas por motores de pasos acoplados a una computadora (Figura 2‐4). El arreglo se monta a la salida del haz de radiación para cambiar la colimación del haz en tiempo de tratamiento. 9 El tamaño de campo máximo es de 10.0 cm x 10.2 cm. El ancho de las hojas proyectado en el plano del isocentro (distancia fuente‐eje del isocentro de 100 cm) es de 3 mm para los 14 pares centrales, 4.5 mm para los siguientes 3 pares a cada lado de las primeras y los 6 pares restantes son de 5.5 mm (3 pares/lado). Las caras de las hojas tienen forma curva para minimizar las variaciones debidas a la penumbra respecto a la posición de las hojas. Las hojas se posicionan en el campo designado mediante pequeños motores eléctricos. Cada posición de hoja puede extenderse hasta 5 cm a partir de la linea central del campo y hasta 4.69 cm cruzando la línea de campo. Figura 2‐4 Colimador mMLC. Consiste de 26 pares de hojas controladas por motores de pasos acoplados a una computadora que se monta a la salida del linac. Con esta configuración es posible obtener campos dinámicos que producen altos grados de conformalidad en los volúmenes blanco, así como una reducción en la dosis que recibe el tejido sano. En general, se sabe que el mMLC representa un dispositivo completamente funcional que puede ser programado para colocar sus hojas de manera precisa en cualquier posición dentro del intervalo específico determinado por la apertura máxima de campo. Se ha encontrado que sus características dosimétricas son consistentes con la experiencia obtenida previmente con los MLCs de hojas mas gruesas (Xia et al. 1999, Milan et al. 1974). 2.4 Radiocirugía con acelerador lineal En sentido estricto, la radiocirugía no es una cirugía como la conocemos tradicionalmente, ya que no se realiza incisión alguna en el cuerpo humano. Pudiera ser mejor etiquetar esta metodología como entrega de radiación enfocada estereotácticamente. Los métodos modernos para radiocirugía, sin importar la fuente de radiación que se utilice, en general incluyen las siguientes características: se entrega una dosis de radiación alta (usualmente en una sóla exposición) en el blanco de interés, se consigue un gradiente de dosis tratando de simular una función escalón, y como consecuencia los tejidos circundantes a la región anatómica de interés reciben dosis bajas, en todos los casos, menores a las dosis que 10 radiobiológicamente está demostrado que podrían producir daño permanente. Los métodos estereotácticos se utilizan para identificar la localización del blanco, utilizando además cálculos dosimétricos mediante programas de cómputo y la entrega del tratamiento se realiza con gran precisión mecánica. El sitio en el que se entrega la dosis alta de radiación se denomina volumen blanco de planeación PTV (por sus siglas en inglés Planning Target Volume). Como en radiocirugía la dosis se entrega en una sola sesión, se utilizan técnicas de colimación del haz y de entrega del tratamiento de gran precisión. La técnica de tratamiento es normalmente isocéntrica, haciendo uso de arcos o campos conformados estáticos múltiples. 2.4.1 Modalidades de tratamiento En radiocirugía/radioterapia, los blancos de tratamiento son en general de forma irregular y representan un reto muy especial para el uso de tratamientos con un isocentro, en especial cuando se hace uso de campos circulares generados con colimadores cilíndricos, incluso con colimadores de varios diámetros. Se sabe que la toxicidad en tejido se incrementa cuando los niveles de dosis empleados aumentan y con el volumen de tejido irradiado. Desde hace poco mas de una década se utilizan tratamientos con colimación esférica a partir de isocentros múltiples, lo que ha permitido conformar blancos relativamente grandes a costa de incrementar el tiempo de tratamiento y la inhomogeneidad en la dosis, lo que puede incrementar, la toxicidad no deseada en tejido sano (Shiu et al. 1997). Existen varias modalidades de tratamiento utilizando el linac: arcos circulares no coplanares, haces conformados, arcos conformados e IMRT. 2.4.2 Arcos circulares Esta modalidad se realiza utilizando colimadores de tipo cónico, con los que se proyecta en la superficie de irradiación un haz circular. Con esto podemos conseguir distribuciones de dosis aproximadamente esféricas. Estos colimadores son accesorios al linac y se colocan externamente acoplándose a la salida del cabezal. Se pueden utilizar diferentes diámetros de colimación, desde 3 mm hasta 20 mm definidos en el plano del isocentro. 2.4.3 Haces conformados Para esta técnica de tratamiento se usan haces estáticos confomados a partir de múltiples direcciones de incidencia. Se utiliza la colimación del haz provista por un MLC. Las láminas del colimador se colocan al borde de la lesión determinada para un plano específico de incidencia y se busca conseguir la forma mas cercana de la frontera del blanco, limitado por las dimensiones físicas del MLC. 11 2.4.4 Arcos conformados En esta técnica de tratamiento se utiliza el MLC para cambiar la forma de la proyección del blanco conforme se describe el arco definido, abarcando desde un ángulo inicial hasta otro final, siempre irradiando mientras rota el cabezal. 2.4.5 Intensidad Modulada (IMRT) La radioterapia con intensidad modulada es una técnica de tratamiento en la que se utiliza un sistema de cálculo y planeación conocida como planeación inversa, esto es, el algoritmo de cálculo toma como condición a la entrada la dostribución de dosis esperada y el cálculo arroja como resultado el movimiento que tendrán que realizar las hojas en tiempo de irradiación para conseguir una fluencia del haz de radiación variable y tratando de conseguir las metas planteadas inicialmente. Estas metas estan relacionadas con los objetivos terapéuticos: dosis al blanco y protección al tejido normal. Las hojas del MLC se mueven de forma continua modificando la intensidad del haz a lo largo del campo de radiación mientras el haz se encuentra activo en múltiples posiciones estáticas del cabezal. 2.5 Sistemas de detección y medida de la dosis 2.5.1 Cámara de ionización de dedal El principio bajo el que funciona una cámara de ionización de dedal se ilustra en la Figura 2‐5, en la que se muestra un volumen esférico de aire con una cavidad en su centro. Supongamos que esta esfera de aire se irradia uniformemente con un haz de fotones y que la distancia entre la esfera exterior y la cavidad interior es igual al alcance máximo de los electrones generados en aire. Si el número de electrones que ingresan a la cavidad es el mismo de los que salen de ella, se dice que existe equilibrio electrónico. Supongamos también que somos capaces de medir la carga por ionización que se produce en la cavidad por los electrones que se liberan en el aire que rodea a la cavidad. Entonces, al conocer el volumen o la masa del aire dentro de ella, podremos calcular la carga por unidad de masa o la exposición en el centro de ella. Ahora, si la pared de aire se comprimiera en una cubierta sólida (Figura 2‐5‐ B), obtenemos una cámara de ionización de dedal. Aunque la pared de esta cámara es sólida, es también aire equivalente, es decir, su número atómico efectivo es el mismo que aquel del aire. Además, el grosor de esta pared es tal que ocurre el equilibrio electrónico dentro de la cavidad a la que rodea, como se describió antes, así que el grosor debe también ser igual o mayor que el alcance máximo de los electrones liberados en la pared. 12 Figura 2‐5Diagrama que ilustra los fundamentos de una cámara de ionización de dedal. A) Cavidad de aire con frontera de aire. B) Cubierta de aire sólida con cavidad de aire en su interior. C) Cámara de ionización de dedal. Una cámara de dedal se construye con pared de aproximadamente 1 mm o menor y se complementa con un capuchón que rodea a la pared de Plexiglas o algún plástico para alcanzar el grosor necesario para el equilibrio electrónico para el haz de radiación en cuestión. La pared de estas cámaras tiene forma de dedal (de donde viene el nombre). La superficie interna se recubre con un material especial para hacerla conductora electricamente. Con esto se forma un electrodo. El otro electrodo es una barra de material de número atómico bajo tal como grafito o aluminio que se coloca en el centro del volumen interno a la pared pero electricamente aislado de ella. Se aplica una diferencia de potencial adecuada entre ambos electrodos para colectar los iones producidos en la cavidad de aire. La mayor parte de la ionización producida en la cavidad de aire proviene de los electrones que se liberan en la pared (Figura 2‐5‐C). Una cámara de ionización se puede utilizar para medir directamente la exposición si fuera equivalente a aire, si el volumen de su cavidad se conociera con precisión y si el grosor de su pared fuera suficiente para proveer equilibrio electrónico. Bajo estas condiciones, la exposición X está dada por: Ec. 2‐1 X = (Q/ρ.ν)(1/A), donde Q es la carga liberada en la cavidad de aire de densidad ρ y volumen ν; A es la fracción de la fluencia de energía que se transmite a través de la pared aire‐equivalente y 13 grosor de equilibrio. El valor de A es ligeramente menor que 1.00 y se utiliza para calcular la exposición debida a una fluencia de enrgía que existiría en el punto de medida en ausencia de la cámara. Respuesta de la cámara Aunque se requiere un grosor adecuado para conseguir el equilibrio electrónico, la pared produce algo de atenuación del haz de fotones (Figura 2‐6). Cuando el grosor de la pared es mucho menor que el requirido para el equilibrio o ionización máxima, se generan muy pocos electrones en ella y entonces la respuesta de la cámara es baja. Si el grosor excede lo necesario para el equilibrio, la respuesta de la cámara de nuevo se ve reducida debido a la atenuación del haz en la propia pared. La exposición real (sin atenuación) se puede obtener mediante la extrapolación lineal de la curva de atenuación mas alla del máximo hacia grosor cero. Grosor de la pared (cm) Figura 2‐6 Esquema del efecto del grosor de la pared en la respuesta de la cámara. Si la respuesta de la cámara se normaliza a la lectura máxima, entonces, el valor extrapolado para grosor de pared cero nos da el valor del factor de corrección 1/A que se usa en la ecuación anterior. Este valor de corrección es inherente en el factor de corrección que se obtiene cuando la cámara ionización se compara con cámaras de ionización de aire libre en laboratorios estandarizados. Así, cuando el factor de calibración se aplica a la lectura de la cámara (corregida por cambios en temperatura y presión en la cavidad de aire), éste convierte el valor en exposición real en aire libre (como en ausencia de la cámara). Entonces el valor de exposición obtenido está libre de atenuación en la pared o de perturbaciones por influencia de la presencia de la cámara. La cámara de ionización se conecta a un electrómetro para obtener la medida de la carga generada en la cavidad. El electrómetro se conecta al electrodo central de la cámara mediate un cable de soporte. 14 2.5.1.1 Recolección de iones La carga generada en la cámara de ionización se ve afectada por condiciones ambientales y de funcionamiento de la cámara misma. Corriente de iones en la cámara Conforme la diferencia de potencial aplicada a los electrodos se incrementa, la corriente por ionización también lo hace, al principio casi de forma lineal y después mas lentamente. Finalmente la curva voltaje aplicado vs. corriente generada alcanza un valor de saturación para una tasa de exposición dada (Figura 2‐7). El incremento inicial de la corriente con el voltaje es causada por la recolección de iones incompleta a voltajes bajos. La cámara entonces debiera ser utilizada en la región de saturación de tal forma que cambios pequeños que se pudieran presentar en el voltaje no influyan en el resultado de la lectura de la corriente. Voltaje en la cámara Figura 2‐7 Esquema de saturación de una cámara de ionización. Por otro lado, la lectura en la colección de iones también se puede ver afectada por los efectos de polaridad en la cámara. Algunas veces se presenta que para una exposición dada, la carga iónica colectada por una cámara cambia su magnitud conforme la polaridad de los voltajes se invierte. Con una cámara de ionización que funciona en condiciones de saturación, algunas de las razones mas importantes por las que el cambio en la polaridad afecta la lectura son: A. Los electrones de alta energía como los generados por efecto Compton debidos a fotones de alta energía, generan una corriente independiente del gas de ionización. Esto puede abonar o reducir la corriente colectada, dependiendo de la polaridad en los electrodos. Un valor real de la ionización se puede obtener mediante la lectura promedio de las corrientes obtenidas con la inversión de la polaridad. B. La corriente extracámara que se genera cuando se colectan electrones generados fuera del volumen sensible de la cavidad. Esta corriente se puede generar por la 15 irradiación del cable conector entre la cámara y el electrómetro. Estos errores en la lectura pueden ser minimizados mas no eliminados por completo, al tomar lecturas promedio por ambas polaridades de funcinamiento en la cámara de ionización. Las condiciones ambientales también influyen en la lectura de la corriente, una vez que la densidad del aire depende de la temperatura y presión del ambiente. Los laboratorios de referencia calibran las cámaras de ionización bajo condiciones estándar de presión y temperatura (760 mm Hg y 22ºC). Si las medidas de la ionización se realizan en condiciones que no son las de referencia, la corrección por condiciones atmosféricas se tiene que considerar. 2.5.1.2 Medida de la exposición La exposición en unidades de roentgen se puede medir de manera absoluta con una cámara de ionización contando con un factor de calibración para la exposición Nc que sea trazable al National Institute of Standards and Technology para una calidad de haz de radiación específica. Si suponemos que se obtiene una lectura M para una exposición dada, ésta se puede convertir a roentgens como: Ec. 2‐2 X=M⋅Nc⋅C, donde C es el factor de corrección por condiciones ambientales y de funcionamiento de la cámara de ionización. 2.5.1.3 Medida de la Dosis Existen protocolos internacionales (Almond et al. 1999) para realizar la dosimetría clínica en condiciones de referencia para haces externos de radiación utilizando haces de fotones con energías nominales desde la de haces de 60Co hasta 50 MV. La mayoría de ellos utilizan las lecturas obtenidas con las cámaras de ionización con factores de calibración de dosis absorbida a agua (ND,w,60Co), mismos que son trazables a laboratorios primarios. La ecuación mediante la que se puede obtener el valor absoluto de dosis absorbida en agua es: Dw,Q = M⋅kq⋅ND,w,60Co, donde Q es la calidad del haz de interés, Dw,Q es la dosis absorbida en agua en el punto de medida en el que se coloque la cámara de ionización bajo condiciones de referencia, M es la lectura de la cámara de ionización corregida por todos los factores necesarios discutidos antes y kq es el factor de conversión por la calidad del haz. 2.5.2 Película Radiográfica Las películas radiográficas basadas en emulsiones de halogenuro de plata (AgH) se usan ámpliamente para dosimetría relativa de haces de tratamiento con radiación externa en el intervalo de energía de megavoltaje. Estas películas proveen registro permanente de distribuciones de dosis espaciales integradas (Pai et al. 2007). 16 En años recientes, la dosimetría fílmica se ha convertido en una herramienta indispensable para verificar distribuciones de dosis en tratamientos con radiación utilizando técnicas modernas como lo son Radioterapia con Intensidad Modulada (IMRT) y radiocirugía estereotáctica. La naturaleza bidimensional de las películas, ofrece la opción de selección de la orientación de la película relativa a la distribución de dosis y, dado que es un dosímetro integrador, ayuda en la medida de distribuciones de dosis entregadas de manera dinámica. La dosimetría fílmica ofrece un método rápido y apropiado para obtener distribuciones de dosis bidimensionales a partir de las que se pueden extraer conjuntos de curvas de isodosis en el plano de la película. La independencia de la energía de algunos tipos de película se puede explicar por el hecho de que la razón de poderes de frenado por colisión en la emulsión y en el agua varía lentamente con la energía de los electrones, sin embargo, su aplicación para dosimetría de haces de fotones de megavoltaje es mas complejo. Esto es resultado del hecho que la sensitividad fílmica varía porque el espectro de energía de los fotones en maniquíes, varía como función del tamaño de campo y de la profundidad. Los datos existentes en relación a la influencia de la geometría de irradiación en la curva sensitométrica son contradictorios. Las técnicas de radioterapia modernas como la IMRT y la radioterapia estereotáctica de intensidad modulada, utilizan dosis tiempo‐dependientes y por lo tanto requieren de dosímetros integradores para cuantificar la dosis entregada integrada o total. Los retos principales en el uso de película radiográfica como dosímetro de haces de megavoltaje es la dependencia de la densidad óptica (DO) en: a. La energía del haz de fotones , el tamaño de campo y la profundidad en el maniquí b. El plano de orientación de la película con respecto a la dirección del haz c. Las diferencias en las emulsiones entre las películas de lotes diferentes, del mismo lote o dentro de una misma película d. Las condiciones de procesamiento; y e. Los métodos densitométricos y los artefactos relacionados. La implicación de estos es que la misma DO no siempre se asocia con la misma dosis, haciendo la conversión de DO a dosis potencialmente difícil. 2.5.2.1 Densidad Óptica El valor de opacidad de una película se cuantifica a través del factor de transmisión T, y se mide mediante una cantidad llamada densidad óptica DO. La DO es un valor que describe el ennegrecimiento de una película y se mide con un densitómetro: 17 Ec. 2‐3 DO = ‐log10(T) = log(I0/I), donde I0 es la intensidad de luz incidente en ausencia de película e I es la intensidad transmitida perpendicularmente al plano de la película y a través de ella. Si α es el área promedio (cm2/grano) de un grano de plata revelado y si existen n granos revelados granos/cm2 de la película, entonces podemos escribir a T como T = e‐αn, así: Ec. 2‐4 DO = ‐log10(e‐αn) = 0.4343αn, Es difícil saber el número de electrones que se necesitan para revelar un grano. Sin embargo, si asumimos que un solo electrón es responsable de revelar un grano, entonces podemos correlacionar la fluencia de electrones φ, que pasa perpendicular a la película, con la densidad óptica. Si N es el número de granos de bromuro de plata por unidad de área de una película no expuesta, entonces n y la DO se pueden escribir como: Ec. 2‐5 n = αNφ 2 Ec. 2‐6 DO = 0.4343α Nφ Como la DO es proporcional al número de granos de plata por unidad de área y a la fluencia de fotones, y dado que la fluencia de fotones y de electrones esta relacionada directamente con la dosis de radiación, la densidad óptica debiera ser una función de la dosis. La relación entre la dosis y la densidad óptica se conoce como curva sensitométrica. 2.5.2.2 Curvas características Hurter y Driffield introdujeron la curva sensitométrica en 1890, a la que ahora se le refiere como curva H&D (Pai et al. 2007). La curva H&D es la curva de respuesta de la película de una en la que log(exposición) se grafica en el eje X y la DO en el eje Y. Las curvas H&D son importantes para cuantificar contraste y rango dinámico de una película radiográfica. Las características de la respuesta de la película puede graficarse de varias formas como son: dosis vs. DO, log(dosis) vs. DO o log(dosis) vs. log(DO). En radioterapia, la representación mas usada es la de dosis vs. DO, referida como curva sensitométrica. La DO es una función de varios parámetros: DO=f(D,RD,R,γ,d,TC,θ,τ) donde D es la dosis de radiación, RD es la rapidez de dosis, E es la energía, γ es el tipo de radiación primaria (rayos‐X, electrones, etc.), d es la profundidad de medida, TC es el tamaño de campo, θ es la orientación relativa de la película (paralela o perpendicular al haz de radiación) y τ se refiere a las condiciones del procesador/revelador (tiempo de revelado, concentración del revelador, etc.). La curva sensitométrica en radioterapia refleja las características de una película. Típicamente tiene tres secciones: talón, gradiente y hombro. La respuesta de todas las películas a la radiación se debe principalmente a su tamaño de cristal y las variaciones son significativas. 18 2.5.2.3 Medida de dosis relativa y absoluta La curva sensitométrica debe establecerse para una energía específica, un lote de películas, tipo de película, orientación y condiciones de procesamiento bajo las que la película será usada. Si uno opera en la región donde la DO tiene una relación lineal con la dosis y se aplica una calibración válida, entonces, se puede obtener una dosimetría relativa precisa. Si se requiere valores de dosis absoluta, entonces debemos establecer la relación de dosis con un valor de pixel o DO. Mediante el procesamiento de un conjunto de datos de una nueva calibración de película al mismo tiempo que se obtienen las películas correspondientes a un experimento, entonces se pueden obtener valores absolutos de dosis precisos. Recientemente, Kodak desarrolló una película radiográfica para utilizarse en radioterapia con rango de dosis amplio, denominada EDR2 (Enhaced Dose Rate v.2). La ventaja que presenta esta película es que tiene un rango lineal de DO mayor, estructura microcristalina mas pequeña, contenido de plata menor y una respuesta, que se extiende a dosis mayores, que pueden ser hasta de 3.5 Gy. Las películas deben exponerse inmersas en material que simule tejido (plásticos agua‐ equivalente). Se recomienda que se coloquen algunos centímetros de material agua‐ equivalente sobre y por debajo de la película que será expuesta. Si la película se utilizará contenida en su sobre protector y el maniquí en contacto con ella debe presionarse para que se remuevan las bolsas de aire. 2.6 Algoritmos de cálculo de la dosis Como en radiocirugía se tratan campos de dimensiones pequeñas (extensiones lineales máximas del PTV ≤ 3.5 cm) y con un número de campos mayor, es apropiado simplificar los cálculos de dosis en relación con los cálculos que se requieren para campos de tratmientos grandes, no‐isocéntricos que comunmente se emplean en radioterapia convencional. En general, la suposición principal de los modelos clásicos para el cálculo de dosis utilizando estereotaxia es que los fotones secundarios dispersados se pueden considerar de significacia limitada. Algunos autores han propuesto e investigado esta hipótesis (Rice et al. 1987, Luxton et al. 1991) y los cálculos de dosis han tenido la tendencia a ser una función de tres parámetros básicos: razones máximas de tejido, factores de salida relativos y perfiles de los haces. La contribución por fotones dispersados (en particular en tejido) se considera implícita a estas medidas, y no varía significativamente con la profundidad en el medio, mientras éste sea homogéneo. Así, los algoritmos clásicos utilizan equivalencias de tejido en profundidad y razones de tejido‐aire, incorporando una corrección unidimensional donde la densidad a lo largo de la trayectoria a partir de la 19 fuente hasta el punto de cálculo es utilizada para corregir la dosis absorbida por el efecto de la heterogeneidad (Milan y Bentley 1974). Estos métodos incluyen la razón tejido‐aire y la ley de potencias de Batho (Sontag y Cunningham 1977). Posteriormente se utilizaron métodos de corrección por heterogeneidad bidimensionales, en los que se utilizaban correcciones por dispersión semi‐empíricas. Tales métodos incluían la equivalencia tejido‐ aire y el método de convolución de la transformada rápida de Fourier, en los que la corrección por dispersión se incluye a través de una aproximación lineal (Boyer y Monk 1985, Boyer y Monk 1986, Boyer et al. 1988, Martel et al. 1992). La precisión que proveen los algoritmos de corrección antes mencionados en el cálculo de dosis, padecían de limitantes al modelar las componentes de dosis asociadas a la radiación dispersa. Inspirado por esta limitante, emerge una nueva generación de métodos de corrección en los que explícitamente se realiza el trazado de los rayos para la dispersión en tres dimensiones. Estos métodos son los de la razón diferencial de aire‐dispersión propuesto por Cunningham (Cunnigham, 1972) e implementado mas tarde por Larson y Prasad (Larson y Prasad 1978). Por otro lado, encontramos el método del volumen delta de Wong y Henkelman (Wong y Henkelman 1983), el arreglo de depósito de dosis propuesto por Mackie y colaboradores (Mackie et al. 1985) y por último el algoritmo de haz de lápiz diferencial por Mohan y colaboradores (Mohan et al. 1986). En este método semianalítico los efectos por heterogeneidad son considerados directamente por el modelo y se convierte en inherente al cálculo. Parte de la suposición es que se cuenta con un modelo del depósito de energía a partir del sitio de interacción de un fotón primario en agua. Esta distribución también se conoce como el kernel de dosis por dispersión. El kernel se ajusta para incluir los efectos de la heterogeneidad en la densidad aplicando el Teorema de O’Connor de escalamiento de dosis (O'Connor 1957), suponiendo que no hay cambios en la composición atómica del paciente sino que solamente cambios en la densidad. 2.6.1 Algoritmo de haz de lápiz diferencial Un “pencil beam” o haz de lápiz deferencial (DPB) se define como la distribución de dosis relativa a la posición de la primera colisión, por unidad de densidad de colisión, para un haz de lápiz de fotones delgado en un medio homogéneo infinito de densidad unitaria (Mohan et al. 1986). Un haz de lápiz que incide sobre la superficie de un maniquí homogéneo da lugar a una distribución de dosis en él. El número de colisiones primarias por unidad de volumen que se llevan a cabo en el punto Q a lo largo del haz se puede escribir como: ΦQ(E) x µ(E) x exp [‐µ(E)tQ], 20 Ec. 2‐7 donde ΦQ(E) es la fluencia en Q de la energía de los fotones incidentes de energía E, µ es el coeficiente lineal de atenuación y tQ es la profundidad a lo largo del haz de lápiz. La dosis en el punto P se calcula como: Ec. 2‐8 DP=∫ ΦQ(E) x µ(E) x exp [‐µ(E)tQ] x DPB(rPQ,θ,E) x dtQ, donde DPB(rPQ,θ,E) es la distribución de dosis como función de la energía de los fotones y de la posición del punto de interés relativo al punto de colisión; para una distribución que corresponde a un haz monoenergético que incide en un maniquí semi‐infinito de densidad unitaria está dado por la integral de los haces diferenciales con su intensidad atenuada apropiadamente, y donde rPQ es la distancia entre el punto de interés P y el punto donde ocurren las colisiones primarias Q. 2.6.2 Métodos Monte Carlo Una de las tareas más importantes en radioterapia es determinar las distribuciones de la dosis absorbida en medios de interés (pacientes y maniquíes). Las técnicas de cálculo utilizando métodos Monte Carlo (MC) han demostrado ser la manera más exacta de hacer esto. Estas técnicas han desempeñado un papel importante en la dosimetría de la radiación (Rogers, 2006), incluso permiten estimar la dosis en las regiones donde realizar medidas con los sistemas de detección convencionales son inadecuadas, por ejemplo en la región de incremento. Estos algoritmos son considerados como el punto de referencia de los cálculos teóricos para determinar el depósito de dosis. La metología Monte Carlo es capaz de entregar el valor de dosis absorbida directamente, eliminando así la necesidad de convertir la ionización a dosis. Esto es particularmente útil e importante en regiones donde no existe el equilibrio electrónico de partícula cargada y por lo tanto los factores de conversión no son válidos. Mas aún, el “detector” siempre está hecho del mismo material que el medio, no tiene paredes y puede definirse tan pequeño como estadísticamente sea posible. Además, como los cálculos Monte Carlo pueden incorporar todas las interacciones físicas relevantes, son ideales para comparar otros modelos de cálculo, así como medidas obtenidas experimentalemente. Utilizando esta metodología es posible separar los fenómenos físicos de los factore geométricos (sistema de colimación, fuente de tamaño finito, etc.) y deteminar la robustez física de los principios fundamentales del modelo. Simular los experimentos en geometrías complicadas utilizando la metología Monte Carlo puede consumir cantidades importantes de tiempo, una vez que al ejectuar el transporte de radiación se consideran todos los fenómenos físicos presentes partícula por partícula. Los fotones tienen un número limitado de interacciones antes de ser absorbidos; esto hace posible simular todas las interacciones de manera directa. Por otro lado, en el 21 transporte de electrones, el número de interacciones Coulombianas con los núcleos atómicos es tan grande que la simulación directa es impráctica. Esto ha motivado el desarrollo de lo que se conoce como técnicas de historia condensada en las que diferentes interacciones microscópicas se clasifican en grupos para proveer de una representación macroscópica detallada del transporte de las partículas. Las técnicas condensadas suponen que el medio es homogéneo localmente, lo que hace no trivial el estudio de los efectos de las interfases en detalle. La implementación de estas técnicas se puede hacer usando diferentes aproximaciones (Kawrakow y Bielajew 1998, Bielajew y Rogers 1987) convenientes para el cálculo de dosis. 2.7 Ensayos in vivo/in vitro Los estudios radiobiológicos utilizan un amplio rango de tumores experimentales de diferentes tipos histopatológicos se han desarrollado para estudios radiobiológicos. Para producir un gran número de tumores virtualmente idénticos, se usa la propagación por transplantación a partir de una generación de animales a la siguiente. En la práctica, se utilizan cepas puras de ratas o ratones para mantener la variabilidad asociada al cambio de animales al mínimo. A partir de un animal donador, el tumor se remueve en condiciones de asepsia y se prepara en una suspensión celular. Para efectuar un transplante, se inoculan de forma subcutanea 104 a 106 células en cada uno de los animales receptores. El sitio del transplante puede variar, aunque lo mas frecuente es usar la región posterior en la pata trasera del animal; en algunas ocasiones se implantan los tumores en el cerebro. En semanas o días, dependiendo del tipo celular que se haya empleado y del animal receptor, tumores de tamaño palpable comienzan a aparecer. De esta manera se pueden utilizar decenas de animales, de tal forma que sea posible diseñar estudios cuantitativos y estudiar, por ejemplo, la respuesta tumoral a diferentes esquemas y dosis de radiación, bajo tratamientos sólo con radiación o combinados con agentes quimoterapéuticos o radiosensibilizadores. Un número limitado de líneas celulares se ha adaptado para esayos in vivo/in vitro de tal forma que sean transplantables como un tumor en un animal o como células clonogénicas (viables para su replicación y formación de colonias) en un frasco de cultivo. Estas células pueden ser transferidas fácilmente de ensayos in vivo a in vitro o viceversa (Figura 2‐8). En una generación pueden crecer como un tumor sólido en un animal y en la siguiente como una monocapa en una caja de Petri. Después del tratamiento cada tumor es removido y preparado en una suspensión celular, se cuantifica la concentración celular. Posteriormente, se pude transferir un número 22 conocido de células a un cultivo celular que contenga medio de cultivo fresco que facilite el crecimiento de las células, así será posible contabilizar la porción de células que presentan viabilidad para la replicación. De esta forma se pueden construir las curvas de sobrevida celular. Figura 2‐8 Principio de ensayos in vivo/in vitro utilizando un tumor de rata. El tumor sólido se remueve del animal y las células de él en suspensión son luego transferidas al ensayo para la formación de colonias en cajas de cultivo celular, tomada de (Hall & Giaccia, 2006). Tanto los modelos animales como los estudios in vitro han sido un instrumento en la búsqueda de los procesos bioquímicos y fisiológicos del cáncer y de la propagación de organismos vivos. De manera mas importante, han sido una vía para evaluar diagnósticos nuevos y fármacos terapéuticos que eventualmente podrían ser utilizados en la salud humana. De hecho, actualmente encontramos que el estudio de los efectos de los fármacos y terapias en experimentación es un pre‐requisito para proponer estudios clínicos en pacientes. Los estudios in vitro y en animales, pueden proveer información farmacológica y toxicológica; además pueden predecir la eficiencia clínica de nuevos farmacos, así como terapias combinadas, por ejemplo, compuestos nuevos con radiación ionizante y/o cirugía. Los estudios in vitro se utilizan en una etapa inicial, una vez que son mas baratos, relativamente fácil de producir y manejar; además, es posible mantener un control riguroso de las condiciones bajo las que se realizan los experimentos, lo que nos permite alcanzar un grado de reproducibilidad y sistematicidad importante, sin olvidar la variabilidad intrínseca a la línea celular que se utilice. Estos estudios pueden ser de gran valor; los resultados en animales algunas veces no son enteramente aplicables a escala humana dadas las diferencias biológicas inherentes entre 23 las especies. La decisión en la selección de un modelo experimental relevante, así como el diseño, el desarrollo y la evaluación de los experimentos han de ser muy cuidadosos. Por lo que se recomienda conservar un espíritu crítico ante las aplicaciones de los resultados de ensayos pre‐clínicos en el dominio clínico. 2.7.1 La curva de sobrevida in vitro y la relación dosis­respuesta Una curva de sobrevida es una gráfica de la fracción de supervivencia celular vs. la dosis (por radiación, fármacos citotóxicos o algún otro agente que favorezca la muerte celular). La Figura 2‐9 muestra que cuando se grafica en escalas lineales la curva de sobrevida para células irradiadas en un cultivo celular es generalmente una curva sigmoide: tiene un hombro seguido de una curva que se acerca a cero asintóticamente. Para indicar la sensibilidad de las células a la radiación pudieramos extraer la dosis a la que se ha conseguido eliminar al 50% de las células. Otra manera de presentar las curvas de sobrevida es en una escala logarítmica, dos razones son las fundamentales: si la muerte celular es aleatoria, entonces, la sobrevida será una función exponencial de la dosis, y esta será una línea recta en una gráfica semi‐ log y una escala logarítmica nos permite mas fácilmente ver y comparar la sobrevida muy pequeñas, análisis que es necesario para obtener una reducción significativa en el tamaño tumoral o para el control tumoral local. A B Figura 2‐9 Curva de sobrevida para células de gliblasma multiforme humano. A) Muestra que cuando se grafica en escala lineal, la curva presenta forma de sigmoide: tiene un hombro seguido de una curva que se acerca a cero asintóticamente. B) La fracción de sobrevida se grafica en una escala logarítmica vs. la dosis en escala lineal. Las curvas de sobrevida son básicas para entender tanto de la radiobiología como sea posible de lo que está sucediendo conforme se desarrollan los pasos del experimento, en particular, utilizando las líneas celulares en el cultivo. El término eficiencia de pegado indica el porcentaje de las células cultivadas que crecen en colonias. La eficiencia de pegado se define mediante EP=(Número de colonias cuantificadas/Número de células cultivadas)x100. 24 Este proceso se repite para varios valores de dosis y así estimar la sobrevida que se obtiene para un intervalo de dosis de interés clínico. Para clasificar un fenómeno biológico como efecto de la radiación se requiere que este fenómeno no sea visto o sea visto rara vez después de dosis cero y visto en prácticamente todos los casos después de un valor específico (generalmente alto) de dosis. Conforme se incremente la dosis por radiación, en general los efectos se pueden incrementar en severidad (grado) o en frecuencia (incidencia) o ambas. 2.8 Irradiación de modelos pre­clínicos La investigación en animales pequeños y en cultivos celulares permite el estudio detallado de procesos biológicos, de progresión de enfermedades y de la respuesta de los organismos a terapias, con el potencial de proveer un puente natural al ambiente clínico. En particular la terapia con radiación ionizante o radioterapia (RT) ha avanzado enormemente desde la introdución de los aceleradore lineales. Avances tales como las fuentes de radiación rotatorias, colimadores multihojas conformales, la RT y su verificación guiadas por imagen y la radioterapia con intensidad modulada (IMRT) son ahora equipos y técnicas de uso común en los centros modernos de radioterapia. Sin embargo, en los laboratorios, los sistemas análogos para el tratamiento de animales pequeños, así como para experimentación en cultivos celulares, carecen de muchos de estos avances, por lo que el conocimiento de los efectos biológicos de la radiación en estudios de carácter pre‐clínico está retrasado respecto a las aplicaciones clínicas. A lo largo de cuatro décadas, los investigadores han utilizado diferentes técnicas de irradiación para experimentos in vitro, cambiando las fuentes de radiación así como el estado del cultivo celular –frascos de diferente geometría, con pozos multiples, para el crecimiento en suspensión o en placa‐. Algunas de las fuentes que han sido usadas mayormente son los isótopos radiactivos 137Cs (Bäckström et al. 1971, Grenman et al. 1988, Yoshida et al. 1994, Badie et al. 1999, Tarnawski et al. 2003, Ning et al. 2004), así como algunas máquinas de kilovoltaje (Bäckström et al. 1971, Garret et al. 1998, Shibamoto et al. 2004). Las técnicas de irradiación que describen estos autores son relativamente sencillas de implementar dada la energía baja de las fuentes utilizadas ya que los ensayos requerían campos de radiación homogéneos. Mas recientemente, los aceleradores lineales para producir rayos X de alta energía estan siendo utilizados principalmente para estudiar los efectos de la irradación con IMRT en cultivos celulares, es decir, además de emplearse en la aplicación clínica, estan siendo utilizados en investigación pre‐clínica (Sterzing et al. 2005, Suchowerska et al. 2005, Bromley et al. 2006, Moiseenko et al. 2007, Mackonis et al. 2007, Bromley et al. 2009, Butterworth et al. 2010). 25 Cuando se utilizan haces de mayor energía se presenta el problema de alcanzar el equilibrio electrónico de partícula cargada en la región de interés que, para el caso de energías mayores, se encuentra a mayor profundidad. 2.8.1 Equilibrio de partícula cargada en la irradiación de cultivos celulares Muchas de las veces los reportes mencionados muestran que se ha realizado un gran esfuerzo por parte de los autores para alcanzar las condiciones de equilibrio electrónico en los cultivos celulares con el objetivo de poder asignar valores de dosis precisos a sus ensayos. Cuando nos referimos al uso de energías de 6 MeV o mayores, tales esfuerzos son todavía mas importantes, una vez que la profundidad a la que se ha de colocar la región de interés se puede extender a mas 1.5 cm en agua. En la región de incremento (donde el equilibrio electrónico no se consigue) el cociente del poder de frenado restringido promedio, así como los factores de perturbación en las cavidades de las cámaras de ionización (fluencia, factores de pared y electrodo central) cambian significativamente con la profundidad; como consecuencia, las medidas llevadas a cabo en esta región (así como en las zonas de transición de medios) exhiben una sobre‐ respuesta en la cámara de ionización provocada por estas perturbaciones (Nilson y Montelius 1986). En los casos en que realizar las medidas con estos sistemas de detección es inadecuado, las técnicas de simulación usando métodos Monte Carlo son consideradas como la forma más precisa para determinar la dosis absorbida (Rogers, 2006) y han sido usadas como el estándar en la validación de medidas dosimétricas de la radiación en el medio, como se muestra en algunos protocolos internacionales de medida de la dosis (Almond et al. 1999, IAEA 1987). Aunque se han presentado discusiones importantes en relación con las discrepancias entre cálculos Monte Carlo y medidas en la región de incremento, estas aparecen principalmente para irradiaciones con haces de energía mayor a 6 MeV (Ding, 2002). Para el caso particular del uso de un haz de rayos X de 6 MeV, como el que utilizaremos en este trabajo, Abdel‐Rahman y colaboradores (Abdel-Rahman et al. 2005) han investigado exhaustivamente estas diferencias y han tenido éxito al explicarlas mediante simulaciones Monte Carlo. 26 3 Dosimetría, cálculos Monte Carlo e irradiación de cultivos celulares 3.1 Dosimetría: Cálculos Monte Carlo y Medidas Para poder simular tratamientos con aplicaciones clínicas y/o pre‐clínicas en RT, es necesario incluir todas las características del sistema físico en el que se aplicará el tratamiento, es decir, necesitamos caracterizar tanto el haz de radiación (espectro de energía, fluencia de fotones, contaminación por electrones, etc.) con que se entregará el tratamiento como el medio en el que se requiere el transporte. Es por ello que en este proyecto primero fue necesario validar la simulación efectuada mediante métodos MC de la fuente de radiación que utilizamos para realizar nuestros experimentos. Esta validación se realiza por medio de medidas experimentales de distribuciones de dosis, comparadas en términos de porcentajes de dosis depositada en profundidad y perfiles fuera del eje central. Para las medidas relativas de dosis en los planos de interés utilizamos película radiográfica y para obtener las medidas de dosis absoluta en puntos de referencia empleamos una cámara de ionización. Con esto, obtenemos las medidas directamente de los instrumentos antes mencionados y los resultados de las simulaciones mediante métodos MC al reproducir las condiciones bajo las que se realizaron las medidas, para después compararlos y decidir si los resultados de la simulación reproducen las medidas. Estas medidas nos permiten verificar si el desempeño de las simulaciones es correcto; por lo que primero, la evaluación se lleva a cabo en medios homogéneos para después modificar el sistema e incluir en él las características de las condiciones experimentales reales, que en nuestro caso son, la incidencia perpendicular del haz sobre un frasco de cultivo colocado sobre un bloque de medio dispersor. Para la simulación del haz de fotones que emerge del linac utilizamos el código para el transporte de radiación en materia BEAMnrc. La energía del haz de fotones incidente en el blanco para generar la radiación de frenado y su radio de dispersión se ajustaron para producir el mejor acuerdo entre distribuciones de dosis medidas y calculadas. Tanto las curvas de depósito de dosis en profundidad como las razones fuera del eje central a diferentes profundidades en agua se obtuvieron con el código de usuario DOSXYZnrc. La energía cinética inicial del haz de electrones incidiendo en el blanco se fijó en 6.1 MeV con una intensidad de distribución gaussiana de 1.2 mm y un valor de FWHM = 10%. Las partículas que salen del blanco se transportaron a través de la línea de componentes del acelerador lineal: colimadores primarios, filtro de aplanado y cámara de ionización. La energía, posición y dirección, carga y peso de las partículas generadas se registró en un espacio fase. 27 El espacio fase archivado se utilizó como información de entrada en el transporte con el código de usuario DOSXYZnrc para calcular la distribución de dosis, primero en un maniquí homogéneo y en segundo lugar en el modelo para la irradiación del cultivo celular. Estas partículas fueron transportadas a través de las quijadas que definen el tamaño de campo seleccionado para el experimento. La energía de corte para los electrones y fotones se fijó en 0.01 MeV. Los cálculos se ejecutan con un número de historias para alcanzar una incertidumbre estadística menor al 1 % en la dosis. Las simulaciones Monte Carlo se realizaron para un haz de fotones de 6 MV para un acelerador lineal de uso clínico dedicado al tratamiento del sistema nervioso central Novalis (BrainLAB, Heimstetten, Alemania), equipado con un mMLC de BrainLAB, que se encuentra en el Instituto Nacional de Neurología y Neurocirugía de la Ciudad de México. El tamaño de campo seleccionado fue de 9.8 cm x 9.8 cm definidos a 100 cm de la fuente, incidente en un maniquí de agua de 30 cm x 30 cm x 30 cm; y en la segunda simulación, incidente en la superficie del medio de cultivo en el sistema de irradiación del cultivo celular. El plano de registro del espacio fase se colocó a 2 cm sobre la superficie del medio de cultivo. El maniquí se definió rodeado por aire. Todos los materiales se seleccionaron de acuerdo con los datos del ICRU‐700. La dosis se calculó en voxeles de 1 mm x 1 mm x 1 mm a partir de la superficie y hasta 2 cm de profundidad, de 1 mm x 1 mm x 5 mm en el intervalo de 2 cm a 5 cm y, finalmente, de 1 mm x 1 mm x 10 mm de 5 cm a 14 cm. Las medidas experimentales puntuales se obtuvieron utilizando un sistema controlado por computadora PTW‐Freiburg MPE Therapy Beam Analyzer para medir distribuciones de dosis con una cámara de ionización a prueba de agua de 0.015cm3 PTW‐PinPoint. El sistema de irradiación para calcular la dosis absorbida en el cultivo celular consiste de un frasco de cultivo para proliferación en placa, con una superficie del crecimiento de 25 cm2 colocado sobre un bloque de PMMA (dimensiones 20 cm x 20 cm x 15.5 cm) (Figura 3‐1‐A). Cinco mililitros de medio de cultivo celular (densidad electrónica equivalente del agua) serán agregados al frasco. El volumen del medio de cultivo utilizado forma una capa con ancho de 3.0 mm sobre el fondo del frasco. El plano de referencia superficial se definió sobre la superficie del medio de cultivo. 28 2 Figura 3‐1 Arreglo experimental: Irradiación de un monocapa celular en un frasco de cultivo de 25 cm con un campo abierto de 9.8 cm x 9.8 cm. El cultivo celular se encuentra en el fondo del frasco. A) Reproducción esquemática de la irradiación. El frasco se coloca directamente sobre placas de plástico, localizándose el fondo del frasco al nivel del isocentro. El centro del orificio para introducir la cámara de ionización se encuentra a 5.5 cm de profundidad, medidos desde la superficie del plástico. B) Fotografía del montaje del arreglo experimental descrito antes. La irradiación cubre homogéneamente toda la superficie de crecimiento celular. 3.1.1 Medio Homogéneo Las medidas de dosis en agua corresponden a un tamaño de campo de irradiación de 9.8 cm x 9.8 cm con incidencia normal sobre el medio para el transporte de radiación con dimensiones de 30 cm x 30 cm x 30 cm. Los resultados de las simulaciones se validan en comparación contra las medidas de dosis en profundidad y razones fuera del eje central. 3.1.2 Arreglo experimental In vitro La configuración para la irradiación es la misma que para la simulación (Figura 3‐1‐B). La cámara de ionización se posiciona dentro de un maniquí de plástico (hecho de bloques de PMMA) colocada bajo el eje central del haz a través de un orificio cilíndrico en una de las placas plástico de dimensiones ajustadas para que se pudiera introducir el dispositivo. Se mide la dosis en el sistema para irradiación del cultivo celular a una profundidad total de referencia igual a 6.1 cm por debajo de la superficie del medio de cultivo celular. Esta medida de referencia se utiliza para escalar la distribución de dosis en profundidad obtenida en la simulación MC del sistema de irradiación del cultivo celular y así se determina la dosis depositada en la superficie de crecimiento de la línea celular. Todas las irradiaciones se realizan con una tasa de dosis de 480 UM/min. Las incertidumbres para nuestras medidas de dosis en profundidad se estiman multiplicando el valor de la dosis para una profundidad particular z como la raíz cuadrada de la suma de las incertidumbres cuadráticas relativas a las señales dosimétricas en la profundidad de dosis máxima y a la profundidad de interés z. 29 3.2 Calibración de la película radiográfica Con la finalidad de utilizar un sistema de detección que nos permita conocer las distribuciones de dosis que generemos en los cultivos celulares, específicamente para evaluar la homogeneidad en el caso de irradiaciones con campos abiertos y para la evaluación de la generación de campos de intensidad variable en el caso que el interés sean los efectos inducidos por radioterapia de intensidad modulada, es necesario plantear una metodología de calibración de película radiográfica, una vez que el uso de la película radiográfica como un método para la verificación de dosimetría relativa para haces de fotones está completamente estandarizado en el área de radioterapia y constituye una herramienta de relativo bajo costo y fácil empleo (Williamson, 1981; Danciu, 2001). 3.2.1 Calibración utilizando campos separados La metodología de calibración que utilizamos es la que se maneja desde hace un tiempo de manera convencional por múltiples autores en la que se utiliza un tamaño de campo fijo para generar diferentes valores de dosis en la película radiográfica colocada perpendicular a la dirección de incidencia del haz de radiación y a una profundidad mayor a la de depósito de dosis máxima, dentro de un maniquí a una profundidad mayor a la de depósito máximo de dosis para el mareial del material atenuador; los diferentes valores de dosis se obtienen cambiando el tiempo de irradiación manteniendo constante la tasa de dosis en el linac. Utilizamos película radiográfica Kodak EDR2. Toda la película pertenece a la misma caja entregada por el proveedor para minimizar la variabilidad asociada a la manufactura. Irradiamos la película radiográfica con el haz de rayos X de 6 MV antes descrito. Usamos un tamaño de campo de 3 cm x 3 cm de intensidad uniforme. Todas las irradiaciones se realizaron en una pieza de película para minimizar la variabilidad por pliego de película, cada campo irradiado está separado del siguiente por 2 cm de distancia tanto en dirección vertical como en dirección horizontal. Los campos irradiados corresponden a un intervalo de unidades monitor desde 0 (radiación de fondo) hasta 600, en pasos de 20. Colocamos la película a una profundidad 5 cm en un maniquí de agua sólida (30 cm x 30 cm x 15 cm) con una distancia fuente a la superficie del maniquí de 95 cm, debajo del agua sólida colocaremos 10 cm mas de PMMA. Se perfora uno de los extremos del sobre de la película radiográfica y se ejerce un poco de presión sobre ella para remover el aire dentro del sobre. El eje central del haz incide en dirección perpendicular a la superficie del maniquí. El valor de dosis absoluta de referencia se obtiene utilizando una cámara de ionización que se coloca en la posición de la película radiográfica irradiándose 100 UM, con este valor asignamos los valores a los diferentes puntos en el intervalo de dosis seleccionado, una vez que se conoce de la respuesta lineal de la cámara de ionización con las unidades 30 monitor aplicadas para los parámetros de operación seleccionados. La cámara de ionización es de tipo semiflex de 0.135 cm3 (PTW‐Freiburg). Una vez irradiada la película procedemos con el proceso de revelado (incluyendo una película sin irradiar) para su posterior lectura con un densitómetro de punto y así generar la curva sensitométrica, misma que utilizamos para realizar un ajuste y obtener una expresión analítica que modele el comportamiento de esta película radiográfica para las condiciones de nuestro experimento. 3.3 Extrapolación de valores de dosis en la región de incremento con película radiográfica La dosis puede variar considerablemente dentro de los primeros milímetros de profundidad debido a las características de la región de incremento de los rayos X. Como la película radiográfica es una alternativa relativamente barata para realizar estimaciones de dosis en superficies bidimensionales, la podemos emplear para explorar el alcance del empleo de este dosímetro en la región de incremento y así contaremos con una herramienta para evaluar la dosis entregada en los experimentos con los cultivos celulares. Colocamos una serie de películas radiográficas separadas por placas delgadas de material equivalente a agua de grosores 1 mm y 5 mm a partir de la superficie del arreglo experimental, obtenemos una estimación de la dosis en regiones cercanas a la superficie usado el método de extrapolación adecuado para el número de puntos incluidos en el análisis. Luego extrapolamos los valores para diferentes profundidades efectivas de interés en relación con las profunidades en las que serán colocados los cultivos celulares. Comparamos estas medidas con estimaciones obtenidas mediante simulaciones MC de este arreglo experimental. Utilizamos película radiográfica Kodak EDR2. El arreglo experimental para la estimación de dosis en superficie se muestra en la Figura 3‐2. La distancia fuente‐superficie es de 100 cm. En el plano del isocentro se colocó una placa de 1 mm de agua sólida, debajo de ella se encuentra una pieza de película radiográfica, después encontramos otra placa de agua sólida, ahora de 5 mm, seguimos con este proceso con las dimensiones que se especifican en la Figura 3‐2(B). En un segundo experimento para la extrapolación de la dosis en superficie, cambiamos la posición relativa de la película radiográfica y las placas de agua sólida, esto con la finalidad de incrementar el número de medidas a diferentes profundidades en la región de incremento. 31 !" #$$"%&'" #" &" !)*$$"+,-&" ($$"%&'" #!$$"%&'" /" !)*$$"+,-&" !)*$$"+,-&" &!$$"%&'" !)*$$"+,-&" ." .!$$"%&'" Figura 3‐2 Película radiográfica EDR2 colocada entre placas de material equivalente a agua en los primeros milímetros de profundidad para extrapolar valores de dosis en superficie. (A) Arreglo experimental, (B) diagrama representativo de la distribución en profundidad de la película radiográfica. La distribución para el segundo experimento se muestra en la Figura 3‐3 Esquema de las posiciones en profundidad de la película radiográfica para el segundo experimento de extrapolación en superficie. #" &" /" ." !)*$$"+,-&" #$$"%&'" !)*$$"+,-&" #$$"%&'" !)*$$"+,-&" ($$"%&'" !)*$$"+,-&" #!$$"%&'" !" &!$$"%&'" .!$$"%&'" Figura 3‐3 Esquema de las posiciones en profundidad de la película radiográfica para el segundo experimento de extrapolación en superficie. Todas las irradiaciones se hicieron utilizando el haz de rayos X producido por un linac Novalis de 6 MV, con una distancia fuente‐superficie de 100 cm. Previo a los experimentos 32 para la extrapolación de dosis en superficie, la película radiográfica se calibró utilizando la metodología presentada en la sección 3.2. La profundidad relativa medida para el paquete de película radiográfica se tomó como el punto medio de cada paquete colocado entre las placas de agua sólida. El análisis se hizo con un densitómetro de punto de luz visible Victoreen 0010128. Las conversiones de densidad óptica a dosis se hicieron en las películas de este experimento usando los resultados suministrados a partir de la curva de calibración producida en el tamaño de campo apropiado para la irradiación, que en este caso fue de 3 cm x 3 cm. 3.4 Técnica de irradiación In vitro: Irradiación y ensayo clonogénico Utilizamos la línea celular U373MA dado su origen de un glioma humano maligno. Las células de glioblastoma multiforme (GBM) humano U373 se mantendrán a 37ºC en 5% de CO2 bajo condiciones de esterilidad en medio de cultivo Dulbecco (Sigma Chemical Co., St. Louis, MO) complementado con 10% de suero fetal bovino. La curva de sobrevida por exposición a la radiación se genera utilizando un ensayo clonogénico. Las células de GBM U373MA se plantan por triplicado en frascos de cultivo celular para proliferación en placa de 25cm2 con tapadera con filtro. Las células se irradian con dosis únicas de 0 a 14 Gy a temperatura ambiente. El número de células sembradas por frasco se ajusta por dosis absorbida, de tal manera que resulte un número de colonias cuantificable. Todas las irradiaciones se hacen a 100 cm de distancia fuente‐superficie. Después de 12 d de incubación, las células se fijan con metanol y se cuantifican las colonias. Los fondos de los frascos se analizan a través de un microscopio de contraste de fase. 3.4.1 Técnica de irradiación In vitro: Análisis de datos Se calcula la fracción de sobrevida (FS) dada por FS=número de colonias tratadas/número de colonias control. También se estima la dosis media de inactivación representada por el área bajo la curva definida por la FS vs. dosis absorbida. La curva de FS se compara con lo que reportan otros autores, por ejemplo Badie y cols (Badie, 1999) y Ning y cols (Ning, 2004), quienes utilizaron diferentes técnicas de irradiación para líneas celulares de estirpe glial y malignas. 3.5 Irradiación con campos de intensidad modulada en cultivos celulares Para la irradiación con campos de intensidad modulada, utilizamos el colimador micromultihojas descrito en la sección 2.3 para cambiar la intensidad del haz que incide en el cultivo celular mediante el movimiento de las hojas que componen al colimador, la 33 irradiación se realiza en modalidad de paso‐disparo, es decir, una vez que las hojas se han colocado en la posición deseada el acelerador genera el haz de radiación. Con esto es posible modular la dosis a lo largo de los campos de tratamiento para poder entregar dosis altas en unas regiones y dosis bajas en otras. Lo que resulte de esta irradiación podría ayudarnos a estudiar efectos locales de la dosis y efectos por comunicación efectos que que la radioterapia convencional de campos uniformes y los modelos radiobiológicos aceptados no observan ni predicen, como por ejemplo el efecto Bystander. 3.5.1 Descripción de la geometría de irradiación Utilizamos un haz de rayos X de 6 MV con un patrón de modulación de 9 sub‐campos rectangulares contiguos (tamaño de campo total: 9.8 cm x 9.8 cm) (Figura 5 1). Figura 3‐4 Representación del patrón de movimiento de las hojas del colimador. Se generan 9 sub‐campos de dimensiones aproximadas de 3 cm x 3 cm. En escala de gris de mas claro a mas oscuro corresponde de menor a mayor dosis programada. Diseño realizado en el programa MLC Shaper, creado con la finalidad de generar campos o movimientos del mMLC. Uso del programa autorizado en la Unidad de Radioneurocirugía del Instituto Nacional de Neurología y Neurocirugía de la Ciudad de México El sistema consistió de un frasco de cultivo para proliferación celular en placa, con una superficie de crecimiento de 75 cm2, colocado sobre un medio dispersor equivalente a agua (20 cm x 20 cm x 10 cm). El volumen del medio de cultivo forma una capa de 4.0 mm de grosor sobre el fondo del frasco. La superficie del medio de cultivo se colocó a nivel del isocentro (distancia fuente‐superficie de 100 cm). 3.6 Validación del diseño experimental La distribución espacial de dosis se estudió con película radiográfica Kodak EDR2 colocada debajo del frasco cultivo. La calibración absoluta (a 5 cm de profundidad) y las medidas de carga relativa en cada sub‐campo se obtuvieron con una cámara de ionización de 0.125 34 cm3 PTW‐semiflex que se colocó en el eje central del haz dentro de un maniquí de agua sólida a través de un orificio cilíndrico. Utilizamos métodos Monte Carlo (EGSnrc/DOSXYZnrc) para simular la generación del haz de radiación y el transporte del mismo en la geometría de interés. La medida de referencia se utilizó para normalizar la distribución de dosis en profundidad obtenida de la simulación Monte Carlo y así determinar la dosis depositada en la región de crecimiento de la línea celular. Los resultados se comparan con medidas de la dosis en la región de incremento realizadas con película radiográfica. La descripción del haz de radiación por sub‐campos se obtiene a partir del espacio fase generado previamente. Desarrollamos un código de programación con Matlab para leer las componentes del archivo binario que corresponde al espacio fase (tipo de partícula, energía, posición en el plano de registro, dirección, etc.) y con esto seleccionar las 9 regiones de interés en que se dividirá el campo total mediante una colimación artificial, esto es, generando un espacio fase para cada sub‐campo filtrando solamente las componentes del espacio fase original que tengan vectores de posición en el espacio que define las fronteras de las regiones de interés. Una vez que contamos con las regiones para generar los subcampos, es necesario simular el transporte de cada sub‐campo en la geometría descrita en esta sección, para sumar los efectos individuales y así determinar la dosis depositada por cada uno de los campos en que se dividió el campo total. De los cálculos Monte Carlo podemos extraer la información correspondiente a los depósitos de dosis en profundidad debajo del “sub‐eje central”, así como los perfiles de dosis fuera del eje central en los planos de interés para su análisis. Con las medidas de dosis absoluta obtenidas con la cámara de ionización colocada debajo del eje central en una profundidad con equilibrio de partícula cargada, y con el resultado de la carga relativa depositada por sub‐campo podremos seleccionar los diferentes puntos de referencia para normalizar las curvas obtenidas como resultado del cálculo Monte Carlo. Con esto, es posible asignar valores de dosis absoluta a cada una de las secciones del campo total con las que se irradiarán los cultivos celulares y con ello generar regiones de valores variables de dosis para poder estudiar el efecto de esta variación en la sobrevida de la línea celular con comunicación intra‐celular mediante el medio de cultivo continuo. 3.1 Calibración de campos contiguos con intensidad variable Diseñamos una matriz de campos de radiación contiguos para obtener en un sólo evento dinámico de las hojas del mMLC, diferentes valores de dosis para la curva sensitométrica. Con el diseño de campos contiguos formaremos una matríz de 3 x 3 campos. Para esto, 35 utilizamos el programa MLC Shaper disponible en la Unidad de Radioneurocirugía del Instituto Nacional de Neurología y Neurocirugía. El valor de dosis absoluta se mide colocando la cámara de ionización utilizada en 5.1 en el eje central dentro del maniquí de agua sólida sobre 10 cm de PMMA para considerar las contribuciones por retrodispersión. Este instrumento se coloca a 5 cm de profundidad a partir de la superficie y a 95 cm de distancia fuente‐superficie del maniquí. La dosis absorbida para calibrar el evendo de movimiento del mMLC, la obtenemos colocando la cámara de ionización debajo del sub‐campo central, es decir, el campo del centro del arreglo alineado con el eje central del haz, y mediremos la carga generada para un evento dinámico completo. Para asignar los valores proporcionales de dosis de los restantes 8 campos, medimos los valores de carga colocando la cámara de ionización debajo de cada uno de ellos para un evento dinámico de irradiación completo por medida de cada campo. Con esto, podemos obtener valores de carga relativos a lo que medimos debajo del sub‐campo central y así asignar valores de dosis proporcionales. 36 4 Resultados de la simulación Monte Carlo e irradiación con campos uniformes 4.1 Validación de la simulación MC En la Figura 4‐1 observamos los valores de depósito de dosis en profundidad medido con la cámara de ionización y calculado mediante simulaciones MC, el medio es agua. Ambas curvas corresponden a un campo abierto de 9.8 cm x 9.8 cm para el haz de fotones e 6 MV generado por el acelerador lineal dedicado Novalis. Los datos para la curva medida se obtuvieron utilizando una cámara de ionización PinPoint y los valores para la curva PDD se calcularon con el código de usuario DOSXYZnrc/EGSnrc. Figura 4‐1 Comparación de curvas de depósito de dosis en profundidad: medida con cámara de ionización y calculada con métodos Monte Carlo. El medio de atenuación es agua. El tamaño de campo seleccionado fue de 9.8 cm x 9.8 cm con una distancia fuente‐superficie de 100 cm. Se muestra el intervalo completo de medida en el eje x‐profundidad, desde la superfice hasta 20 cm. La Figura 4‐2 muestra una reducción en la escala del eje x‐profundidad para evaluar las diferencias a partir de 1 cm de profundidad. Observamos un buen acuerdo entre la curva medida y la calculada cuando analizamos las diferencias a partir del punto de depósito máximo de dosis (1.7% de discrepancia máxima). 37 Figura 4‐2 Comparación de curvas de depósito de dosis en profundidad: medida y calculada. Se muestra en el eje x‐ profundidad el intervalo a partir de la profundidad de equilibrio (1 cm) hasta 14 cm. Por otro lado, en la región de incremento, cuya intervalo de profundidad se muestra la figura Figura 4‐3, las diferencias entre las medidas y los cálculos se encuentran entre el ‐ 7% y el 23%, como era esperado. Figura 4‐3 Comparación de curvas de depósito de dosis en profundidad: medida y calculada. Se muestra el intervalo en el eje horizontal para enfatizar las diferencias en la región de incremento. 38 Algunos autores presentan sus resultados en relación con sus simulaciones utilizando métodos MC (Ding 2002). En la figura Figura 4‐4 comparamos nuestros datos con la simulación de depósito de dosis en profundidad reportada por Abdel‐Raman y colaboradores (Abdel-Rahman et al. 2005), las condiciones de la simulación descritas son similares a las de nuestro experimento. Los valores calculados con nuestra simulación presentan un buen acuerdo con los del autor referido (±1%). Figura 4‐4 Cálculos de depósito de dosis en profundidad. Los datos en este estudio se comparan con los de las simulaciones reportadas por Abdel‐Rahman y colaboradores (Abdel‐Rahman et al. 2005) En base a estos resultados, concluimos que nuestra simulación representa estadísticamente el arreglo experimental, por lo que el cálculo de depósito de dosis en profundidad es correcto. Otra función dosimétrica que analizamos es la de la razón fuera del eje central (OAR). Para ello comparamos los valores medidos y calculados de perfiles para un campo abierto de intensidad uniforme de 9.8 cm x 9.8 cm y en diferentes profundidades: 1.4, 5 y 10 cm, seleccionadas a partir de valores estándar utilizados en el comisionamiento de una fuente de radiación externa para uso clínico. En la Figura 4‐5 Comparación de perfiles de dosis entre medidas hechas con cámara de ionización (línea punteada) y cálculos MC (símbolos) para tres profundidades en agua y una distancia fuente‐superficie de 100 cm con un campo abierto de 9.8 cm x 9.8 cm. se muestra el resultado de esta comparación de perfiles de dosis. Podemos observar que los perfiles de dosis calculados a las tres profundidades se empatan a los resultados de las medidas, tanto en la región mas cercana 39 al eje central del haz como en el borde del campo de radiación (penumbra). En la Tabla 4‐1 se muestran las diferencias promedio y máxima para cada profundidad. Figura 4‐5 Comparación de perfiles de dosis entre medidas hechas con cámara de ionización (línea punteada) y cálculos MC (símbolos) para tres profundidades en agua y una distancia fuente‐superficie de 100 cm con un campo abierto de 9.8 cm x 9.8 cm. Δ (Perfil medido vs. calculado) (%) Promedio Máxima 10 cm 5 cm 1.4 cm 0.97 1.98 0.85 2.30 0.76 1.85 Tabla 4‐1 Resultados de las comparaciones entre los perfiles de dosis medidos y calculados para tres diferentes profundidades. Las diferencias se expresan en pocentajes promedio y máxima. La serie de resultados presentados son suficientemente buenos como para continuar con la implementación de las modificaciones necesarias en la geometría del maniquí para simular el modelo para la irradiación del cultivo celular. 4.1 Calibración de la película radiográfica En la Figura 4‐6 Curva sensitométrica para película radiográfica EDR2 irradiada con un haz de fotones de 6 MV con un tamaño de campo de 3 cm x 3 cm. La línea punteada es el resultado del ajuste descrito en esta sección utilizando el modelo de doble‐golpe de Zhu y colaboradores (Zhu, et al., 2003).se muestra la curva sensitométrica para la película EDR2, esta curva se obtuvo con el arreglo experimental descrito en la sección 3.2. El ajuste se realiza utilizando la propuesta de doble golpe descrita por Zhu y colaboradores (Zhu, et al., 2003). La ecuación utilizada para el ajuste tiene la forma: 40 DO = DO1,max[1‐e‐α1.D(1+α1D)]+ DO2,max[1‐e‐α2.D(1+α2D)] Ec. 4‐1 Los parámetros del ajuste (R=9995) de la curva de calibración obtenida son: DO1,max 3.3599 ± 0.0281 α1 0.0065 ± 0.0001 DO2,max 0.1688 ± 0.0185 α2 0.1335 ± 0.1098 En el ajuste es posible observar el buen acuerdo que mantiene con los datos experimentales incluso en la región de dosis menores a 100 cGy; este acuerdo fue posible gracias a la forma de la ecuación propuesta por Zhu y colaboradores, una vez que antes de eso, el modelo utilizado era el de golpe‐simple y con él, la predicción del modelo subestimaba los resultados que se observaban experimentalmente. Figura 4‐6 Curva sensitométrica para película radiográfica EDR2 irradiada con un haz de fotones de 6 MV con un tamaño de campo de 3 cm x 3 cm. La línea punteada es el resultado del ajuste descrito en esta sección utilizando el modelo de doble‐golpe de Zhu y colaboradores (Zhu, et al., 2003). 4.2 Dosis en la región de incremento con película radiográfica En la Figura 4‐7 se muestra el resultado de la dosis medida con película radiográfica en la región de incremento comparado con lo que arroja la simulación Monte Carlo que realizamos del arreglo experimental. La normalización del cálculo se hizo utilizando la dosis medida con película radiográfica a una profundidad de 3.47 cm. Los resultados para 41 las profundidades efectivas a las que se encontraba la película radiográfica se muestran en la Tabla 4‐2. Profundidad (cm) 0.035 0.135 0.205 0.375 0.670 0.945 1.75 Dosis medida Película radiográfica (cGy) 79 111 142 171 206 222 221 Dosis calculada MC (cGy) 53.00 96.31 130.58 167.38 209.68 219.56 225.42 Diferencias (%) 33.00 13.23 8.04 2.11 ‐1.78 1.09 ‐2.00 Tabla 4‐2 Comparación de dosis en profundidad entre película radiográfica EDR2 y cálculos MC para la estimación de dosis en la región de incremento. Observamos diferencias importantes en profundidades de 0.205 cm y menores, mientras que para profundidades mayores las diferencias son menores que el 3%, con esto, podemos considerar el uso de este dosímetro en la estimación de dosis en la región de incremento para profundidades mayores o iguales que 0.375 cm sin requerir de factor de corrección alguno. Con este resultado se hace posible el uso de película radiográfica Kodak‐EDR2 para evaluar el depósito de dosis en las condiciones que nos interesan para su aplicación en cultivos celulares que presenten las condiciones experimentales descritas en este trabajo. Figura 4‐7 Comparación de dosis en profundidad en la región de incremento para un haz de rayos X de 6 MV entre medidas hechas con película radiográfica (círculos blancos) y cálculos MC (círculos negros) para una irradiación con un campo abierto de 3 cm x 3 cm. 42 4.3 Irradiación del cultivo celular En la Figura 4‐8 presentamos la dosis en profundidad calculada para el arreglo experimental descrito en la sección 3.1.2. Los datos corresponden a los resultados obtenidos a lo largo del eje central. Los voxeles para el registro de la dosis en la región de interés se definieron de 1 mm x 1 mm x 1 mm. Observamos una curva de incremento dentro de los primeros 4 mm por debajo de la superficie del cultivo celular; después, se muestra la presencia de las siguientes capas, correspondientes a dos medios distintos: 1.5 mm de poliestireno y 1.5 mm de aire entre el fondo del frasco de cultivo y la superficie de los bloques de PMMA colocados como material para retrodispersión. Entre la capa de 1 mm de medio de cultivo en el fondo del frasco y el poliestireno de la base debajo de la anterior, vemos un cambio en el gradiente del depósito de dosis en profundidad. Una vez que la capa de aire se alcanza, la curva presenta disminución importante. Superada la presencia del aire, se genera de nuevo, una curva de incremento en el depósito de dosis en profundidad, ahora en las placas de PMMA, hasta alcanzar la profundidad de depósito máximo aproximadamente a 1 cm de la superficie del plástico de retrodispersión, para luego disminuir de manera consistente. Figura 4‐8 Distribución de dosis en profundidad en regiones específicas localizadas a lo largo del eje central en el modelo para irradiación de cultivos celulares con campos abiertos. La profundidad a la que se midió la dosis de referencia que nos permite asignar los valores de dosis absoluta en el eje vertical se fijó en 6.8 cm por debajo de la superficie del medio de cultivo (0.7 cm corresponden a valores en profundidad dentro del frasco de cultivo 43 agregándose 0.15 cm de aire y 6.1 cm a partir de la superficie del PMMA sobre la cámara de ionización). Este arreglo nos permitió determinar la dosis en la profundidad de interés, esto es, en la capa de 1 mm sobre el fondo del frasco de cultivo, donde se encuentra la superficie de cultivo celular: 0.877 Gy/100 UM ± 2%. 4.4 Irradiación de la línea celular: fracción de sobrevida La figura Figura 4‐9 muestra la curva de sobrevida para la línea celular de glioblastoma multiforme U373MA como función de la dosis absorbida. Figura 4‐9 Fracción de sobrevida de glioblastoma multiforme U373MA irradiados en un intervalo de 0 a 14 Gy. Cada punto corresponde al promedio del experimento por triplicado. En esta curva es posible apreciar en la región de dosis absorbida por debajo de los 2 Gy (Figura 4‐10) un patrón de hiper‐radiosensibilidad a bajas dosis. En la Figura 4‐11 presentamos una comparación con dos curvas de sobrevida reportadas para líneas celulares de glioblastoma multiforme: U373MA y SNB‐75 (Badie et al. 1999, Ning y Knox 2004); estas curvas dosis‐respuesta se obtuvieron utilizando un irradiador de 137 Cs con una tasa de dosis de 5.94 Gy/min. Observamos un excelente acuerdo con nuestros resultados y los reportados por estos autores, con diferencias menores al 10%. Es importante resaltar que los resultados obtenidos presentan este buen acuerdo a pesar de las diferencias en las técnicas de irradiación. 44 Figura 4‐10 Fracción de sobrevida para la línea celular U373MA de glioblastoma multiforme irradiada con un haz de fotones de 6 MV. Se muestra el intervalo de 0 a 6 Gy. A dosis por debajo de 2 Gy se observa un patrón de hiper‐ radiosensibilidad. La dosis media de inactivación para la línea celular utilizada en este estudio fue de 2.2 Gy. Figura 4‐11 Fracción de sobrevida como función de la dosis absorbida en cultivos celulares de glioblastoma multiforme humano. Los cuadros negros corresponden a los resultados de nuestro experimento; en círculos y 137 triángulos se muestran los datos de dos autores utilizando un irradiador de Cs (Badie et al. 1999, Ning y Knox. 2004). 45 5 Resultados de la irradiación con campos de intensidad modulada Los resultados de la irradiación con los campos de intensidad modulada en un arreglo de 3 x 3 campos de intensidad uniforme dentro de un tamaño de campo total de 9.8 cm x 9.8 cm actualmente se encuentran en análisis. 46 6 Conclusiones Los resultados del cálculo MC en el medio homogéneo comparados con mediciones en profundidades más allá de la región de incremento fue validada, permitiéndonos extender su aplicación a la geometría de irradiación del frasco de cultivo para proliferación en placa, donde encontramos un problema dosimétrico experimental. La dosis absorbida, considerando diferentes capas de materiales (incluyendo capas de aire) y mas específicamente la relacionada con la región de incremento, se estimó satisfactoriamente. Este método de determinación de dosis supone que todos los argumentos considerados en el protocolo internacionale de calibración dosimétrica IAEA TRS‐277, basado en la absorción de dosis en agua, son razonables. En este trabajo hemos presentado un modelo de irradiación para cultivos celulares que reproduce las condiciones en las que se mantienen las células dentro de los frascos de cultivo. El modelo incluye la simulación del transporte de radiación utilizando un haz de rayos X generado por un acelerador lineal de 6 MV. Este haz, con incidencia normal sobre el frasco de cultivo, genera condiciones fuera de equilibrio electrónico en el volumen de interés, de tal manera que el uso de métodos dosimétricos convencionales es inapropiado. Bajo tales condiciones experimentales, este método nos permite determinar la dosis absorbida en la región en que proliferan las células sobre la base del frasco de cultivo. Fue posible medir la dosis con película radiográfica EDR2 en la región de incremento para un haz de megavoltaje dentro del 3% de diferencia respecto a cálculo MC para profundidades mayores o iguales a 0.375 cm. La reproducibilidad de la preparación de la línea celular se estudió con el grupo control (desviación estándar de 6%). Todos los frascos irradiados, así como los controles, contenían células de la misma suspensión. El grupo control y los frascos por ser irradiados se tomaron del área de laboratorio y se llevaron a la unidad de irradiación; las células se mantuvieron a temperatura ambiente el mismo periodo de tiempo. La eficiencia de proliferación fue de 65%, y la dosis media de inactivación para esta línea celular se estimó en 2.2 Gy. Este resultado está en excelente acuerdo con lo que reportan otros autores [3]. El modelo de irradiación es fácil de montar y brinda buen control de la dosis absorbida (precisión total estimada 2%), por lo que fue posible obtener una curva de dosis‐ respuesta de la línea celular de GBM humano U373MA, la cual es comparable con los resultados obtenidos en otros ensayos para estudiar la radiosensibilidad de líneas 47 celulares similares. La dosis media de inactivación estimada para esta línea celular fue de 2.2 Gy. 48 7 Bibliografía Larson, K., & Prasad, S. (1978). Absorbed‐dose computations for inhomogeneous media in radiation‐treatment planning using differential scatter‐air ratios. Annual Symposium on Computer Aplications in Medical Care, (págs. 93‐99). Cunnigham, J. (1972). Scatter‐air ratios. Phys. Med. Biol. , 17, 42‐51. Cunningham, J., Bruce, W., & Webb, H. (1965). A convenient 137Cs unit for irradiation cell suspensions and small laboratory animals. Phys. Med. Biol. , 10, 381. Luxton, G., Jozsef, G., & Astrahan, M. (1991). Algorithm for dosimetry of multiarc linear‐ accelerator stereotactic radiosurgery. Med. Phys. , 18 (6), 1211‐1221. Almond, P., Biggs, P., Hanson, W., Saiful Huq, M., Nath, R., & Rogers, D. (1999). AAPM's TG‐51 protocol for clinical reference dosimetry of high‐energy photon and electron beams. Med. Phys. , 26 (9), 1847‐1870. Abdel‐Rahman, W., Seuntjens, J., Verhaegen, F., Deblois, F., & Podgorsak, E. (2005). Validation of Monte Carlo calculated surface doses for megavoltage photon beams. Med. Phys. , 32 (1), 286‐298. Bäckström, A., Jakobsson, P., Littbrand, B., & Sarby, S. (1971). Quantitative comparison of cellular radiation effects in vitro with 60 Co‐gamma radiation, 190kV conventional roentgen radiation and 6 MV roentgen radiation. Nord. Med. , 85 (43), 1251‐1252. Badie, B., Sing‐Goh, C., Klaver, J., Herweijer, H., & Boothman, D. (1999). Combined radiation and p53 gene therapy of malignant glioma cells. Cancer Gene Therapy , 6 (2), 155‐162. Bielajew, A., & Rogers, D. (1987). PRESTA: The parameter reduced electron step transport algorithm for electron Monte Carlo transport. Nucl. Instrum. Methods , 18, 165‐181. Boyer, A., & Mok, E. (1986). Calculation of photon dose distributions incan inhomogeneous medium using convolutions. Med. Phys. , 13, 503‐509. Boyer, A., & Mok, E. (1985). A photon dose distribution model employing convolution calculations. Med. Phys. , 12, 169‐177. Boyer, A., Wackwitz, R., & Mok, E. (1988). A comparison of the speeds of three convolution algorithms. Med. Phys. , 15, 224‐227. 49 Bromley, 2., Oliver, L., Davey, R., Harvie, R., & Baldock, C. (2009). Predicting the clonogenic survival of A549 cells after modulated x‐ray irradiation using the linear quadratic model. Phys. Med. Biol. , 54, 187‐206. Bromley, R., Davey, R., Olive, L., Harvie, R., & Baldock, C. (2006). A preliminary investigation of cell growth after irradiation using a modulated x‐ray intensity pattern. Phys. Med. Biol. , 51, 3639‐3651. Butterworth, K., McGarry, C., O’Sullivan, J., Hounsell, A., & Prise, K. (2010). A study of the biological effects of modulated 6 MV radiation fields. Phys. Med. Biol. , 55, 1607‐1618. Danciu, C., Proimos, B., Rosenwald, J., & Mijnheer, B. (2001). Variation of sensitometric curves of radiographic films in high energy photon beams. Med. Phys. , 28 (6), 966‐974. Ding, G. (2002). Dose discrepancies between Monte Carlo calculations and measurements in the buildup region for a high‐energy photon beam. Med. Phys. , 29 (11), 2459‐2463. Garret, G., Haas‐Kogan, D., Levine, K., Aldape, K., & Israel, M. (1998). Ionizing radiation inhibits chemotherapy‐induced apoptosis in cultures glioma cells: Implications for combined modality therapy. Cancer Res. , 58, 3819‐3825. Grenman, R., Burk, D., Virolainen, E., Wagner, J., Lichter, A., & Carey, T. (1988). Radiosensitivity of head and neck cancer cells in vitro: A 96‐well plate clonogenic assay for squamous cell carcinoma. Arch. Otolaryngol. , 114 (4), 427‐431. Hall, E., & Giaccia, A. (2006). Radiobiology for the Radiologist. Lippincott Williams & Wilkins. IAEA. (1987). Absorbed dose determination in photon and electron beams: an international code of practice. Vienna: International Atomic Energy Agency. Kawrakow, I., & Bielajew, A. (1998). On the condensed history technique for electron transport. Nucl. Instrum. Methods Phys. Res. B , 142, 253‐280. Mackie, T., Scrimger, J., & Battista, J. (1985). A convolution method of calculating dose for 15‐MV X rays. Med. Phys. , 12, 188‐196. Mackonis, E., Suchowerska, N., Zhang, M., Ebert, M., McKenzie, D., & Jackson, M. (2007). Cellular response to modulated radiation fields. Phys. Med. Biol. , 52, 5469‐5482. Martel, M., Fraass, B., & McShan, D. (1992). Study of limits of applicability of ETAR—Like inhomogeneity correction methods. Med. Phys. , 19, 785. 50 Milan, J., & Bentley, R. (1974). The syorage and manipulation of radiation dose data in a small digital computer. Br. J. Radiol. , 47, 115‐121. Mohan, R., Chui, C., & Lindofsky, L. (1986). Differential pencil beam dose computation model for photons. Med. Phys. , 13, 64‐73. Moiseenko, V., Duzenli, C., & Durand, R. (2007). In vitro study of cell survival following dynamic MLC intensity‐modulated radiation therapy dose delivery. Med. Phys. , 34 (4), 1514‐1520. Nilson, B., & Montelius, A. (1986). Fluence perturbation in photon beams under nonequilibrium conditions. Med. Phys. , 13 (2), 191‐195. Ning, S., & Knox, S. (2004). Increased cure rate of glioblastoma using concurrent therapy with radiotherapy and arsenic trioxide. Int. J. Radiat. Oncol. Biol. Phys. , 60 (1), 197‐203. O'Connor, J. (1957). The variation of scattered x‐rays with density in an irradiated body. Phys. Med. Biol. , 1, 352‐369. Pai, S., Das, I., Dempsey, J., Lam, K., Losasso, T., Olch, A., y otros. (2007). TG‐69: radiographic film for megavoltage beam dosimetry. Med. Phys. , 34 (6), 2228‐2258. Rice, R., Hansen, J., Svensson, G., & Siddon, R. (1987). Measurements of dose distributions in small beams of 6 MV x‐rays. Phys. Med. Biol. , 32 (9), 1087‐1099. Rogers, D. (2006). Fifty years of Monte Carlo simulations for medical physics. Phys. Med. Biol. , 51, R287‐R301. Shibamoto, Y., Ito, M., Sugie, C., Ogino, H., & Hara, M. (2004). Recovery from sublethal damage during intermittent exposures in cultured tumor cells: implications for dose modification in radiosurgery and IMRT. Int. J. Radiat. Oncol. Biol. Phys. , 59 (5), 1484‐1490. Shiu, A., Kooy, H., Ewton, J., Tung, S., Wong, J., Antes, K., y otros. (1997). Comparison of miniature multileaf collimation (mMLC) with circular collimation for stereotactic treatment. Int. J. Radiation Oncology Biol. Phys. , 37 (3), 679‐688. Sontag, M., & Cunningham, J. (1977). Corrections to absorbed dose calculations for tissue inhomogeneities. Med. Phys. , 4, 431‐436. Sterzing, F., Münter, M., Schäfer, M., Haering, P., Rhein, B., Thilman, C., y otros. (2005). Radiobiological investigation of dose‐rate effects in Intensity‐Modulated Radiation Therapy. Strahlenther. Onkol. , 181, 42‐48. 51 Suchowerska, N., Ebert, M., Zhang, M., & Jackson, M. (2005). In vitro response of tumor cells to non‐uniform irradiation. Phys. Med. Biol. , 50, 3041‐3051. Tarnawski, R., Widel, M., & Skladowski, K. (2003). Tumor cell repopulation during conventional and accelerated radiotherapy in the in vitro megacolony culture. Int. J. Radiat. Oncol. Biol. Phys. , 55 (4), 1074‐1081. Williamson, J., Khan, F., & Sharma, S. (1981). Film dosimetry of megavoltage photon beams: A practical method of isodensity‐to‐isodose curve conversion. Med. Phys. , 8 (1), 94‐98. Wong, J., & Henkelman, R. (1983). A new approach to CT pixel‐based photon dose calculations in heterogeneous media. Med. Phys. , 10, 199‐208. Xia, P., Geis, P., Xing, L., Ma, C., Findley, D., Forster, K., y otros. (1999). Physical characteristics of a miniature multileaf collimator. Med. Phys. , 26 (1), 65‐70. Yoshida, D., Piepmeier, J., & Weinstein, M. (1994). Estramustine Sensitizes Human Glioblastoma Cells to Irradiation. Cancer Res. , 54, 1415‐1417. Zhu, X., Yoo, S., Jursinic, P., Grimm, D., Lopez, F., Rownd, J., y otros. (2003). Characteristics of sensitometric curves of radigraphic films. Med. Phys. , 30 (5), 912‐919. 52