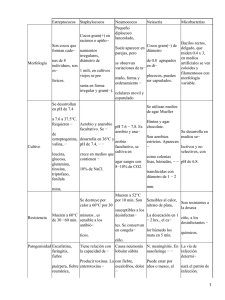
aislamiento e identificacion de flora bacteriana
Anuncio

AISLAMIENTO E IDENTIFICACION DE FLORA BACTERIANA NATIVA DEL SUELO DE LOS PÁRAMOS CRUZ VERDE Y GUASCA (CUNDINAMARCA) GERMÁN DAVID BENAVIDES RODRIGUEZ ANA MARÍA HERMIDA SILVA PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL Bogotá D.C 2008 AISLAMIENTO E IDENTIFICACION DE FLORA BACTERIANA NATIVA DEL SUELO DE LOS PÁRAMOS CRUZ VERDE Y GUASCA (CUNDINAMARCA) GERMAN DAVID BENAVIDES RODRIGUEZ ANA MARÍA HERMIDA SILVA TRABAJO DE GRADO Presentado como requisito parcial Para optar el título MICROBIOLOGO INDUSTRIAL PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL Bogotá D.C 2008 NOTA DE ADVERTENCIA Artículo 23 de la Resolución Nº 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien que se vea en ellas el anhelo de buscar la verdad y la justicia”. AISLAMIENTO E IDENTIFICACION DE FLORA BACTERIANA NATIVA DEL SUELO DE LOS PÁRAMOS CRUZ VERDE Y GUASCA (CUNDINAMARCA) GERMAN DAVID BENAVIDES RODRIGUEZ ANA MARÍA HERMIDA SILVA APROBADO DIRECTOR Rubén Darío Torrenegra Químico JURADO JURADO AISLAMIENTO E IDENTIFICACION DE FLORA BACTERIANA NATIVA DEL SUELO DE LOS PÁRAMOS CRUZ VERDE Y GUASCA (CUNDINAMARCA) GERMAN DAVID BENABIDES RODRIGUEZ ANA MARÍA HERMIDA SILVA APROBADO DECANO ACÁDEMICO DIRECTOR DE CARRERA Ingrid Schuler, ph.D. Janeth Arias Palacios, M.Sc. M.Ed. RESUMEN En el presente trabajo se realizó el aislamiento y la identificación de la flora nativa del suelo de los páramos Cruz verde y Guasca; con el fin de contribuir al estudio de la población bacteriana de estos ambientes extremos. El muestreo se basó en la norma ICONTEC NTC 4113-6 y se llevó a cabo por medio de tres métodos diferentes: Caja rodac, Pala y Barreno. Se realizaron dos técnicas de aislamiento que fueron la técnica de dilución en tubo y dispersión directa, en los medios Agar Extracto de Suelo y Medio Agar Nutritivo. Por medio de la coloración Gram se hizo la identificación microscópica dividiendo así las cepas en dos grupos Gram positivos y Gram negativos y posteriormente en subgrupos los esporoformadores y no esporoformadores,obteniendo un alto porcentaje de bacterias Gram positivas; mediante el uso de bioquímicas y medios de cultivos selectivos se identificaron 40 cepas bacterianas correspondientes a los siguientes géneros: Amphibacillus, Bacillus, Brochothrix, Caryophanon, Kurthia, Lactobacillus, Sacharococeus, Lactococcus, Sarciana, Listeria, Micrococcus, Sporolactobacillus, Pediococcus, Sporosarcina, Staphylococcus y Trichococcus. Los géneros Bacillus y Lactobacillus fueron los géneros más predominantes en este proyecto. Finalmente las cepas identificadas se conservaron con el propósito de mantener este material biológico en un estado viable y estable, la conservación se hizo por tres métodos diferentes: Suelo estéril, Glicerol, Sensidiscos. TABLA DE CONTENIDO TÍTULO PÁGINA 1. Introducción 2 2. Marco Teórico 3 2.1. Suelo 3 2.1.1. Perfil del Suelo 4 2.1.2. Textura del suelo 4 2.1.3. Componentes del Suelo 4 2.1.4. Microorganismos del Suelo 5 2.1.5. Muestreo del Suelo 7 2.2. 7 Páramo 2.2.1. Vegetación de los páramos 7 2.2.2. Suelo de los Páramos 8 2.3. 9 Crecimiento Microbiano 2.3.1. Efecto de la Temperatura 10 2.3.1.1. Crecimiento Microbiano a Temperaturas Extremas 10 2.3.2. Acidez y Alcalinidad 11 2.3.3. Oxígeno 12 2.4. 12 Identificación Bioquímica 2.4.1. Prueba de Voges Proskauer 14 2.4.2. Prueba Rojo de Metilo 14 2.4.3. Prueba LIA (Descarboxilación Lisina) 15 TÍTULO PÁGINA 2.4.4. Hidrólisis de Almidón 16 2.4.5. Prueba SIM 16 2.4.6. Prueba TSI 17 2.4.7. Prueba Citocromo Oxidasa 17 2.4.8. Prueba de Citrato 18 2.4.9. Prueba de Ureasa 18 2.4.10. Prueba Reducción de Nitratos 19 2.4.11. Prueba de Catalasa 19 2.4.12. Licuefacción de gelatina 20 2.4.13. Prueba de fermentación de hidratos de carbono 20 2.5. Bioconservación 21 3. Formulación del Problema y Justificación 23 3.1. Formulación del Problema 23 3.2. Justificación 23 4. Objetivos 25 4.1. Objetivo General 25 4.2. Objetivos Específicos 25 5. Metodología 26 5.1. Recolección de las Muestras 26 5.2. Procesamiento de las Muestras 28 5.2.1. Técnicas de aislamiento 28 5.2.1.1. Lavado de Suelo 28 TÍTULO PÁGINA 5.2.1.2. Técnica de placa de conteo de Warcup 28 5.2.1.3. Técnica de cultivo líquido 29 5.3. 29 Identificación Bacteriana 5.3.1. Identificación Microscópica y Macroscópica 29 5.3.2. Identificación Bioquímica 29 5.4. 30 Conservación de Cepas 5.4.1. Métodos de Conservación 30 5.4.1.1. Conservación en Aceite Mineral 30 5.4.1.2. Conservación por suspensión en agua destilada 30 5.4.1.3. Conservación en Suelo estéril 30 5.4.1.4. Conservación en Sílica Gel 31 5.4.1.5. Conservación por Liofilización 31 5.4.1.6. Criopreservación 31 5.4.1.7. Conservación por Desecación en papel de filtro 32 6. Experimentación 33 6.1. Reconocimiento de la Zona 33 6.2. Recolección de Muestras 34 6.3. Procesamiento de las Muestras 36 6.4. Aislamiento de Bacterias 37 6.4.1. Aislamiento Primario 37 6.4.1.1. Técnica Dilución en Tubo 37 6.4.1.2. Técnica de Aspersión Directa 37 TÍTULO PÁGINA 6.4.1.3. Aislamiento a Partir de Caja Rodac 37 6.5. 38 Identificación Bacteriana 6.5.1. Identificación Microscópica 38 6.5.2. Identificación Bioquímica 38 6.6. Conservación de Cepas 39 6.6.1. Conservación en Suelo Estéril 39 6.6.2. Conservación en Glicerol 40 6.6.3. Conservación en Sensidiscos 40 7. Resultados y Discusión 41 7.1. Parámetros para la selección de géneros 41 7.2. Bacilos esporoformadores Gram positivos 42 7.2.1. Género Amphybacillus 44 7.2.1.1. Amphybacillus sp. 44 7.2.1.2. Amphybacillus xylanus 45 7.2.2. Género Bacillus 46 7.2.2.1. Bacillus azotoformans 47 7.2.2.2. Bacillus cereus 48 7.2.2.3. Bacillus circulans 49 7.2.2.4. Bacillus globisporus 50 7.2.2.5. Bacillus marinus 51 7.2.2.6. Bacillus pasteurii 52 7.2.2.7. Bacillus sphaericus 53 TÍTULO PÁGINA 7.2.3. Género Sporolactobacillus 54 7.2.3.1. Sporolactobacillus inulinus 54 7.3. 55 Cocos eporoformadores Gram positivos 7.3.1. Género Sporosarcina 55 7.3.1.1. Sporosarcina ureae 56 7.4. 57 Bacilos Gram positivos no esporoformadores 7.4.1. Género Bochotrix 57 7.4.1.1. Brochothrix campestris 58 7.4.1.2. Brochothrix thermosphacta 59 7.4.2. Género Caryophanon 60 7.4.2.1. Caryophanon latum 60 7.4.2.2. Caryophanon tenue 61 7.4.3. Género Kurthia 62 7.4.3.1. Kurthia gibsonii 62 7.4.3.2. Kurthia sibirica 63 7.4.3.3. Kurthia zopfii 64 7.4.4. Género Lactobacillus 64 7.4.4.1. Lactobacillus agilis 65 7.4.4.2. Lactobacillus collinoides 66 7.4.4.3. Lactobacillus confusus 67 7.4.4.4. Lactobacillus fructosus 68 7.4.4.5. Lactobacillus kandleri 69 TÍTULO PÁGINA 7.4.4.6. Lactobacillus sake 70 7.4.4.7. Lactobacillus viridescens 71 7.4.5. Género Listeria 72 7.4.5.1. Listeria murrayi 72 7.4.5.2. Listeria welshimeri 73 7.5. 74 Cocos Gram positivos no esporoformadores 7.5.1. Género Lactococcus 74 7.5.1.1. Lactococcus lactis 75 7.5.2. Género Micrococcus 76 7.5.2.1. Microccocus luteus 76 7.5.2.2. Micrococcus roseus 77 7.5.3. Género Pediococcus 77 7.5.3.1. Pediococcus sp. 78 7.5.4. Género Sacharococeus 79 7.5.4.1. Sacharococeus thermophilus 79 7.5.5. Género Sarcina 80 7.5.5.1. Sarcina ventriculi 80 7.5.6. Género Syaphylococcus 81 7.5.6.1. Staphylococcus arlettae 81 7.5.6.2. Staphylococcus auricularis 82 7.5.6.3. Staphylococcus equorum 83 7.5.6.4. Staphylococcus hominis 84 TÍTULO PÁGINA 7.5.6.5. Staphylococcus lentus 85 7.6. Coco-Bacilos no esporoformadores Gram positivos 86 7.6.1. Género Trichococcus 86 7.6.1.1. Trichococcus flocculiformis 86 8. 87 Conclusiones 9. Recomendaciones 88 10. 89 Referencias TABLA DE FIGURAS TÍTULO DE FIGURA PÁGINA FIGURA 1. Recorrido en toma de muestras en suelo 26 FIGURA 2. Barrenos 27 FIGURA 3. Mapa de cuadrantes de muestreo 34 FIGURA 4. Toma de muestras con cajas rodac 35 FIGURA 5. Toma de muestras con pala 35 FIGURA 6. Toma de muestras con barreno 36 FIGURA 7. Transporte de muestras 36 FIGURA 8. Aislamiento primario en cajas rodac 38 FIGURA 9. Microscopia 100X de Amphybacillus sp. 44 FIGURA 10. Amphybacillus sp. en Agar Nutritivo 44 FIGURA 11. Microscopia 100X de Amphybacillus xylanus 45 FIGURA 12. Amphybacillus xylanus en Agar Nutritivo 45 FIGURA 13. Microscopia 100X de Bacillus azotoformans 47 FIGURA 14. Bacillus azotoformans en Agar Nutritivo 47 FIGURA 15. Microscopia 100X de Bacillus cereus 48 FIGURA 16. Bacillus cereus en Agar Nutritivo 48 FIGURA 17. Microscopia 100X de Bacillus circulans 49 FIGURA 18. Bacillus circulans en Agar Nutritivo 49 FIGURA 19. Microscopia 100X de Bacillus globisporus 50 FIGURA 20. Bacillus globisporus en Agar Nutritivo 50 FIGURA 21. Microscopia 100X de Bacillus marinus 51 FIGURA 22. Bacillus marinus en Agar Nutritivo 51 FIGURA 23. Microscopia 100X de Bacillus pasteurii 52 FIGURA 24. Bacillus pasteurii en Agar Nutritivo 52 FIGURA 25. Microscopia 100X de Bacillus sphaericus 53 FIGURA 26. Bacillus sphaericus en Agar Nutritivo 53 FIGURA 27. Microscopia 100X de Sporolactobacillus inulinus 54 FIGURA 28. Sporolactobacillus inulinus en Agar Nutritivo 54 FIGURA 29. Microscopia 100X de Sporosarcina ureae 56 FIGURA 30. Sporosarcina ureae en Agar Nutritivo 56 FIGURA 31. Microscopia 100X de Brochothrix campestris 58 FIGURA 32. Brochothrix campestris en Agar Nutritivo 58 FIGURA 33. Microscopia 100X de Brochothrix thermosphacta 59 FIGURA 34. Brochothrix thermosphacta en Agar Nutritivo 59 FIGURA 35. Microscopia 100X de Caryophanon latum 60 FIGURA 36. Caryophanon latum en Agar Nutritivo 60 FIGURA 37. Microscopia 100X de Caryophanon tenue 61 FIGURA 38. Caryophanon tenue en Agar Nutritivo 61 FIGURA 39. Microscopia 100X de Kurthia gibsonii 62 FIGURA 40. Kurthia gibsonii en Agar Nutritivo 62 FIGURA 41. Microscopia 100X de Kurthia sibirica 63 FIGURA 42. Kurthia sibirica en Agar Nutritivo 63 FIGURA 43. Microscopia 100X de Kurthia zopfii 64 FIGURA 44. Kurthia zopfii en Agar Nutritivo 64 FIGURA 45. Microscopia 100X de Lactobacillus agilis 65 FIGURA 46. Lactobacillus agilis en Agar Nutritivo 65 FIGURA 47. Microscopia 100X de Lactobacillus collinoides 66 FIGURA 48. Lactobacillus collinoides en Agar Nutritivo 66 FIGURA 49. Microscopia 100X de Lactobacillus confusus 67 FIGURA 50. Lactobacillus confusus en Agar Nutritivo 67 FIGURA 51. Microscopia 100X de Lactobacillus fructosus 68 FIGURA 52. Lactobacillus fructosus en Agar Nutritivo 68 FIGURA 53. Microscopia 100X de Lactobacillus kandleri 69 FIGURA 54. Lactobacillus kandleri en Agar Nutritivo 69 FIGURA 55. Microscopia 100X de Lactobacillus sake 70 FIGURA 56. Lactobacillus sake en Agar Nutritivo 70 FIGURA 57. Microscopia 100X de Lactobacillus viridescens 71 FIGURA 58. Lactobacillus viridescens en Agar Nutritivo 71 FIGURA 59. Microscopia 100X de Listeria murrayi 72 FIGURA 60. Listeria murrayi en Agar Nutritivo 72 FIGURA 61. Microscopia 100X de Listeria welshimeri 73 FIGURA 62. Listeria welshimeri en Agar Nutritivo 73 FIGURA 63. Microscopia 100X de Lactococcus lactis 75 FIGURA 64. Lactococcus lactis en Agar Nutritivo 75 FIGURA 65. Microscopia 100X de Micrococcus luteus 76 FIGURA 66. Micrococcus luteus en Agar Nutritivo 76 FIGURA 67. Microscopia 100X de Micrococcus roseus 77 FIGURA 68. Micrococcus roseus en Agar Nutritivo 77 FIGURA 69. Microscopia 100X de Pediococcus sp 78 FIGURA 70. Pediococcus sp en Agar Nutritivo 78 FIGURA 71. Microscopia 100X de Sacharococeus thermophilus 79 FIGURA 72. Sacharococeus thermophilus en Agar Nutritivo 79 FIGURA 73. Microscopia 100X de Sarcina ventriculi 80 FIGURA 74. Sarcina ventriculi en Agar Nutritivo 80 FIGURA 75. Microscopia 100Xde Staphylococcus aerlettae 81 FIGURA 76. Staphylococcus aerlettae en Agar Nutritivo 81 FIGURA 77. Microscopia 100X de Staphylococcus auricularis 82 FIGURA 78. Staphylococcus auricularis en Agar Nutritivo 82 FIGURA 79. Microscopia 100X de Staphylococcus equorum 83 FIGURA 80. Sacharococeus equorum en Agar Nutritivo 83 FIGURA 81. Microscopia 100X de Staphylococcus hominis 84 FIGURA 82. Sacharococeus hominis en Agar Nutritivo 84 FIGURA 83. Microscopia 100X de Staphylococcus lentus 85 FIGURA 84. Sacharococeus lentus en Agar Nutritivo 85 FIGURA 85. Microscopia 100X de Trichococcus flocculiformis 86 FIGURA 86. Trichococcus flocculiformis en Agar Nutritivo 86 AGRADECIMIENTOS • Al Dr. Rubén Darío Torrenegra, por sus excelentes aportes de conocimiento. • A Andrea García y Sindy Lorena Rodríguez por su colaboración. • A Colciencias, por su financiación parcial para éste proyecto, 12010-IT0101103. • A nuestros padres por su paciencia y apoyo para lograr el objetivo de ser profesionales. 1. INTRODUCCIÓN La búsqueda de microorganismos importantes en la producción de metabolitos de interés industrial, ha conducido a los investigadores a realizar búsquedas en nuevas zonas poco estudiadas en gran mayoría aquellas con climas extremos, debido a la necesidad de mejorar el rendimiento, eficacia y el contrarrestar otros organismos que durante el paso del tiempo han ganado tolerancia a metabolitos ya existentes. Así mismo mediante la identificación de especies microbianas en estas zonas se pretende ampliar la gama de microorganismos conocidos, contribuyendo así al conocimiento de la biodiversidad de nuestro país, microbiota que puede ser capaz de producir metabolitos de interés industrial por consecuencia de interacciones microbianas o algún tipo de estrés ambiental. El páramo se ha considerado como una fuente muy importante en almacenamiento de recursos ambientales, pero así mismo en comparación con otras zonas de investigación, es poco el número de proyectos desarrollados en los mismos y es alta la taza de explotación y contaminación que se espera en unos años. Los sistemas de páramo juegan un papel importante como reguladores del recurso hídrico, albergue de un gran número de especies animales y vegetales, riqueza paisajística y procesos socioeconómicos del territorio colombiano. Conjuntamente en la actualidad los ecosistemas paramunos tienen una gran demanda de explotación para caracterizar microbiota y con esta investigación se pretende contribuir al estudio de la microbiología de suelos con el aislamiento e identificación de bacterias nativas del páramo de Cruz Verde y Guasca. 2. MARCO TEÓRICO 2.1. Suelo El termino suelo, que deriva del latín solum, y significa piso, puede definirse como la capa superior de la tierra que se distingue de la roca sólida y en donde las plantas crecen. Los suelos deben considerarse como formaciones geológicas naturales desarrolladas bajo condiciones muy diversas de clima y materiales de origen, lo cual justifica su continua evolución. El suelo independientemente de su origen tiene una función: soportar una vegetación y en él se deben dar las condiciones necesarias para el desarrollo de las plantas. Con una concepción fisiológica vegetal, el suelo se define como la mezcla de partículas sólidas pulverulentas, de agua y de aire que provee de los elementos nutritivos necesarios para las plantas (Forsythe, 2002).). El suelo posee carga negativa, esta propiedad física del suelo también esta relacionada con la densidad y el espacio entre partículas o porosidad, consecuentemente en relación con la microbiota, los rangos entre estas propiedades permiten una retención de nutrientes y la viabilidad para que los microorganismos los aprovechen (Ömer, et al. 2007). Se sabe que el suelo es el mayor hábitat de colonias bacterianas y en cualquier área de la industria las cepas microbianas en su gran mayoría son aisladas e identificadas del suelo, obviamente debido a la gran variabilidad de condiciones y ambientes que toleran (Shayne, et al. 2003). Actualmente se ha venido buscando la renovación del grupo de células manejadas en la industria con microorganismos poco comunes en su mayoría no cultivables, en consecuencia se han desarrollado y modificado técnicas y medios de cultivo con el fin de recuperar aquellos microorganismos (Shayne, et al. 2003). 2.1.1. Perfil del Suelo Básicamente el perfil del suelo comprende tres horizontes principales: El Horizonte A está formado por el suelo superficial y en él se encuentra la mayor parte de materia orgánica procedente de las raíces de las plantas y otros restos que son depositados sobre la superficie. Presenta un color oscuro debido a la materia orgánica presente (Merchan S, 2007). El Horizonte B constituye la capa intermedia y suele estar altamente meteorizado. De color más claro, en él se sitúan las raíces de los arbustos y árboles. El contenido en materia orgánica es mucho menor (Merchan S, 2007). El Horizonte C comprende la capa más profunda del perfil. Está formado por partículas de roca poco desmenuzadas y prácticamente sin actividad por parte de organismos vivos (Merchan S, 2007). 2.1.2. Textura del Suelo Independiente de los horizontes, los suelos contienen proporciones variables de arcilla, aluviones y partículas de arena. La proporción de estas partículas de diferente tamaño constituye la textura del suelo, la cual es una propiedad importante para la ecología de los microorganismos, ya que determina el área de la superficie disponible como hábitat para el crecimiento de los microorganismos. Los suelos con mayor composición en arcilla tienen una mayor área de superficie disponible que aquellos en los que predomina la concentración de granos de arena, cuyo tamaño es mucho mayor que el de las partículas de arcilla (Atlas y Bartha, 2002) 2.1.3. Componente suelo En la mayoría de los suelos el reservorio principal de nutrientes se encuentra presente en los compartimentos de la materia orgánica y en el suelo mineral, con solamente una pequeña cantidad disponible para las plantas en un corto tiempo (en los nutrientes cambiables/extractables y en la solución del suelo) (Navarro y Navarro, 2000). La materia orgánica del suelo es heterogénea con respecto a la actividad biológica y la biomasa microbiana por si misma representa una fuente significativa de nutrientes. Así, son importantes los grupos de bacterias nitrificantes, los hongos y las bacterias solubilizadoras de fósforo y las interacciones micorrizas vesículo-arbusculares que permite al ecosistema aumentar la eficiencia de la captación de algunos de los nutrientes, necesarios para el crecimiento de las plantas (Cárdenas y Moreno, 1993). 2.1.4. Microorganismos del suelo Los microorganismos del suelo representan la mayor proporción de uso a nivel industrial, la comunidad edáfica dependen del conjunto de nutrientes en el ecosistema pero pueden ser considerados como el principal agente transformador en el movimiento de los nutrientes a través del suelo y como una fuente productora de compuestos para las plantas durante sus ciclos de renovación (Duxbury, et al. 1989). El suelo contiene el más alto número de grupos filogenéticos existentes, aproximadamente hay > 10 9 células bacterianas por gramo de suelo, pero existe una gran problemática, no es cantidad de microorganismo, es la sensibilidad de una fracción de grupos bacterianos muy alterables al cambio de condiciones ambientales, el mas pequeño cambio climático y en respuesta dejan de producir metabolitos y enzimas muy importantes en el campo científico (Duxbury, et al. 1989) El suelo es generalmente un hábitat favorable para la proliferación de microorganismos y en las partículas que lo forman se desarrollan microcolonias. Típicamente en los hábitats del suelo se encuentran de 108 a 1010 bacterias por gramo de suelo. Los microorganismos aislados de suelo comprenden virus, bacterias, hongos, algas y protozoos. (Atlas y Bartha, 2002). La mayoría de la población bacteriana organotrófica aerobia de gran parte de los suelos está compuesta por géneros Gram Positivos. No sería correcto generalizar los porcentajes de varios grupos, pero no es extraño encontrar que hasta el 70% de la totalidad de los aislamientos bacterianos del suelo se clasifican dentro de las denominadas bacterias Gram positivas del género Arthrobacter sp, siendo la mayoría de la microflora restante Bacillus sp, y Microccus sp (Grant, 1989). La población Gram negativa generalmente está compuesta en su mayor parte por Pseudomonas sp. y Flavobacterium sp. Otros géneros relativamente frecuentes considerados nativos incluyen Acinetobacter sp, Agrobacterium sp., Alcaligenes sp. y Nocardia sp. (Grant, 1989) La variabilidad de las comunidades microbianas en el suelo dependen mayormente de la viabilidad par metabolizar una fuente de carbono, la disponibilidad de macro y micro elementos, el contenido de agua, el pH y el tamaño de las partículas. Cuando estas características se alternan se producen ambientes anaerobios, saturados o tóxicos según sea el nivel de presencia, hay es donde se encuentran especies bacterianas con propiedades metabólicas incomparables y procesos adaptativos regidos por componentes enzimáticos desconocidos (Hansel, et al. 2008). Muchos géneros de bacterias aisladas de climas extremos se han utilizado en biorremediación de hidrocarburos en diferentes tipos de terrenos, con un óptimo resultado frente a otros mecanismos físicos o químicos, más demorados, costosos o con residuos no tan tóxicos pero de difícil degradación. De estos géneros se han creado diferentes inóculos de variados tipos de microorganismos que interaccionan de forma más insuperable y cómodo control (Albert, 1996). 2.1.5. Muestreo del Suelo Se han desarrollado numerosos métodos con el objetivo de examinar cuantitativamente y cualitativamente las poblaciones microbianas en diversos ecosistemas (Hurst, et al.1997), para examinar microorganismos en sistemas naturales basándose en el número total de individuos, en el número de poblaciones especificas, o en sus actividades metabólicas, se han analizado submuestras representativas de los mismos y los resultados se han aplicado a la totalidad de la comunidad o del ecosistema (Board, et al. 1973). En muestreos de suelos en donde también importa la profundidad de las respectivas muestras se pueden introducir tubos en cinco áreas anteriormente seleccionadas basadas en el tipo de terreno, profundidad. (Albert, 1996) 2.2. Páramo Se denomina Páramo al ecosistema húmedo de los Andes tropicales. Sobre 3000m de altura excluyendo de esta definición las alturas de Perú y Bolivia, porque en ellas predomina la sequedad; Colombia posee así el 60% de los páramos del mundo, el resto lo comparten Venezuela y Ecuador (Guhl, 1982). Estos ecosistemas son de gran importancia como reservorio de agua y juegan un papel importante como albergue de un gran número de especies de animales, vegetales y cepas microbianas nativas (Bernal, 2006), (Chitiva, et. al. 2002). 2.2.1. Vegetación de los Páramos En los páramos la vegetación natural dominante está representada por: • Musgos: Entre estas especies se encuentran los musgos de la turba (Sphagnum spp) y el llantén de páramo (Plamtago rigida), característicos de zonas pantanosas. • Pajonales o Gramíneas: Están representados por la paja ratón (Callamagrostis), carrizo (Cortadeiras), frailejón (Espeletia spp), chite (Hypericum), vira-vira (Gnaphalium spp), chusque (Chusque spp), romero de páramo (Senecio spp), gaque (Clusia spp), y cardo (Puyas) • Arbóreas y arbustivas: Compuestas por mortiño (Hesperomeles spp), chilco (Baccharis spp), quiebra barriga (Pernettya spp), y encenillo (Weinmania spp). (Cárdenas, et al. 1993). Estas especies ayudan a la regulación y captación de agua proveniente de los procesos de condensación en ésta zona. La estructura y composición del subpáramo corresponden a un mosaico de formaciones arbustivas, que también cumple una función esencial de protección, mantenimiento y recarga de acuíferos (Cárdenas, et al. 1993). 2.2.2. Suelo de los Páramos En la mayor parte de los páramos de Colombia el material a partir del cual evolucionan los suelos son las cenizas volcánicas y como resultado se tiene la presencia de suelos de tipo Andisoles, aunque también se presentan Entisoles, Inceptisoles e Histosoles. Si bien existe una variada gama de suelos en los páramos colombianos, éstos se caracterizan por ser similares en sus propiedades morfológicas, físicas, químicas y mineralógicas (Malagón, et al. 2000). En general, son suelos con estructura de bloques finos y medianos, mediana a alta retención de humedad, porcentajes altos a muy altos de carbono orgánico, altos valores de CIC, baja cantidad de bases de cambio, altos contenidos de aluminio, escasos contenidos de fósforo disponible y marcada acidez (Malagón, et al. 2000). Las condiciones del suelo en el páramo incluyen: una escasa capa de hojarasca con grandes fracciones de suelo descubierto, con un horizonte A rico en humus que descansa sobre un horizonte C (de material parental) donde los organismos del suelo son muy escasos, determina la presencia de una comunidad edáfica localizada principalmente en el horizonte A (Cárdenas, et al. 1993). 2.3. Crecimiento Microbiano A nivel molecular las bacterias precisan de al menos 10 elementos para producción de hidratos de carbono, lípidos proteínas y ácidos nucleicos, otros elementos no son tan necesarios pero forman parte de enzimas y cofactores (Prescott, 2004). Las moléculas de nutrientes, con frecuencia no pueden atravesar por difusión pasiva las membranas plasmáticas selectivamente permeables. En este caso deben ser transportadas por uno de los tres mecanismos principales de transporte que comprenden la participación de proteínas transportadoras (Prescott, 2004) La célula bacteriana es esencialmente una máquina que es capaz de duplicarse a sí misma. Los procesos sintéticos del crecimiento celular bacteriano implican no menos de 2000 reacciones bioquímicas. Algunas de estas reacciones implican transformaciones de energía. Otras, implican la síntesis de pequeñas moléculas así como cofactores y coenzimas necesarios para las reacciones enzimáticas (Madigan, et al. 2000) En la mayoría de los procariotas, el crecimiento de una célula individual continua hasta que se divide en dos nuevas células, un proceso llamado fisión binaria (binario, para expresar el hecho de que se forma dos células a partir de una) (Madigan, et al. 2000). Pero también en el crecimiento microbiano hay un parámetro de gran importancia y es la relación entre microorganismos para favorecer o evitar la proliferación celular, por ejemplo la contribución entre especies bacterianas y fúngicas en la descomposición de sustratos en función de un ecosistema o contrariamente la interacción antagonista bacteriana frente a hongos, debido a su amplio rango de crecimiento y al mas alto índice de reducción y producción metabólica (Rousk, et al. 2008) 2.3.1. Efecto de la Temperatura En todo el mundo la diversidad de especies microbianas principalmente se debe a la variabilidad de temperaturas tanto a nivel geográfico, alteración humana o de estaciones ambientales; debido a esto el crecimiento a latencia de la célula depende del favorecimiento ambiental (Hansel, et al. 2008) La temperatura es unos de los factores ambientales más importantes que afecta al crecimiento y a la supervivencia microbiana. Puede afectar a los microorganismos vivos de dos formas muy diferentes. A medida que la temperatura sube, las reacciones enzimáticas son más rápidas y el crecimiento se hace más rápido. Sin embargo, por encima de una cierta temperatura, las proteínas, ácidos nucleicos y otros componentes celulares pueden dañarse irreversiblemente. Por encima de este punto las funciones celulares paran. Por tanto, para cada microorganismo existe una temperatura mínima por debajo de la cual no existe crecimiento, una temperatura optima a la cual el crecimiento es el más rápido posible y una temperatura máxima rebasada la cual no existe crecimiento. (Mandigan, et al. 2000) 2.3.1.1. Crecimiento Microbiano a Temperaturas Extremas Algunos aislamientos de grupos bacterianos en ambientes extremos se han podido llevar acabo modificando las temperaturas de incubación, de las manejadas comúnmente (35°C), existiendo cepas b acterianas tan sensibles a estos cambios de temperatura que son incapaces de recuperarse si no se cultivan a la temperatura exacta donde ellas crecían (Kathryn, et al. 2005) Existen cuatro grupos microbianos en relación con su temperatura óptima: psicrófilos, con temperaturas óptimas bajas, mesófilos con temperaturas óptimas medianas, termófilos con temperaturas óptimas más altas e hipertermófilos con temperaturas muy altas (Mandigan, et al. 2000) Los psicrófilos son los microorganismos de interés en este estudio, son aquellos que son capaces de crecer con una temperatura óptima de crecimiento de 15 ºC o más bajo, una máxima por debajo de 20 ºC y una mínima de 0 ºC o menor. Los psicrófilos se encuentran en ambientes permanentemente fríos y mueren rápidamente si se exponen a temperatura ambiente (Mandigan, et al. 2000). Los psicrófilos producen enzimas que funcionan óptimamente en frío y que se desnaturalizan rápidamente a temperaturas moderadas. Otras características de los psicrofilos si se compara con los mesófilos, es que a bajas temperaturas tienen lugar procesos de trasporte activo, lo que es una clara indicación de que la membrana de estos microorganismos es de distinta naturaleza, pues a bajas temperaturas pueden seguir llevando a cabo su función. Sus membranas contienen una mayor proporción de ácidos grasos insaturados lo que ayuda a mantener el estado semifluido de la membrana a bajas temperaturas. (Mandigan, et al. 2000) 2.3.2. Acidez y Alcalinidad La acidez o alcalinidad de un medio influye sobre el crecimiento microbiano. Algunos microorganismos se desarrollan mejor a pH alto 9-14 alcalinófilos, mientras que otros a pH bajo 5-2 acidófilos, estos rangos pueden variar debido a la adaptabilidad de muchas cepas. Aquellos microorganismos que crecen a rangos de pH de 6-8 se llaman neutrófilo; hay que tener en cuenta que el pH intracelular debe permanecer próximo a la neutralidad, aunque el pH externo sea altamente ácido o básico. En muchos casos el microorganismo como consecuencia de su metabolismo crea un gradiente extracelular de iones OH- o H+ (Rico, 2004). Cada organismo tiene un rango de pH dentro del cual es posible el crecimiento y normalmente posee un pH óptimo muy bien definido. La mayoría de los ambientes naturales tienen valores de pH de 5,9 y los organismos con pH óptimo equivalente son los habituales. Solo unas pocas especies pueden crecer a pH inferior a 2 o mayor a 10. Los que crecen a pH bajos se llaman acidófilos y por el contrario los que crecen a pH altos se llaman alcalófilos (Mandigan, et al. 2000) 2.3.3. Oxígeno Como elemento constituyente, también es requerimiento para la respiración aeróbica para cubrir sus necesidades energéticas y para ello el oxigeno funciona como agente oxidante terminal, organismos denominados aerobios estrictos (Stanier, 1992). Los organismos que carecen de sistemas respiratorios no pueden utilizar el oxígeno como aceptor termina de electrones. Tales organismos se llaman anaerobios, pero existen dos clases de anaerobios: los anaerobios aerotolerante, que pueden tolerar el oxígeno y crecer en su presencia aún cuando no pueden utilizarlo como por ejemplo las bacterias ácido lácticas, q poseen un metabolismo productor de energía que es exclusivamente fermentativo y los anaerobios estrictos que mueren en presencia del oxígeno (Mandigan, et al. 2000) (Stanier, 1992). 2.4. Identificación Bioquímica Una especie bacteriana es una colección de cepas que comparten características comunes. El metabolismo bacteriano es un equilibrio dinámico entre biosíntesis (reacciones anabólicas) y degradación (reacciones catabólicas). La reacciones catabólicas además de proveer las unidades más pequeñas para los procesos biosintéticos posteriores, provee la energía “para manejar” las reacciones biosintéticas (Koneman, 2001). En este proceso, la energía proviene de la hidrólisis de uniones químicas es capturada de las uniones fosfato de alta energía del adenosintrifosfato (ATP). Estas uniones suministran la energía para la activación y la continuación de otros elementos bioquímicos. Así mismo requieren de la polimerización de proteínas, ácidos nucleicos, polisacáridos y lípidos (Rico, 2004). Los anteriores elementos deben encontrarse preformados en el medio donde se encuentra el microorganismo o deben ser sintetizados por la propia célula (Rico, 2004) La capacidad de un microorganismo dado para producir ácido a partir de una variedad de carbohidratos (p. ej., maltosa, sacarosa, manitol, manosa, etc.) refleja la capacidad enzimática de estos microorganismos para convertir inicialmente estos carbohidratos en glucosa, que es el punto de partida tanto para el metabolismo aeróbico de los carbohidratos como el anaeróbico (Koneman, 2001). En general muchas pruebas empleadas en microbiología involucran la detección de productos finales del metabolismo bacteriano en medios de cultivo líquido agotados, tanto por medio de indicadores de pH presentes en el medio como por cromatografía gas líquido (Prescott, 2004). Las pruebas bioquímicas consisten en distintos test químicos aplicados a medios biológicos, los cuales, conocida su reacción, permite identificar distintos microorganismos presentes. Su sistema de funcionamiento generalmente consiste en determinar la actividad de una vía metabólica a partir de un sustrato que se incorpora en un medio de cultivo y que la bacteria al crecer incorpora o no (Mandigan, et al. 2000). Existen gran cantidad de bioquímicas usadas para la identificación bacteriana, las utilizadas en esta investigación fueron las siguientes: 2.4.1. Prueba de Voges Proskauer La prueba Voges-Proskauer se basa en la producción de acetilmetilcarbinol o acetoína, un producto final neutro derivado del metabolismo de la glucosa, que al reaccionar con los indicadores produce un color rojo; se emplea para diferenciar especies de Bacillus y bacterias entéricas (Prescott, 2004). La glucosa es metabolizada a ácido pirúvico, el principal intermediario en la glucólisis. A partir del ácido pirúvico, las bacterias pueden seguir muchos caminos metabólicos; la producción de acetoína es una de las vías metabólicas de la degradación de la glucosa en las bacterias (Koneman, 2001) El primer reactivo agregado es el catalizador α-naftol, este actúa como intensificador del color, lo que incrementa la sensibilidad de la reacción sin pérdida de la especificidad. El segundo reactivo es el KOH al 40%, el cual ayuda a la absorción de CO2 en el medio (MacFaddin, 2003) La prueba positiva muestra un color rosado-rojo en la superficie del medio (acetoína presente) y en una prueba negativa se observa un color amarillo en la superficie del medio (anexo 1) (MacFaddin, 2003) 2.4.2. Prueba Rojo de Metilo Es una prueba cuantitativa basada en el uso de un indicador de pH, el rojo de metilo, para determinar la concentración del ion hidrógeno cuando un microorganismo fermenta la glucosa (Koneman, 2001). La validez de la prueba rojo de metilo depende de una incubación prolongada para permitir que ocurra la diferencia en el metabolismo de la glucosa (MacFaddin, 2003). Para una prueba positiva el cultivo es suficientemente ácido para permitir que el reactivo rojo de metilo permanezca con un color distintivo rojo brillante, mientras que en una prueba negativa se observa un color amarillo en la superficie (anexo 1) (MacFaddin, 2003). 2.4.3. Prueba LIA (Descarboxilación Lisina) La descarboxilación es el proceso por el cual las bacterias que poseen enzimas descarboxilasas específicas atacan los aminoácidos en su carboxilo terminal (COOH) para formar amina o una diamina y dióxido de carbono (Prescott, 2004). El aminoácido L-lisina es descarboxilado para formar cadaverina (una diamina) y dióxido de carbono por la acción de la enzima específica lisina descarboxilasa. El aminoácido L-ornitina es descarboxilado por la enzima ornitina descarboxilasa para formar la diamina putrescina y dióxido de carbono. El aminoácido L-arginina es catabolizado por medio de dos sistemas que pueden ocurrir de manera simultánea o separada. Estas dos vías metabólicas son el sistema de la arginina dihidrolasa y el sistema de la arginina descarboxilasa (MacFaddin, 2003). También se utiliza el componente citrato amónico férrico para la detección en la producción de H2S (Prescott, 2004). En la prueba positiva se observa un color púrpura turbio a amarillo apagado (el microorganismo produjo cadaverina) y una prueba negativa se ve un color amarillo brillante, claro (el microorganismo solo fermentó la glucosa) (MacFaddin, 2003). 2.4.4. Hidrólisis de Almidón El almidón es un homopolisacárido; la estructura básica del almidón es una mezcla de dos moléculas de polisacárido poliglucosa: amilosa lineal y amilopectina ramificada (Prescott, 2004). Las amilasas son enzimas que catalizan la hidrólisis de 1,4 α - D – Glucanos como el almidón y glucógeno generando dos moles de glucosa (Pedroza, 1999). Para observar la actividad enzimática se utiliza el agar almidón que es fundamental por el contenido de almidón que se encuentra disponible, el cloruro de sodio encontrado en este agar es de vital importancia pues las α amilasas al ser metaloenzimas requieren de calcio para su estabilidad y su actividad (Serrano, 1990) (Wulf, 1993). Como reactivo se utiliza el lugol, el yodo contenido en el lugol (YodatoYoduro) se une a los enlaces α 1-4 del almidón generando una coloración azul-negro mientras que los sitios en que se genera hidrólisis permaneces incoloras poniendo en evidencia a las colonias de acción amilolítica (Serrano, 1990). 2.4.5. Prueba SIM (Producción de sulfuro de Hidrógeno) Esta prueba tiene tres própositos: 1. Determinar si la bacteria a través de Triptofanasas puede degradar el Triptófano a indol. 2. Determinar si hay producción de azufrados. 3. Determinar si la bacteria es móvil. H2S a partir de aminoácidos La presencia de anillo rojo muestra la presencia de indol, es decir, el triptófano fue degradado, presencia de un precipitado negro muestra la producción de H2S y movilidad difuminación de la bacteria hacia los lados (Prescott, 2004). 2.4.6. Prueba TSI (Agar con azúcar triple y hierro) El agar TSI es un medio de cultivo diferencial. Para la determinación de fermentaciones de tres hidratos de carbono (glucosa, lactosa y sacarosa), la producción de CO2 al fermentar los hidratos de carbono y la determinación de la producción de H2S. Además contiene sulfato amónico ferroso y tiosulfato sódico (Prescott, 2004). La fermentación tiene lugar tanto en aerobiosis como anaerobiosis. El monosacárido glucosa es catabolizado inicialmente por la vía metabólica anaerobia de Embden-Meyerhof-Parnas, usada por aerobios y anaerobios para producir el intermediario clave ácido pirúvico. El ácido pirúvico es degradado luego a través del ciclo de Krebs por aerobio o anaerobios facultativos para rendir CO2, H2O y energía (Koneman, 2001). Se emplea para identificar los microorganismos entéricos por su capacidad de fermentar la glucosa, la lactosa o la sacarosa, y liberar sulfuros de sulfato amónico o del tiosulfato sódico (Prescott, 2004). 2.4.7. Prueba Citocromo Oxidasa Los citocromos son hemoproteínas que transportan electrones, normalmente como componentes de la cadena transportadora de electrones (Prescott, 2004). La prueba de oxidasa se basa en la producción bacteriana de una enzima oxidasa intracelular. Esta reacción de oxidasa se debe a un sistema de citocromo oxidasa que activa la oxidación del citocromo reducido por el oxígeno molecular, el que a su vez actúa como un aceptor de electrones de la fase terminal del sistema de transferencia de electrones (Koneman, 2001). El sistema citocromo, por lo común presente sólo en los microorganismos aerobios, permite a éstos utilizar el oxígeno como aceptor final de hidrógeno para reducir el oxígeno molecular a peróxido de hidrógeno (Koneman, 2001). 2.4.8. Prueba de Citrato El citrato de sodio es una sal del ácido cítrico en el ciclo de los ácidos tricarboxilicos, esta prueba determina si este producto es usado como única fuente de carbono, por lo tanto el medio utilizado no debe tener proteínas e hidratos de carbono como fuentes de carbono. Se detecta por la producción de subproductos alcalinos, puesto que el citrato de sodio es un anión, la única fuente de nitrógeno es el fosfato de amonio que puede convertirse en amoniaco produciendo hidróxido de amonio (NH4OH) (Koneman, 2001). En medio citrato de Simmons si se observa un intenso color azul en el pico de flauta la prueba es positiva y si el medio conserva el mismo color inicial (verde) la prueba es negativa (anexo 1) (MacFaddin, 2003). 2.4.9. Prueba de Ureasa El sustrato urea, una diamina del ácido carbónico, a menudo se designa como una carbamida. Todas las amidas son hidrolizadas con facilidad (MacFaddin, 2003). Los microorganismos que poseen la enzima especifica ureasa hidrolizan la urea, con la cual se libera moléculas de amonio como producto final, virando a rojo violeta el indicador rojo de fenol (anaxo1) (Koneman, 2001). Al desdoblar la urea en amoniaco también hay liberación de CO2, se utiliza para diferenciar géneros como: Proteus, Klebsiella pneumoniae y bacterias entéricas (Prescott, 2004). 2.4.10. Reducción de nitratos La reducción de nitrato (NO3) a nitrito (NO2) y a nitrógeno gaseoso (N2) por lo común se produce en condiciones de anaerobiosis, en las cuales en un microorganismo produce su oxígeno del nitrato. El oxígeno actúa como un aceptor de hidrógeno, es decir, el protón y el aceptor final de electrones (MacFaddin, 2003). La prueba para la presencia de nitritos en el medio, se realiza añadiendo en cada tubo 0.5 ml de reactivo de Griess, y se observa un color: una prueba positiva color rojo, una prueba negativa incoloro; si no se observa cambio de color se adicionara una pequeña cantidad de polvo de zinc y si presenta una coloración se informará como negativo, si no presenta cambio será positiva (anexo 1) (Carrascal, 2003). Las posibilidades del producto final en la reducción del nitrato son muchas: nitrito, amoniaco, nitrógeno molecular, óxido nítrico, óxido nitroso o hidroxilamina. El producto formado depende de la especie bacteriana (MacFaddin, 2003). 2.4.11. Prueba de Catalasa La catalasa es una enzima que descompone el peróxido de hidrogeno (H2O2) en agua y oxígeno (anexo 1). Es una hemoproteína similar a la hemoglobina excepto que sus cuatro átomos de hierro están en estado oxidado, debido a que el peróxido de hidrógeno se forma como producto final de la oxidación en el metabolismo aerobio de hidratos de carbono, si se acumula resulta letal para la célula, se utiliza en la diferenciación de Streptococcus (-) de Staphylococcus (+) y Bacillus (+) de Clostridium (-) (Koneman, 2001) (Prescott, 2004). 2.4.12. Licuefacción de Gelatina La gelatina es una proteína derivada del colágeno animal, ésta se siembra a diferentes medios de cultivo para determinar la capacidad de un microorganismo de producir enzimas proteolíticas, detectadas por digestión o licuefacción de la gelatina (MacFaddin, 2003). En la prueba de la licuefacción de la gelatina, la gelatina se siembra previamente y se lleva a incubar por 24 horas a 35°C, su lectura se realiza visualizando un cambio en la consistencia dura de la gelatina, por una consistencia liquida, lo que indicara una licuefacción. Es importante destacar que la gelatina a 35°C es liquida, por lo que es necesario enfriar las bioquímicas en el chorro de agua fría para evitar falsos positivos (Carrascal, 2003). 2.4.13. Pruebas de fermentación de Hidratos de Carbono Los hidratos de carbono están formados por carbono, hidrogeno y oxigeno. Se clasifican en: monosacáridos, aldehídos polhidroxilados o cetonas; en polisacáridos u oligosacáridos y en alcoholes polihídricos y ciclitoles. A partir de ellos se obtiene energía, también realizan funciones de reserva energética (glucógeno) y estructurales como la celulosa (Salve, 1997). Un monosacárido o azúcar simple por lo común contiene entre 1 y 6 átomos de carbono; la eritrosa es un azúcar de 4 carbonos (C4H8O4); la ribosa, ribulosa, xilosa y arabinosa son azúcares de 5 carbonos(C5H10O5) y la glucosa, la fructosa, la galactosa y la manosa son azúcares de 6 carbonos (C6H12O6) (MacFaddin, 2003). para todos los procesos fermentativos de los hidratos de carbono, se toma una colonia a examinar y se adicionara en un tubo con la azúcar a investigar, una coloración amarilla indicara la fermentación del azúcar por este microorganismo y se informara como positivo, sino se presenta cambio será negativo, para la fermentación, en el proceso fermentativo hay producción de ácidos que bajan el pH del medio, existiendo una variación en el color dada por el indicador de pH rojo de fenol (Carrascal, 2003). 2.4. Bioconservación A medida que la biotecnología avanza en todos los esquemas de la innovación moderna en cualquier trabajo que implique el uso de los microorganismos, es deseable contar con una fuente pura y viable del agente de interés, ya que es posible afrontar problemas de pureza y viabilidad de las cepas así como de pérdida de microorganismos por el simple hecho de no contar con copias adicionales del mismo. Debido a estas problemáticas se trataron e investigaron tres métodos de conservación: mediante glicerol al 20%, sensidiscos y en suelo estéril directo bajo congelación (Garcia, 1999) (Leveau, 2000). Así mismo las cepas bajo técnicas de conservación, son utilizadas en el futuro después de varios años, estas técnicas de conservación han permitido a los científicos, utilizar cepas cultivadas varios años atrás con nuevas técnicas mejorando el rendimiento y permitiendo obtener nuevos metabolitos y actividades benéficas (Garcia, 1999) (Leveau, 2000). El aislamiento e identificación de un microorganismo ideal para un proceso industrial puede ser un proceso largo y costoso y es esencial que los microorganismos seleccionados mantengan sus propiedades a lo largo del tiempo, sin sufrir contaminaciones cruzadas que impidan o modifique el crecimiento óptimo de la cepa. Los procedimientos de conservación utilizados para cepas bacterianas, fueron debidamente seleccionados con el fin de evitar: • Evitar las mutaciones genéticas o alteración metabólica. • Evitar que se produzcan contaminaciones y muerte por metabolismos antagónicos. • Conservar intacta su viabilidad y mantener intacta las baterías enzimáticas. Así mismo los bancos de conservación permiten tener reservas, dado algún imprevisto. Por otro lado permiten tener una base de microorganismos puros si se desea ampliar el banco de conservación. (García, 1999) (Leveau, 2000) Para conservar correctamente las cepas microbianas en los laboratorios de microbiología es necesario: que el cultivo a conservar sea puro, evitando que se produzcan contaminaciones durante el proceso de conservación; que durante el tiempo de conservación sobrevivan al menos el 70-80% de las células, y por último, que estas células permanezcan genéticamente estables (García, 1999). El propósito de una colección es el de mantener el material biológico en un estado viable y estable que retenga todas las propiedades originales, es necesario mantener cepas confiables utilizando técnicas apropiadas de conservación que eviten variabilidad genética (Sánchez, 2005). 3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 3.1 Formulación del problema: El suelo localizado en zonas poco óptimas para el crecimiento bacteriano no ha sido adecuadamente estudiado y la poca caracterización de especies bacterianas en suelos paramunos produce un limitante en información, potencial y beneficios a la hora de buscar nuevas cepas productoras de metabolitos como vacunas, primes, antifúngicos, biocidas y bioestáticos, entomopatógenos, biocontroladores, capaces de reemplazar los biocompuestos tradicionales. Muchas de las cepas bacterianas aisladas y conservadas en colecciones, pierden características metabólicas y estructurales significativas debido al constante agravio al que son enfrentadas en diversos estudios; así mismo se ha visto que diversos métodos de conservación interfieren con la viabilidad de una cepa. Estas causas interfieren gravemente con el desarrollo en investigaciones en diversos campos de la ciencia al ver reducido el rendimiento en producción industrial. 3.2 Justificación: Años atrás se trabajaba con un grupo de microorganismos muy limitado; debido a la falta de preocupación por innovar; actualmente se busca nuevos microorganismos que remplacen y mejoren las propiedades con las cuales se trabajan actualmente. En el transcurso de estos últimos años, la visión científica microbiológica se ha centrado en caracterizar microorganismos en ambientes extremos, donde la mano del hombre no haya interferido con estos microcosmos. Los científicos han reconocido cada vez más que los microorganismos ocupan una posición clave en el flujo ordenado de materiales y energía a través del ecosistema global, en virtud de sus capacidades metabólicas. Consecuentemente en el transcurso del tiempo se han venido modificando ciertas sustancias para disminuir su toxicidad, pero aun así existen y se producen muchas más contaminantes, de las cuales el ambiente no está habituado y por ello se ha incursionado en la búsqueda de cepas las cuales podrían dar nuevas pautas en biorremediación. Así mismo la constante demanda de nuevos medicamentos y compuestos con mayor espectro, duración, economía de producción y menor toxicidad para otros organismos y el ambiente, ha repercutido en la búsqueda de microorganismos que no han sido caracterizados y son productores. Los microorganismos más útiles en distintos campos han sido aislados de los más diversos y extremos ambientes, debido a su adaptabilidad a condiciones adversas. El páramo un ambiente extremo y una zona poco explorada en este país, se ha considerado como una de las áreas de las cuales se encuentra gran biodiversidad y donde se van adquiriendo novedosas cepas tanto de hongos como de bacterias debido a las bajas temperaturas, poca disponibilidad de luz solar y anaerobiosis por saturación de agua en el suelo. Otra cualidad interesante en este tipo de zonas es la marcada transformación causada por el hombre, extinguiendo cepas nativas, conjuntamente con la intervención por la mano del hombre, viene la contaminación del suelo, la atmosfera y las corrientes acuíferas, modificando ampliamente el nicho ecológico en el cual las cepas ya están adaptadas. En consecuencia a la persistente contaminación en el ambiente de diversos productos y restos químicos que son utilizados diariamente, se ha dado a los microorganismos un papel crucial en la solución de estos problemas ambientales y económicos. 4. OBJETIVOS 4.1. Objetivo General: Aislar e identificar cepas bacterianas nativas del suelo de los páramos Cruz Verde y Guasca. 4.2 Objetivos Específicos: • Utilizar diferentes métodos de muestreo en suelo, para determinar aquel que ofrezca mejores condiciones de trabajo, mayor conservación de condiciones y número de cepas bacterianas aisladas. • Identificar mediante estudios en cultivos selectivos, procesos bioquímicos y observaciones morfológicas a nivel micro y macroscópico, la microbiota de los páramos Cruz Verde y Guasca que ha sido recuperada. • Seguir una cadena de procedimientos que nos permitan caracterizar de manera rápida y concisa diferentes grupos de bacterias, presentando resultados verídicos. • Elaborar un banco de cepas bacterianas a base de la microbiota nativa obtenida del suelo del páramo Cruz Verde y Guasca, con el fin de tener varias cepas en excelentes condiciones para futuros estudios en diferentes campos de la investigación. 5. METODOLOGÍA 5.1. Recolección de muestras No hay un método único de toma de muestras, debido a la diversidad de ambientes naturales y los distintos objetivos del análisis. El recorrido a efectuar en la toma de muestra es de acuerdo a alguno de los siguientes esquemas: Figura 1. Recorrido en toma de muestras en suelo. Fuente: Atlas M. 2002 Cuando se toman muestras de suelo, no se suelen utilizar técnicas asépticas sino que de forma pragmática se recurre a una pala y a un cubo; la gran abundancia de microorganismos en el suelo relativiza la acción de posibles contaminaciones procedentes del aire o de recipientes no estériles (Atlas y Bartha, 2002). Si se desea obtener una muestra de suelo de una profundidad determinada, se usa un muestreador cilíndrico (corer) para suelos, (Ver figura 1) que está formado por un tubo hueco de funcionamiento manual o dirigido por un motor, con un borde cortante y afilado (Atlas y Bartha, 2002). Figura 2. Barrenos Fuente: Atlas y Bartha, 2002 El muestreo de microorganismos presentes en el suelo es un número relativamente bajo puede requerir el uso de atrayentes o cebos. En muchos casos, es suficiente con ofrecer una superficie que concentrará, por absorción, los nutrientes disueltos que se encuentran de forma natural (Atlas y Bartha, 2002). La técnica de Cholodny-Rossi del portaobjetos enterrado se usa frecuentemente en la recogida y recuento directo de microorganismos de suelo y sedimentos. En esta técnica se implanta en el suelo o el sedimento un portaobjetos (Navarro y Navarro, 2000). Se supone que la superficie limpia del portaobjetos no es selectiva y actúa como la superficie de las partículas minerales presentes en el suelo. Por tanto los tipos de organismos que se adhieren a dicha superficie, así como su proporción, se pueden considerar representativos de la comunidad (Navarro y Navarro, 2000). El estudio de los valores como factor ambiental es muy importante, por su interferencia en el modo de crecimiento en bacterias (rango óptimo de crecimiento); debido a la variabilidad de condiciones dentro del laboratorio se espera conservar el entorno de desarrollo de los páramos de Cruz de Verde y Guasca. 5.2. Procesamiento de las muestras 5.2.2. Técnicas de Aislamiento: 5.2.2.1. Lavado del suelo: Elaborar un aparato lavador modificando el descrito por Valencia (1979), el cual consta de dos embudos buzchner de 5cm de diámetro. En el extremo superior colocar el primer embudo con un tapón de caucho conectado a una manguera de entrada de agua contenida en un galón. Dicho embudo a su vez se acopla por su extremo inferior al segundo embudo que contiene papel de filtro para reducir el tamaño del poro. Este último se acondiciona a un recipiente de vidrio para recoger el agua del proceso (Chitiva, et al 2002) (Hamaki T. et al. 2005). Los tapones de caucho, son perforados introduciendo varillas de vidrio que faciliten la entrada de aire para permitir la circulación de agua. Tomar 20 g de suelo previamente cernido por tamiz de 2mm y colocar en el aparato lavador. Las partículas de suelo lavadas se toman del segundo embudo y se secan sobre el papel de filtro en una caja de Petri, para luego transferir partículas sobre las placas de agar (Chitiva, et al 2002) (Hamaki T. et al. 2005). Se manejaron dos medios de cultivo agar nutritivo y agar extracto de suelo preparado según la metodología descrita (Hamaki T. et al. 2005) 5.2.2.2. Técnica de Placa de Conteo de Warcup: Es el método más empleado para el aislamiento de microorganismos de crecimiento rápido, por el método de diluciones seriadas (Valencia, 1979). Con esta técnica se pretende recuperar la población bacteriana viable y cultivable. A partir de cada dilución sembrar de forma masiva por triplicado en los medios de cultivo seleccionados para el aislamiento de bacterias obtenidas a partir de suelo. Incubar a 32ºC por 48 horas (Camacho y Hernández, 2002). 5.2.2.3. Técnica de Cultivo Líquido: Esta técnica se utiliza con el fin de proporcionar a las bacterias presentes en el suelo un medio de preenriquecimiento con los nutrientes y las condiciones necesarias para su recuperación (García y Ordoñez, 2003). Tomar 10 gramos de cada muestra de suelo y adicionar a erlenmeyers con 90 mL de caldo tripticasa de soya. Incubar a 32 ºC por 18 horas. A partir de cada muestra realizar siembra masiva por triplicado en los medios establecidos para el aislamiento, incubar a 32 ºC por 48 horas (García y Ordoñez, 2003). 5.3. Identificación bacteriana 5.3.1. Identificación microscópica y macroscópica: realizar coloración Gram para determinar la morfología de las bacterias aisladas, conjuntamente realizar medidas y tomar fotografías, para comparación y registro de características en su crecimiento (morfología de colonia, pigmentación, tipo de borde y tamaño). 5.3.2. Identificación bioquímica: Realizar pruebas de Oxidasa, Catalasa, Citrato, SIM (H2S, Indol, Motilidad), LIA (Lisina, Hierro Agar), TSI (Triple Azúcar Hierro), OF (Oxidación-Fermentación), Voges Proskauer, Rojo de Metilo, Nitratos, Urea, Gelatina, Almidón, Gelatina, Glucosa, Sacarosa, Maltosa, Manosa, Manitol, Fructosa, Celobiosa, Celulosa, Melobiosa, Sorbitol, Inositol, Sucrosa, Ramnosa, Xilosa, Galactosa, Lactosa; para microorganismos aislados. determinar el metabolismo de los Finalmente sembrar los microorganismos identificados en medios específicos como método confirmatorio y distintivo par los diferentes géneros (Camacho y Hernández, 2002). 5.4. Conservación de cepas 5.4.1. Métodos de conservación Los métodos más utilizados en las diferentes colecciones a nivel mundial son: 5.4.1.1. Conservación en aceite mineral: Sembrar las cepas en cajas de petri con Medio Agar Nutritivo, incubar a 35ºC hasta alcanzar un óptimo crecimiento, posteriormente hacer coloración Gram para confirmar la pureza de la cepa y repiques en viales con el mismo medio de cultivo, incubar a 35ºC hasta obtener un crecimiento abundante. Finalmente agregar a cada vial 3 ml de aceite mineral estéril para inhibir la actividad metabólica del microorganismo y sellar con tapón de caucho y agrafe de aluminio (Corredor, 2002) 5.4.1.2. Conservación por suspensión en agua destilada: Es un método alternativo muy utilizado y que da altos porcentajes de viabilidad en diversos tipos de microorganismos, tanto hongos filamentosos como levaduras y algunas bacterias. Consiste en suspender en agua estéril unas cuantas células del cultivo que se quiere conservar. Se pueden preparar en criotubos de los anteriormente mencionados. En este caso la concentración celular no debe ser superior a 104-105 células/ml en el caso de bacterias y levaduras. (García y Uruburu, 2000) 5.4.1.3. Conservación en suelo estéril: Es una técnica que ha sido ampliamente usada en laboratorios industriales para el mantenimiento de cultivos de importancia comercial. Este método es usado para cultivos que producen esporas y estructuras de resistencia; las cepas pueden almacenarse en diferentes substratos como arena, papel filtro o perlas de vidrio. El método consiste en esterilizar y secar el suelo el cual es utilizado como medio absorbente para una pequeña cantidad de inoculo (Abreu et al, 2003). 5.4.1.4. Conservación en sílica gel: El método consiste en llenar frascos de vidrio con una malla de granos lisos de sílica y luego colocarlos en bandejas con agua, se llevan a congelar a -20ºC, luego se prepara una suspensión de esporas en leche descremada al 5% (p/v), se adiciona la suspensión a la sílica enfriada se agita y se distribuye la suspensión de esporas; los frasco se deben incubar de 10 – 14 días a 25ºC hasta que los cristales de sílica gel se sequen y se separen, luego se almacenan a 4ºC en contenedores cerrados (Abreu et al, 2003). 5.4.1.5. Conservación por Liofilización: Es un proceso suave con la pared celular, mediante el cual se elimina el agua por medio de desecación al vacio, mediante efecto de sublimación del hielo alrededor de las células; primero se congela el agua libre de las células y después se elimina mediante el vacío, sin que haya necesidad de subir la temperatura, es este paso el mas critico debido a un incremento en las presiones dentro y fuera del microorganismos. La estabilidad genética es alta en comparación con otros procesos que utilizan compuestos alteradores de enzimas (García y Uruburu, 2000) (Abreu et al, 2003). 5.4.1.6. La criopreservación: Es un proceso de almacenamiento no letal de material biológico de células, tejidos u órganos a ultras–bajas temperaturas generalmente entre -80°C y -196 °C (el punto de congelación del nitrógeno líquido). A esas temperaturas, cualquier actividad biológica que pudieran producir la muerte de una célula, quedan efectivamente detenidas (Corredor, 2002). 5.4.1.7. Conservación por desecación en papel de filtro: Se utiliza un papel absorbente (Whatman nº 3) que se impregna con una solución concentrada de células y se deja secar al aire (en condiciones estériles) (García y Uruburu, 2000). También es posible desecarlos por el procedimiento que se llama desecación líquida (L-Dry) porque se utiliza para ello el liofilizador, pero sin que haya habido congelación previa de las células. El vacío producido por el liofilizador deseca las células, pero hay que evitar que un vacío excesivo provoque evaporación brusca con ebullición o que la temperatura disminuya demasiado, ocasionando incontrolada de las células (García y Uruburu, 2000). la congelación 6. EXPERIMENTACIÓN 6.1. Reconocimiento de la zona El área de muestreo corresponde a la zona del páramo de Cruz Verde (departamento de Cundinamarca), en la vereda de San Francisco a 17 Km de Bogotá, vía Choachí (4°36’latitud Norte y 74° 00’ longitud Oeste). El uso actual de la tierra es principalmente el cultivo de papa y el levantamiento de ganado de doble propósito. Los suelos corresponden a inceptisoles que se han desarrollado a partir de cenizas volcánicas depositadas sobre arcillas (Jaimes y Sarmiento, 2002). La precipitación promedio anual es de 1254 mm y presenta un régimen monomodal de lluvias, con una estación lluviosa entre los meses de marzo a diciembre y un corto periodo seco entre los meses de enero y febrero. La temperatura media anual es de 8,4ºC y varía mensualmente entre 6 a 10ºC (Jaimes y Sarmiento, 2002). La humedad relativa permanece durante todo el año por encima de 80% y presenta un promedio de 91,7%. La vegetación natural consiste en la comunidad de Espeletia grandiflora y Calamagrostis fusa (Jaimes y Sarmiento, 2002). Por otro lado la zona del páramo de Guasca se encuentra a 40 Km al noroeste de Bogotá en el municipio de Guasca- Cundinamarca con una altitud de 3000-350m (IGAC, 1984). El suelo del páramo Guasca presenta una textura dominante tipo franco arenoso-orgánica y franco orgánica; estructura de granular a fina; consistencia en húmedo friable a muy fiable; permeabilidad rápida (IGAC, 1984). 6.2. Recolección de muestras Se realizaron dos muestreos correspondientes a los meses de Agosto y Septiembre; basados en la norma ICONTEC NTC 4113-6. Se realizó una inspección del área para determinar los puntos de muestreos, a partir de estos se escogió un punto central, se demarco con lana un cuadrado de 25 m2 y se tomaron 5 submuestras en forma de X, (figura 3) éstas fueron mezcladas con el fin de obtener una muestra compuesta representativa de cada cuadrante. Figura 3. Mapa de cuadrantes de muestreo. Fuente: Autores. En el primer muestreo se utilizaron los siguientes métodos: Cajas rodac con medio Nutritivo (Figura 4), extracción de suelo con el uso de palas (Figura 5) y perforación por medio del barreno (Figura 6) con el fin de comparar el mejor método de muestreo. Figura 4. Toma de muestras con Cajas Rodac. Fuente: Autores. Posteriormente se determinó que el mejor método de muestreo era la perforación con el uso el barreno, y por tanto para el segundo muestreo solo se utilizó el método mencionado anteriormente. Las muestras tomadas con el barreno y las palas, se transportaron en bolsas resellables y en nevera manteniendo una temperatura constante de 4 ºC (figura 7). En cada muestreo se midió la temperatura ambiental y del suelo. Figura 5. Toma de muestras con Pala. Fuente: Autores. Figura 6. Toma de muestras con Barreno. Fuente: Autores. Figura 7. Transporte de Muestras. Fuente: Autores. 6.3. Procesamiento de las muestras Las 5 muestras se tamizaron en un tamiz de 2mm y fueron incubadas a 37 ºC. 24 horas después se tomó el pH del suelo y las muestras fueron procesadas. Las muestras tomadas con las cajas rodac se incubaron directamente a 35 ºC por 48 horas. 6.4. Aislamiento de bacterias 6.4.1. Aislamiento primario: 6.4.1.1. Técnica dilución en tubo: Se hizo un pre-enriquecimiento de las 5 muestras, se pesaron 100 g de suelo y se adicionaron a 900 ml de Caldo Nutritivo, se incubaron a 37ºC por 24 horas (Hamaky et al, 2005). A partir de la primera dilución (pre-enriquecimiento de las muestras) se realizaron tres diluciones seriadas (10–2 - 10–4) en 9 ml agua destilada estéril; cada dilución se sembró en superficie en Agar Nutritivo y Agar Extracto de Suelo, por duplicado. Se incubó a 37 °C por 48 horas (Hamaky et al, 2005). Después de 48 horas de incubación las cepas recuperadas fueron aisladas mediante el método de siembra por agotamiento en Agar Nutritivo (García y Ordoñez, 2003), se incubó a 37ºC por 48 horas; para obtener así cultivos puros de cada cepa aislada (Hamaky et al, 2005). 6.4.1.2. Técnica de aspersión directa: En Medio Agar Nutritivo se sembró suelo directamente en la superficie del medio distribuida uniformemente, se incubó a 37 ºC por 48 horas. A partir de las colonias obtenidas se realizaron aislamientos en Medio Agar Nutritivo (Camacho y Hernández, 2002), se incubó a 37ºC por 48 horas. 6.4.1.3. Aislamiento a partir de caja rodac: Las cajas sembradas con agar nutritivo, fueron manejadas en total asepsia, para evitar falsos positivos. De las cepas recuperadas de los diferentes horizontes en el suelo, se diferenciaron macroscópicamente y microscópicamente las cepas (Figura 8) y posteriormente se realizaron aislamientos en Medio Agar nutritivo con el fin de obtener cepas puras. Figura 8. Aislamiento primario en cajas Rodac. Fuente: Autores 6.5. Identificación bacteriana 6.5.1. Identificación microscópica: De cada aislamiento puro obtenido, se realizó coloración Gram para determinar la morfología de las cepas obtenidas. 6.5.2. Identificación bioquímica: A partir de cada cepa aislada se sembraron pruebas bioquímicas de Oxidasa, Catalasa, Citrato, SIM (H2S, Indol, Motilidad), LIA (Lisina, Hierro Agar), TSI (Triple Azúcar Hierro), OF (Oxidación-Fermentación), Voges Proskauer, Rojo de Metilo, Nitratos, Urea, Gelatina, Almidón, Gelatina, Glucosa, Sacarosa, Maltosa, Manosa, Manitol, Fructosa, Celobiosa, Celulosa, Melobiosa, Sorbitol, Inositol, Sucrosa, Ramnosa, Xilosa, Galactosa, Lactosa; para determinar el metabolismo de los microorganismos aislados (Camacho y Hernández, 2002). Cada bioquímica fue incubada a 37 ºC por 48 horas y pasado el tiempo de incubación se observaron resultados de acuerdo a cada reacción bioquímica (Camacho y Hernández, 2002). Para cada bioquímica se realizaron controles positivos y negativos con los siguientes microorganismos: Tabla 1. Controles positivos y negativos de cada bioquímica utilizada BIOQUÍMICA CONTROL POSITIVO CONTROL NEGATIVO Voges-Proskauer Klebsiella sp. E. coli Rojo de Metilo E. coli No inoculado TSI E. coli Pseudomonas sp. Reducción de E. coli No inoculado Citrato Salmonella sp. E. coli Citocromo Oxidasa Pseudomonas aeruginosa E. coli Gelatina Staphylococcus aureus E. coli Almidón Bacillus subtilis E. coli LIA Klebsiella No inoculado Ureasa Proteus E. coli Catalasa Staphylacoccus aureus Streptococcus Nitratos Fuente: MacFaddin, 2003 6.6. Conservación de cepas La conservación de las cepas identificadas se llevó a cabo por medio de tres métodos diferentes, la temperatura de congelación a la cual se llevaron los tres métodos fue -4°C bajo cero. 6.6.1. Conservación en Suelo Estéril: El suelo utilizado para conservar las cepas fue recogido del páramo Cruz Verde; este suelo fue tamizado en un tamiz de 2mm y partículas orgánicas y minerales fueron removidas (rocas, palos, hojas e insectos). Se manejaron recipientes de vidrio color ámbar para evitar la penetración de la luz, con tapón de goma y tapa rosca. Los envases y el suelo fueron esterilizados a 125 °C, 1 atm durante 15 minutos. Previamente se preparo un cultivo líquido de cada cepa en caldo nutritivo a una concentración respecto al tubo Nº 2 de nefelometro de MacFarlan que fue anticipadamente incubado por 24 horas a 35 ºC. En cada recipiente se introdujeron 10 g de suelo y se inoculó con 1 mL de cultivo bacteriano trabajando en condiciones de absoluta esterilidad. 6.6.2. Conservación en Glicerol: En este método existe una relación de volúmenes 2-1-1 (cultivo celular – caldo nutritivo – glicerol 20%) respectivamente. Se trabajó con tubos eppendorf de capacidad 1.5 mL. Debido a la expansión por efecto de la congelación se manejo un volumen de trabajo de 1 mL de mezcla para cada vial. La relación de volúmenes trabajada fue de 0.5 mL de cultivo celular, 0.25 mL de caldo nutritivo y 0.25 mL de glicerol al 20%; estos dos últimos componentes fueron debidamente esterilizados a 125 °C, 1 atm durante 1 5 minutos; el glicerol fue preparado a partir de un stock de 99% de pureza (Monroy, 2002) Cada vial fue llenado mediante micropipeta y bajo condiciones de cámara de flujo laminar. (Mesa y Monroy, 2002). 6.6.3. Conservación en Sensidiscos: A partir de un cultivo líquido en caldo nutritivo que fue previamente incubado por 24 horas a 35ºC a una concentración con respecto al tubo Nº 2 del nefelómetro de MacFarlan para cada cepa aislada; con el uso de pinzas estériles se sumergieron los sensidiscos de papel filtro debidamente esterilizados para ser impregnados; estos sensidiscos se secaron a temperatura ambiente en condiciones estériles, repitiendo este proceso tres veces. Los sensidiscos fueron introducidos en tubos eppendorf estériles (125 °C, 1 atm y por 15 minutos) (Pedroza, 2003) Finalmente todos los frascos y viales utilizados en los tres métodos de conservación fueron rotulados con el nombre del microorganismo, el páramo de donde fue aislado y la fecha de inicio del procedimiento de conservación. 7. RESULTADOS Y DISCUSIÓN En el momento del muestreo la temperatura ambiental fue 15 ºC; la temperatura del suelo 4,7 ºC. Con la muestra compuesta se realizaron mediciones de pH del suelo obteniendo como resultado un pH de 5. 7.1. Parámetros para la selección de géneros Del primer muestreo realizado en el páramo de Cruz Verde se recuperaron 86 colonias bacterianas, con las técnicas de toma de muestras mediante uso de pala, tubo PVC y método de contacto en cajas rodac con agar nutritivo. Del segundo muestreo realizado en el suelo del páramo de Cruz Verde se recuperaron 37 cepas utilizando solo el método de muestreo con barreno; todas las cepas fueron enumeradas para evitar confusiones a la hora de realizar los procedimientos de identificación. En total se aislaron 123 cepas puras, sin embargo, después de la caracterización se comprobó que muchas eran repetidas; finalmente se aislaron e identificaron 40 cepas. Para la selección de género bacteriano, mediante el uso de material bibliográfico, se realizaron varias exclusiones de acuerdo a cuatro parámetros en general: Nicho ecológico: Debido a la existencia de ambientes muy similares al suelo de la zona paramuna, por ejemplo (suelo sabanero, suelo de alta montaña, suelos de clima alternado por las cuatro estaciones, suelo de estepas, suelo en nevados); se descartaron aquellos nichos ecológicos que presentaban una marcada diferencia con la zona muestreada basados en los siguientes parámetros del suelo: estructura, formación, compactación, composición mineral, contenido de materia orgánica y por último variables físicas, químicas y ambientales (temperatura, pH, contenido de sales, humedad relativa, retención de agua lluvia, etc) Se descartaron aquellos géneros bacterianos que han sido aislados únicamente en ambientes marinos, suelos adyacentes a playas, suelos salinos, suelos con humedad relativa menor al 45%, suelos con un pH menor a 3 y mayor a 8, es decir, cepas bacterianas que se desarrollan en ambientes totalmente diferentes al páramo. También fueron descartados géneros halófilos estrictos con requerimientos de NaCl a concentraciones mayores al 1%. Requerimientos metabólicos: El suelo posee todos los nutrientes necesarios, debido a esto es el mayor hábitat microbiano, en consecuencia los géneros bacterianos que necesitan compuestos especializados para su crecimiento pertenecen a otros ambientes totalmente diferentes al suelo paramuno. Los géneros bacterianos que requieren compuestos específicos para su desarrollo como: ácidos mixtos, triptófano, metionina, cisteína, cistina, entre otros, y atmósfera anaeróbica estricta, fueron descartados debido a que los géneros encontrados en los páramos no requieren de estos compuestos específicos para crecer debido a que las cepas fueron sembradas en agar nutritivo que por su alto contenido de nutrientes permite un optimo crecimiento, sin ser selectivo para otras cepas bacterianas. Patogénicidad: La mayoría de las cepas patógenas son anaerobias, necesitan condiciones y sustratos especiales para su crecimiento, y son muy susceptibles a cambios climáticos. Hay géneros que exclusivamente crecen en ambientes hospitalarios y en órganos humanos o de otro mamífero. Esta clase de géneros presentan características metabólicas similares a las de los géneros encontrados en el páramo, pero por lo anteriormente mencionado estos géneros patógenos fueron descartados. Características macro y microscópicas: Las bacterias encontradas fueron divididas inicialmente en los dos grupos más grandes Gram positivos y Gram negativas, posteriormente fueron clasificadas dentro de los subgrupos esporoformadores y no esporoformadores. Ya con la selección de posibles géneros con los pasos anteriormente mencionados, se comparo macroscópicamente y microscópicamente con la ayuda de las medidas obtenidas por medio del microscopio Motic. NOTA: Las imágenes de macroscopia y microscopia, y las tablas de las bioquímicas publicadas durante todos los resultados en este escrito fueron efectuadas por los autores. Las abreviaturas utilizadas en las tablas de las características bioquímicas se refieren a: X: xilosa, L: lactosa, SU: sucrosa, M: maltosa, C: celobiosa, MN: manosa, ME: melobiosa, I: inositol, SO: sorbitol, S: sacarosa, R: ramnosa, F: fructosa, G: galactosa, Ma: manitol, GE: gelatina, RM: rojo de metilo, VP: voges preskauer, CI: citrato, AL: almidón, CA: catalasa 7.2. Bacilos esporoformadores Gram positivos Los géneros correspondientes a bacilos esporoformadores Gram positivos teóricamente existentes son: Amphibacillus, Bacillus, Desulfotomaculum, Sporohalobacter, Sporolactobacillus, Sulfobacillus, Syntrophospora; (Bergey´s, 2000). Posteriormente se realizó una selección de estos géneros descartando al género Sulfobacillus por requerir un pH óptimo de 1.9-2.4 para su crecimiento, así mismo requiere temperatura de incubación de 50°C. Adicionalmente no suelen encontrarse en suelo sino en depósito de pirita. Las cepas aisladas presentaron catalasa positiva, en consecuencia los géneros con catalasa negativa Amphibacillus, Desulfotomaculum, Sporohalobacter, Sporolactobacillus fueron descartados, así mismo Desulfotomaculum es anaerobio estricto y algunas cepas requieren fuente de azufre. Sporohalobacter es un género estricto anaerobio y halófilo requiere 0.5 – 2 M de NaCl para su crecimiento y se encuentra en hábitat salinos (Bergey, 2000) (Bergey, 1984). 7.2.1. Género Amphibacillus 7.2.1.1. Amphibacillus sp. Amphibacillus, se diferencia de los otros géneros bacilo Gram positivo esporoformador por ser catalasa negativo, motilidad positivo y su presencia en suelos con alta concentración de materia orgánica vegetal en descomposición (Bergey, 2000) (Bergey, 1984). Figura 9. Microscopia 100x de Amphibacillus sp Figura 10. Amphibacillus sp en Agar Nutritivo. Tabla 2. Microscopia y macroscopia de Amphibacillus sp. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 3,1 µm, ancho 1,1 µm Colonias de forma circular con bordes irregulares, con apariencia cremosa, de pigmentación amarillo claro. Tabla 3. Características Bioquímicas de Amphibacillus sp. X L SU M C MN ME I SO S R - + + + - + + + - - + F G Ma GE UREA RM LIA TSI CI AL CA + + - + + - - Alk/alk - - - 7.2.1.2. Amphibacillus xylanus Amphibacillus xylanus es descrito por (Niimura, et al. 1990), como un microorganismo anaerobio facultativo, bacilo Gram positivo, esporoformador, que pueden crecer en medios alcalinos. Figura 11. Microscopia 100x de Amphibacillus xylanus. Figura 12. Amphibacillus xylanus en Agar Nutritivo. Tabla 4. Microscopia y macroscopia de Amphibacillus xylanus Características Microscópicas Características Macroscópicas Bacilo esporoformador Gram positivo; largo 3,5 µm, ancho 1,1 µm Colonias de forma circular con bordes irregulares, con centro cremoso, de pigmentación amarillo claro. Tabla 5. Características Bioquímicas de Amphibacillus xylanus X L SU M C MN ME I SO S R - - + + - + + - - + - F G Ma GE UREA VP LIA TSI CI AL CA + + - + - + + Alk/ac - + - Solo existe una especie reportada que es A. xylanus debido a que este género no aparece en los anteriores volúmenes del manual Bergey´s y solo aparece en la versión del año 2000, porque fue creado en 1990 por Niimura et al. Por tanto las otras especies que no pertenecen a Amphibacillus xylanus deben ser catalogadas como Amphibacillus sp para que en futuros estudios sean realmente diferenciadas (Bergey, 2000) (Bergey, 1984). 7.2.2. Género Bacillus Este género presenta bacilos Gram positivos esporoformadores, poseen gran adaptabilidad y se disponen en pares o cadenas. Poseen gran adaptabilidad y baterías enzimáticas que les permiten ser aislados en diversos hábitats con respecto al calor, pH y salinidad (Ordoñez, 1998). Es catalasa positiva y crece en medios sintéticos que contengan azúcares, ácidos orgánicos, alcoholes, como únicas fuente de carbono. Producen una enzima hidrolítica que degrada polisacáridos, ácidos nucleicos y lípidos, lo que permite a estos usar dichos productos como fuente de carbono y donadores de electrones. Este género contiene 77 especies reconocidas (EPSA, 1991). Este género se encuentra comúnmente en suelos y plantas donde tiene un papel importante en el ciclo del carbono y nitrógeno. Son habitantes comunes de aguas frescas y estancadas, son particularmente activos en sedimentos (Rusell Et al 1987). La diferenciación entre especies del género Bacillus se centro en los resultados de la fermentación de lactosa, sorbitol, manitol, melobiosa, hidrólisis de la urea y descarboxilación de la lisina (Bergey, 2000) (Bergey, 1984). 7.2.2.1. Bacillus azotoformans Figura 13. Microscopia 100x Bacillus azotoformans. Figura 14. Bacillus azotoformans en Agar Nutritivo. Tabla 6. Microscopia y macroscopia de Bacillus azotoformans. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; esporoformador, largo 2,7 µm, ancho 1,1 µm. Colonias de forma circular, pequeña, de consistencia cremosa, bordes regulares y de pigmentación blanco grisáceo. Tabla 7. Características Bioquímicas de Bacillus azotoformans. X L SU M C MN ME I SO S R - - + - - - + + - - - F G Ma GE UREA RM LIA TSI CI AL CA - - - + + - - Alk/acid - + + 7.2.2.2. Bacillus cereus Figura 15. Microscopia 100x de Bacillus cereus. Figura 16. Bacillus cereus en Agar Nutritivo. Tabla 8. Microscopia y macroscopia de Bacillus cereus. Características Microscópicas Bacilo Gram positivo; esporoformador, largo 2,8 µm, ancho 1,0 µm Características Macroscópicas Colonias de forma circular, de tamaño grande, de consistencia cremosa y presenta una pigmentación beige. Tabla 9. Características Bioquímicas de Bacillus cereus. X L SU M C MN ME I SO S R + - + + - + - - - - - F G Ma GE UREA VP LIA TSI CI AL CA + - - + + - - Alk/alk - - + 7.2.2.3. Bacillus circulans Figura 17. Microscopia 100x de Bacillus circulans. Figura 18. Bacillus circulans en Agar Nutritivo. Tabla 10. Microscopia y macroscopia de Bacillus circulans. Características Microscópicas Bacilo Gram positivo; esporoformador, largo 2,3 µm, ancho 1,0 µm Características Macroscópicas Colonia redonda, lisa, de contextura cremosa, crecimiento irregular, elevación plana presenta y color blanco amarillento. Tabla 11. Características Bioquímicas de Bacillus circulans. X L SU M C MN ME I SO S R + + + + - + - + + - + F G Ma GE UREA VP LIA TSI CI AL CA + - - + - - +/+/- Alk/alk - + + 7.2.2.4. Bacillus globisporus Figura 19. Microscopia 100x de Bacillus globisporus. Figura 20. Bacillus globisporus en Agar Nutritivo. Tabla 12. Microscopia y macroscopia de Bacillus globisporus. Características Microscópicas Bacilo Gram positivo; Esporoformador (endoespora), largo 2,8 µm, Ancho 1,5 µm Características Macroscópicas Colonias irregulares, grandes, con bordes irregulares, de consistencia polvorienta, no cremosa y de color blanco. Tabla 13. Características Bioquímicas de Bacillus globisporus. X L SU M C MN ME I SO S R + + + + - + + + + + - F G Ma GE UREA VP LIA TSI CI AL CA + + + + + + - Ac/Ac + - + 7.2.2.5. Bacillus marinus Figura 21. Microscopia 100x de Figura 22. Bacillus marinus en Bacillus marinus. Agar Nutritivo. Tabla 14. Microscopia y macroscopia de Bacillus marinus Características Microscópicas Bacilo Gram positivo; esporoformador (endoespora), largo 3,2 µm, ancho 1,3 µm Características Macroscópicas Colonias de forma circular, grandes, con bordes irregulares, de consistencia cremosa, elevación plana y de color blanco. Tabla 15. Características Bioquímicas de Bacillus marinus X L SU M C MN ME I SO S R + + + + - + - - - + - F G Ma GE UREA VP LIA TSI CI AL CA + - - + - - - Al/ac + - + H2S 7.2.2.6. Bacillus pasteurii Figura 23. Microscopia 100x. Figura 24. Bacillus pasteurii en Agar Bacillus pasteurii Nutritivo. Tabla 16. Microscopia y macroscopia de Bacillus pasteurii Características Microscópicas Características Macroscópicas Bacilo Gram positivo; esporoformador ; largo 3,5 µm, ancho 1,0 µm Colonia redonda, de consistencia cremosa y de color Crema. Tabla 17. Características Bioquímicas de Bacillus pasteurii X L SU M C MN ME I SO S R - - + - - + + - - - - F G Ma GE UREA RM LIA TSI CI AL CA + - - + + - - Alk/Ad - - + Para la identificación de ésta cepa, se enfatizó en la hidrólisis de la urea; del cual existen cuatro especies que corresponden a este resultado, conjuntamente se utilizo la fermentación de la melobiosa, obteniendo solo dos especies: Bacillus globisporus y Bacillus pasteurii; esta última fue seleccionada, debido a la diferenciación en la no fermentación de lactosa y sorbitol (Bergey, 2000) (Bergey, 1984). 7.2.2.7. Bacillus sphaericus Figura 25. Microscopia 100x Bacillus sphaericus. Figura 26. Bacillus sphaericus en Agar Nutritivo. Tabla 18. Microscopia y macroscopia de Bacillus sphaericus. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; esporoformador, largo 2,8 µm, ancho 1,5 µm Colonias de irregular, de consistencia cremosa. Presenta color beige oscuro y con producción de pigmentación rosado claro en el medio. Tabla 19. Características Bioquímicas de Bacillus sphaericus X L SU M C MN ME I SO S R - - + + - + - - - + - F G Ma GE UREA RM LIA TSI CI AL CA - - - + - - - Alk/ac +/+/- + + H2S 7.2.3. Género Sporolactobacillus Este género está compuesto por 5 especies y se caracteriza por ser catalasa negativo, anaerobio facultativo o microarofílico esporoformador. El hábitat de los miembros de éste género incluye productos de leche, pollo, suelos y plantas (Sanders.et al 2003). 7.2.3.1. Sporolactobacillus inulinus Sporolactobacillus inulinus se caracteriza por producir ácido láctico pero es incapaz de fermentar la lactosa, su optimo crecimiento es de 35 ºC (rango 15 ºC – 40 ºC) (M. Sanders. 2003) Figura 27. Microscopia 100x de Sporolactobacillus inulinus. Figura 28. Sporolactobacillus inulinus en Agar Nutritivo. Tabla 20. Microscopia y macroscopia de Sporolactobacillus inulinus Características Microscópicas Características Macroscópicas Bacilo Gram positivo; esporoformador ; largo 3,8 µm, ancho 1,0 µm Colonias de consistencia cremosa, con bordes irregulares, lisas y presenta pigmentación blanco. Tabla 21. Características Bioquímica de Sporolactobacillus inulinus X L SU M C MN ME I SO S R - - + + - + - - - - - F G Ma GE UREA RM LIA TSI CI AL CA + - - - + + - Alk/alk - - - Se determinó que ésta cepa, pertenecía al género Sporolactobacillus, debido a su formación de esporas, su catalasa negativa y su nicho ecológico (suelo). De este género se selecciono como especie S.inulinus, debido a su capacidad fermentativa de las siguientes hexosas: fructosa, glucosa, maltosa, manosa, rafinosa, sucrosa, trehalosa, manitol y sorbitol; la no fermentación de pentosas: arabinosa, xilosa, galactosa, lactosa, melobiosa, celobiosa, ramnosa; la no capacidad proteolítica sobre gelatina y la no hidrólisis del almidón (Bergey, 2000) (Bergey, 1984). 7.3. Cocos esporoformadores Gram positivos. 7.3.1. Género Sporosarcina En cuanto a cocos Gram positivos esporoformadores se determinó que ésta cepa pertenece al género Sporosarcina por ser catalasa positivo y no es anaerobio estricto en comparación con Clostridium (Bergey, 1984). Dentro de este género existen dos especies reportadas, Sporosarcina ureae y Sporosarcina halophila; según su metabolismo se diferencian por ser urea positiva y gelatina negativa, debido a esto se estableció que la cepa aislada pertenece a Sporosarcina ureae (Bergey, 1984). 7.3.1.1. Sporosarcina ureae Ésta especie se encuentra en suelos y en cantidades mayores en aquellos que reciben aportes de orina, descompone activamente la urea, transformándola en CO2 y NH3 y crece en medios con pH de hasta 10 (Bergey, 2000). Figura 29. Microscopia 100x de Figura 30. Sporosarcina ureae en Sporosarcina urea. Agar extracto se suelo. Tabla 22. Microscopia y macroscopia de Sporosarcina ureae. Características Microscópicas Coco Gram positivo; esporoformador diámetro 1,1 µm Características Macroscópicas Colonias pequeñas, de contextura cremosa, elevación plana, presenta pigmentación blanco grisáceo. Tabla 23. Características Bioquímicas de Sporosarcina ureae. X L SU M C MN ME I SO S R + + + - - + + + - - + F G Ma GE UREA VP LIA TSI CI AL CA + - - - + - - Ac/ac + - + 7.4. Bacilos Gram Positivos no esporoformadores. Para el subgrupo de bacilos Gram positivos no esporoformadores, se descartaron los siguientes géneros: Erysipelothrix por no crecer en el suelo y no tener otra fuente de aislamiento diferente al de organismos de mamíferos y aves y su relación patógena frente e ellos, Carnobacterium y Renibacterium por ser patógena para peces, requerimientos obligatorios de cisteína y rangos de temperatura de 15-18 °C (Be rgey, 2000) (Bergey, 1984). 7.4.1. Género Brochothrix El género Brochothrix se caracteriza por ser rojo de metilo y VogesProskauer positivo, así mismo presentan enzima catalasa, crecen a temperatura desde un rango de 0-30 °C, no son pigme ntadas, no móviles, no esporoformador, anaerobio facultativo y se encuentran distribuidos por todo el medio ambiente (Gregory et al 1993). Este género ha sido clasificado dentro de la rama de Clostridium, Lactobacillus y Bacillus. Las cepas pertenecientes a este género se caracterizan por no ser patógenas, y generalmente no crecen a temperaturas arriba de 30 ºC (Gregory et al 1993). Las dos cepas B. campestris y B. thermosphacta respectivamente fueron diferenciadas por la fermentación de la ramnosa con referencia a la primera cepa (Bergey, 2000) (Bergey, 1984). 7.4.1.1. Brochothrix campestris Figura 31. Microscopia 100x de Brochothrix campestris Figura 32. Brochothrix campestris en Agar Nutritivo. Tabla 24. Microscopia y macroscopia de Brochothrix campestris Características Microscópicas Características Macroscópicas Bacilo Gram positivo, largo 3,5 µm, ancho 1,2 µm Colonias de forma circular, grandes, polvorienta, lisas, elevación plana, presenta color blanco. Tabla 25. Características Bioquímica de Brochothrix campestris X L SU M C MN ME I SO S R + - + + - + - - + + - F G Ma GE UREA RM LIA TSI CI AL CA + + + + + + + Alk/alk + + + 7.4.1.2. Brochothrix thermosphacta Figura 33. Microscopia 100x de Figura 34. Brochothrix thermosphacta Brochothrix thermosphacta. en Agar Nutritivo. Tabla 26. Microscopia y macroscopia de Brochothrix thermosphacta. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 3,9 µm, ancho 1,5 µm Colonias irregulares, rugosas, de consistencia cremosa, de pigmentación crema oscuro. Tabla 27. Microscopia y macroscopia de Brochothrix thermosphacta. X L SU M C MN ME I SO S R - - + - - + + - - + + F G Ma GE UREA RM LIA TSI CI AL CA + + + + + + - Ac/ac - - + 7.4.2. Género Caryophanon Caryophanon es un género muy poco estudiado, debido a su poca tolerancia a condiciones de estrés, son móviles, no son esporoformadoras, estrictas aeróbicas y son catalasa positiva. Sus colonias son de tamaño grande y cambian de tonalidad en su pigmentación amarilla de oscuro a claro según el tiempo transcurrido de crecimiento (Nauman, et al. 1974). 7.4.2.1. Caryophanon latum Figura 35. Microscopia 100x de Caryophanon latum. Figura 36. Caryophanon latum en Agar Nutritivo. Tabla 28. Microscopia y macroscopia de Caryophanon latum. Características Microscópicas Bacilo Gram positivo; largo 2,0 µm, ancho 0,9 µm Características Macroscópicas Colonias redondas, lisas, de consistencia cremosa, de color amarillo ocre, producción de pigmentación café en el medio. Tabla 29. Características Bioquímica de Caryophanon latum. X L SU M C MN ME I SO S R + F G + Ma + GE UREA + VP LIA TSI CI AL CA + - - - + - - Alk/ac - - + 7.4.2.2. Caryophanon tenue Figura 37. Microscopia 100x de Caryophanon tenue. Figura 38. Caryophanon tenue en Agar Nutritivo. Tabla 30. Microscopia y macroscopia de Caryophanon tenue. Características Microscópicas Bacilo Gram positivo; largo 1,8 µm, ancho 1,1 µm Características Macroscópicas Colonias medianas de tonalidad gris, cremosas y ovaladas Tabla 31. Características Bioquímica de Caryophanon tenue X L SU M C MN ME I SO S R + + + + - + + + + + + F G Ma GE UREA RM LIA TSI CI AL CA + + + - - + - Ac/ac + - + Debido a la similitud de caracterización bioquímica, el parámetro más importante para la determinación y diferenciación entre estas dos especies, son las mediciones microscópicas, en este estudio las obtenidas mediante el microscopio motic, debido al gran tamaño de la especie Caryophanon latun 2.8-3.2 µm, existe una diferenciación notable con Caryophanon tenue 1.4-2.0 µm (Bergey, 2000) (Bergey, 1984). 7.4.3. Género Kurthia Este género se caracteriza por ser fermentadoras de glucosa, ser catalasa positiva. También presentan batería enzimática con efecto proteolítico sobre la gelatina, presenta motilidad, no es patógena para el ser humano y animales, crece a temperatura optima de 25-30 °C, con tolerancia a altos y bajos cambios drasticos y se encuentra en todo el medio ambiente debido a que posee alta actividad degradadora de materia vegetal (Bergey, 2000) (Bergey, 1984). 7.4.3.1. Kurthia gibsonii Figura 39. Microscopia 100x Kurthia gibsonii. Figura 40. Kurthia gibsonii en Agar Nutritivo. Tabla 32. Microscopia y macroscopia de Kurthia gibsonii. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 3,2 µm, ancho 1,0 µm. Colonias redondas, pequeñas, de consistencia cremosa, lisas, con bordes regulares, de color blanco. Tabla 33. Características Bioquímica de Kurthia gibsonii. X L SU M C MN ME I SO S R - - + + - - - - - + - F G Ma GE UREA VP LIA TSI CI AL CA - + - + - - - Ac/ac - - + 7.4.3.2. Kurthia sibirica Figura 41. Microscopia 100x de Kurthia sibirica. Figura 42. Kurthia sibirica en Agar Nutritivo. Tabla 34. Microscopia y macroscopia de Kurthia sibirica Características Microscópicas Bacilo Gram positivo; largo 3,8 µm, ancho 1,5 µm Características Macroscópicas Colonias de forma irregular, presentan centros cremosos el borde polvoriento, pigmentación beige. Tabla 35. Características Bioquímica de Kurthia sibirica X L SU M C MN ME I SO S R - - + + - - + - - - - F G Ma GE UREA RM LIA TSI CI AL CA + + - + - - - Ac/ac - - + 7.4.3.3. Kurthia zopfii Figura 43. Microscopia 100x de Figura 44. Kurthia zopfii en agar Kurthia zopfii. Nutritivo. Tabla 36. Microscopia y macroscopia de Kurthia zopfii Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 2,0 µm, ancho 0,9 µm Colonias pequeñas de tonalidad naranja, contextura cremosa. Tabla 37. Características Bioquímica de Kurthia zopfii. X L SU M C MN ME I SO S R - - + + - - - - - - + F G Ma GE UREA RM LIA TSI CI AL CA - + + + - - - Ac/ac - + + 7.4.4. Género Lactobacillus Son Bacilos Gram positivos, largos, delgados, formando cadenas. Su metabolismo es fermentativo y sacaroclásico, el producto final es del carbono es el lactato. Son microaerofílicos e inmóviles. Bioquímicamente reducen el nitrato, no utilizan la gelatina, son catalasa y citocromo oxidasa negativ,. Su hábitat es en la superfice de plantas y frutas (De la Rosa, 1996). Las cepas nombradas a continuación fueron identificadas en el género Lactobacillus por ser catalasa negativa, no actividad proteolítica sobre la gelatina, su distribución en el ambiente y la no reducción de nitratos (Bergey, 2000) (Bergey, 1984). 7.4.4.1. Lactobacillus agilis Figura 45. Microscopia 100x de Lactobacillus agilis. Figura 46. Lactobacillus agilis en Agar Nutritivo. Tabla 38. Microscopia y macroscopiade Lactobacillus agilis. Características Microscópicas Bacilo Gram positivo; largo 2,9 µm, ancho 0,9 µm Características Macroscópicas Colonias de forma circular, lisas, de contextura cremosa, blancas. Tabla 39. Características Bioquímica de Lactobacillus agilis. X L SU M C MN ME I SO S R - + + + - + + + - + - F G Ma GE UREA VP LIA TSI CI AL CA + - + - + + - Alk/alk - - - Esta cepa presenta similitud con 4 especies: L. maltaromicus, L, plantarum, L. salivarius y L. agilis al presentar fermentación de lactosa, manitol, melobiosa y no fermentación de ramnosa pero se diferencio L. agilis por la no fermentación del sorbitol (Bergey, 2000) (Bergey, 1984). 7.4.4.2. Lactobacillus collinoides Fig 47. Microscopia 100x de Fig 48. Lactobacillus collinoides Lactobacillus collinoides. en Agar Nutritivo. Tabla 40. Microscopia y macroscopia de Lactobacillus collinoides. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 5,3 µm, ancho 1,3 µm. Colonias de forma circular, pequeñas, de pigmentación blanca. Tabla 41. Características Bioquímica de Lactobacillus collinoides. X L SU M C MN ME I SO S R - - + + - - - - - - + F G Ma GE UREA VP LIA TSI CI AL CA + + - - + + - Alk/alk - + - 7.4.4.3. Lactobacillus confusus Figura 49. Microscopia 100x de Figura 50. Lactobacillus confusus Lactobacillus confusus. en Agar Nutritivo. Tabla 42. Microscopia y macroscopia de Lactobacillus confusus. Características Microscópicas Bacilo Gram positivo; largo 2,7 µm, ancho 1,1 µm Características Macroscópicas Colonias de forma circular, de tamaño variable, de contextura un seca, irregulares, de pigmentación beige claro. Tabla 43. Características Bioquímica de Lactobacillus confusus. X L SU M C MN ME I SO S R - - + + - + - - - + - F G Ma GE UREA VP LIA TSI CI AL CA + + + - + + - Alk/alk - - - 7.4.4.4. Lactobacillus fructosus Figura 51. Microscopia 100x de Figura 52. Lactobacillus fructosus en Lactobacillus fructosus. Agar Nutritivo. Tabla 44. Microscopia y macroscopia de Lactobacillus fructosus. Características Microscópicas Características Macroscópicas Bacilo Gram positivo, largo 4,1 µm, ancho 1,5 µm. Colonias cremosas, tamaño y forma variable, lisas, de elevación plana, de pigmentación crema con centro oscuro. Tabla 45. Características Bioquímica de Lactobacillus fructosus. X L SU M C MN ME I SO S R - - - - - - - - - + - F G Ma GE UREA RM LIA TSI CI AL CA + - - - + + + Ac/ac - + - 7.4.4.5. Lactobacillus kandleri Figura 53. Microscopia 100x de Fig 54. Lactobacillus kandleri en Lactobacillus kandleri. Agar Nutritivo. Tabla 46. Microscopia y macroscopia de Lactobacillus kandleri. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 4,2 µm, ancho 1,2 µm Colonias de forma circular, cremosas, lisas, de color amarillo claro. Tabla 47. Características Bioquímica de Lactobacillus kandleri. X L SU M C MN ME I SO S R - - - - - - - - - + - F G Ma GE UREA RM LIA TSI CI AL CA + + + - + + + Ac/ac - - - 7.4.4.6. Lactobacillus sake Fig 55. Microscopia 100x de Lactobacillus sake. Fig 56. Lactobacillus sake en Agar Nutritivo. Tabla 48. Microscopia y macroscopia de Lactobacillus sake Características Microscópicas Bacilo Gram positivo; largo 3,1 µm, ancho 1,0 µm Características Macroscópicas Colonias irregulares, de consistencia cremosa, lisa y de pigmentación Blanco Hueso. Tabla 49. Características Bioquímica de Lactobacillus sake X L SU M C MN ME I SO S R - + + + - + + - - + - F G Ma GE UREA VP LIA TSI CI AL CA + - - - + + - Alk/alk - - - 7.4.4.7. Lactobacillus viridescens Figura 57. Microscopia 100x de Lactobacillus viridescens. Figura 58. Lactobacillus viridescens en Agar Nutritivo. Tabla 50. Microscopia y macroscopia de Lactobacillus viridescens. Características Microscópicas Bacilo Gram positivo; largo 3,9 µm, ancho 1,1 µm Características Macroscópicas Colonias grandes con centro cremoso, color blanco. Tabla 51. Características Bioquímica de Lactobacillus viridescens. X L SU M C MN ME I SO S R - - - + - + - + - + - F G Ma GE UREA VP LIA TSI CI AL CA + - - - + + - Alk/ac - - - 7.4.5. Género Listeria El género Listeria, se caracteriza por bacterias no son esporoformadoras, móviles, crecen a temperatura de 20-25 °C, catalasa positiva, así mismo son cepas no patógenas (Bergey, 2000) (Bergey, 1984). 7.4.5.1. Listeria murrayi Figura 59. Microscopia 100x Listeria murrayi. Figura 60. Listeria murrayi en Agar Nutritivo. Tabla 52. Microscopia y macroscopia de Listeria murrayi. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 1,9 µm, ancho 1,1 µm Colonias de forma circular, de contextura cremosa, con bordes regulares, pigmentación beige claro. Tabla 53. Características Bioquímica de Listeria murrayi X L SU M C MN ME I SO S R - + - + - + - - - + + F G Ma GE UREA VP LIA TSI CI AL CA + + + + - + - Alk/alk - - + 7.4.5.2. Listeria welshimeri Figura 61. Microscopia 100x de Figura 62. Listeria welshimeri en Listeria welshimeri. Agar Nutritivo. Tabla 54. Microscopia y macroscopia de Listeria welshimeri. Características Microscópicas Características Macroscópicas Bacilo Gram positivo; largo 2,7 µm, ancho 1,0 µm Colonias irregulares, de una tamaño pequeño, de consistencia cremosa, de pigmentación blanco Tabla 55. Características Bioquímica de Listeria welshimeri. X L SU M C MN ME I SO S R + + + + - - + - - - - F G Ma GE UREA RM LIA TSI CI AL CA + - - + - + - Alk/alk - - + 7.5. Cocos Gram positivos no esporoformadores Los géneros de cocos no esporoformadores Gram positivos descartados por no encontrarse en ambientes similares al páramo fueron: Marinococcus, Vagococcus, Planococcus y Salinococcus ya que estos géneros requiere de una temperatura de crecimiento de 30 a 37 °C, requieren una concentración de 0.5 a 20 % NaCl, así mismo son encontrados en suelos salinos y hábitat marinos. Aerococcus demanda pH 9.6 para su crecimiento, 10% NaCl y 40% de bilis. Coprococcus es estrictamente anaeróbico y es aislado en intestinos y heces humanas. (Bergey, 2000) (Bergey, 1984). Gemella, Peptoccoccus, Peptostreptococcus, Stomatococcus y Streptococcus fueron descartados por ser parásitos obligados de humanos y mamíferos al ser invasivos de membranas mucosas del tracto respiratorio, tractos intestinales, glándulas mamarias y tener implicación en diferentes procesos infecciosos. Por sus características morfológicas se determinó que las cepas aisladas no pertenecen al género Deinobacter por mostrar colonias rosadas o rojas y Deinococcus por presentar colonias rojas o naranjas. Otro requerimiento al momento de ser cultivados es una atmosfera anaerobia de CO2 para los géneros descartados Melissococcus y Ruminococcus (Bergey, 2000). 7.5.1. Género Lactococcus Género de bacterias del ácido láctico formado por cinco especies relacionadas con Streptococcus. Las bacterias de este género son típicamente esféricas u ovoides, de 0,5 a 1,2 µm por 0,5 a 1,5 µm, y se agrupan en pares o en cadenas cortas. Son no formadoras de esporas y no mótiles (Valbuena et al. 2005). Del género Lactococcus solo se encontró una cepa, su especie fue seleccionada por las condiciones de temperatura (40 °C) y concentración de NaCl para su desarrollo (4%), la especie seleccionada fue L. lactis, pero esta especie presentaba tres subespecies diferenciadas por la no fermentación de la lactosa y el manito, correspondiente a Lactococcus lactis subespecie hordniae (Bergey, 2000). 7.5.1.1. Lactococcus lactis El Lactococcus lactis es un microorganismo mesófilo, capaz de fermentar la lactosa produciendo ácido láctico en gran cantidad, de la misma forma es capaz de producir algunas substancias antibacterianas conocidas en forma genérica como bacteriocinas, entre las cuales destacan la nisina y la diplococcina. Ambos factores, acidez y bacteriocinas, son capaces de inhibir el crecimiento de un amplio rango de microorganismos (Valbuena et al. 2005). Figura 63. Microsocopia 100x de Lactococcus lactis. Figura 64. Lactococcus lactis en Agar Nutritivo. Tabla 56. Microscopia y macroscopia de Lactococcus lactis. Características Microscópicas Coco Gram positivo; diámetro 1,1 µm. Características Macroscópicas Colonias de forma circular, de tamaño diminuto, de consistencia cremosa y color blanco. Tabla 57. Características Bioquímica de Lactococcus lactis. X L SU M C MN ME I SO S R - + + + - - + + - - - F G Ma GE UREA VP LIA TSI CI AL CA - - - + + + - Alk/alk - + - 7.5.2. Género Microccocus Los microorganismos pertenecientes al género Micrococcus poseen células esféricas, que pueden agruparse en pares, tétradas o en forma irregular. Las colonias son pigmentadas. Son aerobios estrictos, su metabolismo es respiratorio con escasa o nula producción de ácido, y crecen bien en medios simples. La prueba de la catalasa es positiva, la de la oxidasa frecuentemente lo es aunque débilmente (Altamirano y Pozzo. 2000). 7.5.2.1. Microccocus luteus Figura 65. Microscopia 100x de Figura 66. Micrococcus luteus en Microccocus luteus. Agar Nutritivo. Tabla 58. Microscopia y macroscopia de Microccocus luteus. Características Microscópicas Coco Gram positivo; diámetro 1,7 µm. Características Macroscópicas Colonias redondas, lisa, de contextura cremosa, de pigmentación amarillo. Tabla 59. Características Bioquímicas de Micrococcus luteus. X L SU M C MN ME I SO S R + - + + - + - - - - - F G Ma GE UREA RM LIA TSI CI AL CA + - - + + - - Alk/alk - - + 7.5.2.2. Micrococcus roseus Figura 67. Microscopia 100x Micrococcus roseus. Figura 68. Micrococcus roseus en Agar Nutritivo Tabla 60. Microscopia y macroscopia de Micrococcus roseus. Características Microscópicas Coco Gram positivo; diámetro 0,9 µm. Características Macroscópicas Colonias redondas y lisas, cremosas, de pigmentación rosa. Tabla 61. Características Bioquímicas de Micrococcus roseus. X L SU M C MN ME I SO S R + - + + - - - - - - - F G Ma GE UREA VP LIA TSI CI AL CA + - - + + + - Alk/acid - - + 7.5.3. Género Pediococcus Son cocos Gram positivos, inmóviles, no forman esporas. Microscopicamente se observan formando tétradas, pero también pueden estar en pares. Son homofermentativos Su rango óptimo de crecimiento es de 25 ºC a 40 Cº. (De la Rosa 1996) 7.5.3.1. Pediococcus sp. Según las características ésta cepa, no pertenece al género Micrococccus, Planococcus o Deinococcus, géneros característicos por presentar pigmentación en las colonias; debido a la no presencia de la batería enzimática catalasa, así mismo se determinó que pertenece al género Pediococcus por su no motilidad, no formación de esporas, fermentación de glucosa y carbohidratos, no reduce nitratos, no es patógena para animales o humanos y se ha aislado de material vegetal (Bergey, 2000). Figura 69. Microscopia 100x de Pediococcus sp. Figura 70. Pediococcus sp en Agar Nutritivo. Tabla 62. Microscopia y macroscopia de Pediococcus sp. Características Microscópicas Características Macroscópicas Coco Gram positivo; diámetro 1,2 µm Colonias de forma circular, lisas, de consistencia cremosa, de pigmentación amarillo. Tabla 63. Características Bioquímica de Pediococcus sp. X L SU M C MN ME I SO S R + + + + - + + - - - - F G Ma GE UREA VP LIA TSI CI AL CA + + - + + + - Alk/ac + - - 7.5.4. Género Sacharococeus 7.5.4.1. Sacharococeus thermophilus En diferentes estudios Saccharococcus thermophilus se ha aislado en refinerías de azúcar, a pesar de su resistencia a altas temperaturas se ha venido encontrando en otros hábitats con bajas temperaturas (Bergey, 2000). Figura 71. Microscopia 100x de Figura 72. Sacharococeus thermophilus Sacharococeus thermophilus. en Agar Nutritivo. Tabla 64. Microscopia y macroscopia de Sacharococeus thermophilus. Características Microscópicas Características Macroscópicas Coco Gram positivo; diámetro 0,9 µm Colonias de forma circular, de consistencia cremosa, lisa, de pigmentación Beige. Tabla 65. Características Bioquímica de Sacharococeus thermophilus X L SU M C MN ME I SO S R + - + + - + + - - + - F G Ma GE UREA VP LIA TSI CI AL CA + + + + + - + Ac/ac + + + 7.5.5. Género Sarcina El género Sarcina fue seleccionado por su producción de CO2, hidrólisis de almidón y catalasa negativa, existen dos especies: Sarcina maxima y Sarcina ventriculi esta última fue seleccionada por ser fermentadora de melobiosa y celulosa y no fermentadora de xilosa (Bergey, 2000). 7.5.5.1. Sarcina ventriculi Figura 73. Microscopia 100x de Figura 74. Sarcina ventriculi en Agar Sarcina ventriculi. Nutritivo. Tabla 66. Microscopia y maroscopia de Sarcina ventriculi. Características Microscópicas Coco Gram positivo; diámetro 1,1 µm Características Macroscópicas Colonias de formas irregulares, de consistencia rugosa, presenta pigmentación blanca. Tabla 67. Características Bioquímica de Sarcina ventriculi. X L SU M C MN ME I SO S R - + + - + + + - - - - F G Ma GE UREA RM LIA TSI CI AL CA + - - + - - +/- Ac/ac - + - CO2 7.5.6. Género Staphylococcus Son cocos Gram positivos, necesita una fuente nitrogenada orgánica y en sus necesidades de oxígeno es facultativo, se caracteriza por ser catalasa positivo (Prescott. 1999). La cepas a continuación se determinaron que pertenecían al género Staphylococcus debido a su no formación de esporas, no motilidad, sus colonias opacas blancas, raramente amarillas o naranjas, son catalasa positiva, y no son cepas patógenas (Bergey, 2000). 7.5.6.1. Staphylococcus arlettae Figura 75. Microscopia 100X de Figura 76. Staphylococcus arlettae en Staphylococcus arlettae. Agar Nutritivo. Tabla 68. Microscopia y macroscopia de Staphylococcus arlettae. Características Microscópicas Coco Gram positivo; diámetro 1,1 µm Características Macroscópicas Colonias redondas, de tamaño pequeño, lisas, de pigmentación blanco. Tabla 69. Características Bioquímica de Staphylococcus arlettae. X L SU M C MN ME I SO S R + F + G + Ma + GE UREA + RM + LIA TSI CI + AL CA + + + + - + + Ac/ac + - + Esta cepa se diferenció de las otras especies del género Staphylococcus por ser urea negativa, pero así mismo presentaba dos posibles especies: Staphylococcus auricularis y Staphylococcus arlettae; ésta última fue seleccionada por presentar fermentación de lactosa (Bergey, 2000). 7.5.6.2. Staphylococcus auricularis Esta cepa fue identificaba como Staphylococcus auricularis por no fermentar manitol y manosa que permitió diferenciarla de otras cepas bacterianas de especia metabólicamente similares (Bergey, 1984). Figura 77. Microscopia 100X de Staphylococcus auricularis. Figura 78. Staphylococcus auricularis en Agar Nutritivo. Tabla 70. Microscopia y macroscopia de Staphylococcus auricularis. Características Microscópicas Coco Gram positivo; diámetro 0.9 µm Características Macroscópicas Colonias de contextura cremosa, lisa, de pigmentación Amarillo, translucidas. Tabla 71. Características Bioquímica de Staphylococcus auricilaris. X L SU M C MN ME I SO S R + - + - - - + - - - + F G Ma GE UREA RM LIA TSI CI AL CA + - - + + + - Alk/ac - - + 7.5.6.3. Staphylococcus equorum Figura 79. Microscopia 100x de Staphylococcus equorum. Figura 80. Staphylococcus equorum en Agar Nutritivo. Tabla 72. Microscopia y macroscopia de Staphylococcus equorum Características Microscópicas Coco-Bacilo Gram positivo, largo 1,5 µm, ancho 1,1 µm. Características Macroscópicas Colonias irregulares, lisas, de consistencia seca, elevación plana, de pigmentación Blanca. Tabla 73. Características Bioquímica de Staphylococcus equorum X L SU M C MN ME I SO S R - + + + - + + - - + + F G Ma GE UREA VP LIA TSI CI AL CA + + - + + + - Alk/alk - - + 7.5.6.4. Staphylococcus hominis Estas cepas fueron identificadas Staphylococcus equorum y Staphylococcus hominis por la hidrólisis de la urea, estas dos especies se diferenciaron respectivamente por no presentar fermentación de la aldopentosa xilosa y el polialcohol manitol respecto a S. equorum y si fermentadora por parte de S. hominis (Bergey, 2000). Figura 81. Microscopia 100x de Staphylococcus hominis. Figura 82. Staphylococcus hominis en Agar Nutritivo. Tabla 74. Microscopia y macroscopia de Staphylococcus hominis. Características Microscópicas Coco Gram positivo, largo 1,7µm y ancho 0,9 Características Macroscópicas Colonias de forma circular, cremosas y lisas, de pigmentación blanco. Tabla 75. Características Bioquímica de Staphylococcus hominis. X L SU M C MN ME I SO S R + + + + - - + - - + - F G Ma GE UREA VP LIA TSI CI AL CA + + + + + - - Ac/ac + - + CO2 7.5.6.5. Staphylococcus lentus Esta cepa, también urea negativa presentaba dos opciones S. kloosii y S. lentus pero esta última fue seleccionada por fermentar sucrosa y manosa (Bergey, 2000) (Bergey, 1984). Figura 83. Microscopia 100x de Staphylococcus lentus. Figura 84. Staphylococcus lentus en Agar Nutritivo. Tabla 76. Microscopia y macroscopia de Staphylococcus lentus. Características Microscópicas Coco Gram positivo; diámetro 1,1 µm Características Macroscópicas Colonias lisas, de consistencia cremosa, de pigmentación amarillo. Tabla 77. Características Bioquímica de Staphylococcus lentus X L SU M C MN ME I SO S R - + + - - + + - - + + F G Ma GE UREA VP LIA TSI CI AL CA + + + + - + - Alk/ac - - + 7.6. Coco-Bacilos no esporoformadores Gram positivos. 7.6.1. Género Trichococcus 7.6.1.1. Trichococcus flocculiformis Figura 85. Microscopia 100x de Figura 86. Trichococcus flocculiformis Trichococcus flocculiformis. en Agar Nutritivo. Tabla 78. Microscopia y macroscopia de Trichococcus flocculiformis. Características Microscópicas Características Macroscópicas Coco-Bacilo Gram positivo, largo 1,7 µm, ancho 0,8 µm Colonias redondas, consistencia cremosa y pigmentación blanca Tabla 79. Características Bioquímica de Trichococcus flocculiformis. X L SU M C MN ME I SO S R - + + + - + + - - + - F G Ma GE UREA VP LIA TSI CI AL CA + + + + + + +/- Alk/acid - + + CO2 8. CONCLUSIONES • Se realizó una renovación del grupo de cepas microbianas del laboratorio de bioensayos de la Pontificia Universidad Javeriana en la línea de investigación de fitoquímica , con especies bacterianas nativas que han sido encontradas en diferentes ambientes y lugares del mundo entero, proporcionando nuevas herramientas microbiológicas. • Se amplió las expectativas en encontrar cepas bacterianas, que metabolicen nuevos compuestos con efecto bactericida, antifungicos, bacteriostáticos y biocontroladores de plagas, necesarios para la innovación en áreas biotecnológicas y bioquímicas. • Se aislaron en total 123 cepas, de las cuales se identificaron mediante estudios de género y especie 40 cepas. • Se siguió una cadena de parámetros en la identificación, centrándose en las características metabólicas mediante procesos bioquímicos, sus requerimientos y condiciones de cultivo, el nicho ecológico y por último las características taxonómicas: microscópicas mediciones celulares mediante microscopio motic y macroscópicas con la caracterización morfológica de las colonias. • Mediante los diferentes pases en agar nutritivo y agar extracto de suelo se obtuvieron las diferentes cepas bacterianas puras y viables. • Utilizando los diferentes métodos de conservación (glicerol al 20%, sensidiscos y en suelo), se mantuvo la colección de cepas en condiciones puras y genéticamente estables, para que en tiempos futuros sean utilizadas mediante nuevas técnicas en descubrimiento de capacidades metabólicas. 9. RECOMENDACIONES • Llevar a cabo procesos de aislamiento e identificaci0n in situ, así mismo cultivar las cepas bacterianas a temperatura de 5ºC correspondiente a la temperatura aislada del suelo de un páramo, para recuperar aquellos géneros bacterianos que no son tolerantes a las temperaturas comúnmente utilizadas en incubación y enriquecimiento. • Realizar pruebas confirmativas mediante identificación molecular y así mismo realizar comparación mediante el banco de genes. • Ejecutar extracciones en secciones de genes codificantes para poder establecer una mejor caracterización de las propiedades metabólicas, de síntesis y tolerancia de una célula bacteriana. • Evaluar estadísticamente los diferentes métodos de muestra y técnicas de recuperación celular a partir de suelo según: numero de colonias aisladas y recuperadas, propiedades representativa, número de muestreos entre otros. 10. REFERENCIAS de muestra ABREU J., GONZÁLEZ J. y JAQUEMAN F. 2003. Conservación por liofilización de diferentes especies de géneros de levaduras. Rev. Alimentaria. Pp. 119-122 ALBERT, D. Eds. 1996. Bioremediation of and experimental oil spill on the shoreline of Delaware Bay. Environmental Science echnology. Vol 30:5 pp: 1764-1775. ALEXANDER, M. 1977. Introduction to Soil Microbiology. Segunda Edición. Wiley. Nueva Cork. ALTAMIRANO M. y POZZO M. 2000. Aislamiento e identificación de bacterias hidrocarburolíticas provenientes de un suelo sometido a biorremediación. Instituto Universitario de Ciencias de la Salud. Universidad Nacional del Comahue. ATLAS, M. R. y BARTHA, R. 2002 Ecología microbiana y microbiología ambiental. Segunda edición. Editorial Addison Wesley. Madrid, España. 217-218 BAYONA A. 2003. Conservación y mantenimiento de cepas microbianas con fines docentes e investigativos. RMSC. Vol. 20 (36) BERGEY D. Bergey's manual of determinative bacteriology.1984. Editorial Lippincott Williams & Wilkins. Philadelphia, Estados Unidos de Norte América. BERGEY D. Bergey's manual of determinative bacteriology. 2000. Novena edición. Editorial Lippincott Williams & Wilkins. Philadelphia, Estados Unidos de Norte América. BERNAL E., CELIS S., GALÍNDEZ X., MORATTO C., SÁNCHEZ J. y GARCÍA D. 2006. Microflora cultivable y endomicorrizas obtenidas en hojarasca de bosque (páramo guerrero finca puente de tierra) zipaquirá, Colombia. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá. Colombia. Acta biol.Colomb. v.11 BORRAD, R. G. y LOVELOCK D. W. 1973. Sampling Microbiological Monitoring of Environments. Academic Press, Londres. CAMACHO S. y HERNÁNDEZ N. 2002. Aislamiento e Identificación de población bacteriana aerobia presente en la zona de frailejones en muestras de suelo del páramo de Guasca - Cundinamarca (Colombia). Trabajo de grado. Pontificia Universidad Javeriana. Departamento de Microbiología Industrial. Bogotá, Colombia CÁRDENAS G. y MORENO G. 1993. Características foliares adoptivos en 6 comunidades vegetales del páramo Cruz Verde (Cundinamarca). Tesis pregrado. Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Biología. Bogotá. CARRASCAL A. PÁEZ A y BURBANO M. 2003. Manual de laboratorio: microbiología de alimentos. Centro editorial Javeriano. Bogotá, Colombia. CORREDOR I. 2002. Evaluación del efecto de dos métodos de conservación sobre diferente microorganismos con interés en control biológico. Trabajo de Grado. Pontificia Universidad Javeriana. Departamento de Microbiología Agrícola y Veterinaria. Bogotá, Colombia CHITIVA A. TORRENEGRA R. CABRERA C. DÍAZ N y PINEDA V. Contribución al estudio de microhongos filamentosos en los ecosistemas páramo de guasca y el tablazo. Estudio preliminar de mohos de páramos Colombianos. Grupo de investigación en Fotoquímica y Biotransformación. Departamento de química. Pontificia Universidad Javeriana. CHOLODNY, N. 1930. Ülber eine neue Methode zur Utersuchung der Bodenmikflora. Archiv fiir mikrobiologie (Berlin) 1:650-652. DE LA ROSA Z. 1996. Correlación del método turbidimetrico para siete microorganismos de utilidad industrial. Tesis de pregrado. Bacteriología. Pontificia Universidad Javeriana. DUXBURY, J.M., SMITH,M.S. and DORAN, J.W. 1989. Soil organic matter as a source and sink of plant nutrients. In: Coleman, D:C: Oades, J:M: and Uehara, G. (eds). Dynamycs of Soil Organic Matter in Tropical Ecosystems. Honolulu. Hawaii, USA. University of Hawaii Press. EPSA. 1991. Bioaumentación. Microorganismos vivos en suspensión líquida. Tratamiento de aguas residuales, industriales, municipales y domesticas. Bogotá pp: 1-17 FLOCARI. M. 1998. Métodos de conservación de cultivos bacterianos. Revista argentina de microbiología, vol. 30 pp: 42-51, ISSN 0235 – 7541. Buenos Aires- Argentina. FORSYTHE W. 2002. Parámetros ambientales que afectan la temperatura del suelo en turrialba, costa rica y sus consecuencias para la producción de cultivos. Agronomfa Costarricense 26(1): 43-62. GARCÍA, A y ORDOÑES, D. 2003. Aislamiento y caracterización de bacterias no filamentosas con capacidad degradadora de plaguicidas a partir de suelo superficial de cultivos de arroz (Oryza sativaL,). Trabajo de grado. Microbiología industrial. Facultad de Ciencias. GARCÍA D. y URUBURU F. 2000. La conservación de cepas microbianas. Colección Española de Cultivos Tipo (CECT). Universitat de València. Burjassot Valencia – España. Act SEM 30:1-8 GARCÍA M. 1999. La conservación de las cepas microbianas, colección española de cultivos tipo CECT. Universidad de Valencia. pp: 28: 12-3 GRAY T. y PARKINSON D. 1968. The ecology of soil Bacteria. University of Toronto Press. Toronto. Canadá. GRANT W. 1989. Microbiología ambiental. Editorial Acribia. ZaragozaEspaña GUHL E. 1982. Los Páramos Circundantes de la Sabana de Bogotá. Jardín Botánico “José Celestino Mutis”. Bogotá. HAMAKY T., SUZUKI M., FUDOU R., JOJIMA Y., KAJIURA T., TABUCHI A., SEN K. and SHIBAI H. 2005. Isolation of Novel Bacteria and Actinomycetes Using Soil-Extract Agar Medium. Journal of Bioscience and Bioengineering. Vol. 99 (5) pp 485-492 HANSEL CM. FENDORF S. JARDINE PM. Y FRANCIS CA. 2008. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile. Department of Geological and Environmental Sciences, Stanford University, Stanford, California. HENAO I, FRANCO M y MARIN G. 2006. Evaluación de métodos de conservación para Aspergillus niger con actividad enzimática amilolitica. Universitas Scientiarum. Vol 11 (002) pp: 51-60 HURST J, KNUDSEN R, MCINERNEY J, STETZENBACH D, y WATTER V. 1997. Manual of Environmental Microbiology. American Society for Microbiology Press, Washington, DC. ICONTEC. NORMA TÉCNICA COLOMBIANA. 1997, Gestión ambiental. Calidad de suelo. Muestreo, Guía para la recolección, manejo y almacenamiento de suelo para la evaluación de procesos microbianos aeróbicos en el laboratorio. IGAC. 1984. Estudios físico-Químico del suelo. Bogotá. JAIMES V. y SARMIENTO L. 2002. Regeneración de la vegetación de páramo después de un disturbio agrícola en la cordillera oriental de Colombia. ECOTROPICOS 15(1):61-74 KATHRYN E. JOSEPH S. y JANSEEN P. 2004. Effects of growth medium, inoculums size, and incubation time on culturability and insolation of soil bacteria. Applied and environmental microbiology. Vol. 71, No 2. Pag. 826-824. KONEMAN E. 2001. Diagnostico microbiológico: texto y atlas color. 5ta. Edición. Editorial Médica Panamericana. Buenos Aires, Argentina. LEVEAU J. 2000. Microbiología industrial: los microorganismos de interés industrial, editorial Acribia. Zaragoza, España. MacFADDIN J. 2003. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. Tercera edición. Editorial Médica Panamerica. Buenos Aires. MADIGAN M. MARTINKO J. y PARKER J. 2000. Brock. Biología de los microorganismos. Octava Edición. Prentice Hall. Madrid-España MALAGÓN, D. y PULIDO, C. 2000. Suelos del Páramo Colombiano. En: Rangel, O. (Ed.). Colombia Diversidad Biótica III. La Región de Vida Paramuna. Universidad Nacional de Colombia. Facultad de Ciencias. Instituto de Ciencias Naturales. Bogotá, Colombia. pp. 37-84. MERCHAN S. 2003. Comportamiento de un suelo fino estabilizado con columnas de cal, suelo y cemento, análisis con modelo experimental. Trabajo de grado. Facultad de Ingenería. Pontificia Universidad Javeriana. Bogotá. MESA, R y MONROY, A. 2002. Evaluación de la esterilidad del método de criopreservación en glicerol 10% v/v para el establecimiento de una banco de cepas. Trabajo de grado. Facultad de Ciencias. Pontificia Universidad Javeriana. Bogotá MONROY A. MESA R. RODRÍGUEZ P. POUTOU R. PEDROSA A. 2002. Estudio preliminar para la conservación de cepas mediante la técnica de glicerol para una industria cervecera. III Congreso Internacional de Microbiología Industrial. Pontificia Universidad Javeriana. Bogotá, Colombia. NAUMAN R y WILKIE E. 1974. Isolation of bacteriophage for Caryophanon latum. Journal of Virology 13 (5), pp: 1151-1152 NAVARRO S. y NAVARRO G. 2000. Química Agrícola. El suelo y los elementos químicos esenciales para la vida vegetal. Editorial MundiPrensa. Madrid. Pág 15-16 NIIMURA Y, KOH E, YANAGIDA E, SUZUKI F, KOMAGATA K y KOZAKI K. 1990. Amphibacillus xylanus gen. nov., sp. nov., a facultatively anaerobic sporeforming xylan-digesting bacterium which lacks cytochrome, quinone, and catalase. International Journal of Systematic Bacteriology Vol. 40, no. 3, pp. 297-301. ÖMER K. y BOLAT I. 2007. Influence of soil compaction on microfungal community structure in two soil types in Bartin Province, Turkey. Zonguldak Karaelmas University Scientific Research Projects Committee. ORDOÑEZ P. 1998. Evaluación de la participación de bacterias del Género Bacillus en los procesos de degradación de los lodos de las lagunas de oxidación. Tesis de pregrado. Microbiología industrial. Pontificia Universidad Javeriana. PEDROZA A. 1999. Producción de amilasa termoestable a partir de Thermus sp. Tesis de maestría. Facultad de ciencias. Pontificia universidad javeriana. PEDROZA A. MATIZ A. QUEVEDO B. AGUIRRE A. 2003. Manual de laboratorio de biotecnología industrial. Centro editorial Javeriano. Bogotá, Colombia. PRESCOTT L. 2004. Microbiología. 5a Ed. Editorial McGraw-Hill Interamericana. Madrid-España. RICO M. 2004. Microbiología general. Primera Edición. Fotocopiar Impresores. Bogotá, Colombia. ROUSK J. DEMOLING L. BAHR A. y BẬẬTH E. 2008. Examining the fungal and bacterial niche overlap using selective inhibitors in soil. FEMS Microbiol. Ecol. 350-358. RUSELL S. PHYLLIS A, y REICHELDERFER C. 1987. Selective Process for Efficient Isolation of Soil Bacillus spp. Appl. Environ. Microbiol. 53(6): 1263–1266. SALVE L. AMICH S. PRIETO.S y CASAS A. 1997. Laboratorio clínico: bioquímica. Editorial McGraw-Hill. Interamericana, Madrid, España. SANCHEZ L. y CORRALES C. 2005. Evaluación de la congelación para conservación de especies autóctonas bacterianas. Programa de Bacteriología y Laboratorio Clínico. Facultad Ciencias de la Salud. Universidad Colegio Mayor de Cundinamarca. SANDERS M, MORELLI M y TOMPKINS A. 2003. Sporeformes as human probiotics: Bacillus, Sporobacillus y Bevibacillus. Rev Food Science and Food Safety. Vol 2 pp: 101-110. SERR ANO S. 1990. Introducción a las aplicaciones de las enzimas. Editorial alhambra. Madrid-España. SHAYNE J. HUGENHOLTZ P. SANGWAN P. OSBORNE C. y JANSSEN P. 2003. Laboratory cultivation of widespread and previously uncultured soil bacteria. Applied and environmental microbiology. Vol 69, No. 12. Pag. 7210-7215. SIRAGUSA G y NETTLES C. 1993. Brochosin-C a new bacteriocin produced by Brechothrix campestris. Applied and environmental microbiology. Vol 59 (3) p p. 2326-2328. SOLOMON E., BERG L., MARTIN D y VILLEE C. 1996. Biologia de Villee. Tercera Edición. Editorial Interamericana Mcgraw Hill. Mexico D.F. Mexico. STANIER R. INGRAHAM J. WHEELIS M. y PAINTER P. 1992. Microbiología. Segunda Edición. Editorial Reverte, S.A. Baecelona, Espeña. VALBUENA E, BARREIRO J, SÁNCHEZ E, CASTRO G, BRÍÑEZ W y TOVAR A. 2005. Modelos sintéticos aplicados al crecimiento de Lactococcus lactis en leche. Revista científica 15 (5) VALENCIA H. 1979. La microbiología del Suelo y sus Perspectivas. Boletín Informativo Departamento de Biología, 1:1-18.UNC. Colombia. WILHELM L. 1981. Ecoclimatological Conditions of the Paramo Belt in the Tropical High Mountains Mountain Research and Development, Vol. 1, No. 3/4, pp. 209-221 WULF C. y ANNELIESE C. 1993. Biotecnología: Manual de microbiología industrial. Editorial Acribia. Zaragoza – España ANEXO 1 RESULTADOS DE LAS BIOQUÍMICAS • VOGES-PROSKAUER • ROJO DE METILO • REDUCCIÓN DE NITRATOS • UREASA • PRUEBA DE CITRATO • PRUEBA CATALASA • INDOL Fuente: www.joseacortez.com