Mad jun 04 - Mestre a casa
Anuncio

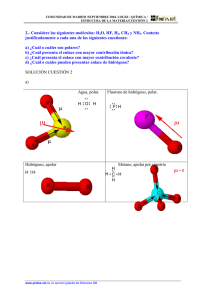
MADRID /JUNIO 04. LOGSE / QUÍMICA / ESTRUCTURA DE LA MATERIA/CUESTIÓN 2 Cuestión 2.- Dadas las moléculas HCl, KF y CH2Cl2: a) Razone el tipo de enlace presente en cada una de ellas utilizando los datos de electronegatividad. b) Escriba la estructura de Lewis y justifique la geometría de las moléculas que tienen enlaces covalentes. Datos.- Valores de electronegatividad: K = 0,8; H = 2,1; C = 2,5; Cl = 3,0; F = 4,0. Solución a) H-Cl → Enlace covalente molecular polar KF → Enlace iónico ( F- y K+) .Diferencia de electronegatividades muy grande: 4 - 0,8 = 3,2 CH2Cl2 → Enlace covalente molecular. Los enlaces C-Cl están más polarizados que los C-H, debido a una mayor diferencia de electronegatividades entre los átomos. La molécula es polar, ya que presenta un momento dipolar total. b) H Cl C Cl H Cl H HCl geometría lineal µ Cl CH2Cl2 geometría tetraédrica Cl µ µt H Covalente polar µ H µ µ H Covalente polar www.profes.net es un servicio gratuito de Ediciones SM Cl




![Avance 2 [Equipo 3]](http://s2.studylib.es/store/data/009095275_1-f7551ea29a7444c1555d28de2be76fd4-300x300.png)