Tema 10 Tratamientos de los materiales
Anuncio

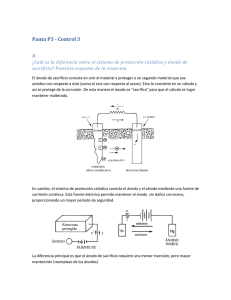
Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación Guión 1. Clasificación del acabado y tratamiento de los metales. 2. Tratamiento de los metales. Tratamientos térmicos. Temple. Recocido. Normalizado. Revenido Tratamientos termoquímicos. Cementación. Nitruración. Cianuración. Sulfinización. 3. La oxidación, corrosión y sus efectos. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación 2. Tratamientos de los metales Tratamientos térmicos Consisten en operaciones de calentamiento y enfriamiento a los que se somete a los metales para conseguir determinados cambios en la estructura cristalina pero sin variar la composición química. OBJETIVO: Mejorar las propiedades de los metales y aleaciones, por lo general, de tipo mecánico. En ocasiones se utiliza este tipo de tratamientos para, posteriormente, conformar el material. Temple El temple se utiliza para obtener un tipo de aceros de alta dureza llamado martensita. Se trata de elevar la temperatura del acero hasta una temperatura cercana a 1000 ºC y posteriormente someterlo a enfriamientos rápidos o bruscos y continuos en agua, aceite o aire. La capacidad de un acero para transformarse en martensita durante el temple depende de la composición química del acero y se denomina templabilidad. Al obtener aceros martensíticos, en realidad, se pretende aumentar la dureza. El problema es que el acero resultante será muy frágil y poco dúctil, porque existen altas tensiones internas y disminuye el alargamiento unitario. Ensayo de templabilidad o ensayo de Jominy El ensayo de Jominy consiste en templar una muestra estándar de acero llamada probeta con un chorro de agua de caudal y temperatura constante. La temperatura de la probeta se eleva y se proyecta el chorro de agua por uno de los extremos de la probeta. Ese extremo de la probeta se enfriará rápidamente, sufriendo el temple y será más duro que el otro extremo. Luego se mide la dureza de la probeta cada 1,5 mm a lo largo y se traza la curva de templabilidad. La curva de templabilidad asegura que si la dureza disminuye rápidamente conforme nos alejamos del extremo templado, el acero tendrá una templabilidad baja, mientras que los aceros cuyas curvas son casi horizontales serán de alta templabilidad, es decir, susceptibles de endurecerse rápido cuando sufren temple. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación Fíjate en el siguiente diagrama: Corresponde a dos ensayos de Jominy con dos materiales diferentes. En vertical se presenta la dureza y en horizontal se presenta la distancia desde el extremo templado. Se observa que, a media que nos alejamos del extremo templado, la dureza (HRC) disminuye. Se puede observar que el descenso de la dureza en la curva inferior es más rápido, con lo cual podemos afirmar Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación que en ese caso, la probeta tendrá baja templabilidad, es decir, que ese acero tiene menos capacidad para transformarse en un acero de alta dureza (martensita) cuando se enfría rápidamente con un líquido (normalmente agua). Revenido El revenido es el tratamiento térmico que sigue al temple y es por tanto un tratamiento complementario del temple. Recuerda que un acero templado es aquel que tiene una dureza muy alta (llamado martensita), pero tiene el inconveniente de ser frágil y poco dúctil porque tiene tensiones internas. El revenido consiste en calentar la pieza templada hasta cierta temperatura, para reducir las tensiones internas que tiene el acero martensítico (de alta dureza). De esto modo, evitamos que el acero sea frágil, sacrificando un poco la dureza. La velocidad de enfriamiento es, por lo general, rápida. Recocido El recocido consiste en calentar un material hasta una temperatura dada y, posteriormente, enfriarlo lentamente. Se utiliza, al igual que el caso anterior, para suprimir los defectos del temple. Se persigue: Eliminar tensiones del temple. Aumentar la plasticidad, ductilidad y tenacidad del acero. ¿Cómo se practica el recocido? 1. Se calienta el acero hasta una temperatura dada. 2. Se mantiene la temperatura durante un tiempo. 3. Se enfría lentamente hasta temperatura ambiente, controlando la velocidad de enfriamiento. Si la variación de temperatura es muy alta, pueden aparecer tensiones internas que inducen grietas o deformaciones. El grado de plasticidad que se quiere dotar al metal depende de la velocidad de enfriamiento y la temperatura a la que se elevó inicialmente. Normalizado Este tratamiento se emplea para eliminar tensiones internas sufridas por el material tras una conformación mecánica, tales como una forja o laminación Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación para conferir al acero unas propiedades que se consideran normales de su composición. El normalizado se practica calentando rápidamente el material hasta una temperatura crítica y se mantiene en ella durante un tiempo. A partir de ese momento, su estructura interna se vuelve más uniforme y aumenta la tenacidad del acero. Tratamientos termoquímicos Cementación: Consiste en aumentar la cantidad de carbono de la capa exterior de los aceros. Se mejora la dureza superficial y la resiliencia. Se aplica a piezas que deben ser resistentes a golpes y la vez al desgaste. Se aplica a los aceros. Nitruración: Consiste en endurecer la superficie de los aceros y fundiciones. Las durezas son elevadas y tienen alta resistencia a la corrosión. El componente químico añadido es nitrógeno, que se obtiene del amoniaco. Cianuración o carbonitruración: Se trata de endurecer la superficie del material introduciendo carbono y nitrógeno. Es una mezcla de cementación y nitruración. La temperatura es intermedia entre la utilizada para la cementación y la nitruración, que es mucho menor que aquella. Se aplica a los aceros. Sulfinación: Se trata de introducir en la superficie del metal azufre, nitrógeno y carbono en aleaciones férricas y de cobre. Se aumenta la resistencia al desgaste, favorece la lubricación y disminuye el coeficiente de rozamiento. 4. La oxidación, la corrosión y sus efectos. Proceso de oxidación y corrosión. En primer lugar vamos a hacer la distinción entre oxidación y corrosión: Oxidación: reacción química en la cual el elemento que se oxida cede electrones al elemento oxidante. De forma esquemática se puede expresar la oxidación como: Material + Oxígeno Óxido del material ± Energía El más popular de los oxidante por su presencia en el aire atmosférico es el O 2, aunque existen muchos otros como el cloro, el bromo, el hidrógeno ,etc. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación Algunos metales son especialmente resistentes a la oxidación, como el níquel, cromo, aluminio o cobre, al igual que las aleaciones de las que forman parte. El bronce como ejemplo de aleación de cobre, y el acero inoxidable como ejemplo de aleación de acero, níquel y cromo, son muestras de aleaciones resistentes a la corrosión. Hasta ciertos límites de espesor y temperatura, la capa de óxido que se forma y recubre el material puede servir de protección e impedir que esta siga avanzando. Pero al elevar la temperatura, su puede agrietar la capa de óxido y permitir el paso de oxígeno facilitando el avance de la oxidación hasta el interior del material. Corrosión: es la destrucción lenta y progresiva de un material, producida por el oxígeno del aire cuando aparece combinado con la humedad. Los agentes corrosivos más habituales son el cloruro de sodio presente en el agua del mar, y el dióxido de azufre que se produce en las combustiones. En este caso, el metal es atacado por un agente corrosivo en presencia de un electrolito. Un electrólito es cualquier sustancia, normalmente líquida, que contiene iones libres, que se comportan como un medio conductor eléctrico. Normalmente un electrolito es una disolución, en la que el disolvente suele ser agua y el soluto otra sustancia. El ejemplo más conocido es el agua del mar (el cloruro sódico es un agente corrosivo), que actúa como electrolito. Los procesos de corrosión son procesos electroquímicos, ya que en la superficie del metal se generan “micropilas galvánicas” en las que la humedad actúa como electrólito. El metal actúa como ánodo (polo positivo) y, por lo tanto, se disuelve. Así, el electrólito actúa como medio conductor a través del cual viajan las cargas que abandonan los electrones del ánodo que se corroe, el metal. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación Ánodo: Metal que cede electrones y se corroe. Cátodo: Receptor de electrones. Electrolito: Líquido que está en contacto con el ánodo y el cátodo. Debe ser conductor eléctrico. Este líquido proporciona el medio a través del cual se asegura el desplazamiento de cargas eléctricas desde el ánodo hasta el cátodo. Existe un tipo de corrosión de tipo electroquímico que aparece cuando se juntan metales diferentes o son conectados eléctricamente. Al producirse el contacto, el metal más electronegativo desempeña el papel de ánodo y, por tanto, sufre la corrosión. Por último decir que la corrosión puede ser uniforme, localizada e intergranular: En la corrosión uniforme (figura a), el espesor de la zona afectada es igual en toda la superficie del metal. Al disminuir el espesor de la pieza, también decrece su resistencia mecánica. Es el caso típico de los metales atacados con ácidos. La corrosión localizada (figura b) produce picaduras, hoyos, surcos en la superficie del metal. En este tipo de corrosión, disminuye la capacidad de Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación deformación y es muy difícil de prevenir. El hierro atacado por el agua del mar es el ejemplo más conocido. En la corrosión intergranular (figura c), el ataque se localiza en la unión de los granos de los constituyentes de los metales y provoca perdida de cohesión entre ellos. El metal puede llegar a desintegrarse totalmente sin que se aprecie ninguna alteración superficial. Técnicas de protección frente a la oxidación y la corrosión Impedir la corrosión implica impedir reacciones electroquímicas. Es decir, eliminar la posible presencia de un electrolito que actúe como medio conductor para facilitar una reacción de transferencia de electrones desde un metal anódico. Así, las soluciones podrían ser: 1. Selección adecuada de materiales: elegimos un material lo suficientemente resistente a la corrosión para las condiciones en las que va a ser utilizado. A este respecto se pueden mencionar los aceros inoxidables y también algunos tipos de materiales cerámicos, si bien estos últimos presentan el inconveniente de su fragilidad. 2. Protección por recubrimiento: Es decir, crear una capa o barrera que aísle el metal del entorno. Dentro de este tipo de protección podemos hallar: Recubrimientos no metálicos: siendo los más comunes... o Pinturas y barnices: Es económico y exige que la superficie esté limpia de óxidos y grasas o Plásticos: Son muy resistentes a la oxidación y son flexibles, pero apenas resisten el calor. El más empleado es el PVC. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación o Esmaltes y cerámicos: Tiene la ventaja de resistir las altas temperaturas y el desgastes. Recubrimientos metálicos: o Inmersión: Se recubre el metal a proteger en un baño de metal fundido. El metal al solidificar forma una fina capa protectora. Los metales más empleados son... a) Estaño (la técnica se llama estañado): latas de conserva. b) Aluminio (la técnica se llama aluminización): Es económico y con calidad. c) Plomo (la técnica se llama plombeado): Para recubrir cables y tuberías. d) Cinc (la técnica se llama galvanizado): Para vigas, vallas, tornillos,...y otros objetos de acero. o Electrodeposición (mediante electrólisis, que puede considerarse como el fenómeno opuesto a la corrosión) : En este caso se hace pasar corriente eléctrica entre dos metales diferentes que están inmersos en un líquido conductor que hace de electrolito. Uno de los metales será aquel que hará de ánodo, el cual se oxidará y sacrificará. El otro metal, el que se desea proteger, hará de cátodo y ambos estarán inmersos en el electrolito que estarán en una cuba. Cuando pasa la corriente eléctrica, sobre el metal catódico se crea una fina capa protectora hecha del material procedente del metal anódico, pues la pila obliga a ceder electrones al ánodo que alcanzarán al cátodo. Cuando el metal que hace de cátodo y se desea proteger es acero y el otro que va a protegerlo (que hace de ánodo) es cinc, el proceso se llama galvanizado. Controlando el tiempo y la intensidad de la corriente se puede determinar la cantidad de metal depositado según la ley de Faraday). 3. Protección por capa química: Se provoca la reacción de las piezas con un agente químico que forme compuestos en su superficie que darán lugar a una capa protectora. Por ejemplo: Cromatizado: Se aplica una solución de ácido crómico sobre el metal a proteger. Se forma una capa de óxido de cromo que impide su corrosión. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación Fosfatación: Se aplica una solución de ácido fosfórico y fosfatos sobre el metal. Se forma una capa de fosfatos metálicos que la protegen del entorno. 4. Protección catódica: Se fuerza al metal a comportarse como un cátodo, suministrándole electrones. Se emplea otro metal que estará en contacto con el metal que se desea proteger, llamado “ánodo de sacrificio”, el cual se corroe y acaba destruyéndose aportando electrones al metal. En definitiva, el metal “ánodo de sacrificio” se pone en contacto con el metal a proteger el cual recibe electrones del primero. Se necesita la presencia de un electrolito. Se emplea mucho en tuberías enterradas. 5. Inhibidores: Se trata de añadir productos químicos al electrolito para disminuir la velocidad de la corrosión. 6. Buen diseño: podemos indicar las siguientes normas generales de diseño: Para prevenir la corrosión por grieta son preferibles las uniones soldadas que las remachadas. Y si han de emplear remaches, estos han de ser de un material catódico respecto a los materiales que se unen. En la medida de lo posible deben usarse metales galvánicamente similares. Y en caso de no ser así, resulta conveniente utilizar una arandela de material no conductor, que evite contacto eléctrico entre los metales. No se deben diseñar ángulos pronunciados en tuberías por las que circulen fluidos a alta velocidad, para evitar que se produzca corrosión por erosión. También es importante que en las tuberías no haya puntos calientes que potencien la corrosión generalizada. Tema 10 Tratamientos de los materiales 2º de Bachillerato Último tema 2ª evaluación A la hora de calcular secciones de estructuras que vayan a estar sometidas a atmósferas agresivas, se deben tener en cuenta los efectos de la corrosión. Los tanques y depósitos destinados al almacenamiento de sustancias corrosivas deben estar provistos de un sistema de desagüe que permita su limpieza y vaciado. Los elementos sometidos a condiciones extremas de corrosión deben estar situados de tal manera que resulte fácil su inspección y sustitución en caso.