Reacciones de reordenamiento molecular
Anuncio
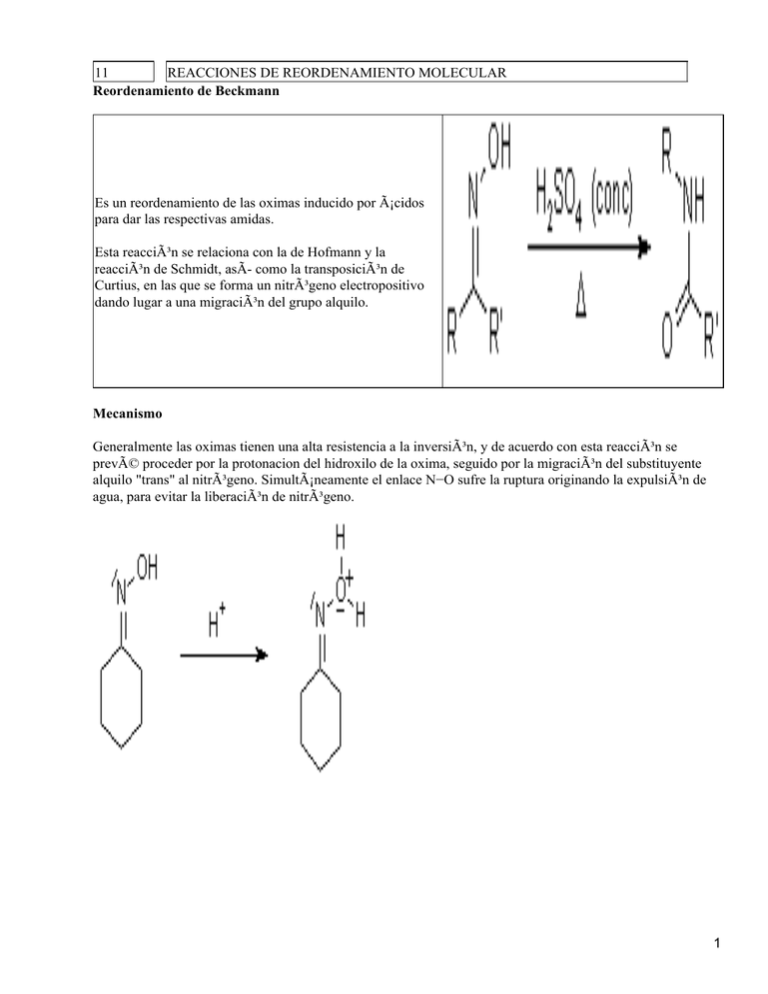
11 REACCIONES DE REORDENAMIENTO MOLECULAR Reordenamiento de Beckmann Es un reordenamiento de las oximas inducido por ácidos para dar las respectivas amidas. Esta reacción se relaciona con la de Hofmann y la reacción de Schmidt, asÃ- como la transposición de Curtius, en las que se forma un nitrógeno electropositivo dando lugar a una migración del grupo alquilo. Mecanismo Generalmente las oximas tienen una alta resistencia a la inversión, y de acuerdo con esta reacción se prevé proceder por la protonacion del hidroxilo de la oxima, seguido por la migración del substituyente alquilo "trans" al nitrógeno. Simultáneamente el enlace N−O sufre la ruptura originando la expulsión de agua, para evitar la liberación de nitrógeno. 1   Literatura Reciente: L. De Luca, G. Giacomelli, A. Porcheddu, J. Org. Chem., 2002, 67, 6272−6274. S. Chandrasekhar, K. Gopalaiah, Tetrahedron Lett., 2003, 44, 755−756. Reordenamiento de Curtius: El reordenamiento molecular de Curtius consiste en la descomposición térmica de azidas del carboxilo para producir un isocianato. Estos intermedios pueden aislarse, o su reacción correspondiente o productos de hidrólisis La sucesión de la reacción − incluyendo que los azida del acilo en el caso presente se han preparado del la reacción subsiguiente con agua que haluro de acilo y una sal del azida lleva a la amina − se nombra como la 2 Reacción de Curtius. Esta reacción es similar a la Reacción de Schmidt con los ácidos, difiriendo en Mecanismo: Preparación de azidas: Descomposición: La reacción del isocianato con el agua da ácido carbámico inestable, que sufrirá una decarboxilación espontánea, originando la amina respectiva: Los isocianatos son materiales de partida muy versátiles en la sÃ-ntesis orgánica: Los isocianatos también son de interés como el monómero para el trabajo de polimerización y en el derivatización de biomacromoléculas. Literatura Reciente: H. Lebel, O. Leogane, Org. Lett., 2005, 7, 4107−4110. L. Marinescu, J. Thinggaard, I. B. Thomsen, M. Bols, J. Org. Chem., 2003, 68, 9453−9455. 3 L. Marinescu, J. Thinggaard, I. B. Thomsen, M. Bols, J. Org. Chem., 2003, 68, 9453−9455. Reacción de Schmidt La reacción de azida de hidrógeno catalizada por ácidos, con los electrófilos, como los compuestos carbonÃ-licos, alcoholes terciarios o alquenos, forman compuestos que después de un reordenamiento y expulsión de N2, producen amines, nitrilos, amidas o iminas. Mecanismo: La reacción con ácidos carboxÃ-licos da azidas del acilo que se reordenan al isocianato respectivo y éstos pueden ser hidrolizados al ácido carbámico o solvolizados al carbamato. La correspondiente decarboxilación, lleva a las aminas. La reacción con una cetona da un intermedio del azidohidrina que se reordena para formar una amida: 4 Los alquenos pueden sufrir la adición de HN3 como con cualquier reactivo de HX, y los azida del alquilo resultantes pueden reestructurarse para formar un imina: Los alcoholes terciarios dan la substitución por el azida vÃ-a un ión carbeno, y los azida de alquilo resultantes pueden reestructurarse para formar una imina. Literatura Reciente Gold(I)−Catalyzed Intramolecular Acetylenic Schmidt Reaction D. J. Gorin, N. R. Davis, F. D. Toste, J. Am. Chem. Soc., 2005, 127, 11260−11261. Reordenamiento BencidÃ-nico: Las 1,2−dicetonas sufren un reordenamiento en presencia de una base fuerte, produciendo los ácidos hidroxicarboxilicos. Los rendimientos más altos se obtienen cuando las dicetonas no tienen los protones enolizables. La reacción de una di cetona cÃ-clica lleva a una reducción del anillo interesante: Los cetoaldehidos no reaccionan de la misma manera dónde se prefiere un cambio del hidruro (vea la Reacción de Cannizzaro) Mecanismo 5 La transposición de Claisen La transposición de Claisen es una reestructuración [3,3]−sigmatrópica en la que un éter de vinilo alÃ-lico se convierte termalmente a un compuesto de carbonÃ-lico insaturado. La Transposición de Claisen aromática se acompaña por una rearomatización: La eterificación de alcoholes o fenoles y su subsiguiente transposición de Claisen bajo las condiciones. termales adecuadas, permiten la extensión de la cadena del carbono de la molécula Mecanismo La transposición o reordenamiento de Claisen puede verse como la oxa−variante del reordenamiento de Cope:  Mecanismo de reordenamiento de Cope 6 Mecanismo del reordenamiento de Claisen La reacción procede preferentemente vÃ-a un estado de transición del tipo silla. Los materiales de partida con átomo de carbono quiral, dan productos de pureza óptica alta. Un estado de transición de barco también es posible, y puede llevar hacia la formación de los productos: La transposición de Claisen aromática, es seguida por un rearomatization: Cuando la posición orto está sustituida, la rearomatización no es posible. El grupo alilo debe sufrir primero un reordenamiento de Cope, para ubicarse luego en la posición para antes de que se produzca una tautomerización sea posible. Todas las reacciones de transposicÃ-on de Claisen descritas para que tengan lugar requieren de temperaturas > 100 °C sin ningún catalizador. La observación de la forma de cómo se retira el electrón del C−1 del 7 grupo vinilo ejerce una influencia positiva en la proporción de la reacción y el rendimiento ha llevado al desarrollo de las variaciones siguientes: • Reordenamiento de Irlanda−Claisen • La transposición de Eschenmoser−Claisen • La transposición de Johnson−Claisen Literatura  Reciente Using Geminal Dicationic Ionic Liquids as Solvents for High−Temperature Organic Reactions X. Han, D. W. Armstrong, Org. Lett., 2005, 7, 4205−4208. A Domino Copper−Catalyzed C−O Coupling−Claisen Rearrangement Process G. Nordmann, S. L. Buchwald, J. Am. Chem. Soc., 2003, 125, 4978−4979. Tandem Horner−Wadsworth−Emmons Olefination/Claisen Rearrangement/Hydrolysis Sequence: Remarkable Acceleration in Water with Microwave Irradiation E. Quesada, R. J. K. Taylor, Synthesis, 2005, 3193−3195. Asymmetric Claisen Rearrangements Enabled by Catalytic Asymmetric Di(allyl) Ether Synthesis S. G. Nelson, K. Wang, J. Am. Chem. Soc., 2006, 128, 4232−4233. Gold(I)−Catalyzed Synthesis of Highly Substituted Furans M. H. Suhre, M. Reif, S. F. Kirsch, Org. Lett., 2005, 7, 3873−3876. Reordenamiento de Ireland−Claisen Esta variante a la transposición de Claisen emplea el éster alÃ-lico de un ácido carboxÃ-lico en lugar de un éter de alil−vinilico. El éster se convierte a su enolate silil−estabilizado (el acetal de cetona de silil) que se reordena a temperaturas por debajo de 100 °C. El producto inmediato del reordenamiento es un ácido carboxÃ-lico del ester silil, no puede aislarse y puede hidrolizarse durante la reacción. El reordenamiento de Irlanda−Claisen permite de este modo, acceder a ácidos carboxÃ-licos de cadena extendida Mecanismo Como ocurre en la transposición de Claisen, la modificación de Irlanda procede también con un grado alto de estereoselectividad: 8 Una ventaja de la transposición de Irlanda−Claisen es la opción de controlar la geometrÃ-a del enolate a través de la opción adecuada del solvente: Literatura Reciente: S. P. Miller, J. P. Morken, Org. Lett., 2004, 60, 2743−2745. Reordenamiento de Cope/ (Anionic) Oxy−Cope Rearrangement La transposición de Cope consiste en la isomerización termal de un 1,5−dieno que lleva a un regioisómero 1,5−dieno. El producto principal es el regioisómero termodinámicamente más estable. La transposición Oxi−Cope tiene un substituyente del hidroxilo en un carbono con hibridación sp3 en el material isomérico de partida. 9 La fuerza o tendencia para producir la transposición aniónica de Cope es que el producto sea un enol o enolato que tautomerice al compuesto del carbonilo correspondiente. La transposición de Cope es beneficiada cuando el alcohol de partida es desprotonado por ejemplo con KH. La reacción transcurre entonces más rápidamente y puede efectuarse a temperatura ambiente. Mecanismo Dos estados de transición son posibles, y el resultado de la reacción puede predecirse en base al solapamiento más favorable solape de los orbitales del doble enlace, los cuales se hallan influenciados por los factores estereoelectronicos: Literatura reciente 10 T. Kawasaki, Y. Nonaka, K. Watanabe, A. Ogawa, K. Higuchi, R. Terashima, K. Masuda, M. Sakamoto, J. Org. Chem., 2001, 66, 1200 − 1204. Transposición de FrÃ-es La transposición de FrÃ-es permite la preparación de fenoles acilados. Mecanismo La reacción se cataliza por los ácidos de Brønsted o Lewis como HF, AlCl3, BF3, TiCl4 o SnCl4. Los ácidos se usan más del requerimiento estequiométrico, sobre todo los ácidos de Lewis, puesto que ellos forman los complejos con los materiales de partida y los productos. El complejo puede disociarse para formar un ion acilo. Dependiendo del solvente, puede formar un par iónico, y las especies iónicas pueden reaccionar entre sÃ- dentro del solvente. Sin embargo, la reacción con una molécula más distante también es posible: Después de la hidrólisis, el producto se libera. Por ejemplo, la reacción es orto, para−selectivo. El sitio de acilación pueda regularse por la variación de temperatura. Sólo los arenos monosustituidos son los substratos más convenientes, dado que los substituyentes interfieren con esta reacción. 11 El requisito para las cantidades equimolares del catalizador, las condiciones corrosivas y tóxicas (HF), y la reacción violenta del catalizador con el agua han originado el desarrollo de nuevos protocolos. AsÃ-, las Zeolitas han demostrado ser impropios, dado que ellos se desactivan, pero los ácidos fuertes, como los ácidos sulfónicos, proporcionan una alternativa razonable. Una opción adicional para inducir una transposición de FrÃ-es es la excitación fotoquÃ-mica, pero este método sólo es factible en el laboratorio: Literatura Reciente: K. W. Anderson, J. J. Tepe, Tetrahedron, 2002, 58, 8475−8481. A. Commarieu, W. Hoelderich, J. A. Laffitte, M.−P. Dupont, J. Mol. Cat. A.: Chemical, 2002, 182−183, 137−141. Reordenamiento del Pinacol. La reacción del pinacol, origina el nombre del reordenamiento donde se produce la eliminación de agua, catalizada por un ácido a partir del pinacol para producir una cetona metÃ-lica, con un grupo t−butilo Mecanismo Esta reacción ocurre totalmente con una variedad de 1,2−dioles, y puede entenderse que en ella se involucra la formación de un intermedio de ión carbeno que a su vez sufre un reordenamiento. El primer intermedio generado, es un ión α−hidroxicarbeno, y se reordena a través de una migración 1,2 de un grupo alquilo para producir el compuesto carbonÃ-lico. Si dos de los substituyentes forman un anillo, la transposición del Pinacol puede formar una anillo−expandido. 12 Literatura Reciente: Asymmetric Addition of Alkylzinc Reagents to Cyclic α,β−Unsaturated Ketones and a Tandem Enantioselective Addition/Diastereoselective Epoxidation with Dioxygen S.−J. Jeon, P. J. Walsh, J. Am. Chem. Soc., 2003, 125, 9544−9545. Reordenamiento de Baker−Venkataraman La transposición del grupo acil−éster inducido por una base origina un éster de fenol o−acilada. El traslado del acil éster inducido por una base, se reagrupa en un éster de fenol o−acilada que conducen a un 1,3−dicetona. Esta reacción se relaciona a la Condensación de Claisen, y mejora el rendimiento a través de la formación de un enolato, seguido por el traslado intramolecular. del grupo acil Mecanismo Literatura Reciente A. V. Kalinin, A. J. M. Da Silva, C. C. Lopes, R. S. C. Lopes, V. Snieckus, Tetrahedron. Lett., 1998, 39, 4995−4998 Lic. QuÃ-m. Wilbert Rivera Muñoz (2006) 1 13

