Producción de sulfatos comerciales a partir de
Anuncio

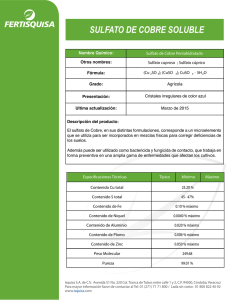
Producciones Científicas. Sección: Ambiente y Recursos Naturales Producción de sulfatos comerciales a partir de oxidados de cobre Autores: Peralta, Eduardo Hugo; Ovejero, Ana Ingrid; Watkins, Silvia Graciela.Dirección: Universidad Nacional de Catamarca - Facultad de Tecnología y Ciencias Aplicadas - Maximio Victoria Nª 55- 4700 - Tele-Fax: 03833 -435112 Introducción Los depósitos existentes en Catamarca con impregnaciones de minerales de cobre, algunos sin ser grandes, pueden tener interés para comprobar su producción a pequeña escala. Se seleccionaron cuatros sectores en base a sus posibles tonelajes y contenidos útiles tomándose muestras típicas para someterlas a diversos tratamientos y observar sus respuestas. Los sectores seleccionados fueron la Mina Capillitas, el Distrito Cerro Atajo, la Sierra de Famatina (Narvaez-Ojo de San Antonio)y un probable deposito tipo “Red Bed” cercano a Santa María. Otra área con este tipo de características es La Borita pero se la excluyó, por su lejanía, escasez de agua y por su ganga calcárea. El estudio se basa en que pueda ser un ingreso complementario para explotaciones artesanales para lo cuál se necesita cierta potencialidad del recurso de oxidados de cobre y la probabilidad de obtener un insumo con valor comercial. Los ensayos de separación se iniciaron en el laboratorio de Mineralogía de la U.N.Ca. y se complementaron en domicilio particular por razones de comodidad y seguridad. Los análisis químicos de control fueron realizados en laboratorio privado, por el Sr. Geólogo Benigno Peralta, especialista en química mineral. a)Capillitas Es un centro volcánico del mioceno, intruído en granito Paleozoico. Con numerosas vetas de sulfuros polimetálico con predominio cuprífero (calcopirita, enargita, cobres grises y calcosina), acompañados por abundante pirita, algo de marcasita, blenda, galena, con ganga carbonatica (rodocrosita) En algunas galerías abandonadas del yacimiento se forman concreciones y costras de sulfato de cobre , la acumulación anual de estos “salitres” obligan a una extracción periódica para ser transitable. Estas limpiezas son suficientemente abundantes para intentar el aprovechamiento para lo cuál se usaron como “muestra tipo” Congreso Regional de Ciencia y Tecnología Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca Sección: Ambiente y Recursos Naturales - Página 1 - b)Cerro Atajo Este distrito consta de dos domos ácidos intruyendo andesitas Mio-pliocenas, con fuerte y extensa alteración hidrotermal en ambas intrusiones y con anomalías en oro. En el sector vetiforme María Eugenia la mineralización es cuprífera, es un “ore shoot” principal y varias vetas que fueron explotadas a fines del siglo pasado. La mineralización predominante consta de sulfuros de tipo calcosina y pirita abundante que al oxidarse producen abundancia de sulfatos cupríferos y ferríferos. Esta zona de minerales oxidados llega hasta los 50 m de profundidad. Se observa un nivel freático endicado entre dos zonas de falla muy rico en sulfatos de hierro y cobre. El volumen de agua almacenada es considerable, más una recarga anual interesante, la suma puede ser suficiente al menos para iniciar una pequeña producción. b) Chaschuil En esta zona a diferencia de las anteriores, los oxidados de cobre son carbonatos, algunos silicatos y tenorita en la base de las areniscas carbónicas en contacto con granito del paleozoico inferior (sector ojo de San Antonio). Si bien ya se ha extraído algo de mineral con 2% de Cu contenido, quedan aún remanentes. d)Santa María Se pudo conseguir una interesante muestra con más del 10% de cobre contenido, se trata de una arenisca (sedimentos terciarios?) con abundante cuprita, parte de la cuál se ha oxidado, formando carbonatos: malaquita y azurita. Se estima que se trata de depósitos similares a otros existentes en Tucumán y Salta a lo largo del Valle Calchaquí pero, por la descripción este sería algo más grande. Al igual que el caso de Chaschuil pertenecería al tipo genético sedimentario de capas rojas (Red Bed). Tareas Realizadas Se distiguen dos tipos de muestras: a) Capillita-Atajo en la que predominan los sulfatos cúpricos y ferrosos b) Santa María-Chaschuil de óxidos (cúpricos y/o cuprosos) coexistiendo con carbonatos (malaquita-azurita) Las muestras fueron molidas a granulometría menor a 0.25mm y atacada con ácido sulfúrico diluido. Para estandarizar se usó un electrolito común de baterías, en los casos de Chaschuil, Santa María y algunas muestras de Cerro Atajo. En las muestras de Capillitas, por ser sales solubles se usó agua común. En Cerro Atajo se procesaron muestras sólidas (andesitas inpregnadas de sulfatos), pero también con óxidos y silicatos que se atacaron con el mismo ácido a igual concentración que los anteriores, procesándose la solución resultante. También se hicieron ensayos usando directamente la solución natural tomada de los socavones, La única diferencia entre ambos tipos de soluciones (artificial y natural)parece ser la concentración de sales disueltas y seguramente la abundancia relativa de los sulfatos Cu+2 Fe+2. Congreso Regional de Ciencia y Tecnología Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca Sección: Ambiente y Recursos Naturales - Página 2 - Estas muestras dan los mejores resultados o al menos los más nítidos. En la muestra de Santa María, por ser óxidos cuprosos, resultó difícil lograr solubilización total o mayoritario del cobre. En todos los casos, se trató de lograr un mínimo de medio litro de solución rica en sulfato. Proceso Químico de Obtención Paso 1: Se busco reproducir el sistema de pozas solares, para la concentración de la solución. Se realizaron numerosos ensayos, alcanzando 19 validos, los que indicaron que se debe evaporar a temperatura ambiente hasta alcanzar una concentración equivalente entre 1,3 y 1,5 veces la del electrolito normal de baterías, medida con pignómetro a una temperatura de alrededor de 20° 25°. Alcanzando ese punto comienza la precipitación de sales y mucilagos compuesta por un a mezcla muy compleja de sulfatos de Cu-Fe-Zn (muestra tipo Capillitas). Se debe continuar evaporando hasta un volumen de alrededor de ¼ del punto de partida. Es muy difícil lograr mayor concentración si solo se usa evaporación solar. Paso 2: A partir de este momento se realiza un tratamiento térmico, calentando hasta ebullición y en lo posible evaporando otro 10 % del volumen. Paso3: Se deja enfriar y al llegar a 25°, 30°C, comienza la precipitación de sulfato cúprico cristalizado (alrededor de75 g/litro). Este precipitado, contiene 24% Cu contenido, por lo cuál casi cumple con las Norma IRAM 12451aunque tiene entre el 3 y 5 % de Fe que le da cierto tinte verdoso al sulfato azul (lo llamamos sulfato de primera). La Normas IRAM no menciona limitaciones por contenido de Fe, pero exige 24.9% Cu. e intentó lograr el mismo efecto sin calentar artificialmente la solución, pero dejándola enfriar con temperaturas bajo cero (en invierno en la región de C°Atajo), pero el contraste térmico no fue suficientemente grande(sulfato cúprico de primera). Paso 4: Se acidula, se vuelve a calentar y calentar lográndose, una segunda precipitación de sulfato cúprico, (45 a 60 g/litro adicionales) pero con mayor contaminación de sulfato ferroso (más del 10 % de Fe) Son cristales verde azulados (sulfato Cúprico de segunda) Paso 5: La solución residual contiene aún mucho cobre, al parecer irrecuperable, pero si en caliente se le agrega sulfato de amonio industrial de uso agrícola, en una proporción de 35 a 40 g/litro. Se logra un abundante precipitado de sal de Mhor(sulfato ferroso-amónico) de muy agradable color verde botella (esta vez con impurezas de Cu)a la que denominamos sulfato triple, muy bien cristalizado: en una proporción de 125 g/litro. Si no se agrega sulfato de amonio, la sal ferrosa no cristaliza y es muy ávida de agua. Congreso Regional de Ciencia y Tecnología Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca Sección: Ambiente y Recursos Naturales - Página 3 - Resultados Químicos -La gran diferencia de solubilidades entre ambos tipos de sulfato cúprico y triple que aumenta geométricamente al elevarse la temperatura hace posible separar una buena parte de ambos , a partir de una solución sobresaturada proveniente de minerales oxidados de cobre .La solución sobrante al parecer es inservible para cualquier caso. -El sulfato ferroso solo es posible obtener un producto cristalizado, agregando sulfato de amonio para formar la sal de Mhor con algo de cobre (sulfato triple) -Partiendo de una solución saturada original (fin del paso 1) se puede obtener poco mas de 100 g/litro de “sulfato de cobre cristalizado” y unos125 de sulfato triple (Fe-NH4Cu).Manteniendo las proporciones equivalen a 100 y 125 Kg/m3 respectivamente. Para minas Capillitas hay un alto contenido de Zn, para los otros casos no es notable. - La solubilidad del sulfato cúprico , aumenta cuando hay presencia de sulfato ferroso, por lo cuál parece muy difícil lograr una separación total, siendo inevitable que los cristalizados de cada uno de ellos contenga bastante del otro Conclusiones Los procedimientos seguidos apuntaban a un proceso sencillo al máximo lograr una producción a nivel artesanal, con el mínimo de costo posible. Parece inevitable sin embargo la necesidad de recurrir a energía térmica artificial y por lo tanto, gasto en combustible. En todos los casos se trató de lograr una solución rica en sulfatos de cobre pero inevitablemente esta acompañada de otros metales en especial Fe +2 y además Zn en el caso de Capillitas. Podría tener interés comercial si se logra poner a punto el procedimiento de separación. Podría justificar un proyecto de química industrial, sobre todo en la región de Atajo-Capillitas a nivel de pequeña empresa. En principio los tonelajes serían suficientes, para producción artesanal. El sulfato ferroso-amónico tiene algunas aplicaciones también en la agricultura pero en este caso la presencia de 10 – 12 % Cu lo transforma más bien en sulfato triple, que lo acerca bastante a un producto de ese mismo nombre usado en citricultura. Congreso Regional de Ciencia y Tecnología Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca Sección: Ambiente y Recursos Naturales - Página 4 - Bibliografía • Babor J.A. Ibarz J. 1963. “ Química General Moderna. Editorial Marin.7° Edición. Barcelona. Congreso Regional de Ciencia y Tecnología Secretaría de Ciencia y Tecnología, Universidad Nacional de Catamarca Sección: Ambiente y Recursos Naturales - Página 5 -