Inhibidores de la entrada: enfuvirtida, una realidad en el
Anuncio

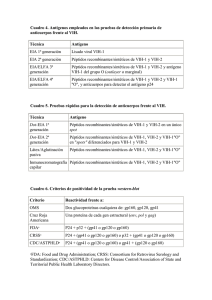
Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. FARM HOSP (Madrid) Vol. 28. N.° 2, pp. 106-115, 2004 1130-6343/2004/28/2/106 FARMACIA HOSPITALARIA Copyright © 2004 ARÁN EDICIONES, S. L. REVISIONES Inhibidores de la entrada: enfuvirtida, una realidad en el tratamiento antirretroviral A. PÉREZ PLASENCIA, B. MARTÍNEZ SÁNCHEZ Servicio de Farmacia. Hospital Universitari Dr. Josep Trueta. Girona Resumen Los inhibidores de la entrada conforman una nueva clase de agentes antirretrovirales que actúan bloqueando la entrada del VIH en las células del organismo. La reciente autorización del inhibidor de la fusión T-20 o enfuvirtida por la FDA y por la Agencia Europea del Medicamento constituye el primer paso para la ampliación de un arsenal terapéutico que se prevé aumentará en al menos media docena de nuevos fármacos en los próximos años. El T-20 está indicado en el tratamiento de la infección por VIH-1, en combinación con otros fármacos antirretrovirales, en aquellos pacientes que presentan resistencias a los inhibidores de la proteasa y de la transcriptasa inversa. En los estudios realizados en fase III, el T-20 ha demostrado una adecuada eficacia y seguridad a las 24 semanas de tratamiento aunque todavía queda por determinar sus efectos a más largo plazo. Hasta su comercialización en España, el programa de Acceso Precoz a T-20 por la vía del uso compasivo está permitiendo su utilización en nuestro país para aquellos pacientes que cumplan los criterios exigidos en la guía de uso establecida por el laboratorio. Palabras clave: Terapia antirretroviral. VIH. Inhibidores de la entrada. Inhibidores de la fusión. T-20. Enfuvirtida. Summary Entry inhibitors make up a new class of antiretroviral agents that block HIV entry into body cells. The recent approval of the fusion inhibitor T-20 or enfuvirtide by both FDA and the European Agency for the Evaluation of Medicinal Products (EMEA) is a first step in the expansion of a therapeutic armamentarium that is expected to increase in at least half a dozen new drugs in oncoming years. T-20 is indicated for the treatment of HIV-1 infection –in combination with other antiretroviral drugs- in patients who Recibido: 10-05-2003 Aceptado: 08-12-2003 Correspondencia: Ana Pérez Plasencia. Servicio de Farmacia. Hospital U. Dr. Josep Trueta. Av. de França, s/n. 17007. Girona. e-mail: farmacia@ htrueta.scs.es are resistant to both protease and reverse transcriptase inhibitors. In phase III studies, T-20 has demonstrated adequate efficacy and safety at 24 weeks after treatment, but long-term effects remain to be established. Until it finally becomes available in Spain, the compassionate use-related Early Access to T-20 Program allows it to be employed in our country for patients who meet criteria specified in the manufacturer’s user’s guide. Key words: Antiretroviral therapy. HIV. Entry inhibitors. Fusion inhibitors. T-20. Enfuvirtide. INTRODUCCIÓN La década de la terapia antirretroviral de alta eficacia se ha caracterizado por la combinación de al menos tres fármacos pertenecientes a los grupos hasta ahora comercializados, los inhibidores de la proteasa (IP) y los inhibidores de la transcriptasa inversa, tanto análogos de nucleósidos (NRTI) como no análogos de nucleósidos (NNRTI) y, más recientemente, los análogos de nucleótidos. El éxito de estos regímenes ha permitido reducir la morbilidad y mortalidad de los pacientes con infección por el virus de la inmunodeficiencia humana (VIH) y aumentar de manera considerable tanto la esperanza como la calidad de vida (1,2). La otra cara de la moneda la conforman los inconvenientes asociados a estas terapias que no se pueden obviar, tales como los efectos adversos al inicio y a lo largo del tratamiento, anormalidades metabólicas y morfológicas, las dificultades en la adherencia, la complejidad de la administración y las resistencias descritas para estos agentes (3-8). Y es que el manejo de pacientes que presentan infección por virus resistentes a los grupos de antirretrovirales disponibles es uno de los principales problemas en la práctica clínica. Las resistencias a una o más clases de fármacos antirretrovirales pueden ser consecuencia de fallos sucesivos en 44 Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Vol. 28. N.° 2, 2004 INHIBIDORES DE LA ENTRADA: ENFUVIRTIDA, UNA REALIDAD EN EL TRATAMIENTO ANTIRRETROVIRAL un régimen antirretroviral pero, además, se están incrementando de manera importante el número de individuos que presentan resistencias tras infección reciente (9,10). La elección de un tratamiento óptimo para estos pacientes requiere la disponibilidad de nuevas clases de agentes con un mecanismo de acción diferente. El objetivo del presente artículo es realizar una introducción a los inhibidores de la entrada, nuevo grupo de agentes antirretrovirales que actúan impidiendo la entrada del VIH-1 en las células huésped del organismo, y revisar la enfuvirtida como primer representante del grupo que ha obtenido la autorización de la FDA y de la Agencia Europea del Medicamento (EMEA). Para ello se ha realizado una búsqueda bibliográfica en Medline empleando los términos de “enfuvirtida”, “T20”, “inhibidores de la entrada” e “inhibidores de la fusión” y se han tenido en cuenta las comunicaciones a las conferencias internacionales de enfermedades infecciosas y sida. PROCESO DE ENTRADA DEL VIH-1 El desarrollo de la terapia antirretroviral ha ido avanzando a medida que ha ido mejorando el conocimiento del ciclo viral del VIH. Las dianas terapéuticas se han centrado en aquellas fases que son específicas del virus en relación con las células humanas para conseguir una mayor eficacia y una menor incidencia de efectos adversos. Los fármacos disponibles hasta la fecha inhiben la acción de los enzimas virales, fundamentalmente la transcriptasa inversa y la proteasa (2,11,12), ya que los agentes ensayados hasta el momento frente a la integrasa viral no han dado los resultados esperados. Las nuevas estrategias se centran en una fase anterior a la entrada del virus en la célula huésped, por lo que el conocimiento de las interacciones que tienen lugar a nivel de las membranas viral y celular ha sido clave a la hora de definir las nuevas dianas terapéuticas. La entrada del virus en la célula es, esencialmente, un proceso en tres etapas: 1. Unión del VIH-1 al receptor CD4. 2. Interacción con el correceptor de la quimiocina. 3. Fusión de las membranas viral y celular. En este proceso interviene una glicoproteína de la envoltura del VIH-1 (Env) compuesta de dos subunidades denominadas gp120 y gp41. La gp120 es una proteína de superficie que se une a los receptores de unión de la célula hospedadora mientras que la gp41 es una proteína transmembrana que se inserta en la membrana de la célula y provoca la fusión. Estas proteínas se ubican en la cubierta lipídica de la partícula viral constituyendo trímeros heterodímeros, es decir, tres conjuntos formados por una subunidad gp120 y una subunidad gp41. El primer paso consiste en el acoplamiento entre la gp120 y la proteína CD4, que es la molécula que actúa como receptor celular para el VIH-1 y que se sitúa en la superficie de 45 107 linfocitos T y macrófagos (13,14). Esta unión provoca un cambio conformacional en la gp120 de tal manera que un sector de la misma llamado bucle V3 es reconocido por moléculas correceptoras, CCR5 y CXCR4, moléculas también presentes en la superficie de macrófagos y linfocitos T. Estas moléculas CCR5 y CXCR4 son los receptores naturales de unas sustancias químicas llamadas quimiocinas, sustancias que cuando están presentes logran inhibir la replicación del VIH al impedir su penetración en la célula (15,16). La unión de la gp120 al CD4 y a los correceptores de la quimiocina permite que la proteína transmembrana gp41 experimente un cambio de su conformación no fusogénica a una conformación fusogénica. El dominio de la gp41 contiene dos regiones helicoidales, una cerca del extremo amino terminal (hélice N, péptido N, péptido de fusión o HR1) y otra cerca del extremo carboxi terminal (hélice C, péptido C o HR2). En la conformación no fusogénica se encuentran disociadas y las tres subunidades HR1 se encuentran en el interior del complejo, mientras que las HR2 están ubicadas en la parte exterior. Cuando se produce el cambio conformacional de la gp41, el HR1 se inserta en la membrana celular formando un estado intermedio o “pre-horquilla” que dura algunos minutos, siguiendo un mecanismo similar al descrito para el virus influenza (17). A continuación se produce un plegamiento de la gp41 de modo que las regiones HR1 y HR2 interaccionan entre sí de manera antiparalela, como una “horquilla”. Esto facilita la yuxtaposición entre las membranas viral y celular, produciéndose la fusión entre ambas (18-20) y la formación de un poro a través del cual la cápside viral penetra en el citoplasma celular atravesando el citoesqueleto de la célula por mecanismos aún no aclarados (Fig. 1 A-E). El proceso de entrada del VIH-1 se produce en un rango variable de velocidades en función de la concentración de moléculas CD4 y correceptores en la superficie de la célula huésped, lo que puede condicionar la actividad de los fármacos potenciales dirigidos a estas dianas terapéuticas: a menor concentración de receptores, más lento es el proceso de entrada y de más tiempo dispone el inhibidor de la entrada para ejercer su acción (21). Los agentes antirretrovirales que se están desarrollando dirigidos a diferentes fases de este proceso de entrada del VIH-1 en las células se denominan en conjunto inhibidores de la entrada, dividiéndose en inhibidores de la unión, antagonistas de los correceptores de la quimiocina e inhibidores de la fusión. INHIBIDORES DE LA ENTRADA Inhibidores de la unión CD4 recombinante soluble Los primeros intentos que se realizaron para bloquear el proceso de entrada del VIH-1 se centraron en el desa- Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 108 A. PÉREZ PLASENCIA Y B. MARTÍNEZ SÁNCHEZ A FARM HOSP (Madrid) B VIH-1 gp41 Correceptor de la quimiocina gp120 Receptor CD4 C D HR2 HR1 E } gp41 F Inhibidor de la fusión Fig. 1.- Proceso de entrada del VIH-1. En el proceso de entrada del VIH-1 en las células del organismo participan, por parte de la célula huésped, dos tipos de receptores (CD4 y correceptores de la quimiocina) y, por parte del VIH-1, una glicoproteína formada por dos subunidades, gp120 y gp41, subunidades que se encuentran formando trímeros heterodímeros en la superficie viral (A). La proteína gp120 se une inicialmente al receptor CD4 (B) y a continuación a los correceptores de las quimiocinas (CXCR4 y/o CCR5) (C). Esto provoca un cambio conformacional en la gp41 de manera que su péptido de fusión (HR1) queda al descubierto y se inserta en la membrana de la célula huésped formando un estado denominado “pre-horquilla”D (D). Posteriormente el péptido C (HR2) se pliega para interaccionar de manera antiparalela con el HR1, facilitando la yuxtaposición de ambas membranas y permitiendo el proceso de fusión (E). Los inhibidores de la entrada actúan en las diferentes fases de este proceso de entrada. Los inhibidores de la fusión, por ejemplo, se unen al HR1 en el estado “pre-horquilla”, impidiendo así el plegamiento del HR2 y deteniendo el proceso de entrada (F). 46 Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Vol. 28. N.° 2, 2004 INHIBIDORES DE LA ENTRADA: ENFUVIRTIDA, UNA REALIDAD EN EL TRATAMIENTO ANTIRRETROVIRAL rrollo de moléculas CD4 recombinantes solubles que impidiesen la interacción entre la proteína viral gp120 y la molécula CD4. En los estudios in vitro realizados demostraron una potente inhibición del VIH-1 (22), pero en los estudios clínicos sólo presentaron actividad a muy altas dosis (23). PRO 542 Proteína híbrida tetramérica que contiene regiones del receptor CD4 unidas a una inmunoglobulina G. Su mecanismo de acción consiste en unirse a la proteína gp120 en la cubierta externa del virus impidiendo la interacción con la molécula CD4 de la célula huésped. En los estudios en fase I/II llevados a cabo con este fármaco se ha demostrado su actividad antiviral en pacientes adultos y pediátricos, siendo bien tolerado en ambos grupos (24,25). TNX 355 Anticuerpo monoclonal anti-CD4 que también se une a la proteína gp120 bloqueando así el proceso de entrada. En los estudios realizados se ha demostrado una reducción significativa de la carga viral a las 2-3 semanas de una única administración intravenosa. Aunque como anticuerpo anti-CD4 podría producir efectos inmunosupresores, hasta el momento no se han detectado reacciones severas a corto plazo (26). BMS 806 Molécula de pequeño tamaño con un mecanismo de acción similar al resto de inhibidores de la unión comentados (27) y que ha suscitado un gran interés por la posibilidad de administrarse por vía oral. Ha demostrado una potente inhibición del VIH-1 in vitro, aunque con una actividad muy variable según el subtipo de VIH-1 del que se tratase (28). Este hecho, unido a la selección de resistencias descrita (29), ha mitigado el entusiasmo inicial con el que se acogió esta molécula, encontrándose actualmente en fase de desarrollo preclínico. Antagonistas de los correceptores de la quimiocina Los correceptores de la quimiocina (CCR5 y CXCR4) constituyen la segunda diana terapéutica para bloquear el proceso de entrada viral. Las cepas del VIH-1 que se unen exclusivamente a receptores CCR5 (variantes R5) están implicadas en la transmisión sexual de la infección y predominan en las fases iniciales de la enfermedad. En cambio, las cepas con afinidad por los receptores CXCR4 (variantes X4) o por ambos tipos de receptores (variantes 47 109 X4/R5), predominan en fases más avanzadas de la enfermedad y se asocian a una rápida disminución en el recuento de células CD4, progresión a sida y muerte (30,31). Los antagonistas del CCR5 podrían ser más prometedores que los que atacan el CXCR4 si se tiene en cuenta que actuarían en una fase más temprana de la enfermedad y que las reacciones adversas potenciales serían menores (las moléculas CXCR4 se expresan en una gran variedad de tipos celulares y el efecto que provocaría su inhibición es incierto), aunque no hay que olvidar la posible selección de variantes X4. SCH-C Antagonista del receptor CCR5 que ha demostrado elevada potencia in vitro contra la mayoría de las variantes R5 del VIH-1 (32). Su biodisponibilidad oral es adecuada y su farmacocinética permite administrarlo cada 12-24 horas (33). En un estudio clínico realizado en 12 pacientes adultos se demostró una reducción significativa de la carga viral aunque no de manera uniforme. Por otro lado, en un estudio anterior con voluntarios sanos se describieron arritmias y prolongación del intervalo QT a dosis altas, lo que ha puesto en entredicho la futura aplicación clínica de este agente (30). AMD-3100 Molécula no peptídica que inhibe la interacción entre la gp120 y el receptor CXCR4. En el estudio en fase II llevado a cabo con este fármaco no se consiguió reducir la concentración de carga viral de los pacientes incluidos, aunque la mayoría mostró una cambio en el tipo de cepa viral predominante, que pasó de las variantes X4 o X4/R5 a R5, la variante menos virulenta y más común (34). Estos datos aportan cierta esperanza de cara a la utilización clínica de los antagonistas de CXCR4. Inhibidores de la fusión Péptidos que imitan las regiones HR2 de la proteína gp41 nativa. En el estado “pre-horquilla” el péptido de fusión queda expuesto y es ese momento el que aprovechan los inhibidores de la fusión para interaccionar en su lugar con las subunidades HR1 (18,35,36). De este modo, el cambio conformacional de la gp41 no puede completarse y el proceso de fusión de ambas membranas queda detenido (Fig. 1 F). Los inhibidores de la fusión que se encuentran en fases más avanzadas de desarrollo son el T-20 y el T-1249. El T-20 o enfuvirtida es actualmente el único inhibidor de la entrada aprobado por la FDA y por la EMEA y es por ello que hemos considerado necesario realizar una revisión completa. El T-1249 es un péptido de estructura similar al T-20 que en estudios preliminares Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 110 A. PÉREZ PLASENCIA Y B. MARTÍNEZ SÁNCHEZ ha demostrado disminuir los niveles de ARN viral y ser bien tolerado (37). Además, su unión al HR1 es más extensa que en el caso de la enfuvirtida, lo que parece explicar su actividad en los casos en los que se ha desarrollado resistencia al T-20. Sin embargo, todavía es necesario esperar a los resultados de estudios en fase III para poder establecer su seguridad y eficacia en tratamientos combinados. En la tabla I se relacionan los inhibidores de la entrada que en el momento actual han alcanzado como mínimo la fase I/II de desarrollo y que parecen tener cierta probabilidad de pasar a fases ulteriores en un futuro inmediato. ENFUVIRTIDA Farmacología La enfuvirtida es un péptido sintético de fórmula química C204H301N51O64, compuesto por una secuencia de 36 aminoácidos que se corresponde con la región FARM HOSP (Madrid) HR2 de la proteína gp41. Se trata de un fármaco innovador porque posee un mecanismo de acción diferente al resto de antirretrovirales comercializados. Al mimetizar la región HR2, se une al HR1 e impide la interacción entre ambas regiones (36,38), interacción que, como ya se ha comentado, es necesaria para que se complete el proceso de fusión entre las membranas viral y celular. Resistencia Se han descrito resistencias in vitro e in vivo para el T20 asociadas a mutaciones en la proteína gp41 (39,40) que pueden limitar el éxito de las terapias combinadas con este fármaco. Las variantes que han desarrollado resistencia al T-20 mantienen la sensibilidad in vitro al segundo inhibidor de la fusión en estudio, el T-1249, aunque la actividad en los pacientes que han presentado resistencia a la enfuvirtida todavía no ha sido investigada en profundidad (41). Tabla I. Inhibidores de la entrada Tipo de inhibidor Laboratorio Mecanismo de acción Fase de desarrollo Comentarios Inhibidores de la unión PRO 542 Progenics Se une a la proteína gp120 impidiendo que interaccione con el receptor CD4 Fase I/II Administración parenteral (endovenosa/subcutánea) TNX 355 Tanox Se une a la proteína gp120 impidiendo que interaccione con el receptor CD4 Fase I/II Anticuerpo monoclonal. Administración parenteral Antagonistas de los correceptores de la quimiocina SCH-C Schering Plough Bloquea la interacción entre la proteína gp120 y el correceptor CCR5 Fase I/II Administración vía oral. Prolongación del intervalo QT a altas dosis AMD 3100 Anor Med Bloquea la interacción entre la proteína gp120 y el correceptor CXCR4 Fase II (interrumpido por falta de actividad) Promueve el paso de variantes X4 ó X4/R5 del VIH-1 a variantes R5 menos virulentas Inhibidores de la fusión T-20 (enfuvirtida) Trimeris Roche Mimetiza la región HR2 de la gp41 impidiendo su correcto plegamiento y bloqueando así la fusión de membranas viral y celular Fase III Aprobado por la FDA (marzo 2003) y la EMEA (mayo 2003) Administración subcutánea T-1249 Trimeris Roche Mimetiza la región HR2 de la gp41 impidiendo su correcto plegamiento y bloqueando así la fusión de membranas viral y celular Fase I/II Administración parenteral. Actividad frente a cepas resistentes al T-20 48 Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Vol. 28. N.° 2, 2004 INHIBIDORES DE LA ENTRADA: ENFUVIRTIDA, UNA REALIDAD EN EL TRATAMIENTO ANTIRRETROVIRAL Farmacocinética Enfuvirtida no se puede administrar por vía oral debido a su estructura peptídica. El desarrollo de la molécula ha dado como pauta más adecuada la administración subcutánea de 90 mg dos veces al día, evaluándose farmacocinéticamente la absorción, distribución, metabolismo y excreción con este régimen (38). Absorción y distribución La biodisponibilidad absoluta de enfuvirtida es de 84,3% ± 15,5%. En combinación con otros agentes antirretrovirales la Cmax en el estado estacionario fue de 5,0 ± 1,7 µg/mL, la Cmin de 3,3 ± 1,6 µg/mL, el AUC0-12h de 48,7 ± 19,1 µg•h/mL y el Tmax de 4 horas (rango 4-8 horas). La absorción es comparable cuando la inyección subcutánea se realiza en la parte superior del brazo, en la parte superior del muslo o en el abdomen (42). El volumen de distribución es de 5,5 ± 1,1 L y se une a proteínas plasmáticas en un 92%, fundamentalmente albúmina y, en menor extensión, α-1 glicoproteína ácida. Metabolismo y eliminación Dada la naturaleza peptídica de la enfuvirtida se presupone que se metaboliza mediante hidrólisis, degradándose en sus aminoácidos correspondientes, los cuales se incorporarán a las vías metabólicas endógenas. Tras una dosis única de 90 mg de enfuvirtida se obtuvo una semivida de eliminación de 3,8 ± 0,6 h y un aclaramiento de 24,8 ± 4,1 mL/kg/h. En combinación con otros agentes antirretrovirales, se obtuvo un aclaramiento de 30,6 ± 10,6 mL/kg/h. Se ha observado un menor aclaramiento en mujeres y en individuos de bajo peso, aunque no existen recomendaciones específicas en este grupo de pacientes. Poblaciones especiales Los pacientes con insuficiencia hepática o renal no requieren en principio ajustes posológicos. Sin embargo, hay que tener en cuenta que no se han realizado estudios farmacocinéticos específicos en estas poblaciones. En cuanto a la raza, los ensayos clínicos no han encontrado diferencias entre los pacientes de raza negra y los caucásicos ni entre los caucásicos y los asiáticos, una vez ajustados los datos al peso corporal. En relación a la edad, no existen datos farmacocinéticos en pacientes mayores de 65 años y, en la población pediátrica, los datos son muy limitados (43,44). En un estudio de 18 pacientes de edades comprendidas entre 6 y 16 años, a dosis de 2 mg/kg/12 h (dosis máxima de 90 mg dos veces al día) y en combinación con otros agentes 49 111 antirretrovirales, se obutvieron concentraciones plasmáticas similares a la de la población adulta y aclaramientos de 40 ± 14 mL/h/kg (38). Eficacia y seguridad La enfuvirtida fue aprobada por la FDA en marzo de 2003 mediante un procedimiento acelerado y tras seis meses de revisión prioritaria. La solicitud de autorización se basó en los resultados de los dos estudios fundamentales de fase III llevados a cabo en cerca de 1.000 pacientes: TORO 1 (T-20 versus Optimized Regimen Only) y TORO 2, resultados que se presentaron en última Conferencia Mundial del sida celebrada en Barcelona en julio de 2002 (45,46). En el estudio TORO 1, también conocido como T20301, se incluyeron 491 pacientes de Norteamérica y Brasil con infección por VIH-1 que habían sido pretratados con terapia antirretroviral de alta eficacia y/o presentaban resistencia documentada a las tres clases de fármacos antirretrovirales comercializados en el momento de iniciar el estudio (NRTI, NNRTI e IP). Para la inclusión en el estudio se requirió que cada paciente tuviese un nivel de ARN del VIH-1 superior a 5 log10 copias/ml y se les realizó una prueba de resistencia genotípica y fenotípica con el objetivo de seleccionar un régimen antirretroviral optimizado. Este régimen optimizado consistía en la administración de tres a cinco fármacos incluyendo, en los casos apropiados, hasta dos fármacos aprobados recientemente o en fase de investigación (tenofovir, lopinavir-ritonavir). Una vez seleccionado el régimen optimizado, los pacientes fueron distribuidos aleatoriamente en proporción 2:1, recibiendo el régimen optimizado más enfuvirtida o sólo el régimen antirretroviral optimizado. En los pacientes asignados al primer grupo, el T-20 se administró como una autoinyección subcutánea de 90 mg dos veces al día. Está previsto realizar el seguimiento de cada paciente durante 48 semanas, ampliándolo opcionalmente 48 semanas más. Los resultados obtenidos a las 24 semanas de seguimiento muestran que los pacientes que recibieron T-20 como parte de un régimen optimizado, obtuvieron una reducción de los niveles de ARN del VIH de 1,697 log10 copias/mL, comparada con 0,763 log10 copias/mL en los pacientes asignados a la rama de control (nivel medio inicial de ARN del VIH-1 de 5,2 log10 copias/mL en ambos grupos). La variable de evaluación primaria de la eficacia definida en el estudio fue la diferencia de magnitud de la disminución del número de copias del VIH entre las dos ramas y se estimó en 0,933 log copias/mL (p < 0,001). La tercera parte de los pacientes tratados con T-20 alcanzaron una reducción de la carga viral por debajo de los niveles detectables (ARN del VIH-1 < 400 copias/mL) después de 24 semanas mientras que con el régimen optimizado sólo lo consiguió el 16% de los pacientes (p < 0,0001). Por otro lado la media del recuento de células inmunes en el régi- Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 112 A. PÉREZ PLASENCIA Y B. MARTÍNEZ SÁNCHEZ men que contenía T-20 se incrementó en 76 CD4/mm3 de sangre comparado a un incremento de 32 CD4/mm3 en el grupo que no recibió enfuvirtida (p < 0,0001). El porcentaje de pacientes con fallo virológico en la semana 8 en el grupo control fue del 33% frente al 16% en el grupo que contenía enfuvirtida, diferencia que persistió a la semana 24, siendo de 64 y 42% respectivamente. Las reacciones adversas más frecuentes (diarreas, náuseas, fatiga) fueron similares en ambos grupos, exceptuando las reacciones locales en el lugar de inyección que se produjeron en el 98% de los pacientes tratados con T-20, aunque sólo un 3% abandonaron el estudio por esta causa. Otros acontecimientos adversos con mayor incidencia (>10%) en el grupo de T-20 que en el de control fueron insomnio, cefalea, neuropatía periférica y mareos, aunque no fue posible establecer una relación causal entre estos acontecimientos adversos y la enfuvirtida. El segundo estudio en fase III, el TORO 2 o T20-302, se está realizando en 504 pacientes de Europa y Australia. Los resultados a las 24 semanas también han sido favorables, obteniéndose una diferencia de 0,78 log10 copias/mL (p < 0,0001) en los pacientes en tratamiento con T-20 frente a los que solamente llevaban el régimen optimizado, una reducción de la carga viral por debajo de los niveles detectables en un 28% de los pacientes con T20 frente a un 16% en el grupo control (p = 0,0001) y un incremento de 65 CD4/mm3 frente a 38 CD4/mm3 (p = 0,023) respectivamente. El perfil de seguridad del fármaco está basado en un estudio que incluyó 1.188 pacientes procedentes del TORO 1 y TORO 2 y que confirmó la seguridad del tratamiento a las 24 semanas con las siguientes observaciones: —Mayor incidencia de neumonías, fundamentalmente bacterianas, en el grupo con T-20 frente al grupo control (5,6% o 4,9 por 100 pacientes-año de exposición versus 0,3% o 0,6 por 100 pacientes año, p = 0,02), aunque el porcentaje total de infecciones bacterianas fue similar en ambos estudios (20,5% o 17,8 por 100 pacientes-año de exposición versus 9% o 18,4 por 100 pacientes-año de exposición, p = 0,56). —Dos casos de reacción de hipersensibilidad sistémica asociada al tratamiento con enfuvirtida (ambos en el estudio TORO 1). —Mayor incidencia de esosinofilia en el grupo con T20 aunque no se pudo asociar a una hipersensibilidad a enfuvirtida. —Reacciones locales en el lugar de inyección en la mayoría de los pacientes en tratamiento con el T-20 (98%) pero sólo un 8,7% requirió analgesia para el dolor o limitó las actividades habituales (47). Limitaciones de los ensayos Los resultados no son extrapolables a poblaciones diferentes a las estudiadas: pacientes no pretratados, niños menores de 6 años y pacientes con insuficiencia FARM HOSP (Madrid) hepática o renal. A pesar de la eficacia demostrada en los estudios en fase III realizados, el periodo de seguimiento no es el adecuado para asegurar una respuesta virológica prolongada. Dosis y administración La dosis recomendada de enfuvirtida en adultos es de 90 mg dos veces al día, inyectada subcutáneamente en la zona superior del brazo, en el abdomen o en la parte superior del muslo (38). Cada vial contiene un liofilizado de 108 mg de enfuvirtida que se han de reconstituir con 1,1 ml de agua estéril para inyección. Después de añadir el agua los viales deben dejarse en reposo (no se pueden agitar) hasta que el polvo se haya disuelto completamente, proceso que puede tardar hasta 45 minutos. La solución reconstituida es estable 24 horas en la nevera, por lo que el paciente puede preparar las dos dosis diarias simultáneamente. Es necesario instruir al paciente en el uso de técnicas asépticas cuando se administre la enfuvirtida para evitar infecciones en el lugar de inyección. Se recomienda que la primera inyección se realice bajo la supervisión de un profesional sanitario cualificado, así como la realización de revisiones periódicas de los procedimientos y técnicas de autoinyección. Reacciones adversas El 98% de los pacientes tratados con enfuvirtida presentan reacción local en el lugar de administración que se manifiesta con dolor, induración, eritema, nódulos, quistes y prurito. Otros efectos adversos descritos son diarrea (26,8%), náuseas (20,1%), fatiga (16,1%), insomnio (11,3%), neuropatía periférica (8,9%), depresión (8,6%), tos (7,4%), pérdida de peso (6,5%), pérdida de apetito (6,3%), sinusitis (6,2%), ansiedad y astenia (5,7%), prurito (5,1%), mialgia (5%), constipación (3,9%) o pancreatitis (2,4%) (38,48). Interacciones Al no metabolizarse a través del citocromo P450 es improbable que existan interacciones con otros agentes antirretrovirales. Los estudios farmacocinéticos llevados a cabo administrando enfuvirtida en combinación con ritonavir, ritonavir/saquinavir y rifampicina, determinaron que no existían interacciones farmacocinéticas clínicamente significativas (49). Un aspecto interesante a destacar es la sinergia que se ha demostrado entre el T-20 y otros inhibidores de la entrada. Esta sinergia puede ser debida a que si se disminuye la velocidad en las fases iniciales del proceso de entrada, fundamentalmente la interacción con el corre- 50 Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Vol. 28. N.° 2, 2004 INHIBIDORES DE LA ENTRADA: ENFUVIRTIDA, UNA REALIDAD EN EL TRATAMIENTO ANTIRRETROVIRAL ceptor CCR5 o CXCR4, aumenta el intervalo de tiempo en el que el T-20 puede interaccionar con la región HR1, potenciando la actividad antirretroviral total (50). Consideraciones económicas El tratamiento de enfuvirtida tiene un coste aproximado de 52 euros por paciente y día, lo que le convierte en el fármaco más caro aprobado para el tratamiento del VIH hasta la fecha. Diferentes asociaciones europeas y estadounidenses ya han expresado su preocupación por la limitación de acceso que provocará este precio ya que muchos programas de dispensación de antirretrovirales no podrán asumir este coste. ACCESO AL T-20 EN ESPAÑA En septiembre de 2002 se presentó la documentación de registro de la enfuvirtida a la EMEA solicitando su autorización para el tratamiento, en combinación con otros fármacos antirretrovirales, de pacientes adultos infectados con VIH-1 que hubiesen recibido tratamiento previo con, al menos, un fármaco de cada una de las siguientes clases farmacológicas: IP, NRTI y NNRTI. Posteriormente se inició un programa de acceso precoz al T-20 en distintos países europeos con el fin de hacer llegar este tratamiento a aquellos pacientes que más se pudiesen beneficiar del mismo. Para la inclusión de pacientes en este programa de acceso precoz en nuestro país se debe tramitar a través de usos compasivos restrictivos que se evalúan quincenalmente, caso por caso, en un comité convocado por el Ministerio de Sanidad. La guía de uso facilitada por el laboratorio Roche (51) establece los criterios de inclusión y no inclusión a tener en cuenta a la hora de solicitar un tratamiento con T-20. Los pacientes deben de cumplir los siguientes criterios: —Pacientes mayores de 16 años de edad infectados por el VIH-1. —Carga viral de ARN del VIH-1 mayor o igual a 10.000 copias/mL y recuento de linfocitos CD4 menor o igual a 100 células/mL. —Pacientes con test de resistencia viral documentado, toxicidad limitante de tratamiento y/o que hayan recibido al menos 6 meses de tratamiento previo con cada una de las tres clases de antirretrovirales actualmente disponibles y que, a juicio del médico responsable, cabe esperar que se beneficien del tratamiento con T-20 en combinación con antirretrovirales orales. —Deberán poder y querer otorgar su consentimiento informado por escrito (para pacientes menores de 18 años, uno de los progenitores o el tutor legal también deberá firmar el consentimiento informado). 51 113 —Las mujeres en edad fértil deberán tener una prueba de embarazo con resultado negativo que se efectuará en las 24 horas previas a la primera dosis de T-20. Los pacientes que mantengan relaciones heterosexuales con mujeres en edad fértil deberán asegurarse de que estas utilizan un método anticonceptivo fiable durante todo el tiempo de tratamiento con T-20 y en los 90 días siguientes a la última dosis del fármaco. No podrán incluirse en el programa de acceso precoz aquellos pacientes que cumplan alguno de estos criterios: —Pacientes de sexo femenino embarazadas, en periodo de lactancia o que prevean quedar embarazadas durante el tratamiento. —Cualquier parámetro clínico o de laboratorio de grado 4 según las recomendaciones de la OMS para la graduación de los efectos tóxicos agudos y subagudos. Las anomalías de grado 4 asintomáticas podrán ser permitidas por el médico responsable, si el posible beneficio del tratamiento supera al posible riesgo. —Abuso de alcohol y/o fármacos o sustancias ilegales o incumplimiento de otros tratamientos en el pasado que, a juicio del médico responsable, pudieran plantear dudas sobre la capacidad de cumplimiento del paciente. —Incapacidad para autoinyectarse T-20, a menos que el paciente disponga de un cuidador fiable que pueda prestarle este servicio mientras dure el tratamiento. —Demostración de infección oportunista activa y no tratada, enfermedades intercurrentes, toxicidad de fármacos o cualquier otra situación que impediría al paciente tomar o seguir tomando un determinado régimen antirretroviral. En caso de que el paciente cumpla los criterios para entrar en el programa de Acceso Precoz a T-20 y el Ministerio de Sanidad y Consumo autorice el tratamiento, el laboratorio facilitará el fármaco hasta que esté disponible en el mercado español, seguramente a finales del año 2003 o principios del año 2004. CONCLUSIONES Los inhibidores de la entrada son un nuevo grupo de fármacos antirretrovirales cuyo mecanismo de acción se ejerce antes de que el VIH-1 penetre en las células huésped del organismo. De entre ellos, el inhibidor de la fusión T-20 o enfuvirtida es ya una realidad en el tratamiento antirretroviral ya que se ha aprobado recientemente por la FDA y por la EMEA. Los datos de eficacia y seguridad avalan su utilización en combinación con otras clases de agentes antirretrovirales en el tratamiento de pacientes que han desarrollado resistencias a los grupos hasta la fecha comercializados (IP, NRTI y NNRTI), ampliando así el limitado arsenal terapéutico del que se disponía en estos casos. Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 114 A. PÉREZ PLASENCIA Y B. MARTÍNEZ SÁNCHEZ FARM HOSP (Madrid) Bibliografía 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA, et al. Declining morbidity and mortality among patients with advanced virus infection. HIV Outpatient Study Investigators. N Engl J Med 1998; 338 (13): 853-60. Mocroft A, Katlama C, Johnson AM, Pradier C, Antunes F, Mulcahy F, et al. AIDS across Europe, 1994-98: the EuroSIDA study. Lancet 2000; 356: 291-6. Lichtenstein KA, Delaney KM, Armon C, Ward DJ, Moorman AC, Wood KC, et al. Incidence of and risk factors for lipoatrophy (abnormal fat loss) in ambulatory HIV-1-infected patients. J Acquir Immune Defic Syndr 2003; 32 (1): 48-56. Carr A, Cooper DA. Adverse effects of antiretroviral therapy. Lancet 2000; 356: 1423-30. Moyle G. Clinical manifestations and management of antiretroviral nucleoside analog-related mitochondrial toxiciy. Clin Ther 2000; 22 (8): 911-36. Paterson DL, Swindells S, Mohr J, Brester M, Vergis EN, Squier C, et al. Adherence to proteasa inhibitor therapy and outcomes in patients with HIV infection. Ann Intern Med 2000; 133: 21-30. Geletko SM, Poulakos MN. Pharmaceutical services in an HIV clinic. Am J Health-System Pharm 2002; 59: 709-13. Race E, Dam E, Obry V, Paulous S, Clavel F. Analysis of HIV crossresistance to proteasa inhibitors using a rapid single-cycle recombinant virus assay for patients failing on combination therapies. AIDS 1999; 13: 2061-8. Ledergerber B, Egger M, Opravil M, Telenti A, Hirschel B, Battegay M, et al. Clinical progression and virological failure on highly active antiretroviral therapy in HIV-1 patients: a prospective cohort study. Lancet 1999; 353 (9156): 863-8. Little SJ, Holte S, Routy JP, Daar ES, Markowitz M, Collier AC, et al. Antiretroviral-drug resistance among patients recently infected with HIV. N Engl J Med 2002; 347 (6): 385-94. Carpenter CC, Fischl MA, Hammer SM, Hirsch MS, Jacobsen DM, Katzenstein DA, et al. Antiretroviral therapy for HIV infection in 1998: updated recommendations of the International AIDS SocietyUSA Panel. JAMA 1998; 280 (1):78-86. Department of Health and Human Services (DHHS) and Henry J. Kaiser Family Fundation-USA. Guidelines for the use of antiretroviral agents in HIV-infected adults and adolescents < http://www.hivatis.org > [Consulta: 20/03/03]. Kwong PD, Wyatt R, Robinson J, Sweets RW, Sodroski J, Hendrickson WA. Structure of an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and neutralizing human antibody. Nature 1998; 393: 648-59. Dalgleish AG, Beverly PC, Clapham PR, Carwford DH, Greaves MF, Weiss RA. The CD4 (T4) antigen is an essential component of the receptor for the AIDS retrovirus. Nature 1984; 312 (5996): 763-7. Feng Y, Broder CC, Kennedy PE, Berger EA. HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G-protein-coupled receptor. Science 1996; 272 (5623): 809-10. Samson M, Labbe O, Mollereau C, Vassart G, Parmentier M. Molecular cloning and functional expression of a new human CC-chemokine receptor gen. Biochemistry 1996; 35 (11): 3362-7. Carr CM, Kim PS. A spring-loaded mechanism for the conformational change of influenza hemaglutinin. Cell 1993; 73 (4): 823-32. Cammack N. The potential for HIV fusion inhibition. Curr Opin Infect Dis 2001; 14 (1): 13-6. Ji H, Shu W, Burling FT, Jiang S, Lu M. Inhibition of human immunodeficiency virus type 1 infectivity by gp41 core: role of a conserved hydrofobic cavity in membrane fusion. J Virol 1999; 73 (10): 857886. Bewley CA, Louis JM, Ghirlando R, Clores GM. Design of a novel peptide inhibitor of HIV fusion that disrupts the internal trimeric coiled-coil of gp41. J Biol Chem 2002; 277 (16): 14238-45. Moyle G. Finally, the new drug classes arrive. Curr Opin Infect Dis 2003; 16 (1): 1-3. Fisher RA, Bertonis JM, Meier W, Johnson VA, Costopoulos DS, Liu T, et al. HIV infection is blocked in vitro by recombinant soluble CD4. Nature 1988; 331 (6151): 76-8. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. Schooley RT, Merignan TC, Gaut P, Hirsch MS, Holodniv M, Flynn T, et al. Recombinant soluble CD4 therapy in patients with the acquired immunodeficiency syndrome (AIDS) and AIDS-related complex. A phase I-II escalating dosage trial. Ann Intern Med 1990; 112 (4): 247-53. Jacobson JM, Lowy I, Fletcher CV, O’Neilll TJ, Tran DN, Ketas TJ, et al. Single-dose safety, pharmacology and antiviral activity of the human inmunodeficiency virus (HIV) type 1 entry inhibitor PRO 542 in HIV-infected adults. J Infect Dis 2000; 182: 326-9. Shearer MH, Timanus DK, Benton PA, Lee DR, Kennedy RC. Crossclade inhibition of human immunodeficiency virus type 1 primary isolates by monoclonal anti-CD4. J Infect Dis. 1998; 177 (6): 1727-9. Kuritzkes DR, Jacobson JM, Powderly W, Godofsky E, DeJesus E, Haas F, et al. Safety and preliminary anti-HIV activity of an anti-CD4 m-Ab (TNX-355; formerly Hu5A8) in HIV-infected patients. 10th Conference on Retroviruses and Opportunistic Infections, Boston, 2003. Abstract 13. Lin PF, Guo K, Fridell R, Ho H-T, Yamanaka G, Colom R. Identification and characterization of a novel inhibitor of HIV-1 entry. II. Mechanism of action. 9th Conference on Retroviruses and Opportunistic Infections, Seattle, 2002. Abstract 10. Lin PF, Robinson B, Gong YF, Ricarrdi K, Guo Q, Deminie C, et al. Identification and characterization of a novel inhibitor of HIV-1 entry. I. Mechanism of action. 9th Conference on Retroviruses and Opportunistic Infections, Seattle, 2002. Abstract 9. Lin PF, Gong YF, Rose B, Blair W, Zhon N, Guo Q, et al. Generation and characterization of HIV-1 variants resistant to BMS-806, a novel HIV-1 entry inhibitor. Antivir Ther 2002; 7:S6. Abstract 6. Cooley LA, Lewin SR. HIV-1 cell entry and advances in viral entry inhibitor therapy. J Clin Virol 2003; 26: 121-32. Kilby JM, Eron JJ. Novel therapies based on mechanisms of HIV-1 cell entry. N Engl J Med 2003; 348 (22): 2228-38. Reynes J, Rouxier R, Kanouni T. SHC-C: safety and antiviral effects of a CCR5 receptor antagonist in HIV-infected subjects. 9th Conference on Retroviruses and Opportunistic Infections, Seattle, 2002. Abstract 1. Strikzi JM, Xu S, Wagner NE, Wojcik L, Liu J, Hou X, et al. SCH-C (SCH 351125), an orally bioavailable, small molecule antagonist of the chemokine receptor CCR5, is a potent inhibitor of HIV-1 infection in vitro and in vivo. Proc Natl Acad Sci USA 2001; 98 (22): 12718-23. Schols D, Claes S, De Clercq E. AMD 3100, a CXCR4 antagonist, reduced HIV viral load and X4 virus levels in humans. 9th Conference on Retroviruses and Opportunistic Infections, Seattle, 2002. Abstract 4. Kilby JM, Hopkins S, Venetta TM, DiMassimo B, Cloud GA, Lee JY, et al. Potent supression of HIV-1 replication in humans by T-20, a peptide inhibitor of gp41-mediated virus entry. Nat Med 1998; 4 (11): 1302-7. Moyle G. Stopping HIV fusion with enfuvirtide: the first step to extracellular HAART. J Antimicrob Chem 2003; 5 (2): 213-7. Eron J, Merigan T, Kilby M, Yangco B, Gleavy J, Rusnak P, et al, for the T1249-101 Study Group. A 14-day assessment of the safety, pharmacokinetics, and antiviral activity of T-1249, a peptide inhibitor of membrane fusion. 8th Conference on Retroviruses and Opportunistic Infections, Chicago, 2001; Abstract 14. Ficha técnica. Fuzeon<http://www.fda.gov/cder/foi/label/2003/ 021481lbl.pdf> [Consulta: 30/10/2003]. Zöllner B, Feucht HH, Scröter M, Chäfer P, Plettenberg A, Stoehr A, et al. Primary genotypic resistance of HIV-1 to the fusion inhibitor T20 in long-term infected patients. AIDS 2001; 15 (7): 935-6. Poveda E, Rodés B, Toro C, Martín-Carbonero L, González-Lahoz J, Soriano V. Evolution of the gp41 env region in HIV-infected patients receiving T-20, a fusion inhibitor. AIDS 2002; 16: 1959. Miralles GD, Lalezari J, Bellos N, Richmond G, Zhang Y, Murchinson H, et al. T-1249 demostrates potents antiviral activity over 10-day dosing in most patients who have failed a regimen containing enfuvirtide: planned interim analysis of T1249-102. A phase I/II study. 10th Conference on Retroviruses and Opportunistic Infections, Boston, 2003. Abstract 597. 52 Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Vol. 28. N.° 2, 2004 INHIBIDORES DE LA ENTRADA: ENFUVIRTIDA, UNA REALIDAD EN EL TRATAMIENTO ANTIRRETROVIRAL 42. Patel IH, Lalezari J, Dorr A, Hawker N, Siddique Z, Kolis S, et al. T20 is optimally absorbed from 3 different subcutaneous injection sites. XIV International AIDS Conference, Barcelona, 2002. Abstract TuPeB4542. 43. Cunningham C, Church J, Hughes M, Sista P, Palumbo P, Mofenson L, et al. Chronic subcutaneous T-20 (enfuvirtide) in HIV infected children: 48 week outcome. 40th Annual Meeting of IDSA, Chicago, 2002. Abstract 441. 44. Soy D, Aweeka FT, Church JA, Cunningham CK, Palumbo P, Kosel BW. Population pharmacokinetics of enfuvirtide in pediatric HIV patients: searching for exposure response relationships. Clin Pharm Ther (en prensa). 45. Henry K, Lalezari J, Ohearn M, Trottier B, Montaner J, Piliero P, et al. Enfuvirtide (T-20) in combination with an optimized background (OB) regimen vs OB alone in patients with prior experience or resistance to each of three classes of approved antiretrovirals (ARVs) in North America and Brazil. 14th International AIDS Conference, Barcelona, 2002. Abstract LbOr19B. 46. Clotet B, Lazzarin A, Cooper D, Reynes J, Arasteh K, Nelson M, et 53 47. 48. 49. 50. 51. 115 al. Enfuvirtide (T-20) in combination with an optimized background (OB) regimen vs OB alone in patients with prior experience or resistance to each of three classes of approved antiretrovirals (ARVs) in Europe and Australia. 14th International AIDS Conference, Barcelona, 2002. Abstract LbOr19A. Lalezari JP, Henry K, O’Hearn M, Montaner JSG, Piliero PJ, Trottier B, et al, for the TORO 1 Study Group. Enfuvirtide, an HIV-1 fusion inhibitor, for drug-resistant HIV infection in North and South America. N Engl J Med 2003; 348: 2175-85. Drugdex® System. Drug Evaluations. Micromedex® Heathcare Series Vol. 117 (caducidad: 03/2004). Boyd M, Ruxrungtham K, Zhang X, Bellibas E, Buss NE, Patel IH. Enfuvirtide: investigations on the drug interaction potential in HIVinfected patients. 10th Conference on Retroviruses and Opportunistic Infections, Boston, 2003. Abstract 541. Tremblay CL, Kollmann C, Giguel F, Chou TC, Hirsch MS. Strong in vitro synergy between the fusion inhibitor T-20 and the CXCR4 blocker AMD-3100. J Acquir Inmune Defic Syndr 2000; 25 (2): 99-102. Guía de uso T-20. < http://www.gesidaseimc.com [Consulta: 20/03/03].