descargar
Anuncio

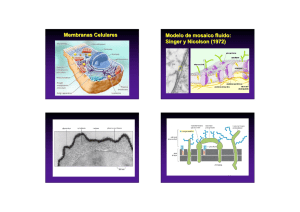
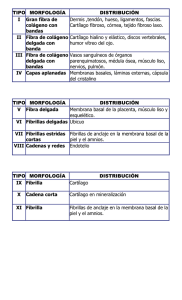
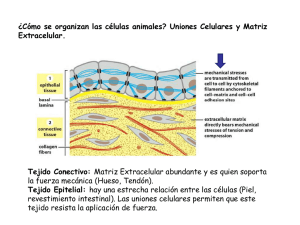
IMPORTANCIA DEL CONOCIMIENTO DE LA MEMBRANA EXTRACELULAR SU APLICACIÓN EN KINESIOLOGIA Y ESTETICA Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación de la Asociación Argentina de Kinesiología Palabras claves: Matriz extracelular – Kinesiología – Estética – Colágeno – Proteína – Tejido conectivo. INTRODUCCION: A mediados del siglo XIX, Carl Rokitansky describió el crecimiento del tejido conectivo, afirmando que los elementos celulares y las enfermedades se producían a partir de los fluidos corporales, así mismo Claude Bernard definió el entorno extracelular o el medio interno del organismo, proponiendo que su estado saludable era esencial para la salud y que las impurezas de este terreno produciría enfermedades. En el siglo XX Alfred Pischinger, a quién se lo considera el padre del sistema básico de la matriz extracelular (MEC), la describió como un gel amorfo que ocupa el entorno extracelular, posteriormente lo llamó “tercer sistema”, sistema básico o de regulación basal. Hasta ese momento se consideraba a la célula como la mínina unidad viviente, pero al aislar la célula moría. A partir del nuevo modelo de patología celular de Alfred Pischinger, se propone como unidad minima de vida, la tríada CAPILAR-MEC-CÉLULA. Esto supone que la MEC no es un material inerte o de sostén pasivo, sino como componente activo, dinámico, con múltiples funciones. Como desarrollaremos más adelante la vitalidad de la MEC y su correcto funcionamiento, que dependen de su limpieza y correcto drenaje. La importancia del conocimiento de la MEC para la Kinesiología y la Estética. Radica en comprender como el tejido conectivo, que envuelve a todos los órganos y células del organismo, por donde se conectan todos estos elementos entre sí, es precisamente la matriz, donde van dirigidos todas las acciones mecánicas, (el masaje, las técnicas manuales, todos los elementos de la fisioterapia, el ejercicio y las técnicas de la estética), quién las transforma en acciones químicas para alcanzar la membrana basal modificando el cito esqueleto. QUE ES LA MATRIZ EXTRACELULAR La matriz extracelular representa una red tridimensional que engloba todos los órganos, tejidos y células del organismo. Constituye un filtro biofísico de protección, nutrición, inervación celular, es el terreno para la respuesta inmune, angiogénesis, fibrosis y regeneración tisular. Representa el medio de transmisión de fuerzas mecánicas a la membrana basal, que a través de las integrinas soporta el sistema de tensegridad y activa los mecanismos epigenéticos celulares. La función de comunicación entre órganos, tejidos y células, la realizan a una velocidad superior a la del sistema nervioso, está a cargo de un tejido llamado “tejido conectivo”, en estas instancias es la MEC; debemos agregar a las funciones de soporte y comunicación, las del aporte de oxigeno, nutrientes a la célula, eliminación de Co2, toxinas y producción de desechos, por eso constituye también un espacio idóneo para el almacenamiento del material toxico. En condiciones normales, el aumento de toxinas en la MEC es drenado a través del sistema linfático hacia la cadena ganglionar. Si dicho drenaje, no se da o es insuficiente se produce una respuesta que se traduce en inflamación, acidosis y dolor (muy conocido por nosotros en las distintas patologías que tratamos diariamente). Otras funciones de la matriz consisten en actuar como reservorio de otras moléculas, incluyendo factores de crecimiento, citosina y proteasas. El organismo tiene una gran diversidad de tipo de MEC, basada en el colágeno, quién constituye el principal elemento de soporte estructural, así como desempeña un papel importante en los procesos de organización, orientación tisular, adhesión celular, migración, diferenciación, proliferación y apoptosis (muerte celular). Está inervada por el sistema vegetativo, cuyas terminaciones libres constituyen auténticas sinapsis a distancia, tanto de las propias células de la matriz como de las células parenquimatosas más próximas. La matriz está compuesta por una compleja mezcla de proteínas, proteoglicanos y glicoproteínas que confieren las propiedades estructurales de células y tejidos. Dichas proteínas ejercen a su vez un papel regulador de una extensa variedad de procesos celulares. Todos estos eventos celulares se traducen en los procesos fisiológicos, también es motivo de inicio de procesos patológicos cuando la correcta información se pierde dando lugar a procesos inflamatorios, autoinmune, degenerativos y tumorales. La alteración de la matriz extracelular supones la perdida de su función de filtro eficaz, nutrición, alimentación, denervación celular, perdida de la capacidad de regeneración, cicatrización y alteración de la transmisión mecánica o mecano transducción, también la perdida del sustrato para una correcta respuesta inmune. Esto nos lleva a decir que el correcto funcionamiento y vitalidad de la MEC dependen de su limpieza y correcto drenaje. El interés de nuestro trabajo es reflejar la importancia de la matriz extracelular en nuestro quehacer diario como kinesiólogos y esteticistas, ya que nuestras acciones con todas las herramientas disponibles para los diferentes tratamientos, rehabilitaciones, o reeducaciones, están destinadas a este tejido conectivo denominado MEC. Es nuestro objetivo describir lo más minucioso y simple, la complejidad y funcionamiento de este proceso. COMPONENTES DE LA MATRIZ EXTRACELULAR Está compuesta por una compleja mezcla de proteínas, proteoglicanos, y glicoproteínas que confieren las propiedades estructurales de células y tejidos. Dichas proteínas ejercen a su vez un papel regulador de una extensa variedad de procesos celulares. De esta interacción se deriva la morfología celular, su comportamiento y la respuesta a moléculas solubles para los que la MEC sirve de reservorio, como citosinas y factores de crecimiento. Las fibras ofrecen resistencia tensil, elasticidad y forman un andamiaje sobre el cual están desplegadas las células. El resto de elementos crean un filtro biofísico de adhesión y son responsables de las características de hidratación ejerciendo una importante influencia sobre el intercambio vital. En general, entre una estructura gruesa de fibras de colágeno y elastina está la estructura fina de los proteoglicanos y glicoproteínas bañadas por el líquido intersticial o tisular. Las macromoléculas que constituyen la MEC son de cuatro grandes multifuncionales (laminina, fibronectina, tenacina y trombospondina), cada una desempeña funciones de manera integrada con las demás, esto hace que la matriz sea calificada como un verdadero complejo funcional. Los colágenos y el sistema elástico constituyen la arquitectura de la matriz. Las glicoproteínas actúan como moléculas de adhesión del sustrato intercelular, importante en las interacciones célula – célula y célula-matriz. Los glicosaminoglicanos y proteoglicanos tienen un papel fundamental en el equilibrio hidroelectrolítico y acidobásico. La matriz ayuda a organizar las células en tejidos y coordina las funciones celulares al activar las vías de señalización intracelular que controlan el crecimiento, la proliferación y la expresión genética celular. Muchas funciones de la matriz requieren receptores de adhesión transmembrana que se unen directamente a los componentes de la MEC y que también interactúan, a través de las proteínas adaptadoras, con el citoesqueleto. Los principales receptores de adhesión entre célula y matriz con las integrinas. Una de las funciones de la matriz es la mecano transducción este proceso convierte el estímulo mecánico en señales químicas y permite la adaptación celular a su microambiente. Sus alteraciones se han mostrado claves en un amplio espectro de enfermedades que van desde la osteoporosis hasta el cáncer. Como su mecanismo incluye pasos que van desde la matriz hasta la membrana citoplasmática, El citoesqueleto y la propia membrana nuclear, cantidad de proteínas y moléculas que pueden verse implicadas es enorme, por eso las podemos clasificar en tres grupos: A) Alteraciones que corresponden al microambiente celular. B) Las que afectan la estructura y organización celular. C) Las que afectan la señalización celular. Debemos comprender que todas ellas acaban afectando a nivel genético y epigenético la cromatina nuclear de una manera diferente y específica en cada enfermedad. Recordemos que la velocidad a la que se transmiten los estímulos mecánicos es mucho más alta que el de las señales químicas. Esto constituye un mecanismo físico de integración de la parte con el todo (globalidad), ya que cada vez que movemos un músculo o realizamos un masaje, trabajamos sobre la piel, un hueso recibe la compresión, o cualquier tejido vivo recibe un estímulo, estos responden con su función. Ahora bien, si el estímulo es excesivo o se mantiene en el tiempo, el efecto mecano químico remodela el sistema de tensegridad que informará del cambio mecánico y lo transformará en nuevas condiciones moleculares. La tensegridad explica porque los genes, las moléculas y sus interacciones no pueden considerarse de forma independiente, aislada, todo el comportamiento y función biológica cobra sentido a partir de los ensamblajes supra moleculares. Comprendiendo estos procesos biológicos es que consideramos la globalidad como forma de estudio, de trabajo. Todos los días nos encontramos con estos procesos en cualquiera de las especialidades que desarrollamos, o trabajando sobre la piel, el músculo, articulaciones, desbalances musculares, etc. Es conociendo estas reacciones, que podemos dar más eficiencia a nuestras soluciones a patologías de atención diaria. Como ya hemos dicho la matriz nuclear, la matriz citoplasmática y la matriz extracelular, están interconectadas formando una red que pone en comunicación todas las moléculas del cuerpo. Las vías de energía y los circuitos de información encuentran sus grandes autopistas precisamente en la MEC, cuya composición y estructura no solamente sirven de elemento de soporte, sino que constituye precisos circuitos de transmisión mecánica, vibratoria, energética, eléctrica y química, conformando la pieza clave que mantiene conectados a los órganos y que garantiza su correcto funcionamiento. También constituye un reservorio de cargas negativas con capacidad de absorber o donar electrones según la necesidad, de una manera tan rápida que las reacciones bioquímicas no pueden alcanzar, empleadas en la neutralización de radicales libres que liberan oxidativos, como en el caso de la inflamación. La unidad fundamental de la matriz, el matrisoma, acoge la función de mantener la homeostasis osmótica, iónica, electromagnética y electrónica, tanto a nivel local como sistémico. FUNCIONAMIENTO DE LA MATRIZ EXTRACELULAR Aunque parezca muy difícil, poco entendible, aburrido, etc. (que tienen razón), les pido que lean lo más cuidadosamente posible este material, ya que, si bien, lo he resumido demasiado, es necesario para comprender sobre que tipo de tejido estamos trabajando todos los días, como se producen las modificaciones estructurales que luego derivarán en enfermedades, (musculares, inflamatorias, retensión de líquido, en la piel, posturales, circulatorias, artrosis, osteoporosis, hasta cáncer), Es por esto que he decidido dividir el material en artículos, donde en cada uno de ellos expondré y desarrollaré los componentes de la matriz extracelular, para su mejor comprensión y sobre todo como con los elementos disponibles podemos revertir los procesos patológicos de nuestros pacientes. Como se expuso anteriormente, la matriz representa una red tridimensional que engloba todos los órganos y células, es un tejido conectivo, una fascia, estos nombres sugieren una función de comunicación, ésta se produce a una velocidad superior a la del sistema nervioso. El equilibrio de la matriz se mantiene por una regulación entre la síntesis, formación, desgaste, y remodelación. Este proceso es regulado por moléculas que estimulan su elaboración, tales como los factores de crecimiento, y otros factores que regulan su catabolismo y la regeneración. La síntesis es realizada por células de origen epitelial y mesenquimal, como el fibroblasto y mio fibroblasto. Su catabolismo ocurre por acción de enzimas líticas tipo colagenasas, elastasa y otras. Las células epiteliales se adhieren a la membrana basal y ella recibe las señales de control procedentes de la MEC. Las membranas basales son estructuras complejas compuestas por una lámina lúcida, una lámina densa y por cuatro tipos principales de glicoproteínas que varían según el tipo de tejido: laminina, colágeno tipo IV, nidógenos y proteoglicanos de tipo heparansulfato. Entre sus funciones principales se destacan las referidas a la adhesión celular, la regulación de la proliferación y su papel como filtro selectivo a la difusión. El líquido intersticial es el medio indispensable que hace que sea posible mantener la homeostasis entre las zonas intra y extracelulares. Está formado por un vehiculo de agua que contiene principalmente ácidos grasos, aminoácidos, azucares, coenzimas, sustancias mensajeras como citocinas, hormonas, neurotransmisores y otras sustancias como sales minerales y productos de desecho. El citoesqueleto es una estructura dinámica que ocupa el citoplasma. Los principales polímeros que forman el citoesqueleto son: microfilamentos, microtubulos y filamentos intermedios. La minima modificación extracelular del potencial eléctrico podrá ser un desencadenante de cambios en el citoesqueleto, (la utilización de equipos de fisioterapia, el masaje, los ejercicios, las técnicas manuales, los golpes, accidentes, heridas, por ejemplo). La matriz extracelular es por tanto una zona de transición cuya principal función es la transmisión de materia, energía e información mediante sustancias mensajeras, potencial eléctrico e impulsos eléctricos, que sirven de base a la mayor parte de las interacciones entre las diferentes sistemas de regulación del organismo. LA MATRIZ EXTRACELULAR DE LOS TEJIDOS NO EPITELIALES Examinemos algunas características generales de las moléculas que interactúan entre célulascélula y célula-matriz de los tejidos no epiteliales: tejido conectivo, músculo y nervio. Los colágenos fibrilares son las principales proteínas fibrosas de la matriz extracelular del tejido conectivo. El tejido conectivo del tendón y del cartílago difiere de otros tejidos sólidos en que la mayor parte de su volumen se compone de MEC más que de células. Esta matriz está repleta de proteínas insolubles y contiene proteoglicanos, diversas proteínas multiadhesivas y hialuronano, glucosaminoglicanos (GAG) no sulfatado muy grande. La proteína fibrosa más abundante en el tejido conectivo, es el colágeno. Fibras de elastina, que pueden ser estiradas o relajadas, también están en sitios deformables, como la piel, los tendones, etc. Las fibronectinas una familia de proteínas multiadhesivas de la matriz, forman sus propias fibrillas distintivas en la matriz de algunos tejidos conectivos. Aunque hay muchos tipos de células en los tejidos conectivos, los diversos componentes de la MEC son producidos en gran medida por los fibroblastos. El 80 a 90% del colágeno corporal está compuesto por colágeno tipo I; II; III, ubicados principalmente en el tejido conectivo. El colágeno tipo I, (se denomina así porque es el que primero se pudo aislar y categorizar), su unidad estructural fundamental es una hélice triple larga (300nm), delgada 1,5 nm de diámetro, (este dato es muy importante para nuestro trabajo, ya que en próximos trabajos veremos el efecto de las distintas corrientes sobre esta estructura), que consta de dos cadenas alfa uno (I) y cadena alfa dos (I), cada una de exactamente1050 aminoácidos de longitud. Las moléculas de tres hebras se asocian para formar polímeros de orden más alto llamados fibrillas, que a su vez se agrupan para formar haces más grandes llamados fibras de colágeno. Las clases menores de colágeno incluyen los colágenos asociados a fibrillas, que conectan los colágenos fibrilares entre sí o con otros componentes de la MEC, los colágenos formadores de láminas y de anclaje, que forman redes bidimensionales en la lámina basal (tipo IV) y conectan la lámina basal de la piel a los tejidos conectivos subyacentes (tipo VII), los colágenos transmembrana, que funcionan como receptores de adhesión, y los colágenos de defensa del huésped, que ayudan al cuerpo a reconocer y eliminar patógenos. Una observación interesante es que varios colágenos (tipo XVIII y XV), funcionan como proteínas centrales de los proteoglicanos. La formación de las fibrillas de colágeno comienza en el retículo endoplasmático y se completa fuera de la célula. Las cadenas alfa de colágeno son sintetizadas como precursores más largos, llamados cadenas pro alfa, en ribosomas adheridos al retículo endoplasmático (ER), las cadenas pro alfa atraviesan una serie de modificaciones covalentes y se pliegan para formar moléculas de pro colágeno de hélice triple antes de ser liberadas en la célula. Luego de la secreción del pro colágeno de la célula, la peptidasa extracelular (es decir, la proteína-1 morfogenética osea), elimina los péptidos N-terminal y C-terminal. Con respecto a los colágenos fibrilares, las moléculas resultantes, que consisten casi enteramente en una hélice de triple hebra, se asocian largamente para generar fibrillas con un diámetro de 50200nm. En las fibrillas, las moléculas adyacentes de colágeno están separadas por 67nm, cerca de un cuarto de su longitud. Las propiedades únicas de los colágenos fibrosos (es decir, los tipo I, II, III), se deben principalmente a la formación de fibrillas. Los segmentos cortos que no son triple hélice en ambos extremos de la cadena alfa de colágeno son de particular importancia en la formación de fibrillas de colágeno. Las cadenas laterales de lisina y de hidroxilisina, de estos segmentos son modificadas en forma covalente por lisiloxidasa extracelular para formar aldehídos en lugar del grupo amino en el extremo de la cadena lateral. Estos grupos de aldehídos reactivos forman enlaces cruzados covalentes con los residuos de lisina, hidroxilisina e histidina en moléculas adyacentes. Estos entrecruzamientos estabilizan el empaquetamiento lado a lado de las moléculas de colágeno y generan una fibrilla fuerte. La eliminación de los propeptidos y de los enlaces cruzados covalentes tiene lugar en el espacio extracelular para prevenir el ensamblaje potencialmente catastrófico de fibrillas dentro de la célula. Los colágenos tipo I y II forman diversas estructuras y se asocian con distintos colágenos no fibrilares. Los colágenos difieren en su capacidad de formar fibras y para organizar las fibras de manera tal de constituir retículos. En los tendones por ejemplo, fibrillas largas de colágeno tipo I se agrupan lado a lado en haces paralelos y forman fibras gruesas de colágeno. Debido a que las fibras de colágeno tipo I tienen mayor fuerza extensible, los tendones pueden estirarse sin romperse. Dos colágenos fibrilares cuantitativamente menores, el tipo V y XI, se agrupan junto con el colágeno tipo I para formar fibras, regulando así las estructuras y propiedades de las fibras. La incorporación del colágeno tipo V produce fibras de menor diámetro. Las fibras de colágeno tipo I también se utilizan como barras de refuerzo en la construcción de los huesos. Los huesos y dientes son duros porque tienen grandes cantidades de carbonato de hidroxiapatita, un mineral cristalino que contiene calcio y fósforo. La mayoría de los huesos contienen un 70% de minerales y un 30% de proteínas, la mayor parte de las cuales es colágeno tipo I. Los huesos se forman cuando los condorcitos y osteoblastos secretan fibrillas de colágeno que luego son mineralizados por deposición de cristales pequeños de carbonato de hidroxiapatita. En muchos tejidos conectivos, el colágeno tipo VI y los proteoglicanos se unen en forma no covalente a los lados de las fibrillas de tipo I y pueden unir las fibras entre sí para formar fibras de colágeno más gruesas. El colágeno tipo VI es poco común en el sentido que la molécula se compone de hélices triples relativamente cortas con dominios globulares en ambos extremos. La asociación lateral de dos monómeros de tipo VI genera un dímero “antiparalelo”. La asociación extremo con extremo de estos dímeros a través de sus dominios globulares forman las “microfibrillas tipo VI”. Estas microfibrillas tienen el aspecto de cuentas en una soga, o de rosario, con regiones de hélices triple de cerca de 60nm de largo separadas por dominios globulares de 40nm de largo. Las fibrillas de colágeno tipo VI, el principal colágeno en el cartílago, son más pequeñas en diámetro que las tipo I y están orientadas al azar en una matriz viscosa de proteoglicanos. Las fibrillas rígidas de colágeno imparten fuerza y compresibilidad a la matriz y les permite resistir grandes deformaciones. Esta propiedad le permite a las uniones absorber contusiones. Las fibrillas tipo II están unidas a los proteoglicanos de la matriz mediante enlaces cruzados de colágeno tipo IX, otro colágeno asociado con las fibrillas. El colágeno tipo IX y otros asociados tienen dos o tres segmentos helicoidales triples conectados por angulaciones flexibles y por un segmento globular N-terminal. El segmento globular N-terminal del colágeno tipo IX se extiende desde las fibrillas en el extremo de uno de sus segmentos helicoidales, como lo hace una GAG (glucosaminoglicano), que a veces está unida a una de las cadenas tipo IX. El hialuronano resiste la compresión y facilita la migración celular. El hialuronano, también llamado ácido hialurónico, es un GAG no sulfatado sintetizado por una enzima unida a la membrana plasmática (HA sintasa) como una repetición de disacáridos compuestos de ácido glucurónico y de N- acetilglucosamina y es secretado directamente al espacio extracelular. Es un componente principal de la MEC que rodea las células en migración y proliferación, en especial en los tejidos embrionarios, además el hialuronano forma la columna vertebral de organizaciones de proteoglicanos complejos halladas en muchas MEC, sobre todo en el cartílago. Debido a sus propiedades físicas destacadas, el hialuronano imparte rigidez y elasticidad, así como una cualidad lubricante a muchos tejidos conectivos como las articulaciones. Debido al gran número de residuos aniónicos sobre su superficie, la molécula de hialuronano típica que se une a grandes cantidades de agua se comporta como si fuera una gran esfera hidratada con un diámetro de alrededor de 500nm. A medida que la concentración de hialuronano aumente, las cadenas largas comienzan a enredarse y forman un gel viscoso. Aún en concentraciones bajas, el hialuronano forma un gel hidratado, cuando se lo coloca en un espacio confinado, como en la matriz entre dos células, las moléculas largas de hialuronano tenderán a empujar hacia fuera. Este empuje crea un aumento de volumen, o presión de turgencia, dentro del espacio extracelular. Además la unión de cationes por grupos COO-, sobre la superficie del hialuronano incrementa las concentraciones de iones y por ende la presión osmótica en el gel. Como resultado, grandes cantidades de agua son tomadas dentro de la matriz y contribuyen a la presión de turgencia. Estas fuerzas de turgencia les confieren a los tejidos conectivos su capacidad para resistir las fuerzas de compresión, a diferencia de las fibras de colágeno, que son capaces de resistir fuerzas de estiramiento. La asociación de hialuronano y proteoglicanos forman agregados complejos y grandes. El proteoglicanos predominante en el cartílago es el denominado “agregan”, se agrupa con el hialuronano para formar agregados muy grandes. El esqueleto del agregado de proteoglicanos del cartílago es una molécula larga de hialuronano a la cual se unen moléculas de agregan, uno de los mayores complejos macromoleculares conocidos, pueden ser de 4mm de longitud y pueden tener un volumen más grande que el de una bacteria, estos agregados le otorgan al cartílago sus propiedades únicas similares a un gel y su resistencia a las deformaciones, esencialmente para distribuir la carga en las articulaciones que soportan el peso. La proteína núcleo de agregan tiene un dominio globular N-terminal que se une con gran facilidad a la secuencia decasacárido específica dentro del hialuronano. Esta secuencia específica se genera por modificaciones covalentes de algunas de los disacáridos repetidos en la cadena de hialuronano. La interacción entre el agregan y el hialuronano está facilitada por una proteína conectora que se une tanto a la proteína central del agregan como al hialuronano. El agregan y la proteína conectora tienen un dominio “conector” en común de alrededor de 100 aminoácidos de largo, que se encuentra en numerosas matrices y proteínas de unión al hialuronano, tanto en tejidos cartilaginosos como no cartilaginosos. Las fibronectinas conectan muchas células a colágenos fibrosos y otros componentes matriciales. Muchos tipos de células sintetizan fibronectinas, es una proteína multiadhesiva de la matriz. Las fibronectinas son esenciales para la migración y diferenciación de muchos tipos celulares durante la embriogénesis. Estas proteínas también son importantes para la cicatrización de las heridas porque promueven la coagulación sanguínea y facilitan la migración de macrófagos y otras células inmunes hacia el área afectada. Las fibronectinas ayudan a adherir a la matriz extracelular mediante la unión de otros componentes de la MEC, sobre todo colágeno fibroso y proteoglicanos heparansulfato, y a receptores de adhesión de la superficie celular, como las integrinas. A través de sus interacciones con los receptores de adhesión (como la integrina alfa 5 deta 1), las fibronectinas incluyen en la forma y el movimiento de las células y la organización del citoesqueleto. A la inversa, las células pueden esculpir la MEC de su entorno de acuerdo con sus necesidades, regulando su unión con la fibronectina y otros componentes de la MEC mediante receptores. Las fibronectinas son dímeros de los polipéptidos similares unidos en sus extremos C-terminal por dos enlaces disulfuros, cada cadena mide de 60-70nm de largo y 2-3nm de grosor. La unión de integrinas de la superficie celular a la fibronectinas de la matriz induce el movimiento dependiente del citoesqueleto de actina, de algunas moléculas de integrinas en el plano de la membrana. La tensión mecánica resultante debido al movimiento relativo de diferentes integrinas unidas a un dímero único de fibronectina estira la fibronectina. Este estiramiento fomenta la asociación mutua de fibronectinas para formar fibrillas multiméricas. La fuerza necesaria para desplegar y exponer sitios funcionales de autoasociación en las fibronectinas es mucho menos que la necesaria para destabilizar las uniones entre integrinas y fibronectinas. Por lo tanto, las moléculas de fibronectinas permanecen, unidas a las integrinas mientras que las fuerzas mecánicas generadas por la célula inducen la formación de fibrillas. En efecto la integrinas, a través de proteínas adaptadoras transmiten las fuerzas intracelulares generadas por el citoesqueleto de actina a las fibronectinas extracelulares. En forma gradual, las primeras fibrillas de fibronectinas maduran para formar, a través de enlaces cruzados covalentes, componentes matrízales muy estables. En algunas imágenes obtenidas por microfotografía electrónica, las fibrillas exteriores de fibronectina parecen alinearse en una línea continua con haces de fibras de actina dentro de la célula. Esta observación y los resultados de otros estudios proporcionan el primer ejemplo de un receptor de adhesión molecularmente bien definido (es decir, una integrina), que forma un puente entre el citoesqueleto intracelular y los componentes de la matriz extracelular. CONCLUSIÓN Podemos concluir diciendo lo complejo de la función de la matriz extracelular, pero asimismo, lo importante que es comprender sus funciones, ya que es el tejido donde llegan todas nuestras acciones de tratamiento sobre los diferentes tejidos corporales. Como mencionara anteriormente, en próximos trabajos debemos ser más explicativos en cuanto al desarrollo y acciones, de cada estructura que interviene en el correcto funcionamiento de la matriz extracelular. Debemos comprender que es necesario conocer los elementos con los que trabajamos todos los días, como podemos influenciar con las distintas corrientes fisioterápicas y cuales son sus efectos sobre este tejido, también, como modificamos la estructura alterada de un tejido mediante el masaje, u otras técnicas. Creemos que ha llegado el momento de ser más científicos en el momento de exponer nuestro criterio de tratamiento sobre una patología, el conocimiento de la biología molecular y celular, la profundización de la biofísica, son algunos de los elementos que nos permiten incrementar nuestro análisis al momento de elaborar una estrategia de tratamiento. Saber el efecto de las diferentes corrientes fisioterápicas en los tejidos, cuanta energía conseguimos con una técnica manual, si bien, en la literatura se expresa, por ejemplo, que el tens produce analgesia, no sabemos, porque, donde cuanto, actúan estos elementos sobre una proteína, una enzima, un proteoglicano, como puedo modificar un colágeno, como actúan los canales iónicos, cuanta cantidad de sustancia puede traspasar una membrana, son algunas de las cuestiones a saber para poder acercarnos a una dosificación lo más correcta posible, y ser así más eficientes en nuestro trabajo. BIBLIOGRAFIA 1. Stryer, L Bioquímica (edición revisada y corregida) – Editorial Reverte, S.A. 2. De Robertis (h) – HIP – Ponzio Biología celular y molecular – Editorial El Ateneo, 6ª edición 2008. 3. Lodish – Berk – Matsudaira – Kaiser – Krieger – scout – Zipursky – Darnell Biología celular y molecular – Editorial Panamericana, 5ª edición 2006. 4. Naranjo, T A, Noguera Salva R, Fariñas Guerrero F. La matriz extracelular: morfología, función y biotensegridad parte I. Revisión – Revista Española “Patología” vol. 42 nª 4 2009. 5. Huxley-Jones J, Pinney JW, Archer J, Robertson DL, Boot-Handford RP. Back to basics–how the evolution of the extracellular matrix underpinned vertebrate evolution. Int J Exp Pathol 2009; 90: 95-100. 6. Huang S, Ingber DE. The structural and mechanical complexity of cell-growth control. Nat Cell Biol 1999; 1: E131-8. 7. Pischinger A. The extracellular matrix and ground regulation. En: Hartmut Heine editor. Basis for a holistic medicine. Berkeley (CA): North Atlantic books, 2006. 8. Noble D. Claude Bernard, the first systems biologist, and the future of physiology. Exp Physiol 2008; 93: 16-26. 9. Stevens A, Lowe J. Células de sostén y la matriz extracelular. En: Stevens A, Lowe J, editors. Histología humana 3.ª ed. Madrid: . Elservier Mosby; 2006. p. 46-64 10. Geneser F. Tejido conectivo. En: Geneser F. Histología. 3.ª ed. Madrid: Editorial Médica Panamericana; 2000. p 197-26. 11. Alberts B, Dennis B; Lewis J, Raff M, Roberts K, Watson JD, editors. Biología molecular de la célula. 4.ª ed. Madrid: Omega ed SA; 2004 12. Discher DE, Mooney DJ, Zandstra PW. Growth factors, matrices, and forces combine and control stem cells. Science 2009; 324: 1673-7. 13. Wang N, Tytell JD, Ingber DE. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol 2009; 10: 7582. 14. Pankov R, Yamada KM. Fibronectin at a glance. J Cell Sci 2002; 115: 3861-3. 15. Bassett CA. Beneficial effects of electromagnetic fields. J Cell Biochem 1993; 51: 38793. 16. Goller DA, Weidema WF, Davies RJ. Transmural electrical potential difference as an early marker in colon cancer. Arch Surg 1986; 121: 345-50. 17. Silvera Arenas,L, Barrios C, La matriz extracelular: el ecosistema de la célula –Salud uninorte Barranquilla – Colombia – 16:9-18, 2002.