Karzinom des ösophago-gastralen Übergangs
Anuncio
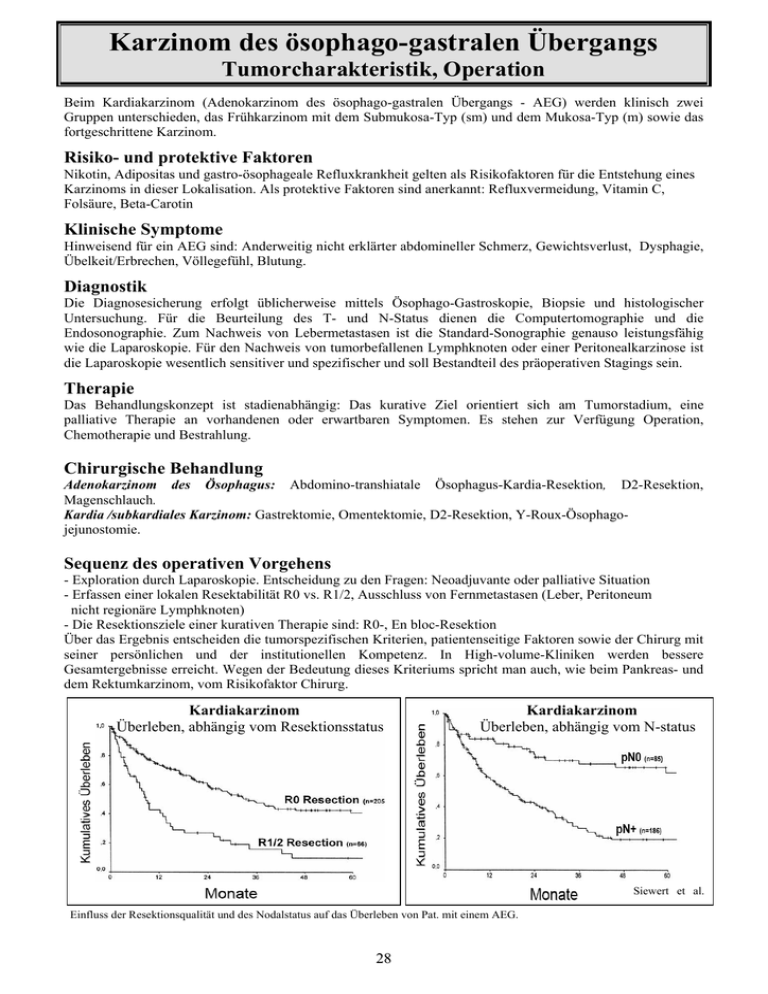
Karzinom des ösophago-gastralen Übergangs Tumorcharakteristik, Operation Beim Kardiakarzinom (Adenokarzinom des ösophago-gastralen Übergangs - AEG) werden klinisch zwei Gruppen unterschieden, das Frühkarzinom mit dem Submukosa-Typ (sm) und dem Mukosa-Typ (m) sowie das fortgeschrittene Karzinom. Risiko- und protektive Faktoren Nikotin, Adipositas und gastro-ösophageale Refluxkrankheit gelten als Risikofaktoren für die Entstehung eines Karzinoms in dieser Lokalisation. Als protektive Faktoren sind anerkannt: Refluxvermeidung, Vitamin C, Folsäure, Beta-Carotin Klinische Symptome Hinweisend für ein AEG sind: Anderweitig nicht erklärter abdomineller Schmerz, Gewichtsverlust, Dysphagie, Übelkeit/Erbrechen, Völlegefühl, Blutung. Diagnostik Die Diagnosesicherung erfolgt üblicherweise mittels Ösophago-Gastroskopie, Biopsie und histologischer Untersuchung. Für die Beurteilung des T- und N-Status dienen die Computertomographie und die Endosonographie. Zum Nachweis von Lebermetastasen ist die Standard-Sonographie genauso leistungsfähig wie die Laparoskopie. Für den Nachweis von tumorbefallenen Lymphknoten oder einer Peritonealkarzinose ist die Laparoskopie wesentlich sensitiver und spezifischer und soll Bestandteil des präoperativen Stagings sein. Therapie Das Behandlungskonzept ist stadienabhängig: Das kurative Ziel orientiert sich am Tumorstadium, eine palliative Therapie an vorhandenen oder erwartbaren Symptomen. Es stehen zur Verfügung Operation, Chemotherapie und Bestrahlung. Chirurgische Behandlung Adenokarzinom des Ösophagus: Abdomino-transhiatale Ösophagus-Kardia-Resektion, D2-Resektion, Magenschlauch. Kardia /subkardiales Karzinom: Gastrektomie, Omentektomie, D2-Resektion, Y-Roux-Ösophagojejunostomie. Sequenz des operativen Vorgehens - Exploration durch Laparoskopie. Entscheidung zu den Fragen: Neoadjuvante oder palliative Situation - Erfassen einer lokalen Resektabilität R0 vs. R1/2, Ausschluss von Fernmetastasen (Leber, Peritoneum nicht regionäre Lymphknoten) - Die Resektionsziele einer kurativen Therapie sind: R0-, En bloc-Resektion Über das Ergebnis entscheiden die tumorspezifischen Kriterien, patientenseitige Faktoren sowie der Chirurg mit seiner persönlichen und der institutionellen Kompetenz. In High-volume-Kliniken werden bessere Gesamtergebnisse erreicht. Wegen der Bedeutung dieses Kriteriums spricht man auch, wie beim Pankreas- und dem Rektumkarzinom, vom Risikofaktor Chirurg. Kardiakarzinom Überleben, abhängig vom Resektionsstatus Kardiakarzinom Überleben, abhängig vom N-status Siewert et al. Einfluss der Resektionsqualität und des Nodalstatus auf das Überleben von Pat. mit einem AEG. 28 Karzinom des ösophago-gastralen Übergangs Klassifikation Das Adenokarzinom des ösophago-gastralen Übergangs wurde in der Vergangenheit vielfach entweder als Ösophagus- oder als Magenkarzinom angesehen. Diese Tumore zeigen deutliche Unterschiede sowohl zum klassischen Plattenepithelkarzinom des Ösophagus als auch zum Magenkarzinom (Siewert JR et al. Ann Surg 2001; 234:360-67). Definition Alle Adenokarzinome im Bereich des ösophago-gastralen Übergangs, d.h. zwischen 5 cm oral und 5 cm aboral der anatomischen Kardia, werden unter dem Begriff AEG zusammengefasst. Die Kardia ist anatomisch der Bereich des Übergangs der 2-schichtigen Ösophagusmuskelwand zur 3-schichtigen Muskulatur der Magenwand. Endoskopisch beginnt die Kardia an der oralen Begrenzung der Magenschleimhautfalten. Beachte: Die Ora-serrata- oder Z-Linie, die lediglich die Grenze zwischen Platten- und Zylinderepithel wiedergibt, kann im Verhältnis zur muskulär definierten Kardia deutlich verschoben sein und ist deshalb nicht geeignet für die anatomische Lokalisation der Kardia (Stein HJ et al. in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, SpringerVerlag, 2004). Anatomisch-topographische Klassifikation Die anatomisch-topographische Klassifikation der Adenokarzinome des ösophago-gastralen Übergangs (AEG) umfasst drei Typen. Für die Zuordnung gilt das Tumorzentrum oder >50% der Tumormasse. Adenokarzinom des distalen Ösophagus (Barrett-Karzinom) Klassifikation der Karzinome des gastro-ösophagealen Übergangs - AEG (adenocarcinoma of AEG Typ I: Der Tumor ist zwischen the esophago-gastric junction), Typ I, II, III. Sendler A, et al. Onkologe 2008;14:831-42 5 cm und 1 cm oral der Kardia lokalisiert. Diese Karzinome entwickeln sich in der Regel auf dem Boden einer refluxinduzierten, intestinalen Metaplasie im distalen Ösophagus, dem Barrett- oder Endobrachy-Ösophagus, und stellen das typische Adeno-Ca des distalen Ösophagus dar. Häufig infiltrieren diese Tumore die Kardia von oral. Eigentliches Kardiakarzinom AEG Typ II: Hierzu gehören Tumore, deren Zentrum direkt in Höhe der anatomischen Kardia gelegen ist (oral: <1 cm, aboral: <2 cm). Subkardiales Magenkarzinom AEG Typ III: Bei eindeutig distal (>2 cm und >5 cm) des oralen Endes der typischen Magenschleimhautfalten lokalisiertem Tumorzentrum wird vom AEG Typ III gesprochen. Die Infiltration der Kardia erfolgt von aboral. Epidemiologische und tumorbiologische Charakteristika der AEG-Untergruppen Eine wichtige Frage in Hinblick auf therapeutische Konsequenzen ist, ob die drei Tumorentitäten Unterschiede in ihrer Tumorbiologie aufweisen. Solche lassen sich nachweisen: - Das Überwiegen männlicher Patienten nimmt von Typ I (9:1) zu Typ III (2:1) kontinuierlich ab. - Dem gastroösophagealen Reflux kommt nur beim Typ I eine pathogenetische Bedeutung zu. Pat. mit AEG Typ I weisen im Gegensatz zu den Typen II und III zumeist eine lange Refluxanamnese und eine Hiatushernie auf. - Eine intestinale Metaplasie im distalen Ösophagus (Barrett-Ösophagus) findet sich praktisch immer beim Tumortyp I, nur gelegentlich (in etwa 10-20% der Fälle) beim Typ II und praktisch nie beim Typ III. - Bei den Typen II und III steht eine intestinale Metaplasie der Magenschleimhaut streng mit dem Nachweis von Helicobacter pylori in Verbindung. - Das Tumorgrading ist beim Typ I günstiger (G3/G4 in etwa 25% der Fälle) als bei den Typen II und III (G3/G4 in 75% bzw. 50%). Eine Lymphknotenmikrometastasierung erscheint beim Typ I verzögert aufzutreten. 29 Karzinom des ösophago-gastralen Übergangs Therapiestrategie Klassifikation Bezüglich der T-Kategorie zeigt die Auswertung der Überlebenskurven eine treffendere prognostische Voraussage, wenn die Ösophaguskarzinomklassifikation verwendet wird. Teilt man die Lymphknotenmetastasen gemäß dem Ösophaguskarzinom ein, entsprechen befallene Lymphknoten im unteren hinteren Mediastinum und parakardial einer N1-Kategorie, während solche am Truncus coeliacus und entlang der großen und kleinen Kurvatur als M1lymph einzuordnen wären. Bei einer Klassifikation des Lymphknotenbefalls analog dem Magenkarzinom wäre die Anzahl der befallenen Lymphknoten entscheidend. Unter diesem Gesichtspunkt erscheinen die UICC-/AJCC-Kriterien des Magenkarzinoms für das Lymphknotenstaging geeigneter. Diagnostik Um eine stadienadaptierte Behandlung zu ermöglichen, ist eine systematische Diagnostik notwendig¹). Operatives Vorgehen Die Operation der Wahl ist beim AEG Typ I die subtotale Ösophagektomie. Für AEG-Typen II und III wird die transhiatal erweiterte totale Algorithmus der Diagnostik und Therapie bei Adenokarzinomen des Gastrektomie mit Resektion onkologisch gastroösophagealen Übergangs (AEG)1). notwendiger Anteile des distalen Ösophagus und Rekonstruktion durch Ösophagojejunostomie favorisiert. Bei Frühbefunden (hochgradige Dysplasie, Frühkarzinom) wird die Schematische Notwendigkeit der totalen Gastrektomie bzw. subtotalen Darstellung der ReÖsophagektomie, vor allem bei den AEG Typ I und II, in Frage konstruktion nach gestellt und aus onkologischer Sicht die proximale Gastrektomie limitierter Resekund distale Ösophagusresektion diskutiert. Um Reflux aus dem tion am ösophagoRestmagen zu verhindern, erfolgt dabei die Rekonstruktion mit gastralen Übereinem isoperistaltisch interponierten Jejunumsegment. gang. Lymphadenektomie Nach: Stein HJ et al. in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, SpringerVerlag, 2004 Die systematische Lymphadenektomie des hinteren unteren Mediastinums, kombiniert mit einer abdominellen D2Lymphadenektomie, gilt als Standard. Pankreasschwanz und Milz werden bei fehlender Tumorinfiltration generell erhalten, um die mit einer Entfernung assoziierte Morbidität zu vermeiden. Auch beim AEG Typ I ist die transhiatale mediastinale Lymphadenektomie zumeist ausreichend. Nur wenn beim Barrett-Karzinom mehr als 6 regionale Lymphknoten (hinteres unteres Mediastinum bzw. perikardial) tumorbefallen sind, ist mit einer nennenswerten Inzidienz eines subkarinalen oder oberen mediastinalen Lymphknotenbefalles zu rechnen. Bei diesen Patienten ist die Prognose mit alleiniger chirurgischer Therapie auch nach ausgedehnter oberer mediastinaler Lymphadenektomie desolat. Eine präoperative Chemotherapie ist für diese Patienten sinnvoll. Die Überlebenswahrscheinlichkeit lässt sich damit verbessern. 10-Jh-Überlebensraten bei 1002 resezierten Adenokarzinomen des gastroösophagealen Übergangs (AEG) der TU München, unterschieden nach der Tumorlokalsation. Ergebisse der Arbeitsgruppe Siewert, München. 1) Aus: Stein HJ et al. in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, Springer-Verlag, 2004. 30 Frühkarzinom Endoskopische Mukosaresektion Endoskopische Mukosaresektion (EMR) Frühkarzinome (T1) des Gastrointestinaltraktes sind Tumore, die auf die Mukosa (T1m) und Submukosa (T1sm) begrenzt sind. Die Frühkarzinome des GI-Traktes werden nach der „Paris-Klassifikation“ endoskopischmakroskopisch in drei Typen differenziert: polypoider Typ I, flacher Typ II, exulzerierter Typ III. Typ II wird weiter in 3 Untergruppen (IIa flach erhaben, IIb im Schleimhautniveau, IIc leicht eingesenkt) unterteilt. Frühkarzinome sind in den vergangenen Jahren zunehmend in das Zentrum des Interesses gerückt, da sie bei adäquater Therapie eine sehr gute Prognose haben. Neben der chirurgisch-onkologischen Resektion steht in Form der EMR eine endoskopische, lokal-ablative Therapie zur Verfügung. Die Indikation für die EMR wird durch das Risiko von Lymphknotenmetastasen limitiert. Dieses ist insbesondere von der Infiltrationstiefe des T1-Karzinoms bestimmt. Während bei T1m-Tumoren das Risiko für Lnn-Metastasen zwischen 0 und 4% liegt, steigt es mit zunehmender Submukosainfiltration bis 20% an. Als limitierend für die EMR wurde daher eine sm-Infiltration von 200µm im Ösophagus, 500µm im Magen und 1000µm im Kolon postuliert (Yamamoto S et al, Gastroenterology 2004; 51:9981000). Für eine EMR sind Frühkarzinome (Typ I, IIa, IIb) mit einem Niedrig-Risikobefund geeignet. Low risk-Kriterien (H, Eur J Gastroenterol Hepatol 2006, 18:863-866): hoher Differenzierungsgrad (G1-2), fehlende Venen- und Lymphgefäßinfiltration (L0, V0) fehlende, allenfalls oberflächliche sm-Infiltration Die endoskopische Resektion wird in der Regel nach Unterspritzung der Läsion mit NaCl 0,9% durchgeführt. Dadurch wird ein Polster zwischen den Tumor und die Muscularis propria gelegt. Die Abtragung erfolgt dann mit einer einfachen Schlinge oder mit Hilfe einer Kappen- und Saugtechnik. Mit diesen Methoden können Läsionen bis zu einem maximalen Durchmesser von 2 cm en bloc reseziert werden. Die Komplikationsraten der EMR sind niedrig. Perforationen treten am oberen GI-Trakt in 0,06 bis 5% der Fälle auf, Blutungen kommen in bis zu 13% der behandelten Pat. vor. Blutungskomplikationen können in aller Regel unmittelbar endoskopisch unter Kontrolle gebracht werden. Größere Läsionen müssen in mehreren Technik der EMR A) Abtragung einer flachen Läsion mit der Schlinge Fragmenten (Piece-Meal-Technik) abgetragen werden. Bei B) EMR mit der Schlinge nach submucöser NaCl-Injektion dieser Technik steigt jedoch das Risiko der inkompletten C) EMR mit der Inoue-Kappe nach submucöse NaCl-Inj. Tu-Entfernung und damit des Rezidivrisikos in bis zu 20% nach Wehrmann T et al, Z Gastroenterol 2001; 39: 919-28 der Fälle deutlich an. Risiko einesLymphknotenbefalls bei Pat. mit Zustand nach Gastrektomie und radikaler Lymphknotendissektion wegen eines Magenfrühkarzinoms (Rabenstein T. et al. Onkologe 2008;14:350-61) Differenziertes Adenokarzinom, pL0, intramukosal (m1-m3) Ohne Ulzerationen bei jeder Tumorgröße Bei Ulzerationen Tumorgröße <3 cm Differenziertes Adenokarzinom, winzige submuköse Infiltration (sm1), pL0 Ohne Ulzerationen und Tumorgröße <3 cm Intramukosales undifferenziertes Karzinom (G3/G4), pL0, intramukosal (m1-m3) Ohne Ulzerationen und Tumorgröße <3 cm 0/ 929 Patienten 0/1230 Patienten 0/145 Patienten 0/141 Patienten Endoskopische submukosale Dissektion (ESD) Eine Weiterentwicklung der EMR ist die ESD, die vor allem in Japan bei Magenfrühkarzinomen in den letzten Jahren zunehmend durchgeführt wird. Hier werden Tumorareale nach ausgedehnter Unterspritzung zumeist mit Hyaluronsäure oder NaCl mittels spezieller Koagulations- und Schneideinstrumente (z.B. hook-knife, IT-knife, triangle-knife) von der Muscularis propria en bloc abpräpariert. Die ESD ermöglicht die Abtragung wesentlich größerer Areale als die EMR, ist jedoch bislang noch mit einer höheren Komplikationsrate behaftet (Tamegai Y et al, Endoscopy 2007; 39:418-422). Ob sich diese sehr zeitaufwendigen Techniken in Europa etablieren werden, bleibt abzuwarte Die endoskopische Resektion (ER) bietet eine der Chirurgie vergleichbare therapeutische Effizienz, ist aber mit geringerer Beeinträchtigung des Patienten durchführbar und preiswerter.Die ER des mukosalen Magenfrühkarzinoms ist in Japan inzwischen die Behandlungsmethode der Wahl. 31 Karzinom des ösophago-gastralen Übergangs POET-Studie, Therapieablauf Insgesamt können bei pT3/4-Adenokarzinomen des ösophago-gastralen Übergangs mit alleinigem chirurgischem Vorgehen, nach kompletter Resektion in Form eines Zweihöhleneingriffs, nur etwa 15-25% der Patienten geheilt werden. Präoperative Chemo- und kombinierte Radio-/Chemotherapie mit R0-Resektion Eine Verbesserung der R0-Resektionsrate durch eine Chemotherapie ist bei nicht resektablen Magenkarzinomen gesichert. Auch bei distalen Ösophaguskarzinomen scheint sich dies zu bestätigen (Phase-III-Studie des britischen Medical Research Council (MRC) Oesophageal cancer Working Party, Girling DJ Lancet 2002; 359:1727-33). In vielen Phase-II- und randomisierten Studien wurde der Stellenwert einer präoperativ eingesetzten Radio-/ Chemotherapie (RT-ChT) mit dem Ziel der Prognoseverbesserung beim Adenokarzinom des gastroösophagealen Übergangs untersucht. Diese Therapien sind effektiv und können in ca. 25% der Pat. eine pathologisch komplette Remission induzieren. Nach der Metaanalyse von Gebski et al. (Lancet Oncol 2007;8:226-34,) wird das 2-JahreÜberleben nach neoadjuvanter RT-ChT und Operation um 13% im Vergleich zur alleinigen Chirurgie erhöht. Insbesondere Patienten mit einer schlechten Prognose nach alleiniger Chirurgie profitieren von der neoadjuvanten RT-ChT. Die individuelle Prognose hängt von verschiedenen Faktoren wie einer frühen PET- Response ab. Auch die präoperative Chemotherapie alleine kann nach randomisierten Studien, insbesondere dem MAGIC-Trial (N Engl J Med 355:11-20, 2006), zu einer Prognoseverbesserung beim Adenokarzinom des gastroösophagealen Übergangs im Vergleich zur alleinigen Chirurgie führen (M.Stuschke, GI-Oncology, Wiesbaden, 2007). Eine Steigerung der lokalen Tumorkontrolle durch eine präoperative RT-ChT ist ebenfalls erreichbar. Die etwas erhöhte postoperative Letalität nach Radiatio muss berücksichtigt werden. Die Bedeutung der präop. Radiatio für das Langzeitüberleben ist jedoch noch unklar. Bisher gibt es keine Daten aus einem randomisierten Vergleich über den Beitrag der Strahlentherapie am Behandlungsergebnis einer neoadjuvanten Therapie von AEG-Tumoren. Die neoadjuvante RT-ChT führte im retrospektiven Vergleich mit alleiniger Operation zu höheren Überlebensraten (Stahl M et al. Ann Hematol 1998, 77 (Suppl II): 43, A167). Im Rahmen der prospektiv randomisierten und inzwischen abgeschlossenen POET-Studie überprüfte die German Oesophageal Cancer Study Group unter Führung der Essener Arbeitsgruppe die neoadjuvante Chemotherapie mit einer Chemo-/Radiotherapie (5FU/Folinsäure/Cisplatin) beim Adenokarzinom des ösophago-gastralen Übergangs. Leiter der klinischen Prüfung: PD Dr. M.Stahl, Innere Klinik I der Kliniken Essen-Mitte, Henricistr. 92, 45136 Essen, Telefon- und Fax-Nr: 0201/174-1251 / -1255 Studiendesign [A] PFL1) 1 2 [B] PFL1) 1 2 2,5 OP R 1) CDDP + VP RT Cisplatin/5-FU/Leucovorin Therapieablauf 5-FU: 2 g/m2; Folinsäure (FA): 500 mg/m2, Cisplatin 50 mg/m2 Radio-Chemotherapie: Cisplatin: 50 mg/m2, d 1 und d 8; Etoposid: 80 mg/m2, d 3-5, Strahlentherapie: 2 Gy/d 5 Tage / Woche, Gesamtdosis von 30 Gy im Referenzpunkt 32 OP Karzinom des ösophago-gastralen Übergangs POET-Studie, Chemotherapie Chemotherapie Arm A, Präoperative Chemotherapie: PLF-Schema Cisplatin Folinsäure 5-FU 50 mg/m2 2 500 mg/m 2000 mg/m2 1 Stunde i.v.-Inf. Woche 1, 3, 5 2 Stunden i.v.-Inf. 24 Stunden i.v. -Inf. Woche 1, 2, 3, 4, 5, 6 Woche 1, 2, 3, 4 ,5, 6 Wiederholung: Tag 50, Applikation von 2½ Zyklen, d.h. einschließlich Tag 15 des 3. Zyklus. Operation in der Woche 21 oder 22. Die Reihenfolge der Medikamente entspricht genau dem oben stehenden Schema (Cisplatin dann Folinsäure dann 5FU), die angegebenen Infusionszeiten sind einzuhalten. 5-FU wird über tragbare Infusionspumpen verabreicht. Zur Durchführung der Chemotherapie ist daher die Implantation eines zentralvenösen Portsystems notwendig. Arm B, Präoperative Chemo-/Radiotherapie Zunächst 2 Zyklen Chemotherapie PLF wie oben, dann ab Woche 15: CE-Therapie. Die Chemotherapie beginnt am Tag 2 der kombinierten Chemo-/Radiotherapie, idealerweise an einem Dienstag. Die Chemotherapie wird parallel zur Radiatio nach folgendem Schema verabreicht: CE-Schema Cisplatin Etoposid 50 mg/m2 80 mg/m2 1 Stunde i.v.-Inf. 1 Stunde i.v.-Inf. Tage 2 und 8 Tage 3 bis 5 Die Reihenfolge der Medikamente und die Infusionsdauer müssen eingehalten werden. Besteht vor Beginn der Chemo-/Strahlentherapie eine Neuro- oder Nephrotoxizität über Grad 1, so wird auf die Gabe von Cisplatin zur Radiatio verzichtet. Dosismodifikation Tritt innerhalb von 24 Stunden vor einer geplanten Chemotherapie einer der folgenden Toxizitäten auf Diarrhoe CTC-Grad 1 bis 2, Mucositis CTC-Grad 1 bis 2, Hand-Fuß-Syndrom CTC-Grad 2 Leukopenie CTC-Grad 2 (2000 bis 3000), Thrombopenie CTC-Grad 1 (75.000 bis 100.000/µl) so wird die geplante Therapie um bis zu einer Woche verschoben, bis die nicht-hämatologischen Nebenwirkungen abgeklungen sind bzw. bis die Leukozyten über 3000/µl und die Thrombozyten über 100.000/µl angestiegen sind. Unabhängig von der Verschiebung wird die Chemotherapie je Therapieblock 6 mal (bzw. im 3. Block 3 mal) verabreicht. Tritt zu irgendeinem Zeitpunkt innerhalb eines Therapieblocks der Chemotherapie einer der folgenden Toxizitäten auf Diarrhoe CTC-Grad >2, Mucositis CTC-Grad >2, Hand-Fuß-Syndrom CTC-Grad >2 so erfolgt neben der o.g. Therapieverschiebung ab diesem Zeitpunkt eine Dosisreduktion von 5-FU um 20%. Tritt zu irgendeinem Zeitpunkt innerhalb eines Therapieblocks der Chemotherapie einer der folgenden Toxizitäten auf Leukopenie CTC-Grad >2 (<2000/µl), Thrombopenie CTC-Grad >1 (<75.000/µl) so erfolgt neben der o.g. Therapieverschiebung ab diesem Zeitpunkt eine Dosisreduktion von Cisplatin um 20%. Tritt zu irgendeinem Zeitpunkt der präoperativen Therapie folgende Toxizität auf Neurotoxizität CTC-Grad >1, Nephrotoxizität CTC-Grad >1 wird die Gabe von Cisplatin gestoppt und die Therapie mit 5-FU/Leukovorin fortgesetzt. Die Gesamtdauer der Chemotherapie muss in diesem Fall nach Rücksprache mit der Studienleitung festgelegt werden. Bei Auftreten von Angina pectoris bis zu 2 Tage nach 5-FU muss ein akuter Herzinfarkt ausgeschlossen werden. Bei Abklingen der Symptomatik und normalem EKG/Laborwerten sollte bei den nächsten Applikationen von 5-FU ein Calcium-Antagonist prophylaktisch gegeben werden. Kommt es im weiteren Verlauf dennoch erneut zu Angina pectoris, so muss der Patient aus der Studie genommen werden. Das weitere Vorgehen ist dann freigestellt. Die Studienzentrale ist innerhalb von 24 Studien über den Vorfall zu informieren. Minimaler Hämoglobinwert, Erythropoetingabe Um optimale Bedingungen für die Durchführung der Chemo-/Radiotherapie zu gewährleisten, muss während der gesamten Dauer der präoperativen Therapie ein Hämoglobin-Wert von mindestens 12 g/dl gewährleistet sein. Dies sollte möglichst nicht durch die Transfusion von Erythrozyten-Konzentraten erreicht werden. stattdessen ist eine Stimulation der Erythropoese mit humanem, rekombinantem Erythropoetin durchzuführen, sobald ein Abfall des HbWertes auf 12,5 g/dl oder weniger nachgewiesen wird. Erythropoetin wird als Langzeitpräparat einmal wöchentlich s.c. verabreicht. Lokaler Tumorprogress Falls während der präoperativen Therapie ein lokaler Tumorprogress nachgewiesen wird, muss die Chemotherapie bzw. die Chemo-/Radiotherapie abgebrochen werden. In diesem Fall sollte eine vorgezogene Operation erfolgen. 33 Karzinom des ösophago-gastralen Übergangs POET-Studie; Strahlentherapie, Operation Radiotherapie Präoperative Chemo-/Radiotherapie (Arm B) Bereits während des 2. Blocks der Chemotherapie müssen die vorbereitenden Untersuchungen und die Vorstellung in der Strahlentherapie des jeweiligen Zentrums so rechtzeitig erfolgen, dass die kombinierte Chemo-/Radiotherapie innerhalb von 3 Wochen nach der letzten Chemotherapie (d.h. am Tag 50 bis 63 des zweiten Blocks der Chemotherapie) beginnen kann. Eine Verzögerung um max. 1 Woche ist erlaubt, falls die Nebenwirkungen der Chemotherapie (Leuko-/Thrombopenie, Mucositis) noch nicht vollständig abgeklungen sind oder aus technischen Gründen ein Beginn nicht früher möglich ist. Die erste Bestrahlung im Behandlungsteil der kombinierten Chemo-/ Radiotherapie findet möglichst an einem Montag statt (Tag 1 der Chemoradiotherapie). Zur Bestrahlungsplanung benötigte Patientendaten Die initialen Staginguntersuchungen sind oben aufgeführt. Eine Computertomographie von Thorax und Abdomen, eine Ösophagus-Kontrastdarstellung sowie die Befunde der Ösophagoskopie und Endosonographie müssen zur Bestrahlungsplanung vorliegen. Strahlentherapeutische Volumina Das klinische Zielvolumen (CTV) enthält den Primärtumor in der ursprünglichen Tumorausdehnung vor Therapie einschließlich nachfolgend beschriebener Sicherheitssäume und die klinisch/bildgebend befallenen Lymphknoten und die Lymphknotenregionen mit hohem Risiko für einen subklinischen Tumorbefall. Nur im Falle eines lokalen Tumorprogresses während der Induktionschemotherapie und dem Entschluss zur (vorzeitigen) Chemo-/Radiotherapie schließt des CTV die Tumorausdehnung nach Chemotherapie mit einem Sicherheitssaum in allen Richtungen ein. Zum makroskopischen Primärtumor beträgt der Sicherheitssaum 5 cm in der oralen und aboralen Richtung des Hohlorgans sowie 2 cm in transversaler Richtung im Weichteilgewebe. Der genannte Sicherheitsabstand nach caudal gilt nur für Tumoren des unteren Ösophagus. Bei infradiaphragmaler Tumorausdehnung beträgt der Sicherheitssaum 3 cm entlang der Schleimhautoberfläche und 2 cm transversal im Weichteilgewebe. Neben allen befallenen Lymphknotenstationen werden folgende Lymphknotenstationen obligat ins CTV eingeschlossen, auch wenn sie klinisch nicht befallen sind: die Lymphknoten links und rechts um die Kardia, die Lymphknoten entlang des Stammes der linken A. gastrica und weiter entlang der kleinen Kurvatur bis zur Angulusfalte, die Lymphknoten im Bereich des Truncus coeliacus und entlang der proximalen Anteile der A. hepatica communis und A. lienalis (bis 2 cm nach deren Abgang) einschließlich eines Sicherheitssaumes von 1,5 cm. Das CTV endet an einer vom Tumor nicht infiltrierten anatomischen Grenze, z.B. der äußeren Wirbelsäulenkontur oder der Pleura visceralis. Das Planungszielvolumen (PTV) enthält das CTV plus einem Sicherheitssaum von 0,8 cm, um Lagerungsvariationen und Organbewegungen zu berücksichtigen. Gesamtdosis, Fraktionierung Bestrahlt wird in konventioneller Fraktionierung mit einer Fraktion von 2 Gy pro Tag an 5 Tagen pro Woche, bis zu einer Gesamtdosis von 30 Gy im Referenzpunkt. Die Bestrahlung sollte möglichst an einem Montag beginnen. Bestrahlungspausen sind nicht vorgesehen. Bei Auftreten einer Mukositis > Grad 2 unter Radio(chemo)therapie wird die Radiatio beendet. Falls eine Unterbrechung der Strahlentherapie aufgrund anderer Toxizität, interkurrenter Erkrankung oder aus sonstigen Gründen notwendig ist, müssen die Dauer der Unterbrechung und der Grund hierfür dokumentiert werden. Ein Dosisausgleich für Behandlungspausen ist nicht vorgesehen. Die erste Fraktion sollte nicht an einem Freitag, die letzte nicht an einem Montag verabreicht werden. Operation Die konventionelle transhiatale Operation erfüllt sicherlich nicht die Forderungen der lokalen Radikalität, so dass in dieser Studie neben der transthorakalen en blocÖsophagektomie alternativ die radikale transhiatale Ösophagektomie, fakultativ mit Durchführung einer sog. Endodissektion, zur Anwendung kommen kann. Die Entscheidung, welches Vorgehen nach präoperativer Chemo- oder Chemo-/ Radiotherapie gewählt wird, trifft die teilnehmende Chirurgische Klinik anhand der innerhalb der Klinik vorliegenden Erfahrung mit der jeweiligen Methode, insbesondere nach präoperativer Chemotherapie / Chemo-/Radiotherapie. Lymphknotendissektion Die exakte und systematische Lymphknotendissektion ist ein wesentlicher Teil des chirurgischen Vorgehens. Im Rahmen des abdominellen und des thorakalen Operationsschrittes ist eine Zweifelder-Lymphadenektomie (einschließlich StandardMediastinektomie) durchzuführen. Resektat eines Kardiakarzinoms. PD Dr. U. Klinge, Aachen 34 Ösophagus Tumor Adenokarzinom ösophago-gastraler Übergang POET-Studie, Ergebnisse Perioperative Chemotherapie Ergebnisse der POET-Studie (M. Stahl et al. 43. ASCO-Meeting, Chicago, 2007, A:4511) Die Studie wurde wegen schleppender Rekrutierung vorzeitig beendet. Geplant waren 394 Patienten. Die Studie stützt sich auf 126 randomisierte Patienten. Die Rekrutierungszeit erstreckte sich von 12/00 bis 12/05. Die Daten von 119 Patienten waren auswertbar. Die Toxizität war im Chemotherapiearm gering. Eine schwergradige Leukozyten- und Thrombozytopenie fand sich in 16% gegenüber 35% in der kombinierten Radio-/ Chemotherapie-Gruppe. Bis 12/06 wurden 90 Patienten operiert. Es lagen vollständige Daten über diese Gruppe vor. Eine komplette Resektion wurde bei 77% im Chemotherapiearm und in 85% im Radio-/Chemotherapie (RT-ChT)-Arm erreicht. Die Rate der kompletten histologischen Remissionen betrug 2,5% für den Arm A und 17% für den Arm B (p=0.06). Als besonders bemerkenswert wird die Reduktion von Lymphknotenmetastasen zum Operationszeitpunkt von 2/3 nach einer Induktionschemotherapie auf 1/3 nach Radio-/Chemotherapie angesehen. Es ließ sich ein Trend zu einem verlängerten Überleben nach RT-ChT ablesen. Die postoperative Letalität war nach neoadjuvanter Radio-/Chemotherapie trotz niedriger Gesamtstrahlendosis von 30 Gy in konventioneller Fraktionierung im Vergleich zur Vorbehandlung mit alleiniger Chemotherapie erhöht (5 versus 2 Pat.). Ob dieser nichtsignifikante Effekt an Prognosefaktoren lag (Pat. im Radio-/Chemotherapie-Arm waren im Durchschnitt fünf Jahre älter als im Chemotherapie-Arm), auf die neoadjuvante Kombinationsbehandlung zurückzuführen ist oder eine zufällige Beobachtung darstellt, kann nicht mit Bestimmtheit entschieden werden. Verbessertes 3-Jahres-Überleben Trotz der erhöhten Mortalität nach der RT-ChT war die mediane Überlebenszeit mit 32,8 Monaten und das 3Jahres-Überleben mit 43% besser als in der Chemotherapiegruppe (21,1 Monate bzw. 27%, p=0,14). POET-Studie. Verbessertes histopathologisches Ansprechen und höheres Gesamtüberleben durch eine neoadjuvante Radio-/ Chemotherapie vs. alleinige Chemotherapie beim lokal fortgeschrittenen Adenokarzinom des ösophago-gastralen Übergangs (M. Stahl et al., ASCO 2007, Abstr. 4511) Fazit Die Studie zeigte, dass eine präoperative Radio-/Chemotherapie das Gesamtüberleben und auch das Kriterium Freiheit von der lokalen Tumorprogression im Vergleich zur alleinigen präoperativen Chemotherapie bei lokal fortgeschrittenen Karzinomen des oesophago-gastralen Adenokarzinoms verbessert. Trotz der vergleichsweise kleinen Zahl von Pat. kommen die Autoren zu dem Schluss, dass die Studie dennoch eine wichtige Aussage bezüglich des Stellenwertes der kombinierten RT-ChT in der neoadjuvanten Behandlung des Karzinoms des oesophago-gastralen Übergangs erlaubt. Durch moderne Strahlentherapietechniken können die Nebenwirkungen dieser Therapiemodalität deutlich gesenkt werden (M. Stuschke, GI-Oncology, Wiesbaden, 2007). POET-Studie. Histopathologische Ergebnisse Arm A Arm B p T0 N0 M0 T1-4 N0 M0 T0-4 N0 M0 T0-4 N+ M0 T1-4 N+ M1 R0-Resektio (n=49) (n=45) 2,0 % 34,7 % 36,7 % 55,1 % 8,2 % 70 % 15,5 % 48,9 % 64,4 % 31,1 % 4,4 % 72 % 0,03 0,01 Gibt es eine Standard-Radio-/Chemotherapie? Das amerikanische NCCN (National Comprehensive Cancer Network (www.nccn.org) empfiehlt in seinen Leitlinien zur kombinierten Radio-/Chemotherapie des Kardiakarzinoms neben der Bestrahlung folgende Chemotherapien: 5-FU/Cisplatin oder Taxan- oder Irinotecan-basierte zytostatische Behandlung. 35 PET. Metabolische Responsebeurteilung MUNICON1-Studie PET Die PET mit der Suchsubstanz FDG (18F-Fluor-Deoxy-Glukose) basiert auf einer szintigraphischen Darstellung eines erhöhten Glukosestoffwechsels in Zellen maligner Tumore. Im Unterschied zu morphologisch orientierten bildgebenden Verfahren wie CT und MRT spielt für die PET das metabolisch-molekulare Verhalten der Tumorzellen die entscheidende Rolle für die Detektion einer Neoplasie. Die Kombination mit einer CT-Untersuchung (PET/CT) erhöht die diagnostische Genauigkeit. Üblicherweise wird die PET zum Staging vor Therapiebeginn eingesetzt. Für das nicht-kleinzellige Bronchialkarzinom liegt dafür inzwischen eine anerkannte Indikation vor. Beim Staging des lokal fortgeschrittenen Adenokarzinoms des Ösophagus ergeben sich durch die PET-Untersuchung in circa 15 % der Fälle therapierelevante Befunde im Vergleich zum alleinigen Kontrastmittel-CT. Diese Änderungen betreffen eine Revision der Behandlungsstrategie, z.B. von kurativ nach palliativ oder umgekehrt (Stahl A.R. MedWelt 2008,59:277-86). Prä- und posttherapeutisches Staging Wenn das PET posttherapeutisch eingesetzt wird, muss eine Wartezeit zwischen Therapieende und PETUntersuchung von mindestens 4 Wochen eingehalten werden, um behandlungsbedingte, entzündliche Veränderungen und damit falsch positive Befunde von residualen Tumormanifestationen abgrenzen zu können. Berücksichtigt man diese Einschränkung, entspricht ein noch erhöhtes PET-Signal in einer Zielregion in aller Regel einem vitalen Resttumor. In der neoadjuvanten Therapiesituation wird das Ansprechen eines Tumors als einer der wichtigsten, unabhängigen prognostischen Faktoren angesehen, vergleichbar in der Bedeutung mit dem Metastasenstatus oder einer R0-Resektion. Neben prognostischen Informationen kann dieses posttherapeutische, so genannte späte Monitoring, die Entscheidung über Beibehaltung oder den Wechsel der ursprünglichen Therapiestrategie beeinflussen. Nachteil des späten Monitorings ist die fehlende Möglichkeit, in die aktuelle Therapie eingreifen zu können. Frühes Monitoring während einer zytotoxischen Therapie Überlebenswahrscheinlichkeit Beim Karzinom des ösophagogastralen Übergangs ist bereits zu einem frühen Zeitpunkt, nämlich 2 Wochen nach Einleitung einer Chemo-und/oder PET-Responder Strahlentherapie eine metabolische Bewertung des Tumoransprechens mithilfe der PET möglich. In der Studie von Ott K. et al. JCO 2006;24:4692) erhielten alle Pat., unabhängig vom Ansprechen, 3 Zyklen einer Chemotherapie (ChT) mit Cisplatin/5-FU/FOL. Die Responder hatten ein PET-Non-Responder signifikant besseres Gesamtüberleben, siehe nebenstehende Grafik. Das Monate metabolische Ansprechen auf eine ChT nach 15 Tagen erwies sich als das einzige prädiktive Kriterium einer Rezidivwahrscheinlichkeit bei R0Resezieren Pat. (p= 0.018). Schlussfolgerung: Eine PET-Response während der ChT ermöglicht eine Vorhersage zum Ansprechen, zur Prognose und zum Rezidivrisiko eines resektablen AEG-Tumors. Demnach macht die frühe Evaluation bei einem Nicht-Ansprechen eine frühzeitige Änderung der Behandlungsplanung möglich. Diese Form des therapeutischen Monitorings setzt ein Höchstmaß an methodischer Standardisierung voraus, um verlässliche Resultate zu erhalten und ist deshalb nur an hochspezialisierten Zentren durchführbar. MUNICON1-Studie In einer Phase-II-Studie wurden potentiell 111 Pat. mit einem R0resektablen AEG-Tumor vom Typ 1 und 2 der Siewert-Klassifikation (T3 N0/+ M0) eingeschlossen. Alle Patienten erhielten vor einer Chemotherapie mit Cisplatin/5-FU/FOL eine PET-Untersuchung. Nach 14 Tagen wurde das PET wiederholt. Eine Verminderung der FDG-Aufnahme durch den Tumor ≥35 % wurde als metabolisches Ansprechen gewertet. Eine geringere Rückbildung wurde als Nichtansprechen interpretiert. Pat. mit einer Response erhielten vor der Operation 3 Chemotherapiezyklus. Non-Responder wurden sofort operiert. Ergebnisse, Lordick F. et al. Lancet Oncology 2007;8:754. Von den 110 auswertbaren Pat. zeigten nach 2 Wochen 49 % ein metabolisches Ansprechen. 104 Pat. wurden operiert. Histologisch fand sich eine Komplettremission in 16 %, bei 42 % lag eine subtotale histologische Remissionen in der Gruppe der metabolischen Responder vor. Darüber hinaus war ein Shift zu niedrigen Tumorstadien unter den PET-Respondern festzustellen (ypT0 16 % , ypT1 26 % p<0.0001. Die R0Resektionsrate betrug 96 % versus 74 % für die Nicht-Ansprecher. Das mediale Überleben war für die Responder noch nicht erreicht, für die Non-Responder betrug das mediane OS 25,8 Monate. Die Ergebnisse sind ermutigend für eine frühe Selektion der Pat., die von einer präoperativen. Chemotherapie profitieren. 36 Magenkarzinom ESMO-Mindestanforderungen 2008; Diagnostik Inzidenz Die Inzidenz des Magenkarzinoms in der Europäischen Union hat in den letzten Jahrzehnten abgenommen und beträgt ~18,9/100.000 Einwohner/Jahr, die Mortalität liegt bei 14,7/100.000 Einwohner/Jahr mit einer 1,5-fach erhöhten Rate für Männer im Vergleich zu Frauen und mit einem Altersgipfel in der 7. Dekade. Eine Infektion mit Helicobacter pylori erhöht das Risiko für ein Magenkarzinom. Andere Risikofaktoren sind männliches Geschlecht, atrophische Gastritis, Rauchen, M. Menetrier und genetische Faktoren wie hereditäres nicht-polypöses Kolonkarzinom (HNPCC). Diagnose Die Diagnose wird durch eine endoskopische oder chirurgische Biopsie mit histopathologischer Sicherung entsprechend den WHO-Kriterien gestellt. Staging Das Staging beinhaltet die klinische Untersuchung, Laboruntersuchungen, Röntgen-Thorax, CTAbdomen und Endoskopie. Ein Barium-Breischluck ist häufig nützlich für die chirurgische Planung. Endoskopischer Ultraschall und Laparoskopie können helfen, die Resektabilität zu bestimmen. Die Stadieneinteilung sollte nach TNM 2002 und AJCC vorgenommen werden (siehe Tabelle). TNM-Klassifikation 2002 und AJCC-Stadieneinteilung Stadium 0 Stadium IA T1 N0 N0 M0 Stadium II T1 T2a/b T1 T2a/b N1 N0 N2 N1 M0 M0 M0 M0 Stadium IIIA T3 T2a/b T3 N0 N2 N1 M0 M0 M0 Stadium IIIB T4 T3 N0 N2 M0 M0 Stadium IV T4 T1-3 N1-3 N3 M0 M0 Tx Nx M1 Stadium IB Tis M0 Ein alternatives japanisches Stadieneinteilungssystem verwendet Serosainvasion anstelle von TStadium, verwendet andere Definitionen für N-Stadien und berücksichtigt das Ausmaß von peritonealer und hepatischer Metastasierung. Behandlungskonzept Multidisziplinäre Behandlungsplanung ist unbedingt notwendig. Chirurgische Resektion ist die einzige potentiell kurative Option und wird für die Stadien Tis-T3 N0-N2 M0 oder T4 N0 M0 empfohlen. Das Ausmaß der notwendigen regionalen Lymphadenektomie für optimale Ergebnisse wird noch diskutiert. Randomisierte Studien haben bisher keine Überlegenheit einer D2 im Vergleich zu einer D1 Resektion zeigen können, aber ein Minimum von 14, optimal mindestens 25 Lymphknoten sollen entfernt werden. Ann Oncol 2008; 19 (Supp.2):23-24 37 Magenkarzinom ESMO-Mindestanforderungen 2008; Therapie Behandlung lokalisierter Tumore (Stadium 0-II: Tis-T2, N0-N2, T3N0) Eine nordamerikanische randomisierte Intergroup Studie zeigte, dass 5 Zyklen postoperativer adjuvanter 5FU/Leukovorin Chemotherapie vor, während und nach der Radiotherapie mit 45 Gy in fünf 1,8 GyFraktionen/ Woche über fünf Wochen zu einem ca. 15% Überlebensvorteil nach 4-5 Jahren führte [I, C]. Während dieses Vorgehen in Nordamerika Standardtherapie ist, ist es in Europa bisher nicht generell akzeptiert wegen Bedenken hinsichtlich der Toxizität abdomineller Radio-/Chemotherapie und der Art der erfolgten Operation. In der Studie erhielten 54% der Patienten weniger als eine D1-Resektion, das heißt bei der Mehrheit der Patienten wurden nicht alle N1-Lymphknoten reseziert. Die europäische MAGIC-Studie randomisierte neu diagnostizierte Patienten mit Adenokarzinom des Magens oder ösophago-gastralen Übergangs im Stadium II oder höher, aber nicht metastasiert, in einen Arm mit alleiniger Operation oder in einen Arm mit drei Zyklen Chemotherapie mit Epirubicin, Cisplatin und kontinuierlicher 5-FU Gabe (ECF) vor und nach der Operation. Erhöhte R0-Resektionsraten und verbessertes progressionsfreies Überleben und Gesamtüberleben, nach 5 Jh. von 23 % auf 36,3%, konnten für den perioperativen Chemotherapie-Arm gezeigt werden. Diese Daten wurden von der französischen FFCD-Studie bestätigt und sind in weiten Teilen Europas übernommen worden. Metaanalysen verschiedener Studien zeigten für die adjuvante Chemotherapie einen kleinen Überlebensvorteil [III, C], obwohl die einzelnen Studien keinen Überlebensvorteil für postoperative Chemotherapie zeigen konnten. Hinzu kommt eine ausgeprägte Toxizität der postoperativen Chemotherapie, daher ist eine sorgfältige Patientenauswahl nötig. Ermutigende Ergebnisse hat die japanische Studie an 1059 Pat. gebracht, die im randomisierten Vergleich einen signifikanten Überlebensgewinn für die über 12 Monate mit der Substanz S1-behandelten Pat. gegenüber der Kontrollgruppe erbracht hat. Behandlung der lokal fortgeschrittenen Tumore (Stadium III: T3-4; N1) Einige Patienten mit lokal fortgeschrittener Tumorerkrankung profitieren von der präoperativen Chemotherapie durch ein down-staging und bessere Resektionsergebnisse, jedoch sind die Resultate der Phase-II-Studien konfliktreich, so dass keine optimale Behandlungsmethode definiert werden konnte [II, B]. Die Therapie für Patienten mit inkompletter Resektion ist eine palliative. Behandlung der metastasierten Tumorerkrankung (Stadium IV) Kombinationsschemata mit Cisplatin, 5-FU, mit oder ohne Anthrazyklin werden eingesetzt. Epirubicin 50mg/m2, Cisplatin 60mg/m2 und protrahierte 5-FU-Infusion 200mg/m2/Tag (ECF) sind eine effektive und gut tolerierte Kombination [II, A]. Docetaxel steigert die Aktivität von Cisplatin/5-FU, ist jedoch stärker toxisch. Irinotecan/5-FU/Folinsäure ist ähnlich wirksam wie Cisplatin/5-FU. Eine aktuelle Metaanalyse zeigte einen Überlebensvorteil für Drei-Medikamente-Regime, die sowohl ein Anthrazyklin als auch Cisplatin enthielten, im Vergleich zu Zwei-Medikamente-Regime, die eine der beiden Substanzen wegließen. Nach den Daten der REAL2-Studie wird ECX oder EOX in vielen Zentren Europas favorisiert, da diese Regime ein Portsystem entbehrlich machen. Nachsorge Es gibt keinen Nachweis, dass ein intensives follow-up nach initialer Behandlung ein besseres outcome bringt. Symptomorientierte Untersuchungen werden empfohlen [D]. Gezielte laborchemische und radiologische Untersuchungen sollten bei Patienten mit konkretem Verdacht auf Rezidivgeschehen eingesetzt werden. Radiologische Untersuchungen sollten bei den Pat. durchgeführt werden, für die eine palliative Chemo- oder Radiotherapie in Betracht kommt. Anmerkung Die Angaben bezüglich Level of Evidence [I-V] und Grade of Recommendation [A-D] stimmen mit den Empfehlungen der American Society of Clinical Oncology überein. Andere Angaben beziehen sich auf klinisch geprüfte Expertenmeinungen und die ESMO. Ann Oncol 2008; 19 (Supp.2):23-24 38 Magenkarzinom Häufigkeit, Histologie Häufigkeit Inzidenz pro 100.000 E. Die Inzidenz des Magenkarzinoms ist in den letzten 50 Jahren in westlichen Industrienationen rückläufig. Derzeit beträgt die Häufigkeit in Deutschland 25/100.000 für Männer, 10/100.000 für Frauen neue Erkrankungen pro Jahr (Fuchs CS et al. N Engl J Med 1995; 333:32-41). Während die Häufigkeit distaler Magenkarzinome deutlich abgenommen hat, ist in den letzten 20 Jahren eine Zunahme von Karzinomen der Kardia und des ösophago-gastralen Überganges zu verzeichnen. Eine Ursache dafür wird in der Refluxkrankheit gesehen, die für diesen Typ eine Präkanzerose darstellt. Histologie Über 90 % aller malignen Magentumore sind Adenokarzinome. Bei den restlichen Tumoren handelt es sich um Non-Hodgkin-Lymphome und GIST-Neoplasien. Für die Adenokarzinome ist die Einteilung nach Laurén von praktischer Bedeutung. Danach werden unterschieden ein intestinaler und diffuser Typ. Karzinome vom intestinalen Typ weisen histologisch einen drüsenartigen, tubulären Bau auf, sind makroskopisch oft ulzerierend und häufiger distal im Magen lokalisiert. Karzinome vom diffusen Typ sind öfter in der Kardia anzutreffen, kommen häufiger bei jüngeren Menschen vor und weisen eine schlechtere Prognose auf als Karzinome vom intestinalen Typ. Histologisch findet sich eine diffuse Infiltration der Magenwand. Häufigkeit und rückläufige Mortalität des Magen-Ca in Deutschland. Quelle: Ges. epidemiologisches Krebsregister in Deutschland. Magenkarzinom Links: Intestinaler Typ mit gut ausgeformten malignen glandulären Elementen Rechts: Diffuser Typ, kein tubuläres Muster, stärkere szirrhöse Komponente Der histologische Laurén-Typ hat eine praktische Bedeutung für das chirurgische Vorgehen. Beim intestinalen Typ reicht das Tumorwachstum nur wenige Millimeter über den makroskopisch erkennbaren Tumorrand hinaus. Demgegenüber kann beim diffusen Typ die Ausbreitung bis zu 10 cm über den erkennbaren Rand hinaus in die scheinbar intakte Magenwand reichen. Aus diesem Grunde ist beim diffusen Typ im Allgemeinen die Gastrektomie das Operationsverfahren der Wahl, während beim intestinalen Adenokarzinom eine eingeschränkte Resektion möglich sein kann, vor allem bei einem distalen Sitz. Makroskopische Erscheinungsformen nach Borrmann 1. Vorwiegend exophytisch wachsende, meist breitbasige polypöse Karzinome mit knolliger, papillärer, blumenkohlartiger oder zottiger Oberfläche. 2. Karzinome mit zentraler schüsselförmiger Exulzeration mit steilen wallartig aufgeworfenen Rändern und relativ scharfer Abgrenzung zur Umgebung. 3. Karzinome mit zentraler Exulzeration ohne wallartig aufgeworfene Ränder und mit unscharfer Abgrenzung zur Umgebung. 4. Diffuse Tumorinfiltration der Magenwand. Magenfrühkarzinom Unter einem Frühkarzinom („early cancer“) versteht man ein auf die Mukosa oder die Submukosa beschränktes Magenkarzinom. Es kann sich um einen diffusen oder intestinalen Typ handeln. Die häufigste Erscheinungsform des Magenfrühkarzinoms ist das Ulkus mit fokaler Mukosadyskoloration und Schleimhautexkavation am Rand. Verwechslungen mit einem benignen Ulkus sind möglich. Magenfrühkarzinome können multifokal auftreten und lymphogen in regionäre Lymphknoten metastasiert sein, allerdings nur dann, wenn sie eine Ausdehnung bis in die Subkutis aufweisen. 39 Magenkarzinom Präkanzeröse Bedingungen Präkanzeröse Bedingungen (Präkanzerosen im weiteren Sinne) • • • • • • • • Adenome der Magenschleimhaut Hyperplastische Polypen: In Verbindung mit Magenkarzinomen werden in 2% synchron auftretende hyperplastische Polypen gefunden. Peutz-Jeghers-Syndrom: Gehäufte Manifestation maligner Tumore innerhalb und außerhalb des Gastrointestinaltraktes. Morbus Ménétrier Vorausgegangene Magenresektion vom Typ Billroth II Chronische atrophische Gastritis vom Perniziosatyp: Karzinomrisiko 3 - 4mal erhöht Intestinale Metaplasie Infektion mit Helicobacter pylori: Karzinomrisiko um den Faktor 3.6-6 erhöht, etwa 60% der Magenkarzinome werden durch HP-Infektionen induziert. Für das Adenokarzinom des distalen Ösophagus stellt die Refluxkrankheit die häufigste Ursache dar. Präkanzeröse Läsionen im engeren Sinne sind histologisch fassbare Gewebsveränderungen mit erhöhtem Karzinomrisiko. Diese besitzen ein höheres Entartungsrisiko als präkanzeröse Konditionen. Die Dysplasie ist definiert durch das Auftreten von Zellatypien, abnormer Gewebsdifferenzierung und Architektur bei fehlender Invasion und signifikant erhöhtem Entartungsrisiko. Die Dysplasie spielt als Vorläufer des Karzinoms im Sinne der Dysplasie-Karzinom-Sequenz die entscheidende Rolle. Den Schweregraden nach kann eine leichte, mittelschwere und schwere Dysplasie unterschieden werden, wobei das Entartungsrisiko direkt mit dem Schweregrad der Dysplasie korreliert. Die geringe und mittlere Dysplasie kann als low-grade dysplasia zusammengefasst und der schweren Dysplasie als high-grade dysplasia gegenübergestellt werden. Formen der Dysplasie • Schwere Formen der chronisch-atrophen Gastritis (Helicobactergastritis, autoimmune Gastritis bei perniziöser Anämie, reaktiv chemisch-toxische Gastritis bei Gallereflux) +/– intestinaler Metaplasie • Intestinale Metaplasie (reife intestinale Metaplasie = Dünndarmtyp; unreife intestinale Metaplasie = Kolontyp; Entartungsrisiko v.a. bei Kolontyp) • Riesenfaltengastritis (Morbus Ménétrier): extrem selten • Ulcus pepticum ventriculi (maligne Entartung selten; unter 1%, meist primäre Magenkarzinome mit sekundärer Exulzeration) • Hyperplasiogener Polyp nach Elster (besitzt selbst keine präkanzeröse Potenz; sein Auftreten ist aber mit einer erhöhten Magenkarzinominzidenz assoziiert) Praktisches Management der Präkanzerosen Gastroskopien in folgenden Zeitintervallen: • Präkanzeröse Bedingungen: alle 3-5 Jahre. • M. Ménétrier, Perniziosa, Zustand nach subtotaler Resektion wegen Magenkarzinom während der ersten 5 Jahre alle 1-2 Jahre, danach alle 3-5 Jahre. • Präkanzeröse Läsion: Halbjährlich, nach Entfernung eines Adenoms, ab dem 2. Jahr jährlich. Chronisch-atrophische Gastritis. Starke Rarefizierung der Schleimhautfalten M.Ménétrier. Hyperplastische Schleimhautfalten. 40 Magenkarzinom Diagnostik, Empfehlung Deutsche Krebsgesellschaft Die klinische Symptomatik des Magen-Ca ist uncharakteristisch. Da durch eine frühe Diagnosestellung die Prognose entscheidend verbessert wird, ist die Indikation zur Gastroskopie großzügig zu stellen. Oberbauchbeschwerden von mehr als 14 Tage Dauer sind eine Indikation für eine endoskopische Untersuchung. Die Ösophago-GastroDuodenoskopie (ÖGD) ist der Röntgenuntersuchung wegen der Möglichkeit der Biopsiegewinnung überlegen. 5 bis 10 Biopsien liefern eine Trefferquote von 98 % gegenüber 70% bei der Entnahme nur einer Biopsie. Präoperative Diagnostik, Staging1) Obligate Basisdiagnostik • Klinische Untersuchung (supraklavikuläre Lymphknotenvergrößerung, Aszites, intraabdomineller Tumor) • Rö.-Thoraxaufnahme in 2 Ebenen • Ösophago-Gastro-Duodenoskopie mit multiplen (5-10) Biopsien • Endosonographie (Tiefeninfiltration, Lymphknotenmetastasen) • Sonographie des Abdomens und kleinen Beckens • Computertomogramm Abdomen (bei unklarem sonographischem Befund, Verdacht auf Metastasen in der Leber, den Ovarien u.a., Beurteilung des lokoregionären Tumorwachstums vor Chemotherapie) • Laparoskopie, bei Verdacht auf Peritonealkarzinose, zur Beurteilung der Resektabilität vor geplanter neoadjuvanter Therapie. Letztere Untersuchung gewinnt zunehmend an Bedeutung. Siehe Flussdiagramm Therapiestrategie • Tumormarker (CA 72-4, CA 19-9, CEA, Bestimmung mindestens eines Markers) Im Einzelfall nützliche Untersuchungen • Doppelkontrastuntersuchung bei unklarem endoskopischem Befund, wachsendem Karzinom (Linitis plastica) • Computertomographie Thorax (bei Verdacht auf Lungenmetastasen) z.B. bei submukös Patho-histologische Diagnostik Die präoperative Biopsiediagnostik erfordert eine Differenzierung zwischen Karzinom und Lymphom. Für die Abgrenzung undifferenzierter und kleinzelliger Karzinome von malignen Lymphomen sind immunhistologische Untersuchungen von Bedeutung. Bei Karzinomen ist an der präoperativen Biopsie eine Differenzierung bezüglich des intestinalen oder diffusen Typs vorzunehmen. Entsprechend der WHO-Klassifikation sind Karzinome, die sowohl Strukturen eines intestinalen als auch eines diffusen Typs aufweisen, für die therapeutische Entscheidung als Tumoren vom diffusen Typ zu klassifizieren. Schnellschnitt Eine intraoperative Schnellschnittuntersuchung ist dann indiziert, wenn davon die weitere operative Vorgangsweise abhängt (z.B. die Untersuchung chirurgischer Resektionsränder und Lymphknoten auf Tumorfreiheit oder eine fragliche Infiltration eines Nachbarorganes mit eventuell notwendiger Erweiterung des Eingriffs). Die histologische Verifikation einer diffusen Peritonealkarzinose im intraoperativen Schnellschnitt ermöglicht die Einschränkung des operativen Vorgehens auf einen Palliativeingriff. Histologische Untersuchung des Resektates Forderungen der Klinik an den histo-morphologischen Bericht: Der Bericht muss eindeutige Angaben zu folgenden Kriterien enthalten: - Tumorgröße - Lymphknotenstatus - Histologische Wuchsform nach Laurén - Histologischer Malignitätsgrad - Daten zur R-Klassifikation an den Resektionslinien • oral 1) • aboral • Halteapparat • Nachbarorgan Kurzgefasste interdisziplinäre Leitlinien 2006, W. Zuckschwerdt Verlag, München, 2006 41 Magenkarzinom, Diagnostik Endosonographie Die Indikation zur endoskopischen Ultraschalldiagnostik (EUS) bei der Diagnostik maligner Erkrankungen liegt vorzugsweise im lokoregionären Tumorstaging (T- und N- Kategorie) gastrointestinaler Tumore des Ösophagus, des Magens und des Dickdarms, insbesondere des Rektums, sowie auch pankreatobiliärer Tumoren. Darüber hinaus bestehen Indikationen in der Primärdiagnostik submuköser Neoplasien. Benutzt werden neben Radial- und Linearscannern mit Ultraschallfrequenzen von 5 bis 12 MHz MiniSonden, die sich über den Arbeitskanal konventioneller Endoskope einführen lassen und bei Frequenzen von 12 bis 30 MHz insbesondere zur Differenzierung mukosaler Prozesse geeignet sind. Durch Kombination mit einer gezielten Feinnadelpunktion lässt sich im Einzelfall eine weitere Steigerung der diagnostischen Aussagekraft erzielen. Endosonographie des Magens. Normalbild. Magen mit Die Möglichkeit durch EUS die verschiedenen Flüssigkeit gefüllt. In der Bildmitte das Endoskop mit einem Ballon über der Gerätespitze. Normale Schichten der Schichten der Wand des Gastrointestinaltraktes Magenwand. Aufnahme: Prof. E. Roeb, RWTH Aachen. sichtbar zu machen, hat sich vor allem auch für das präoperative lokoregionäre Staging intestinaler Karzinome als sinnvoll und auch notwendig erwiesen. Bedingt durch die geringe Eindringtiefe des hochfrequenten Ultraschalls lassen sich T- und N- Stadium meist gut, das Ausmaß einer eventuellen Fernmetastasierung (z. B. in die Leber) jedoch kaum beurteilen. Treffsicherheit des lokoregionären Staging Entscheidend für die richtige Behandlungsstrategie ist eine korrekte T- und N- Klassifikation der malignen gastrointestinalen Tumore. Dies gelingt in der Regel durch EUS zuverlässiger und auch meist kostengünstiger als durch andere bildgebende Verfahren, insbesondere das CT oder die MRT. Ösophagus CA Magen CA Rektum CA Pankreas CA n T- Stad. EUS T- Stad. CT N- Stad. EUS N- Stad. CT 339 325 419 235 85% 87% 84% 85% 58% 39% 68% 49% 75% 78% 94% 74% 54% 56% 60% 47% (Nach Rösch und Classen, in: Hahn, Riemann: Klinische Gastroenterologie, 3. Aufl.) Bei der Festlegung der Tumorinfiltrationstiefe und des Lymphknotenstatus werden von geübten Untersuchern Genauigkeiten von 80–90% bzw. 70–80% erzielt. Von besonderer Bedeutung für das chirurgische Vorgehen ist der Nachweis einer Infiltration anderer Organe wie z. B. des Pankreas oder der Leber. Anhaltspunkte für eine Peritonealkarzinose können indirekt über den Nachweis auch kleinster Aszitesmengen diagnostiziert werden. Zu bedenken ist die Möglichkeit eines „Overstagings“, das durch peritumoröse entzündliche oder fibrosierende Veränderungen bei etwa 15% der Fälle, insbesondere bei T2-Karzinomen und ulcerierenden Magenfrühkarzinomen, beobachtet wird. Ein Overstaging wurde bei bis zu 70% der neoadjuvant chemotherapierten Ösophaguskarzinome (92% Adeno-Ca, 8% Plattenepithel-Ca) beschrieben. Ein Understaging in dieser Situation fand sich bei nur 4%, so dass die Genauigkeit des T-Stagings lediglich noch 29%, die des NStagings 58% betrug. Klinische Anwendung des EUS im Rahmen des Tumorstagings Der EUS stellt inzwischen im Rahmen differenzierter Therapiekonzepte eine unverzichtbare Methode der prätherapeutischen Diagnostik der malignen Tumore des Ösophagus, des Magens und des Rektums dar. Dies betrifft zum einen verschiedene Resektionsverfahren (endoskopische oder minimal invasive Resektion von Frühkarzinomen versus konventionelle Chirurgie bei T2 – T4-Tumoren) und zum anderen multimodale Therapiekonzepte, die bei lokal fortgeschrittenen, aber nicht fernmetastasierten Stadien, eine präoperative Radio- und/oder Chemotherapie mit dem Ziel eines „Down-Staging“ vorsehen. Ob dies letztlich zu einem verbesserten Behandlungserfolg führen wird, bleibt abzuwarten und ist Gegenstand aktueller Studien. 42 Magenkarzinom TNM–Klassifikation (UICC/AJCC 2002) T - Primärtumor TX - Primärtumor nicht beurteilbar TO - Kein Anhalt für Primärtumor Tis - Carcinoma in situ: intraepithelialer Tumor ohne Infiltration der Lamina propria T1a - Invasion der Lamina propria 1b - Invasion der Submukosa T2a - Invasion der Muscularis propria 2b - Invasion der Subserosa T3 - Tumor penetriert Serosa (viszerales Peritoneum), aber nicht benachbarte Strukturen. T4 - Tumor infiltriert benachbarte Strukturen Magenkarzinom. T-Kriterien nach UICC. N - Regionäre Lymphknoten Die Überarbeitung der TNM-Klassifikation 1997 hat gegenüber der Version von 1992 eine Änderung in der Klassifikation der regionären Lymphknotenmetastasen ergeben. Ausschlaggebend ist in der aktuellen Einteilung nicht mehr die Distanz zum Primärtumor (N1: <3cm, N2: >3cm), sondern die Zahl der befallenen Lymphknoten: NX NO N1 N2 N3 - Regionäre Lymphknoten nicht beurteilbar Keine regionären Lymphknotenmetastasen Metastasen in 1–6 regionären Lymphknoten Metastasen in 7– 5 regionären Lnn. Metastasen in mehr als 15 regionären Lnn Epithel Lamina propria mucosae Muscularis mucosae Submucosa Muscularis propria m1 Keine Infiltration der Basalmembran m2 Infiltration der Mukosa m3 Infiltration der Muscularis mucosae sm1 Infiltration der Submukosa oberes Drittel sm2 Infiltration der Submukosa mittleres Drittel sm3 Infiltration der Submukosa unteres Drittel Murata et al. Endoscopy 2003;35:429-36 Magenfrühkarzinom T1, Tis. Mucosa (m), Submucosa (sm)-Klass. Definition der Lymphknotenkompartimente des Magens Kompartiment I : Lnn-Gruppen 1-6 der japanischen Nomenklatur. Perigastrische Lnn entlang der kleinen Kurvatur, einschließlich rechtsseitiger kardialer und suprapylorischer Lnn, sowie der perigastrischen Lnn an der großen Kurvatur, eingeschlossen die linksseitigen kardialen und infrapylorischen Lnn. Kompartiment II : Gruppen 7-11 der japanischen Nomenklatur. Lnn entlang der Aa. gastrica sinistra, Tr. coeliacus und im Lig. hepatoduodenale. Kompartiment III: hepatica communis, lienalis, des Gruppen 12 ++ der japanischen Nomenklatur. Lnn retropankreatisch, mesenterial und paraaortal. Für eine suffiziente Bewertung des perigastralen Nodalstatus wird von onkologischer Seite die histologische Untersuchung von mindestens 25 der en bloc entnommenen Lymphknoten nach einer D2-Dissektion gefordert. Lymphknoten der Kompartimente I und II werden als regionäre Lymphknotenmetastasen gewertet, diejenigen des Kompartimentes III als Fernmetastasen. M-Fernmetastasen MO M1a 1b 1c - Keine Metastasen Metastasen nur in nicht-regionären Lnn Metastasen an anderen Lokalisationen außer Peritoneum und Pleura Metastasen an Peritoneum und Pleura 43 Magenkarzinom Stadieneinteilung (UICC/AJCC 2002) 5-Jahres-ÜL-Raten % 1) 1) Stad. IA T1 N0 M0 85,2 Stad. IB T1 T2 N1 N0 M0 M0 69,2 Stad. II T1 T2 T3 N2 N1 N0 M0 M0 M0 43,7 Stad. IIIA T2 T3 T4 N2 N1 N0 M0 M0 M0 28,6 Stad. IIIB T3 N2 M0 17,7 Stad. IV T4 jedes T jedes T N 1, 2 N3 jedes N M0 M0 M1 8,7 Österreichische Gesellschaft für Chirurgie Anmerkungen Ein Tumor kann sich über die Muscularis propria in das Ligamentum gastrocolicum oder hepatogastricum oder in das große oder kleine Netz ausbreiten, ohne das viszerale Peritoneum zu penetrieren. In diesem Falle wird der Tumor als T2b klassifiziert. Findet sich eine Perforation des viszeralen Peritoneums über den gastrischen Ligamenten oder dem großen oder kleinen Netz, ist der Tumor als T3 einzustufen. Benachbarte Strukturen des Magens sind: Milz, Kolon transversum, Leber, Zwerchfell, Pankreas, Bauchwand, Nebennieren, Niere, Dünndarm und Retroperitoneum. Die intramurale Ausbreitung im Duodenum oder Ösophagus wird nach der tiefsten Infiltration in diesen Organen beurteilt. R - Klassifikation - (postoperatives Ergebnis. R steht für Residualtumor) R0 R1 R2 Kein residueller Tumor Mikroskopisch residueller Tumor Makroskopisch residueller Tumor Beachte: R steht für Residualtumor, nicht für Resektionsrand, siehe die D – Klassifikation (D steht für Dissektion) D1-Resektion: D2-Resektion: D3-Resektion: Lymphadenektomie des Lymphknotenkompartiments I Lymphadenektomie des Lymphknotenkompartiments II Lymphadenektomie des Lymphknotenkompartiments III Histologisches Grading nach BRODER (AJC) Die WHO unterscheidet bei den Adenokarzinomen hoch-, mittel- und niedrigdifferenzierte Tumore, wobei hoch- und mitteldifferenzierte als niedriger Malignitätsgrad und niedrig differenzierte als hoher Malignitätsgrad aufgefasst werden. Diese Gradingstufen der WHO entsprechen prinzipiell den Gradingstufen der UICC und werden mit G1 bis G3 bezeichnet. Die UICC gibt zusätzlich noch einen Grad 4 an, der dem undifferenzierten Karzinom nach WHO entspricht. G1: gut differenziertes Karzinom G2: mäßig gut differenziertes Karzinom G3: G4: schlecht differenziertes Karzinom undifferenziertes (anaplastisches) Karzinom 44 Magenkarzinom PHNS-Klassifikation (Japan) Die Japanese Research Society for Gastric Cancer hat ein eigenes Klassifikationssystem für Magenkarzinome entwickelt. Die T-Kriterien sind mit denen der UICC identisch. Daneben wird jedoch die Beziehung zu prognosebestimmenden Strukturen genau definiert. P - Peritoneum P0 P1P2 P3 - Kein Hinweis für peritoneale Aussaat Peritonealer Befall, limitiert auf die suprakolische Region einschließlich des großen Netzes, nicht des Diaphragmas Kleine Zahl von Knötchen unterhalb des Mesokolons mit oder ohne Diaphragmabeteiligung Zahlreiche Knötchen unterhalb des Mesokolons oder auf dem Diaphragma H - Leber H0 H1 H2 H3 - Keine Lebermetastasen Metastasen begrenzt auf einen Leberlappen Kleine Zahl von Metastasen in beiden Leberlappen Viele Metastasen in beiden Leberlappen N - Lymphknoten N0 N1 N2 N3 N4 - (siehe Blatt, Klassifikation der loko-regionalen Lnn.) 5-Jahres-ÜL-Rate 1) 84 % 47 % 25 % 11 % 7% Kein Lnn-Befall Lnn-Befall Gruppe 1 : Lnn-Nr. 1 - 6 Lnn-Befall Gruppe 2 : Lnn-Nr. 7 – 11 Lnn-Befall Gruppe 3 : Lnn-Nr. 12 - 14, 110, 111 Lnn-Befall jenseits Gruppe 3 S – Serosa S0 S1 S2 S3 - Keine Serosainvasion Verdacht auf Invasion Sichere Serosainvasion Invasion benachbarter Organe und Strukturen 82 % 48 % 26 % 9% Seitens des Pathologen ist bei der histologischen Präparataufarbeitung vor allem auch auf den Serosadurchbruch sowie auf eine repräsentative Anzahl histologisch untersuchter Lymphknoten zu achten. Eine definitiv festgelegte Mindestanzahl von histologisch verifizierten Lymphknoten liegt noch nicht vor. 25-30 histologisch untersuchte Lymphknoten bei Gastrektomien und circa 15-20 bei subtotalen, distalen Resektionen können jedoch als Richtwerte im Sinne der Qualitätssicherung angesehen werden. Ergebnisse: Japanese Histological Staging of Gastric Cancer Stadium 2) 5-J.-Überlebensrate Stad. I PO HO NO SO 95 % Stad. II PO HO N1 S1 62 % Stad. III PO HO N2 S2 33 % Stad. IV P1, 2, 3 H1, 2, 3 N3, 4 S3 10 % 1) 2) GILES, G.R. in: Cancer of the stomach, Grune & Stratton, 1986, pg 89-105 CRAVEN, J.L. in: Cancer of the stomach, Grune &Stratton, 1986, pg 165 45 Magenkarzinom Klassifikation der lokoregionären Lymphknoten Schematische Darstellung der perigastralen Lymphknoten Aus: M. Nishi, Cancer of the stomach, Grune & Stratton, 1986 Nr. Lokalisation Nr. Lokalisation 1 Rechts der Kardia 8b Unterhalb der A. hepatica communis 2 Links der Kardia 9 Um die A. coeliaca 3 Entlang der kleinen Kurvatur 10 Im Milzhilus 4 Entlang der großen Kurvatur 11 Entlang der A. lienalis 4 sa Entlang der großen Magenarterien 12 Im Lig. hepaticoduodenale 4 sb Entlang der li. A. epiploica 13 Auf der ventralen Seite des Pankreas 4d Entlang der re. A. epiploica 14 Um die Mesenterialwurzel 5 Suprapylorisch 15 Entlang der A. colica medialis 6 Infrapylorisch 16 Paraaortal 7 Entlang der li. A. gastrica 110 Paraösophageal im unteren Thoraxbereich 8 Entlang der A. hepatica communis 111 Im Diaphragma 8a Oberhalb der A. hepatica communis 46 Magenkarzinom Therapiestrategie - Flussdiagramm Schematische Darstellung der Behandlung eines Magenkarzinoms unter kurativer oder palliativer Zielstellung. (Aus: Onkologe 2001; 7: 603) Magenkarzinom Gastroskopie & Biopsie: Magenkarzinom cT1 N0, cT1 N1, cT2 N0; M0 Staging Staging Staging Staging Laparoskopie Laparoskopie Laparoskopie Laparoskopie cT1 N0, cT1 cT1 N1,N0, cT2cT1 N0;N1, cT2M0 N0; M0 T1 N2, T2 N1, T3 N0, T2 N2, T3 N1, T4 N0, T3 N2, T4 N1-2; M0 3 x ECF Chemoth. präoperativ Gastrektomie 3 x ECF Chemoth. postoperativ Empfehlung 2007 Grundsätzlich ist der angegebene DiagnostikBeachte: und Therapieablauf noch gültig. Folgende 1. Jeder Patientwird mit einem histologisch gesicherten Modifikation empfohlen: Magen-CA sollte präoperativ in einem 1. multidisziplinären Jeder Patient mit einem histologisch geTumorboard vorgestellt sicherten sollte präoperativ in einem werden Magen-CA und einen multimodalen Behandlungsplan erhalten, wenn sinnvoll. multidisziplinären Tumorboard vorgestellt werden undder MAGIC-Studie einen multimodalen Behand2. Die Daten (siehe dort) sind so lungsplan erhalten, überzeugend, dass wenn jedem sinnvoll. Patienten mit einem Behandlungskonzept (Stad.II/III) 2. kurativen Die Daten der MAGIC-Studie (siehe eine dort) präund postoperative Chemotherapie mit demmit sind so überzeugend, dass jedem Patienten ECF-Schema angeboten werden soll. einem kurativen Behandlungskonzept, Stad.II/III, eine prä- und postoperative 3. Bezüglich der Chemotherapie gilt: Capecitabin ist Chemotherapie mit dem ECF-Schema wirkungsgleich mit infusionalem 5-FU angeboten werden sollte. 47 Frühkarzinom T1m, T1sm-Tumor. Therapiestrategie Diagnostik und Therapie der frühen Stadien Algorithmus aus: Der Onkologe 2008,330 Magenkarzinom Rationale Diagnostik und Therapie Frühe Tumorstadien Endoskopie + Biopsien Diagnosesicherung: Magenkarzinom Abdorninale Sonographie Kein Hinweis für Fernmetastasen Endosonographie (EUS) Verdacht auf Magenfrühkarzinom (uT1) uT1 m/sm1 EMR/ESD uT1>sm1 uT2 konventionelle Resektion R 1/2 R0 Nachsorge EMR: Endoskopische Mükosaresektion T1-Karzinome Für den Therapieentscheid in den frühen Stadien ist wesentlich, ob eine Infiltration der Submukosa vorliegt oder nicht. Die beste diagnostische Information gibt die Endosonographie mit einem Hochfrequenz Schallkopf über eine Minisonde (20 MHz). Grundsätzlich gilt: Bei einer Invasiontiefe, die auf die Mukosa beschränkt ist, stellt heute die endoskopischen Mukosaresektions die Behandlungsmethode dar. Ist bereits die Submukosa tumorinfiltriert, besteht mit einer Wahrscheinlichkeit von etwa 20 % eine Lymphknotenmetastasierung. Aus diesem Grunde ist in diesem Fall eine konventionelle operative Tumorentfernung erforderlich. 48 Magenkarzinom Stadienabhängige Therapiestrategie Stadienbezogene Therapiestrategie des Magenkarzinoms Stad. I Stad. II Stad. III; VI A* *(T1-3,N3,M0) Stad. IV B* *(Tx,Nx,M1) Lokale Tumorexzision, wenn möglich endoskopisch, keine Lnn-Dissektion. Präoperative Chemotherapie mit drei Zyklen ECF. Gastrektomie mit D2-Lnn-Dissektion, bei distalem Sitz evtl. 4/5-Resektion. Postoperative Chemotherapie mit 3x ECF. Down-Staging durch neoadjuvante Chemotherapie (3x ECF oder ähnliches Schema). Sekundäre Op. Postoperativ adjuvante Chemotherapie, 3x ECF. Im Falle einer R1-Resektion und Unmöglichkeit einer Nachoperation postoperative Radio-/ Chemotherapie entsprechend dem SWOG-Protokoll (siehe dort), aber mit einer zeitgemäßen Chemotherapie, z.B. Capecitabine/Cisplatin Palliative Behandlungsstrategie nach individuellen Erforderlichkeiten. Wenn keine Kontraindikationen vorliegen, Chemotherapie mit einem Schema der 3. Generation, z.B. ECF-, TCF- oder einem anderen Schema. Stad. I A (Early gastric cancer) Mukosatyp (T1m). Zum Verständnis, siehe Seite TNM-Klassifikation des Magenkarzinoms. Für das pT1m-Karzinom beträgt die Wahrscheinlichkeit einer Lnn-Metastasierung <5%. Operativ genügt eine lokale Exzision durch Resektion mit dem Laser, endoskopische Mukosaresektion oder als kombinierte endoskopisch-laparoskopische Magenwandresektion. Endoskopische Mukosaresektion Bei allen lokalisierbaren intraepithelialen Neoplasien oder Frühkarzinomen ist die endoskopische Abtragung mittels Mukosaresektion (EMR) als Verfahren der Wahl anzusehen. Aufgrund der Erfahrungen an großen Patientenzahlen wurden von japanischen Gastroenterologen sog. Low-risk-Kriterien für das Magenfrühkarzinom definiert, bei denen eine lokale endoskopische Therapie adäquat und ausreichend ist. Ggf. kann auch eine kombinierte endoskopischelaparoskopische Vollwandresektion erfolgen (Wedge-Resection). Low-risk-Kriterien für das Magenfrühkarzinom - Der Tumor hat maximal eine Größe von 20-30 mm Tumor ist auf die Mukosa (T1m) begrenzt Es handelt sich um einen intestinalen Zelltyp Histologisch liegt eine gute bis mäßiggradige Differenzierung (G1-G2) vor Die makroskopische Klassifizierung zeigt einen polypoiden oder flachen Tumor Ist eines dieser Kriterien nicht erfüllt, so muss von einem höheren Lnn-Metastasierungsrisiko ausgegangen werden, das in Relation zum Operationsrisiko gesetzt werden muss. Eine endoskopische Lokaltherapie sollte dann nur bei inoperablen Patienten oder solchen mit deutlich erhöhtem Operationsrisiko aufgrund von Alter und/oder anderen Begleiterkrankungen erfolgen (Werk D. et al. in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, SpringerVerlag, 2004). Die Diagnose des Mukosakarzinoms muss durch den Pathologen bestätigt werden. Falls eine Infiltration in die Submukosa T1sm (Submukosa-Karzinom) vorliegt, ist eine standardmäßige Resektion mit Lymphadenektomie unverzichtbar. Stad. I B Eine Lymphknotenmetastasierung wird in diesen Stadien bereits in einem hohen Prozentsatz erwartet, beim Submukosa-Ca. schon in 22%. Bei dieser Pat.-Gruppe ist es möglich, eine R0-Resektion sowohl des Primärtumors als auch des Lnn-Abflussgebietes mit ausreichenden Sicherheitsabständen zu erreichen. Diese Gruppe wird primär operiert mit Tumorresektion und D2-Lymphadenektomie. Das Submukosakarzinom wird nach den Prinzipien dieser Gruppe chirurgisch behandelt. Stad. II, III, IVA* In den Stadien dieser Gruppe ist eine perioperative, prä- und postoperative Chemotherapie indiziert und sinnvoll (siehe MAGIC-Studie). Die Operation erfolgt bei diesem Konzept sekundär. Stad. IVB* In diesem Stadium ist eine Operation in der Regel nicht indiziert. Ein Teil der Pat. profitiert jedoch von der palliativen Tumorresektion (Lee J. et al. Ann Oncol 2007;18:886-91). In Betracht kommt eine systemische Chemotherapie. Eine operative Tumormassenresektion bewirkt keine Prognoseverbesserung und soll deshalb unterbleiben. Die Unterscheidung in die Kategorien A und B entspricht nicht dem Text der UICC-Klassifikation. Die Subtypisierung wird hier analog der Einteilung der Ösophaguskarzinome vorgenommen, da hier wie da ein biologischer Unterschied zwischen einem lokal fortgeschrittenen Karzinom und einer Fernmetastasierung besteht. 49 Magenkarzinom, Therapiestrategie Nationales Centrum für Tumorerkrankungen Heidelberg Empfehlung zur Diagnostik und Therapie des Nationalen Centrums für Tumorerkrankungen (NCT) Heidelberg, Lordick, F et al. Klinikarzt 2008;37:359-64 Statements des NCT-Heidelberg zur Diagnostik und Therapie des Magen-Ca. Welches Staging sollte ein Patient mit Magenkarzinom erhalten? Endoskopie (videodokumentiert) Endoskopischer Ultraschall zur Definition der T-Kategorie Hochauflösende CT (außer Frühkarzinome) von Hals, Thorax, Abdomen und Becken Laparoskopie (außer Frühkarzinome) zum Ausschluss einer Peritonealkarzinose Wo sollte ein Patient mit Magenkarzinom vorgestellt werden? In einem ausgewiesenen onkologischen Zentrum mit prätherapeutischer Festlegung des Therapieplans im multidisziplinären Tumorboard ausgewiesener onkologischer Chirurgie (routinemäßige D2-Lymphadenektomie) Verfügbarkeit aller weiteren Therapiedisziplinen (medizinische und radiologische Onkologie) Wann ist eine adjuvante Therapie indiziert? Im Rahmen des perioperativen Therapiekonzeptes ist eine adjuvante Therapie dann indiziert, wenn der Patient die postoperative Weiterführung der Therapie hinsichtlich seines Allgemeinzustandes toleriert und in die möglichen Nebenwirkungen einwilligt. Eine adjuvante Chemotherapie ohne vorausgegangene neoadjuvante Chemotherapie ist kein Ersatz für eine neoadjuvante Chemotherapie. Individualempfehlungen zur alleinigen adjuvanten Chemotherapie lassen sich bei nodal-positiven Magenkarzinomen begründen. Eine adjuvante Radio-/Chemotherapie ist nach unzureichender Lymphadenektomie (<25 entfernte Lymphknoten) indiziert. Wird bei R1-Resektion nachbehandelt? R1 am oralen oder aboralen Absetzungsrand: Möglichkeit der Nachresektion prüfen. R1 am Absetzungsrand in der Tiefe: Nachresektion in der Regel nicht möglich. Eine additive Radio-/Chemotherapie ist bei anatomisch eng umschriebenen Befunden als Individualempfehlung begründbar. Resektion des Primärtumors bei Fernmetastasierung? Palliative Resektionen sind nur bei anderweitig nicht beherrschbaren Problemen indiziert (z. B. konservativ nicht beherrschbare Tumorblutung, symptomatische Magenausgangs- stenose mit rezidivierendem Erbrechen. Nach Ansprechen auf eine primäre Chemotherapie ist in Einzelfällen bei begrenzter systemischer Tumorlast und kompletter Resektabilität von Metastasen die chirurgische Therapie zu erwägen. 50 Magenkarzinom Operatives Vorgehen Zielstellung Das Ziel der chirurgischen Therapie des Magenkarzinoms ist das Erreichen einer R0-Resektion des tumortragenden luminalen Anteils, einschließlich des extragastralen Lymphabflussgebietes. Das Resektionsausmaß am Magen ist weitgehend standardisiert und orientiert sich an der Lokalisation, der Infiltrationstiefe und dem Wachstumstyp nach Laurén1). Als onkologisch radikale Verfahren mit kurativer Zielstellung stehen drei Operationsmethoden zur Verfügung. o Subtotale Magenresektion (4/5-Resektion) o Gastrektomie o Erweiterte Gastrektomie Resektionsausmaß am Magen Die am häufigsten durchgeführte Operation ist die Gastrektomie mit erweiterter Lymphadenektomie entsprechend dem Ausbreitungsstadium des Tumors. Indikation für die subtotale Magenresektion Magenkarzinom mit Lokalisation im unteren Magendrittel (bei Einhaltung des oralen Sicherheitsabstandes von 6 cm in situ) und histologisch intestinalem Typ. Multiviszerale Resektion Eine transhiatale Erweiterung der Resektion auf den distalen Ösophagus ist insbesondere beim proximalen Magen-Ca mit Infiltration der Kardia erforderlich, um einen genügenden Sicherheitsabstand zu erreichen. Bei T4-Tumoren mit Infiltration von Nachbarorganen wie linkem Leberlappen, Milz, Pankreas oder Kolon hat die multiviszerale en-blocResektion dann einen Sinn, wenn damit eine R0-Situation erreicht werden kann. Allerdings Magenkarzinom. Überleben in Abhängigkeit von ist mit einer zusätzlichen Splenektomie oder einer gleichzeitigen Milz- sowie Milz+PankreasPankreasresektion eine erhöhte Morbidität und Resektion.(Schieri et al. Br J Cancer, 1999) Mortalität verbunden. In diesen Fällen ist es in besonderem Maße sinnvoll, eine präoperative Chemotherapie voranzustellen, siehe MAGICStudie. Eine standardmäßige Milz- oder Pankreas-entfernung hat eher nachteilige Folgen, wie aus der nebenstehenden Tabelle hervorgeht. Lymphadenektomie Zur Frage der Ausdehnung der Lymphadenektomie beim Magenkarzinom besteht eine anhaltende Kontroverse aufgrund der diskrepanten Ergebnisse der randomisierten und der nicht-randomisierten Studien. Während die holländische und britische randomisierte Multicenter-Studien, wahrscheinlich methodisch bedingt, eine signifikante Erhöhung der Morbidität und Mortalität bei der radikalen Lymphadenektomie aufwiesen, ist das negative Ergebnis in der Metaanalyse der nicht-randomisierten Studien nicht nachweisbar. Diese Analyse ergibt einen signifikanten Pro-gnosevorteil für die Patienten mit D2-Lymphadenektomie. Der Benefit zeichnete sich in den ersten Ergebnissen der randomisierten Studien nicht ab, wahrscheinlich aufgrund der erhöhten postoperativen Mortalität. Die genannte Prognoseverbesserung bezieht sich besonders auf die Stadien II und IIIA. Siehe Blatt: Stellenwert der Lymphadenektomie. In den meisten europäischen Zentren wird heute die D2-Lymphadenektomie favorisiert, um neben einem besseren Staging, zumindest für bestimmte Untergruppen von Patienten mit einer Lymphknotenmetastasierung, den möglichen Überlebensvorteil zu nutzen. Entfernung von mehr als 15 Lymphknoten in den Stadien II, IIIA ist heute operativer Standard in Europa. Mortalität Eine erhöhte operative Mortalität ist assoziiert mit: (McCulloch P, Br J Surg 2005) 1) 2) - Pankreatiko-Splenektomie - Geringe Fallzahl in einer Institution - Mangel an speziellem Training der operierenden Ärzte Hölscher, A. H., E. Bollschweiler, Onkologe, 1998; 4:301–09 Sendler A et al. Internist 2000; 41:817-30 51 Magenkarzinom Operationsverfahren Beim Magenkarzinom ist das Operationsverfahren der Wahl für distale Karzinome die subtotale Gastrektomie mit Lymphknotendissektion der Gruppen N1 und N2 und der Resektion des Omentum en bloc. Für alle übrigen Magenkarzinome erfolgt die totale Gastrektomie mit D2-Lymphadenektomie. Rekonstruktionsverfahren nach Gastrektomie Links: Resektionstypen bei Magenkarzinom. Rechts: Rekonstruktionsverfahren bei totaler Magenexstirpation 1: Jejunumhochzug mit breiter Braun-Anastomose nach Hoffmann; 2: Jejunuminterposition nach Longmire-Gütgemann; 3: Rekonstruktion des Digestionsweges mit ausgeschalteter Roux-Schlinge, termino-laterale Ösophago-Jejunostomie; 4: Rekonstruktion mit Roux-Schlinge und Jejunoplikatio; 5: Ersatzmagen und Jejunoplikatio nach Siewert und Peiper; Jejunum-Ersatzmagen mit YRoux-Schlinge und Jejunoplikatio nach Rodino. Definition einer kurativen Resektion 1) 1. Keine Fernmetastasen (Japanische Nomenklatur: PO, HO) 2. Freie Resektionsränder 3. Kein Einwachsen in umgebende Strukturen, wenn T4, dann muss eine adäquate kombinierte Resektion erfolgt sein Die Qualität der Resektion, einschließlich des Lnn-Sampling, ist ein besonders wichtiger Prognosefaktor. Nichtkurative Operation R1-Resektion, keine Fernmetastasen Ergibt sich postoperativ nach vermeintlicher R0-Resektion ein mikroskopischer Tumorrest (R1Resektion), ist eine Nachoperation mit dem Ziel einer R0-Resektion anzustreben. Ist diese nicht möglich, kommt eine postoperative kombinierte Radio-/Chemotherapie in Betracht. Der Verzicht auf diese additive Behandlung verlangt eine besondere Begründung. R2-Resektion mit Fernmetastasen Zur Behandlung dieser Patienten stehen operative Maßnahmen, strahlen- und chemotherapeutische Behandlungen zur Verfügung, wobei die Wahl abhängig von der bestehenden Symptomatik individuell erfolgt. Grundsätzlich ist die Indikation zur Chemotherapie gegeben, wobei deren Einsatz maßgeblich durch den Allgemein- und Ernährungszustand bestimmt wird. Wegen des raschen Krankheitsverlaufes ist die Chemotherapie frühzeitig einzuleiten. Für Patienten mit hochgradig eingeschränktem Allgemeinzustand (Karnofsky <60%) kommt eine zytostatische Therapie nicht in Frage. Eine Strahlentherapie kann auch als lokal umschriebene Maßnahme zur Schmerzbehandlung indiziert sein. Auf jeden Fall ist für eine adäquate Schmerztherapie Sorge zu tragen. 1) Nishi, M et al. in: Cancer of the stomach, Preece PE et al. (ed) Grune & Stratton, 1986, pg 107-21 52 Magenkarzinom Lymphknotendissektion Ausmaß der Lymphadenektomie Definition D1-Resektion Einfache oder Standardlymphadenektomie, entsprechend der Entfernung der Lymphknoten (LK) an der kleinen und großen Kurvatur (LK 1-6) (Kompartiment I). D3-Resektion Ausweitung der LK-Dissektion auf nicht regionale LK am Lig. hepatoduodenale (LK 12), retroduodenal (LK13) und para-aortal (LK 14-16) (Kompartiment I, II, III). Abb. D1-3 aus: Onkologe 1998; 4:301-09 D2-Resektion Systematische oder radikale Lymphadenektomie mit zusätzlicher Entfernung definierter, weiter vom Tumor entfernter regionaler LK (LK 7-11) (Kompartiment I und II). Mit Hilfe eines in Japan entwickelten Computerprogramms ist es möglich, den wahrscheinlichen Befall und die Lokalisation der metastatisch infiltrierten Lnn präoperativ vorherzusagen (Maruyama-Schema). Die Graphik zeigt den errechneten LnnBefall bei einem T3-Tumor, nach Sendler A et al. Internist 2000; 41:817-30. Eine exakte und systematische Lymphknotendissektion gehört nicht nur aufgrund theoretischer Überlegungen, sondern vor allem wegen der klinischen Relevanz zum entscheidenden Konzept der Chirurgie mit kompletter Resektion aller Ebenen der Tumorausbreitung. (Meyer HJ, in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, Springer-Verlag, 2004) 53 Magenkarzinom Lymphadenektomie Wertigkeit der Lymphadenektomie Nach den Daten der neueren Literatur profitieren die Patienten von der ausgedehnten D2-Resektion gegenüber der eingeschränkten D1-LAD, mit einer z.T. signifikant höheren Überlebenswahrscheinlichkeit. Bei ausgedehnter lymphogener Metastasierung kann durch eine systematische Lymphadenektomie die lokoregionäre Rezidivrate gesenkt werden. (Meyer HJ, in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, Springer-Verlag, 2004). Die Tab. zeigt den Vergleich der 5-Jahres-Überlebenswahrscheinlichkeiten (5-JÜL) nicht-randomisierter Studien nach D1- D2-Lymphadenektomie (LAD) beim pT1-Magenkarzinom (Hölscher, AH, E. Bollschweiler, Onkologe1998; 4:301-09) Ein anderer wesentlicher Aspekt sind die Zahl der exstirpierten (n) Lymphknoten sowie das Ausmaß Miwa 295 p<0.01 von deren Befall. Für eine Baba 321 p<0.05 adäquate Beurteilung des Nodalstatus werden mindestens Σ 1064 p<0,05 15 Lymphknoten im Resektionspräparat verlangt. Für eine standardmäßige D2-Lymphadenektomie ist diese Zahl nicht ausreichend. Nach der Analyse der Daten der deutschen Magenkarzinomstudie sind hier mindestens 25 dissezierte Lymphknoten erforderlich. (Schuhmacher, C et al. Onkologe 2008,14:339Studie UICC Stad. Pat. (n) 392 473 1494 D1-LAD (n) 5-J-ÜL(% 97 88 52 90 385 86 Ausmaß Lnn Dissektion D2-LAD 5J-ÜL(%) 98 97 93 5-J.-ÜL-Rate % + SEM P= p 10-J. ÜL-R % + SEM 49). Wie die nebenstehende Tabelle zeigt, haben Pat., bei denen mehr als 25 Lnn entfernt > 25 Lnn (n=130) 84,3 + 3,2 73,7 + 4,9 IA = 0,42 wurden, eine signifikant bessere < 25 Lnn 80,9 + 3,7 70,1 + 5,4 (n=99) Prognose als solche mit einer 53,5 + 5,8 > 25 Lnn (n=137) 68,9 + 4,0 = 0,13 IB geringeren Zahl exstirpierter < 25 Lnn 64,7 + 5,5 47,6 + 6,4 (n=84) Lnn. > 25 Lnn (n=141) 56,2 + 4,3 49,5 + 4,6 II < 0,001 Das TNM-System des Lymph< 25 Lnn 27,2 + 4,8 16,0 + 4,8 (n=89) knotenstatus bezeichnet einen (n=177) 28,0 + 3,5 19,0 + 3,3 > 25 Lnn = 0,02 III A fehlenden Lymphknotenbefall 18,9 + 4,4 13,2 + 4,1 (n=85) < 25 Lnn als pN0, 1-6 befallene 15,1 + 5,8 > 25 Lnn (n=160) 24,2 + 6,5 Lymphknoten als pN1, 7-15 als = 0,3 III B < 25 Lnn 12,1 + 2,7 9,0 + 2,5 (n=44) pN2 und mehr als 15 befallene Lnn als pN3. Der > 25 Lnn (n=351) 6,9 + 1,4 5,3 + 1,3 IV = 0,32 < 25 Lnn 8,1 + 2,3 0 (n=157) Lymphknotenstatus korreliert direkt mit der Überlebensrate der entsprechenden Patienten. (Siehe untenstehende Graphik). Offenbar ist bei genauerer Untersuchung der entnommenen Lymphknoten von Bedeutung, ob diese bereits Tumorzellen enthalten, auch dann, wenn diese lediglich in immunhistochemischen Färbungen zu sehen sind. Das Verhältnis von befallenen zu entfernten Lymphknoten erwies sich als ein brauchbarer Prognoseparameter. Sind weniger als 20% der entfernten Lymphknoten befallen, ist die Lebenserwartung deutlich besser als bei einem ungünstigeren Lymphknotenbefall. Demnach gibt es Bedeutung des Lnn-Status (links) und der Ratio befallene zu exstirpierten Lnn (rechts). Aus Schumacher et al. Onkologe 2008;14:339-49) eine radikale Operation nicht nur für den Primärtumor sonder auch für das Lymphabflussgebiet. Die in älteren Studien berichtete höhere Letalität der D2-LAD, z.B. in dem niederländischen und britischen Trial, war mindestens als Teilkomponente durch die zu dieser Zeit häufiger durchgeführte Splenketomie und Pankreasresektion bedingt. 54 Magenkarzinom Chemotherapie, Ansprechraten Monotherapie Das Magenkarzinom ist ein chemosensibler Tumor. In der Monotherapie finden sich für die wirksamen Substanzen folgende Ansprechraten, siehe den Kasten links. Mitomycin 5-FU Adriamycin Epirubicin Cisplatin Oxaliplatin Etoposid BCNU Docetaxel Irinotecan Capecitabin 31% 23% 23% 22% 17% 20% 6-21% 18% 20–24% 23% 34% Entwicklung der Chemotherapie (ChT) beim fortgeschrittenen Magenkarzinom 1990 FAMTX ELF FUP 2000 ECF PLF 2005 2007 Docetaxel Capecitabin* (DCF) Irinotecan* Oxaliplatin (IF) In Deutschland zur ChT des Magen-Ca nicht zugelassen, Stand 10/2008 Nach M. Möhler, GI-Oncology, Wiesbaden, 2008 * Die Substanzen sind zur Behandlung des Magenkarzinoms in Deutschland nicht zugelassen. Neuere Substanzen Docetaxel (Ansprechrate 20 – 24 %) (Eur J Cancer 1995; 31A Suppl 4:21-24; Gan To Kagaku Ryoho 1994; 21:243137 und 1998; 25:1915-24) und Irinotecan (Ansprechrate 23%) (Gan To Kagaku Ryoho 1994; 21:1033-38) eine Aktivität. Oxaliplatin (Ansprechraten in der Kombination mit 5-FU/Folinsäure von 43% (Al-Batran et al. JCO, 2004) und 44,9% (Louvet C. et al. JCO, 2002) Gemcitabin hat sich beim Magenkarzinom als nicht wirksam erwiesen (Ann Oncol 1994;5:471-72). Kombinationstherapie Mit einer Kombinationstherapie wird ein Ansprechen von 29-71% erreicht. Die bekanntesten, jedoch zum Teil historischen Schemata sind: FAM, FAMTX, ELF, EAP, sowie moderne Regime wie ECF, DCF, TCF und PLF. Die letzten 4 Regime sind aktuelle, derzeit häufig verwandte Therapieschemata. In Deutschland am gebräuchlichsten sind PLF (HD-5-FU+Leucovorin+Cisplatin) und ECF (Epirubicin+Cisplatin+5-FU). Trotz der Wirksamkeit einer zytostatischen Behandlung ist eine Heilung durch eine Chemotherapie nicht möglich. Dennoch ist eine medikamentöse Therapie unter verschiedenen Zielstellungen sinnvoll: - präoperativ im Sinne eines Down-Staging - postoperativ als adjuvante Therapie - palliativ bei vorhandener Metastasierung Präoperative Chemotherapie Indikation Diese Therapieform kommt zum Einsatz, wenn bei einem primär onkologisch nicht sicher radikal resezierbaren Magenkarzinom durch ein Down-Staging sekundär eine kurative Operation möglich erscheint. Nach Daten einer deutschen multizentrischen Studie wurden bei 35 Patienten mit primär irresektablem Karzinom nach einer Chemotherapie mit 3-4 Zyklen des EAP-Schemas eine sekundäre Resektabilität von 60% und ein Langzeitüberleben von 20% erreicht. (Wilke, H., et al., J Clin Oncol 1989; 7; 1318-26). PLF-Schema In der neoadjuvanten Situation wurde das PLF-Schema (Cisplatin, HD-5-FU, Folinsäure) untersucht. In einer PhaseII-Studie (Siewert JR et al. Langenbecks Arch Chir Suppl Kongressbd 1998; 115:717-9) bei 41 Patienten wurde es mit EAP verglichen und zeigte identische Ergebnisse bei deutlich geringerer Toxizität. ECF-Schema In einer Phase-III-Studie wurden 503 Patienten prospektiv randomisiert auf einen alleinigen Chirurgie-Arm und einen Arm mit neoadjuvanter (präoperativer) und zusätzlich adjuvanter (postoperativer) Chemotherapie mit ECF. Durch die Chemotherapie konnten ein signifikantes Down-Staging, eine höhere Resektionsrate sowie ein verbessertes progressionsfreies und Gesamt-Überleben erreicht werden, (siehe Blatt MAGIC-Trial). 55 Magenkarzinom Adjuvante Chemotherapie, Metaanalysen In vielen bisher durchgeführten kontrollierten klinischen Studien konnte kein eindeutiger Überlebensvorteil gegenüber den nicht behandelten Kontrollgruppen gezeigt werden. Daher galt eine adjuvante Chemotherapie beim Magen-Ca in Deutschland allgemein als nicht indiziert. Durch Metaanalysen und Ergebnisse des Intergroup-Trials (s. SWOG-Studie) muss die Indikation zur adj. Chemotherapie jedoch neu überdacht werden. Metaanalysen Eine neuere Metaanalyse (Earle and Maroun, 1999) analysierte 13 randomisierte, kontrollierte Studien, die einen alleinigen Chirurgiearm mit einem Arm mit 20 Artikel, 21 Vergleiche postoperativer Chemotherapie verglichen. Die Odds3658 Pat., 2180 Todesfälle Ratio für Tod war in der chemotherapeutisch behandelten Patientengruppe 0,80 (95% Konfidenzintervall: 0,66 bis 3 Studien Monotherapie 0,97). Eine Subgruppenanalyse zeigte, dass dieser Effekt 10 Studien 5-FU-Kombinationen ohne Anthrazykline besonders bei nodal-positiven Patienten zum Tragen 7 Studien 5-FU-Kombinationen mit Anthrazyklinen kam. Die größte Metaanalyse (Mari et al., 2000) schließt 3.658 HR 0,82, 95% CI 0,75-0,89, p<0,001 Pat. ein. Es wurden 21 vergleichende Untersuchungen Chemotherapie reduziert Todesrisiko um 18% zwischen einer adj. postop. Chemotherapie und alleiniger Anthrazyklinkombinationen zeigten keinen Vorteil Chirurgie untersucht (siehe obige Tabelle). Durch die adjuvante Chemotherapie konnte das Todesrisiko um 18% reduziert werden (Hazard-Ratio) 0,82 (95% Konfidenzintervall: 0,75 bis 0,89, p < 0,001). Metaanalyse, Mari et al, Ann Oncol 2000 Koreanische Studie Die nicht randomisierte einarmige Studie untersuchte die Wirksamkeit einer adjuvanten, postoperativen Chemotherapie beim R0-resezierten Magenkarzinom mit D2-3-Lymphadenektomie. Rekrutierungszeit 1984-1996. Pat.-Zahl: n=301. Chemotherapie: Adriamycin 40 mg/m2 alle drei Wochen x 5 Jahre 10 Jahre ERGEBNISSE 12; 5-FU 400 mg/m2 wöchentlich für 60 Wochen. Das mediane Follow-up betrug 58 Monate. (Jeung HC et al. Krankheitsfreies Überleben 58,4% 46,5% Cancer 2001; 91: 2016-25). Gesamt-Überleben 62,1% 50,5% 5-Jahres-Gesamt-ÜL der Pat., die eine ChT ohne Dosiskompromiss oder einen vorzeitigen Abbruch erhielten: 75,2% gegenüber 52,9% für die Gruppe mit unvollständiger Therapie. Fazit: Nach einer multivariaten Analyse ist eine komplett verabreichte ChT ein unabhängiger Prognosefaktor. Italienische GOIM-Studie Die italienische GOIM-Studie (De Vita et al. ASCO 2006) stellt die Ergebnisse einer randomisierten Studie (n=228) vor. In einem randomisierten Vergleich erhielt die Therapiegruppe postoperativ Epirubicin/Etoposid/Folinsäure/5-FU. Eingeschlossen wurden Pat. im Stad. Ib- III, die mindestens eine D1-Resektion erhalten hatten. Das krankheitsfreie und das Gesamtüberleben ließ einen Trend für einen Vorteil der Therapiegruppe erkennen. Offenbar profitierten aber solche Pat., bei denen 6 oder mehr Lymphknoten befallen waren. Kernaussagen zur adjuvanten Chemotherapie des Magenkarzinoms 1. Die Ergebnisse MAGIC-Studie werden das künftige Vorgehen in der täglichen Praxis verändern. Pat. mit operablem Magenkarzinom des Tumorstad. ≥T3 NX MO profitieren von drei Zyklen ECF-prä- und postop. 2. In den USA wird weiterhin eine adjuvante Radio-/Chemotherapie bevorzugt. 3. Primär inoperable Pat. können durch neoadjuvante Maßnahmen sekundär in ein operables Stadium überführt werden. Dabei profitieren die R0-resezierten Pat. hinsichtlich des Gesamtüberlebens. Alternativ kann eine alleinige Chemotherapie in dieser Indikation verabreicht (ECF, PFL) oder eine Radio-/Chemoth. gegeben werden. 4. Eine alleinige Chemotherapie in adjuvanter Indikation verbessert das postoperative Leben nicht. Zurzeit in Europa rekrutierende Studie zur periund postoperativ Chemo- und Radiotherapie bei Pat. mit fortgeschrittenen, aber operablem Magenkarzinom. Im besonderen wird eine Antwort auf den Stellenwert der adjuvanten beim Radiotherapie Magenkarzinom erwartet. Velde van de C.J.H. CRITICS-Studie 56 Neoadjuvante + adjuvante Chemotherapie MAGIC-Studie In Großbritannien wurde der Stellenwert einer perioperativen neoadjuvanten und adjuvanten Chemotherapie mit dem ECF-Regime im Vergleich zu alleiniger Chirurgie untersucht. Die Ergebnisse dieser Studie wurden beim ASCO 2005 vorgestellt und 2006 als full paper veröffentlicht (Cunnigham D et al. NEJM 2006,355:11-20) Status der Studie: Nach 503 eingeschlossenen Patienten wurde die Studie im April 2002 geschlossen. Einschlusskriterien Pat. mit einem Adenokarzinom des Magens und des ösophago-gastralen Übergangs im Stad. II und höher ohne Metastasen wurden in die Studie eingeschlossen. Der Befund musste potentiell kurativ operabel sein. Studiendesign Randomisation zwischen alleiniger Operation und zwischen 3 Zyklen OP präoperativer Chemotherapie mit ECF, R OP und drei Zyklen postoperativer 3 x ECF OP 3 x ECF Chemotherapie mit ECF, siehe Graphik. Chemotherapie Die Zyklen ECF wurden alle 3 Wochen wiederholt. Die Operation folgte nach 3 präoperativen Zyklen ECF. Die 3 postoperativen Chemotherapiezyklen begannen 6–12 Wochen nach der OP. In dem Chemotherapie-Arm ECF wird 5FU als kontinuierliche Infusion über einen Venenport appliziert. ECF-Schema Substanz Dosis [mg/m²/d] Epirubicin Cisplatin 5-FU 50 60 200 Applikationsform Therapietage iv-Bypass 4-Std.-Infusion kontinuierliche Infusion 1 1 1-21 Wiederholung: Tag 22 Von den 503 eingeschlossenen Pat. hatten ein Adenokarzinom des Magens 74%, des gastroösophagealen Übergangs 15% und des distalen Ösophagus 11%. Ansprechen: Die Rate der kurativen Resektionen konnte im Chemotherapie + OP-Arm signifikant gesteigert werden (79% vs. 69%). Die Rate der postoperativen Komplikationen Magenkarzinom. MAGIC-Studie war durch die vorangegangene Chemotherapie nicht erhöht (46% in beiden Armen). Auch die 30 Tage-Mortalität war mit Überlebenskurven 6% gleich. Durch die präoperative Chemotherapie konnte ein signifikantes Down-Staging erreicht werden, so dass im OPResektat im Chemotherapie-OP-Arm 54% T1-2 Tumoren gefunden wurden vs. 36% im alleinigen OP-Arm. Ergebnisse Medianes Follow-up >3 Jahre. Bei zwei Drittel der Pat. war eine D2-Lnn-Dissektion erfolgt. Es wurden 319 Todesfälle beobachtet (Chemotherapiearm n=149, Nur-Operations-Arm n=170). Die 5-Jahres-Überlebensrate betrug 36% vs. 23% (p=0.009). Auch das progressionsfreie Überleben war signifikant zugunsten des Chemotherapiearmes verlängert. Das Cunningham NEJM 2006;355:11-20 mediane Überleben betrug 24 vs. 20 Monate. CHT. + OP 250 36% OP 253 23% p-Wert Hazard ratio Schlussfolgerung Die perioperative Chemotherapie des nicht metastasierten 0,009 0,75 Magenkarzinoms verbessert die 0,0001 0,66 Resektionsrate und erhöht signifikant das progressionsfreie und das Gesamtüberleben. Die Verminderung der Todesrate beträgt nach der Hazard ratio 25%. Von chirurgischer Seite wird das schlechte Überleben im Operationsarm kritisch angemerkt. n= 5-Jahres-Überleben Progressionsfreies ÜL. Aufgrund der statistischen Power dieser Studie kann die perioperative Chemotherapie des operablen Magenkarzinoms als Teil eines multimodalen Behandlungskonzeptes empfohlen werden. 57 Perioperative Chemotherapie Französische FFCD-Studie Prospektiv randomisierte Phase-III-Studie von Patienten mit einem resektablen Adenokarzinom des Magens, der Kardia und des unteren Ösophagus. Vergleich zwischen einer perioperativen Chemotherapie mit Cisplatin und infusionalen 5-FU gegenüber einer alleinigen Operation. Die Ergebnisse dieser Studie wurden auf dem ASCOMeeting 2007 in Chikago vorgestellt (Boige V et al, ASCO 2007 Abstr. 4510). Auswertbar waren 224 Patienten mit einem resektablen Adenokarzinom des Magens, der Kardia und des unteren Ösophagus. Die Einschlusskriterien für die Studie waren Alter ≤75 Jahre, Allgemeinzustand WHO: <2. Im Arm 2 der Studie erhielten die Patienten eine Perioperative Chemotherapie. Daten der britischen und französischen Studie. Chemotherapie mit 2-3 Zyklen von Cisplatin 100 mg/m² Tag 1 und 5-FU 800 mg/m²/d Tag 1-5 als kontinuierliche Infusion alle 28 Tage. Der Hauptzielpunkt der Studie über das Gesamtüberleben sowie das krankheitsfreie Überleben mit einem Evaluationszeitpunkt nach 6 Monaten. Der Rekrutierungszeitraum der Studie: 1995 - 2003. Es waren Pat. von 28 französischen Zentren eingeschlossen. Die Verteilung auf die beiden Gruppen war hinsichtlich der wichtigen Prognosefaktoren gut balanciert. Das mediane Follow-up betrug 5,7 Jahre. Im Chemotherapiearm erhielten 109 Pat. vor der Operation eine Chemotherapie mit Cisplatin, 5-FU, 98 bekamen mehr als 2 Zyklen. Nach der Gastrektomie erhielten 54 Pat. eine FFCD-Studie. Gesamtüberleben Chemotherapie. Ergebnisse Eine R0-Resektion wurde im Arm 1 in 73% der Pat. und im Arm 2 in 84% erreicht (p=0.04). Die präoperative Chemotherapie verbesserte das krankheitsfreie Überleben (p=0.003). Hazard ratio 0,65 mit einem 3- und 5- Jahre-krankheitsfreien-Überleben von 25% und 21% im Arm 1 gegenüber 40% und 34% im Chemotherapiearm 2. Die Hazard ratio für ein Rezidivereignis betrug 0,69 mit einem 3-Jahres-Überleben von 35% und einem 5Jahres-Überleben von 24% in der Nur-Operation-Gruppe gegenüber 48% und 38% im Chemotherapiearm. Die Lokalisationen der Tumoren im Magen, der Kardia und der im unteren Ösophagus hatten keinen Einfluss auf das Ergebnis. Die Daten der französischen FNLCD/FFCD-Gruppe entsprechen im Wesentlichen den Resultaten der britischen MAGIC-Studie. Danach sind Cisplatin und 5-FU als die effektivs.ten Substanzen in der adjuvanten Chemotherapie des Magenkarzinoms anzusehen. Postoperativ erhielten die Patienten Reseziertes Magen-, Kardia-Ca, Adeno-Ca des unteren Ösophagus (n=54) 2 Zyklen Chemotherapie. Die (n=224)5-FU/Cisplatin x 2-3 OP 5-FU/Cisplatin x 2 vs. OP alleine eingeschränkte Möglichkeit, OP ChT OP ChT p postoperativ die geplante Chemo(n=111) (n=113) therapie zu geben, deckt sich mit den Periop.Mortalität 5 5 Ergebnissen der MAGIC-Studie. Dort Keine Resekt. 9% 6% war auch bei 58% der Pat. die R0 73% 84% 0.04 Chemotherapie postoperativ nicht voll oder gar nicht durchführbar. N0 16% 28% 0.05 Als Fazit ergibt sich aus der 3J DFS* 25% 40% 0.002 französischen Studie eine vergleichbare 5J DFS* 17% 34% < 0.01 perioperative Mortalität bei einer signifikant erhöhten Rate an R0-Resektionen und einem häufiger gefundenen N0-Stadium in der Chemotherapiegruppe gegenüber dem alleinigen Operationsarm. Insgesamt war das 3-Jahres-krankheitsfreieÜberleben für die perioperative Therapiegruppe von 25% auf 40% verbessert. Das 5-Jahres krankheitsfreie Überleben verdoppelte sich von 17% auf 34%. Damit hat die perioperative Chemotherapie als neuer Therapiestandard einen herausragenden Evidenzgrad (I A B) erreicht. 58 Adjuvante Therapie Japanische S-1 und Tegafur-Studie S-1-Studie Japanische Phase-III-Studie. Patienten mit Magenkarzinom der Stad. II oder III mit Z.n. Gastrektomie und D2-Lymphadenektomie wurden prospektiv-randomisierte in Nachbeobachtung oder eine adjuvante Chemotherapie mit der Substanz S-1 für 12 Monate. S-1 ist eine zusammengesetzte Substanz und besteht aus 3 Komponenten Tegafur, Gimeracil (erhält die Konzentration von 5-FU im Plasma und im Tumorgewebe) und Oteracil (hemmt die Aktivität der Orotat Phosphoribosyl Transferase und bewirkt eine Reduktion der gastrointestinalen Toxizität). Tegafur hat eine antimetabolische Aktivität auf DNA und RNA, in dem es schrittweise zu 5-FU umgewandelt wird. In die Studie wurden 529 Patienten in die S-1-Gruppe und 530 Pat. in die Nur-Operation-Gruppe randomisiert. Das Chemotherapieregime bestand aus einem 6-Wochen-Zyklus, 4-Wochen Behandlung mit 80 mg/m2 täglich S1 oral und 2 Wochen Pause für die Gesamtdauer eines Jahres. Primärer Endpunkt der Studie war das Gesamtüberleben. Rekrutierungszeit Oktober 2001 bis Dezember 2004. Die Studie wurde vorzeitig gestoppt, da bei einer Interimsanalyse die S-1-Gruppe eine signifikant höhere Gesamtüberlebens-Rate aufwies als die Patienten in Beobachtungsarm (p= 0.002). Das 3-Jahre-Gesamtüberleben betrug 80,1 % für die S-1-Gruppe und 70,1 % für den Kontrollarm. Die Hazard Ratio für das Todesereignis betrug für die S-1-Gruppe im Vergleich zum Kontrollarm 0.68. Nebenwirkungen wurden als moderat beschrieben. Grad-3/4: Anorexie 6 %, Übelkeit 3,7 %, Diarrhoe 3,1 %. Japanische Adjuvans-Studie S-1. Signifikanter Vorteil der adjuvant behandelten Pat. für das PFS und das OS im Vergleich zur Kontrollgruppe. Sakuramoto S. et al. NEJM 2007;357:1810-20 Tegafur-Studie Prospektiv-randomisierte Studie aus Japan. Eingeschlossen wurden Patienten mit dem Tumorstadium in T2 N1-2 M0. Nach einer Gastrektomie wurde das Patientenkollektiv randomisiert. Im Therapiearm erhielten die Patienten Tegafur 360 mg/m² täglich peroral für 16 Monate. Die Kontrollgruppe wurde lediglich nachbeobachtet. Eingeschlossen wurden 190 Patienten, 95 in jeder Gruppe. Therapiebedingte Nebenwirkungen waren mild. Die Studie wurde wegen schleppender Randomisation vorzeitig beendet. Nach einem Follow-up von 6,2 Jahren war das Gesamtüberleben und das Rezidivfreie-Überleben für die Chemotherapie-Gruppe signifikant höher. Für das Gesamtüberleben ergab die Hazard Ratio 0.48 (p= 0.017), Signifikanter Überlebensgewinn für Pat. mit für das Rezidivfreie-Überleben ergab die HR einen Wert Magenkarzinom der Stad. T2 N1-2 M0 durch eine von 0.44, (p= 0.005). Fazit: Obwohl die Studie nicht die adjuvante Therapie mit oral applizierbarem Tegafur. ursprünglich geplante Patientenzahl erreichte, war dennoch Nakajima T. et al. Brit J Surg 2007;94:1468-76 eine Aussage möglich. Die mit Tegafur behandelten Patienten zeigten einen signifikanten Vorteil auch für das Gesamtüberleben. 59 Magenkarzinom Adjuvante Radio-/Chemotherapie, SWOG-Studie Von zahlreichen randomisierten Adjuvanzstudien hatte sich lediglich in der Untersuchung der GITSG (1974) ein Überlebensvorteil für den Therapiearm im Vergleich zur Kontrollgruppe ergeben. Nach Daten einer Metaanalyse von 12 randomisierten Studien profitieren möglicherweise Patienten mit nodal-positiver Erkrankung von einer postoperativen adjuvanten Therapie (Earle CC et al. Proc ASCO 1998: Abstr 1009). Nach Daten der jüngeren Vergangenheit muss der therapeutische Nihilismus revidiert werden. Postoperative adj. Radio-/Chemotherapie des Magen-Ca US-amerikanische randomisierte multizentrische Phase-III-Studie. SWOG-Trial (Macdonald JS et al. NEJM 2001; 345:725-30). Studiendaten: n=556 Pat., R0-Resektion nach Magen- oder Kardiakarzinom. Zwei Drittel hatten einen T3- oder T4-Tumor, 80% waren N+. Studiendesign: Radio-/Chemotherapie vs. Beobachtung In der Therapiegruppe erhielten die Pat. eine Behandlung in drei Abschnitten, die nachstehend als Therapie 1, 2, 3 ausgewiesen ist. SWOG-Studie. OP vs OP + RT-CHT Therapie 1: (vor RT) 5-FU 425mg/m2/d i.v. Bolus d1-5 Folinsäure 20 mg/m2/d i.v. Bolus d1-5 Therapie 2: Radio/Chemoth. Radiotherapie 45Gy/ 5 Wochen/ (5 Fraktionen/Woche) Chemotherapie 5-FU 400 mg/m2 /d i.v. Bolus Folinsäure 20 mg/m2/d i.v. Bolus (ab Tag 28) (Mayo-Clinic-Schema) an den ersten 4 und den letzten 3 Tagen der Radiatio Therapie 3: (nach RT) 2 Zyklen 5-FU + FA über jeweils 5 Tage wie vor der RT (Mayo-Clinic-Schema), einen und zwei Monate nach Beendigung der Bestrahlung Ergebnisse Durchschnittliche Follow-up-Dauer 5 Jahre (Arm A = Beobachtung) Therapiearm Mediane Überlebenszeit Vollständige RT-CHT Rezidivfreies Überleben (3 Jahre ) Lokalrezidive Peritonealkarzinose A 27 Monate* 31% 29% 72% B 36 Monate* 64% 48% 19% 65% * Unterschied statisch signifikant p= 0.005 Fazit: Die adjuvante Radio-/Chemotherapie verlängert deutlich das rezidivfreie und das Gesamt-ÜL und wurde deswegen, ergänzend zur Operation, in den USA zum Standard der Therapie des Magenkarzinoms erklärt. Kritische Bewertung Ein wesentliches Problem dieser Studie bestand darin, dass nach europäischen Verhältnissen die chirurgische Radikalität hinsichtlich des Ausmaßes der Lymphadenektomie (LAD) unzureichend war. Nur 10% der Pat. hatten eine D2-Resektion, 30% eine D1-LAD und in 54% lag ein operativer Status <D1 vor. Vor diesem Hintergrund müssen die Ergebnisse der SWOG-Studie gesehen werden. Eine unkritische Übertragung der Ergebnisse auf die Verhältnisse in Deutschland ist deshalb nicht erlaubt. Wohl darf daraus abgeleitet werden, dass bei einer Hochrisikokonstellation für ein Rezidiv, z.B. bei ausgedehntem Lymphknotenbefall, eine adjuvante kombinierte Radio-/Chemotherapie eine sinnvolle Option darstellt. Die Chemotherapie sollte allerdings nicht mehr mit toxischem Mayo-Clinic-Schema durchgeführt werden, sondern besser mit Xeloda. Beachte: Aufgrund der positiven Ergebnisse der britischen MAGIC-Studie wird die Bedeutung der SWOG-Studie in Europa relativiert. In der MAGIC-Studie hatten zwei Drittel der Pat. eine D2-Lnn-Resektion. Im Gegensatz dazu halten die Onkologen in den USA weiterhin an der postoperativen Radio-/Chemotherapie als Standardbehandlung fest. Anmerkung: Eine zeitgemäße Alternative zur oben angegebenen 5-FU/Folinsäure-Therapie kann die Gabe von Capecitabin sein. Dosierung: Vor und nach der Bestrahlung 2x 850 mg/m²/d, während der Bestrahlung 2x 625 mg/m²/d. Ein Zyklus d1-14. Wiederholg d22 60 Magenkarzinom Intraoperative Strahlentherapie Einleitung Gegenüber der perkutanen Strahlentherapie bietet die intraoperative Bestrahlung den Vorteil, Risikoorgane in enger Nachbarschaft zu Tumoren aussparen zu können. Insbesondere im Bauchraum, wo Dünndarm, Rückenmark, Nieren und Nervengewebe zu schonen sind, können so deutlich höhere Strahlendosen appliziert werden. Bis heute kommt diese Methode nur an wenigen Zentren weltweit zur Anwendung. Der klinische Einsatz erfordert einen hohen technologischen und personellen Einsatz, sowie eine sehr enge Kooperation zwischen Operateur und Strahlentherapeut. Für die moderne intraoperative Strahlentherapie werden Linearbeschleuniger verwendet, die hochenergetische Elektronen (4-21 MeV) produzieren und über ein spezielles Kollimationssystem zur präzisen Einstellung verfügen. Strahlenempfindliche Strukturen innerhalb des Applikatorfeldes werden mit Hilfe von Bleiplatten geschützt. Zumeist wird die intraoperative Strahlentherapie mit einer perkutanen Strahlentherapie kombiniert. Links: Mobiler Linearbeschleuniger zur IORT (Novac7) am Universitätsklinikum Aachen. Die Strahlbündelung erfolgt über ein starrverbundenes Applikatorsystem, siehe Insetbild. Rechts: Schematische Darstellung des intraoperativen Zielvolumens (ZV) und des erweiterten perkutanen Strahlenfeldes (ZV-ERBT) nach MJ Eble Onkologe 2001; 7: 649-56) Magenkarzinom Die erste Entwicklungsphase der heutigen IORT vollzog sich in Japan ausgehend von der Universitätsklinik Kyoto unter M. Abe. Dieser berichtete 1980 in einer ersten Durchführbarkeitsstudie über 14 Pat. mit nicht resektablen Lymphknotenmetastasen oder nicht resektablen Lnn-Läsionen, die in den Pankreas einwuchsen. Mit einer Einzeldosis von 30-35 Gy konnten Lnn-Metastasen kleiner 3 cm ausgelöscht werden. Das Zielvolumen nach Teilresektion oder Gastrektomie umfasst die Region des Truncus coeliacus, den medialen Anteil des Leberhilus und die Milzhilusgefäße, sowie den kranialen Anteil von Pankreaskopf und -korpus. Auf der Grundlage von Tierexperimenten wurden tolerable Dosisbereiche von 15-20 Gy ermittelt. Im Stadium II, III und IV ergaben sich in ersten klinischen Prüfungen, insbesondere auch einer randomisierten Studie, Überlebensvorteile von 2-25%. Bei Dosen von 15 Gy intraoperativ und 46 Gy perkutan, beschränkt auf die Truncus-coeliacus-Region, waren die Nebenwirkungen gering. Durchführung Die IORT kann prinzipiell in zwei Modalitäten erfolgen (Hinkelbein W., T. Wiegel in: Management des Ösophagus- und des Magenkarzinoms. Hrsg. HJ Meyer, HJ Buhr, H Wilke, Springer-Verlag, 2004) - Alleinige intraoperative Strahlentherapie mit Einzeitdosen von 20-40 Gy Kombination einer niedrigen Einzeitdosis von 12-20 Gy mit anschließender perkutaner Bestrahlung unter Einbeziehung des Kompartiments III mit einer Gesamtdosis von 35-50 Gy. Ergebnisse In zwei bisher durchgeführten randomisierten Studien mit kleinen Pat.-Zahlen fand sich eine signifikante Reduktion der lokoregionären Rezidive. Es konnte aber keine Verlängerung des Gesamtüberlebens gefunden werden (Sindelair WF et al. Am J Surg 1993; 165: 178-87; Krämling HJ et al. Langenbecks Arch Chir 1996; 211: Suppl. II). Auch die kombinierte IORT/Perkutanbestrahlung führte nicht zu besseren Langzeitergebnissen. Aufgrund der geringen Zahl aktiver Zentren, der unterschiedlichen Behandlungskonzepte und einer starken Heterogenität der Pat.-Kollektive bei insgesamt niedrigen Fallzahlen muss der Stellenwert der intraoperativen Strahlentherapie für diese Erkrankung noch weiter in prospektiven Studien geklärt werden. 61 Metastasiertes Magenkarzinom Chemotherapie, Best supportive care Ist eine Chemotherapie sinnvoll? Um die Frage zu klären, ob eine Chemotherapie beim fortgeschrittenen Magenkarzinom sinnvoll ist, wurden bislang vier randomisierte Studien mit Chemotherapie im Vergleich zu best supportive care durchgeführt (siehe Tabelle). Alle vier Studien konnten eine signifikante Verlängerung des medianen Überlebens nachweisen. Insgesamt kann durch eine Chemotherapie eine Lebensverlängerung von ca. 6 Monaten erreicht werden. Medianes Überleben (Monate) Chemotherapie BSC1) Murad et al. (Cancer, 1993) Pyrhönen et al. (Br J Cancer, 1995) Scheithauer et al. (2. Conf Bio Prev Treat GII Mal, 1995) Glimelius et al. (Ann Oncol 1997) Summe: n=40 n=41 9 12 3 3 p=0,001 p=0,001 n=37 7,5 5 p<0,05 n=61 n=174 8 10 5 3-4 p=0,003 1) BSC – Best supportive care Wie verhält sich die Lebensqualität der Patienten unter einer Chemotherapie? Um diese Frage zu beantworten, wurde von Glimelius (Glimelius et al., 1997) die Lebensqualität mittels eines EORTC-QLC-C30-Fragebogens bei Patienten mit Chemotherapie (bestehend aus Etoposid, Leucovorin und 5-FU bzw. aus 5-FU und Leucovorin) im Vergleich zu einer best supportive care Gruppe evaluiert. Es zeigte sich in der Chemotherapiegruppe bei 45% der Patienten eine verbesserte bzw. anhaltend hohe Lebensqualität im Vergleich zu 20% in der best supportive care Gruppe. Dieser Unterschied war statistisch signifikant. Auch die Evaluation der Lebensqualität durch den Arzt zeigt eine wesentlich bessere Lebensqualität in der chemotherapeutisch behandelten Patientengruppe. Der Anteil des Gesamtüberlebens mit hoher Lebensqualität war mit 69% in der chemotherapeutisch behandelten Gruppe deutlich höher als in der Gruppe mit best supportive care (47%). Ansprechraten beim metastasierten Magenkarzinom AIO-Schema plus X Autor Stahl Bokemeyer Raida Vanhöfer Kretzschmar Kollmannsberger Hofheinz Möhler Gnad Al-Batran 1996 1997 1998 1998 2000 2001 2002 2004 2004 2004 Cisplatin/Epirubicin Taxol Cisplatin/Adriamycin Cisplatin Mitomycin q6w Cisplatin/Taxol Mitomycin q3w Irinotecan Mitomycin q4w / Caelyx Oxaliplatin Pat. n Ansprechen (%) Überleben M0 27 22 24 83 30 45 33 58 29 37 50 32 55 62 37 51 54 45 45 43 7 11 14 11 7 14 10 11 14 10 Tumorstatus Optionen Multiple Metastasen, asymptomatisch Capecitabin/Cisplatin oder PLF ECF oder ECX; EOX DCF oder Gastro-TAX Lokal fortgeschritten, keine Metastasen DCF oder Radio-/Chemotherapie Multiple Mets, symptomatisch, Gefahr für Verschlechterung DCF oder Gastro-TAX XP (PLF) ECF oder Modifikationen (ECX, EOX) Resektabel ECF (ECX,EOX) Differenzialtherapie des lokal fortgeschrittenen oder metastasierten Magen-Ca Abhängig von den individuellen Verhältnissen eines Patienten und dem gesteckten Therapieziel ergeben sich unterschiedliche Optionen für eine Chemotherapie. Therapievorschlag nach D. Arnold, Halle 62 Magenkarzinom Chemotherapie der 1./2. Generation: FAM, EAP-Schema In den früheren Jahren stellten diese Kombinationen den Goldstandard in der Chemotherapie des metastasierten Magenkarzinoms dar. Inzwischen hat es relevante Weiterentwicklungen gegeben. Diese fußen auf einer Langzeitapplikation von 5-FU sowie der Einbeziehung neuer Substanzen. Voraussetzungen für eine Chemotherapie Folgende Kriterien müssen erfüllt sein. 1. Ausreichender Allgemeinzustand, ≤ WHO 2. 2. Evaluierbare Tumorparameter müssen nachweisbar sein, die prätherapeutisch das Festlegen einer messbaren Referenzläsion erlauben. Diese dient der Bewertung des Therapieergebnisses. 3. Kontraindikationen gegen die verwandten Zytostatika dürfen nicht bestehen. FAM Substanz Macdonald, Ann Intern Med 1980; 93: 533 Dosis [mg/m²/d] Applikationsform Therapietage 5-FU 600 i.v.–Bolus 1, 8, 29, 36 Adriamycin 30 i. v. (Bypass) 1, 29 Mitomycin 10 i. v. (Bypass) 1 Wiederholung: Tag 57. Ergebnis: Ansprechrate: 35 %, davon CR 5 %. Die EAP-Kombination ist toxisch und kommt deswegen heute nur noch ausnahmsweise zum Einsatz. Die Indikation beschränkt sich auf den neoadjuvanten Einsatz primär nicht resektabler Magenkarzinome, bei denen ein DownStaging mit dem Ziel einer sekundären Resektabilität möglich erscheint. Das Vorhandensein eines Aszites schließt ein kuratives Konzept aus. Für diese Situation kann das EAP-Schema nicht empfohlen werden, da das NutzenLasten-Verhältnis bei dieser Befundkonstellation nicht stimmig ist. EAP Substanz Preusser, P., Wilke, H., et al. J Clin Oncol 1989; 7: 1310-17 Dosis [mg/m²/d] Applikationsform Therapietage Adriamycin 20 i.v. Bypass 1, 7 Cisplatin 40 1-Std.-Infusion 2, 8 Etoposid 100 (120) * 1-Std.-Infusion 4, 5, 6 * für Patienten < 60 J. Wiederholung: Tag 29. Maximal 6 Zyklen. Bei präoperativer Gabe (2-) 4 Zyklen. Kontrolle des Therapieergebnisses monatlich. Voraussetzung Präoperativ: Staginglaparotomie. Lokoregionär fortgeschrittener Tumor oder lokal begrenzte Metastasierung. Guter Allgemeinzustand (Zubrod 0 - 2). Keine Kontraindikation gegenüber ADM und DDP. Festlegung der beurteilbaren Markerläsion. Bereitschaft des Patienten gegebenenfalls auch eine stärkere Toxizität in Kauf zu nehmen, wenn damit eine Erhöhung der Heilungschancen möglich erscheint. Einverständniserklärung des Patienten. Beachte: Hohe Toxizität: Myelosuppression, Übelkeit, Erbrechen, Nierenfunktion, Alopezie, Neuropathie. Ergebnisse: (n = 145), darunter 49 Pat. mit lokal fortgeschrittenem Tumor. Ansprechrate 57 %, davon 15 % CR, medianes Überleben 10 Monate. Die Ansprechrate und das mediane Überleben waren bei der lokal fortgeschrittenen Erkrankung signifikant höher als bei einer Fernmetastasierung, Ansprechrate 73 % vs. 49 %. Von 36 Pat. mit chirurgisch dokumentierter Irresektabilität wegen eines lokoregionär fortgeschrittenen Karzinoms erreichten 24 Pat. eine CR oder PR. 21/36 Pat. wurden einer Second-look-Operation unterzogen. 6/21 Pat. hatten im Resektat histologisch eine CR, 10/21 wiesen noch vitales Tumorgewebe auf, konnten aber R0-reseziert werden, 3/21 waren resektabel, hatten aber positive Resektionsränder. 2/21 blieben inoperabel. Die Relapserate der 21 Pat., die keinen nachweisbaren Tumor nach der präoperativen Chemotherapie + OP + postop. Chemotherapie erkennen ließen, betrug 57 % nach einem medianen Follow-up von 19 Monaten. 63 Magenkarzinom Chemotherapie der 3. Generation, 5-FU c.i., PLF Für 5-FU besteht eine Dosis-Wirkungsbeziehung. Eine Steigerung des zytostatischen Effektes ist durch eine vorangestellte Folinsäuregabe möglich. Für hochdosiertes 5FU + Folinsäure sind verschiedene Schemata veröffentlicht worden. Die Schemata mit Langzeitinfusion von 5-FU werden auch als Chemotherapiekombinationen der 3. Generation zur Behandlung des Magenkarzinoms bezeichnet. Diese Infusional-5-FU-Regime haben eine vergleichbare Wirksamkeit wie die intensiven Zweitgenerationsschemata EAP oder FAMTX, sind aber weniger toxisch und einfacher zu handhaben, so dass eine ambulante Durchführung ohne Beeinträchtigung der Therapiesicherheit möglich ist. Beachte: Diese Therapieschemata verlangen einen venösen Port und eine tragbare Injektionspumpe. Wenn die Applikation über eine periphere Vene erfolgt, resultiert eine ausgeprägte Phlebitis. AIO-Schema Substanz Folinsäure 5-FU Metastas. Magen-Ca, c.i. 5-FU/FS-Infusion. Therapievorteil durch die Kombination mit Cisplatin (P) und Irinotecan (I). Vanhöfer, U., H. Wilke, H.-J. Weh et al. (Ann Oncol 1994;5:850-51) Dosis [mg/m²/d] 500 2.600 Applikationsform 2-Std.-Infusion 24-Std.-Infusion Therapietage 1, 8 ff 1, 8 ff Wiederholung: Wöchentlich über 6 Wochen, dann 1 Woche Pause. Dauer maximal 3 Zyklen. Ergebnisse: n = 17 (davon 14 mit FAMTX, ELF oder Cisplatin/5-FU vorbehandelte Pat): PR = 18%, stable disease 41%. Mediane Überlebenszeit nach Therapiebeginn: 5 Monate. PLF-Schema Substanz Wilke, H., M.Korn et al. (Ann Oncol 1996;7: Suppl.2,A2130) Dosis [mg/m²/d] Applikationsform Therapietage 50 500 2.000 1-Std.-Infusion 2-Std.-Infusion 24-Std.-Infusion 1, 15, 29 1, 8, 15, 22, 29, 36 1, 8 15, 22, 29, 36 Cisplatin Folinsäure 5-FU Wiederholung: Tag 50, Dauer im Rahmen der Studie 3 Zyklen. Beachte: Das Cisplatin wird zeitlich vor 5-FU/FS gegeben. Ergebnisse: n = 76 unvorbehandelt: CR 7%, PR 38%, toxic death 2%. Die Therapie ist mit Hilfe einer Infusionspumpe über ein Portsystem ambulant durchführbar. EORTC-Studie 40953 Die beiden oben angegebenen Schemata bildeten die Grundlage für die Phase-II-Studie 40953 der EORTC unter der Federführung der AIO. Die Daten wurden jetzt veröffentlicht (Lutz M.P. et al. J Clin Oncol 2007,25:2580-85) Studiendesign Vergleich wöchentliches 5-FU als kontinuierliche Infusion, 3000 mg/m²/24h; 5-FU 2600 mg/m²/24h + Folinsäure 500 mg/m²; 5-FU 2000 mg/m²/24h/Folinsäure/Cisplatin 50 mg/m² alle 14 Tage für 6 Wochen mit einer Woche Therapiepause. Ziel war die Erfassung der Responserate. In die Studie wurden eingeschlossen: Pat. < 75 Jahre mit einem lokal fortgeschrittenen, nicht resektablen und/oder metastasierten Magenkarzinom. Von 1/1996 bis 8/1999 wurden 145 Patienten aus 17 Institutionen rekrutiert. Der HD-5-FU-Arm wurde vorzeitig geschlossen. 33 Patienten waren in diesem Arm bewertbar. Im Arm B konnten 49 und im Arm C 46 Patienten evaluiert werden. Ergebnisse Ansprechraten: Arm A 6,1%, Arm B 25%, Arm C 45,7%. Darunter 4 komplette Remissionen. Der Arm A war wegen der geringen Ansprechraten vorzeitig geschlossen worden. Das mediane progressionsfreie Überleben für alle Patienten betrug: Arm A 1,9, Arm B 4,0, Arm C 6,1 Monate. Dem entsprach ein Gesamtüberleben von 7,1; 8,9 und 9,7 Monaten. Die Überlebensrate nach einem Jahr betrug 24,3%, 30,3% und 45,3%. Grad-4-Toxizitäten waren selten. Am häufigsten trat eine Neutropenie vom ToxizitätsGrad-3/4 auf, und zwar in: 1,9%, 5,4%, 19,6%. Eine relevante Diarrhoe wurde beobachtet bei 2,7%, 1,9% und 3,9%. Die Cisplatin-haltige Therapie war den beiden anderen Behandlungsarmen signifikant überlegen. Die Autoren schlussfolgern, PLF kann eine Alternative für die Patienten sein, bei denen eine Langzeit-Infusion mit 5-FU nicht durchführbar ist und die eine weniger intensive Behandlung als mit dem ECF-Schema wünschen. 64 Magenkarzinom Chemotherapie der 3. Generation, FFP, EP, ECF Inzwischen wurden eine Reihe weiterer Therapieschemata veröffentlicht, die auf der Langzeitapplikation von 5-FU beruhen. Auch diese Behandlungen erfordern einen venösen Port. FFP-Schema Substanz Folinsäure 5-FU Paclitaxel Bokemeyer, C et al. (Anticancer Drugs 1997;8:396-99) Dosis [mg/m²/d] Applikationsform Therapietage 500 2-Std.-Infusion 1, 8, 15, 22, 29, 36 2.000 24-Std.-Infusion 1, 8, 15, 22, 29, 36 175 3-Std.-Infusion 1, 22 Wiederholung: Tag 50 Beachte: Paclitaxel wird zeitlich vor 5-FU/FS gegeben. Ergebnisse: n=20 unvorbehandelt, CR 0%, PR 32%, mediane Überlebenszeit 11 Monate, med. progressionsfreies Intervall 8 Monate. Toxizität: Neutropenie WHO 3/4 14%, Alopezie 45%, Fieber/Infektion 9%, Diarrhoe/Erbrechen 5% . EP-Schema Substanz Adler, Magenkarzinom-Studie, Uniklinik Ulm Dosis [mg/m²/d] Applikationsform Therapietage Epirubicin 25 30-Min.-Infusion 1, 8, 15, 22, 29, 36 Paclitaxel 80 3-Std.-Infusion 1, 8, 15, 22, 29, 36 Wiederholung: Tag 50 ECF-Schema Substanz Webb a. et al. J Clin Oncol 1997;15:261-67 Dosis [mg/m²/d] Applikationsform Therapietage Epirubicin 50 i.v.-Bypass 1 Cisplatin 60 30-Min.-Infusion 1 5-FU 200 Kontinuierliche Infusion 1-21 Wiederholung: Tag 22, maximal 7 Zyklen im Rahmen der durchgeführten Studie. Phase-III-Studien In einer randomisierten Phase-III-Studie wurde ECF mit dem bisherigen Referenzregime FAMTX bei ösophago-gastralen Tumoren verglichen. 274 Patienten wurden eingeschlossen (Webb et al. JCO, 1997). ECF zeigte mit einer Ansprechrate von 45% versus 21% eine hoch signifikant bessere Effektivität, das mediane Überleben war mit 8,9 Monaten ebenfalls besser als im FAMTX-Arm (5,7 Monate). Auch das rezidivfreie Überleben konnte signifikant verbessert werden bei insgesamt gleicher Lebensqualität wie im FAMTX-Arm. Aufgrund dieser Daten gilt das ECF-Schema in Großbritannien als Standard in der Therapie des metastasierten Magenkarzinoms. In einer weiteren randomisierten Phase-III-Studie der Arbeitsgruppe um Cunningham wurde an 580 Pat. mit ösophago-gastralen Tumoren ECF mit MCF (Mitomycin, 5-FU-Dauerinfusion, Cisplatin) verglichen (Ross et al. JCO 2004). Die Ansprechraten von ECF konnten reproduziert werden. Aufgrund des günstigeren Toxizitätsprofils wurde ECF auch in dieser Studie als Standard bestätigt. Fazit: ECF ist das bestuntersuchte Referenzregime zur Chemotherapie des metastasierten Magenkarzinoms. 5-FU vs. Capecitabine und Cisplatin vs. Oxaliplatin Nach den Ergebnissen der großen internationalen REAL-2 (siehe dort) sind Capecitabine dem in kontinuierlicher Infusion gegebenen 5-FU und das Oxaliplatin dem Cisplatin in der Therapie des fortgeschrittenen Magenkarzinoms mindestens gleichwertig. Allerdings ist Oxaliplatin nicht zur Chemotherapie des Magenkarzinoms zugelassen. 65 Magenkarzinom Cisplatin Hintergrund Cisplatin und 5-FU sind chemotherapeutisch wirksame Substanzen beim Magenkarzinom und sind in Deutschland mit dem sog. Wilke-Schema weit verbreitet. Die Langzeitinfusion von 5-FU braucht aus Gründen der Venenverträglichkeit ein venöses Portsystem und ist mit den damit verbundenen Problemen, wie Infektion, Okklusion und Venenthrombose behaftet. Capecitabin ermöglicht als Alternative zur kontinuierlichen intravenösen Applikation auf dem oralen Wege gleichfalls anhaltend hohe Wirkstoffspiegel, siehe auch Seite PLF. Phase-II-Studie Cisplatin + Capecitabin Die koreanische Arbeitsgruppe (Kim TW et al. Ann. Oncol 2002; 13:1893-98) berichtete als Ergebnis einer Phase-II-Studie über 42 Pat. mit lokal fortgeschrittenem (5 Pat.) oder metastasiertem Adenokarzinom des Magens (37 Pat.). Keiner der Patienten war chemo- oder radiotherapeutisch vorbehandelt. Therapie Xeloda 2 x 1250 mg/m2/d p.o. d 1 - 14 60 mg/m2 1h-i.v. Inf. d1 Cisplatin Wiederholung: Tag 22 Ergebnisse Intention-to-treat-Analyse (n = 42). Ansprechen n % RR CR PR SD PD Nicht auswertbar 23 1 22 7 8 4 54,8 2,4 52,4 16,7 19 9,5 Alle 5 Patienten mit lokal fortgeschrittener Erkrankung erreichten eine partielle Remission. In zwei Fällen wurde eine sekundäre Operation möglich. Weitere Daten Medianer Follow-up 18,2 Mo Mediane Dauer des Response 6,2 Mo Mediane time to progression 6,3 Mo Medianes Survival 10,1 Mo 1-Jahr-Survivalrate 45,8% Meier Kaplan-Kurve: Time to progression Nebenwirkungen Insgesamt 216 Therapiezyklen. Die häufigste Nebenwirkung war Neutropenie Grad-3/4 bei 13 Pat. (32,5%) in insgesamt 38 Zyklen. Es trat jedoch keine Fieberepisode auf. Thrombozytopenie Grad-3/4: 4 Pat. (10%). HandFuß-Syndrom Grad 2: 20%, Grad 3: 7,5%. Es wurde kein therapieassoziierter Todesfall beobachtet. Eine Dosisreduktion war in 34,7% der Zyklen erforderlich. Für Cisplatin wurden 87%, für Capecitabin 93% der Zieldosis erreicht. Wirkungsäquivalenz Nach neueren Daten ist das weniger toxische Oxaliplatin gleichermaßen wirksam wie das Cisplatin. 66 Magenkarzinom Capecitabin Zulassung, Dosierung Für Capecitabin besteht seit 4/2007 eine europäische Zulassung zur Chemotherapie des Magenkarzinoms in der Kombination mit Cisplatin. In dieser Kombination beträgt die empfohlene Dosis von Xeloda 1000 mg/m2 zweimal täglich über 14 Tage, gefolgt von einer 7-tägigen Therapiepause. Die erste Xeloda-Dosis wird am Tag 1 abends und die letzte Dosis am Tag 15 morgens gegeben. Wenn Epirubicin Bestandteil der Behandlung ist, beträgt die empfohlene Dosis von Xeloda 625 mg/m² zweimal täglich Tag 1-14. Epirubicin soll in einer Dosis von 50 mg/m² alle 3 Wochen, jeweils am Tag 1, als Bolusinjektion gegeben werden. Das Platin-haltige Arzneimittel (Cisplatin in einer Dosis von 60 mg/m2 in der Dreifach-Kombination, bzw. 80 mg/m² als Zweifach-Kombination oder Oxaliplatin in einer Dosis von 130 mg/m2) soll alle 3 Wochen, jeweils am Tag 1, als zweistündige intravenöse Infusion gegeben werden. Wirksamkeit beim fortgeschrittenen Magenkarzinom Das oral verabreichbare Capecitabin zeigt als Monotherapeutikum beim Magenkarzinom in einer Dosierung von 1250 mg/m² d 1-14 bei 44 untersuchten Patienten eine Ansprechrate von 34% bei einem medianen Überleben von 9,5 Monaten und ist damit eine sehr aktive Substanz (Hong et al., Ann Oncol 2004). In der Kombination mit Cisplatin (Cisplatin 60mg/m², Capecitabin 1250 mg/m² d1-14) wurden an 38 Patienten Ansprechraten von 55% bei einem medianen Überleben von 10,1 Mo. beschrieben (Kim et al., Ann Oncol 2002). In einem 2 x 2 factorial design (REAL-2-Studie) verglich die Arbeitsgruppe um Cunningham das Referenzregime ECF (Epirubicin/Cisplatin/5-FU) hinsichtlich der Wirksamkeit und der Toxizität mit ähnlichen Kombinationen, indem Cisplatin durch Oxaliplatin und 5-FU durch Capecitabin ersetzt wurde. Inzwischen liegen Ergebnisse der Studie vor (Cunningham D et al. Proc.ASCO 2006;24:Abstr.LBA4017), siehe REAL-2-Studie. Vergleich Cisplatin+5-FU vs. Capecitabin Kang Y-K et al. Ann Oncol 2006;17 (Suppl. 6),Abst O-003 verglichen bei 160 Pat mit lokal fortgeschrittenem oder metastasiertem Magenkarzinom in einer prospektiv randomisierten Studie (ML17032, Zulassungsstudie). Cisplatin+5FU (P 80 mg/m² d1, F 800 mg/m²/d c.i. d 1-5); [FP / Gruppe A, n=156] mit Cisplatin+Capecitabin (P gleiche Dosis, Capecitabin 1000mg/m² 2x tgl. d1−14 [XP / Gruppe B, n=160]. Wiederholung jeweils alle drei Wochen. Ziel der Studie war der Nachweis der Nichtunterlegenheit von Capecitabin gegenüber 5-FU als kontinuierliche Infusion (Noninferiority-study). Sowohl für die Responserate (29% vs. 41%), als auch für die Toxizität war der Capecitabin-Arm der PFGruppe nicht unterlegen. Der Median für das progressionsfreie Vergleich FP vs XP beim fortgeschrittenem Überleben betrug 5,6 Monate für Xeloda + Cisplatin gegenüber Magenkarzinom. Mindestens Gleichwertigkeit von 5,0 Monate für 5-FU + Cisplatin. Die Hazard-Ratio für das Capecitabine (X) gegenüber 5-FU (F) in der Kombination Gesamtüberleben war ähnlich derjenigen für das mit Cisplatin (P). Kang Y-K et al. Ann Oncol progressionsfreie Überleben (Hazard-Ratio 0,85). Die Überlebensdauer betrug im Median 10,5 Monate (XP) gegenüber 9,3 Monaten (FP). Die Daten der Real-2-Studie und der Studie ML1731 bestätigten diese Befunde (Okines A.F.C. et al. ESMO 2008 #1296) Fazit: Aufgrund dieser Daten der Studie ML17032 kann das 5-FU im PF-Schema ohne Verlust an Wirksamkeit durch Capecitabin ersetzt werden und unterstützten die Anwendung von Xeloda in der first-line-Therapie des fortgeschrittenen Magenkarzinoms. Ein weiterer Vorteil ist die einfachere Handhabung mit der Nichtnotwendigkeit eines venösen Portsystems. Nebenwirkungen Die größte praktische Bedeutung haben das Hand-Fuß-Syndrom und die Diarrhoe. Außerdem kommen vor: Anorexie, Diarrhoe, Erbrechen, Übelkeit, Stomatitis, Bauchschmerzen, Abgeschlagenheit, Asthenie. Das palmoplantare Erythrodysästhesie (Hand-Fuß)-Syndrom trat in der Kombination mit Cisplatin bei 22% der behandelten Patienten auf. Laborseitig werden beobachtet: Erniedrigte Hämoglobinwerte, Erniedrigte Neutrophile/Granulozyten, Lymphozytenzahl, Thrombozyten. Erniedrigte Natrium-, Kalium-, Kalziumwerte, erhöhte Werte für Bilirubin, alkalische Phosphatase, SGPT,SGOT In der Kombination mit Epirubicin und Cis- oder Oxaliplatin werden häufiger beobachtet: Leuko-, Neutropenie, Anämie, Thrombozytopenie, febrile Neutropenie, periphere Neuropathie, Infektionen, Thromboembolie. Lethargie. Anwendungsbeschränkung Leukozyten <1,5 G7l, Thrombozyten <100 G/l, Kreatinin-Clearance <30 ml/min, schwere Beeinträchtigung der Leberfunktion, bekannte Dihydropyrimidin-Dehydrogenase-Mangel (DPD), Schwangerschaft und Stillzeit sind Kontraindikationen für Capecitabin. Bei einer Krea-Clearance von 30-50 ml/min: Dosisreduktion auf 75%. Vorsicht bei Pat. > 60 Jahre. Es empfiehlt sich eine Initialdosis von 75-80%. Das gilt besonders für die Kombination mit Docetaxel. 67 Magenkarzinom Oxaliplatin Auch Oxaliplatin zeigt in der Kombination mit 5-FU-Dauerinfusion reproduzierbar vielversprechende Ansprechraten von etwa 40-50%. Eine Reihe von Oxaliplatin-basierten Therapiestudien wurden in Erst- und ZweitlinienBehandlung geprüft. Studie Regime Pat. RR Med. Ü-leben Al-Batran, JCO, 2004 Ox (85),FA (500),FU (2,600) q2w 41 43 % 9,6 Mo. Chao, BrJC, 2004 Ox (65),FA (300),FU (2,6) d1+8 50 56 % 10,0 Mo. Louvet, JCO 2002,20.4543-48 Ox 100, FA 400, FU Bol 400, FU 46h 3,000 q2w 49 45 % 8,6 Mo. Auf dem ASCO-Meeting 2006 (Al-Batran, S-E et al. LBA 4016) wurde die deutsche Phase-III-Studie vorgestellt, bei der das modifizierte FOLFOX-Schema FLO mit der Kombination Leucovorin/infusionales 5-FU und Cisplatin (AIO/PLF) verglichen wurde. FLO verursachte signifikant weniger Nebenwirkungen wie Anämie, Fatique, Übelkeit, Erbrechen, Alopezie und Nierentoxizität als FLP. Außerdem fand sich ein signifikant besseres Ansprechen für FLO mit 34% vs. 25% für PLF. Darüber hinaus war ein Trend zu einer längeren Dauer der Zeit bis zur Tumorprogression (5,7 vs. 3,8 Monate) festzustellen. Das mediane Gesamtüberleben lag bei 10,6 Monaten für FLO und 8,7 Monaten für PLF. Die Subgruppenanalyse zeigte, dass ältere Patienten (>65 Jahre) von dem FLO-Schema besonders profitierten. In einer vorausgegangenen Studie konnten (Al-Batran, S-E et al. J Clin. Onkol. 2004; 22: 658-63) die Wirksamkeit der Kombination Oxaliplatin, 5-FU und Folinsäure nachweisen. Diese Studie war die Grundlage für die oben zitierte Phase-III-Vergleichsuntersuchung zwischen FLO und dem in Deutschland weit verbreiteten AIO-PLF-Schema. FLO-Schema Substanz 5-FU Folinsäure Oxaliplatin Al Batran S-E et al ASCO-Meeting 2006, .LBA4016 Dosis [mg/m²/d] 2600 200 85 Applikationsform 24h- Infusion 2h-Infusion 2h-Infusion Therapietage 1 1 1 Wiederholung Tag 22 Die französische Arbeitsgruppe Louvet C. et al. J. Clin. Onkol. 2002; 23: 4543-48 veröffentliche eine Phase-II-Studie zur Behandlung des fortgeschrittenen oder metastasierten Magenkarzinoms mit der Kombination FOLFOX. Auswertbar waren 53 Pat. Die Behandlung bestand aus Oxaliplatin 100 mg/m², Folinsäure 400 mg/m² in 5%iger Glukose über 2 Stunden, gefolgt von einem Bolus 5-FU 400 mg/m² als 10-Min-Infusion unmittelbar gefolgt von 5FU 3.000 mg/m² als kontinuierliche Infusion über 46 Stunden. Die Behandlung wurde alle 14 Tage wiederholt. Der Altersmedian der Pat. betrug 61 Jahre. 89% der Patienten waren im guten Allgemeinzustand (WHO 0-1). Ergebnisse Komplette Remission 4%, partielle Remission 41%, Gesamtansprechrate 44,9%, stabile Erkrankung 29%. Oxaliplatinhaltige Erstlinientherapie bei metastasiertem Magenkarzinom. Ergebnisse der Studien Links: Louvet C et al. Rechts: AlBatran S-E et al. (siehe oben) Off-label-use Trotz der gut belegten Wirksamkeit ist Oxaliplatin zur Chemotherapie des Magenkarzinoms in Deutschland nicht zugelassen (Stand 9/2007). Im Off-label-use gibt es bei Kontraindikationen gegenüber Cisplatin gute Argumente für den Einsatz dieser Substanz. 68 Magenkarzinom REAL-2-Studie REAL-2-Studie Randomisierte multizentrische Phase-3-Studie beim fortgeschrittenen Karzinom des Magens und des Ösophagus. Es handelt sich um eine so genannte NonInferiority-Studie mit einer 2x2-Randomisation. Eingeschlossen wurden 1.002 Pat. Das mediane Alter betrug 63 Jahre. Unter den Pat. befanden sich 35% Ösophaguskarzinome, sowohl Adeno- als auch Plattenepithel- und undifferenzierte Karzinome. Die Behandlung dauerte 24 Wochen (8 Zyklen). Zur Beurteilung erfolgte eine Computertomographie vor Beginn der Behandlung sowie nach 12 und nach 24 Wochen. Der primäre Zielpunkt der Studie war das * Kontinuierliche Infusion Gesamtüberleben. Die Verteilung auf die 4 Arme war ausgeglichen. In jeder Gruppe befanden sich rund 250 Pat. Die Studie hatte eine Power von 80%, um die Nichtunterlegenheit von Capecitabin gegenüber 5-FU und die von Oxaliplatin gegenüber Cisplatin zu beweisen. Es erfolgte eine Intention-to-treat-Analyse. Das Gesamtüberleben geht aus der nebenstehenden Tabelle hervor. Das mediane follow-up betrug 12,5 Monate. Die Daten wurden auf dem ASCOMeeting 2006 in Atlanta vorgestellt (Cunningham D et al. Proc.ASCO 2006;24:Abstr.LBA4017) Ergebnisse Im Ergebnis fand sich kein signifikanter Unterschied bezüglich der Ansprechraten und der Zeit bis zur Krankheitsprogression zwischen den Studienarmen. Da es sich um eine Non-Inferiority-Studie handelte, ist das Ergebnis für Capecitabin und für Carboplatin als positiv zu bewerten. Die Pat. im EOX-Arm hatten zudem ein signifikant verlängertes medianes Gesamtüberleben im Vergleich zu den Pat. im ECF-Arm (11,2 vs. 9,9 Monate). TherapieArm ECF (n=249) EOF(n=245) ECX(n=250) EOX(n=244) GesamtÜberleben 9,9 9,3 9,9 11,2 1-Jahres-ÜLRate CI 95% 37,7 (31,8-43,6) 40,4 (34,2-46,5) 40,8 (34,7-46,9) 46,8 (40,4-52,9) p-Wert 0,612 0,389 0,020 Hazard ratio CI 95% 1 0,96 (0,79-1,15) 0,92 (0,76-1,11) 0,80 (0,66-0,97) Bezüglich der Nebenwirkungen war in den beiden Oxaliplatingruppen eine stärkere Grad-3/4-Toxizität in Form von: Anämie, Neutropenie und Alopexie zu beobachten. Thromboembolien, Durchfall und Neuropathie waren weitere nennenswerte Toxizitätserscheinungen. In der Capecitabingruppe trat verstärkt ein Hand-Fuß-Syndrom auf. Fazit Mit dem Einsatz von Capecitabin ECX oder EOX wird das ECF-Schema deutlich vereinfacht. Die Nicht-Unterlegenheit von Oxaliplatin gegenüber Cisplatin und von Capecitabin gegenüber 5-FU konnte zweifelsfrei bewiesen werden. Die Pat. REAL-2. Gesamtüberleben ECF vs EOX im EOX-Arm zeigten außerdem ein signifikant verlängertes Gesamtüberleben im Vergleich zu den Pat. im ECF-Arm (11,2 vs. 9,9 Monate). Hinsichtlich der Wirksamkeit von Capecitabin und Oxaliplatin erhärtet die REAL-2-Studie die Daten des „Kang-Trials“. Für das Capecitabin gilt wie für das Oxaliplatin, dass diese den EOX bisherigen Referenzsubstanzen 5-FU bzw. Cisplatin hinsichtlich der Wirkung ebenbürtig und in Bezug auf die Toxizität weniger problematisch sind. Trotz der guten Datenlage ist Oxaliplatin für die Behandlung ECF des lokal fortgeschrittenen oder metastasierten Magenkarzinoms in Deutschland bislang nicht zugelassen (siehe Seite Oxaliplatin) 69 Magenkarzinom Docetaxel Docetaxel Docetaxel ist die zurzeit am intensivs.ten untersuchte neue Substanz. In einer randomisierten Phase-II-Studie von Ajani konnte sich die Dreier-Kombination aus Docetaxel, Cisplatin und 5-FU gegenüber der Zweier-Kombination Docetaxel/Cisplatin durchsetzen und wurde nachfolgend in einer randomisierten Phase-III-Studie mit einer Cisplatin/5-FU-Kombination verglichen. Kürzlich vorgestellte Zwischenergebnisse dieser Studie zeigten die Kombination DCF (Docetaxel/Cisplatin/5-FU) bezüglich des Ansprechens und der Zeit bis zur Tumorprogression dem Cisplatin/5-FU-Arm signifikant überlegen. Eine signifikante Verbesserung des medianen Überlebens wird für die Endauswertung erwartet. Allerdings wird der hier gewählte Vergleichsarm Cisplatin/5-FU (FP) derzeit nicht mehr als empfohlener Referenzarm angesehen (siehe Vanhoefer, JCO, 2000: FP keine Überlegenheit gegenüber FAMTX). Die Schweizer Arbeitsgruppe SAKK (Roth AD et al. Proc. ASCO 2004; 22: 318,A4020) entwickelte eine Dreierkombination mit Docetaxel/Cisplatin und 5-FU als Dauerinfusion über 14 Tage. In einer randomisierten Phase-II-Studie, die noch keinen statistischen Vergleich der Therapiearme erlaubt, wurde ECF dem TC (Docetaxel/Cisplatin) und TCF (Docetaxel/Cisplatin/5FU) gegenübergestellt, siehe Graphik rechts. Der TCFArm zeigt auch im Vergleich zu ECF viel versprechende Daten, so dass diese Kombination derzeit im Phase-IIISetting versus ECF getestet wird. Eine randomisierte Phase-II-Studie der Charité, Berlin, wirft die Frage auf, in wieweit Cisplatin zum Erreichen hoher Effektivität erforderlich ist oder eventuell sogar eine Zweierkombination aus Docetaxel und 5-FU (DF) ähnlich effektiv wie ECF sein könnte. In der Charité läuft derzeit als Nachfolgeprojekt eine Phase-II-Studie, in der Docetaxel mit Capecitabin in der 1st-line Situation kombiniert wird. Informationen unter Email [email protected]. Studie Regime Pat. Ajani, ASCO, 2000 DC (85/75) DCF (75/75/750d1-5) 153 Ajani, ASCO, 2003 DCF (75/75/750d1-5) q3w CF (100/1000d1-5) q4w 460 Roth, Ann Onc, 2004 Doce 75/85, Cis 75, FU(300)d114 q3w Roth, ASCO, 2004 ECF (50/60/200CI) TC (85/75) TCF (85/75/300d1-14) Thuss-Patience, ASCO, 2002 DF (75/200CI) ECF (50/60/200CI) Lee, Br J C 2004 Epi/D/Cis (30/60/75) q3w q3w RR[%] 28 43 Med. Überleben [Mo] NR (nicht berichtet) 38,7 10,2 23,2 8,5 41 51 9,3 40 46 8,2 38 42 11,0 41 55 10,4 45 37,8 9,5 45 35,6 9,7 30 47 11,0 Fazit:In den USA wird postuliert, dass DCF der neue Standard zur Behandlung des Magenkarzinoms sein wird. Toxizität Die Toxizität nach DCF (75/75/750x5) ist hoch. 62% der Pat. erlitten eine Grad-3/4-Toxizität (Ajani J.A. et al. J Clin Oncol 2007;25:3210-16). Im Vordergrund standen Neutropenie mit Fieber und Diarrhoe. Trotz dieser Nachteile erwies sich die Taxotere-haltige Therapie im Vergleich zur weniger toxischen Cisplatin/5-FU (45% schwere unerwünschte Ereignisse), als wesentlich wirksamer mit einer signifikanten Verlängerung der Zeit bis zum Auftreten einer klinischen Verschlechterung. Für den Gesamtkrankheitsverlauf war die Lebensqualität der DCF-behandelten Pat. besser als in der Cisplatin/5-FU-Gruppe. Deshalb gilt Docetaxel als eine sehr potente Substanz in der Chemotherapie des Magenkarzinoms (Ajani J.A. et al. J Clin Oncol 2007;25:3210-16). 70 Metastasiertes Magenkarzinom Therapiestudien, TAX 325-Studie Die Schweizer Arbeitsgruppe der SAKK um A. Roth (Proc. ASCO 2004; 22; 4020A) stellte die Ergebnisse einer dreiarmigen Studie vor, bei der das ECF-Schema mit zwei Docetaxel-haltigen Schemata verglichen wurde. Wegen inadäquater Toxizität erfolgte nach den ersten 21 Pat. eine Dosisreduktion für das Docetaxel auf 75 mg/m2. Studienziele Ansprechrate (primärer Endpunkt), Zeit bis zur Progression, Selektion des besten Kontrollarms für randomisierte Studie gg. ECF. Ergebnisse Wie die Meier-Kaplan-Kurven zur Zeit bis zur Tumorprogression zeigen, ist für die drei Therapieschemata kein nennenswerter Unterschied ersichtlich. Kürzlich wurden die aktualisierten Daten publiziert (Roth A.D. et al. J Clin Oncol 2007;25.3217-23). Ansprechrate ECF 25%, TC 18,5%, TCF 36,6%. Das mediane Überleben betrug: 8,3, 11,0, 10,4 Monate. Die Toxizität wird als akzeptabel beschrieben (TCF-Arm Neutropenie Grad-3/4: 57%). TCF war TC überlegen. Die Kombination scheint geeignet für den neoadjuvanten Einsatz anstelle von ECF. TAX 325-Studie Auf dem ASCO Meeting 2005 wurden die aktualisierten Daten der TAX 325-Studie vorgestellt und das signifikante längere Überleben der Docetaxel-behandelten Patienten sowohl für das krankheitsfreie und das Gesamtüberleben statistisch bewiesen. Auch hinsichtlich der Lebensqualität erwies sich TCF gegenüber CF als überlegen (Ajani J.A. et al. J Clin Oncol 2007;25:3210-16). Ein Problem ist jedoch die hohe Toxizität, vor allem die hämatologische, des TCF-Schemas. Aufgrund der guten Ansprechraten des Docetaxels beim metastasierten Magenkarzinom wird man in der Erstlinienbehandlung nicht auf dessen Einsatz verzichten. Eine Dosisreduktion wie im TAX-GASTRO-Trial (Lorenzen S., GI-ASCO, San Francisco, 2006) kann bei erhaltener Wirksamkeit, aber deutlich reduzierter Toxizität, eine Alternative zum TCF (75/75/750x5) sein. Links: Signifikante Verbesserung der Zeit bis zur Tumorprogression. Rechts: Überlebenskurven. Doppelt so hohes ÜL nach zwei Jahren. 71 Magenkarzinom Chemotherapie, GASTRO-TAX Phase-II-Studie des primär unbehandelten fortgeschrittenen Magenkarzinom und Adenokarzinom des ösophagogastralen Übergangs. GASTRO-TAX-1-Studie Lorenzen S., GI-ASCO, St. Francisco, 2006. Eingeschlossen waren 61 Pat. Medianes Alter 53 Jahre (26-76), Geschlechtsverteilung: Männer 42, Frauen 19, Performance-Status ECOG 0: 45, ECOG 1: 16, Magenkarzinom 37, Adeno-Ca des ösophago-gastralen Übergangs 24, lokal fortgeschrittener Tumor 24, metastasiertes Stadium 37. Die Therapie erfolgte mit Docetaxel, Cisplatin, Leukovorin/5FU in der Dosierung wie in der Tab. dargestellt. GASTRO-TAX-Schema Lorenzen S. et al. GI-ASCO, San Francisco, 2006 Substanz Dosis [mg/m²/d] Docetaxel 40 i.v. Inf. 30 min. 0, 14, 28 Cisplatin 40 i.v. Inf. 60 min. 1, 15, 29 Folinsäure 200 2-Std.-Infusion 1, 8, 15, 22, 29, 36 2.000 24-Std.-Infusion 1, 8, 15, 22, 29, 36 5-FU Applikationsform Therapietage Wiederholung: Tag 50 Dauer der Therapie bis zum bestmöglichen Ansprechen oder nicht tolerabler Toxizität. In der GASTRO-TAXStudie erhielten die Pat. durchschnittlich zwei vollständige Zyklen. Dosisreduktion Die ursprüngliche Dosierung betrug für Docetaxel und Cisplatin je 50 mg/m², Leukovorin 500 mg/m², 5-FU 2000 mg/m². Wegen nicht akzeptabler Toxizität, die ähnlich der TAX 325-Studie war, erfolgte nach 15 Pat. ein Amendment mit einer Dosisreduktion entsprechend den Angaben der obigen Tab. Dosisreduktionsdaten lagen von 59/61 Pat. vor. Die Reduktion von <80% mindestens einer zytostatischen Substanz war bei 40/59 (68%)Pat. erforderlich. Nach dem Amendment 27/44 (61%), vor dem Amendment 12/15 (80%). Die 60-Tage-Mortalität betrug 1/61 (1,6%). Ergebnisse Ergebnisse GASTRO-TAX-1-Studie Ansprechen Kohorte I Kohorte II Gesamt Pat-Zahl 15 44 59 Komplette Remission Partielle Remission Stable disease Progression Nicht bewertbar Gesamtansprechrate 1 6 6 1 1 7 1 19 17 2 5 20 2 (3,4%) 25 (42,4%) 23 (39%) 3 (5,1%) 6 (10,2%) 27 (45,8%) GASTRO-TAX-1-Studie. Sekundäre Resektionsqualität (27 Pat.) R0-Resektion 21/27 /78%) R1-Resektion 4/27 (15%) Histopathologisches Ansprechen Komplette Rem. 3/27 (11%) <10% Residualtumor 6/27 (22%) 10-50% Residualtu. 9/27 (33%) >50% Residualtumor 9/27 (33%) Die Bewertung erfolgte nach RECIST-Kriterien: Progrediente Erkrankung 5,1%, Stable disease 39,0%, partielle Remission 42,4%, komplette Remission 3,4%. Vergleich der Toxizitätsdaten zwischen den Studien Gesamtansprechrate 45,8%. Die Autoren schlussfolgern, TAX-325 und GASTRO-TAX-1(Kohorte II) dass die modifizierte TCF-Therapie ein gutes Verhältnis zwischen Wirksamkeit und Toxizität aufweist. Bei lokal Gastro-Tax-1 TAX 325 fortgeschrittenen und initial nicht resektablen nach Dosisredukt. Grad-3/4 Toxizität n = 221 (%) n = 44 (%) Karzinomen war bei 27 von 46 evaluierbaren Pat. eine Anämie 40 (18.2) 0 (0.0) potentiell kurative, sekundäre Resektion nach dieser Thrombozytopenie 17 (7.7) 1 (2.3) Therapie möglich. Neutropenie 181 (82.3) 7 (15.9) Schlussfolgerung Fiebrige Neutropenie 66 (30.0) 2 (4.5) Bei lokal fortgeschrittenem oder metastasiertem Diarrhoe 45 (20.4) 8 (18.2) Adenokarzinom des Magens oder des ösophagogastralen Übelkeit 35 (15.8) 3 (6.8) Übergangs ist die Kombination von Docetaxel, Cisplatin, Erbrechen 33 (14.9) 4 (9.1) 5-FU und Leukovorin in der Split-dose-Applikation eine Stomatitis 46 (20.8) 0 (0.0) sehr wirksame und hinsichtlich der Toxizität tolerable Sensor. Neuropathie 17 (7.7) 1 (2.3) Chemotherapie. Fatique 47 (21.3) 7 (15.9) Bei lokal fortgeschrittenen und primär irresektablen Stadien war eine erfreulich hohe Rate sekundärer Resektionen mit einer potentiell kurativen Zielstellung möglich. 72 Magenkarzinom Irinotecan Irinotecan Irinotecan wurde bisher in mehreren Phase-II-Studien in Kombination mit Cisplatin untersucht. Es zeigten sich hohe Ansprechraten bei jedoch nicht zu vernachlässigender Toxizität. In einer randomisierten Phase-II-Studie, aus der Zwischenergebnisse von Pozzo vorgestellt wurden, erwies sich der Therapiearm mit Irinotecan/Folinsäure und 5-FUDauerinfusion im Vergleich zu Irinotecan/Cisplatin als viel versprechend. Dieses Regime wird derzeit in einer randomisierten Phase-III-Studie mit einer Cisplatin/5-FU-Kombination verglichen. Irinotecan als Erstlinientherapie beim fortgeschrittenen/metastasierten Magenkarzinom Studie Regime Pat. RR [%] Med. Überleben Shirao, JCO, 1997 Iri (70) d1,15, Cis (80) d1 24 42 Nicht angegeben Boku, JCO, 1999 Iri (70) d1,5, Cis (80) d1 44 48 10,1 Mo. Ajani, Onc Hunt, 2001 Iri (50-65), Cis (30), q1w 25 51 Nicht angegeben Iri (200), Cis (60),d1, q3w 72 28 6,9 Mo. Iri (80), FA (500), FU (2g), q1w 74 34 10,7 Mo. Pozzo, ASCO, 2001 Irinotecan-Mono wöchentlich Wöchentliches Irinotecan. Zweitlinien-Therapie nach Cisplatin-basierter Behandlung, Chun J.H. et al, Jpn J Clin Oncol 2004;34:8-13. Pat. mit metastasiertem Magenkarzinom nach Versagen einer Cisplatin-basierten Chemotherapie erhielten Irinotecan 125 mg/m²/wöchentlich für 4 Wochen, gefolgt von einer 2-WochenTherapiepause bis zur Krankheitsprogression. Ergebnisse Auswertbar waren 37 Pat. Responserate 20%, 23% hatten eine stabile Krankheit, so dass die Tumorkontrollrate knapp 43% betrug. Die Zeit bis zur Progression betrug 2,6 Monate, das Gesamtüberleben 5,2 Monate. Neutropenie und Diarrhoe waren die wesentlichen Toxizitäten. Grad 3-Neutropenie trat bei 43%, Grad 4 bei 23% der Pat. auf, eine Diarrhoe, Grad-3/4 wurde in 19%/0%, Übelkeit Grad-3/4: 19%/0% beobachtet. FOLFIRI beim Magenkarzinom Zweitlinientherapie beim Taxane- und Cisplatin-refraktären metastasierten Magenkarzinom mit modifiziertem FOLFIRI (Kim S.T. et al, Br J Cancer 2005;92:1850-54). In einer Phase-II-Studie wurde die Kombination Irinotecan 150 mg/m² Tag 1, Leukovorin 100 mg/m² Tag 1, 5-FU c.i. 1000 mg/m² Tag 1 und 2 alle 2 Wochen bei Pat. mit Taxane- und Cisplatin-refraktären metastasierten Magenkarzinomen bis zur Progression der Erkrankung gegeben. Die Patienten waren in einem guten Allgemeinzustand. Auswertbar waren 57 Pat. Ergebnisse: Partielle Remission 21%, Stable disease 25%, das entspricht einer Tumorkontrolle von 46%. Das mediane Überleben vom Zeitpunkt des Beginns der Behandlung betrug 7,6 Monate. Grad-3/4-Toxizitäten betrafen Neutro- und Thrombozytopenie. Ein therapiebedingter Todesfall wurde nicht beobachtet. Fazit: Irinotecan hat in beiden Studien eine mäßiggradige Aktivität als Zweitlinienbehandlung beim Cisplatin- oder Taxane-vorbehandelten, metastasierten Magenkarzinom. Die Toxizität wird als geringgradig eingestuft. Studie Futatsuki, Gan To KR, 1994 Lin, ASCO, 2000 Findlay, ASCO, 2001 Baker, ASCO, 2001 Assersohn, Ann Oncol, 2004 Regime Irinotecan 100/m² q1w Irinotecan 125/m² q1w Irinotecan 125/L 20/FU 500 mg/m² Cisplatin 30 mg/m² q1w Irinotecan 50 mg/m² q1w Irinotecan 180mg/L 125/ FU Bolus 400 / FU 48h 1200 mg/m² Pat. 45 22 19 RR [%] 20 14 21 29 31 38 29 Bevacizumab/Cisplatin/Irinotecan Es wurden Ergebnisse einer Phase-II-Studie Shah MA et al. ASCO-Meeting 2006, A4020) beim metastasierten Adenokarzinom des Magens oder des gastroösophagealen Übergangs präsentiert. Die Behandlung bestand aus Bevacizumab 15 mg/kg KG d1, sowie Irinotecan 65 mg/m2 + Cisplatin 30 mg/m2 Tag 1 und 8. Eingeschlossen wurden 47 Pat. Die Zeit bis zur Tumorprogression betrug 8,9 Monate. Die Gesamtansprechrate wurde mit 65% angegeben. Von der Toxizität wurden erwähnt Grade 3/4-Neutropenie 21%, Thromboembolien 25%, gastrointestinale Perforationen 4%. Beachte: Irinotecan ist in Deutschland für die Chemotherapie des Magen-Ca nicht zugelassen (Stand 9/2007). 73 Magenkarzinom Fortgeschrittenes Stadium, Second-line-Therapie Zweitlinien-Behandlung Bei vielen Patienten mit metastasiertem Magenkarzinom besteht bei einer Progression nach der First-lineChemotherapie ein starker Wunsch nach Weiterführung der Therapie. Der Nachweis einer Überlebensverlängerung gegenüber alleiniger symptomatischer Therapie steht bislang jedoch aus, da es bisher keine prospektiv randomisierte Phase-III-Studie zur Zweitlinientherapie des Adenokarzinoms des Magens gibt. Ergebnisse von mehr als 40 publizierten einarmigen Studien zeigten jedoch, dass Patienten, die auf eine Zweitlinientherapie ansprechen, länger leben. Eine Second-line-Therapie kann in 50% der Patienten durchgeführt werden. Die folgenden Substanzen kommen dafür in Abhängigkeit von der Primärtherapie in Betracht: Taxotere, Mitomycin C oder Irinotecan jeweils als Monotherapie oder in Kombination mit 5-FU. Second-line-Chemotherapie bei metastasiertem Magenkarzinom Substanz Taxane Pat. (n) Ansprechrate Literatur Docetaxel 100/m² q3w 25 20% Vanhoefer, ASCO, 1999 Paclitaxel 225mg/m² q3w 36 22% Cascinu, Anticancer Drugs, 1998 Paclitaxel 210mg/m² q3w 31 25% Ohtsu, ASCO, 2000 Paclitaxel 200/m², Carboplatin AUC6 q3w 23 22% Ryoo, ASCO, 2001 Epirubicin 60/m², Docetaxel 75 mg/m² q3w 23 21% André, ASCO, 1999 Irinotecan 100/m² q1w 45 20% Futatsuki, Gan To KR, 1994 Irinotecan 125/m² q1w 22 14% Lin, ASCO, 2000 Irinotecan 125/L 20/FU 500 mg/m² 19 21% Findlay, ASCO, 2001 Irinotecan 50mg/m², Cisplatin 30 mg/m² q1w 29 31% Baker, ASCO, 2001 Irinotecan 180mg/L 125/ FU Bolus 400/FU 48h 1200 mg/m² 38 29 Assersohn, Ann Oncol, 2004 23 26 Kim, Ann Oncol, 2003 Irinotecan Oxaliplatin Oxaliplatin 85mg/L 150/ FU Bolus 400/FU 48h 2400 Beachte Im Gegensatz zu den hier angegebenen Ansprechraten in der Second-line-Therapie sind Irinotecan und Oxaliplatin zur Chemotherapie des Magenkarzinoms in Deutschland nicht zugelassen. Ihre Anwendung muss die Besonderheiten eines Off-label-use berücksichtigen. Zweitlinien-, Drittlinientherapie, Therapiesequenz Wendet man strenge evidenzbasierte Kriterien zur Chemotherapie eines lokal fortgeschrittenen oder metastasierten Magenkarzinoms an, gibt es gut abgesicherte Daten nur für eine Erstlinientherapie, da aussagekräftige Phase-III-Studien für eine Zweitoder Drittlinientherapie fehlen. Dennoch lehrt die tägliche Arbeit, dass ein Teil der Pat. von einer Nachfolgetherapie profitiert. Option I Option II 1. L. ECF oder EOX Gastro-TAX 2. L. Gastro-TAX Epi-XEL 3. L. Mitomycin C Mitomycin C 74 AIO-Therapiestudien Ösophagus- und Magenkarzinome Übersicht der Studien. Details siehe www.aio.portal.de Sprecher der Arbeitsgruppe: PD Dr. Markus Möhler, Medizinische Klinik, Abteilung Gastroenterologie, Universitätsklinik Mainz 55101 Mainz, E-Mail: [email protected] Lokal fortgeschrittenes Plattenepithelkarzinom des Ösophagus – neoadjuvante Radio-/Chemotherapie Neoadjuvante Radio-/Chemotherapie beim lokal fortgeschrittenen Plattenepithelkarzinom des Ösophagus mit wöchentlich Cetuximab plus Oxaliplatin plus kontinuierlich i.v. 5-FU und konventionell fraktionierter externer Mehrfeldbestrahlung bis 45 Gray. Stadium II/III Adenokarzinom des Magens oder gastro-ösophagealen Übergangs – neoadjuvante / perioperative Therapie Multizentrische, offene klinische Phase-II-Studie zur Beurteilung der Sicherheit und Wirksamkeit einer perioperativen Chemotherapie mit Docetaxel, Cisplatin und Capecitabin bei Patienten mit einem Adenokarzinom des Magens und des gastroösophagealen Übergangs GC-DOR-2004: Prospektive, offene multizentrische Phase I/II-Studie zur Bestimmung der Sicherheit und Wirksamkeit einer neoadjuvanten Radio-/Chemotherapie mit Docetaxel und Oxaliplatin bei Patienten mit Adenokarzinomen des gastroösophagealen Übergangs Lokal fortgeschrittenes oder metastasiertes Adenokarzinom des Magens oder gastro-ösophagealen Übergangs – palliative Therapie 1st line Phase-II-Studie mit Docetaxel und Capecitabin als first-line Therapie bei Patienten mit lokal fortgeschrittenem oder metastasiertem Magenkarzinom Eine Phase-II-Studie zur Evaluation der Wirksamkeit von Docetaxel und Oxaliplatin mit Capecitabin (TEX) bei Patienten mit inoperablen oder metastasiertem Magenkarzinom Offene, unkontrollierte Phase-II-Studie zur Überprüfung der Wirksamkeit und Verträglichkeit einer Kombination mit Cisplatin/Docetaxel und Cetuximab bei Patienten mit lokal fortgeschrittenem oder metastasiertem Adenokarzinom des Magens oder gastroösophagalen Übergangs. FLOT65+ – Multizentrische randomisierte Phase-II-Studie zur Therapie des fortgeschrittenen Magenkarzinoms oder Adenokarzinoms des Ösophagogastralen Überganges bei Patienten über 65 Jahre unter besonderer Beachtung der Lebensqualität und des pharmakogenetischen Risikoprofils Prospektive, multizentrische Studie mit 5-FU, Leucovorin, Oxaliplatin und Docetaxel (FLOT) bei Patienten mit lokal fortgeschrittenen, limitiert metastasierten oder diffus metastasierten Adenokarzinomen des Magens und des ösophagogastralen Überganges Lokal fortgeschrittenes oder metastasiertes Adenokarzinom des Magens oder gastro-ösophagealen Übergangs – palliative Therapie 2nd line Sunitinib bei Patienten mit chemorefraktärem metastasiertem Magenkarzinom Geschlossene Studien Randomisierte Phase-III-Studie zur second-line Therapie des metastasierten Magenkarzinoms mit Irinotecan + best supportive care versus best supportive care alleine GC-CIF-2005: Eine offene, unkontrollierte Phase-II-Studie zur Überprüfung der Wirksamkeit und Verträglichkeit von Cetuximab in Kombination mit Irinotecan und 5-FU/FA bei Patienten mit metastasiertem Magenkarzinom Offene multizentrische Phase I/II-Studie zur Therapie von vorbehandelten und nicht vorbehandelten Patienten mit lokal fortgeschrittenem, primär inoperablem und metastasiertem Ösophaguskarzinom mit Paclitaxel und Oxaliplatin 75 Erstlinientherapie CapDoc Trial, Berliner Studie Studientitel Kontrollierte, multizentrische Phase-II-Studie mit Docetaxel und Capecitabin als first-line-Therapie bei Patienten mit lokal fortgeschrittenem oder metastasiertem Magenkarzinom (CapDoc Trial). Studienleitung Dr. med. P. Reichardt, Virchow-Klinikum, Humboldt-Universität, Uni-Klinikum Charité, Campus Berlin Studienzentrale: Universitätsklinikum Charité, Campus Virchow-Klinikum, Humboldt-Universität Berlin Medizinische Klinik m. S. Hämatologie und Onkologie, Augustenburger Platz 1, 13353 Berlin Email: [email protected] Rationale Derzeit gibt es zur first-line-Therapie des metastasierten Magenkarzinoms kein weltweit etabliertes Standardregime. Eine Kombination aus Epirubicin/Cisplatin und 5-FU-Dauerinfusion (ECF) konnte eine Überlegenheit gegenüber bisheriger Regime zeigen, so dass sie als Referenzregime vielfach herangezogen wird. Eigene Vorarbeiten legen den Schluss nahe, dass eine Chemotherapie mit Docetaxel und 5-FU-Dauerinfusion ähnliche Effektivität aufweist wie das Referenzregime ECF. Capecitabin, als oral applizierbares Prodrug von 5-FU, kann eine 5-FU-Dauerinfusion imitieren. Capecitabin konnte als Monotherapeutikum beim Magenkarzinom Ansprechraten von 19-28% zeigen. In der aktuellen Studie wird in der Kombination Docetaxel/5-FU die 5-FU- Dauerinfusion konsequenterweise durch Capecitabin ersetzt mit der Hoffnung, dadurch ein leicht ambulant applizierbares, hochwirksames Therapieregime zu entwickeln. Die Kombination von Docetaxel mit Capecitabin wurde in einer Studie beim Mammakarzinom bereits untersucht und zeigte dort bei guter Verträglichkeit eine sehr hohe antitumorale Wirksamkeit. Studienziele Hauptzielkriterium Ansprechrate. Nebenzielkriterien Medianes Überleben, Zeit bis zur Tumorprogression, Toxizität, Lebensqualität Chemotherapie Capecitabin Docetaxel 2 x 1000mg/m²7d p.o. Tag 1-14, 75 mg/m² 500ml NaCl über 1 Std Tag 1 Wiederholung alle 3 Wochen (Tag 22) Studienmedikation. Capecitabin und Docetaxel werden kostenfrei zur Verfügung gestellt Einschlusskriterien Patienten mit histologisch gesichertem Adeno-Ca des Magens oder Adeno-Ca des gastro-ösophagealen Übergangs Pat. mit Fernmetastasen oder Patienten mit laparoskopisch oder durch Laparotomie gesicherter operativer Inkurabiliät eines lokal fortgeschrittenen Magenkarzinoms (keine kurative Resektion möglich) oder Patienten mit Tumorrezidiv nach Gastrektomie Patienten, die bisher keine palliative Chemotherapie erhalten haben. Eine adjuvante Chemotherapie ist erlaubt Alter mindestens 18 und ≤ 75 Jahre Ausreichende Knochenmarkfunktion definiert als Leukozyten > 3,0 Gpt/l, Thrombozyten > 100 Gpt/l Ausreichende Leberfunktion, definiert als Serumbilirubin < 1,5 mg/dl (1,5 fache der Norm), ALAT und ASAT ≤ 3 fache der Norm Ausreichende Nierenfunktion, definiert als Serumkreatinin < 1,25-fach der oberen Norm, bzw. Kreatinin-Clearence > 60 ml/min berechnet nach Cockroft-Gault Kontrazeption bei Patienten im reproduktiven Alter Karnofsky-Index ≥ 60% Messbare Tumormanifestationen Schriftliches Einverständnis des Patienten Ausschlusskriterien KI 50% oder weniger, Patienten, die bereits eine first-line-Chemotherapie für die palliative Situation erhalten haben. Früherer oder gleichzeitig bestehender Zweittumor (außer Basalzell-Karzinom der Haut oder Carcinoma in situ der Zervix nach adäquater Behandlung), ZNS-Metastasen Parallele Strahlentherapie, Unkontrollierte Infektionen vor Therapiebeginn, Sonstige schwere internistische Begleiterkrankung. Weniger als 2 Wochen zurückliegende größere Operation Parallele Behandlung mit einer weiteren experimentellen Therapie. Chronischer Durchfall, Subileus Chronisch entzündliche Darmerkrankungen oder Darmverschluss. Unfähigkeit orale Medikation einzunehmen Schwangerschaft und Stillzeit 76

