somatropin - PSUSA-2772
Anuncio

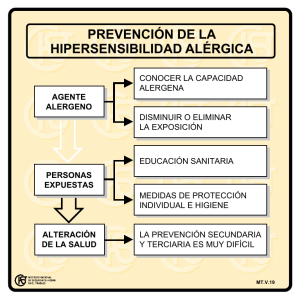
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPS) para la somatropina, las conclusiones científicas del CHMP son las siguientes: Saizen y denominaciones asociadas (Titular de la Autorización de Comercialización (TAC): Merck) En total, el TAC encontró 890 casos de hipersensibilidad. De ellos, 572 se consideró que estaban asociados a una reacción de hipersensibilidad localizada o generalizada. Estas reacciones de hipersensibilidad presentaban principalmente erupción, urticaria, dermatitis, eccema, edema y prurito. Estas reacciones pueden estar localizadas o extenderse fuera de la zona de la inyección. En 42 de los 572 casos (7,3 %), la retirada fue positiva y la reducción de la dosis/ interrupción temporal del tratamiento condujeron a una mejoría o una recuperación total. La reexposicion al tratamiento provocó nuevas reacciones de hipersensibilidad en 13 de los 572 casos (2,3 %). En la mayoría de los casos, las reacciones de hipersensibilidad se desencadenaron rápidamente (entre 0 y 5 días en el 10,3 % de los casos). Humatrope y denominaciones asociadas (TAC: Eli Lilly) En total, el TAC obtuvo 382 casos de hipersensibilidad. De ellos, 114 casos presentaron al menos una posibilidad razonable de relación causal con el tratamiento con somatropina: 1 caso de hipersensibilidad debida al principio activo, 72 casos en los que no se podía distinguir si la reacción adversa se debía al diluyente o al principio activo, y 41 casos donde el diluyente podía ser el agente causal. Ninguno de estos casos fueron mortales y la mayoría de ellos (100 de 114) no eran graves. El único caso de reacción de hipersensibilidad con una relación causal razonable con el principio activo somatropina fue un episodio bien definido que se corresponde con la presentación clínica típica de una reacción de hipersensibilidad de Tipo I. Esta reacción generalizada, que se manifiesta en forma de urticaria, se produjo en cuestión de minutos a horas tras la exposición, y se administró con éxito un tratamiento de desensibilización con hormonas del crecimiento, que también es conforme con un proceso mediado por IgE. Por lo tanto, a la vista de los datos presentados en los IPS revisados, el PRAC consideró que los cambios realizados en la información del producto de los medicamentos Saizen (y denominaciones asociadas) y Humatrope (y denominaciones asociadas) estaban justificados. En el caso de otros medicamentos que contienen somatropina, el PRAC consideró que el riesgo de hipersensibilidad se describe adecuadamente en la información del producto de estos medicamentos. El CHMP está de acuerdo con las conclusiones científicas del PRAC. Motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización De acuerdo con las conclusiones científicas para la somatropina, el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contiene(n) somatropina no se modifica sujeto a los cambios propuestos en la información del producto para los medicamentos anteriormente mencionados. El CHMP recomienda que se modifiquen las condiciones de la(s) autorización(es) de comercialización. Anexo II Modificaciones de la información del producto para el(los) medicamento(s) autorizado(s) por procedimiento nacional Modificaciones que se deben incluir en las secciones relevantes del Resumen de las Características del Producto del medicamento Saizen y denominaciones asociadas (texto nuevo subrayado y en negrita, texto eliminado tachado atravesado con barra) • Sección 4.8 Se deben añadir las siguientes reacciones adversas en el Sistema de clasificación de órganos (SOC, por sus siglas en inglés) «Trastornos del sistema inmunológico», con frecuencia «no conocida»: Reacciones de hipersensibilidad localizadas y generalizadas Modificaciones que se deben incluir en las secciones relevantes del prospecto del medicamento Saizen y denominaciones asociadas (texto nuevo subrayado y en negrita, texto eliminado tachado atravesado con barra) • Sección 4 Posibles efectos adversos Frecuencia no conocida (no puede estimarse a partir de los datos disponibles) Usted (o su hijo) puede presentar reacciones alérgicas debidas al tratamiento con [nombre del producto]. Modificaciones que se deben incluir en las secciones relevantes del Resumen de las Características del Producto del medicamento Humatrope y denominaciones asociadas (texto nuevo subrayado y en negrita, texto eliminado tachado atravesado con barra) • Sección 4.3 Hipersensibilidad al principio activo • Sección 4.8 Hipersensibilidad al principio activo: Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)