DESTILACIÓN DE UN VINO OBJETIVO: FUNDAMENTO TEORICO:
Anuncio

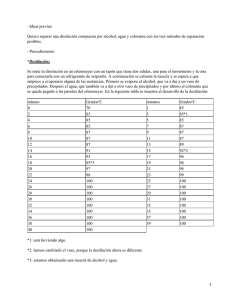
DESTILACIÓN DE UN VINO OBJETIVO: Observar en el vino, la separación del mosto y del alcohol mediante un sistema de refrigeración. FUNDAMENTO TEORICO: La destilación es un método para separar los componentes de una solución. Cada compuesto en estado líquido tiene una temperatura de ebullición que lo caracteriza, esta propiedad se aprovecha para poder separarla de otros compuestos. Los procesos físicos involucrados en la destilación son dos: evaporación y condensación. De esta forma la operación requiere de dos etapas: − El calentamiento inicial de la mezcla hasta lograr el porcentaje de vaporización requerido para separación. − El enfriamiento gradual de los vapores. Se va condensando los vapores a medida que atraviesan el equipo de destilación. La destilación simple es el método que se efectúa normalmente en lo laboratorios. La operación se realiza calentando la mezcla líquida inicial hasta su temperatura de ebullición y retirando continuamente los vapores producidos. A medida que transcurre la operación el líquido se empobrece en componentes más volátiles, elevándose continuamente la temperatura de ebullición de la mezcla. Del mismo modo los vapores producidos son cada vez más pobres en componentes más volátiles y su temperatura de condensación aumenta progresivamente. PROCEDIMIENTO: Con el embudo echamos 80 ml de vino al matraz aforado (que previamente esta sujeto con el soporte de pinzas a la boca del refrigerador). Le colocamos el tapón con el termómetro (no es necesario que el termómetro este en contacto con el vino). Encendemos la malla térmica y vamos midiendo la temperatura cada minuto hasta que termina la destilación del vino. Una vez que se haya producido la ebullición, el alcohol empezara a caer en el baso de precipitados que le hemos puesto al final del refrigerador. Cuando ya tengamos una cantidad superior a 40 ml de alcohol, le añadimos agua hasta llegar a los 80ml. A continuación medimos el grado de alcohol del vino, mediante un barómetro de densidades o alcoholímetro Grado de alcohol: 10º 1 CUESTIONES: 1.− Representar en una gráfica las temperaturas de la disolución frente al tiempo. ¿Se mantiene constante la temperatura de la disolución? A partir de los 86 ºC la temperatura permanece más bien constante, aumentando muy poco a poco, siendo a partir de entonces cuando empieza la destilación y dura más de 60 minutos el proceso hasta que alcanza los 100 ºC. 2.− Anote la densidad de la mezcla hidroalcoholica final obtenida. En función de la tabla y calcule el grado alcohólico. d (g/mL) 0,987 0,985 0,984 0,983 0,982 % Vol 10 11 12 13 14 d (g/mL) 0,981 0,980 0,979 0,977 0,976 % Vol 15 16 17 18 19 d (g/mL) 0,975 0,974 0,973 0,972 0,971 % Vol 20 21 22 23 24 Mi resultado con el densímetro es 0,986, que observando la tabla del laboratorio, se que el grado alcohólico es 10% vol. OBTENCIÓN DEL PLASTICO FORMOL−CASEINA (GALATITA) PROCEDIMIENTO: Lo primero que debemos hacer es aislar la caseína, para ello vertemos 100 ml de leche en un vaso ancho de 250 ml sin dejarla reposar mucho tiempo. Después la calentamos y la añadimos ácido acético diluido gota a gota hasta que no precipite mas mientras agitamos constantemente la disolución. Cuando observemos que se ha formado una gran masa en el fondo del vaso, separamos la caseína con la ayuda de un trapo, quedándonos la caseína en el trapo y en un vaso la disolución. Pasamos la caseína a unos papeles de filtro para que se seque del todo y pasados un par de días la pesaremos ( 8.03 g), sabiendo la densidad de la leche (1,03 g/ml) podremos calcular el porcentaje de caseína en la leche. Si de esta caseína bien seca cogemos un trozo y lo introducimos en un tubo de ensayo con formaldehído en un par de días eliminando el aldehído, obtenemos el polímero Galatita. Volvemos a la disolución que dejamos en el vaso y la añadimos 2,5 g de carbonato de calcio y agitamos (separamos 2 ml de esta para hacer pruebas). Posteriormente calentaremos suavemente y filtraremos al vació para separar las albúminas de carbonato de calcio que aún puedan quedar. Vertemos la disolución en un vaso de 250 ml y calentamos la disolución hasta que solo nos queden unos 20 ml. Una vez realizado esto le añadimos 85 ml de etano al 95%, 0.2g. de carbono activo y lo mezclamos bien todo. Filtramos otra vez al vacio, quedándonos otra disolución transparente, esta la pasamos a un erlenmeyer donde la dejaremos reposar unos días hasta que se formen cristales de lactosa por las paredes del erlenmeyer. Estos cristales los filtramos al vacio y los lavamos con etanol al 25%. Pesamos lo filtrado y vemos que hemos obtenido 1,27 g de lactosa. En un capilar meteremos unos pocos cristales para hallar el punto de fusión que 2 resulta ser cercano a 204ºC, además determinaremos la rotación específica de la lactosa mediante un polarímetro y esta ecuación: D = / (d x C) C = 1,27 / 25 = 0,0508 Los cristales los disolvemos en unos 20 ml de agua, para que esto sea mas rápido los calentamos un poco. Una vez que observamos que no quedan cristales en la disolución, rellenamos el matraz y utilizamos el polarímetro que nos da el valor de : =4 Como conocemos todos los datos, sustituimos y obtenemos el valor de D D = 78.74 ENSAYOS: Detección del almidón Colocamos en un tubo de ensayo unos dos ml de leche, añadimos unas gotas de yodo ,si hubiera almidón se volvería azul. Detección del ácido salicílico Del suero que guardamos después de que precipitase la caseína, colocamos 2 ml en un tubo de ensayo al que añadimos unas gotas de solución de cloruro de hierro (III). Si hubiera salicílico obtendríamos una coloración entre rosa o violeta. Detección del ácido bórico Añadimos a 2ml de leche en un tubo de ensayo tres gotas de fenolftaleina. Después añadimos gota a gota NaOH de una disolución hasta que observamos un cambio de color rosado. Después adicionamos 1ml de glicerina. Si el color rosado desapareciera indicaría que hay acido bórico en la disolución CUESTIONES: 1 si la densidad de la leche es de 1,03 g/ml, calcular el porcentaje de caseína y de lactosa que contiene tu muestra de producto. Como tenemos 100ml de leche, sabemos por su densidad que corresponden a 103g de leche; por tanto: 8.03g de caseina equivalen a: 7.79% 1.27g de lactosa equivalen a: 1.23% 2 Indica la reacción que tiene lugar entre la caseína y formaldehído. ¿Que tipo de polímero obtienes? El carbono del formaldehído sufre un ataque de un centro con densidad electrónica alta de los grupos funcionales de la caseína y después el oxigeno sufre un ataque de un centro de densidad baja. 3 El tipo de polímero es termoestable 3 ¿Por qué es necesario realizar un lavado con agua abundante de la caseína antes de mezclara con el formaldehído? Porque sino se lava, el formaldehído reaccionaria con el ácido 4¿Qué test de los ensayados te han dado positivos y que conclusiones indicarías a partir de ellos? 1 Tiene salicílico 2 Tiene bórico 3 Tiene almidón 5 Dibuja el complejo que se forma al reaccionar el FeCl3 6 ¿porque el ácido bórico presenta un mayor grado de ionización en glicerina que en disolución acuosa? Porque la glicerina es mas apolar que la disolución acuosa y se ioniza mas el ácido bórico PREPARACIÓN DE UN JABÓN Y UN DETERGENTE OBJETIVO: El objetivo de esta práctica es realizar la preparación de un jabón y de un detergente y comparar su comportamiento diferente agua dura debido a su diferente estructura molecular. PROCEDIMIENTO: • Preparación de un jabón. En un vaso de 100ml coloco 20 g de aceite y en otro vaso preparo una disolución con 2 g de NaOH en la mínima cantidad de agua y le añado también 5 ml de etanol a la disolución. Esta disolución se la añado al aceite poco a poco en lo que agito constantemente hasta que se produce la saponificación y se forma una sustancia densa. Paso el jabón a una cápsula de petri donde la dejo secar para luego realizarla una prueba de alcalinidad con un trozo de papel indicador. Si la basicidad es superior a 9 este jabón es demasiado básico para poderlo utilizar. En mi ensayo la medida de pH me dio entre 8 y 9. • Preparación de un detergente. En un vaso de 100ml añado 15 g de dodecanol y 10 ml ácido sulfúrico concentrado. En otro vaso de 100 ml preparo una disolución de 30 ml de NaOH 6 M, a la q la añado 3 gotas de fenolftaleina. Añado muy lentamente y con agitación constante la disolución ácida sobre la básica sin dejar que la mezcla se caliente demasiado. La disolución básica se va poniendo de color rosa y según añado mas ácido se vuelve de color blanco y va espesando, momento en el cual se deja de añadir ácido y filtro al vacío el sólido que he obtenido. Dejo secar al aire un par de días el detergente y le hago una prueba de acidez. Me da el detergente un pH de 2. 4 • Ensayos. 1.− capacidad de formar espumas en distintos tipos de agua. − En agua de grifo y agua destilada, tanto el jabón como el detergente realizaban mucha espuma. − En agua dura el jabón no producía casi espuma y el detergente muy poca espuma. 2.− comprobar la tensión superficial con un capilar. El agua subía mucho por el capilar unos tres centímetros, en cambio con el detergente y el jabón sube como un centímetro por lo que tienen mayor tensión superficial. CUESTIONES 1.− Describir las reacciones que tienen lugar en el proceso de obtención del jabón y el detergente. 5