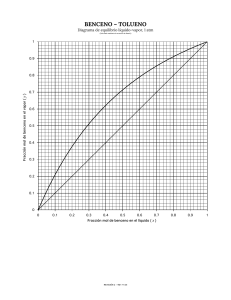
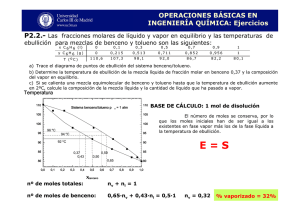
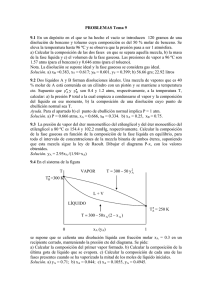
Equilibrio líquido-vapor. Comportamiento ideal. 1. El benceno y el
Anuncio

Equilibrio líquido-vapor. Comportamiento ideal. 1. El benceno y el tolueno forman soluciones casi ideales. A 300 K, P°tolueno= 32.06 mmHg y P°benceno= 103.01 mmHg. a) Calcular la presión de vapor del tolueno en la mezcla variando la fracción molar del tolueno (xtol) desde 0 hasta 1.0, de 0.1 en 0.1 utilizando la ley de Raoult: Ptol = xtol P°tol b) Calcular la presión de vapor del benceno en la mezcla variando la fracción molar del benceno (xben) desde 0 hasta 1.0 , de 0.1 en 0.1 utilizando la ley de Raoult: Pben = xben P°ben c) Hacer la gráfica de Ptol vs xtol d) Hacer la gráfica de Pben vs xben sobre la misma gráfica de Ptol vs xtol observando que xtol+ xben=1 e) Calcular la presión total Ptotal de la mezcla en función de la fracción mol en la fase líquida del tolueno (xtol) f) Demostrar que Ptotal= P°ben+(P°tol-P°ben)xtol g) Sobre la misma gráfica que se está trabajando, graficar Ptotal vs xtol h) En el equilibrio Líquido-Vapor (ELV) representamos a la fracción molar del tolueno líquido con xtol, mientras que a la fracción molar del tolueno en vapor le llamamos ytol, definida como ytol=Ptol/Ptotal. Calcular ytol en todo el intervalo de concentraciones de 0.1 en 0.1 i) Calcular yben en todo el intervalo de concentraciones de 0.1 en 0.1 observando que ytol+yben=1 j) En la misma gráfica que se está trabajando, añadir los puntos correspondientes a Ptotal vs ytol k) Demostrar que l) Despejar x1 de la ecuación del inciso anterior m) Demostrar que