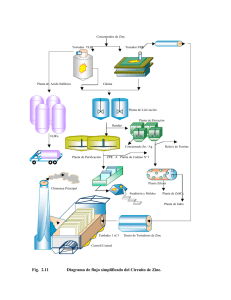
Tesis Electrónicas UACh - Universidad Austral de Chile
Anuncio

Universidad Austral de Chile Facultad de Ciencias de la Ingeniería Escuela de Ingeniería Civil en Obras Civiles “EVALUACIÓN DE LA PROTECCIÓN CATÓDICA DE ACEROS ESTRUCTURALES PARA OBRAS CIVILES MEDIANTE DEPOSICIÓN ELECTROFORÉTICA DE ZINC: CARACTERIZACIÓN FÍSICA Y QUÍMICA DE REVESTIMIENTOS” Tesis para optar al Título de: Ingeniero Civil en Obras Civiles Profesores Patrocinantes: Dr. Héctor Pesenti Pérez. M.Sc. Carlos Cabezas Cuevas. Profesor Informante: M.Sc. Pablo Oyarzún Higuera. PATRICIO NICOLÁS VERA RIVERA VALDIVIA – CHILE 2013 A mi madre, por acompañar y apoyar durante este proceso y en la vida. ÍNDICE CAPÍTULO 1 ....................................................................................................................................................1 INTRODUCCIÓN .............................................................................................................................................1 1.1 PLANTEAMIENTO DEL PROBLEMA ...........................................................................................................1 1.2 OBJETIVOS ................................................................................................................................................3 1.2.1 Objetivo General ..............................................................................................................................3 1.2.2 Objetivos Específicos........................................................................................................................3 CAPÍTULO 2 ....................................................................................................................................................4 DESARROLLO TEÓRICO ..................................................................................................................................4 2.1 DEFINICIÓN DE DEPOSICIÓN ELECTROFORÉTICA .....................................................................................4 2.2 ANTECEDENTES HISTÓRICOS DE LA EPD ..................................................................................................5 2.3 DESCRIPCIÓN DEL PROCESO DE EPD ........................................................................................................5 2.4 FORMACIÓN DE PELÍCULAS ......................................................................................................................6 2.5 CONSOLIDACIÓN DE LAS PARTÍCULAS .....................................................................................................7 2.6 APLICACIONES DE LA EPD EN LA ACTUALIDAD ........................................................................................9 2.7 IMPORTANCIA DEL USO DEL ACERO EN INGENIERÍA CIVIL ....................................................................11 2.8 LA CORROSIÓN COMO PROBLEMA EN LAS OBRAS CIVILES ...................................................................12 2.9 GALVANIZADO EN CALIENTE COMO PROTECCIÓN CONTRA LA CORROSIÓN DEL ACERO .....................13 2.10 PROCESO INDUSTRIAL DE GALVANIZADO ............................................................................................14 2.11 TÉCNICAS DE CARACTERIZACIÓN .........................................................................................................15 2.11.1 Verificación de adherencia de los revestimientos .......................................................................15 2.11.2 Rugosidad .....................................................................................................................................16 2.11.3 Microscopía Electrónica de Barrido (MEB) y Espectroscopia de Energía Dispersiva (EDS) .........18 2.11.4 Microdureza .................................................................................................................................19 2.11.5 Electroquímica .............................................................................................................................20 2.11.5.1 Potenciales de electrodo .......................................................................................................20 2.11.5.2 Potencial del electrodo..........................................................................................................21 2.11.5.3 Electrodo estándar de hidrógeno ..........................................................................................23 2.11.5.4 Otros electrodos de referencia .............................................................................................25 2.11.5.5 Celdas electroquímicas ..........................................................................................................26 2.11.5.6 Potencial de equilibrio ...........................................................................................................28 2.11.5.7 Protección electroquímica ....................................................................................................30 2.11.5.7.1 Protección catódica ........................................................................................................30 2.11.5.7.2 Pasivación o protección anódica ....................................................................................31 2.11.5.8 Cinética de electrodo.............................................................................................................31 2.11.5.9 Curvas de polarización anódica y catódica ............................................................................32 2.11.5.9.1 Curvas de polarización anódica ......................................................................................32 2.11.5.9.2 Curvas de polarización catódica .....................................................................................33 2.11.5.9.2.1 Determinación de las curvas de polarización...........................................................33 2.11.5.9.2.2 Utilización de potenciostatos ...................................................................................34 2.11.5.10 Técnicas electroquímicas utilizadas ....................................................................................35 2.11.5.10.1 Evolución del potencial del electrodo a circuito abierto .............................................35 2.11.5.10.2 Evolución de la corriente en el tiempo a potencial constante para evaluar la carga eléctrica transferida en el proceso de degradación del sólido: Me(s) → Me(ac)n+ + ne- ...............35 2.11.5.10.3 Barrido de potencial anódico para visualizar la forma como se degrada el sólido, intentando discriminar entre la oxidación del Zn y la del Fe .....................................................36 2.11.6 Espectrometría de absorción atómica (AAS) ...............................................................................36 2.11.6.1 Técnica de atomización de la muestra ..................................................................................36 2.11.6.2 Instrumentación para absorción atómica .............................................................................36 2.11.6.3 Aplicaciones de la espectrometría de absorción atómica.....................................................37 CAPÍTULO 3 ..................................................................................................................................................38 DESARROLLO EXPERIMENTAL .....................................................................................................................38 3.1 MATERIALES Y EQUIPOS .........................................................................................................................38 3.1.1 Elección del acero estructural ........................................................................................................38 3.1.2 Equipos utilizados en la obtención de los revestimientos .............................................................39 3.1.3 Materiales usados en la preparación de las suspensiones ............................................................39 3.1.4 Implementación utilizada para efectuar el proceso térmico de los revestimiento…………………….40 3.1.5 Equipos utilizados en los ensayos electroquímicos .......................................................................41 3.1.6 Análisis de los iones metálicos .......................................................................................................43 3.1.7 Microscopía Electrónica de Barrido (MEB) ....................................................................................44 3.1.8 Microdureza Vickers.......................................................................................................................44 3.1.9 Rugosidad .......................................................................................................................................45 3.1.10 Probetas galvanizadas en caliente ...............................................................................................45 3.2 PROCEDIMIENTO EXPERIMENTAL ..........................................................................................................46 3.2.1 Preparación de probetas ................................................................................................................46 3.2.2 Preparación de las suspensiones ...................................................................................................46 3.2.3 Obtención de los revestimientos ...................................................................................................47 3.2.4 Selección de los parámetros operacionales ...................................................................................48 3.2.5 Técnicas de análisis ........................................................................................................................49 3.2.5.1 Verificación de adherencia ......................................................................................................49 3.2.5.2 Medición de rugosidad ............................................................................................................49 3.2.5.3 Microscopía electrónica de barrido (MEB) y Espectroscopía de Energía Dispersiva (EDS) .....49 3.2.5.4 Microdureza Vickers ................................................................................................................49 3.2.5.5 Evaluación electroquímica de los revestimientos ...................................................................49 3.2.5.5.1 Configuración de la celda electroquímica.........................................................................50 3.2.5.6 Química de las soluciones obtenidas en los test electroquímica ............................................50 3.2.6 Caracterización de revestimientos de zinc obtenidos por galvanizado en caliente ......................51 3.2.7 Espesores de las Probetas ensayadas ............................................................................................51 CAPÍTULO 4 ..................................................................................................................................................52 DISCUSIÓN DE RESULTADOS .......................................................................................................................52 4.1 OBTENCIÓN DE LOS REVESTIMIENTOS DE ZINC MEDIANTE EPD ...........................................................52 4.2 TRATAMIENTO TÉRMICO DE LOS REVESTIMIENTOS EN VERDE .............................................................53 4.3 VALORES DE LOS REVESTIMIENTOS OBTENIDOS MEDIANTE EPD .........................................................53 4.4 CARACTERIZACION DE LOS REVESTIMIENTOS DE ZINC OBTENIDOS......................................................56 4.4.1 Verificación de adherencia.............................................................................................................57 4.4.2 Medición de Rugosidad ..................................................................................................................57 4.4.3 Microscopía Electrónica de Barrido (MEB) y Espectroscopía de Energía Dispersiva (EDS) ...........57 4.4.4 Medición de Microdureza Vickers .................................................................................................60 4.4.5 Evaluación electroquímica de las muestras ...................................................................................60 4.4.5.1 Evolución del potencial a circuito abierto ...............................................................................60 4.4.5.2 Determinación de carga a potencial constante.......................................................................61 4.4.5.3 Evolución de la transferencia de carga por polarización anódica ...........................................62 4.4.6 Análisis de las soluciones utilizadas en electroquímica AAS ..........................................................63 4.4.7 MEB de una muestra posterior al análisis electroquímico ............................................................64 4.5 COMPARACIÓN DE REVESTIMIENTOS OBTENIDOS MEDIANTE EPD Y GALVANIZADO .........................67 4.5.1 Medición de rugosidad ..................................................................................................................67 4.5.2 Microscopía Electrónica de Barrido (MEB) de GC y DE ..................................................................68 4.5.3 Medición de Microdureza Vickers .................................................................................................69 4.5.4 Evaluación electroquímica de las muestras ...................................................................................69 4.5.4.1 Evolución del potencial a circuito abierto ...............................................................................69 4.5.4.2 Determinación de carga a potencial constante.......................................................................70 4.5.4.3 Evolución de la transferencia de carga por polarización anódica ...........................................71 4.5.4.4 Análisis mediante AAS de las soluciones resultantes de la polarización anódica ...................72 4.5.4.5 MEB de muestras posterior a la polarización anódica ............................................................73 CAPÍTULO 5 ..................................................................................................................................................75 CONCLUSIONES ............................................................................................................................................75 REFERENCIAS ...............................................................................................................................................77 ANEXOS ........................................................................................................................................................81 ANEXO 1: Resultados Preliminares de Deposición.......................................................................................82 ANEXO 1 (continuación) ...............................................................................................................................83 ANEXO 2: Tiempo y espesores de los revestimientos estudiados ...............................................................84 ANEXO 3: Pruebas electroquímicas..............................................................................................................85 INDICE DE FIGURAS Figura 2.1. Representación esquemática de la celda de EPD.…………………………………....................................4 Figura 2.2. Deposición de partículas en el electrodo.....................................................................................6 Figura 2.3. Fabricación de revestimientos obtenidos mediante EPD............................................................7 Figura 2.4. Procesos de sinterizado: (a) partículas compactadas y (b) producto sinterizado….……………......9 Figura 2.5. Obra civil de estructuras metálicas de acero.............................................................................12 Figura 2.6. Elemento estructural dañado por la corrosión..........................................................................13 Figura 2.7. Elementos estructurales de acero galvanizados en caliente.....................................................14 Figura 2.8. Esquema del proceso de galvanizado........................................................................................15 Figura 2.9. Imagen de un revestimientos de zinc luego de efectuar la prueba de adherencia con un cuchillo……………………………………………................................................................................................16 Figura 2.10. Esquema de la superficie nominal utilizada en las dos definiciones de rugosidad superficial..…………………………………………………………………………………………………………………………………..17 Figura 2.11. Esquema de la impronta del ensayo de dureza Vickers.……………………………………..................19 Figura 2.12. Experiencia electroquímica en la que se sumerge un metal Me en una solución 1 M de iones Me+……………………………………….……………………………………………………………………………………………..........20 Figura 2.13. Dos posibles mediciones electroquímicas...............................................................................22 Figura 2.14. Celda electroquímica Fe/Fe2+ (1 M)//Zn/Zn2+(1M) …............................................................26 Figura 2.15. Reacciones termodinámicas posibles y especies estables en función del potencial del electrodo respecto del de equilibrio.................................................................................................29 Figura 2.16. Protección catódica de un ducto de acero subterráneo..........................................................30 Figura 2.17. Representación esquemática de los diferentes procesos observables durante la polarización anódica de los metales......................................................................................................................32 Figura 2.18. Esquema del funcionamiento de un potenciostato.……………………….......................................34 Figura 2.19. Componentes de diversos tipos de instrumentos para espectroscopía de absorción............37 Figura 3.1. Fuente de poder e implementos utilizados...............................................................................39 Figura 3.2. Morfología de polvos de zinc marca Aldrich de granulometría < 10 µm, 30000X…………………..40 Figura 3.3. Horno utilizado en el procedimiento térmico..………………………………………………………………………41 Figura 3.4 Celda electroquímica configurada para las mediciones…………………………..................................42 Figura 3.5. Electrodos utilizados: (a) electrodo de trabajo y (b) electrodo de referencia...........................42 Figura 3.6. Equipo utilizado en electroquímica. Se observa el potenciostato/galvanostato y la celda electroquímica.……………………………………………...................................................................................43 Figura 3.7. Espectrofotómetro Thermo Scientific modelo ICE 3000...........................................................43 Figura 3.8. Microscopio Electrónico de Barrido ZEISS modelo LEO 420.....................................................44 Figura 3.9. Microdurómetro Struers modelo Duramin.…………...................................................................45 Figura 3.10. Esquema del procedimiento experimental del proceso de EPD de zinc.……………...................46 Figura 3.11. Celda electroforética y distancia entre electrodos.…………………….......................................... 48 Figura 4.1. Cantidad de masa depositada en función del voltaje a diferentes tiempo de proceso.............54 Figura 4.2. Espesores de los depósitos en función del voltaje a diferentes tiempo de proceso.………….....54 Figura 4.3. Cantidad de masa depositada aplicando un voltaje de 100 V...................................................55 Figura 4.4. Espesores de los depósitos aplicando un voltaje de 100 V........................................................56 Figura 4.5. Imágenes de revestimientos obtenidos por EPD: (a) DE5 y (b) DE20.…....................................56 Figura 4.6. Imágenes de los depósitos de zinc a 500X, utilizando como medio de dispersión isopropanol: (a) DE5 y (b) DE20.……………...............................................................................................................58 Figura 4.7. Imágenes de los depósitos utilizando como medio de dispersión isopropanol a 30000X: (a) DE5 y (b) DE20.………….………………………………………………………………...............................................59 Figura 4.8. Comportamiento de DE5, DE20 y SR en el tiempo bajo un sobrepotencial de 60 mV..............61 Figura 4.9. Curvas de polarización para DE5, DE20 y SR..............................................................................62 Figura 4.10. Imágenes de la muestra DE5: (a) antes y b) después de aplicado el sobrepotencial.…...........64 Figura 4.11. Imágenes de la muestra DE20: (a) antes y b) después de aplicado el sobrepotencial............65 Figura 4.12. Imágenes a 1500X de los revestimientos de zinc luego de efectuado el ataque en ambiente salino: a) DE5 y b) DE20.....................................................................................................................65 Figura 4.13. Imágenes a 1500X del revestimiento DE20: (a) zona revestida con zinc y (b) zona dañada luego del ataque corrosivo.………………..............................................................................................66 Figura 4.14. Imágenes de revestimientos de zinc: (a) DE20 y (b) GC.……....................................................67 Figura 4.15. Imágenes a 1500X de revestimientos de zinc: (a) DE20 y (b) GC.………….................................68 Figura 4.16. Comportamiento de DE20, GC y SR en el tiempo bajo un sobrepotencial de 60 mV..............70 Figura 4.17. Curvas de polarización para las muestras DE20, GC y SR........................................................71 Figura 4.18. Imágenes de DE5: a) antes de efectuar el procedimiento y b) después de realizar la medición ……………………………………………………………………………………………………………………………….......................73 Figura 4.19. Imágenes de GC: a) antes y b) después del procedimiento de medición...............................73 Figura 4.20. Imágenes a 1500X de los revestimientos de zinc luego de efectuado el ataque en ambiente salino: a) DE5 y b) GC........................................................................................................................74 INDICE DE TABLAS Tabla 2.1. Valores del potencial normal de algunos electrodos..................................................................24 Tabla 2.2. Potenciales de electrodos de referencia respecto del electrodo normal hidrógeno……………….25 Tabla 3.1. Denominaciones y espesores de las probetas analizadas.…………...............................................51 Tabla 4.1. Componentes y parámetros utilizados en la suspensión que entregó mejores depósitos ………53 Tabla 4.2. Efectos del tratamiento térmico en la calidad de los revestimientos de zinc.............................53 Tabla 4.3. Valores de la medición de rugosidad para DE5, DE20 y SR.........................................................57 Tabla 4.4. Peso de los elementos en porcentaje luego de realizar el análisis elemental EDS.....................60 Tabla 4.5. Valores de microdureza Vickers para: DE5, DE20 y SR............................................................... 60 Tabla 4.6. Concentraciones de los elementos presentes en las soluciones de NaCl donde se efectuaron las mediciones electroquímicas....................................................................................................................... 64 Tabla 4.7. Análisis elemental de la muestra DE20: (a) zona revestida con zinc y (b) zona dañada luego del ataque corrosivo…….……………………………………………………………..........................................................67 Tabla 4.8. Comparación de rugosidad para DE20, GC y SR.……………...........................................................68 Tabla 4.9. Valores de microdureza Vickers para DE20, GC y SR..................................................................69 Tabla 4.10. Concentraciones de los elementos presentes en las soluciones de NaCl 3.5 % p/v luego de la aplicación de +60 mV de sobrepotencial durante 30 minutos....................................................................73 RESUMEN Los ambientes corrosivos determinan fuertemente el comportamiento de los materiales en sus diferentes aplicaciones en las obras civiles, especialmente en aquellas zonas cercanas a las costas marinas o estructuras bajo agresivos ambientes químicos. Por ello, es necesario buscar medios anticorrosivos más económicos y permanentes, es decir, protecciones superficiales más eficientes, de bajo costo de operación y amigables ambientalmente. En relación a lo anterior, la deposición electroforética es un interesante candidato, que está siendo utilizado en múltiples e innovadoras aplicaciones, especialmente en la generación de recubrimientos en la industria cerámica y automovilística. En estos últimos años, ha ido en aumento el interés industrial y científico, no sólo por su uso decorativo, sino por la relación que existe entre eficiencia y costo. La Deposición Electroforética (EPD) es un proceso que utiliza las propiedades electrostáticas de las partículas en dispersión coloidal dentro de un campo eléctrico, para depositar un sustrato homogéneo, que posteriormente se consolida térmicamente a temperaturas muy inferiores al punto de fusión del material depositado, lo que resulta una capa con muy buenas propiedades químicas, mecánicas y superficiales. Por lo tanto, proteger catódicamente aceros usados comúnmente en obras civiles mediante el proceso de Deposición Electroforética de zinc, es un importante desafío tecnológico. Mediante esta tesis se logró evaluar la posibilidad de usar la EPD como proceso de protección ante la corrosión y, asimismo, comparar sus propiedades físicas y químicas con recubrimientos obtenidos por el tradicional método de galvanizado en caliente. Ante esta posibilidad, es aceptable indicar que la deposición electroforética de polvos de zinc sobre acero SAE 1045 fue realizada utilizando como medios de suspensión agua, isopropanol y etanol. Se eligió la solución que entregó los resultados más favorables en cuanto a homogeneidad del revestimiento obtenido, junto con los valores de espesores y masas. Del mismo modo, a cada uno de los recubrimientos obtenidos se les efectuó un tratamiento térmico, para consolidar las partículas en la superficie de las probetas y mejorar las características mecánicas de los depósitos. Luego de efectuar las respectivas caracterizaciones de los sustratos: morfológica, mecánica, química y electroquímica en un ambiente salino, se ha podido probar que la dispersión del Zn en Isopropanol es eficiente para el proceso de EPD y para los objetivos de este estudio. En el tratamiento térmico de Zn fue posible visualizar una excelente adherencia en el acero SAE 1045, a pesar de no obtenerse una sinterización de las partículas entre ellas y sobre la superficie del material. Dicha adherencia podría atribuirse a la formación de nanoagujas de óxido de zinc, que se entrelazan en diferentes direcciones, enganchándose entre partículas y a la superficie del material. Este mecanismo de unión superficie-partícula-partícula, por lo visto mediante métodos electroquímicos, presenta una adecuada respuesta en ambiente salino, teniendo un excelente comportamiento anódico, similar a las condiciones de los revestimientos galvánicos comerciales. Debido a todo ésto, es factible mencionar que el método de EPD de Zn se presenta como un interesante candidato a proteger contra la corrosión aceros comúnmente usados en obras civiles. ABSTRACT Constantly, corrosive environments influence the behavior of materials in civil works; mainly these are strongly affected in areas close to the seashore or under chemically aggressive environments. It is therefore necessary to explore alternative methods of permanent superficial protection which has low operating cost and more environmentally friendly. For this reason, the electrophoretic deposition (EPD) is an interesting candidate for superficial protection of civil engineering materials. This method is being used in many innovative applications such as in ceramic coatings and automotive industry. In recent years, EPD has had increasing scientific and technological interest, not only for decorative applications but by the relationship of also its high efficiency and low cost technique. Electrophoretic deposition (EPD) is a method that uses the electrostatic properties of colloidal dispersion of particles within an electric field, to deposit in an electrode or a material a homogeneous substrate. Posteriorly, this deposited substrate (particles) is thermally consolidated at temperatures below the melting point of the deposited particles. Such deposition technique results in a layer with good chemical, mechanical and superficial properties. The technological challenge is how to give cathodic protection to steels commonly used in civil works by electrophoretic deposition of zinc. In this study, we evaluate the cathodic protection by EPD method, as well as compare their physical and chemical properties with coatings obtained by the conventional method of hot-dip galvanization. According to the experimental study, the electrophoretic deposition of zinc powder on SAE 1045 steel was made carried out using three suspensions: water, ethanol, and isopropanol. The isopropanol based suspension was found to be the last most favorable, in terms of uniformity of the coatings obtained as well as mass. Each green coating was thermally treated to consolidate the particles on the surface of the specimens and to improve the mechanical properties of the deposits. According to the morphological, mechanical, chemical and electrochemical characterization of the substrates in saline environments, has been proven that the dispersion of Zn in Isopropanol is effective for the EPD process which is the objective of this study. After the heat treatment of the Zn particles, it was possible to observe an excellent adhesion on the SAE 1045 steel surface, in spite of the fact that sintering of the particles had not occurred between them and the surface of the material. This can be attributed to the presence of zinc oxide nanoneedles obtained during the thermal process, which are interwoven in different directions, hooking between particles and the surface of the material. These binding mechanisms between particle-particle-surface, apparently by electrochemical methods in the saline environment, show an adequate response having excellent anodic behavior, similar to the conditions of commercial galvanic coatings. Therefore, it is possible to state that the Zn EPD method which is presented in this work is an interesting candidate to protect against corrosion of steels commonly used in civil works. CAPÍTULO 1 INTRODUCCIÓN 1.1 PLANTEAMIENTO DEL PROBLEMA Por años se ha observado que las estructuras metálicas en las obras civiles sufren daños irreparables provocados por la agresiva acción del ambiente. Esta natural acción, de retornar desde su estado metaestable a un estado estable de los materiales, es la denominada “Corrosión”, que se ha definido como la “antimetalurgia” de metales y aleaciones en su desempeño tecnológico. De hecho, este fenómeno causa significativos problemas económicos a nivel mundial, donde Chile no está excluído de esta dificultad. Sin embargo, existen varias formas y procedimientos para controlar o prevenir la acción directa de la naturaleza o del ambiente en que está sometido el material. Por ésto, el estudio del fenómeno de corrosión en los materiales es muy importante, para no actuar en forma negligente en la determinación original de cómo deben protegerse los metales y aleaciones. Actualmente, las estructuras civiles tienen la gran necesidad de buscar medios anticorrosivos más económicos y permanentes, ésto quiere decir, protecciones superficiales más eficientes y de bajo costo de operación. Con respecto a estos conceptos se relacionan directamente al mantenimiento y el reemplazo de elementos metálicos estructurales dañados por el desempeño tecnológico. Sin embargo, los ambientes corrosivos determinan fuertemente el comportamiento de los materiales en las diferentes aplicaciones de las obras civiles, 1 especialmente en aquellas zonas cercanas a las costas marinas, lo que hace necesario generar soluciones eficientes, económicas, cero efectos contaminantes y que sean durables en el tiempo, para así asegurar la eficiente operatividad del proyecto y el desempeño tecnológico de las construcciones. Se ha observado claramente que el fenómeno de la corrosión no es asumido inmediatamente en los procesos de diseño de la obra, sino que ocurre cuando las propiedades mecánicas de los materiales, en su desempeño tecnológico, son afectadas. En este mismo sentido, acarrea múltiples problemas vinculados a la seguridad civil y a la desvalorización de los bienes públicos y privados. Antes de esta situación, existen múltiples formas de proteger al acero frente al fenómeno de la corrosión. Sin embargo, la correcta elección de un sistema de protección dependerá de factores como el costo de inversión inicial, tiempo para el primer mantenimiento, vida útil del proyecto, entre otras (Bbosch 1, 2012). Los recubrimientos protectores son una barrera que evita el contacto del acero con el medio corrosivo. En este sentido existen varias alternativas: procedimientos mecánicos, pinturas y recubrimientos metálicos como el galvanizado, que pueden entregar una excelente protección del tipo catódica o de sacrificio al acero (Bbosch1, 2012). El galvanizado por inmersión en caliente y el electrolítico, son las dos formas de protección más utilizadas y de mayor demanda actualmente en nuestro país y el mundo. Son procesos no complejos, de bajo costo de operación y bastantes efectivos. Sin embargo, causan problemas, como la deformación térmica del acero sometido a temperatura de proceso (445 a 465oC) y el manejo de reactivos de alta peligrosidad para la salud laboral, que los hacen ser cuestionables técnicamente. Entre los más importantes dilemas, para ambos procedimientos, son los problemas dimensionales en los bordes de las piezas o estructuras y la emanación de vapores metálicos y gases, que los hacen ser no muy amigables con el entorno, tanto en lo laboral como ambiental. Con referencia a lo expuesto, se intenta mediante esta propuesta de trabajo, buscar una alternativa de protección para el acero estructural más eficiente y amigable con el medio ambiente, mediante la deposición electroforética de partículas de zinc y posterior sinterizado, 2 para formar una película delgada que cumplirá el propósito de controlar el deterioro ambiental en obras civiles. 1.2 OBJETIVOS 1.2.1 Objetivo General Estudiar la factibilidad de proteger catódicamente Aceros Estructurales de Obras Civiles en ambiente salino mediante la Deposición Electroforética de Zinc. 1.2.2 Objetivos Específicos Desarrollar revestimientos de zinc a través de deposición electroforética sobre probetas de acero estructural. Evaluar el comportamiento de los revestimientos de zinc, utilizando técnicas electroquímicas, de manera de simular un ambiente salino semejante al agua de mar. Caracterizar los revestimientos obtenidos mediante instrumental analítico: química elemental, microscopía electrónica de barrido (MEB), medición de microdureza Vickers y rugosidad superficial. Comparar la deposición electroforética de revestimientos de Zinc con el galvanizado en caliente utilizado comercialmente en Chile. 3 CAPÍTULO 2 DESARROLLO TEÓRICO 2.1 DEFINICIÓN DE DEPOSICIÓN ELECTROFORÉTICA La Deposición Electroforética (Electrophoretic Deposition, EPD) es el proceso mediante el cual se procede a cargar bajo un campo eléctrico partículas en suspensión, las que son dirigidas o depositadas en unos de los electrodos con carga opuesta. Las partículas se mueven y se aglomeran formando una densa capa en el electrodo (Hashaikeh, R. 2000), figura 2.1. Figura 2.1. Representación esquemática de la celda de EPD (Hashaikeh, R.. 2000). 4 2.2 ANTECEDENTES HISTÓRICOS DE LA EPD La deposición electroforética se conoce desde el año 1808. En aquella época el científico ruso Ruess, observó que la presencia de un campo eléctrico inducido provocaba el movimiento de partículas de arcilla en el agua. Sin embargo, la primera utilización práctica de la técnica se produjo en 1933. En ese año se realizó la deposición de partículas de torio sobre un cátodo de platino (Besra, L. et al. 2007). Los principios fundamentales relacionados con la EPD son bastantes conocidos. Estos han sido objeto de amplias investigaciones teóricas y experimentales. Pese a ésto, la EPD de partículas de cerámica fue estudiada por primera vez por Hamaker (1940), pero sólo en la década de 1980 el proceso fue considerado en el área de las cerámicas avanzadas. En la actualidad existe acuerdo en la comunidad científica de impulsar la investigación y desarrollo para lograr la comprensión cuantitativa e íntegra de los diferentes mecanismos que fundamentan la EPD. De este modo se obtendría la optimización de los parámetros de trabajo, para así poder dar a la EPD una utilización más amplia en lo que es el procesamiento de materiales (Besra, L. et al. 2007). Tecnológicamente, en la actualidad la EPD está siendo utilizada en revestimientos poliméricos (pinturas y pigmentos), cerámicos (alúmina, magnesita, etc.) y metales (aluminio de alta resistencia, titanio, etc.), ya sea, para la industria aeronáutica, automotriz, u otras, que paulatinamente hacen que este proceso se extienda gracias a su bajo costo de operación y nulos efectos contaminantes, lo que la hacen ser un proceso candidato para mejorar la eficiencia en la protección de materiales. 2.3 DESCRIPCIÓN DEL PROCESO DE EPD En la EPD intervienen dos procesos: la electrofóresis y la deposición (Vargas, G. et al. 2003). La electrofóresis es un fenómeno asociado al movimiento de partículas, que tiene lugar al aplicar un campo eléctrico a una suspensión coloidal estable. Este fenómeno está directamente relacionado con las propiedades electroquímicas superficiales que adquieren las partículas cuando se hallan inmersas en un medio líquido dispersas (Ferrari, B. et al. 1998). El segundo proceso que tiene lugar, es la deposición de partículas sobre el electrodo de trabajo formando un cuerpo en verde relativamente compacto (Sarkar, P. et al. 1996). 5 La EPD es un proceso de dispersión coloidal confiable y de bajo costo, que puede ser utilizado para adherir polvos de cualquier metal submicrónicos y cerámicos como capas delgadas de película y revestimiento (Randall, C. A. et al. 2000). En la EPD, las partículas suspendidas son afectadas por un campo eléctrico. Estas adquieren una carga electrostática, que dependerá de las propiedades del solvente. La aplicación de un campo eléctrico a la suspensión facilita que las partículas cargadas migren hacia el electrodo opuestamente cargado (Randall, C. A. et al. 2000), figura 2.2. Figura 2.2. Deposición de partículas en el electrodo (Randall, C. A. et al.. 2000). 2.4 FORMACIÓN DE PELÍCULAS Existen tres pasos básicos para la formación de una película densa cuando se usa la EPD. El primero y más crítico de los pasos es la creación de una suspensión estable, cargada, no acuosa de partículas para ser depositadas. Normalmente, el solvente para suspensión debe ser distinto al agua, ya que, a voltajes de deposición superiores a 3 o 4 Volts, ésta se electroliza, produciendo burbujas de hidrógeno u oxígeno, las cuales desestabilizan la continuidad de la deposición. Consecutivamente, el segundo paso es la deposición de las partículas. Las partículas son afectadas por un campo eléctrico, por los gradientes de composición química, la convección electrohidrodinámica y gravitacional de la suspensión y, por último, la resistividad de la deposición a medida que ésta se forma. Finalmente, la deposición es sustraída del solvente, 6 secada y sinterizada hasta alcanzar su densidad final (figura 2.3). El secado y el sinterizado son mencionados conjuntamente, pues ambos son principales generadores de tensiones laterales en la deposición, hecho que puede llevar a la fractura de la deposición (Randall, C. A. 2000). Figura 2.3. Fabricación de revestimientos obtenidos mediante EPD 2.5 CONSOLIDACIÓN DE LAS PARTÍCULAS De acuerdo a Groover (1997), el sinterizado o consolidación es una operación de tratamiento térmico que se ejecuta sobre el compactado para unir partículas metálicas, incrementando de esta manera su fuerza y resistencia. El tratamiento se lleva a cabo generalmente a temperaturas entre 0.7 y 0.9 del punto de fusión del metal. El término sinterizado en estado sólido es usado algunas veces para indicar el sinterizado convencional, debido a que el metal permanece sin fundir a la temperatura del tratamiento. 7 Aunque los métodos de fusión y colado son muy frecuentes para muchos materiales manufacturados, los puntos de fusión de muchos cerámicos y de algunos materiales metálicos son demasiado altos para procesarlos por métodos convencionales. La sinterización es un tratamiento de alta temperatura que hace que se unan las partículas sin pasar a la temperatura de fusión, reduciendo en forma gradual el volumen o porosidad de un material. La sinterización es un paso frecuente en la fabricación de componentes cerámicas de alta temperatura de fusión o materiales refractarios (por ejemplo, alúmina, titanato de bario, etc.), así como en la producción de partes metálicas en la llamada área de la “Metalurgia de Polvos” o “Pulvimetalurgia”, una ruta de procesamiento en la cual los polvos metálicos se prensan (verde) y sinterizan formando componentes densos y/o monolíticos (Askeland, D. R.. 2004). Mediante esta técnica, se produce una variedad de materiales compuestos, como carburo de tungsteno-cobalto para herramientas de corte, superaleaciones, etc. En la sinterización, cuando las partículas tienen mayor área expuesta o más fina, hay mayor cantidad de átomos o iones en la superficie activos. El resultado de ésto es que el conjunto de partículas finas de una determinada masa tiene una mayor energía de cohesión cuando se forma la unión de las partículas. En consecuencia, la fuerza impulsora del sinterizado en los metales y los cerámicos en estado sólido es la superficie total de las partículas del polvo. Debido a ésto, cuando un material pulverizado se compacta, las partículas de polvo están en contacto mutuo, y entre ellas generalmente existen apreciables espacios denominados poros. Para reducir la energía total del material, los átomos se difunden hacia los puntos de contacto y permiten que las partículas se adhieran entre sí, resultando finalmente que los poros se contraen. De hecho el transporte de los átomos o iones entre las partículas hacia la región del cuello causa la densificación. Sin embargo, la difusión en la superficie, la difusión en fase gas o vapor y la difusión reticular desde superficies curvas hacia la zona del cuello entre partículas no producen densificación. Por lo tanto, si el sinterizado se hace durante un largo período de tiempo, se pueden paulatinamente eliminar los poros, generando un material más denso (figura 2.4). 8 (a) (b) Figura 2.4. Proceso de sinterizado: (a) partículas compactadas y (b) producto sinterizado (Askeland, D. R. et al. 2004) El grado y la velocidad de sinterización depende de: a) la densidad inicial de los consolidados, b) la temperatura, c) el tiempo, d) el mecanismo de sinterización, e) el tamaño promedio de partícula y f) la distribución de tamaños de partículas de polvo. En algunos casos, se forma una fase líquida en regiones localizadas del material durante el proceso de sinterizado. La presencia de una fase líquida puede proporcionar una forma cómoda de acelerar la sinterización de muchos metales refractarios y formulaciones de cerámicos. Cuando se necesitan densidades excepcionalmente altas, se aplica presión (sea axial o isostática) mientras se sinteriza el material. Estas técnicas se llaman prensado en caliente, cuando la presión es unidireccional, o prensado isostático en caliente (HIP, por sus siglas en inglés), cuando la presión es isostática, es decir, que se aplica en todas direcciones. Con esas técnicas se producen muchas superaleaciones y cerámicos, como el titanato de plomo, zirconio y lantano (PLZT, por sus siglas en inglés). El prensado isostático en caliente produce materiales de alta densidad con propiedades isotrópicas. 2.6 APLICACIONES DE LA EPD EN LA ACTUALIDAD La deposición electroforética es un procedimiento utilizado en múltiples e innovadoras aplicaciones, especialmente en lo que respecta a generación de recubrimientos en la industria 9 productora de cerámicas. Durante los últimos años ha ido en aumento el interés, tanto en el mundo académico como en el sector industrial, no solamente por los diferentes usos que se pueden dar a los materiales y combinaciones obtenidas, sino que también debido a la relación entre la eficiencia y el costo, pues se requiere un equipo no complejo en cuanto a su construcción (Besra, L. et al.. 2007). Aparte de las aplicaciones convencionales, como la creación de recubrimientos protectores contra el desgaste y la corrosión, se utiliza en la fabricación de películas para dispositivos microelectrónicos avanzados, así como en el desarrollo de nuevos materiales compuestos o revestimientos bioactivos para implantes médicos, como depósitos de porcelana dental sobre acero inoxidable (Vargas, G. et al. 2003). También se realizan aplicaciones para montaje a nivel nanométrico de materiales avanzados (Sato, N. et al. 2001). La deposición electroforética también ofrece importantes ventajas en la deposición de compuestos complejos y laminados de cerámica. El grado de estequiometria en el depósito electroforético es controlado por la estequiometria del polvo utilizado. La técnica de EPD ha dado buenos resultados en la obtención de películas gruesas de sílice (Hasegawa, K. et al. 1999), membrana de zeolita de tamaño nanométrico (Shan, W. et al. 2004), recubrimientos de hidroxiapatita sobre un sustrato metálico para aplicaciones biomédicas (Wei, M. et al. 2001), materiales luminiscentes (Yum, J-H et al. 2003), películas superconductoras de alta Tc (Ochsenkuehn-Petropoulou, M. T. et al. 2004), electrodo de difusión de gas y sensores (Hayashi, K. et al. 2004), compuestos multicapa (Yamashita, K. et al. 1998), vidrio y compuestos de matriz cerámica por infiltración de partículas de cerámica en tejidos de fibra (Boccaccini, A. R. et al. 1998), nanovaras de óxido (Limmer, S. J. et al. 2003), películas sobre nanotubos de carbono (Du, C. et al. 2002), cerámicos que funcionan como gradiente (Put, S. et al. 2003), capas de cerámica (Ferrari, B. et al. 1998), superconductores (Maiti, H. S. et al. 1989), materiales piezoeléctricos (Van Tassel, J. et al. 1999), etc.. En la actualidad, industrias como la automovilística utiliza los recubrimientos obtenidos mediante depósitos electroforéticos en sus diversas líneas de producción (dupont.2013). Este proceso es un método automático, controlable y eficiente para aplicar una imprimación anticorrosiva sobre una pieza metálica. La carrocería se carga eléctricamente y se sumerge en un baño que contiene partículas de pintura con la carga opuesta, que son atraídas hacia la superficie metálica. Más tarde se neutralizan y la pieza se hornea, para que se forme una película uniforme 10 y adherente. Actualmente, en este proceso, la carrocería del vehículo suele ser el cátodo, así se minimiza la corrosión en el acero. Los revestimientos utilizados en este proceso se denominan recubrimientos electroforéticos catódicos. Los recubrimientos obtenidos por EPD se utilizan ampliamente en la industria de la automoción, agrícola, militar, de la construcción, de deportes y recreo, de transportes pesados y de productos de consumo, así como de calefacción y refrigeración. 2.7 IMPORTANCIA DEL USO DEL ACERO EN INGENIERÍA CIVIL El acero es una aleación de hierro que contiene entre 0.02 y 1.8 % de carbono en peso. Frecuentemente se incluyen otros elementos aleantes como: manganeso, cromo, níquel, molibdeno y otros para cambiar sus propiedades intrínsecas (Groover, M. P.. 1997). Los aceros constituyen la familia de aleaciones metálicas de mayor uso en aplicaciones estructurales y de carga en obras civiles. Gracias a la facilidad de una amplia variedad de tratamientos superficiales, proporcionan una gran diversidad de microestructuras y de propiedades diferentes. Posiblemente, los aceros son la familia más versátil entre los materiales de ingeniería (Askeland, D. R. et al. 2004). El acero usado en la construcción de obras civiles constituye una parte considerable de los aceros que se producen en la industria siderúrgica. Característica fundamental de estos aceros es la resistencia a diferentes solicitaciones, tanto estáticas como dinámicas. La utilización de acero en la construcción de obras, consiste principalmente en diseño de hormigón armado y estructuras metálicas. La primera emplea el fierro redondo estriado como refuerzo del hormigón, aportando esencialmente resistencia a la tracción. En el caso de la construcción de estructuras metálicas, se usan perfiles unidos mediante pernos y/o soldadura. Estructuralmente, el hormigón armado y las estructuras metálicas funcionan de modo eficiente, pero hay un problema que puede afectar su comportamiento: la “corrosión”. 11 Figura 2.5. Obra civil de estructuras metálicas de acero (Cintac. 2012) 2.8 LA CORROSIÓN COMO PROBLEMA EN LAS OBRAS CIVILES La corrosión es un fenómeno de deterioro de los materiales, usualmente metales, a causa de una reacción con el medio ambiente en que son usados. El fenómeno de corrosión no siempre involucra un cambio de peso o un deterioro visible a simple vista, ya que, muchas formas de corrosión se manifiestan por un cambio de las propiedades de los materiales disminuyendo su resistencia (Matamala R., G. 2004). En Chile, por causas geográficas y climáticas, se presentan condiciones muy favorables para la corrosión. Las industrias por razones estratégicas, han debido instalarse principalmente en las costas o en zonas muy cercanas a ella, existiendo en aquellos lugares “atmósfera marina”, que en la mayoría de los casos es mucho más agresiva que el “ambiente industrial”. Tomando en cuenta estos antecedentes, la formación de ingenieros civiles en obras civiles con conocimientos de corrosión y protección de metales, se deberá traducir en grandes beneficios, que entre otros, pueden ser precisados de la siguiente manera: 1. Prevenir o retardar la corrosión con la consiguiente economía que ello significa. 2. Diagnosticar fallas, evitando con ello paralizaciones improductivas. 12 3. Establecer estándares y especificaciones, en los trabajos de mantenimiento e inspección. 4. Mejorar el proceso productivo y su eficiencia global. 5. Introducir innovaciones en el diseño de las actuales instalaciones, considerando el problema de corrosión. 6. Estudiar el medio agresivo, tratando de hacerlo más inocuo. 7. Familiarizarse con el uso de los materiales en función del medio. 8. Aplicar los sistemas de protección de forma científica. Figura 2.6. Elemento estructural dañado por la corrosión (Sherwinwilliams. 2012) 2.9 GALVANIZADO EN CALIENTE COMO PROTECCIÓN CONTRA LA CORROSIÓN DEL ACERO El galvanizado por inmersión en caliente es un recubrimiento sobre el acero unido metalúrgicamente, aplicado mediante la inmersión de las piezas y estructuras en un baño de zinc fundido a una temperatura aproximada de 450 °C. Su principal aplicación es la protección contra la corrosión del hierro y acero. La ventaja de utilizar recubrimientos de zinc como protección contra la corrosión es que se puede predecir su vida útil, dependiendo del ambiente corrosivo al 13 que se expone. Para ésto, normalmente se aplican las recomendaciones encontradas en ISO 14713, ISO 9223 e ISO 12944 (Bbosch2, 2012). El recubrimiento metálico más utilizado para revestir acero contra la corrosión es el galvanizado por inmersión en caliente (recubrimiento de zinc). Su difundido uso se debe a lo siguiente: cuando se raspa el recubrimiento exponiendo el acero, el zinc sigue actuando, debido a que es anódica su relación con el acero. En el área del cátodo expuesto del acero, el recubrimiento de zinc se corroe en forma muy lenta, por lo cual, el acero se mantiene protegido (Askeland, D. R. et al. 2004). Actualmente, el galvanizado por inmersión en caliente, es la protección mayormente utilizada en Chile, siendo el servicio de galvanizado de la empresa Bbosch el de mayor demanda. Figura 2.7. Elementos estructurales de acero galvanizados en caliente (Bbosch3. 2012) 2.10 PROCESO INDUSTRIAL DE GALVANIZADO Los diferentes procedimientos involucrados en el proceso de galvanizado se han mantenido casi por completo desde que comenzó a emplearse la técnica, sin embargo, las investigaciones a escala industrial y de laboratorio han permitido determinar condiciones óptimas de operación y 14 control del proceso (Matamala, G.. 2007). Este consiste en darle básicamente al acero una preparación superficial adecuada, de manera de obtener una superficie limpia, que reaccione con el zinc fundido, y sumergir luego esta pieza en el baño a una temperatura cercana a los 450 °C por un tiempo determinado. Podemos dividir entonces el proceso en los siguientes pasos: 1. Preparación superficial, 2. Inmersión y galvanizado, 3. Inspección. Figura 2.8. Esquema del proceso de galvanizado (Matamala, G.. 2007) 2.11 TÉCNICAS DE CARACTERIZACIÓN 2.11.1 Verificación de adherencia de los revestimientos Según la norma ASTM A123/A 123M-00 para revestimientos de Zinc (Hot-Dip Galvanized) sobre productos de aceros y fundiciones (ASTM. 2000), es posible determinar la adhesión del revestimiento a la superficie del metal mediante el desprendimiento de material, por la penetración de la punta de un cuchillo. La adhesión se considera suficiente, si el revestimiento no se fragmenta antes de separarse completamente de la superficie del metal. El desprendimiento de partículas del revestimiento no se considera como señal de falla del revestimiento. 15 Figura 2.9. Imagen de un revestimiento de zinc luego de efectuar prueba de adherencia con un cuchillo 2.11.2 Rugosidad La rugosidad se refiere a desviaciones pequeñas con respecto a la superficie nominal finamente espaciadas, que vienen determinadas por las características del material y los procesos que formaron la superficie (Groover, M. P.. 1997). La rugosidad superficial es una característica cuantificable, basada en las desviaciones de la rugosidad. La rugosidad superficial con respecto a la figura 2.10 puede definirse como el promedio de las desviaciones verticales con respecto a la superficie nominal, sobre una longitud especificada de superficie. Se usa una media aritmética (MA) basada en los valores absolutos de la desviación, y a este valor de la rugosidad se le denomina rugosidad promedio. En forma de ecuación, Ra= (2.1) donde Ra= valor de la media aritmética de rugosidad, pulg (m) y Lm= distancia especificada sobre la cual se miden las desviaciones. Mediante una aproximación la ecuación anterior se puede entender mejor. Está determinada por Ra= (2.2) 16 donde Ra tiene el mismo significado que antes, yi= desviación vertical (convertida en valor absoluto) identificada por el subíndice i pulg (m) y n el número de desviaciones en Lm. Hemos indicado que las unidades en estas ecuaciones son inadecuadas (m). De hecho, la escala de las desviaciones es muy pequeña. Así que las unidades más apropiadas son micropulgadas (pulg x 10-6) y micrómetros (m x 10-6 o mm x 10-3). Estas son las unidades más usadas para expresar la rugosidad superficial. El método MA es el más utilizado para promediar la rugosidad superficial hoy en día. Una alternativa usada algunas veces en Estados Unidos es la raíz cuadrada de la media (RCM), también denominada como Rq, que es la raíz cuadrada de la media aritmética de las desviaciones elevadas al cuadrado sobre la longitud de medida. Los valores de RCM serán casi siempre mayores que los valores de MA, debido a que las desviaciones más grandes tienen mayor importancia en los cálculos de RCM. Se tiene que Rq= ( )1/2 (2.3) Rt o Rmáx es la distancia máxima si se trazaran dos líneas paralelas, que intersectan a los puntos extremos, superior e inferior de la superficie real en la correspondiente longitud de la medición (Lm). Figura 2.10. Esquema de la superficie nominal utilizadas en las dos definiciones de rugosidad superficial (Groover, M. P.. 1997) 17 2.11.3 Microscopía Electrónica de Barrido (MEB) y Espectroscopia de Energía Dispersiva (EDS) La MEB se usa para caracterizar morfológicamente la superficie de los materiales mediante imágenes reales a escala micrométrica e incluso en algunos casos a nivel nanométrico. Otra función avanzada asociada a la MEB es la Espectroscopia de Energía Dispersiva (Energy Dispersive X-Ray Spectroscopy, EDS), que permite generar análisis elementales a las superficie de los materiales en forma local (en un punto) o también a todo campo. Dada esta última prestación, es posible además generar mapeos químicos sobre la superficie de los materiales para hacer análisis más exhaustivos de las propiedades químicas (Askeland, D. R. et al. 2004). La MEB mediante un rastreo programado, barre la superficie de una muestra con un haz de electrones de alta energía, dando como consecuencia diversos tipos de señales. La primera de ellas, se refiere a electrones arrancados de la superficie o electrones secundarios de la propia muestra por la acción de un haz incidente, entregando así una señal que proporciona la imagen real de la superficie. La segunda señal, se refiere a los Rayos-X generados en el proceso los cuales capturan la señal producida cuando un electrón es arrancado de una capa electrónica interna por efecto de la interacción con el haz incidente de electrones. Esta radiación constituye el fundamento de la microsonda de electrones, obteniéndose así un espectro de elementos, es decir, un análisis químico elemental de la muestra (EDS). Se considera un electrón secundario aquél que emerge de la superficie de la muestra con una energía inferior a 50 eV, y un electrón retrodispersado (tercera señal) el que lo hace con una energía mayor. Estos electrones retrodispersados proceden en su mayoría del haz incidente que rebota en el material después de diferentes interacciones con energía superior a 50 eV (Goldstein, J. et al. 2003). La imagen de los electrones secundarios es una fotografía de la superficie de la muestra en tres dimensiones. Este tipo de imágenes permite estudiar la morfología y el tamaño de los granos o partículas. Además, permite observar el relieve superficial en los recubrimientos o en poros de cualquier tipo de material, asimismo pueden hacerse estudios de segregaciones y/o defectos planares o línea, tales como bordes de grano y dislocaciones respectivamente. Esto incluye, la identificación de materiales a través de su forma y tamaño. Así como también, el estudio de 18 corrosión, degradación por fatiga o cualquier otro deterioro que suponga una pérdida de material o desarrollo de microgrietas, por mencionar algunas de las aplicaciones (López, I.. 2005). 2.11.4 Microdureza El ensayo de microdureza Vickers es un test de Indentación, que permite medir la capacidad del material para deformarse plásticamente antes del agrietamiento. El ensayo Vickers usa una pirámide con forma de diamante, que al presionar la superficie del material deja una impresión, que está directamente relacionada con la dureza del material (Askeland, D. R. et al. 2004). El penetrador Vickers tiene un ángulo base de 136 °. Se emplea para láminas delgadas de hasta 0.150 mm. La dureza Vickers se calcula con la siguiente fórmula: HV = 1,854 (2.4) donde: P: carga de ensayo, aplicada al penetrador, en Kgf. d: promedio de las diagonales (l1 y l2) de la impresión cuadrada dejadas por el penetrador piramidal en la superficie de la probeta, en mm, figura 2.11 (a). HV: Dureza Vickers. Este símbolo debe completarse con las indicaciones de la carga, en Kgf, y del tiempo de aplicación de ésta, en seg. (a) (b) Figura 2.11. Esquema de la impronta del ensayo de dureza Vickers: (a) impresión cuadrada dejada por el penetrador de punta de pirámide en la superficie, y (b) penetrador en dirección de la carga P (Askeland, D. R. et al. 2004) 19 2.11.5 Electroquímica 2.11.5.1 Potenciales de electrodo La figura 2.12 muestra la experiencia electroquímica más simple. Consiste en sumergir una lámina de un metal Me en una solución 1 M de sus iones Me+ (Galvele, J. R. et al. 2006). Figura 2.12. Experiencia electroquímica en la que se sumerge un metal Me en una solución 1 M de iones Me+ (Galvele, J. R. et al.. 2006) Inmediatamente después de la inmersión, y dependiendo de la naturaleza del metal, pueden ocurrir dos situaciones diferentes: a) para metales como el oro y el platino (y en general, para los metales llamados nobles) los iones tenderán siempre a depositarse desde la solución (reacción de reducción) y el metal tomará un potencial positivo respecto de ella. Esto se representa por la expresión: Men+ + ne- → Me (2.5) b) metales como el magnesio o el zinc (y en general, los metales llamados activos), tenderán a disolverse y pasar a la solución como iones (reacción de oxidación), tomando el metal un potencial negativo respecto de la misma. Esto se representa a través de la expresión: Me → Men+ + ne- (2.6) 20 Un electrodo constituido por un metal puro (Me), inmerso en una solución que contiene iones de este mismo metal en un estado definido de oxidación (Me n+), es denominado electrodo de primera especie y representado por Me/Men+. La barra simboliza la interfase entre el metal Me y la solución con iones Men+. Cuando es necesario, se indica entre paréntesis la concentración o actividad de los iones metálicos, y la presencia de otros iones se indica a continuación separado por comas. Por ejemplo, la inmersión de un metal Me en presencia de una solución 0.02 Molar de iones Men+, que contiene iones cloruros se simboliza como: Me/Men+ (0.02 M), ClTratándose de partículas cargadas, el pasaje de cargas hacia uno y otro lado de la interfase metal-solución, creará una diferencia de potencial que, al ir aumentando, se irá oponiendo al pasaje de nuevas cargas. Luego de cierto tiempo, se alcanzará una diferencia de potencial tal que impedirá el pasaje neto de cargas hacia uno u otro lado de la interfase, llegándose a una situación de equilibrio, ecuación (2.7), a partir de la cual la velocidad de la reacción de izquierda a derecha, será igual a la de la reacción de derecha a izquierda: Men+ + ne- ↔ Me (2.7) Por convención, una reacción electroquímica en equilibrio se escribe como una reacción de reducción, es decir, con los electrones en el miembro de la izquierda. 2.11.5.2 Potencial del electrodo Es imposible medir el valor absoluto de la diferencia de potencial (ØM – ØS) en la interfase electrodo-solución. Esto puede ser apreciado considerando la experiencia mostrada en la figura 2.13 (a), en la que se intenta medir la caída de potencial en la interfase (ØM – ØS) , donde ØM y ØS corresponden a los valores de potencial del metal y de la solución respectivamente, de un electrodo A empleando un voltímetro. Este voltímetro mide la diferencia de potencial generada entre sus dos terminales, permitiendo el paso de una corriente muy pequeña (del orden de los nanoamperes o menos) (Galvele, J. R. et al. 2006). 21 Lo anteriormente expuesto es inaplicable en el esquema de la figura 2.13 (a), ya que, a pesar de tener contacto entre el electrodo metálico (A) y uno de los terminales del voltímetro, el contacto entre la solución y el otro terminal resulta imposible, a menos que se introduzca en el sistema otro electrodo metálico (B) que haga contacto con la solución, figura 2.13 (b). (a) (b) Figura 2.13. Dos posibles mediciones electroquímicas: (a) intento de medir el potencial del electrodo A empleando una sola interfase electrolítica y (b) medición del potencial del electrodo A empleando un electrodo de referencia B (Galvele, J. R. et al., 2006) De esta manera, se puede cerrar el circuito y hacer circular la corriente necesaria para censar la diferencia de potencial, aunque en este caso, el valor obtenido en el voltímetro (∆Ø) corresponde a: ∆Ø = (ØMetal A – ØS) – (ØMetal B – ØS) = ØMetal A – ØMetal B (2.8) De ésto se concluye que para medir la diferencia de potencial entre el metal A y la solución (ØMetal A – ØS) que es el sistema de interés, es necesario emplear otro electrodo B, que actuará como electrodo de referencia. Por lo tanto, el potencial medido corresponde a: ∆Ø = (Øsistema de interés – ØS) – (ØReferencia – ØS) (2.9) Si se emplea un electrodo de referencia que opere de forma tal que (ØReferencia – ØS) se mantenga constante, se llega a que: ∆Ø = (Øsistema de interés – ØS) + constante (2.10) 22 Esto nuevamente deja de manifiesto que no puede ser medido el valor absoluto de (Øsistema de interés – ØS). Sin embargo, si (ØReferencia – ØS) es un valor fijo, se llega a que cualquier cambio en la cantidad (Øsistema de interés – ØS) aparece directamente reflejado en el valor de la diferencia de potencial medido (∆Ø). 2.11.5.3 Electrodo estándar de hidrógeno El electrodo de referencia debe ser un dispositivo que mantenga un valor fijo de potencial con respecto a la disolución, (ØReferencia – ØS), lo que impone a los electrodos de referencia ciertas propiedades específicas para asegurar que este potencial permanezca constante (Galvele, J. R. et al. 2006). Para lograr ésto, es necesario que: 1. La composición química del electrodo de referencia y la solución en la cual está sumergido sea constante. Esto es debido a que el potencial del electrodo se establece a través de una reacción de equilibrio del tipo mostrado en la ecuación (2.7) y, como ya se mencionó, los potenciales químicos dependen de la concentración de las especies. 2. No circule corriente por el sistema. Una consecuencia de la composición química constante implica que sería desastrozo para el electrodo de referencia el pasaje de una corriente alta, pues se producirían reacciones del tipo mostrado en las ecuaciones (2.5) y (2.6), que modificarían las concentraciones de las especies involucradas. 3. El término (ØReferencia – ØS) alcance su equilibrio termodinámico rápidamente. El electrodo de referencia “típico” es el denominado electrodo normal de hidrógeno (o electrodo estándar de hidrógeno), consistente en un electrodo de platino sobre el cual se ha depositado electrolíticamente platino (negro de platino), sumergido en una solución de HCl cuya actividad de iones H+ es 1 M, sobre la que se burbujea hidrógeno gaseoso a 1 atmósfera de presión. Por convención se le asigna a este electrodo un potencial de 0,0 Volts a todas las temperaturas (vale decir, el valor de la constante en la ecuación (2.10) es igual a 0,0 Volts). Este electrodo cumple con los requisitos mencionados ya que: 23 1. Las concentraciones tanto de protones ([H+] = 1 M) como de hidrógeno gaseoso (presión 1 atm) son constantes. 2. La diferencia de potencial es medida con un voltímetro de alta impedancia que mide la circulación de grandes corrientes, por lo que la electrólisis (y por ende, el cambio de concentraciones) es despreciable. 3. El electrodo fabricado con platino recubierto con negro de platino (denominado platino platinado) en vez de platino brillante, asegura un rápido equilibrio termodinámico. El denominado negro de platino depositado sobre la superficie del platino, actúa como catalizador, de manera que el equilibrio que determina el correspondiente potencial, ecuación (2.10) se establece rápidamente: 2H+ + 2e- ↔ H2 (2.11) De este modo, disponiendo de un electrodo de referencia estándar (el electrodo normal de hidrógeno), se puede determinar el valor de (Øsistema de interés – ØS) para cualquier equilibrio electroquímico. Los valores de (Øsistema de interés – ØS) así determinados, y cuando la concentración de especies iónicas es igual a 1 M, se denominan potenciales normales de electrodo, se simbolizan E0, tiene como unidades Volts (en realidad, corresponde especificarlos como V enh, donde el acrónimo enh indica que el potencial fue medido frente al electrodo normal de hidrógeno) y se encuentran tabulados en los libros de electroquímica y de corrosión (tabla 2.1 ). Tabla 2.1. Valores del potencial normal de algunos electrodos (Galvele, J. R. et al., 2006) Reacción F2(g) + 2e⁻ ↔ 2FCe⁺4 + e⁻ ↔ Ce3+ Cl2(g) + 2e⁻ ↔ 2ClAu⁺3 + 3e⁻ ↔ Au O₂ + 4H+ + 4e⁻↔ 2H₂O Ag⁺ + e⁻ ↔ Ag Cu2⁺ + 2e⁻ ↔ Cu 2H⁺ + 2e⁻ = H₂ Pb2⁺ + 2e⁻ ↔ Pb Fe2⁺ + 2e⁻ ↔ Fe Zn2⁺ + 2e⁻ ↔ Zn Ti2⁺ + 2e⁻ ↔ Ti E0/Volts +2.870 +1.720 +1.538 +1.498 1.229 +0.799 +0.342 0.000 -0.126 -0.447 -0.763 -1.630 24 Reacción (continuación) Al3+ + 3e⁻ ↔ Al Mg2+ + 2e⁻↔ Mg Na⁺ + e⁻↔ Na Li⁺ + e⁻ ↔ Li E0/Volts -1.662 -2.372 -2.714 -3.045 2.11.5.4 Otros electrodos de referencia Además del electrodo de hidrógeno, cuyo armado y empleo es muy engorroso, pueden ser empleados otros electrodos de referencia, como por ejemplo el de calomel, el de plata/cloruro de plata, el de mercurio/sulfato mercurioso o el de cobre/sulfato de cobre. Los tres primeros son denominados electrodos de segunda especie, que son los constituidos por un metal en contacto con una sal poco soluble del mismo metal, estando el conjunto inmerso en una solución que contiene aniones de la misma sal (Galvele, J. R. et al. 2006). El electrodo de plata/cloruro de plata, el cual se emplea en esta experiencia, consiste en un alambre de plata o platino revestido en plata, que a su vez se ha convertido parcialmente en cloruro de plata a través de un tratamiento electroquímico en una solución adecuada (ácido clorhídrico y cloruro de potasio). El electrodo se emplea inmerso en una solución de cloruro de potasio y se representa por Ag, AgCl(s) / KCl(acuoso), presenta la siguiente reacción de equilibrio: AgCl + e- ↔ Ag + Cl- (2.12) Los potenciales de estos electrodos de referencia, respecto del electrodo normal de hidrógeno se muestran en la tabla 2.2. Tabla 2.2. Potenciales de diversos electrodos de referencia respecto del electrodo normal de hidrógeno (Galvele, J. R. et al.. 2006) Electrodo de referencia Hg, Hg2Cl2/KCl (0.1 M) Hg, Hg2Cl2/KCl (1 M) Hg, Hg2Cl2/KCl (solución saturada) Ag, AgCl/KCl (0.1 M) Ag, AgCl/KCl (1 M) Hg, Hg2SO4/K2SO4 (solución saturada) Cu/CuSO4(s), Cu2+ (solución saturada) Potencial/Venh +0.3337 +0.2800 +0.2415 +0.2881 +0.2224 +0.6400 +0.3180 25 2.11.5.5 Celdas electroquímicas Para describir una celda de uso general en corrosión se deben tener en cuenta diferentes factores, como la agitación del medio, temperatura, iluminación, ausencia de oxígeno, etc. (Galvele, J. R. et al. 2006). Cuando se quiere estudiar el comportamiento de diferentes materiales en un medio corrosivo particular (suelo, cemento, agua de mar, pozos petrolíferos, fluídos del cuerpo humano, etc.) la celda debe producir en el laboratorio las mismas condiciones que se supone se presentarán en la práctica. Si se tiene una celda electroquímica como la de la figura 2.14, donde en la hemicelda de la derecha se tiene un electrodo de zinc sumergido en una solución 1 M de iones Zn2+, y en la hemicelda de la izquierda se tiene una lámina de hierro en una solución 1 M de iones Fe2+, ambas celdas se encuentran unidas por un puente salino (que permite el flujo de iones entre ambas celdas e impide la acumulación de cargas), y si se mide con un voltímetro de alta impedancia la diferencia de potenciales entre las láminas metálicas, se encontrará un valor igual a 0.3 V. Esta unión de dos celdas donde en cada una de ellas se produce una reacción es denominada pila electroquímica. El valor registrado tiene su origen en que el electrodo de hierro tiene un potencial normal de -0.447 Venh, en tanto que el de zinc tiene un potencial normal de -0.763 Venh (tabla 2.1), por lo tanto, su diferencia es de 0.316 V (valor medido con el voltímetro). Figura 2.14. Celda electroquímica Fe/Fe2+ (1 M)//Zn/Zn2+ (1M) (Galvele, J. R. et al.. 2006) 26 Si ahora se unen los dos electrodos con un conductor eléctrico de baja resistencia, comenzarán a circular electrones por dicho conductor y se observarán reacciones en ambas hemiceldas: sobre el electrodo de hierro se observará un depósito de hierro metálico y el electrodo de zinc se disolverá, es decir, ocurrirán las hemirreacciones siguientes: Fe2⁺ + 2e⁻ → Fe (2.13) Zn → Zn2⁺ + 2e⁻ (2.14) El electrodo donde se produce la reacción de disolución se denomina ánodo. En él se producirá el proceso corrosivo y la reacción correspondiente será de oxidación (pérdida de electrones). Por su parte, el electrodo donde se produce la deposición se denomina cátodo, y la reacción que le corresponde será de reducción (ganancia de electrones). Conociendo los valores de los potenciales normales, es posible predecir este comportamiento realizando los siguientes pasos: 1. con la tabla de potenciales normales se determina cual es el valor correspondiente a la reacción de reducción del hierro: -0.447 Venh (recuérdese que en la tabla de potenciales normales, las reacciones se escriben con los electrones en el primer miembro, por lo tanto, se expresan como reacciones de reducción); 2. como se ha escrito la reacción correspondiente al zinc como una oxidación, y en la tabla de potenciales normales se muestran las reacciones de reducción, se invierte el signo del potencial obtenido a partir de la tabla: +0.763 Venh; 3. se suman ambos potenciales obteniendo de esta forma el potencial de la pila, E = -0.447 V + 0.763 V = 0.316 V, que es el valor medido en el voltímetro; 4. finalmente se calcula la variación de la energía libre con la ecuación ∆G, observando que el signo de ∆G siempre es opuesto al de ∆E, por lo tanto, en el presente caso se obtendrá una variación de energía libre negativa, correspondiente a un proceso espontáneo, con lo que se concluye que las reacciones ocurren en las direcciones tal como fueron escritas. 27 Si se creyera que el hierro se oxida y el zinc se reduce, el cálculo de E daría -0.316 V, con lo que la variación de la energía libre (∆G) sería positiva, indicando que las reacciones no son espontáneas en el sentido supuesto. La reacción global es por lo tanto: Fe2+ + Zn → Fe + Zn2+ (2.15) Como regla general, cuando se unen dos electrodos con potenciales diferentes, el que tenga el potencial más bajo actuará como ánodo (se corroerá, dando la reacción de oxidación), mientras que el que tenga el potencial más alto actuará como cátodo (dará la reacción de reducción). 2.11.5.6 Potencial de equilibrio Respecto a los potenciales de electrodo, no siempre es posible – ni tiene interés práctico – tener una concentración de iones disueltos igual a 1 M y tampoco la temperatura de trabajo es siempre 25 °C. Para determinar los potenciales que corresponden a diversas concentraciones y temperaturas, se recurre a la denominada ecuación de Nernst: Eeq = E0 + (2.16) donde Eeq es el potencial de equilibrio de las nuevas condiciones, E0 es el potencial normal de electrodo (obtenido de la tabla correspondiente), R la constante de los gases 8.314 J / (K*mol), T la temperatura de trabajo (en K), n el número de electrones intercambiados en la reacción, F la constante de Faraday, y aoxidadas y areducidas las actividades de las especies oxidadas y reducidas, respectivamente, que pueden ser reemplazadas por sus concentraciones: [oxid] y [red]. A temperatura ambiente (25 °C), y transformando logaritmos neperianos en decimales, la ecuación (2.16) puede ser escrita como: Eeq = E0 + (2.17) y en términos generales, dado el equilibrio: aAn+ + bB + ne- ↔cC + dD (2.18) la ecuación (2.17) se transforma en: 28 Eeq = E0 + (2.19) Es preciso resaltar el significado práctico del potencial de equilibrio E eq. A dicho potencial las velocidades de las reacciones de la ecuación (2.7) son iguales tanto de izquierda a derecha como de derecha a izquierda, por lo que no existirá una producción neta de ningún producto. Si se aplica al sistema un potencial por encima del de equilibrio (E > E eq), la termodinámica (ecuación de Nernst) indica que el sistema reaccionará aumentando el contenido de iones M n+ en solución, por lo que se producirá la reacción (2.6), disolviéndose el metal Me (corrosión del metal), figura 2.15. Figura 2.15. Reacciones termodinámicas posibles y especies estables en función del potencial del electrodo respecto del de equilibrio (Galvele, J. R. et al., 2006) Si se aplica un potencial por debajo del de equilibrio, la termodinámica indica que debe disminuir el contenido de iones Mn+ en solución, por lo tanto, se favorecerá la reacción (2.5) produciéndose la deposición del metal Me. La conclusión más importante de este análisis es que a potenciales por sobre el de equilibrio, las especies oxidadas son las estables (por favorecerse el proceso de oxidación), mientras que a potenciales por debajo del de equilibrio, las especies reducidas son las estables (al favorecerse el proceso de reducción). 29 2.11.5.7 Protección electroquímica 2.11.5.7.1 Protección catódica Podemos proteger contra la corrosión suministrando electrones al metal obligándolo a comportarse como un cátodo (figura 2.16). La protección catódica puede utilizar un ánodo de sacrificio o un voltaje sobrepuesto (Askeland, D. R. et al. 2004). (a) (b) Figura 2.16: Protección catódica de un ducto de acero subterráneo. (a) Un ánodo de sacrificio de magnesio asegura que la celda galvánica haga del ducto el cátodo. (b) Un voltaje impuesto entre un ánodo auxiliar de chatarra de hierro y el ducto asegura que este se comporte como un cátodo (Askeland, D. R. et al.. 2004) Al material que se debe proteger se le puede adjuntar un ánodo de sacrificio formando un circuito electroquímico. El ánodo de sacrificio se corroe suministrando electrones al metal e impidiendo, por tanto, una reacción anódica en el metal. El ánodo de sacrificio, que normalmente está constituido por zinc o magnesio, se consume y deberá ser reemplazado. Se aplica para evitar la corrosión en tuberías enterradas, en barcos, en plataformas marinas de perforación y en calentadores de agua. El Mg sirve como ánodo y se disuelve, lo que evita la corrosión del acero. 30 Al material que se debe proteger también se le puede aplicar un voltaje superpuesto, obtenido de una fuente de corriente directa conectada entre un ánodo auxiliar y el metal a proteger. En esencia, hemos conectado una batería de forma que los electrones fluyan hacia el metal haciendo que el metal sea el cátodo. El ánodo auxiliar, por ejemplo, un pedazo de chatarra de hierro, se corroe. 2.11.5.7.2 Pasivación o protección anódica Los metales que están cerca del extremo anódico de la serie galvánica son activos y sirven como ánodos en la mayoría de las celdas electrolíticas. Sin embargo, si se hace que estos metales se vuelvan pasivos o más catódicos, se corroen a tasas menores de lo normal, de ahí el término protección anódica. La pasivación se produce al exponer el metal a soluciones oxidantes altamente concentradas. Si el hierro se sumerge en ácido nítrico muy concentrado, se corroe rápida y uniformemente para formar un recubrimiento delgado y protector de hidróxido de hierro. Este recubrimiento protege al hierro contra una corrosión subsecuente en el ácido nítrico. También se puede causar pasivación incrementando el potencial del ánodo por encima de un nivel crítico. Sobre la superficie del metal se forma una película pasiva, causando una fuerte polarización anódica, y la corriente se reduce a un nivel muy bajo. 2.11.5.8 Cinética de electrodo El desplazamiento del potencial de electrodo desde su potencial de equilibrio se denomina polarización y su valor se denomina sobrepotencial (ƞ): – (2.20) Esta polarización tiene distintos componentes, dependiendo de cuál es el fenómeno que controla la velocidad global del proceso. De esta forma se tiene polarización por transferencia de carga, por transferencia de masa, de cristalización, de reacción química y óhmico (Galvele, J. R. et al. 2006). 31 2.11.5.9 Curvas de polarización anódica y catódica 2.11.5.9.1 Curvas de polarización anódica A la gráfica de densidad de corriente en función del sobrepotencial se le denomina curvas de polarización (figura 2.17). Si un metal se encuentra al potencial de equilibrio termodinámico, habrá un intercambio de iones entre el metal y la solución, pero no habrá un pasaje neto en ninguna de las dos direcciones. Al circular una corriente neta el potencial del metal varía, observándose un sobrepotencial. Este sobrepotencial, que puede mantenerse arbitrariamente en cualquier valor, es el que define el comportamiento del metal. Cuando el sobrepotencial es positivo circulará por la interfase metal-solución una corriente positiva, y el metal se corroerá. Midiendo la corriente que circula a cada sobrepotencial se obtiene una curva de polarización anódica, que tendrá algunas de las formas indicadas en la figura 2.17 (Galvele, J. R. et al. 2006). Figura 2.17. Representación esquemática de los diferentes procesos observables durante la polarización anódica de los metales. E: potencial de equilibrio, y Log i: corriente (Galvele, J. R. et al., 2006) 32 Para un sobrepotencial pequeño, al cumplirse la ley de Tafel, se suele observar una relación lineal entre el sobrepotencial y el logaritmo de corriente. A sobrepotenciales mayores comienzan a influir otros factores (difusión de productos o de reactantes, acumulación de productos de corrosión, formación de óxido, etc.) y la relación lineal deja de cumplirse. 2.11.5.9.2 Curvas de polarización catódica La reacción de evolución de hidrógeno requiere el transporte, hacia la superficie del metal, de H+ o de H3O+ en soluciones ácidas (o de moléculas de agua, en soluciones neutras o alcalinas). Sin embargo, debido a la alta movilidad y concentración de H+ (ó H3O+) en soluciones ácidas, y a la abundancia de moléculas de agua en soluciones neutras, la etapa de difusión pasa desapercibida aún a densidad de corriente alta (Galvele, J. R. et al. 2006). Por esta razón en la reacción de desprendimiento de hidrógeno no hay interferencia visible debida a difusión, y la expresión analítica de la curva catódica de evolución hidrógeno responde a la ecuación de Tafel: i- = -i0*[exp(- *ƞ] (2.21) 2.11.5.9.2.1 Determinación de las curvas de polarización Para poder predecir la velocidad de corrosión de un sistema, se deben conocer las curvas de polarización (relaciones i vs E) de cada una de las reacciones electroquímicas que lo componen, por lo que la determinación y estudio de las curvas de polarización es de fundamental importancia en los trabajos de corrosión (Galvele, J. R. et al. 2006). Las curvas de polarización se pueden determinar de las siguientes formas: a) Aplicando una corriente constante y midiendo el potencial. Se repite este procedimiento para diferentes valores de corriente, midiendo en cada caso el nuevo potencial alcanzado. Se tienen así las llamadas curvas galvanostáticas. Esta es la técnica de medición más simple en cuanto a equipamiento se refiere, pero solamente puede usarse cuando las curvas de polarización muestran una variación monótona. No es adecuada en aquellos casos en los que hay cambios bruscos en la curva i – E, tal como ocurre en la pasivación de metales. 33 b) Aplicando un potencial constante y determinando la forma en que varía la corriente. Estas curvas potenciostáticas requieren un equipamiento más complejo que las anteriores, pero son las que encuentran mayor aplicación en los estudios de corrosión de los metales. c) Variando el potencial a una velocidad constante y registrando simultáneamente la variación de la corriente. d) Variando el potencial en escalones de igual valor y esperando siempre el mismo tiempo antes de leer la corriente. 2.11.5.9.2.2 Utilización de potenciostatos Conservar una probeta a un potencial constante y que no sea afectado por la corriente que circula por el sistema, no puede conseguirse con circuitos tan simples como los galvanostáticos. En general, se requiere un circuito electrónico que mantenga el potencial constante, y tenga una velocidad de respuesta lo suficientemente grande (Galvele, J. R. et al. 2006). Estos circuitos, conocidos como potenciostatos, fueron desarrollados inicialmente por Hickling en 1942 y por Roberts en 1954, y el principio de su funcionamiento se describe esquemáticamente en la figura 2.18. Un potenciostato es un dispositivo electrónico que mantiene el potencial de un electrodo de trabajo en un valor constante respecto al electrodo de referencia (Skoog, D. A. et al. 2001). Figura 2.18. Esquema del funcionamiento de un potenciostato. e.t.: electrodo de trabajo o probeta; e.r.: electrodo de referencia; c.e.: contraelectrodo inerte; mV: milivoltímetro; mA: amperímetro o registrador de corriente (Galvele, J. R. et al., 2006) 34 Con el circuito potenciométrico se fija el potencial deseado entre el electrodo de trabajo e.t. y el electrodo de referencia e.r.. Cualquier diferencia que surja entre el potencial fijado y el potencial existente entre el e.t. y el e.r. es detectado como una señal de error por el controlador, que rápidamente ajusta la corriente que circula entre el electrodo de trabajo e.t. y el contraelectrodo c.e. hasta que la señal de error sea reducida a cero. 2.11.5.10 Técnicas electroquímicas utilizadas 2.11.5.10.1 Evolución del potencial del electrodo a circuito abierto No existe forma de medir la diferencia de potencial en la interfase metal – solución, pero sí es posible hacerlo frente a otra interfase que se denomina electrodo de referencia. De este modo, tomando arbitrariamente el potencial del electrodo de referencia igual a cero, se tiene una escala de medición de potenciales metal – solución. 2.11.5.10.2 Evolución de la corriente en el tiempo a potencial constante para evaluar la carga eléctrica transferida en el proceso de degradación del sólido: Me(s) → Me(ac)n+ + neSe aplica el correspondiente valor de sobrepotencial a un electrodo de trabajo de un modo controlado facilitando la transferencia de iones hacia el electrolito. El electrodo auxiliar pasa toda la corriente necesaria para equilibrar la corriente observada en el electrodo de trabajo. Se obtiene un gráfico corriente vs. tiempo (I vs. t). La cantidad de electricidad o carga puede expresarse en unidades de coulombs [C] y de faraday [F]. El coulomb es la cantidad de carga transportada en un segundo por una intensidad de corriente constante de un ampere. Por tanto, para una intensidad de corriente constante de I amperes durante t segundos, el número de coulombs Q viene dado por la expresión Q = It. Sin embargo, para una intensidad de corriente variable, el número de coulombs viene dado por la integral (Skoog, D. A. et al. 2001). 35 2.11.5.10.3 Barrido de potencial anódico para visualizar la forma como se degrada el sólido, intentando discriminar entre la oxidación del Zn y la del Fe Se aplica un barrido de potencial a 1 mV/seg a un electrodo de trabajo de un modo controlado facilitando la transferencia de iones hacia el electrolito. El electrodo auxiliar pasa toda la corriente necesaria para equilibrar la corriente observada en el electrodo de trabajo y se registra simultáneamente la variación de la corriente. Se obtiene un gráfico corriente vs. potencial (I vs. E). Para poder predecir la velocidad de corrosión de un sistema, se deben conocer las curvas de polarización (relaciones i vs E) de cada una de las reacciones electroquímicas que lo componen, por lo que la determinación y estudio de las curvas de polarización es de fundamental importancia en los trabajos de corrosión. 2.11.6 Espectrometría de absorción atómica (AAS) La espectrometría de absorción atómica (AAS) es un tipo de método espectrométrico óptico atómico. Es el procedimiento más ampliamente utilizado durante casi medio siglo para la determinación de elementos en muestras analíticas (Skoog, D. A. et al. 2001). 2.11.6.1 Técnica de atomización de la muestra El método más habitual de atomizar la muestra en la espectrometría de absorción atómica es la atomización con llama. En un atomizador de llama, la disolución de la muestra es nebulizada mediante un flujo de gas oxidante, mezclado con el gas combustible, y se transporta a una llama donde se produce la atomización. 2.11.6.2 Instrumentación para absorción atómica Los instrumentos para espectrometría de absorción atómica (AAS) son semejantes al diseño general mostrado en la figura 2.19 y consiste en una fuente de radiación, una zona de muestra, un selector de longitud de onda, un detector y un procesador de la señal y de lectura de salida. La zona de muestra en los instrumentos de absorción atómica es el atomizador que contiene la muestra gaseosa atomizada. 36 Figura 2.19. Componentes de diversos tipos de instrumentos para espectroscopía de absorción (Skoog, D. A. et al.. 2001) 2.11.6.3 Aplicaciones de la espectrometría de absorción atómica La espectrometría de absorción atómica constituye un medio sensible para la determinación cuantitativa de más de 60 elementos metálicos o metaloides. Las líneas de resonancia de los elementos no metálicos se localizan en general por debajo de los 200 nm, y sólo es posible su determinación con espectrofotómetros que operan en vacío. 37 CAPÍTULO 3 DESARROLLO EXPERIMENTAL 3.1 MATERIALES Y EQUIPOS 3.1.1 Elección del acero estructural Se procede a elegir el acero a revestir considerando un elemento estructural característico de una construcción, como es el caso de una viga. Se estudian primero sus propiedades mecánicas y desde ahí se decide en cuanto a su composición. En el sitio de CINTAC se procede a revisar la información relativa a los perfiles estructurales. La calidad indicada es acero A36. Considerando las designaciones para el acero estructural en la Norma NCh203. Of2006 (Acero para uso estructural – Requisitos), el acero que satisface estos requerimientos mecánicos es el A270ES, cuya tensión de fluencia es 270 MPa y su resistencia a la tracción es de 410 a 510 MPa. Considerando la composición del acero se tiene que el tipo que cumple con las propiedades mecánicas antes señaladas es el SAE 1045 (Groover, M. P.. 1997). De acuerdo a las limitaciones geométricas en el portamuestras utilizado en los análisis de corrosión, se decide fabricar cilindros de 19.1 mm de diámetro y 3 mm de espesor, que serán revestidas con zinc mediante deposición electroforética. 38 3.1.2 Equipos utilizados en la obtención de los revestimientos En el proceso gravimétrico se utilizó una balanza marca Acculab Sartorius Group, modelo VICON, cuya precisión es de 0.01 g y una capacidad máxima de 610 g. Para efectuar el control dimensional se empleó un micrómetro digital marca Mitutoyo, modelo Absolute, cuya resolución corresponde a 0.001 mm. Para generar el campo eléctrico se usó una fuente de poder marca Voltronyx, modelo V37, digital y temporizada (figura 3.1). La celda electroforética utilizada fue un vaso precipitado de 100 ml de capacidad. Esta fue implementada con un electrodo de trabajo, que consistieron en cilindros de acero SAE 1045 de 22 mm de diámetro y 3 mm de espesor, y un contraelectrodo rectangular de acero SAE 1045, cuya área de trabajo es aproximadamente 12 cm 2. La celda en su conjunto se posicionó sobre un agitador magnético Marca SYBRON Thermolyne, modelo Type 1000. Figura 3.1. Fuente de poder e implementos utilizados 3.1.3 Materiales usados en la preparación de las suspensiones El material de partida empleado fue polvos de zinc marca Aldrich Nº CAS 7440-66-6, los cuales poseían una granulometría menor a 10 µm y un grado de pureza igual o superior al 99% (figura 3.2). Se emplearon como medios de dispersión isopropanol, etanol y agua destilada. Para 39 mejorar la conductividad del campo eléctrico se agregó hidróxido de sodio (soda cáustica) marca Sigma Aldrich, Nº CAS 1310-73-2, en gránulos. Figura 3.2. Morfología de polvos de zinc marca Aldrich de granulometría < 10 µm, 30000X. 3.1.4 Implementación utilizada para efectuar el proceso térmico de los revestimientos Para la ejecución del proceso térmico se utilizó un horno marca Thermo Scientific, modelo F6010 (figura 3.3). En el cual, se implementó un sistema de campana para generar un ambiente inerte, evitando así la oxidación de los revestimientos debido a las altas temperaturas alcanzadas. En el sistema se introdujo gas Argón, cuya composición es de 99.9% Ar, 0.02% O2 y 0.08% N2. 40 Figura 3.3. Horno utilizado en el procedimiento térmico 3.1.5 Equipos utilizados en los ensayos electroquímicos Se utilizó un galvanoestato / potenciostato marca Basi modelo EPSILON, cuya sensibilidad de medición es 0.02 mV y que usa el software de lectura de datos EPSILON (figura 3.4), junto con la correspondiente celda electroquímica Basi modelo C3 con su respectivo sistema de tres electrodos: de trabajo, de referencia y auxiliar (figura 3.5). Como electrodo de trabajo se usó un portamuestras de cobre, cuyo depósito donde se alojaba la muestra estaba hecho de un polímero de alta resistencia, figura 3.5 (a). El electrodo de referencia empleado correspondió a uno de plata/cloruro de plata, marca Basi, modelo MR-5275, figura 3.5 (b). El electrodo auxiliar considerado fue de grafito. Se usó como celda auxiliar un envase de material PET (tereftalato de polietileno), la cual se posicionó sobre un agitador magnético marca Lab Tech modelo LMS-1001. Luego se efectuaron las conexiones con la celda Basi C3. El electrolito se elaboró utilizando cloruro de sodio de alta pureza marca Sigma-Aldrich Nº CAS 1647-10-5. 41 Figura 3.4. Celda electroquímica configurada para las mediciones (a) (b) Figura 3.5. Electrodos utilizados: (a) electrodo de trabajo y (b) electrodo de referencia 42 Figura 3.6. Equipo utilizado en electroquímica. Se observa el potenciostato/galvanoestato y la celda electroquímica 3.1.6 Análisis de los iones metálicos Para determinar las concentraciones de iones metálicos disueltos en las soluciones utilizadas en las mediciones electroquímicas, se utilizó un Espectrómetro de Absorción Atómica, marca Thermo Scientific, modelo ICE 3000, modalidad llama (figura 3.7). Su límite de detección corresponde a 0.0066 mg/l. Figura 3.7. Espectrofotómetro Thermo Scientific modelo ICE 3000 43 3.1.7 Microscopía Electrónica de Barrido (MEB) El microscopio electrónico de barrido marca ZEISS modelo LEO 420 (figura 3.8), fue utilizado para obtener imágenes de morfología a alto vacío y a una energía de 20 KeV sin metalizar. A través de un equipo complementario EDS (analizador de fluorescencia de rayos X) marca ZEISS se realizaron los análisis elementales de los materiales. Figura 3.8. Microscopio Electrónico de Barrido ZEISS modelo LEO 420 3.1.8 Microdureza Vickers Las mediciones de microdureza fueron realizadas con un microdurómetro marca Struers modelo Duramin (figura 3.9) facilitado por el Laboratorio de Metalurgia Física, Departamento de Ingeniería de Materiales de la Universidad de Concepción. Se utilizaron cargas dependiendo de la necesidad considerada por el operador del equipo, que en este caso resultaron ser de 245.2 y 490.3 mN. 44 Figura 3.9. Microdurómetro Struers modelo Duramin 3.1.9 Rugosidad El relieve superficial de las muestras se midió con un rugosímetro Mitutoyo mod SJ 301, el cual posee una capacidad de medición de 360 µm (200 µm ~+ 160 µm). 3.1.10 Probetas galvanizadas en caliente El galvanizado de 16 probetas de acero, usadas para caracterizar y efectuar las comparaciones respectivas, se realizaron en la planta Galva Sur, perteneciente a la compañía Bbosch, ubicada en el Barrio Industrial en la ciudad de Puerto Varas, Región de los Lagos. 45 3.2 PROCEDIMIENTO EXPERIMENTAL 3.2.1 Preparación de probetas Desde una barra de acero de 19.1 mm de diámetro, se confeccionaron 100 probetas cilíndricas de 3 mm de espesor. Luego se procedió a limpiar cada una de las probetas con acetona, para eliminar residuos orgánicos que interfieran en la deposición. En apariencia, las probetas mostraron muy buenas condiciones superficiales, no siendo necesario efectuar otro tratamiento mecánico sobre la superficie. A cada una de las probetas obtenidas, se les registró el peso y espesor respectivamente, antes y después de efectuar el proceso de revestimiento (figura 3.10). Figura 3.10. Esquema del procedimiento experimental del proceso de EPD de zinc 3.2.2 Preparación de las suspensiones Para buscar la suspensión más favorable para la deposición, 3 g de partículas de zinc fueron introducidas en tres medios diferentes: isopropanol, etanol y agua destilada. Junto a 0.03 g de 46 soda cáustica para mejorar la conductividad del campo eléctrico. La cantidad de líquido utilizado en la celda electroforética fue de aproximadamente 100 ml. Para mantener las partículas de zinc en suspensión se utilizó una suave agitación magnética durante el proceso de deposición. 3.2.3 Obtención de los revestimientos Se utilizó un vaso precipitado de 100 ml como celda electroforética. Se ubicó un electrodo de trabajo, que correspondió a la probeta a revestir con zinc, y, de similar manera, se posicionó a una distancia de 1 cm un contraelectrodo de acero de geometría rectangular con un área de 12 cm2 (figura 3.11). El conjunto de la celda se situó sobre un agitador magnético. Se consideraron tres probetas individuales, para cada tiempo y voltaje aplicado. Se calculó el promedio aritmético considerando los valores de masa y espesor obtenidos Posteriormente, se energizó la celda mediante una fuente de poder, conectando al terminal positivo el contraelectrodo (ánodo) y el negativo al electrodo de trabajo (cátodo), considerando en el proceso los siguientes parámetros: a) Distancia entre electrodos: 1 cm. b) Tiempo de deposición: 5, 10, 15, 20 y 25 minutos. c) Voltaje aplicado: 50, 100 y 200 V. Se efectuaron pruebas utilizando como medios de dispersión isopropanol, etanol y agua destilada. El medio de suspensión con el cual se obtuvieron mejores resultados, en cuanto a cantidad y uniformidad de los revestimientos obtenidos, fue el isopropanol. 47 Figura 3.11. Celda electroforética y distancia entre electrodos Una vez revestidas las probetas de acero con zinc mediante deposición electroforética, se dejaron en un desecador, para evitar el ambiente de oxidación. Esto durante el tiempo que transcurre entre la extracción desde la suspensión y el ingreso al horno para el proceso térmico. Las piezas revestidas se extraen del desecador y se disponen sobre una pieza de cerámica para ser dejadas en el horno. El procedimiento de consolidación se efectuó a 410 °C durante 2 horas, en un ambiente inerte de gas Argón, ésto para evitar que las placas presenten oxidación. Fue necesario considerar que la temperatura de fusión del zinc corresponde a 420° C (Groover, M. P.. 1997). 3.2.4 Selección de los parámetros operacionales Resulta oportuno indicar que se tomó en consideración la masa depositada y el espesor obtenido de los revestimientos de zinc para los ensayos electroquímicos. La cantidad de masa depositada fue calculada por la diferencia de peso entre la probeta utilizada sin revestimiento y la misma con recubrimiento. De similar forma, se realizó la medición de espesores. Utilizando estas mediciones se seleccionaron las muestras con mejores resultados. 48 3.2.5 Técnicas de análisis 3.2.5.1 Verificación de adherencia Se confirmó la adherencia de los sustratos según lo descrito en la norma estándar ASTM A123/A 123M-00 para revestimientos de zinc sobre productos de aceros y fundiciones (ASTM. 2000). 3.2.5.2 Medición de rugosidad Se efectuaron mediciones de rugosidad de los revestimientos de zinc obtenidos mediante EPD. La distancia sobre la cual se miden las desviaciones, Lm, es de 4 mm. 3.2.5.3 Microscopía electrónica de barrido (MEB) y Espectroscopía de Energía Dispersiva (EDS) Se efectuaron observaciones morfológicas y análisis químicos a los revestimientos de zinc obtenidos mediante EPD utilizando diferentes tiempos de deposición. Este proceso se efectuó sobre los polvos y las probetas antes y después de las mediciones electroquímicas. El microscopio electrónico operó en modo de alto vacío utilizando 20 keV. Las imágenes fueron tomadas usando acercamientos de 500X, 1500X, 10000X y 30000X. 3.2.5.4 Microdureza Vickers La medición de microdureza de los revestimientos de zinc se realizó considerando depósitos electroforéticos a diferentes tiempos. Se utilizaron cargas dependiendo de la necesidad considerada por el operador del equipo, que en este caso resultaron ser de 245.2 y 490.3 mN. Una vez alcanzada la carga se mantuvo durante un tiempo de 15 seg para efectuar la medición. 3.2.5.5 Evaluación electroquímica de los revestimientos Se realizarán las mediciones electroquímicas a los revestimientos de zinc obtenidos mediante EPD usando diferentes tiempos de deposición. El electrolito utilizado en cada una de las mediciones electroquímicas fue una solución de cloruro de sodio de 3.5 % peso/volumen (NaCl 3.5 % p/v). 49 Las probetas se colocaron en un portamuestras de polímero que posteriormente fueron selladas con cinta teflón, para así crear un ambiente hermético. De la probeta, sólo queda al descubierto en el centro un área circular de aproximadamente 4 mm de diámetro, que es la que estará en contacto con el electrolito. 3.2.5.5.1 Configuración de la celda electroquímica En la celda auxiliar, envase plástico, se vaciaron aproximadamente 60 ml del electrolito utilizado. En este envase, se instalaron cada uno de los electrodos: el de trabajo, portamuestras; el de referencia, de plata/cloruro de plata y el auxiliar, de grafito. La celda se coloca sobre el agitador magnético. Se efectúan las conexiones con las terminales de la celda electroquímica Basi. El terminal positivo se conecta con el electrodo auxiliar; el negativo, con el de trabajo y el restante, con el electrodo de referencia. Se procede a encender la celda electroquímica y el potenciostato. Ingresando los datos desde el computador, utilizando el software correspondiente (EPSILON), se emplean las técnicas electroquímicas. Los parámetros de ingreso para cada uno de ellos son: a) Medición del potencial de electrodo: Se mide durante un tiempo de 30 minutos, pues el valor obtenido en ese lapso ya es estable. b) Registro de corriente a potencial constante: El sobrepotencial utilizado es 60 mV. Se realiza la medición durante un tiempo de 30 minutos. c) Medición de corriente mediante un barrido de potencial: La velocidad de barrido corresponde a 1 mV/seg. 3.2.5.6 Química de las soluciones obtenidas en los test electroquímica Se utilizó la técnica de Espectrofotometría de Absorción Atómica (AAS) para efectuar la identificación y cuantificación de los iones metálicos disueltos en la medición electroquímica respectiva (registro de corriente utilizando un sobrepotencial constante). Los elementos zinc, hierro, plomo y cadmio fueron buscados en este procedimiento, pues tienen relación con la composición de los polvos de partida usados. 50 3.2.6 Caracterización de revestimientos de zinc obtenidos por galvanizado en caliente Las técnicas de análisis utilizadas para caracterizar los recubrimientos de zinc obtenidos mediante galvanizado en caliente y efectuar la comparación con los revestimientos que se lograron por EPD fueron: Medición de rugosidad Microscopía electrónica de barrido (MEB) Microdureza Vickers Evaluación mediante métodos electroquímicos Identificación de los componentes de las soluciones utilizadas en electroquímica mediante Espectrofotometría de Absorción Atómica 3.2.7 Espesores de las Probetas ensayadas En los diferentes test de caracterización se utilizaron las probetas indicas en la tabla 3.1. Tabla 3.1. Denominaciones y espesores de las probetas analizadas Probeta Sin revestimiento EPD de 5 minutos EPD de 20 minutos Galvanizado en caliente Nomenclatura SR DE5 DE20 GC Espesores (±Error) mm -0.026 (±0.008) 0.130 (±0.028) 0.074 (±0.051) 51 CAPÍTULO 4 DISCUSIÓN DE RESULTADOS 4.1 OBTENCIÓN DE LOS REVESTIMIENTOS DE ZINC MEDIANTE EPD En las suspensiones elaboradas en etanol y agua destilada los depósitos de zinc obtenidos fueron irregulares, es decir, sólo en ciertas zonas del plinto circular (moneda) de superficie de las probetas se produjo el depósito. Además, se evidenciaron signos de oxidación en la superficie del acero. Estos signos de oxidación quedan de manifiesto al observarse el color café intenso en la probeta a revestir. Los mejores resultados, en cuanto a uniformidad de la superficie de zinc obtenida y masa depositada, se obtuvieron utilizando suspensiones de isopropanol entre 5 y 20 min de deposición a 100 V. Además con NaOH (0.03 g en 100 ml de isopropanol) se mejoró la conductividad del campo eléctrico entre los electrodos, lo que incrementó la eficiencia de la deposición. Utilizando estos parámetros, se elaboraron las probetas necesarias para las diferentes etapas de este trabajo de investigación. Mediante ésto, fue posible deducir los parámetros operacionales: voltaje, tiempo de depósito y la suspensión más óptima para generar los mejores revestimientos (tabla 4.1). 52 Tabla 4.1. Componentes y parámetros utilizados en la suspensión que entregó mejores depósitos C3H8O (ml) 100 Zn (gr) 3 NaOH (gr) 0.03 Voltaje (V) 100 tiempo (min) 20 4.2 TRATAMIENTO TÉRMICO DE LOS REVESTIMIENTOS EN VERDE Los revestimientos mejor consolidados se obtuvieron a 410 °C por 2 horas bajo ambiente de argón, siendo un 0.98 del punto de fusión, no presentando signos de oxidación (tabla 4.2). En cambio, cuando se utilizaron temperaturas menores se produjo desprendimiento de partículas de zinc al tocar la superficie. Al usar una temperatura mayor, como es el caso de 415 °C, la superficie de zinc presentaba zonas blancas y grises metálicas. Siendo las primeras señales de oxidación del zinc, mientras que las segundas, son signo de fundición del material. Tabla 4.2. Efectos del tratamiento térmico en la calidad de los revestimientos de zinc Temperatura (°C) 400 410 415 Tiempo (min) 120 120 120 Características de la superficie Se desprende Aprueba adherencia Signos de oxidación y fundición 4.3 VALORES DE LOS REVESTIMIENTOS OBTENIDOS MEDIANTE EPD De acuerdo a lo observado en las figuras 4.1 y 4.2, los mejores resultados se obtuvieron, en cuanto a masas y espesores de los depósitos, aplicando un voltaje de 100 V durante un intervalo de tiempo de 20 minutos. Al aplicar un voltaje de 200 V no se observa un aumento en la cantidad depositada. Lo usual es que los depósitos aumenten al elevar el valor del voltaje aplicado. Si bien los polvos pueden depositarse con una mayor velocidad, utilizando voltajes mayores, la calidad del depósito se ve reducido (Besra, L. et al. 2006). Un mayor valor de voltaje aplicado puede causar turbulencias en la suspensión. Además, las partículas se mueven a una velocidad tan alta que no logran posicionarse, para lograr una estructura compacta (Basu, R. N. et al. 2001). Considerando estos resultados, todos los revestimientos elaborados para los respectivos análisis fueron efectuados a un voltaje de 100 V. 53 0.25 Masa del depósito (g) 0.20 t= 5 minutos 0.15 t= 10 minutos t= 15 minutos t= 20 minutos 0.10 0.05 0.00 0 50 100 150 200 250 Voltaje (V) Figura 4.1. Cantidad de masa depositada en función del voltaje a diferentes tiempos de proceso 0.180 Espesor del depósito (mm) 0.160 t= 5 minutos 0.140 t= 10 minutos 0.120 t= 15 minutos 0.100 t= 20 minutos 0.080 0.060 0.040 0.020 0.000 0 50 100 150 200 250 Voltaje (V) Figura 4.2. Espesores de los depósitos en función del voltaje a diferentes tiempos de proceso 54 Así se concluye que el incremento del tiempo es proporcional a la masa, como también al espesor de los revestimientos obtenidos. En los gráficos de las figuras 4.3 y 4.4, muestra que hasta los 20 minutos, se puede apreciar la proporcionalidad entre el incremento del tiempo de depósito y el aumento en la cantidad de masa y el espesor de éstos. Incrementando el tiempo, después de los 20 min de deposición, no se aprecia un mejoramiento en los valores de espesor y/o masa. En una EPD a voltaje constante ésto es esperable, pues se debe a la formación de una capa aislante de partículas del material sobre la superficie del electrodo (Zhitomirsky, I. et al. 1997). 0.16 Masa del depósito (g) 0.14 0.12 0.10 0.08 0.06 0.04 0.02 0.00 0 5 10 15 20 25 30 Tiempo (min) Figura 4.3. Cantidad de masa depositada aplicando un voltaje de 100 V 55 0.18 Espesor del depósito (mm) 0.16 0.14 0.12 0.10 0.08 0.06 0.04 0.02 0.00 0 5 10 15 20 25 30 Tiempo (min) Figura 4.4. Espesores de los depósitos aplicando un voltaje de 100 V 4.4 CARACTERIZACION DE LOS REVESTIMIENTOS DE ZINC OBTENIDOS La figura 4.5 muestra dos revestimientos de zinc obtenidos mediante EPD utilizando tiempos de deposición de 5 y 20 minutos, DE5 y DE20. (a) (b) Figura 4.5. Imágenes de revestimientos obtenidos por EPD: (a) DE5 y (b) DE20 56 4.4.1 Verificación de adherencia Se efectuó la verificación de adherencia a dos revestimientos de zinc: DE5 y DE20. Siguiendo el procedimiento estipulado en la norma ASTM A123/A 123M-00. El resultado para ambos casos fue positivo, pues no se desprendieron fragmentos. Sólo sucedió que en ambos revestimientos se soltaron algunas partículas, pero ello no es antecedente para considerar el revestimiento como imperfecto. Lo anterior es coherente si se considera que en el caso de la deposición electroforética efectuada sólo se utilizó zinc y soda cáustica en la suspensión de isopropanol, lo que entregó buenos resultados en lo que corresponde al depósito mismo de las partículas. 4.4.2 Medición de Rugosidad Realizando la correspondiente observación en la tabla 4.3, los valores de Ra, Rq y Rt son mayores en el revestimiento obtenido utilizando un tiempo de 20 minutos, que en el de 5. Esto es coherente considerando que el valor del espesor en dicho revestimiento es mayor. Realizando la comparación entre Ra y Rq en cada uno de los revestimientos, se tiene que Rq es mayor en ambos. Esto se debe a que las desviaciones más grandes tienen mayor importancia en los cálculos del valor de Rq (Groover, M. P.. 1997). Tabla 4.3. Valores de la medición de rugosidad para DE5, DE20 y SR Probeta DE5 DE20 SR Ra (µm) 2.11 2.40 2.72 Rq (µm) 2.66 2.97 3.81 Rt (µm) 14.11 15.25 6.11 4.4.3 Microscopía Electrónica de Barrido (MEB) y Espectroscopía de Energía Dispersiva (EDS) Se observa en la figura 4.6 (a), que el depósito formado en 5 minutos tiene menor distribución de las partículas sobre la superficie, dando una impresión de menos homogeneidad. En cambio, en la figura 4.6 (b), el depósito generado en 20 minutos presenta una disminución de la porosidad. Efectuando las correspondientes observaciones en las figuras, se ve una mayor 57 densidad en el depósito de partículas de zinc en el revestimiento obtenido empleando un tiempo de 20 minutos, lo cual es coherente considerando los espesores que se registraron (a) (b) Figura 4.6. Imágenes de los depósitos de zinc a 500X, utilizando como medio de dispersión isopropanol: (a) DE5 y (b) DE20 Efectuando las correspondientes observaciones en la figura 4.7 (a) y (b) se aprecian nanoagujas sobre la superficie de las partículas de zinc. En la figura (b), DE20, se aprecia un mayor desarrollo de las nanoagujas, consecuencia de una mayor oxidación de los polvos de zinc. Asimismo, es posible indicar que en ambas imágenes se observa una porosidad característica, determinada por el diámetro de la partícula de Zn. 58 (a) (b) Figura 4.7. Imágenes de los depósitos de zinc a 30000X, utilizando como medio de dispersión isopropanol: (a) DE5 y (b) DE20 Desde las imágenes se observa que el proceso de consolidación no fue del todo óptimo, pues no se visualizan uniones entre partículas. Sin embargo, se observa una intensa oxidación térmica que ha generado largas nanoagujas, que se entrelazan entre las partículas, que podría ser una de las causas de la buena fijación del revestimiento sobre la superficie del material base y de las partículas entre sí, similar al efecto producido por el “velcro”. Desde un análisis elemental mediante EDS de los revestimientos obtenidos mediante EPD es posible indicar que, al aumentar el espesor del revestimiento, mayor es la posibilidad de cuantificar el Zn de la superficie de las probetas, reportando valores desde un 85.5 a 90.1 %. Obviamente, las emisiones de Fe provenientes del material base son mayores a menor espesor. Esto resulta coherente considerando que la superficie del acero estructural está con un mayor depósito de partículas de zinc en el revestimiento de más espesor. Lo anteriormente expuesto se registra en la tabla 4.4. El porcentaje restante es completado con la presencia de oxígeno en las muestras. 59 Tabla 4.4. Peso en porcentaje de los principales elementos después de EDS: DE5 y DE20 DE5 Elemento Zn K Fe K Peso % 85.5 2.7 DE20 Elemento Peso % Zn K 90.1 Fe K 0.0 4.4.4 Medición de Microdureza Vickers Para efectuar la indentación en el revestimiento de menor espesor se empleó una carga de 245.2 mN, mientras que para el de mayor espesor se usaron 490.3 mN. El valor obtenido de microdureza Vickers es mayor en el de espesor menor, DE5 (tabla 4.5). Lo anterior puede deberse a que incide en dicha medición la base de acero. Los valores de dureza para óxido de zinc figuran entre 105 y 125 HV (Dhanaraj, G. et al. 2006), lo cual es coherente con el valor obtenido en la probeta DE20. Tabla 4.5. Valores de microdureza Vickers para: DE5, DE20 y SR Probeta DE5 DE20 SR HV 208 126 180 4.4.5 Evaluación electroquímica de las muestras Se emplearon mediciones electroquímicas utilizando las probetas DE5, DE20 y SR, en un ambiente salino. Se efectuaron las siguientes técnicas: evolución del potencial de electrodo a circuito abierto, determinación de carga a potencial constante y evolución de la transferencia de carga por polarización anódica. 4.4.5.1 Evolución del potencial a circuito abierto Una vez que se ha estabilizado la diferencia de potencial entre el electrodo de trabajo y el de referencia, lo que ocurre durante un lapso de tiempo no mayor a 15 minutos para cada una de las probetas, se obtiene el correspondiente valor de potencial. 60 Considerando las probetas revestidas (DE5, DE20) y sin revestir (SR), se registraron valores de potencial que no difieren significativamente. Cabe destacar que el valor de potencial de una probeta sin revestimiento, acero, es -0.57 V, que resulta ser menos negativo que los otros valores, lo cual es coherente con la tabla Serie de fuerzas electromotrices (fem) para elementos y reacciones seleccionados (Askeland, D. R. et al. 2004). Los valores reportados por DE5 y DE20, -1.06 y -1.08 V no se diferencian mayormente. 4.4.5.2 Determinación de carga a potencial constante 12 Corriente de respuesta (mA) 10 8 6 4 DE5 DE20 2 SR 0 0 5 10 15 20 25 30 Tiempo de aplicación del sobrepotencial (min) Figura 4.8. Comportamiento de DE5, DE20 y SR en el tiempo bajo un sobrepotencial de 60 mV La corriente de respuesta que se registra producto del sobrepotencial aplicado, 60 mV, nos entrega la medida de cantidad de carga total, en coulombs [C] (figura 4.8). En DE5, sólo actúa zinc hasta un tiempo de 2.2 min. Para el caso de DE20, la protección del zinc dura hasta los 10.8 minutos. 61 En la zona donde aún queda zinc, pero donde ya está actuando el hierro, el tiempo para DE5, entre 2.2 y 4.1 minutos, es menor que para DE20, desde 10.8 a 19.1 minutos (1.9 y 8.3 minutos respectivamente), lo que es coherente con los valores de espesores de zinc iniciales. Se observa que en la zona donde actúa solamente el acero (para DE20 desde 19.1 minutos), los valores de corriente eléctrica obtenidos son mayores para DE5 que para DE20, es decir, la carga eléctrica registrada en esta zona es mayor para DE5, por tanto pasa a la solución una mayor cantidad de hierro. El valor menor de carga eléctrica del revestimiento de mayor espesor significa que hay una mayor resistencia a la degradación, pues para proteger los metales de la corrosión se requiere que la corriente sea lo más pequeña posible, para que no existan iones metálicos que pasen a la solución, como fue detectado por los análisis elementales mediante AAS. DE20 registra valores menores de corriente de respuesta que SR en la zona donde actúa sólo el hierro, lo que indica que está efectuándose la correspondiente protección contra la corrosión, pues la carga eléctrica registrada es menor. 4.4.5.3 Evolución de la transferencia de carga por polarización anódica 12 10 Corriente de respuesta (mA) DE5 8 DE20 SR 6 4 2 0 -1000 -500 0 -2 500 1000 1500 Sobrepotencial (mV) Figura 4.9. Curvas de polarización para DE5, DE20 y SR 62 De acuerdo a la obtención de curvas de polarización, se ha permitido determinar los sobrepotenciales a los cuales se degrada el zinc y el fierro (figura 4.9). En la muestra DE5, sólo actúa zinc hasta llegar a un valor de sobrepotencial de 612 mV registrando un valor de corriente de 7.29 mA. Para el caso de DE20, la protección del zinc llega a 442 mV marcando un valor de corriente de 9.59 mA. La probeta DE20 tiene un mayor depósito de zinc, lo cual aporta una mayor protección al acero. De acuerdo a estos resultados, la acción protectora del zinc depende directamente del grosor de la capa obtenida por deposición electroforética. En la zona donde aún queda zinc, pero donde ya está actuando el hierro, los valores de sobrepotencial de DE5 están entre 612 y 246 mV, registrando valores de corriente entre 7.29 y 1.97 mA. Para DE20 los valores de sobrepotencial se encuentran entre 442 y 97 mV, registrando valores de corriente entre 9.59 y 3.74 mA. En la muestra DE5, en el intervalo de sobrepotencial que está entre 500 y 400 mV, se presume que interviene algún elemento presente en las partículas de zinc, que según el fabricante pueden ser plomo, cadmio o estaño. Asimismo, se obtuvo también una curva de polarización utilizando una muestra SR. En esta se aprecia cómo trabaja el acero a valores de potencial mayores que el zinc, considerando 600 mV, lo que es coherente con la serie de fuerzas electromotrices (fem) para elementos y reacciones seleccionados (Askeland, D. R. et al. 2004). 4.4.6 Análisis de las soluciones utilizadas en electroquímica AAS Las soluciones salinas remanentes de las pruebas electroquímicas de las muestras estudiadas se analizaron mediante espectroscopia de absorción atómica, para realizar la identificación de los elementos y sus respectivas concentraciones. Sólo se buscaron elementos comunes en el polvo de zinc utilizado: hierro, plomo, cadmio y, obviamente, Zn. Se detectó que la concentración de hierro es casi un 90 % mayor en la solución de la muestra DE5 que en la de la muestra DE20 (tabla 4.6). Esto es coherente, considerando que el revestimiento de zinc DE5, que cubre la superficie del acero, es de menor espesor. 63 En relación al Zn presente en las soluciones, en la probeta DE20 aumenta en más de un 20 % en comparación con la solución de la probeta DE5. Esto es consistente, pues la cantidad de zinc depositada es mayor, por lo cual, se genera mayor protección para la base de acero. Tabla 4.6. Concentraciones de los elementos presentes en las soluciones de NaCl donde se efectuaron las mediciones electroquímicas Probeta DE5 DE20 SR Fe (mg/l) 40.9 4.7 40.3 Zn (mg/l) 15.9 19.4 - Pb (mg/l) - Cd (mg/l) - 4.4.7 MEB de una muestra posterior al análisis electroquímico Luego de la aplicación del sobrepotencial anódico a las probetas DE5 y DE20, en las figuras 4.10 y 4.11, se observa el evidente daño en la zona expuesta a la solución salina. (a) (b) Figura 4.10. Imágenes de la muestra DE5: (a) antes y (b) después de aplicado el sobrepotencial 64 (a) (b) Figura 4.11. Imágenes de la muestra DE20: (a) antes y (b) después de aplicado el sobrepotencial. La figura 4.12 (b) corresponde a la observación por microscopía electrónica de la superficie de la muestra DE20, luego del ataque anódico. Se aprecia la presencia de productos de la degradación del zinc, en forma de óxidos o cloruros de este metal. Resulta más probable la presencia de óxido de zinc (ZnO) en la zona dañada, pues el cloruro necesita mayor energía de formación, 99.40 Kcal, mientras que el óxido sólo requiere 83.17 Kcal (Askeland, D. R. et al. 2004). (a) (b) Figura 4.12. Imágenes a 1500X de los revestimientos de zinc luego de efectuado el ataque en ambiente salino: a) DE5 y b) DE20 65 Junto con la obtención de imágenes de las superficies, también se hicieron estudios sobre la composición química de éstas mediante EDS. Se seleccionaron zonas dañadas y no dañadas por el contacto con el medio agresivo. En la figura 4.13 (a) se observa el depósito de zinc que cubre la totalidad de la superficie de la probeta de acero. Lo anteriormente mencionado no ocurre en la zona dañada, en la cual se aprecia que se ha perdido prácticamente la totalidad de las partículas de zinc y su correspondiente cristalinidad, figura 4.13 (b). (a) (b) Figura 4.13. Imágenes a 1500X del revestimiento DE20: (a) zona revestida con zinc y (b) zona dañada luego del ataque corrosivo El análisis químico elemental realizado en ambas zonas de la probeta, parte aún revestida y sección dañada del revestimiento, muestra una disminución considerable del elemento zinc, Zn K, en la zona dañada, que equivale a un descenso de 67 %. En el caso del hierro en la parte corroída, Fe K, éste aumentó su valor porcentual casi 73 veces. Esto tiene coherencia considerando que en la parte que aún permanece revestida el acero está recubierto casi en su totalidad. El cloro, elemento componente del cloruro de sodio, NaCl, utilizado en las mediciones electroquímicas, registra una cantidad considerable en la zona dañada en relación a la zona revestida, ésto indica la existencia de productos de corrosión. Se considera un error experimental el que en la zona que no fue expuesta al ataque salino aparezca un valor diferente de cero para el elemento cloro. Se presume que ello ocurrió por algún residuo que quedó en el portamuestras de ensayo, pese a 66 que siempre se efectuó la limpieza recomendada con agua destilada en cada una de las mediciones. En la tabla 4.7 se pueden observar los datos cuantitativos de los elementos químicos. Tabla 4.7. Análisis elemental de la muestra DE20 luego de realizar el análisis químico: (a) zona revestida con zinc y (b) zona dañada luego del ataque corrosivo Elemento Zn K Fe K Cl K Total Peso % 78.0 0.5 1.9 100.0 (a) Elemento Zn K Fe K Cl K Total Peso % 25.9 36.3 4.1 100.0 (b) 4.5 COMPARACIÓN DE REVESTIMIENTOS OBTENIDOS MEDIANTE EPD Y GALVANIZADO 4.5.1 Medición de rugosidad (a) (b) Figura 4.14. Imágenes de revestimientos de zinc: a) DE20 y b) GC Se consideró también realizar la medición de rugosidad a dos revestimientos de zinc cuyos espesores son comparables: DE20 y GC. Los valores Ra, Rq y Rt son menores en GC, que en DE20. 67 Esto ocurre porque, en el caso del galvanizado en caliente, la probeta de acero es sumergida en zinc fundido obteniéndose un revestimiento más liso. Considerando que en el otro caso el revestimiento se obtiene mediante depósitos de partículas, éstos son siempre más irregulares debido a los factores involucrados como: distancia de los electrodos, verticalidad de éstos, agitación de las suspensiones. Tabla 4.8. Comparación de la rugosidad para DE20, GC y SR Probeta DE20 GC SR Ra (µm) 2.40 1.18 2.72 Rq (µm) 2.97 1.59 3.81 Rt (µm) 15.25 8.01 6.11 4.5.2 Microscopía Electrónica de Barrido (MEB) de GC y DE En la figura 4.15, se tienen dos revestimientos de zinc: DE20 y GC. En el primero se observa una superficie rugosa, con una notoria porosidad. En GC la superficie se presenta lisa, sin presencia de porosidad. En este revestimiento se observa la correspondiente formación de granos. (a) (b) Figura 4.15. Imágenes a 1500X de revestimientos de zinc: (a) DE20 y (b) GC 68 4.5.3 Medición de Microdureza Vickers Se efectuó también la medición de microdureza en: DE20, GC y SR. Se utilizaron revestimientos de espesor comparable. Se hicieron tres indentaciones por recubrimiento registrando el correspondiente promedio aritmético. Se obtiene un mayor valor de microdureza en el revestimiento obtenido utilizando depósitos electroforéticos, que en el revestimiento por galvanizado. Se puede justificar esto considerando que el proceso de sinterizado, realizado en los revestimientos que se obtuvieron por depósitos, es una operación de tratamiento térmico, que se ejecuta sobre el compactado para unir sus partículas metálicas, incrementando de esta manera su fuerza y resistencia (Groover, M. P.. 1997), mientras que el galvanizado por inmersión en caliente se realiza sumergiendo las muestras de acero en un baño de zinc fundido (Askeland, D. R. et al. 2004). Tabla 4.9. Valores de microdureza Vickers para DE20, GC y SR Probeta DE20 GC SR HV 126 38 180 4.5.4 Evaluación electroquímica de las muestras Se emplearon mediciones electroquímicas utilizando las probetas DE20, GC y SR, en un ambiente salino. Se efectuaron las siguientes técnicas: evolución del potencial de electrodo a circuito abierto, registro de corriente a potencial constante y evolución de la transferencia de carga por polarización anódica. 4.5.4.1 Evolución del potencial a circuito abierto Una vez que se ha estabilizado la diferencia de potencial entre el electrodo de trabajo y el de referencia, lo que ocurre durante un lapso de tiempo no mayor a 15 minutos para cada una de las probetas, se obtiene el correspondiente valor. Desde las probetas revestidas (DE20, GC) y sin revestir (SR), se registraron valores de potencial que no difieren significativamente. Cabe destacar que el valor de potencial de una 69 probeta sin revestimiento, acero, es -0.57 V, que resulta ser menos negativo que los otros valores, lo que es coherente con la tabla Serie de fuerzas electromotrices (fem) para elementos y reacciones seleccionados (Askeland, D. R. et al. 2004). Los valores reportados por DE20 y GC, -1.08 y -1.03 V no difieren significativamente. 4.5.4.2 Determinación de carga a potencial constante 12.00 Corriente de respuesta (mA) 10.00 8.00 6.00 4.00 DE20 GC 2.00 SR 0.00 0 5 10 15 20 25 30 Tiempo de aplicación del sobrepotencial (min) Figura 4.16. Comportamiento de DE20, GC y SR en el tiempo bajo un sobrepotencial de 60 mV La corriente de respuesta que se registra producto del sobrepotencial aplicado, 60 mV, durante un tiempo de 30 minutos, nos entrega la medida de cantidad de carga total, en coulombs [C] (figura 4.16). En DE20, se degrada el zinc hasta un tiempo de 10.8 min. Para el caso de GC, la acción protectora del zinc dura hasta los 17.3 minutos. 70 En la zona donde aún queda zinc, pero donde ya está actuando el hierro, desde 10.8 a 19.1 minutos, el tiempo para DE20 es 8.3 minutos. En el caso de GC, esta zona empieza en los 17.3 minutos no finalizando durante el tiempo que se realizó la medición. Se observa que en la zona donde actúa sólo hierro, para DE20 comienza a los 19.1 minutos, mientras que para GC durante el tiempo de medición, 30 minutos, aún no se aprecia este tramo. DE20 registra valores menores de corriente de respuesta que SR en la zona donde actúa sólo el hierro, lo que indica que está efectuándose la correspondiente protección contra la corrosión, pues la carga eléctrica registrada es menor. 4.5.4.3 Evolución de la transferencia de carga por polarización anódica 12.00 Corriente de respuesta (mA) 10.00 8.00 6.00 DE20 GC SR 4.00 2.00 0.00 -1000 -500 0 -2.00 500 1000 1500 Sobrepotencial (mV) Figura 4.17. Curvas de polarización para las muestras DE20, GC y SR 71 De acuerdo a la forma de las curvas de polarización, es posible discriminar entre las zonas de sobrepotencial en las cuales el zinc está activo de aquéllas en las que el acero se activa, para cada una de las muestras. La figura 4.17 muestra estas curvas. En DE20, solamente actúa zinc hasta llegar a un valor de sobrepotencial de 442 mV registrando un valor de corriente de 9.59 mA. Para el caso de GC, el zinc no se inactiva en este rango de potencial, de 1000 a -1000 mV, proporcionando protección en todo el rango, a diferencia de la muestra DE20. Para el caso de la muestra SR, se aprecia en la curva la degradación del acero a valores de potencial mayores que el zinc, lo que es coherente con la serie de fuerzas electromotrices (fem) para elementos y reacciones seleccionados (Askeland, D. R. et al. 2004). 4.5.4.4 Análisis mediante AAS de las soluciones resultantes de la polarización anódica La tabla 4.10 muestra las concentraciones de los elementos químicos analizados. Se observa que hay mayor concentración de hierro en la solución donde fue ensayada la muestra SR y valores muy próximos para las restantes. En el caso de la concentración de zinc, lógicamente no se detecta en la muestra SR, y es mayor en la muestra GC respecto a la DE20. La acción protectora del zinc se manifiesta mientras mayor sea la cantidad de zinc que pasa a la solución. En la muestra GC por cada ppm de ion hierro(II) que pasa a la solución pasan 5.2 ppm de ion Zn(II). En el caso de la muestra DE20 sólo se registran 4.7 ppm de ion hierro (II). En cuanto a la solución donde se ensayó SR, se observa en la tabla 4.10 que la cantidad de hierro, Fe, componente principal del acero estructural, es casi diez veces mayor que en las probetas revestidas con zinc en cualquiera de las dos modalidades, DE20 y GC. Se consideraron en el análisis mediante AAS plomo y cadmio porque forman parte de la composición de los polvos de zinc utilizados. 72 Tabla 4.10. Concentraciones de los elementos presentes en las soluciones de NaCl 3.5 % p/v. luego de la aplicación de +60 mV de sobrepotencial durante 30 minutos Probeta DE20 GC SR Fe (mg/l) 4.7 5.1 40.3 Zn (mg/l) 19.4 26.6 - Pb (mg/l) - Cd (mg/l) - 4.5.4.5 MEB de muestras posterior a la polarización anódica Las imágenes que se muestran a continuación corresponden a las muestras DE5, de espesor 0.040 mm, y GC, de espesor 0.049 mm, antes y después de ser atacadas electroquímicamente. (a) (b) Figura 4.18. Imágenes de DE5: (a) antes de efectuar el procedimiento y (b) después de realizar la medición (a) (b) Figura 4.19: Imágenes de GC: (a) antes y (b) después del procedimiento de medición 73 La comparación de los revestimientos de zinc en las muestras DE5 y GC, que se muestran en la figura 4.20 (a) y (b) respectivamente, informan de una mayor transformación química en el revestimiento DE5 que en el del galvanizado en caliente, lo que corrobora la idea de una menor continuidad del recubrimiento y por tanto de una mayor área expuesta a la transformación del zinc a óxido y/o cloruro de Zn. Resulta más probable la presencia de óxido de zinc (ZnO) en la zona dañada, porque el cloruro necesita mayor energía de formación, 99.40 Kcal, mientras que el óxido de zinc sólo requiere 83.17 Kcal (Askeland, D. R. et al. 2004). (a) (b) Figura 4.20. Imágenes a 1500X de los revestimientos de zinc luego de efectuado el ataque en ambiente salino: (a) DE5 y (b) GC 74 CAPÍTULO 5 CONCLUSIONES En este estudio fue posible conseguir recubrimientos homogéneos y fuertemente adheridos a la superficie del acero del tipo utilizado en construcción, mediante deposición electroforética, con valores de espesores y masas dependientes del tiempo. El isopropanol fue el medio de suspensión donde se obtuvo el mejor resultado en cuanto a valores de espesor y masa de los revestimientos de zinc depositados electroforéticamente. En este tipo de suspensiones el mejor resultado se obtuvo utilizando un voltaje de 100 V durante un tiempo de deposición de 20 minutos. El proceso de elaboración de los revestimientos de Zinc no fue completamente óptimo, pues durante el proceso térmico no se produjo la sinterización. Sin embargo, se observa una intensa oxidación térmica que ha generado largas nanoagujas, que se entrelazan entre las partículas, la que podría ser una de las causas de la buena fijación del revestimiento sobre la 75 topografía de la superficie del material base, similar al efecto producido por el “velcro”. Esto último es factible de profundizar en un posterior estudio, debido a la potencialidad que puede generar tecnológicamente este fenómeno. Desde el punto de vista de la corrosión, el revestimiento de Zn como se constituye se presenta como un buen candidato para protección catódica, teniendo un eficiente comportamiento anódico, comparable al de los revestimientos galvánicos comerciales. Es oportuno indicar que mediante un eficiente cuidado de los aspectos químicos de las suspensiones y los parámetros de funcionamiento, el proceso de deposición electroforética tiene elevadas posibilidades de llegar a buenos resultados en la generación de diferentes recubrimientos para múltiples finalidades, como la protección catódica de aceros estructurales de obras civiles. 76 REFERENCIAS ASKELAND, D. R.; PHULÉ, P. P..2004. Ciencia e ingeniería de los materials. Cuarta edición. México. International Thomson Editores, S.A. de C.V.. 1004 p. ASTM. 2000. A 123/A 123M – 00 Standard Specification for Zinc (Hot-Dip Galvanized) Coatings on Iron and Steel Products. Current edition approved June 10, 2000. Originally published as A 123 – 28 T. Last previous edition A 123 – 97a (1999)e1. 7p. BASU, R. N.; RANDALL, C. A.; MAYO, M. J.. 2001. Fabrication of dense zirconia electrolyte films for tubular solid oxide fuel cells by electrophoretic deposition. J Am Ceram Soc;84(1):33–40. BBOSCH1. 2012. (Disponible en: http://www.bboschrecubrimientos.cl/ambiente.html . Consultado el: 22 de noviembre de 2012). BBOSCH2. 2012. (Disponible en: http://www.bboschrecubrimientos.cl/galvanizado.html . Consultado el: 22 de noviembre de 2012). BBOSCH3. 2012. (Disponible en: http://www.bboschrecubrimientos.cl/celulosa.html . Consultado el: 23 de noviembre de 2012). BBOSCH4. 2012. (Disponible en: http://www.bboschrecubrimientos.cl/plantas.html . Consultado el: 23 de noviembre de 2012). BESRA, L.; LIU, M.. 2007. A review on fundamentals and applications of electrophoretic deposition (EPD). Science Direct. Progress in Materials Science 52 (2007) 1-61. 77 BOCCACCINI, A. R.; KERN, H.; KRUEGER, H. G.; TRUSTY, P. A.; TAPLIN, D. M. R.. 1998. Electrophoretic deposition of nanoceramic particles onto electrically conducting fibre fabrics. In: Proceedings of the 43rd international scientific colloquium. Technical University of Ilmenau, September 21–24; p. 630–5. CINTAC. 2012. Catálogo de Tubest, Vigas y Placas de conexión. Catálogos y Manuales Técnicos de los productos CINTAC. 31 p. DHANARAJ, G.; DUDLEY, M.; BLISS, D.; CALLAHAN, M.; HARRIS, M.. 2006. Growth and process induced dislocations in zinc oxide crystals. Journal of Crystal Growth, Volume 297, Issue 1, 15 December 2006, Pages 74–79. DU, C.; HELDBRANT, D.; PAN, N.. 2002. Preparation and preliminary property study of carbon nanotubes films by electrophoretic deposition. Mater Lett 2002;57:434–8. DUPONT.2013. (Disponible en: http://www.coatingsolutions.dupont.com/portal/es?page=2.2.1_Paint_System_Categories_and_Details&c ategory=electrodeposition_coatings . Consultado el 12 de abril de 2013). FERRARI, B.; SANCHEZ-HERENCIA, A. J.; MORENO, R.. 1998. Electrophoretic forming of Al2O3/Y-TZP layered ceramics form aqueous suspension. Mater Res Bull 1998;33(3):487–99. FERRARI, B.; MORENO, R.. 1998. Conformado de materiales cerámicos por electrofóresis en medios acuosos. Bol. Soc. Esp. Cerám. Vidr.. Mayo 1998. Vol. 37 Núm. 5 Mayo-Junio 1998. P368-381. 14p. GALVELE, J. R.; DUFFÓ, G. S.. 2006. Degradación de materiales – Corrosión. 1ª Edición. Instituto Sabato. 409p. GOLSTEIN, J.; NEWBURY, P.; ECHLIN, D.. 2003. Scanning Electron Microscopy and X-Ray Microanalysis. 3ª Ed. USA. Plenum publishers. 689p. GROOVER, M. P.. 1997. Fundamentos de Manufactura Moderna; Materiales, Procesos y Sistemas. Prentice Hall Hispanoamericana, S.A.. 1062 p. HAMAKER, H. C.. 1940. Formation of deposition by electrofhoresis. Tran Farad Soc 1940:36:279-83. HASEGAWA, K.; KUNUGI, S.; TATSUMISAGO, M.; MINAMI, T.. 1999. Preparation of thick films by electrophoretic deposition using modified silica particles derived by sol–gel method. J Sol–gel Sci Technol 1999;15:243–9. HASHAIKEH, R.. 2000. Fabrication of Thermal Barrier Coating Using Electrochemical Methods. A thesis Submitted to the Faculty of Graduate Studies and Research in Partial Fulfillment of the Requirements for the Degree of Masters of Engineering. Department of Mining and Metallurgical Engineering, McGill University, Montreal, Canada. P15-41. 27p. 80p. HAYASHI, K.; FURUYA, N.. 2004. Preparation of gas diffusion electrodes by electrophoretic deposition. J Electrochem Soc 2004;151(3):A354–7. 78 INN-CHILE. 2006. NCh203.Of2006; Aceros para uso estructural-Requisitos (Norma). Chile. Instituto Nacional de Normalización-INN. 29 p. LIMMER, S. J.; CAO, G.. 2003. Sol-gel electrophoretic deposition for the growth of oxide nanorods. Adv Mater; 15(5): 427-31. LÓPEZ, I.. 2005. Estudio de un nanomaterial base TiFe, como electrodo en baterías recargables tipo NiMH, obtenido por aleado mecánico de alta energía. Tesis Maestría. MAITI, H. S.; DATTA, S.; BASU, R. N.. 1989. High Tc superconductor coating on metal substrates by an electrophoretic technique. J Am Ceram Soc 1989;72(9):1733–5. MATAMALA R., G.. 2004. Corrosión. Talleres Dirección de Docencia, Universidad de Concepción. 215 p. MATAMALA R., G.. 2007. Protección de materiales. Concepción. Talleres Dirección de Docencia, Universidad de Concepción. 285 p. Ochsenkuehn-Petropoulou, M. T.; Altzoumailis, A. F.; Argyropoulou, R.; Ochsenkuehn, K. M.. 2004. Superconducting coatings of MgB2 prepared by electrophoretic deposition. Anal Bioanal Chem 2004;379:792–5. PUT, S.; VLEUGELS, J.; ANNE, G.; VAN DER BIEST, O.. 2003. Functionally graded ceramic and ceramic-metal composites shaped by electrophoretic deposition. Colloids Surf A: Physicochem Eng Aspects 2003;222:223–32. RANDALL, C. A.; VAN TASSEL, J.; HITOMI, A.; DAGA, A.; BASU, R. N.; LANAGAN, M.. 2000. Usos del dispositivo electrocerámico de deposición electroforética. Journal of Materials Education. Edición en Español. Vol. 22.Número 4-6. p133-148. 16p. SARKAR, P.; NICHOLSON, P. S.. 1996. Electrophoretic Deposition (EPD), mechanisms, kinetics, and aplicattion to ceramics. J. Amer. Ceram Soc.. Agosto 1996. Vol. 79 Núm. 8 Mayo-Junio 1996. p1987-2002. 16p. SATO, N.; KAWACHI, M.; NOTO, K.; YOSHIMOTO, N.; YOSHIZAWA, M.. 2001. Effect of particle size reduction on crack formation in electrophoretically deposited YBCO films. Physica C. 357–360:1019–22. SHAN, W.; ZHANG, Y.; YANG, W.; KE, C.; GAO, Z.; KE, Y.. 2004. Electrophoretic deposition of nano-size zeolites in non-aqueous medium and its application in fabricating thin zeolite membranes. Micropor Mesopor Mater 2004;69:35–42. SHERWINWILLIAMS. 2012. (Disponible en: http://www.preguntaleasherwin.cl/2012/%C2%BFcuales-sonlos-diferentes-tipos-de-corrosion/ . Consultado el: 23 de noviembre de 2012). SKOOG, A. D.; HELLER, F. J.; NIEMAN, T. A.. 2001. Principios de Análisis Instrumental. McGRAWHILL/INTERAMERICANA DE ESPAÑA. 558p. 79 VAN TASSEL, J.; RANDALL, C. A.. 1999. Electrophoretic deposition and sintering of thin/thick PZT film. J Eur Ceram Soc 1999;19:955–8. VARGAS, G.; MUÑOZ, A.; MÉNDEZ, J.; MÉNDEZ, M.; MONDRAGÓN, P.. 2003. Deposición electroforética de una porcelana dental sobre acero inoxidable austenítico 304. Bol. Soc. Esp. Cerám. Vidrio, 42 (1) 21-26. WEI, M.; RUYS, A. J.; MILTHORPE, B. K.; SORRELL, C. C.; EVANS, J. H.. 2001. Electrophoretic deposition of hydroxyapatite coatings on metal substrate: a nano-particulate dual coating approach. J Sol–gel Sci Technol 2001; 21:39–48. YAMASHITA, K.; YONEHARA, E.; DING, X.; NAGAI, M.; UMEGAKI, T.; MATSUDA, M.. 1998. Electrophoretic coating of multilayered apatite composite on alumina ceramics. HA coating on alumina ceramics. John Wiley and sons, Inc.; 1998, p. 46–53. YUM, J-H; SEO, S-Y; LEE, S.; SUNG, Y-E. 2003. Y3Al5O12: Ce0.05 phosphor coating on gallium nitride for white light emitting diodes. J Electrochem Soc 2003; 150(2):H47–52. ZHITOMIRSKY, I.; GAL-OR, L.. 1997. Electrophoretic deposition of hydroxyapatite. J Mater Sci: Mater Med;8: 213–9. 80 ANEXOS 81 ANEXO 1: Resultados Preliminares de Deposición Los valores de los revestimientos, considerando valores de espesor y masa de los depósitos obtenidos utilizando diferentes tiempos de deposición, son los siguientes: Utilizando un tiempo de 5 minutos: Voltaje (V) 50 e1 (mm) 0.002 e2 (mm) 0.007 e3 (mm) 0.009 Prom. e (mm) 0.006 100 0.019 0.024 0.034 0.026 200 0.011 0.012 0.016 0.013 Voltaje (V) 50 100 200 m1 (gr) 0.01 0.02 0.02 m2 (gr) 0.02 0.03 0.03 m3 (gr) 0.02 0.05 0.03 Prom. m (gr) 0.02 0.03 0.03 Utilizando un tiempo de 10 minutos: Voltaje (V) 50 e1 (mm) 0.006 e2 (mm) 0.006 e3 (mm) 0.013 Prom. e (mm) 0.008 100 0.023 0.032 0.045 0.033 200 0.036 0.039 0.047 0.041 Voltaje (V) 50 100 200 m1 (gr) 0.01 0.05 0.03 m2 (gr) 0.02 0.05 0.04 m3 (gr) 0.03 0.06 0.04 Prom. m (gr) 0.02 0.05 0.04 82 ANEXO 1 (continuación) Utilizando un tiempo de 15 minutos: Voltaje (V) 50 100 200 e1 (mm) 0.016 0.056 0.048 e2 (mm) 0.020 0.063 0.049 e3 (mm) 0.027 0.073 0.054 Prom. e (mm) 0.021 0.064 0.050 Voltaje (V) 50 100 200 m1 (gr) 0.02 0.11 0.07 m2 (gr) 0.02 0.14 0.08 m3 (gr) 0.03 0.15 0.08 Prom. m (gr) 0.02 0.13 0.08 Utilizando un tiempo de 20 minutos: Voltaje (V) 50 100 200 e1 (mm) 0.017 0.104 0.091 e2 (mm) 0.024 0.127 0.092 e3 (mm) 0.035 0.160 0.097 Prom. e (mm) 0.025 0.130 0.093 Voltaje (V) 50 100 200 m1 (gr) 0.03 0.12 0.10 m2 (gr) 0.04 0.22 0.13 m3 (gr) 0.03 0.22 0.14 Prom. m (gr) 0.03 0.19 0.12 83 ANEXO 2: Tiempo y espesores de los revestimientos estudiados Los diferentes valores de los revestimientos, considerando espesor y masa de los depósitos obtenidos utilizando un voltaje de 100 Volts, son los siguientes: t (min) 5 10 15 20 25 e1 (mm) 0.019 0.023 0.056 0.104 0.094 e2 (mm) 0.024 0.032 0.063 0.127 0.113 e3 (mm) 0.034 0.045 0.073 0.160 0.127 Prom. e (mm) 0.026 0.033 0.064 0.130 0.111 t (min) 5 10 15 20 25 m1 (gr) 0.02 0.05 0.11 0.12 0.10 m2 (gr) 0.03 0.05 0.14 0.22 0.12 m3 (gr) 0.05 0.06 0.15 0.22 0.16 Prom. m (gr) 0.03 0.05 0.13 0.19 0.13 84 ANEXO 3: Pruebas electroquímicas Efectuando las técnicas electroquímicas de medición del potencial de electrodo a circuito abierto y de la corriente de respuesta a potencial constante se obtuvieron los siguientes resultados (no se considera el valor menor ni el mayor): Probeta SR DE5 DE20 GC e<0.040mm GC 0.040mm<e Potencial de Estabilización V -0.55 -0.57 *-0.57 -0.6 -1.02 -1.06 -1.06 *-1.06 -1.07 -1.04 *-1.08 -1.08 -1.08 -1.09 -0.87 -0.99 -0.99 -1 *-0.99 *-1.03 -1.03 -1.04 -1.03 Carga Neta C 3.84 4.32 4.32 5.92 5.17 1.41 4.08 4.08 4.77 2.14 3.57 3.57 1.93 3.83 4.28 3.54 3.72 3.81 3.72 4.19 4.19 2.35 4.28 *: probeta que fue considerada 85