antecedentes - tesis.uson.mx
Anuncio

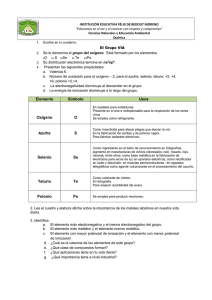
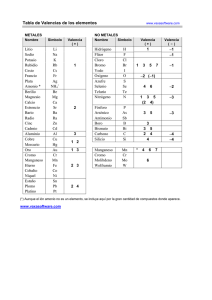
2. ANTECEDENTES 2.1. El proceso convencional de producción de telurio 2.1.1 Procesamiento de las diferentes fuentes de telurio en la industria del cobre El proceso convencional para la recuperación de telurio en forma de telurio elemental puede tener muchas variantes dependiendo del origen del material portador del telurio. En el proceso pirometalúrgico para producción de cobre, la materia prima que contiene telurio son los concentrados de cobre que se alimentan en la etapa de fundición. En estos materiales el contenido de telurio es apenas detectable pero que a medida que el proceso de purificación de cobre avanza en las diferentes etapas, éste se va concentrando al igual que el selenio en la fase metálica, formando complejos metálicos con el cobre, plata y oro. De esta forma, cuando termina el proceso de fundición, el telurio se concentra en el cobre anódico. En Mexicana de Cobre, el contenido de este elemento se ha incrementado de 40 a 75 ppm [27] en el cobre anódico hasta aproximadamente 200 ppm [28] en la actualidad, debido a la reciente alimentación de otro tipo de materiales. Posterior al proceso de fundición de los concentrados de cobre en donde se obtiene el cobre anódico, el siguiente proceso es el correspondiente al de la electro-refinación de cobre, el cual consiste en someter al ánodo de cobre a un sobrepotencial en una celda electrolítica, en donde el cátodo puede ser un electrodo de acero inoxidable o bien una placa de cobre (hoja iniciadora). Al aplicársele un sobrepotencial al ánodo de cobre el cual está inmerso en un electrolito constituido por una solución de ácido sulfúrico y sulfato de cobre (CuSO4), el ánodo se disuelve y en el cátodo se obtiene un depósito de cobre con un grado de pureza mayor que la del ánodo alimentado en esta operación. Impurezas tales como el arsénico, antimonio y bismuto se solubilizan parcialmente y otra fracción precipita en los lodos anódicos junto a los metales preciosos (Ag, Au, Pt y Pd). Estos lodos anódicos también son ricos en cobre y contienen prácticamente todo el selenio y telurio inicialmente presentes en el cobre anódico. Estos lodos anódicos que son colectados del fondo de la celda electrolítica, son enviados dentro del mismo proceso de electro-refinación, a un proceso de decobrización en un xvii reactor a presión en donde estos son contactados con una solución de ácido sulfúrico y donde es inyectado oxígeno a presión a alta temperatura [6,7]. Esta reducción en el contenido de cobre de los lodos anódicos es necesario hacerlo antes de enviar este material hacia la planta de metales preciosos. Debido a que este pretratamiento de lixiviación de los lodos anódicos en ocasiones es bastante severo, en algunos casos dependiendo también de la mineralogía de estos lodos, se ha reportado que fuertes proporciones del telurio contenido es disuelto en la solución de decobrización y el resto se queda en los lodos decobrizados. En la refinería electrolítica de Mexicana de Cobre esto no ocurre probablemente debido a que se tiene una lixiviación no muy severa y a que el porcentaje de plata en los lodos anódicos es muy alto (23 % de Ag al final de la decobrización) lo cual incrementa la formación de compuestos de telurio más estables como el telururo de plata (Ag2Te) en vez del normal telururo de cobre (Cu2Te). Se ha estimado que la proporción del telurio lixiviado con respecto al total que traen los lodos es menor del 20 %. Debido a lo anterior, la mayor proporción del telurio contenido en los lodos anódicos tiene como destino la planta de metales preciosos que finalmente lo extrae del proceso como componente importante en una escoria alcalina. 2.1.1.1 Recuperación del telurio de soluciones ácidas En el método tradicional de recuperación de telurio cuando se parte de soluciones ácidas provenientes de la decobrización de los lodos, la técnica es la precipitación del telurio como telururo de cobre (Cu2Te) por medio de la adición de trozos pequeños de cobre metálico en un reactor especial de destelurización. En alguna ocasión se ha mencionado [6] que el estado de oxidación del telurio en dichas soluciones puede ser de (+4) como ácido teluroso (H2TeO3), pero que en ocasiones se puede encontrar telurio con estado de oxidación (+6) como ácido telúrico (H2TeO4) dependiendo de la presión de suministro de oxígeno al reactor. De acuerdo con lo anterior la cementación de telurio con Cu se lleva a cabo en la forma indicada por las ecuaciones 2.1 y 2.2: H2TeO3 (ac) + 2 H2SO4 + 4 Cu (s) = Cu2Te (s) + 2 CuSO4 (ac) + 3 H2O xviii (2.1) H2TeO4 (ac) + 3 H2SO4 + 5 Cu (s) = Cu2Te (s) + 3 CuSO4 (ac) + 4 H2O (2.2) Ya habiendo precipitado al telurio como Cu2Te, éste se somete a un proceso de lixiviación en medio alcalino por medio de la inyección de aire atmosférico disolviendo al telurio como telurito de sodio y precipitando al cobre como hidróxido de cobre de acuerdo a la ecuación 2.3: Cu2Te (s) + 2 NaOH + 2 O2 (g) + H2O = Na2TeO3 (ac) + 2 Cu(OH)2 (s) (2.3) Con el fin de minimizar el contenido de impurezas este telurito de sodio se neutraliza por medio de ácido sulfúrico hasta un pH de 5.5 para precipitar al telurio como dióxido de telurio (TeO2). Lo anterior está sustentado en que en este valor de pH, el telurio tiene su mínima solubilidad, de acuerdo a la figura 2.1 [29]. Este dióxido de telurio se disolverá de nuevo con una solución alcalina a base de NaOH y se repetirá el ciclo las veces que sea necesario hasta obtener un precipitado de dióxido de telurio con pureza aceptable. Finalmente, este dióxido de telurio ya purificado se someterá a un proceso de reducción para obtener al telurio elemental. Existen dos procedimientos establecidos para la reducción del telurio, dependiendo del tipo de medio ya sea alcalino o ácido en donde se disuelva al dióxido de telurio. Esta última etapa se puede llevar a cabo en medio ácido o en medio alcalino. La desventaja de este procedimiento está en que durante la precipitación del dióxido de telurio al variar el pH de la región alcalina a la región ácida, coprecipitan otras impurezas de acuerdo a la figura 2.2 [17] y que como consecuencia directa está la necesidad de realizar un mayor número de ciclos de purificación. xix Fig. 2.1.- Influencia del pH en la solubilidad del TeO2, a 25 °C. Valores experimentales obtenidos por Kasarnowsky. (Pourbaix, 1974) xx Fig. 2.2.- Curvas típicas de precipitación de algunos metales en función del valor del pH. (Jennings, 1971) xxi Reducción del telurio en medio ácido utilizando SO2 En este método, el dióxido de telurio se disuelve en una solución ácida 2 N. de H2SO4HCl, se filtra y el líquido se calienta a 50 °C y se le inyecta SO2 hasta reducir al telurio de acuerdo a la ecuación 2.4 H2TeO3 (ac) + 2 SO2 (g) + H2O = Te (s) + 2 H2SO4 (2.4) La solución ácida debe contener ácido clorhídrico para incrementar la solubilidad del telurio además de que hace a la reacción más selectiva. Una vez ya precipitado el telurio, la pulpa se filtra y el sólido remanente debe lavarse y enjuagarse perfectamente para evitar que el producto lleve trazas de contaminantes contenidos en la solución ácida. Se filtra de nuevo la pulpa y el telurio elemental se seca y comúnmente se funde utilizando una flama reductora para no oxidarlo, posteriormente se moldea según requerimientos del cliente. La pureza lograda cuando se emplea este método de reducción es aproximadamente de 99.5 % Te. Reducción del telurio en medio alcalino por electrodepositación Este método, inicia con la solubilización del dióxido de telurio purificado, en una solución normalmente de 2-3 N. de NaOH, lo que dará lugar a un electrolito formado del ión telurito (TeO32+), el cual se reducirá en una celda electrolítica, liberando oxígeno, de acuerdo a la ecuación de media celda 2.5. En esta operación se utilizan electrodos de acero inoxidable, una temperatura entre 40-50 °C [7, 30, 31] y el electrolito gastado es regenerado mediante el contacto de este con dióxido de telurio nuevo. TeO32- + H2O = Te (s) + 2 OH- + O2 (2.5) Para visualizar de una mejor manera la reducción del ión telurito a telurio elemental, en la fig. 2.3 se muestra el diagrama Eh-pH [32] para el sistema Te-H2O a 25 °C xxii Fig. 2.3.- Diagrama de equilibrio Eh - pH del sistema Te- H2O a 25 °C. (Pourbaix, 1974) xxiii La anterior ecuación indica que debido a la reacción de descomposición del agua, el telurio se reduce regenerándose el hidróxido de sodio, el cual al final se utilizará para disolver al dióxido de telurio con el que se recargará el electrolito en telurito según se aprecia en la ecuación 2.6. TeO2 + 2 OH- = TeO32- + H2O (2.6) De la misma manera que en el proceso de reducción con dióxido de azufre que se utiliza cuando se parte de soluciones ácidas, al terminarse el proceso de reducción, el telurio elemental es removido del cátodo, el cual es lavado perfectamente para posteriormente secarse fundirse y moldearse bajo las mismas condiciones ya mencionadas. La pureza del producto obtenido por este método es de aproximadamente 99.95 % Te. xxiv En las figuras 2.4 y 2.5 se muestra gráficamente el proceso de recuperación de telurio cuando este proviene del proceso de decobrización de los lodos anódicos. Lodos anódicos Solución acida Decobrización de lodos anódicos L S Valores Precipitación de Cu2Te S Solución de NaOH Oxígeno Planta de Metales Preciosos Cobre metálico Planta de Tratamiento de Agua L Lixiviación de Cu2Te Aire S Fundición de Cobre L Cu(OH)2 Telurito de sodio (Na2 TeO3 ) Fig. 2.4.- Diagrama del proceso de lixiviación de telurio a partir de la solución de decobrización de los lodos anódicos xxv Telurito de sodio (Na2TeO3) H2SO4 Precipitación de TeO2 Planta de Tratamiento de Efluentes L S Solución H2SO4-HCl Horno Kaldo SO2 Disolución ácida S Disolución alcalina Precipitación de telurio L Horno Kaldo S L L Solución de NaOH Electrodeposición de telurio S S L Fusión Fusión Moldeo Moldeo Fig. 2.5.- Diagrama sobre las diferentes variantes del proceso convencional de reducción de telurio xxvi 2.1.1.2 Recuperación de telurio a partir de la escoria alcalina generada en la planta de metales preciosos Una vez que los lodos anódicos han sido decobrizados, se envían hacia la planta de metales preciosos y se inicia su fusión y tratamiento en un horno Kaldo. Durante su procesamiento para la purificación del doré, se utilizan diferentes reactivos tales como dióxido de silicio (SiO2), óxido de plomo (PbO), carbonato de sodio (Na2CO3) y coque. Es el selenio (Se), la penúltima impureza que se elimina del doré mediante su oxidación por medio de la inyección de aire al baño fundido, el cual es volatilizado como dióxido de selenio (SeO2) y capturado en un lavador de gases como ácido selenioso (H2SeO3). Posteriormente este ácido selenioso es reducido en un reactor a selenio elemental (Se) utilizando dióxido de azufre de acuerdo a la ecuación 2.7: H2SeO3 (ac) + 2 SO2 (g) + H2O = Se (s) + 2 H2SO4 (2.7) Conforme avanzan las condiciones de oxidación del baño fundido en el horno Kaldo, antes de finalizar la volatilización del selenio inicia también la volatilización del telurio (13) y para evitar esto, se añade carbonato de sodio con el propósito de fijar al telurio a la escoria alcalina como telurito de sodio. De esta forma se continúa con la oxidación del selenio hasta que se volatiliza la mayor parte y la operación termina con la oxidación del telurio. Las principales reacciones de oxidación del telurio serían las mostradas en las ecuaciones 2.8 y 2.9: Cu2Te + 3/2 O2 (g) + Na2CO3 = Na2TeO3 + Cu2O + CO2 (g) (2.8) Ag2Te + O2 (g) + Na2CO3 = Na2TeO3 + 2 Ag + CO2 (g) (2.9) Ya finalizada la oxidación del telurio, la escoria alcalina que contiene a este elemento es retirada del interior del horno por escorificación y se procede con el tratamiento hidrometalúrgico del doré por un lado y por el otro con el correspondiente a la escoria alcalina rica en plata y telurio. xxvii Dentro del proceso convencional, la recuperación del telurio se efectúa lixiviando esta escoria con agua, después de una operación de reducción de tamaño. Durante la lixiviación, el telurio se disuelve como telurito de sodio y en el residuo de lixiviación queda la plata metálica. Ya teniendo al telurio disuelto, cualquiera de los métodos de reducción enunciados anteriormente en este capítulo pueden ser aplicados para la recuperación del telurio en su forma elemental. 2.2 Necesidad de un método alternativo para la producción de telurio La pureza del telurio elemental obtenido por los métodos anteriormente descritos es insuficiente para la debida comercialización de este producto ya que la pureza mínima requerida es del 99.95. Debido a lo anterior, se presenta la necesidad de desarrollar un método alternativo para la recuperación de telurio, que permita alcanzar ese requerimiento y la que pueda aplicarse al procesamiento de las escorias alcalinas portadoras de telurio como las que se generan en la Planta de Metales Preciosos de Mexicana de Cobre. 2.2.1 Propuesta alternativa de procesamiento para la producción de telurio Con el fin de lograr el objetivo planteado en la sección anterior, se propone un método alternativo que consiste en sustituir la purificación de la solución de telurio vía la precipitaciòn de dióxido de telurio por la formación y precipitación de telurato de sodio. A diferencia del método convencional, en este nuevo proceso la forma de precipitar al telurio se efectúa directamente de la solución alcalina que proviene de la lixiviación con agua de la escoria extraída del horno Kaldo. Mediante la utilización de peróxido de hidrógeno (H2O2) se promueve la oxidaciòn del telurito de sodio a telurato de sodio (Na2TeO4) de acuerdo con la ecuación 2.10: Na2TeO3 (ac) + H2O2 (ac) = Na2TeO4 (s) + H2O (2.10) La anterior separación del telurio en medio alcalino es posible debido a que el telurato de sodio es insoluble en este medio [33]. Adicionalmente se espera una reducción en la coprecipitaciòn de impurezas lo cual se puede traducir en un producto final de mayor pureza. xxviii Con el fin de verificar lo anterior, se plantea la necesidad de realizar un estudio completo relativo a la reducción de telurio a partir de soluciones preparadas después de la formación de telurato tanto en medio ácido como en medio alcalino. xxix