•capitulo 23.qxd
Anuncio
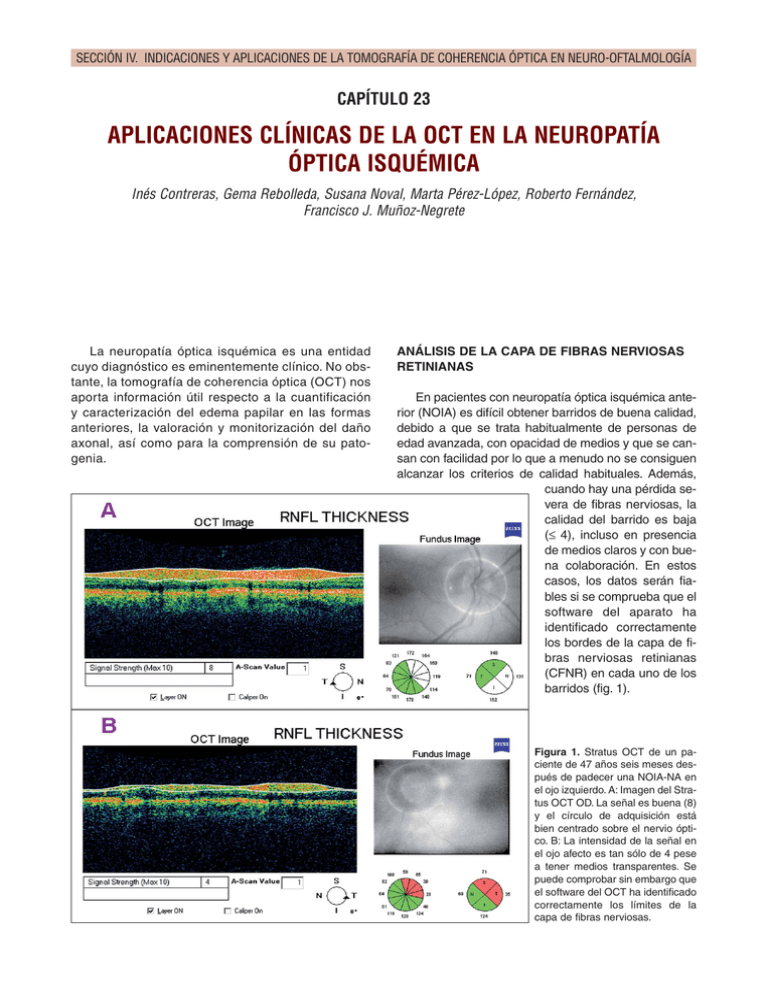
SECCIÓN IV. INDICACIONES Y APLICACIONES DE LA TOMOGRAFÍA DE COHERENCIA ÓPTICA EN NEURO-OFTALMOLOGÍA CAPÍTULO 23 APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA Inés Contreras, Gema Rebolleda, Susana Noval, Marta Pérez-López, Roberto Fernández, Francisco J. Muñoz-Negrete La neuropatía óptica isquémica es una entidad cuyo diagnóstico es eminentemente clínico. No obstante, la tomografía de coherencia óptica (OCT) nos aporta información útil respecto a la cuantificación y caracterización del edema papilar en las formas anteriores, la valoración y monitorización del daño axonal, así como para la comprensión de su patogenia. ANÁLISIS DE LA CAPA DE FIBRAS NERVIOSAS RETINIANAS En pacientes con neuropatía óptica isquémica anterior (NOIA) es difícil obtener barridos de buena calidad, debido a que se trata habitualmente de personas de edad avanzada, con opacidad de medios y que se cansan con facilidad por lo que a menudo no se consiguen alcanzar los criterios de calidad habituales. Además, cuando hay una pérdida severa de fibras nerviosas, la calidad del barrido es baja (≤ 4), incluso en presencia de medios claros y con buena colaboración. En estos casos, los datos serán fiables si se comprueba que el software del aparato ha identificado correctamente los bordes de la capa de fibras nerviosas retinianas (CFNR) en cada uno de los barridos (fig. 1). Figura 1. Stratus OCT de un paciente de 47 años seis meses después de padecer una NOIA-NA en el ojo izquierdo. A: Imagen del Stratus OCT OD. La señal es buena (8) y el círculo de adquisición está bien centrado sobre el nervio óptico. B: La intensidad de la señal en el ojo afecto es tan sólo de 4 pese a tener medios transparentes. Se puede comprobar sin embargo que el software del OCT ha identificado correctamente los límites de la capa de fibras nerviosas. 504 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 2. NOIA-NA ojo derecho. Fase aguda. La OCT detecta edema de la CFNR del ojo afecto (OD), incluso en la zona inferior del nervio óptico, difícil de apreciar en la imagen del fondo de ojo. A los seis meses del episodio. El defecto campimétrico progresó a lo largo del primer mes de evolución. Se puede apreciar la intensa pérdida de fibras nerviosas, con una pérdida en todos los cuadrantes y en el espesor promedio en torno al 50% con respecto a los valores del ojo adelfo. Fase aguda La presencia de edema papilar durante la fase aguda es una característica imprescindible para el diagnóstico de la NOIA. La exploración con OCT permite caracterizar y cuantificar ese edema. Hemos encontrado que el incremento de grosor medio de la CFNR en la fase aguda es un 96% mayor con respecto al ojo adelfo no afecto. La OCT es capaz de detectar zonas de edema que pueden pasar desapercibidas en la exploración del fondo de ojo (fig. 2), sin que hayamos observado una predilección del edema por ningún cuadrante en concreto. Los discos de los pacientes con NOIA son «discos de riesgo», de ahí que no sea excepcional que en la clasificación normativa presenten algún sector horario o cuadrante con grosor por encima de lo normal, dato que interpretado de modo aislado podría condicionar un error diagnóstico (fig. 3). En nuestra serie prospec- Figura 3. NOIA-NA ojo derecho. Superior: Stratus OCT en fase aguda de un varón de 68 años que consultaba por pérdida de visión brusca en ojo derecho. En ausencia de otros datos, se podría pensar que existe un edema de papila en ambos ojos, especialmente si nos fijamos en la clasificación normativa por horas y cuadrantes. Sin embargo, un análisis detallado revela que los valores de la CFNR del ojo izquierdo sólo están levemente por encima de la normalidad, frente a los del ojo derecho, que casi duplican los del ojo izquierdo. En la exploración funduscópica se puede comprobar que no existe edema de papila en el ojo izquierdo. Inferior: Stratus OCT a los 3 meses del episodio. Se aprecia que los valores de la CFNR del ojo izquierdo apenas han variado, frente a la pérdida intensa de fibras nerviosas que se ha producido en el ojo derecho. 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA tiva, la tercera parte de los ojos adelfos presentaban al menos 2 sectores horarios por encima de los valores de normalidad de la base normativa del Stratus OCT; y de éstos más de la mitad (77%) tenían al menos un cuadrante con un grosor de la CFNR por encima de los valores de referencia. En la neuropatía óptica isquémica posterior (NOIP) la OCT nos confirma la ausencia de edema en fase aguda. Monitorización, resolución y atrofia La OCT permite monitorizar los cambios que se producen en la CFNR tanto en las formas anteriores como posteriores. A las 6-8 semanas tras el episodio agudo se puede detectar la resolución del edema que da paso a la atrofia del disco de mayor o menor inten- 505 sidad según la severidad del caso. La CFNR se va adelgazando para estabilizarse aproximadamente 6 meses tras el debut. A los 3, 6 y 12 meses la pérdida promedio es de un 39%, 42% y 44% con respecto al ojo adelfo (fig. 4). Tras la resolución del edema, la pérdida de fibras nerviosas es menos pronunciada en el cuadrante nasal, siendo el cuadrante superior el más afectado (con una pérdida del 51% frente al ojo adelfo), en concordancia con la mayor prevalencia de defectos ínferonasales en la perimetría. Una posible explicación para el respeto relativo del cuadrante nasal es la localización de los territorios frontera vasculares, más frecuente en o junto a la región temporal de la cabeza del nervio óptico, haciendo que esta región sea más vulnerable a la isquemia (fig. 5). Es interesante destacar que el respeto relativo del cuadrante nasal en la OCT también se ha des- Figura 4. Retinografía y tomografía de coherencia óptica (Stratus) de un paciente con NOIA-NA en ojo izquierdo, en fase aguda (superior), a las 6 semanas (centro) y a los 6 meses (inferior). La OCT detecta el edema difuso en fase aguda, seguido de una pérdida progresiva de fibras nerviosas con adelgazamiento significativo de los cuadrantes superior y temporal. El análisis diferencial (RNFL thickness change analysis) nos permite valorar la perdida de fibras por sectores horarios y cuadrantes, siendo más llamativa las primeras 6 semanas, que desde las 6 semanas a los 6 meses. 506 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 5. Aspecto funduscópico, tomografía de coherencia óptica (Stratus) y campo visual de una paciente a los seis meses del episodio de NOIA-NA de ojo derecho. Se puede objetivar el respeto del cuadrante nasal en OCT. crito en otras patologías del nervio óptico como la neuritis óptica (capítulo 22), la neuropatía óptica hereditaria de Leber (capítulo 26.2) y las neuropatías tóxicas, salvo la relacionada con el uso de vigabatrina (capítulo 26.1). Al margen del análisis cualitativo, se puede realizar un análisis cuantitativo de la reducción del grosor mediante el análisis diferencial (RNFL Thickness Change Analysis, fig. 4). Aunque existen programas automatizados para detectar progresión para el glaucoma, su aplicación en esta patología no es útil porque la pérdida es brusca y severa, patrón poco habitual en el glaucoma (fig. 6). En la forma posterior al igual que en las formas anteriores, la OCT permite detectar la pérdida de fibras nerviosas, que suele ser profunda y bilateral (fig. 7). Figura 6. GPA de Stratus correspondiente al paciente de la figura 4. Pese a la reducción pronunciada en el grosor de la CFNR, el programa indica que los cambios no son significativos. Se puede observar como la pérdida de fibras nerviosas se produce sobre todo en los primeros dos meses tras el episodio. También se puede apreciar la elevada repetibilidad de las medidas de grosor obtenidas con Stratus, al ser los valores de todas las visitas del ojo no afecto prácticamente superponibles. Figura 7. Retinografía, tomografía de coherencia óptica y campos visuales de una paciente de 62 años, 6 meses después de sufrir un episodio de neuropatía óptica isquémica posterior no arterítica en ojo derecho en relación con una intervención de laminectomía. Se puede apreciar la profunda pérdida de fibras nerviosas, mayor de lo que se podría esperar en función del daño campimétrico. Se aprecia también la asimetría en la excavación papilar (mayor en el ojo afecto). Correlación OCT CFNR-Perimetría Diversos estudios han comprobado que, una vez estabilizada la pérdida de fibras nerviosas, el grosor de la CFNR se relaciona con el defecto funcional. Nuestro grupo encontró que existía una pérdida de 2 dB por cada micra de adelgazamiento en el grosor medio de la CFNR. En cuanto a la agudeza visual, existe una pérdida de una línea por cada 1,7 µm de adelgazamiento en el grosor medio de la CFNR. El respeto del cuadrante temporal es un marcador de buena agudeza visual (fig. 8). Por el contrario, la afectación del cuadrante temporal suele acompañarse de una mala visión incluso con campos visuales relativamente respetados (fig. 9). La zona de pérdida de fibras detectada mediante OCT suele corresponderse con la localización del defecto campimétrico (fig. 10), aunque existe una tendencia a que la OCT detecte mayor daño del que cabría inferirse del campo visual (figs. 7, 9 y 11). Horowitz y col. comparando la correlación estructural funcional en ojos con NOIA (6 meses desde la fase aguda) y ojos con glaucoma y defectos en hemicampo observaron que no había diferencias en el grosor promedio de la CFNR en los cuadrantes correspondientes al defecto del hemicampo dañado. Sin 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA 507 Figura 8. Aspecto funduscópico, tomografía de coherencia óptica (Stratus) y campo visual en fase aguda (arriba) y a los tres meses del episodio de una NOIA-NA de ojo derecho. A los 3 meses se observa el respeto del cuadrante temporal, la mejoría del daño campimétrico, y una agudeza visual de 0,9. Figura 9. NOIA-NA en el ojo izquierdo de un paciente de 64 años. Arriba: Fase aguda. Edema papilar intenso objetivable tanto en exploración funduscópica como en OCT. Abajo: Seis meses después del episodio. Se puede apreciar una pérdida de fibras nerviosas difusa y severa, incluyendo al cuadrante temporal que justifica el escotoma central y la mala visión. 508 Figura 10. Excelente correlación entre aspecto funduscópico, tomografía de coherencia óptica (Stratus) y campo visual a los seis meses del episodio de NOIA-NA en dos pacientes diferentes. embargo los ojos con glaucoma tenían un mayor grado de adelgazamiento de la CFNR en los cuadrantes que no se correspondían con el defecto perimétrico, justificado por la patogenia distinta de ambas entidades. Utilidad pronóstica El valor pronóstico del estudio de la CFNR en fase aguda es limitado. El grosor inicial de la CFNR no está relacionado ni con el grosor final de ésta, ni con la agudeza visual o el defecto campimétrico. Sin embargo resulta útil para estimar el riesgo de progresión en pacientes con un defecto campimétrico limitado inicial. En estos pacientes, la probabili- TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 11. Aspecto funduscópico, tomografía de coherencia óptica (Stratus) y campo visual de una paciente de 68 años a los seis meses de una NOIA-NA en el ojo izquierdo. La pérdida de fibras nerviosas es mayor de lo que cabría deducir del defecto campimétrico. dad de progresión es mayor si el OCT detecta edema en los cuatro cuadrantes (el defecto progresa en un 30% de los ojos con estas características) que si existe al menos un cuadrante respetado (14,3%) (figs. 12 y 13). ANÁLISIS DEL DISCO ÓPTICO Al igual que en otras neuropatías, la pérdida de fibras nerviosas va acompañada de un aumento secundario de la excavación papilar, con un incremento medio del 50% con respecto al ojo adelfo en las formas Figura 12. Relación OCT basal- evolución del defecto perimétrico. Superior: Paciente con un defecto campimétrico inicial limitado, edema de los 4 cuadrantes en OCT durante la fase aguda (izquierda), que progresó a un defecto campimétrico severo y difuso a los 3 meses (derecha). Inferior: Paciente con un defecto campimétrico inicial relativamente limitado, con respeto del cuadrante superior en la OCT durante la fase aguda (izquierda), que apenas progresa a los tres meses del episodio (derecha). 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA 509 Figura 13. Valor pronóstico de OCT basal en la progresión del defecto perimétrico. A. Paciente de 76 años con defecto campimétrico inicial altitudinal superior. La OCT demuestra edema en los cuatro cuadrantes. B. Campo visual y tomografía de coherencia óptica a los 6 meses del episodio. Se aprecia la pérdida intensa difusa de fibras nerviosas y la progresión del defecto. no arteríticas (figs. 7 y 17). Sin embargo, estos cambios tienen una trascendencia clínica limitada, ya que se trata de pacientes con excavaciones fisiológicas pequeñas, lo que unido a la palidez del disco dificulta su detección en una exploración funduscópica rutinaria (fig. 14). La OCT ha permitido confirmar también que la NOIA-NA se produce habitualmente en discos de riesgo (discos con excavaciones fisiológicas pequeñas o ausentes y apelotonamiento de las fibras nerviosas) (fig. 15). Sin embargo, no se ha podido confirmar y sigue siendo motivo de controversia que estos pacien- Figura 14. Retinografía y OCT en una paciente de 68 años antes y después de un episodio de NOIA-NA en el ojo izquierdo. Se puede observar cómo aumenta el área excavación/papila medida mediante OCT de 0,431 a 0,889 mm2 tras el episodio. 510 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 15. Comparación del aspecto funduscópico y OCT del ojo adelfo de un paciente con NOIA-NA y de un sujeto control. Se puede apreciar cómo pese a un área de disco 50% mayor, el ojo adelfo presenta un área integrada vertical del anillo que multiplica por 8 la del ojo control. El área integrada vertical del anillo es una estimación del volumen total de la CFNR a nivel del anillo neurorretiniano, que se calcula multiplicando la media del área del anillo de cada uno de los barridos individuales que realiza el OCT por la circunferencia de la papila. Un área mayor implica la presencia de más tejido a nivel del disco óptico. tes presenten discos de menor tamaño que la población normal. En la NOIA arterítica, la OCT permite comprobar el incremento marcado en la excavación papilar (fig. 16). El nuevo software del OCT-Cirrus (5.0) permite analizar el disco óptico a partir del mismo análisis de la CFNR realizado en la versión previa (fig. 17). Figura 16. OCT en fase crónica tras una neuropatía óptica isquémica anterior arterítica en ojo izquierdo. La relación excavación/disco (E/D) del ojo no afecto es mayor que en las formas no arteríticas, y se observa también la asimetría en E/D por el incremento secundario de la excavación del ojo afecto. 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA 511 Figura 17. NOIA no arterítica del OS en fase aguda (A) y en fase de resolución (B). Analisis de la CFNR del OS en fase de resolución (22-6-09) con versión 4.0 (C) y el análisis conjunto del disco y de la CFNR obtenido a partir de la misma imagen con la versión actualizada (D), donde se objetiva el aumento secundario de la E/D vertical en comparación con ojo no afecto. ANÁLISIS MACULAR Fase aguda Durante la fase aguda se ha comprobado que el edema peripapilar se puede extender y afectar a la mácula, comprometiendo la visión del paciente. Parte de la recuperación visual objetivada en estos pacientes se puede atribuir a la reabsorción del líquido submacular (figs. 18 y 19). Fase de resolución Hemos podido comprobar que se produce un adelgazamiento en el grosor macular central y nasal tras la NOIA-NA. Además hay una correlación directa entre la agudeza visual y el grosor de los segmentos nasales. Este adelgazamiento probablemente refleja la afectación del haz papilo-macular, principal responsable del nivel de agudeza visual (figs. 19 y 20). Figura 18. Retinografía y OCT de una mujer de 80 años durante la fase aguda de una NOIA-NA de ojo derecho. En la OCT se observa cómo el edema peripapilar alcanza y desprende la mácula. 512 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 19. Superior: OCT en fase aguda de NOIA-NA en ojo derecho. El edema se extiende hasta llegar a afectar a la mácula. Inferior: OCT un año tras el episodio. Se puede apreciar la reabsorción del edema acompañada de una pérdida de grosor retiniano en toda la región macular. Figura 20. OCT macular de una mujer de 79 años que presentó una NOIA-NA en ojo izquierdo tras cirugía de cataratas. A. Exploración macular previa a cirugía de cataratas. B. Exploración macular y de nervio óptico un mes después de la cirugía de catarata del ojo izquierdo. La paciente presentaba una NOIA-NA en el ojo izquierdo con edema difuso. Se observa un aumento del grosor macular en la zona nasal, así como del volumen macular, espesor foveal total y de 3 cuadrantes en el análisis de la CFNR. C. Exploración macular y de nervio óptico 1 año tras el episodio. Existe un adelgazamiento de la CFNR supero-temporal, que se acompaña de un adelgazamiento macular de los segmentos nasales de la mácula, con una disminución del volumen total. OCT DOMINIO ESPECTRAL VS DOMINIO TEMPORAL La velocidad con la que se producen avances tecnológicos ha hecho que cuando apenas habíamos asimilado las características del OCT de dominio temporal dispongamos de los nuevos OCT de dominio es- pectral, que proporcionan una resolución y reproducibilidad aún mayores. Con esta nueva técnica se mejora la relación señal ruido y los artefactos de la imagen prácticamente desaparecen. Además al presentar mayor velocidad, se adquieren muchos más cortes; el barrido controla todas las zonas en detalle y no permite que ninguna quede fuera de la exploración, lo que re- 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA 513 Figura 21. OCT con Cirrus y Stratus en un paciente con una NOIA-NA en ojo derecho en fase aguda y crónica. Se puede apreciar como los valores obtenidos con los dos aparatos son distintos. En este caso en particular, Cirrus y Stratus arrojan valores muy similares en fase de edema, con una media algo más elevada en el Stratus, mientras que en la fase crónica Cirrus proporciona valores más elevados que Stratus. presenta una clara ventaja frente a los cortes radiales que realiza el OCT de dominio temporal. La mayoría de los estudios publicados hasta la fecha dedicados a la neuropatía óptica isquémica se han realizado con tomógrafos de dominio temporal, predominando el modelo Stratus OCT® (Carl Zeiss Meditec, Dublín, CA). Hemos comprobado que los valores de la CFNR calculados por el Stratus OCT y el Cirrus, al igual que lo que sucede en otras patologías, no son intercambiables (fig. 21), por lo que recomendamos seguir siempre al mismo paciente con el mismo aparato. En líneas generales los valores obtenidos con Cirrus son mayores que con Stratus tanto en la fase de edema como en la fase de atrofia, presumiblemente porque el adelgazamiento que se produce es severo, en consonancia con la inversión objetivada en la comparación Cirrus-Stratus en el análisis de la CFNR cuando están muy adelgazadas en glaucoma. Hallazgos similares a los referidos previamente se pueden objetivar con otros OCTs de dominio espectral (adelgazamiento de la CFNR y macular en la fase de atrofia), pero de nuevo los valores no son intercambiables entre sí (fig. 22). • La OCT es una herramienta capaz de cuantificar el edema de papila inicial en las neuropatías ópticas isquémicas anteriores, así como de monitorizar la pérdida posterior de fibras nerviosas tanto en las formas anteriores como posteriores. • La OCT permite detectar si existe edema macular asociado a la NOIA que puede pasar desapercibido en el examen clínico. • La OCT ha demostrado que tras la NOIA no arterítica se puede producir un aumento de la E/D, aunque menos pronunciado que tras las forma arterítica. • La OCT basal ayuda a predecir el patrón de evolución perimétrica. • Una vez estabilizada le pérdida de fibras nerviosas, existe una correlación significativa entre el grado de adelgazamiento de la CFNR y la AV, así como con la perimetría. • Existe un buen acuerdo topográfico entre las zonas de adelgazamiento detectadas mediante OCT y las zonas de daño funcional observadas en perimetría. • El respeto del cuadrante temporal en OCT mejora el pronóstico de cara a la recuperación visual. • Hay una correlación directa entre la visión y el grosor de los segmentos nasales maculares. 514 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 22. El análisis de la CFNR con OCT Cirrus (A) y Spectralis (B) en la fase de atrofia de NOIA-NA revela adelgazamiento de los cuadrantes ínfero-temporales con ambas estrategias. El análisis macular refleja el adelgazamiento en comparación con el ojo adelfo (224 vs 246 µ). Cortesía Dr. J. Lara. CASO CLÍNICO Paciente de 60 años, enviada a control de fondo de ojo por su médico de cabecera por padecer hipertensión arterial. En retinografía no midriática se detectó edema de papila en el ojo derecho. La paciente fue remitida de forma urgente al servicio de neuro-oftalmología. No refería sintomatología visual alguna. La agudeza visual era de 0,9 en ambos ojos. No existía defecto pupilar aferente relativo. Se realizaron campos visuales y OCT (fig. 23). Como único antecedente personal, además de la hipertensión arterial, refería un accidente de tráfico 2 años antes con traumatismo craneal derecho. Se solicitaron de forma urgente VSG y PCR, que se encontraban dentro de límites normales. Al no ajustarse el cuadro al de una NOIA típica, se solicitó una resonancia magnética orbitaria y cerebral, informadas como normales. Dos meses después de la detección del edema, éste se había resuelto completamente. La paciente fue diagnosticada de NOIA incipiente, una entidad descrita recientemente por Hayreh que representa la fase pre-sintomática de la NOIA-NA. Éstas progresan a la forma sintomática o NOIA típica en el 45% de los casos, ya sea en las primeras semanas (20%) o de forma demorada. La figura 24 muestra la retinografía, campimetría y OCT de ambos ojos 1 año después del debut con normalización del cuadro. Figura 23. Retinografía no midriática, campimetría y OCT-Stratus en el momento inicial: NOIA-NA presintomática. 23. APLICACIONES CLÍNICAS DE LA OCT EN LA NEUROPATÍA ÓPTICA ISQUÉMICA 515 BIBLIOGRAFÍA Figura 24. Retinografía, campimetría y OCT-Cirrus un año después del episodio de NOIA-presintomática, con reversibilidad completa del cuadro. 1. Bellusci C, Savini G, Carbonelli M, Carelli V, Sadun AA, Barboni P. Retinal nerve fiber layer thickness in nonarteritic anterior ischemic optic neuropathy: OCT characterization of the acute and resolving phases. Graefes Arch Clin Exp Ophthalmol 2008; 246: 641-7. 2. Chan CKM, Cheng ACO, Leung CKS et al. Quantitative assessment of optic nerve head morphology and retinal nerve fibre layer in nonarteritic anterior ischaemic optic neuropathy with optical coherence tomography and confocal scanning laser ophthalmoloscopy. Br J Ophthalmol 2009; 93: 731-5. 3. Contreras I, Noval S, Rebolleda G, Muñoz-Negrete FJ. Follow-up of Nonarteritic Anterior Ischemic Optic Neuropathy with Optical Coherence Tomography. Ophthalmology 2007; 114: 2338-2344. 4. Contreras I, Rebolleda G, Noval S, Muñoz-Negrete FJ. Optic disc evaluation by optical coherence tomography in nonarteritic anterior ischemic optic neuropathy. Invest Ophthalmol Vis Sci 2007; 48: 4087-4092. 5. Contreras I, Rebolleda G, Noval S, Muñoz-Negrete FJ. Ischemic optic neuropathy. Ophthalmology 2009; 116: 814. 6. Fernández-Buenaga R, Rebolleda G, Muñoz-Negrete FJ, Contreras I, Casas-Llera P. Macular thickness. Ophthalmology 2009; 116: 1587. 7. Deleón-Ortega J, Carroll KE, Arthur SN, Girkin CA. Correlations between retinal nerve fiber layer and visual field in eyes with nonarteritic anterior ischemic optic neuropathy. Am J Ophthalmol 2007; 143: 288-294. 8 Hayreh SS, Zimmerman MB. Incipient nonarteritic anterior ischemic optic neuropathy. Ophthalmology 2007; 114: 1763-72. 9. Hedges TR, III, Vuong LN, Gonzalez-Garcia AO, et al. Subretinal fluid from anterior ischemic optic neuropathy demonstrated by optical coherence tomography. Arch Ophthalmol 2008; 126: 812-5. 10. Horowitz J, Fishelzon-Arev T, Rath EZ, et al. Comparison of optic nerve head topography findings in eyes with non-arteritic anterior ischemic optic neuropathy and eyes with glaucoma. Graefes Arch Clin Exp Ophthalmol 2010; 248: 845-51. 11. Paunescu LA, Schuman JS, Price LL, et al. Reproducibility of nerve fiber thickness, macular thickness, and optic nerve head measurements using Stratus OCT. Invest Ophthalmol Vis Sci 2004; 45: 1716-24. 12. Savini G, Bellusci C, Carbonelli M, Zanini M, Carelli V, Sadun AA, Barboni P. Detection and quantification of retinal nerve fiber layer thickness in optic disc edema using stratus OCT. Arch Ophthalmol 2006; 124: 1111-7.