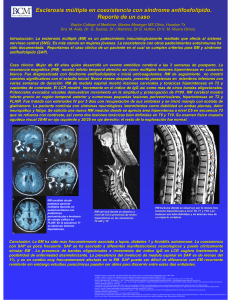
Biomarcadores en esclerosis múltiple
Anuncio

rEVISIÓN Biomarcadores en esclerosis múltiple Óscar Fernández, Rafael Arroyo-González, Alfredo Rodríguez-Antigüedad, Juan A. García-Merino, Manuel Comabella, Luisa M. Villar, Guillermo Izquierdo, Mar Tintoré, Celia Oreja-Guevara, José C. Álvarez-Cermeño, José E. Meca-Lallana, José M. Prieto, Lluís Ramió-Torrentà, Sergio Martínez-Yélamos, Xavier Montalban Resumen. La esclerosis múltiple es la enfermedad neurológica discapacitante más frecuente en adultos jóvenes. En su desarrollo intervienen procesos independientes de inflamación, desmielinización, neurodegeneración, gliosis y reparación, responsables de la heterogeneidad y variabilidad individual en la expresión de la enfermedad, del pronóstico y de la respuesta al tratamiento. Como parte de la medicina personalizada, los avances en la búsqueda de nuevos biomarcadores han identificado candidatos prometedores que pueden resultar de utilidad para el diagnóstico precoz de la enfermedad, para detectar perfiles pronósticos y evolutivos de la enfermedad, y para monitorizar la respuesta al tratamiento. Lamentablemente, pocos de ellos se han validado adecuadamente, lo cual impide su aplicación en la práctica clínica. Dados los últimos resultados, los expertos recomiendan un giro en la investigación, no tanto hacia el descubrimiento de nuevas moléculas o técnicas de imagen, sino hacia una validación clínica de estos marcadores, con el objetivo de promover la investigación translacional. Esta revisión ofrece una actualización de la información disponible acerca de los biomarcadores en esclerosis múltiple actualmente validados y potencialmente candidatos, y su utilidad en el diagnóstico, pronóstico, evaluación de la progresión de la discapacidad ocasionada por la enfermedad y de la respuesta terapéutica. Palabras clave. Biomarcadores. Diagnóstico precoz. Esclerosis múltiple. Definiciones y aspectos generales La identificación de biomarcadores en la esclerosis múltiple (EM) es crucial, debido a la complejidad de esta enfermedad. Un biomarcador o marcador biológico es una característica que puede ser objetivamente medida y evaluada como un indicador de procesos biológicos normales o patológicos, o como un indicador de respuesta farmacológica [1]. Su utilización requiere una cualificación acorde con el proceso patológico y los objetivos clínicos, y una validación clínica conseguida en distintos laboratorios y confirmada en estudios y ensayos independientes. El biomarcador óptimo necesita ser sensible, específico, reproducible, simple, coste-efectivo y estable a lo largo del tiempo. La clasificación de los biomarcadores atiende a la clásica: – Tipo 0: marcador que define la historia natural de la enfermedad y se correlaciona longitudinalmente con índices clínicos conocidos. – Tipo I: marcador que refleja los efectos clínicos de una intervención terapéutica de acuerdo con su mecanismo de acción. – Tipo II: marcador ‘subrogado’ o sustituto de un criterio de valoración, que proporciona información sobre el pronóstico clínico o la eficacia tera- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 péutica, que indica, en este caso, una fuerte correlación con una determinada característica clínica [1] (Fig. 1). Otras posibles clasificaciones atienden al mecanismo fisiopatológico: marcadores de inflamación, de desmielinización, de daño axonal, de activación glial o de regeneración; al tipo de fluido biológico en el que se determinan: sangre, suero, orina y líquido cefalorraquídeo (LCR); a la estructura o función que miden: marcadores moleculares, marcadores clínicos y marcadores en imagen, como resonancia magnética (RM), tomografía por emisión de positrones y tomografía de coherencia óptica (OCT). En la EM, la determinación de biomarcadores se enfrenta a diversos problemas metodológicos, como un conocimiento parcial de la fisiopatología, una fluctuación significativa de las concentraciones de las sustancias consideradas como posibles biomarcadores en sangre y orina, variaciones en determinados parámetros inmunológicos que no son específicas de la enfermedad, y el efecto sinérgico o antagónico de determinados biomarcadores. A pesar de ello, recientes investigaciones que han evaluado fluidos corporales y la estructura y la función cerebral han identificado candidatos prometedores que permiten hacer un diagnóstico más tem- Hospital Regional Universitario Carlos Haya; Málaga (O. Fernández). Hospital Clínico San Carlos; Madrid (R. Arroyo-González, C. OrejaGuevara). Hospital de Basurto; Bilbao (A. Rodríguez-Antigüedad). Hospital Universitario Puerta de Hierro; Madrid (J.A. García-Merino). Hospital Universitari Vall d’Hebron; Barcelona (M. Comabella, M. Tintoré, X. Montalban). Hospital Universitario Ramón y Cajal; Madrid (L.M. Villar, J.C. Álvarez-Cermeño). Hospital Universitario Virgen Macarena; Sevilla (G. Izquierdo). Hospital Universitario Virgen de la Arrixaca; Murcia (J.E. Meca-Lallana). Complejo Hospitalario Universitario de Santiago de Compostela (J.M. Prieto). Hospital Universitario Doctor Josep Trueta; Institut d’Investigació Biomèdica de Girona; Girona (Ll. Ramió-Torrentà). Hospital Universitari de Bellvitge; Barcelona, España (S. Martínez-Yélamos). Correspondencia: Dr. Óscar Fernández Fernández. Instituto de Neurociencias Clínicas. Hospital Regional Universitario Carlos Haya. Avda. Carlos Haya, s/n. E-29010 Málaga. E-mail: oscar.fernandez.sspa@ juntadeandalucia.es Financiación: Este trabajo cuenta con una ayuda no condicionada a la educación médica continuada de Teva Pharma España. Declaración de intereses: O.F. ha recibido honorarios como consultor, asesor, conferenciante o moderador, y ha participado en ensayos clínicos y otros proyectos de investigación promovidos por Biogen-Idec, Bayer-Schering, Merck-Serono, Teva, Novartis, Almirall y Allergan. El resto de autores declara no tener ningún conflicto de interés en relación con este artículo. Aceptado tras revisión externa: 25.02.13. Cómo citar este artículo: Fernández O, Arroyo-González R, Rodríguez-Antigüedad A, García 375 O. Fernández, et al Figura 1. Biomarcadores: marco conceptual. Merino JA, Comabella M, Villar LM, et al. Biomarcadores en esclerosis múltiple. Rev Neurol 2013; 56: 375-90. © 2013 Revista de Neurología prano de la enfermedad, establecer mejor el pronóstico y monitorizar la respuesta al tratamiento en términos de efectividad y toxicidad. No obstante, pocos se han validado hasta el momento, lo que impide su aplicación en la práctica clínica [2]. Los estudios comparativos permitirán identificar los marcadores con mayor especificidad, sensibilidad, fiabilidad y utilidad clínica. De este modo, se abrirá una puerta a la identificación de biomarcadores que permitan medir aspectos fundamentales, como la neurodegeneración en los ensayos pivotales, con el fin de determinar la eficacia neuroprotectora y neurorregeneradora de los fármacos [2]. Biomarcadores clínicos La EM es una enfermedad heterogénea también desde el punto de vista clínico, lo que hace imposible, basándose en estas características, darle a un paciente concreto un pronóstico temprano personalizado y preciso. Sin embargo, en estudios sobre la historia natural de la EM se han identificado algunas variables clínicas que al inicio de la enfermedad se relacionan con el pronóstico de un conjunto de pacientes (no de un enfermo concreto). Los estudios sobre la historia natural de la EM son difíciles de realizar por cuestiones metodológicas y, por ello, pueden adolecer de importantes limitaciones que condicionan la validez de sus conclusiones sobre el valor pronóstico de ciertas variables. Tal es el caso de las series de base hospitalaria y no poblacional, que adolecen de un sesgo de selección; una duración insuficiente de la cohorte impide extraer conclusiones a largo plazo, o resulta difícil anular la influencia de los tratamientos que han recibido los pacientes durante los últimos 15 años. Por ejemplo, la variabilidad metodológica de este tipo de estudios impidió en la revisión sistemática publicada por Langer-Gould et al [3] unificar los 27 trabajos seleccionados para realizar un análisis conjunto. Para paliar estas limitaciones, se han 376 aplicado diferentes estrategias; así, la revisión de De­ genhardt et al [4] no incluyó series en las que > 50% de los pacientes hayan sido tratados durante > 25% de la duración de su enfermedad. Pero, en definitiva, toda esta variabilidad de los diferentes estudios limita la precisión y validez de las conclusiones acerca de las variables pronósticas al comienzo de la EM y limita, por ello, su utilidad para aplicarlas a un paciente concreto. Las principales variables clínicas al inicio de la enfermedad que en la mayoría de los estudios se relacionan con el pronóstico son: evolución clínica, sexo, edad de comienzo, número de brotes y presentación clínica [5]. La forma de evolución inicial de la EM está, sin duda, estrechamente relacionada con el pronóstico de la discapacidad. Los pacientes con una evolución primaria progresiva (PP) alcanzan más rápidamente una discapacidad que aquéllos con una evolución remitente recurrente (RR). Sin embargo, la edad media de comienzo de la EMPP es más tardía que la de la EMRR, por lo que se reducen las diferencias en cuanto a la edad a la que ambos grupos de pacientes alcanzan una discapacidad importante (puntuación en la Expanded Disability Status Scale, EDSS, de 6) [5]. La edad de comienzo de la EM más temprana se relaciona en todos los estudios con una evolución más lenta de la progresión de la discapacidad. Pero, como sucede con la evolución clínica inicial, el efecto beneficioso del inicio temprano de la EM sobre la discapacidad es tan sólo aparente, dado que los pacientes que comienzan con la enfermedad siendo más jóvenes tardan más tiempo en alcanzar una EDSS de 4 o de 6, pero lo hacen a una edad semejante o menor que los que tienen un inicio más tardío [5]. El sexo también se relaciona con el pronóstico de la EM. La EM es casi tres veces más frecuente en las mujeres que en los hombres; y en los hombres, la progresión de la discapacidad es algo más acelerada que en las mujeres [5]. La presentación clínica inicial (síntomas, número de topografías lesionales) se ha relacionado con el pronóstico de la EM a medio-largo plazo. Los pacientes que presentan en el primer brote síntomas sensitivos o una neuropatía óptica tienen un mejor pronóstico que aquellos que comienzan con una afectación cerebelosa, esfinteriana o motora. La presentación de la EM con síntomas atribuibles a más de una topografía lesional se relaciona con una mayor probabilidad de alcanzar antes una EDSS de 4 en relación con el inicio unitopográfico. La EMPP se comporta de una manera más homogénea que la EMRR, y no se observan las dife- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple rencias anteriormente descritas en relación con el sexo, edad de comienzo o características clínicas. La actividad inflamatoria en forma de brotes al comienzo de la EM (dos primeros años) está ampliamente aceptada como factor pronóstico [6]. Pero este efecto se mantiene sólo hasta que se alcanza una EDSS de aproximadamente 3-4; a partir de este punto, la discapacidad progresa de manera continua e independiente de los brotes que los pacientes tengan o hayan tenido. En este sentido, Leray et al [7] recalcan la importancia clínica de este hecho y de considerarlo como la ‘ventana terapéutica’ donde hay que centrar los esfuerzos terapéuticos, antes de que la discapacidad evolucione de manera continua (Fig. 2). El cambio a una evolución secundaria progresiva (SP) está relacionado principalmente con la edad de los pacientes, y este cambio evolutivo se produce alrededor de los 40 años. Al margen de las variables clínicas, existen otros posibles marcadores demográficos que podrían relacionarse con el pronóstico de los pacientes. Los antecedentes familiares de EM incrementan el riesgo de padecer la enfermedad, en función del parentesco y sexo del familiar afectado [8]. Los antecedentes familiares no se relacionan, sin embargo, con el curso clínico de la EM [9]. Está aceptado que el embarazo reduce el riesgo de brotes, aunque durante el puerperio este riesgo se incrementa [10]. Sin embargo, la maternidad no modifica el pronóstico de la EM a largo plazo [11]. En la práctica clínica se emplean como marcadores clínicos de respuesta al tratamiento los brotes y la discapacidad. Resulta, por ello, muy importante que todos los brotes, aunque sean leves, se valoren y contabilicen por el neurólogo responsable del paciente. Del mismo modo, la valoración de la discapacidad debe realizarse de manera sistemática y protocolizada, empleando escalas para este fin (por ejemplo, la EDSS). Biomarcadores en fluidos corporales distintos del líquido cefalorraquídeo A continuación, se exponen los marcadores identificados en los fluidos corporales más utilizados, como la sangre, la orina, las lágrimas y la saliva (Tabla I). Biomarcadores en sangre En la búsqueda de marcadores relacionados con las anomalías inmunológicas y la actividad de la enfermedad se han encontrado mediadores inflamatorios, www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Figura 2. Progresión de la discapacidad durante una fase tardía (fase 2) en el curso de la esclerosis múltiple (EM). Tiempo medio en alcanzar una puntuación en la EDSS (Expanded Disability Status Scale) entre 3-6 en pacientes con EM que alcanzan una EDSS de 3, clasificados en cinco subgrupos según la duración de la fase 1 (tiempo medio desde el inicio de la enfermedad hasta alcanzar una EDSS de 3). Adaptada de [7]. células del sistema inmune, y marcadores de migración celular y paso de la barrera hematoencefálica. Los mediadores inflamatorios, como citocinas y receptores, se han estudiado ampliamente en los últimos 20 años. A modo de resumen, entre las citocinas, los trabajos se han centrado fundamentalmente en la interleucina (IL)-6, la IL-10, la IL-17, la IL-12, el factor de necrosis tumoral (TNF) y la osteopontina. Entre las moléculas de membrana, se han estudiado de forma exhaustiva CD40, 80, 86, el regulador del interferón (IFNr) y los factores de muerte celular programada PD1/PDL1. En cuanto a los subtipos celulares, destacan CD56bright, las células T reguladoras, CD19+ y CD138+. Otras líneas de estudio han sido las moléculas de adhesión y migración transmembrana, como la molécula de adhesión celular vascular, el antígeno asociado a la función de los leucocitos-1, el antígeno de activación tardío-4, la proteína inducida por el interferón-γ-10, la IL-8, la metaloproteinasa de la matriz extracelular, el inhibidor tisular de metaloproteinasa, CCL-2, CCL-5, CXCR-1, CXCR-3, CXCL-8 y CXCL-13. Recientemente se han comenzado a estudiar los micro-ARN y su actividad postranscripcional [12], y las micropartículas endoteliales asociadas a los antígenos CD31 o CD51. Como marcadores de daño neurológico destacan la antiproteína básica de la mielina (anti-MBP), la glucoproteína oligodendrocítica de la mielina, 24SOHcol y la apolipoproteína E. En cuanto a marcadores de remielinización, lamentablemente en la sangre no se dispone de muchos datos. 377 O. Fernández, et al Tabla I. Principales biomarcadores en sangre, orina, lágrimas y saliva. Marcador Relación Citocinas y receptores: IL-6, IL-10, IL-17, IL-12, TNF, osteopontina Moléculas de membrana: CD40, CD80, CD89, IFNr, PD1/PDL1D Subtipos celulares: CD56bright, Tregs, CD19+, CD138+ Adhesión y migración transmembrana: sVACM, LFA-1, VLA-4, IP-10, IL-8, MMP, TIMP, CCL-2, CCL-5, CXCR-1, CXCR-3, CXCL-8, CXCL-13 Anomalías inmunológicas y actividad de la enfermedad Micro-ARN Sangre Micropartículas endoteliales asociadas a CD31 o CD51 Anti-MBP, MOG, 24S-OHcol, ApoE Daño neurológico Proteínas específicas: MxA (interferón-β), BDNF (AG, interferón-β), TRAIL, IFNAR Respuesta al tratamiento Anticuerpos neutralizantes anti-IFN, anti-AG, antinatalizumab Anticuerpos antiacuaporina 4 Diagnóstico TOB1 Pronóstico Orina Cadenas ligeras libres Actividad de la enfermedad Lágrimas Bandas oligoclonales Diagnóstico Saliva HLA soluble de clase II Respuesta al tratamiento AG: acetato de glatiramero; ApoE: apolipoproteína E; BDNF: factor neurotrófico derivado del cerebro; HLA: antígenos leucocitarios humanos; IFNAR: receptor del interferón α/β; IFNr: regulador de interferón; IL: interleucina; IP: proteína inducida por el interferón γ; LFA: antígeno asociado a la función de los leucocitos; MBP: proteína básica de la mielina; MMP: metaloproteinasa de la matriz extracelular; MOG: glucoproteína oligodendrocítica de la mielina; MxA: proteína antiviral; PD: proteína de muerte celular programada; PDL: ligando de muerte programada; sVACM: molécula de adhesión celular vascular; TIMP: inhibidor tisular de metaloproteinasa; TNF: factor de necrosis tumoral; TOB1: factor de transcripción regulador de la proliferación linfocitaria; TRAIL: ligando inductor de apoptosis relacionado con el factor de necrosis tumoral; Tregs: células T reguladoras; VLA: antígeno de activación tardío. Respecto a los marcadores de respuesta terapéutica, se ha observado que la mayoría de los marcadores inmunológicos alterados en la enfermedad activa se modifican en respuesta a determinados medicamentos. Además, existen proteínas específicas inducidas por medicamentos, como la proteína antiviral (interferón), el factor neurotrófico derivado del cerebro (BDNF) –acetato de glatiramero (AG), interferón-β–, el ligando inductor de apoptosis relacionado con el TNF y el receptor del interferón α/β. Por último, no hay que olvidar los anticuerpos 378 neutralizantes antiinterferón-β [13] y antinatalizumab [14,15], cuya utilidad en relación con la eficacia terapéutica ha quedado demostrada. Como marcador de diagnóstico, en la actualidad disponemos de los anticuerpos antiacuaporina-4, un biomarcador validado cuya determinación es útil en la práctica clínica para un diagnóstico di­ ferencial de la neuromielitis óptica (NMO) [16]. Como ejemplo de marcador relacionado con la patogenia, podemos mencionar la serología antivirus de Epstein-Barr, aunque resulta una cuestión bastante teórica, ya que el 100% de los pacientes con EM son positivos para el virus de Epstein-Barr, pero también lo es el 90% de la población adulta [17]. Por tanto, se cuestiona su utilidad, que únicamente podría aplicarse para el diagnóstico de casos dudosos. No obstante, se ha descrito que la coinfección con las variantes 1 y 2 del virus se da con mucha mayor frecuencia en la EM que en la población sana [18]. También se están estudiando marcadores relacionados con el pronóstico, como TOB1, un factor de transcripción regulador de la proliferación linfocitaria, que ha demostrado en algún trabajo que puede ser útil para predecir la conversión del síndrome clínicamente aislado (SCA) a EM clínicamente definida (EMCD). Biomarcadores en orina Los estudios en orina se han enfocado en los valores de excreción de varias moléculas como MBP, neopterina, metabolitos del óxido nítrico, cadenas ligeras, β2-microglobulina, prostaglandinas y diversas citocinas, como IL-2, sIL-2r, IL-6 e IL-8. Como ejemplo, el trabajo de Dobson et al [19] reflejó un patrón de excreción de cadenas ligeras diferente en distintas enfermedades inflamatorias o infecciosas, como enfermedades desmielinizantes, uveítis, artritis reumatoide y sida, resultados que también pudieron observarse en los SCA y las formas RR, PP y SP respecto a los controles, y que requieren futuras investigaciones para determinar una posible correlación con la actividad de la enfermedad. Biomarcadores en lágrimas y saliva La información disponible en lágrimas y saliva es escasa, pero puede ser de utilidad. La presencia de bandas oligoclonales (BOC) en las lágrimas se lleva estudiando desde la década de los ochenta, con hallazgos de una posible correlación entre patrones LCR/lágrimas, aunque controvertidos. Destaca el trabajo de Calais et al [20], cuyos resultados reflejan, en pacientes con SCA, un patrón de BOC con- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple cordante en el suero, el LCR y las lágrimas, que es del 70% entre las lágrimas y el LCR. Los autores sugieren que la detección de BOC en las lágrimas podría sustituir a la detección de BOC en el LCR como una herramienta diagnóstica en casos de SCA, aunque esto aún no se ha validado por otros autores. Otros datos de interés se han obtenido del análisis de marcadores en la saliva, ya que se ha observado un aumento de antígeno leucocitario humano soluble de clase II en respuesta al tratamiento con interferón. Figura 3. Probabilidad de permanecer libre de una segunda recaída. Análisis de Kaplan Meier en pacientes con esclerosis múltiple sometidos a punción lumbar después de la primera recaída: a) Pacientes con bandas oligoclonales de IgM BOCM+ frente a pacientes sin BOCM (BOCM–); b) Pacientes con bandas oligoclonales de IgM lipidoespecíficas (BOCMLE+) frente a pacientes BOCM– y BOCM-LE. Adaptada de [25]. a Biomarcadores en el líquido cefalorraquídeo Bandas oligoclonales de IgM Las BOC de inmunoglobulina M (IgM) se presentan aproximadamente en el 40% de los pacientes con EM, y constituyen un marcador de pronóstico desfavorable en esta patología. Las BOC de IgM se han descrito asociadas con una conversión temprana a EMCD, y a corto plazo con una mayor discapacidad. A largo plazo, un estudio conducido por Villar et al [21] mostró que, en pacientes no tratados con inmunomoduladores o tratados de forma tardía, los positivos para IgM alcanzaban una EDSS de 6 y evolucionaban a formas SP con anterioridad a aquellos IgM(–). Posteriormente, este hallazgo fue validado por el grupo de Gallo en 2006 [22], que observó que el índice de IgM al inicio de la enfermedad estaba claramente asociado con la discapacidad tras 10 años de evolución en pacientes, en su gran mayoría no tratados con inmunomoduladores. En línea con estos resultados, Jongen et al [23] mostraron que, en la EMRR, el índice de IgM correlacionaba con carga lesional en T1 y T2 y atrofia cerebral central, y en la forma SP, con carga lesional periventricular. La IgM la producen en el sistema nervioso central linfocitos B CD5+. En pacientes IgM(+), el aumento de linfocitos B CD5+ es proporcional al índice de IgM, y así se observa mediante citometría de flujo, cuyos resultados muestran la presencia de dicha subpoblación linfocitaria en pacientes con EM IgM(+), que no se observa en aquéllos IgM(–) ni en pacientes con otras enfermedades neurológicas [24]. Dado que las células CD5+ reconocen antígenos no proteicos, Villar et al [25] analizaron la posible reactividad frente a los lípidos de la mielina. Los resultados mostraron que, en más del 80% de los casos, las bandas de IgM reconocían la fosfatidilcolina como único antígeno, y que la presencia de bandas de IgM lipidoespecíficas era un indicador más preciso de la aparición temprana de un segun- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 b do brote que las bandas de IgM totales (Fig. 3). El 20% de los pacientes con bandas IgM no lipidoespecíficas mostró una evolución similar a los pacientes IgM(–). En este grupo se demostró que la síntesis de IgM era una respuesta primaria transitoria. Estos resultados fueron validados en la serie de Than­ garajh et al [26] con pacientes previamente tratados. Se confirmó que la probabilidad de desarrollar de manera precoz una forma SP y de alcanzar una EDSS de 4 era significativamente superior en pacientes IgM(+) frente a aquéllos IgM(–). Por su parte, Boscá et al [27] diseñaron un estudio prospectivo para identificar pacientes con SCA en riesgo de una segunda recaída. Los resultados manifestaron que los pacientes IgG(–)/IgM(–) presentaban una menor probabilidad de conversión frente a aquellos IgG(+)/IgM(–) e IgG(+)/IgM(+) (hazard ratio = 39,62; p < 0,0001). Asimismo, el trabajo 379 O. Fernández, et al de Magraner et al [28] reflejó que el volumen lesional en T2 era significativamente superior en pacientes IgM(+) frente a IgM(–), una diferencia que se incrementaba a lo largo del tiempo. Estos hallazgos llevaron a investigar las estructuras reconocidas por la IgM en el sistema nervioso central mediante inmunohistoquímica de alta sensibilidad en necropsias de 14 pacientes con EM, dos con ictus, dos con encefalitis herpéticas y cuatro controles sin enfermedad neurológica [29]. La presencia de anticuerpos IgM se detectó en la superficie de los axones y en la membrana de los oligodendrocitos en áreas desmielinizadas. Además, en la sustancia blanca aparentemente normal, el doble marcaje con el marcador de oligodendrocitos Olig2 reflejó una interacción con la IgM. Posteriores análisis mostraron que la IgM colocalizaba con el factor del complemento C3b en las lesiones y en la sustancia blanca aparentemente normal, hallazgos que no se observaron en casos de encefalitis herpética, y que llevan a pensar que la IgM no sólo es un biomarcador de peor evolución, sino que tiene un papel en la fisiopatología de la enfermedad. La relación de las bandas de IgM y la respuesta al tratamiento comenzó a estudiarse con interferón por tratarse del primer fármaco comercializado en España. En un trabajo diseñado para analizar la posible influencia de estos anticuerpos en la respuesta terapéutica [30], pudo comprobarse que los pacientes IgM(+) experimentaban un segundo brote tras el inicio del tratamiento con anterioridad a los pacientes IgM(–). Además, se observó una reducción en la tasa de brotes del 51,8% en los pacientes IgM(+) frente al 80,8% en aquellos IgM(–) (p < 0,001), y un mayor porcentaje de pacientes con un incremento ≥ 1 en la escala EDSS (45% frente a 12,9%; p = 0,0003). Considerando que los pacientes con una respuesta subóptima al interferón son candidatos a tratamiento con natalizumab, se estudió el patrón de bandas de IgM antes del tratamiento y un año después del inicio con natalizumab, y su correlación con la respuesta terapéutica [31]. Los resultados mostraron que únicamente en aquellos pacientes que estaban en respuesta completa, los niveles de IgM se negativizaban hasta alcanzar índices < 0,1. Asimismo, se observó una tendencia a una disminución en las bandas de IgG, aunque sin negativizar. Cabe destacar que la desaparición de bandas de IgM no se observó en pacientes que continuaban presentando actividad de la enfermedad durante el tratamiento con natalizumab, y que en este grupo tampoco hubo diferencias significativas entre los índices de IgM antes y después del tratamiento. 380 Bandas oligoclonales de IgG Las BOC de IgG fueron el primer biomarcador descrito en la EM [32,33]. Están presentes en más del 95% de pacientes y, aunque no son específicas de la enfermedad, contribuyen a su diagnóstico y demuestran la naturaleza inflamatoria de las lesiones [34,35]. Neurofilamentos Los neurofilamentos (NF) forman parte del citoesqueleto de las neuronas y de los axones, y, además de tener una función de soporte, intervienen en el proceso de conducción axonal. Hay tres tipos en función de sus proteínas: de cadena pesada (NFH), de cadena intermedia (NFI) y de cadena ligera (NFL); estos últimos son los más estudiados en la EM. Uno de los primeros trabajos que sugería un valor pronóstico del NFL en la EM es el publicado por Salzer et al [36], que demostró una correlación entre los niveles de NF y la discapacidad mediante la escala Multiple Sclerosis Severity Score. Estos resultados se confirmaron en un posterior análisis de seguimiento, al reflejar que los pacientes con un mayor nivel de NFL al inicio de la enfermedad evolucionaban a una forma SP, si bien necesitan una validación. En la misma línea, Madeddu et al [37] evaluaron, junto con el NF, los niveles de otras proteínas del citoesqueleto neural, como la proteína acídica fibrilar glial (GFAP) y la β-tubulina en sus isoformas II y III (βTub II/III) en el LCR de pacientes con EM, y su correlación con índices clínicos. Los resultados mostraron que, a excepción de la βTub II, los niveles en el LCR del resto de proteínas, incluyendo el NFL, se reducían a medida que aumentaba la puntuación en la EDSS, pero sin detectarse una correlación significativa. Estos hallazgos cuestionan su relación con la discapacidad. Por su parte, Kuhle et al [38] estudiaron el NFH –NfH(SMI35)– y su posible correlación con la discapacidad, actividad de la enfermedad o estadios específicos de la EM. Los autores observaron un aumento de los niveles en todas las formas de la enfermedad, en comparación con los controles. Los brotes se asociaron con valores elevados de NfH(SMI35) en el LCR frente a la enfermedad estable, y estos niveles de NfH(SMI35) se correlacionaron con las puntuaciones en la EDSS en pacientes con SCA y EMRR. Un análisis reciente del grupo de Teunissen [39] con datos derivados de los estudios de NFL y NFH sostiene que el NFL puede reflejar mejor el daño axonal agudo, ya que hay una correlación con la actividad de la enfermedad (sea ésta evaluada mediante los brotes, sea mediante lesiones realzadas www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple en gadolinio) o incluso con las BOC, y que, además, puede tener valor pronóstico de conversión de SCA a EM. Sin embargo, el NFL no presenta una fuerte correlación con la progresión de la discapacidad, contrariamente al NFH. Otro trabajo del grupo de Quintana en pacientes españoles [40] analizó, mediante microarrays, la reactividad de anticuerpos en muestras pareadas de suero y LCR de pacientes con formas RR y controles con otras enfermedades neurológicas inflamatorias, frente a 334 antígenos, incluyendo el NF y heatsock proteins. Los resultados mostraron reactividad con NF únicamente en el 25% de los casos de EM, mientras que otras proteínas, como las heat-sock proteins, resultaron ser mejores marcadores. Al estudiar la secreción intratecal de anticuerpos antiNF, este porcentaje alcanzó el 50%. Se trata, por tanto, de un método que, al permitir el análisis de un elevado número de autoanticuerpos específicos del sistema nervioso central, proporciona un patrón de reactividad que refleja con gran detalle las respuestas autoinmunes en el suero y el LCR, si bien requiere su validación en el seguimiento, que se está realizando actualmente. La utilidad del NF para valorar la respuesta al tratamiento quedó ‘demostrada’ en un trabajo publicado por Gunnarsson et al [41], que estudiaron el efecto del natalizumab en la secreción de dos marcadores específicos de daño tisular cerebral, NF y GFAP, en el LCR de pacientes con EM. Los resultados reflejaron que tanto en los pacientes en brote como en remisión, los niveles de NF tras 6-12 meses de tratamiento descienden significativamente para aproximarse a los niveles del grupo control, una disminución más pronunciada en las formas RR que en las SP. Es un hallazgo prometedor que permite anticipar que un tratamiento antiinflamatorio altamente eficaz puede reducir la pérdida axonal y prevenir el desarrollo de una discapacidad neurológica permanente. Quitinasa 3-like 1 El análisis proteómico de muestras del LCR facilita la identificación de proteínas asociadas con la conversión a EMCD. Concretamente, Comabella et al, en su trabajo publicado en 2010 [42], identificaron la quitinasa 3-like 1 (CHI3L1) como un biomarcador pronóstico de conversión a EM y desarrollo de discapacidad en pacientes con SCA. Mediante análisis por espectrometría de masas, los autores identificaron como potenciales candidatos la ceruloplasmina, la proteína de unión a la vitamina D y la CHI3L1. Esta última fue la única que posteriormente se validó mediante ELISA, y cuyos niveles en el LCR estaban www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 significativamente elevados en pacientes que convirtieron a EMCD en comparación con los que continuaban como SCA (p = 0,00002), y sujetos controles (p = 0,012). Asimismo, los niveles elevados de CHI3L1 en el LCR se correlacionaron significativamente con el número de lesiones captantes de gadolinio y de lesiones en T2 basales, y se asociaron con progresión de la discapacidad y con un menor tiempo hasta la aparición de EMCD (p = 0,003). Biomarcadores ADN/ARN: farmacogenética y farmacogenómica Hasta la fecha, existen muy pocos datos de valores de exactitud diagnóstica, ya sea especificidad, sensibilidad o valores predictivos positivo y negativo, en relación con este tipo de biomarcadores. Al respecto, destaca la identificación, mediante estudios de transcripción y genéticos, de nuevos marcadores candidatos de predicción de respuesta al interfe­ rón-β y al AG. Baranzini et al [43] analizaron patrones de expresión génica en pacientes con EM tratados con interferón-β con el objetivo de identificar firmas de expresión de genes preexistentes e inducidas por medicamentos que pudieran predecir una respuesta terapéutica. Tras dos años de tratamiento, estos pacientes fueron clasificados en respondedores y no respondedores según criterios clínicos de brotes y progresión en la EDSS. En estos pacientes, se estudió la expresión de 70 genes reguladores de la vía de los interferones de tipo 1 y genes implicados en el proceso de apoptosis. Los autores identificaron combinaciones de tripletes de genes, cuya expresión se asociaba con predicciones de respuesta superiores al 80%. En otro estudio publicado por Comabella et al [44], se emplearon criterios similares de respuesta al tratamiento, aunque más restrictivos, ya que requerían, para una no respuesta, la presencia de al menos una recaída y progresión de la discapacidad neurológica. Mediante microarrays en muestras de sangre extraídas antes del tratamiento y a los tres meses, se estudiaron patrones de expresión génica, y se identificó una combinación de ocho genes cuya expresión permitía predecir la respuesta con un 80% de precisión. Los principales estudios de genes candidatos que se han publicado se han realizado en tamaños muestrales pequeños, y han manifestado asociaciones débiles o no replicadas [45-48]. La exploración de la combinación de genes asociadas con la respuesta al interferón-β [49] mostró JAK2-IL10RB-GBP1-PIAS1, seguida de JAK2-IL10-CASP3, como las combina- 381 O. Fernández, et al ciones de alelos que presentaron una mayor asociación con la respuesta. En cuanto a estudios de asociación de genoma completo en relación con la respuesta a interferón-β, sólo hay dos publicados hasta la fecha, el trabajo de Byun et al [50] y el de Comabella et al [51], ambos de diseño muy similar, con criterios de respuesta parecidos, aunque más restrictivos en el último, con una selección de polimorfismos de genes candidatos y una posterior validación en cohortes parcial o totalmente independientes. Algunos de los polimorfismos identificados en estos dos estudios fueron localizados en genes con expresión predominante en el tejido cerebral y en genes relacionados con la vía de los interferones de tipo 1, datos que apoyan el papel de estos genes en la respuesta al interferón-β. Una de las principales asociaciones con la respuesta que se obtuvo en el trabajo de Comabella et al [51] fue la manifestada con un gen que codifica para un receptor del glutamato (GRIA3). Del mismo modo, Byun et al [50] observaron una gran representación de genes relacionados con canales iónicos con puerta de ligandos extracelulares (ácido γ-aminobutírico, glutamato), hallazgos que abren la puerta a una interesante asociación entre excitabilidad neuronal y respuesta a interferón-β. Respecto al AG, el número de estudios de farmacogenética y farmacogenómica es bastante menor en comparación con el interferón-β, y destacan hasta la fecha tres estudios de genética. El primero de ellos, de Fusco et al [52], identificó una asociación con la respuesta del alelo HLA-DRB1*1501, que es el principal factor de riesgo genético para la EM. Sin embargo, un estudio posterior de Grossman et al [53] no encontró dicha asociación, de forma que propusieron dos genes adicionales que podrían intervenir en la respuesta a AG, el gen TRBβ, localizado en el receptor de células T, y el gen catepsina-S, que codifica una proteína lisosomal. Un estudio más reciente de Tsareva et al [54] mostró que la combinación de diferentes alelos (DRB1*15+TGFB1*T+CCR5*d+IF NAR1*G) se asociaba a un riesgo 14 o 15 veces superior de una mala respuesta al tratamiento con AG. Biomarcadores de imagen Tomografía de coherencia óptica La OCT es un nuevo biomarcador de imagen de neurodegeneración en EM y un posible candidato para el futuro en la práctica clínica. La OCT permite obtener imágenes del espesor de la retina, cuantificar su grosor y su capa más in- 382 terna. Es una técnica rápida, no invasiva, cuantitativa, precisa y reproducible. Se basa en un principio similar al de los ultrasonidos y se relaciona claramente con la patología e histología de la EM. Asimismo, se correlaciona con la clínica y es sensible a los cambios en el tiempo, aspecto este último bastante importante para comprobar su valor pronóstico. La pérdida de fibras nerviosas en pacientes con EM se ha confirmado en diversos estudios post mortem [55], electrofisiológicos [56], con animales e in vivo [57,58], incluso en pacientes sin historia de neuritis óptica (NO), de ahí su posible valor como biomarcador. Su utilidad como marcador diagnóstico está claramente establecida. En 1999, un estudio de Parisi et al [59] mostró que los ojos de pacientes con EM e historia de NO presentaban una reducción significativa del espesor de la capa de fibras nerviosas de la retina (RNFL) frente a sujetos controles, si bien no había diferencia entre el espesor de la RNFL de los ojos controles y del ojo no afectado de los pacientes con NO. Hasta la fecha, cabe destacar un metaanálisis de 32 estudios, publicado en el año 2010 [60], y cuyos resultados reflejan una disminución de 7,08 µm en pacientes con EM y ojos no afectados de NO, y de 20,38 µm en pacientes con EM y ojos afectados por NO. Años más tarde, Trip et al [61] llevaron a cabo un estudio para determinar la pérdida axonal de la RNFL y la disfunción visual en la NO. Este trabajo, con un total de 25 pacientes con un único episodio previo de NO y recuperación incompleta y 15 sujetos controles, mostró una reducción significativa de aproximadamente un 30% en la RNFL, y del 10% en el volumen macular en los ojos afectados en comparación con los ojos controles y con los ojos contralaterales no afectados clínicamente. Otros trabajos sobre NO asociada o no a EM son los publicados por Oreja-Guevara et al [62] y Pulicken et al [63]. El primero de ellos [62] mostró que el porcentaje de pacientes con atrofia de la capa de fibras nerviosas es de un 57,9% en pacientes con NO, de un 75% en pacientes con EM y NO, y de un 33,3% en pacientes con EM, hallazgos que se demostraron igualmente en el estudio de Pulicken et al [63]. Resulta, por tanto, evidente la afectación de la capa de fibras en pacientes con EM, incluso sin NO. Un estudio de Green et al [64] reflejó principalmente una disminución temporal del espesor de las RNFL en pacientes con EM, sin que hasta hoy se conozca el porqué de una mayor afectación de las fibras temporales. Además de la utilidad diagnóstica en las NO, la OCT facilita el diagnóstico diferencial con otras patologías similares. Así, la OCT ayuda a diferenciar un primer episodio de NO asociada a EM de una www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple NMO, ya que en los tres primeros meses refleja un daño en la retina más grave tras un episodio de NO en los casos de NMO (< 60 µm) en comparación con la EMRR (< 88,3 µm; p < 0,001) [65,66]. Asimismo, la OCT permite diferenciar una NO retrobulbar por EM de una NO isquémica. Después de tres meses, la NO isquémica muestra un patrón de afectación principalmente en el sector superior, mientras que en la NO retrobulbar se afecta principalmente el sector temporal [67]. De la misma manera, el patrón de daño en la retina facilita el diagnóstico diferencial entre el síndrome de Susac y la EM [68]. Como marcador predictivo es mucho más controvertido, y así se manifiesta en los cuatro únicos artículos publicados hasta la fecha, presumiblemente por la limitación derivada de la utilización de máquinas de tercera generación. Se considera que el actual uso de una tecnología más avanzada, con aparatos de cuarta generación, podría mejorar estos resultados. Costello et al, en uno de sus trabajos publicados [69], refieren que la OCT no discrimina de manera fiable los pacientes con un riesgo elevado de convertir a EMCD tras una NO, si bien aquellos pacientes que han convertido después de un año presentan una reducción progresiva del espesor de la RNFL, probablemente debida a eventos de NO subclínicos y recurrentes, un hallazgo que podría ayudar a diferenciarlos de aquellos pacientes sin EM a lo largo del tiempo. Con el propósito de evaluar si la medida del espesor de la RNFL en pacientes con SCA indica qué pacientes van a evolucionar a EM, Oreja-Guevara et al [70] publicaron un trabajo recientemente que comparó el valor predictivo de la OCT con la RM. De este modo, se pudo observar que el daño axonal medido mediante OCT estaba presente en todas las formas de SCA (mielitis, alteraciones del tronco cerebral), no sólo en la NO, como se había visto hasta ahora. La OCT permitía detectar el daño axonal en estadios muy tempranos de la enfermedad, y mostraba una sensibilidad del 75% y una especificidad del 56,25% para predecir diseminación en el espacio por RM (Tabla II). Para su validez como marcador pronóstico a largo plazo, es preciso demostrar con la OCT una evolución en el tiempo en los pacientes con EM. Al respecto, hay trabajos, como el publicado por Toledo et al [71], que han demostrado una asociación entre la disminución del espesor de la capa de fibras de la retina y la actividad de la enfermedad. Así, los pacientes que experimentaron brotes presentaban una mayor reducción del espesor de la capa de fibras nerviosas en comparación con los que permanecían libres de brotes durante dos años. De la misma manera, se demostró una mayor reducción de la www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Tabla II. Precisión diagnóstica de la tomografía de coherencia óptica (adaptado de [70]). Criterios de diseminación en el espacio Resonancia magnética (3/4 criterios de Barkhof) Resonancia magnética y presencia de bandas oligoclonales Sensibilidad Especificidad 75% 56,25% 66,67% 58,33% RNFL en los pacientes que progresan comparados con aquéllos libres de progresión en dos años. Además de las variables clínicas brotes y discapacidad, la cuantificación del espesor axonal en la retina por OCT también se relaciona con variables de imagen, como la atrofia cerebral por RM [72]. La OCT podría ser un marcador biológico para monitorizar la progresión y los tratamientos en la EM. Recientemente, se ha publicado el primer documento de consenso [73] que establece los criterios de evaluación de calidad de la OCT, y que permitirá comparar resultados e implementar la técnica en ensayos clínicos [74], sobre todo en los diseñados para demostrar un efecto neuroprotector. Resonancia magnética La RM como marcador diagnóstico está suficientemente validada en la clínica, y se utiliza de forma rutinaria sobre todo al inicio de la enfermedad para demostrar diseminación en el espacio y diseminación en el tiempo. Como marcador de la actividad de la enfermedad, la RM se utiliza tanto en ensayos clínicos como en la práctica clínica. Su uso en ensayos clínicos está suficientemente avalado para detectar las lesiones que captan gadolinio o las nuevas lesiones en T2, si bien resulta difícil trasladar esta información de utilidad pronóstica a la práctica clínica diaria. En el caso de pacientes con lesiones captantes de gadolinio, una RM aislada tiene un escaso valor pronóstico [75], resulta más fácil ver lesiones captantes de gadolinio en las formas iniciales de la enfermedad [76], y la presencia de lesiones captantes de gadolinio predice la captación en nuevas RM [77,78], pero existe una correlación escasa o nula con la presencia de brotes [75,78]. Para disponer de información pronóstica válida, se necesitarían RM seriadas durante al menos seis meses [75]. En cualquier caso, la relación entre captación de gadolinio y discapacidad es escasa en las formas RR, y más aún en las formas progresivas de la enfermedad [75]. 383 O. Fernández, et al Figura 4. Tiempo hasta alcanzar una puntuación en la Expanded Disability Status Scale (EDSS) de 3 en función de los hallazgos (número de lesiones) en resonancia magnética basal. Adaptada de [79]. Desde el punto de vista del paciente, es posible obtener información pronóstica al inicio de la enfermedad, ya que se ha encontrado una correlación moderada entre el número de lesiones basales y la discapacidad a largo plazo (r = 0,43; p < 0,001) [79] (Fig. 4). Por otro lado, se ha observado que el incremento de lesiones en T2 durante los cinco primeros años puede aportar información pronóstica en cuanto a la posibilidad de desarrollar una forma SP de la enfermedad [80], información que sería útil sobre todo al inicio de la enfermedad, debido al efecto de estancamiento o efecto plateau, que se hace evidente una vez que los pacientes alcanzan una EDSS de 4 o una forma SP [80]. Cabe señalar que no todos los estudios apoyan este efecto plateau; como ejemplo de ello, Li et al [81] confirmaron la limitada correlación entre la carga lesional en T2 y las manifestaciones clínicas, si bien revelaron una relación entre el estancamiento de la carga lesional en T2 y la discapacidad con valores de EDSS > 4,5. Una vez que las lesiones captantes de gadolinio o lesiones en T2 dejan de tener utilidad, las medidas de atrofia cerebral, dirigidas a evaluar los procesos de neurodegeneración, se muestran moderadamente correlacionadas con la discapacidad en pacientes con formas RR y SP [82]. Los métodos de segmentación identifican un patrón de atrofia cerebral regional, con diferentes tasas de afectación de la sustancia gris y de la sustancia blanca. Al respecto, hay trabajos que muestran una atrofia cerebral impor- 384 tante, tanto de la sustancia gris como de la sustancia blanca, que ocurre de forma temprana en el curso clínico de la EM [83], o bien una atrofia progresiva de la sustancia gris en las primeras fases de brotes moderadamente relacionada con la acumulación de las lesiones [84]. Otros trabajos manifiestan esta atrofia de sustancia gris y de sustancia blanca en las diferentes formas clínicas, y existe una correlación moderada-alta entre la atrofia de la sustancia gris y la discapacidad o el trastorno cognitivo [85-87]. Como otras medidas de neurodegeneración, Filippi et al [88] describen las lesiones intracorticales, más frecuentes en las formas más evolucionadas de la EM; las técnicas de transferencia de magnetización, que ayudan en la obtención de medidas más globales de afectación de la sustancia blanca o gris de apariencia normal; la espectroscopia, en la que el estudio de diferentes metabolitos, como el N-acetil-D-aspartato, el glutamato y el sodio, puede aportar información sobre los procesos neurodegenerativos; los estudios de tractografía, que describen los tractos dañados y su correlación con trastornos cognitivos o de la discapacidad; y la técnica de USPIO, que permite estudiar el depósito de hierro como medida para el diagnóstico diferencial y correlacionarlo con medidas de discapacidad. Otras técnicas, como la perfusión o la RM funcional, pueden ayudar a monitorizar determinados tratamientos, como la neurorrehabilitación. Como marcador de respuesta al tratamiento, cabe mencionar que los ensayos clínicos muestran una fuerte correlación (> 80%) entre el efecto del tratamiento en lesiones activas y el efecto terapéutico sobre los brotes [89], y la correlación con la discapacidad es menos evidente [90]. Se trata de un aspecto importante, ya que, si las lesiones activas son realmente válidas como variables subrogadas, se evitaría la realización de ensayos clínicos en fase III. Individualmente, la RM puede utilizarse para monitorizar la respuesta al tratamiento. Un trabajo de Río et al [91] mostró que la combinación de información clínica y de RM podía tener un valor pronóstico para identificar los pacientes con enfermedad activa después de tres años de tratamiento. La puntuación del grupo de Río, basada en el número de brotes (≥ 1), en la progresión de la discapacidad (≥ 1 punto en la EDSS) y en el número de lesiones en T2 o captantes de gadolinio (> 3) al año de tratamiento, permitiría predecir una mala respuesta a los tres años si consideramos como pacientes ‘no respondedores’ aquellos que al año presentan al menos dos de los tres parámetros de la puntuación del grupo de Río. Estos resultados se han validado en una cohorte independiente [92]. www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple Tabla III. Biomarcadores moleculares que reflejan el mecanismo de acción del acetato de glatiramero en pacientes respondedores, pero que no predicen respuesta al inicio del tratamiento. Efecto del acetato de glatiramero Mecanismo de acción Asociación y posible utilidad clínica ↑ CD4(+)CD25(high) / ↑ IL-10 [95] Competencia con péptidos de melina – ↑ CD3+, CD4+ y CD4(+) CD45RA(+) / ↑ BDNF [96] Competencia con péptidos de melina Respuesta clínica a largo plazo ↑ CD4+CD25+ FoxP3+PD1 / ↑ inhibición de la respuesta proliferativa CD4+ [97] Competencia con péptidos de melina Respuesta clínica a largo plazo ↓ Th1,Th17 / ~citocinasTh2 / ~GATA3 [98] Respuesta Th1 → Th2 – ↑ Cociente de citocinas Th1/Th2 [99] Respuesta Th1 → Th2 – ↑ CD8+ supresoras/citotóxicas que destruyen CD4+ frente a proteína básica de la mielina [100] Competencia con péptidos de melina Respuesta inmunomoduladora ↓ supresión de linfocitos T autorreactivos en la encefalitis autoinmune experimental / ↓ producción de IFN-γ proinflamatorio [101] Apoptosis de linfocitos autorreactivos – ~: la expresión no se modifica por efecto del tratamiento; BDNF: factor neurotrófico derivado del cerebro; IFN: interferón; IL: interleucina; PD: proteína de muerte celular programada. Biomarcadores de respuesta al acetato de glatiramero La heterogeneidad genética y la fisiopatología de la EM son responsables, al menos en parte, de la diferente respuesta al tratamiento. En este sentido, sería importante poder seleccionar, previo inicio del tratamiento, los pacientes que van a responder y, por ello, se han dedicado y dedican muchos esfuerzos a la identificación de marcadores que ayuden a ello. El biomarcador de respuesta ideal debería poder correlacionarse no sólo con la historia natural de la enfermedad, sino también con el mecanismo de acción del fármaco y con el beneficio del tratamiento, y debería reflejar su efecto positivo permanente y ser un marcador sustituto de las variables clínicas reconocidas [93]. Como ejemplo, van Winsen et al [94] diseñaron un estudio para predecir la respuesta al tratamiento con glucocorticoides. Estudiaron el efecto de la administración de glucocorticoides sobre la estimulación in vitro de la producción de TNF-α en linfocitos de pacientes con EM antes y después del tratamiento con metilprednisolona. Observaron que el porcentaje de supresión de la producción de TNF-α tras el tratamiento con metilprednisolona era superior en aquellos pacientes cuyos linfocitos habían respondido in vitro al efecto supresor de los glucocorticoides previo inicio del tratamiento. Estos resultados suge- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 rían una resistencia parcial a los glucocorticoides que podría influir en la eficacia del tratamiento. En relación con los mecanismos de acción del AG, se ha estudiado la presencia de determinadas moléculas en el suero y una posible asociación con la predicción de respuesta al inicio del tratamiento (Tabla III). Al respecto, Putheti et al [95] analizaron in vitro los efectos del AG en las células T reguladoras de pacientes con EM, estratificados según tratamiento con o sin inmunomoduladores, y sujetos controles. Observaron que la exposición al AG reguló las células T reguladoras CD4(+)CD25(high), e indujo la producción de IL-10 en todos los grupos de pacientes con EM, independientemente del tratamiento recibido, así como en los sujetos controles. Por su parte, Blanco et al [96] demostraron que la producción del BDNF aumentaba en los pacientes respondedores a lo largo de la evolución de la enfermedad de forma muy significativa en comparación con los no respondedores. Los autores concluyeron que la producción de BDNF podría estar relacionada con la respuesta clínica a largo plazo, y no resulta útil, por lo tanto, como marcador de la predicción de respuesta. Del mismo modo, Saresella et al [97] reflejaron un porcentaje de inhibición de proliferación de células implicadas en la patogenia de la enfermedad superior en pacientes respondedores frente a no respondedores. De nuevo se trata de marcadores con un papel en la EM, que ofrecen una expli- 385 O. Fernández, et al cación de la actividad de la enfermedad y de los mecanismos asociados con la respuesta al tratamiento, pero que no predicen la respuesta. Basándose en el conocido mecanismo de acción del AG de cambio en la respuesta Th1 a Th2, Sellebjerg et al [98] estudiaron recientemente la respuesta inmunológica al AG y su relación con la actividad de la enfermedad. Para ello, analizaron la presencia de anticuerpos anti-AG en el plasma y la expresión de genes que codifican citocinas y factores de transcripción de polarización de linfocitos T en pacientes con EMRR no tratados y tratados con AG. En los pacientes tratados con AG disminuyó la expresión de citocinas proinflamatorias Th1 durante el tratamiento a largo plazo, si bien no aumentó la expresión de las citocinas relacionadas con la respuesta antiinflamatoria Th2. Sin embargo, GATA3, un factor de transcripción asociado al cambio a Th2, y cuya elevada expresión del ARN mensajero se asocia con una baja actividad de la enfermedad en estudios de RM, no se vio modificado por el tratamiento. En definitiva, una expresión disminuida de GATA3 parece asociada a una peor respuesta al fármaco, si bien son datos muy preliminares y, por tanto, de poca utilidad clínica. Continuando con el cambio de respuesta Th1 a Th2, Tumani et al [99], en una muestra muy pequeña de pacientes con EMRR con y sin brotes tratados con AG, observaron que el cociente citocinas Th1/ Th2 aumentaba de forma significativa en pacientes con brotes en comparación con aquéllos libres de brotes tras 12, 24 y 36 meses de tratamiento. Estos resultados pueden parecer lógicos, pues se trata de una respuesta proinflamatoria. En otra línea, Tennakoon et al [100] demostraron que la terapia con AG induce una respuesta supresora/citotóxica de las células T CD8+ que destruye las células CD4+, y que es capaz de modular las respuestas inmunológicas durante el tratamiento. Por último, el trabajo de Toker et al [101], en un modelo de encefalitis autoinmune experimental, ha manifestado que el AG se une directamente a los monocitos circulantes (vía mecanismo independiente MHC-II) y aumenta la capacidad intrínseca de estos monocitos de suprimir la proliferación in vitro de linfocitos T CD4+ específicos frente a la proteína básica de mielina. Esta función supresora del AG se asoció a una disminución de la proliferación de linfocitos T autorreactivos y a una inhibición de la producción del interferón-γ proinflamatorio por los linfocitos Th1. En definitiva, toda la información disponible arroja datos en pacientes a lo largo del tratamiento. Si bien estudios farmacogenómicos recientes [39] 386 apuntan hacia marcadores alélicos relacionados con la respuesta al AG, lamentablemente, hoy en día no hay trabajos en la literatura que hayan identificado algún marcador que al inicio del tratamiento nos indique de una forma válida y fiable los pacientes con una elevada probabilidad de respuesta clínica y radiológica. Conclusiones Las variables clínicas, aunque tienen una utilidad limitada en un pronóstico personalizado, son esenciales para valorar la eficacia del tratamiento modificador de la enfermedad y son la referencia para otros biomarcadores. En la sangre, existen numerosos marcadores que reflejan la activación inmunológica, muchos de los cuales se modifican con los tratamientos, si bien actualmente ninguno de ellos, salvo los anticuerpos anti-NMO-IgG, tiene utilidad diagnóstica ni pronóstica. Con relación a la pérdida de la eficacia terapéutica, ha quedado demostrada la utilidad de los anticuerpos neutralizantes frente a interferón-β y natalizumab. La información disponible en orina, lágrimas y saliva es escasa, pero puede ser de utilidad. En el LCR, la presencia de BOC de IgM identifica pacientes con un curso más agresivo de la enfermedad. Estos anticuerpos reconocen lípidos en la superficie de los axones y en la membrana de los oligodendrocitos, y median el daño a éstos por la activación del complemento. El patrón de BOC de IgM puede modificarse en respuesta a determinados tratamientos, y su desaparición se asocia a una muy buena respuesta clínica. Por otra parte, el estudio combinado de las cadenas del NF puede ser útil para detectar perfiles pronósticos y evolutivos en la EM y en la elección del tratamiento. El NF se anticipa como un marcador de respuesta al tratamiento en el futuro, si bien son necesarios más estudios de correlación clínica. En otra línea, el estudio de biomarcadores de respuesta basados en ADN/ARN requiere estudios de validación, sobre todo en cohortes amplias, para evaluar su utilidad en la clínica y poder aportar datos de valores predictivos de sensibilidad y especificidad. Se necesitan abordajes similares de farmacogenética y farmacogenómica extensibles a otros tratamientos, más allá de interferón-β y AG. El desarrollo de la OCT es otro ejemplo de los beneficios que puede ofrecer el desarrollo de biomarcadores en la EM, y es de utilidad para el diagnóstico de las NO, y para el diagnóstico diferencial de la NMO y otras neuropatías ópticas. No obstan- www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple te, hay escasos estudios sobre el valor pronóstico. Los resultados de la OCT se relacionan con variables clínicas (brotes y EDSS) y con variables de imagen, como la atrofia cerebral. Podría ser un biomarcador de progresión de la enfermedad y de respuesta terapéutica en la EM. Se obtienen datos muy interesantes de la evaluación de la RM. A modo de resumen, se trata de un excelente biomarcador para el diagnóstico, un marcador de inflamación y de actividad de la enfermedad, y un marcador incompleto para la neurodegeneración. En los ensayos clínicos, se muestra como buen subrogado de los brotes en formas RR, aunque como subrogado incompleto de la discapacidad en formas RR y SP. Individualmente, la RM puede ser útil para monitorizar el tratamiento en la fase inflamatoria, aunque no hay suficiente evidencia en la fase neurodegenerativa de la enfermedad. En cuanto a los biomarcadores de respuesta al AG, cabe señalar que, lamentablemente, hoy en día no hay trabajos en la bibliografía que hayan identificado algún marcador que al inicio del tratamiento nos indique de una forma válida y fiable los pacientes con una elevada probabilidad de respuesta clínica y radiológica. Bibliografía 1. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001; 69: 89-95. 2. Ziemann U, Wahl M, Hattingen E, Tumani H. Development of biomarkers for multiple sclerosis as a neurodegenerative disorder. Prog Neurobiol 2011; 95: 670-85. 3. Langer-Gould A, Popat RA, Huang SM, Cobb K, Fontoura P, Gould MK, et al. Clinical and demographic predictors of longterm disability in patients with relapsing-remitting multiple sclerosis: a systematic review. Arch Neurol 2006; 63: 1686-91. 4. Degenhardt A, Ramagopalan SV, Scalfari A, Ebers GC. Clinical prognostic factors in multiple sclerosis: a natural history review. Nat Rev Neurol 2009; 5: 672-82. 5. Tremlett H, Zhao Y, Rieckmann P, Hutchinson M. New perspectives in the natural history of multiple sclerosis. Neurology 2010; 74: 2004-15. 6. Scalfari A, Neuhaus A, Degenhardt A, Rice GP, Muraro PA, Daumer M, et al. The natural history of multiple sclerosis: a geographically based study 10: relapses and long-term disability. Brain 2010; 133: 1914-29. 7. Leray E, Yaouanq J, Le PE, Coustans M, Laplaud D, Oger J, et al. Evidence for a two-stage disability progression in multiple sclerosis. Brain 2010; 133: 1900-13. 8. Ramagopalan SV, Knight JC, Ebers GC. Multiple sclerosis and the major histocompatibility complex. Curr Opin Neurol 2009; 22: 219-25. 9. Hensiek AE, Seaman SR, Barcellos LF, Oturai A, Eraksoi M, Cocco E, et al. Familial effects on the clinical course of multiple sclerosis. Neurology 2007; 68: 376-83. 10. Confavreux C, Hutchinson M, Hours MM, CortinovisTourniaire P, Moreau T. Rate of pregnancy-related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998; 339: 285-91. 11. Ramagopalan S, Yee I, Byrnes J, Guimond C, Ebers G, Sadovnick D. Term pregnancies and the clinical characteristics www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 of multiple sclerosis: a population based study. J Neurol Neurosurg Psychiatry 2012; 83: 793-5. 12. Siegel SR, Mackenzie J, Chaplin G, Jablonski NG, Griffiths L. Circulating microRNAs involved in multiple sclerosis. Mol Biol Rep 2012; 39: 6219-25. 13. Giovannoni G, Munschauer FE, III, Deisenhammer F. Neutralising antibodies to interferon beta during the treatment of multiple sclerosis. J Neurol Neurosurg Psychiatry 2002; 73: 465-9. 14. Calabresi PA, Giovannoni G, Confavreux C, Galetta SL, Havrdova E, Hutchinson M, et al. The incidence and significance of anti-natalizumab antibodies: results from AFFIRM and SENTINEL. Neurology 2007; 69: 1391-403. 15. Polman CH, O’Connor PW, Havrdova E, Hutchinson M, Kappos L, Miller DH, et al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354: 899-910. 16. Wingerchuk DM, Lennon VA, Lucchinetti CF, Pittock SJ, Weinshenker BG. The spectrum of neuromyelitis optica. Lancet Neurol 2007; 6: 805-15. 17. Lunemann JD, Munz C. Epstein-Barr virus and multiple sclerosis. Curr Neurol Neurosci Rep 2007; 7: 253-8. 18. Santon A, Cristóbal E, Aparicio M, Royuela A, Villar LM, Álvarez-Cermeño JC. High frequency of co-infection by Epstein-Barr virus types 1 and 2 in patients with multiple sclerosis. Mult Scler 2011; 17: 1295-300. 19. Dobson R, Miller RF, Palmer HE, Feldmann M, Thompson EJ, Thompson AJ, et al. Increased urinary free immunoglobulin light chain excretion in patients with multiple sclerosis. J Neuroimmunol 2010; 220: 99-103. 20. Calais G, Forzy G, Crinquette C, Mackowiak A, De Seze J, Blanc F, et al. Tear analysis in clinically isolated syndrome as new multiple sclerosis criterion. Mult Scler 2010; 16: 87-92. 21. Villar LM, Masjuán J, González-Porque P, Plaza J, Sadaba MC, Roldán E, et al. Intrathecal IgM synthesis is a prognostic factor in multiple sclerosis. Ann Neurol 2003; 53: 222-6. 22. Perini P, Ranzato F, Calabrese M, Battistin L, Gallo P. Intrathecal IgM production at clinical onset correlates with a more severe disease course in multiple sclerosis. J Neurol Neurosurg Psychiatry 2006; 77: 953-5. 23. Jongen PJ, Nijeholt G, Lamers KJ, Doesburg WH, Barkhof F, Lemmens WA, et al. Cerebrospinal fluid IgM index correlates with cranial MRI lesion load in patients with multiple sclerosis. Eur Neurol 2007; 58: 90-5. 24. Villar LM, Espino M, Cavanillas ML, Roldán E, Urcelay E, De la Concha EG, et al. Immunological mechanisms that associate with oligoclonal IgM band synthesis in multiple sclerosis. Clin Immunol 2010; 137: 51-9. 25. Villar LM, Sadaba MC, Roldán E, Masjuán J, González-Porque P, Villarrubia N, et al. Intrathecal synthesis of oligoclonal IgM against myelin lipids predicts an aggressive disease course in MS. J Clin Invest 2005; 115: 187-94. 26. Thangarajh M, Gómez-Rial J, Hedstrom AK, Hillert J, Álvarez-Cermeño JC, Masterman T, et al. Lipid-specific immunoglobulin M in CSF predicts adverse long-term outcome in multiple sclerosis. Mult Scler 2008; 14: 1208-13. 27. Boscá I, Magraner MJ, Coret F, Álvarez-Cermeño JC, Simó-Castelló M, Villar LM, et al. The risk of relapse after a clinically isolated syndrome is related to the pattern of oligoclonal bands. J Neuroimmunol 2010; 226: 143-6. 28. Magraner MJ, Boscá I, Simó-Castelló M, García-Martí G, Alberich-Bayarri A, Coret F, et al. Brain atrophy and lesion load are related to CSF lipid-specific IgM oligoclonal bands in clinically isolated syndromes. Neuroradiology 2012; 54: 5-12. 29. Sadaba MC, Tzartos J, Paino C, García-Villanueva M, ÁlvarezCermeño JC, Villar LM, et al. Axonal and oligodendrocytelocalized IgM and IgG deposits in MS lesions. J Neuroimmunol 2012; 247: 86-94. 30. Boscá I, Villar LM, Coret F, Magraner MJ, Simó-Castelló M, Álvarez-Cermeño JC, et al. Response to interferon in multiple sclerosis is related to lipid-specific oligoclonal IgM bands. Mult Scler 2010; 16: 810-5. 31. Villar LM, García-Sánchez MI, Costa-Frossard L, Espino M, 387 O. Fernández, et al Roldán E, Páramo D, et al. Immunological markers of optimal response to natalizumab in multiple sclerosis. Arch Neurol 2012; 69: 191-7. 32. Kostulas VK, Link H, Lefvert AK. Oligoclonal IgG bands in cerebrospinal fluid. Principles for demonstration and interpretation based on findings in 1114 neurological patients. Arch Neurol 1987; 44: 1041-4. 33. McLean BN, Luxton RW, Thompson EJ. A study of immunoglobulin G in the cerebrospinal fluid of 1007 patients with suspected neurological disease using isoelectric focusing and the Log IgG-Index. A comparison and diagnostic applications. Brain 1990; 113: 1269-89. 34. Masjuán J, Álvarez-Cermeño JC, García-Barragán N, Díaz-Sánchez M, Espino M, Sadaba MC, et al. Clinically isolated syndromes: a new oligoclonal band test accurately predicts conversion to MS. Neurology 2006; 66: 576-8. 35. Tintoré M, Rovira A, Río J, Tur C, Pelayo R, Nos C, et al. Do oligoclonal bands add information to MRI in first attacks of multiple sclerosis? Neurology 2008; 70: 1079-83. 36. Salzer J, Svenningsson A, Sundstrom P. Neurofilament light as a prognostic marker in multiple sclerosis. Mult Scler 2010; 16: 287-92. 37. Madeddu R, Farace C, Tolu P, Solinas G, Asara Y, Sotgiu MA, et al. Cytoskeletal proteins in the cerebrospinal fluid as biomarker of multiple sclerosis. Neurol Sci 2013; 34: 181-6. 38. Kuhle J, Leppert D, Petzold A, Regeniter A, Schindler C, Mehling M, et al. Neurofilament heavy chain in CSF correlates with relapses and disability in multiple sclerosis. Neurology 2011; 76: 1206-13. 39. Teunissen CE, Khalil M. Neurofilaments as biomarkers in multiple sclerosis. Mult Scler 2012; 18: 552-6. 40. Quintana FJ, Farez MF, Izquierdo G, Lucas M, Cohen IR, Weiner HL. Antigen microarrays identify CNS-produced autoantibodies in RRMS. Neurology 2012; 78: 532-9. 41. Gunnarsson M, Malmestrom C, Axelsson M, Sundstrom P, Dahle C, Vrethem M, et al. Axonal damage in relapsing multiple sclerosis is markedly reduced by natalizumab. Ann Neurol 2011; 69: 83-9. 42. Comabella M, Fernández M, Martín R, Rivera-Vallve S, Borrás E, Chiva C, et al. Cerebrospinal fluid chitinase 3-like 1 levels are associated with conversion to multiple sclerosis. Brain 2010; 133: 1082-93. 43. Baranzini SE, Mousavi P, Río J, Caillier SJ, Stillman A, Villoslada P, et al. Transcription-based prediction of response to IFNbeta using supervised computational methods. PLoS Biol 2005; 3: e2. 44. Comabella M, Lunemann JD, Río J, Sánchez A, López C, Julia E, et al. A type I interferon signature in monocytes is associated with poor response to interferon-beta in multiple sclerosis. Brain 2009; 132: 3353-65. 45. Cenit MD, Blanco-Kelly F, De las Heras V, Bartolomé M, De la Concha EG, Urcelay E, et al. Glypican 5 is an interferon-beta response gene: a replication study. Mult Scler 2009; 15: 913-7. 46. Cunningham S, Patterson CC, McDonnell G, Hawkins S, Vandenbroeck K. Haplotype analysis of the preprotachykinin-1 (TAC1) gene in multiple sclerosis. Genes Immun 2005; 6: 265-70. 47. Martínez A, De las Heras V, Mas FA, Bartolomé M, De la Concha EG, Urcelay E, et al. An IFNG polymorphism is associated with interferon-beta response in Spanish MS patients. J Neuroimmunol 2006; 173: 196-9. 48. Wergeland S, Beiske A, Nyland H, Hovdal H, Jensen D, Larsen JP, et al. IL-10 promoter haplotype influence on interferon treatment response in multiple sclerosis. Eur J Neurol 2005; 12: 171-5. 49. O’Doherty C, Favorov A, Heggarty S, Graham C, Favorova O, Ochs M, et al. Genetic polymorphisms, their allele combinations and IFN-beta treatment response in Irish multiple sclerosis patients. Pharmacogenomics 2009; 10: 1177-86. 50. Byun E, Caillier SJ, Montalban X, Villoslada P, Fernández O, Brassat D, et al. Genome-wide pharmacogenomic analysis of the response to interferon beta therapy in multiple sclerosis. Arch Neurol 2008; 65: 337-44. 51. Comabella M, Craig DW, Morcillo-Suárez C, Río J, Navarro A, 388 Fernández M, et al. Genome-wide scan of 500,000 singlenucleotide polymorphisms among responders and nonresponders to interferon beta therapy in multiple sclerosis. Arch Neurol 2009; 66: 972-8. 52. Fusco C, Andreone V, Coppola G, Luongo V, Guerini F, Pace E, et al. HLA-DRB1*1501 and response to copolymer-1 therapy in relapsing-remitting multiple sclerosis. Neurology 2001; 57: 1976-9. 53. Grossman I, Avidan N, Singer C, Goldstaub D, Hayardeny L, Eyal E, et al. Pharmacogenetics of glatiramer acetate therapy for multiple sclerosis reveals drug-response markers. Pharmacogenet Genomics 2007; 17: 657-66. 54. Tsareva EY, Kulakova OG, Boyko AN, Shchur SG, Lvovs D, Favorov AV, et al. Allelic combinations of immune-response genes associated with glatiramer acetate treatment response in Russian multiple sclerosis patients. Pharmacogenomics 2012; 13: 43-53. 55. Kerrison JB, Flynn T, Green WR. Retinal pathologic changes in multiple sclerosis. Retina 1994; 14: 445-51. 56. Kaufman D, Celesia GG. Simultaneous recording of pattern electroretinogram and visual evoked responses in neuroophthalmologic disorders. Neurology 1985; 35: 644-51. 57. Saidha S, Syc SB, Ibrahim MA, Eckstein C, Warner CV, Farrell SK, et al. Primary retinal pathology in multiple sclerosis as detected by optical coherence tomography. Brain 2011; 134: 518-33. 58. Syc SB, Saidha S, Newsome SD, Ratchford JN, Levy M, Ford E, et al. Optical coherence tomography segmentation reveals ganglion cell layer pathology after optic neuritis. Brain 2012; 135: 521-33. 59. Parisi V, Manni G, Spadaro M, Colacino G, Restuccia R, Marchi S, et al. Correlation between morphological and functional retinal impairment in multiple sclerosis patients. Invest Ophthalmol Vis Sci 1999; 40: 2520-7. 60. Petzold A, De Boer JF, Schippling S, Vermersch P, Kardon R, Green A, et al. Optical coherence tomography in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol 2010; 9: 921-32. 61. Trip SA, Schlottmann PG, Jones SJ, Altmann DR, GarwayHeath DF, Thompson AJ, et al. Retinal nerve fiber layer axonal loss and visual dysfunction in optic neuritis. Ann Neurol 2005; 58: 383-91. 62. Oreja-Guevara C, Noval S, Manzano B, Díez-Tejedor E. Optic neuritis, multiple sclerosis-related or not: structural and functional study. Neurologia 2010; 25: 78-82. 63. Pulicken M, Gordon-Lipkin E, Balcer LJ, Frohman E, Cutter G, Calabresi PA. Optical coherence tomography and disease subtype in multiple sclerosis. Neurology 2007; 69: 2085-92. 64. Green AJ, McQuaid S, Hauser SL, Allen IV, Lyness R. Ocular pathology in multiple sclerosis: retinal atrophy and inflammation irrespective of disease duration. Brain 2010; 133: 1591-601. 65. Noval S, Contreras I, Muñoz S, Oreja-Guevara C, Manzano B, Rebolleda G. Optical coherence tomography in multiple sclerosis and neuromyelitis optica: an update. Mult Scler Int 2011; 2011: 472790. 66. Ratchford JN, Quigg ME, Conger A, Frohman T, Frohman E, Balcer LJ, et al. Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies. Neurology 2009; 73: 302-8. 67. Chan CK, Cheng AC, Leung CK, Cheung CY, Yung AY, Gong B, et al. Quantitative assessment of optic nerve head morphology and retinal nerve fibre layer in non-arteritic anterior ischaemic optic neuropathy with optical coherence tomography and confocal scanning laser ophthalmoloscopy. Br J Ophthalmol 2009; 93: 731-5. 68. Brandt AU, Zimmermann H, Kaufhold F, Promesberger J, Schippling S, Finis D, et al. Patterns of retinal damage facilitate differential diagnosis between Susac syndrome and MS. PLoS One 2012; 7: e38741. 69. Costello F, Hodge W, Pan YI, Metz L, Kardon RH. Retinal nerve fiber layer and future risk of multiple sclerosis. Can J Neurol Sci 2008; 35: 482-7. www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 Biomarcadores en esclerosis múltiple 70. Oreja-Guevara C, Noval S, Álvarez-Linera J, Gabaldón L, Manzano B, Chamorro B, et al. Clinically isolated syndromes suggestive of multiple sclerosis: an optical coherence tomography study. PLoS One 2012; 7: e33907. 71. Toledo J, Sepulcre J, Salinas-Alaman A, García-Layana A, Murie-Fernández M, Bejarano B, et al. Retinal nerve fiber layer atrophy is associated with physical and cognitive disability in multiple sclerosis. Mult Scler 2008; 14: 906-12. 72. Gordon-Lipkin E, Chodkowski B, Reich DS, Smith SA, Pulicken M, Balcer LJ, et al. Retinal nerve fiber layer is associated with brain atrophy in multiple sclerosis. Neurology 2007; 69: 1603-9. 73. Tewarie P, Balk L, Costello F, Green A, Martin R, Schippling S, et al. The OSCAR-IB consensus criteria for retinal OCT quality assessment. PLoS One 2012; 7: e34823. 74. Greenberg BM, Frohman E. Optical coherence tomography as a potential readout in clinical trials. Ther Adv Neurol Disord 2010; 3: 153-60. 75. Kappos L, Moeri D, Radue EW, Schoetzau A, Schweikert K, Barkhof F, et al. Predictive value of gadolinium-enhanced magnetic resonance imaging for relapse rate and changes in disability or impairment in multiple sclerosis: a meta-analysis. Gadolinium MRI Meta-analysis Group. Lancet 1999; 353: 964-9. 76. Filippi M, Rossi P, Campi A, Colombo B, Pereira C, Comi G. Serial contrast-enhanced MR in patients with multiple sclerosis and varying levels of disability. AJNR Am J Neuroradiol 1997; 18: 1549-56. 77. Kermode AG, Thompson AJ, Tofts P, MacManus DG, Kendall BE, Kingsley DP, et al. Breakdown of the blood-brain barrier precedes symptoms and other MRI signs of new lesions in multiple sclerosis. Pathogenetic and clinical implications. Brain 1990; 113: 1477-89. 78. Tubridy N, Coles AJ, Molyneux P, Compston DA, Barkhof F, Thompson AJ, et al. Secondary progressive multiple sclerosis: the relationship between short-term MRI activity and clinical features. Brain 1998; 121: 225-31. 79. Tintoré M, Rovira A, Río J, Nos C, Grive E, Téllez N, et al. Baseline MRI predicts future attacks and disability in clinically isolated syndromes. Neurology 2006; 67: 968-72. 80. Fisniku LK, Brex PA, Altmann DR, Miszkiel KA, Benton CE, Lanyon R, et al. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain 2008; 131: 808-17. 81. Li DK, Held U, Petkau J, Daumer M, Barkhof F, Fazekas F, et al. MRI T2 lesion burden in multiple sclerosis: a plateauing relationship with clinical disability. Neurology 2006; 66: 1384-9. 82. Giorgio A, Battaglini M, Smith SM, De Stefano N. Brain atrophy assessment in multiple sclerosis: importance and limitations. Neuroimaging Clin N Am 2008; 18: 675-86, xi. 83. Chard DT, Griffin CM, Parker GJ, Kapoor R, Thompson AJ, Miller DH. Brain atrophy in clinically early relapsing-remitting multiple sclerosis. Brain 2002; 125: 327-37. 84. Dalton CM, Chard DT, Davies GR, Miszkiel KA, Altmann DR, Fernando K, et al. Early development of multiple clerosis is associated with progressive grey matter atrophy in patients presenting with clinically isolated syndromes. Brain 2004; 127: 1101-7. 85. Riccitelli G, Rocca MA, Pagani E, Rodegher ME, Rossi P, Falini A, et al. Cognitive impairment in multiple sclerosis is associated to different patterns of gray matter atrophy according to clinical phenotype. Hum Brain Mapp 2011; 32: 1535-43. 86. Sanfilipo MP, Benedict RH, Sharma J, Weinstock-Guttman B, Bakshi R. The relationship between whole brain volume and disability in multiple sclerosis: a comparison of normalized gray vs. white matter with misclassification correction. Neuroimage 2005; 26: 1068-77. 87. Tedeschi G, Lavorgna L, Russo P, Prinster A, Dinacci D, Savettieri G, et al. Brain atrophy and lesion load in a large population of patients with multiple sclerosis. Neurology 2005; 65: 280-5. 88. Filippi M, Rocca MA. MR imaging of multiple sclerosis. Radiology 2011; 259: 659-81. 89. Sormani MP, Bonzano L, Roccatagliata L, Cutter GR, Mancardi GL, Bruzzi P. Magnetic resonance imaging as a potential surrogate for relapses in multiple sclerosis: a meta-analytic approach. Ann Neurol 2009; 65: 268-75. 90. Sormani MP, Bonzano L, Roccatagliata L, Mancardi GL, Uccelli A, Bruzzi P. Surrogate endpoints for EDSS worsening in multiple sclerosis. A meta-analytic approach. Neurology 2010; 75: 302-9. 91. Río J, Castillo J, Rovira A, Tintoré M, Sastre-Garriga J, Horga A, et al. Measures in the first year of therapy predict the response to interferon beta in MS. Mult Scler 2009; 15: 848-53. 92. Sormani M, Río J, Tintoré M, Signori A, Li D, Cornelisse P, et al. Scoring treatment response in patients with relapsing multiple sclerosis. Mult Scler 2012; Sep 25. [Epub ahead of print]. 93. Bielekova B, Martin R. Development of biomarkers in multiple sclerosis. Brain 2004; 127: 1463-78. 94. Van Winsen LM, Polman CH, Dijkstra CD, Tilders FJ, Uitdehaag BM. Suppressive effect of glucocorticoids on TNF-alpha production is associated with their clinical effect in multiple sclerosis. Mult Scler 2010; 16: 500-2. 95. Putheti P, Soderstrom M, Link H, Huang YM. Effect of glatiramer acetate (Copaxone) on CD4+CD25high T regulatory cells and their IL-10 production in multiple sclerosis. J Neuroimmunol 2003; 144: 125-31. 96. Blanco Y, Moral EA, Costa M, Gómez-Choco M, TorresPeraza JF, Alonso-Magdalena L, et al. Effect of glatiramer acetate (Copaxone) on the immunophenotypic and cytokine profile and BDNF production in multiple sclerosis: a longitudinal study. Neurosci Lett 2006; 406: 270-5. 97. Saresella M, Marventano I, Longhi R, Lissoni F, Trabattoni D, Mendozzi L, et al. CD4+CD25+FoxP3+PD1-regulatory T cells in acute and stable relapsing-remitting multiple sclerosis and their modulation by therapy. FASEB J 2008; 22: 3500-8. 98. Sellebjerg F, Hedegaard CJ, Krakauer M, Hesse D, Lund H, Nielsen CH, et al. Glatiramer acetate antibodies, gene expression and disease activity in multiple sclerosis. Mult Scler 2012; 18: 305-13. 99. Tumani H, Kassubek J, Hijazi M, Lehmensiek V, Unrath A, Sussmuth S, et al. Patterns of TH1/TH2 cytokines predict clinical response in multiple sclerosis patients treated with glatiramer acetate. Eur Neurol 2011; 65: 164-9. 100. Tennakoon DK, Mehta RS, Ortega SB, Bhoj V, Racke MK, Karandikar NJ. Therapeutic induction of regulatory, cytotoxic CD8+ T cells in multiple sclerosis. J Immunol 2006; 176: 7119-29. 101. Toker A, Slaney CY, Backstrom BT, Harper JL. Glatiramer acetate treatment directly targets CD11b(+)Ly6G(–) monocytes and enhances the suppression of autoreactive T cells in experimental autoimmune encephalomyelitis. Scand J Immunol 2011; 74: 235-43. Biomarkers in multiple sclerosis Summary. Multiple sclerosis is the most frequent disabling neurological disease in young adults. Its development includes independent processes of inflammation, demyelination, neurodegeneration, gliosis and repair, which are responsible for the heterogeneity and individual variability in the expression of the disease, its prognosis and response to treatment. As part of personalised medicine, the progress made in the search for new biomarkers has identified promising candidates www.neurologia.com Rev Neurol 2013; 56 (7): 375-390 389 O. Fernández, et al that may be useful for the early diagnosis of the disease, for detecting prognostic and developmental profiles of the disease, and for monitoring the response to treatment. Unfortunately, few of them have been validated adequately, which prevents them from being applied in clinical practice. In view of the latest findings, the experts recommend orienting research in another direction, not so much towards the discovery of new molecules or imaging techniques, but instead towards a clinical validation of these markers, with the aim of fostering translational research. This review offers an update on the information about the biomarkers in multiple sclerosis that have currently been validated and are thus potential candidates, as well as looking at their value in the diagnosis, prognosis, evaluation of the development of the disability caused by the disease and the response to therapy. Key words. Biomarkers. Early diagnosis. Multiple sclerosis. 390 www.neurologia.com Rev Neurol 2013; 56 (7): 375-390