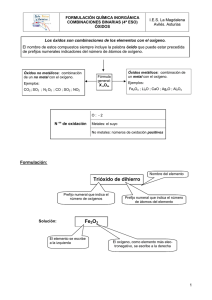
Óxido de hierro(III) Trióxido de dihierro
Anuncio
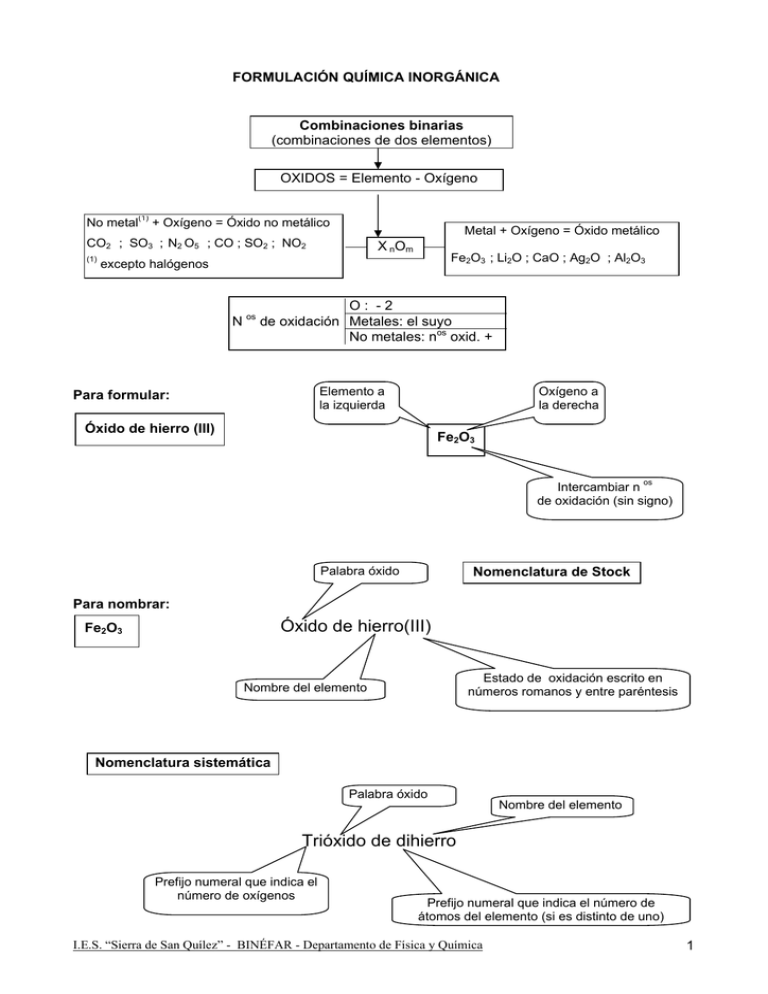
FORMULACIÓN QUÍMICA INORGÁNICA Combinaciones binarias (combinaciones de dos elementos) OXIDOS = Elemento - Oxígeno No metal(1) + Oxígeno = Óxido no metálico Metal + Oxígeno = Óxido metálico CO2 ; SO3 ; N2 O5 ; CO ; SO2 ; NO2 (1) X nOm Fe2O3 ; Li2O ; CaO ; Ag2O ; Al2O3 excepto halógenos N os O: -2 de oxidación Metales: el suyo No metales: nos oxid. + Elemento a la izquierda Para formular: Oxígeno a la derecha Óxido de hierro (III) Fe2O3 Intercambiar n os de oxidación (sin signo) Nomenclatura de Stock Palabra óxido Para nombrar: Óxido de hierro(III) Fe2O3 Estado de oxidación escrito en números romanos y entre paréntesis Nombre del elemento Nomenclatura sistemática Palabra óxido Nombre del elemento Trióxido de dihierro Prefijo numeral que indica el número de oxígenos Prefijo numeral que indica el número de átomos del elemento (si es distinto de uno) I.E.S. “Sierra de San Quílez” - BINÉFAR - Departamento de Física y Química 1 I FORMULACIÓN QUÍMICA INORGÁNICA Combinaciones binarias (combinaciones de dos elementos) PERÓXIDOS = Metal (generalmente alcalino o alcalino-térreo) - Grupo O22- (grupo peróxido) BaO2 ; CaO2 ; Li2O2 ;Ag2 O2 ;Na2O2; Hg2O2 XnO 2 La fórmula es simplificable, siempre que se respete la agrupación (O2) O: -1 N os de oxidación Metales: el suyo Grupo peróxido O22- a la derecha Elemento a la izquierda Para formular: Na2O2 Peróxido de sodio Intercambiar n os de oxidación (sin signo). No es simplificable, ya que si dividimos los subíndices por dos, desaparecería la agrupacíón (O2) Elemento a la izquierda Peróxido de bario Truco para formular peróxidos: 1. Formula el óxido: Na20 2. Añade un oxígeno más: Na2O2 Grupo peróxido O22- a la derecha Ba2(O2)2 = Ba2O4 = BaO2 Ten en cuenta que no se puede simplificar “si desaparece” el grupo (O2) Intercambiar n os de oxidación (sin signo). Es simplificable, ya que si dividimos los subíndices por dos sigue presente la agrupación (O2) Para nombrar K2O2 Palabra peróxido Nombre del elemento Peróxido de potasio H2O2 = Peróxido de hidrógeno a agua oxigenada I.E.S. “Sierra de San Quílez” - BINÉFAR - Departamento de Física y Química 2 FORMULACIÓN QUÍMICA INORGÁNICA Combinaciones binarias (combinaciones de dos elementos) HIDRUROS = Metal - Hidrógeno AlH3 ; LiH; CuH 2 X Hm N os de oxidación Para formular: Metal a la izquierda KH ; FeH3 ; ZnH2 H: -1 Metales: el suyo Hidrógeno a la derecha Hidruro de hierro(III) FeH3 Intercambiar n os de oxidación (sin signo) Estado de oxidación escrito en números romanos y entre paréntesis Palabra hidruro Palabra hidruro Para nombrar: Hidruro de cromo(II) CrH2 Dihidruro de cromo Nombre del metal Prefijo numeral que indica el número de hidrógenos Los hidruros no metálicos no se nombran como tales, todos ellos tienen nombres especiales, no sistemáticos: Las combinaciones binarias del hidrógeno con los no metales del grupo de los anfígenos y halógenos no se consideran hidruros. En ellos se invierte el orden entre el H y el elemento y se nombran de la siguiente forma (el segundo nombre: ácido... , se usa para disoluciones acuosas del gas) CH 4 : Metano HF : Fluoruro de hidrógeno o ácido fluorhídrico SiH4 : Silano HCl : Cloruro de hidrógeno o ácido clorhídrico NH3 : Amoniaco HBr : Bromuro de hidrógeno o ácido bromhídrico PH3 : Fosfano(1) HI : Ioduro de hidrógeno o ácido iodhídrico AsH3 : Arsano (2) SbH3 : Estibano (3) (1) Antes fosfina Antes arsina (3) Antes estibina (2) Nombre del metal H2S : Sulfuro de hidrógeno o ácido sulfhídrico os N oxidación: H : +1; halógenos, anfígenos: estado oxidación negativo Todos son gases y cuando se disuelven en agua se comportan como ácidos (de ahí el nombre: ácidos hidrácidos) I.E.S. “Sierra de San Quílez” - BINÉFAR - Departamento de Física y Química 3 FORMULACIÓN QUÍMICA INORGÁNICA Combinaciones binarias (combinaciones de dos elementos) No metal - No metal SF6 ; PCl3 ; CCl4 Yn X m N os de oxidación SiCl4 ; PCl5 ; CS2 El más electronegativo: - El otro: + Para formular: Elemento más electronegativo a la derecha Elemento menos electronegativo a la izquierda P Cl3 Intercambiar n os de oxidación (sin signo) Nombre del elemento más electronegativo (situado a la derecha) terminado en URO Para nombrar: CCl 4 Tetracloruro de carbono Prefijo numeral que indica el número de átomos del elemento Nombre del elemento menos electronegativo (situado a la izquierda) I.E.S. “Sierra de San Quílez” - BINÉFAR - Departamento de Física y Química 4 FORMULACIÓN QUÍMICA INORGÁNICA Combinaciones binarias (combinaciones de dos elementos) Metal - No metal (halógenos y anfígenos) Sales haloideas KBr ; Fe 2S 3 ; AgCl NaCl ; CaI2 ; PbS2 MnX m N os de oxidación No metal: - Metal: el suyo Para formular: Cloruro de hierro (III) No metal a la derecha Metal a la izquierda FeCl3 Intercambiar n os de oxidación (sin signo) Para nombrar: PbS2 No metal terminado en URO Estado de oxidación escrito en números romanos y entre paréntesis Sulfuro de plomo(IV) No metal terminado en URO Nombre del metal Disulfuro de plomo Prefijo numeral que indica el número de átomos del no metal I.E.S. “Sierra de San Quílez” - BINÉFAR - Departamento de Física y Química Nombre del metal 5