Manuales de los equipos - Facultad de Ciencias-UCV
Anuncio

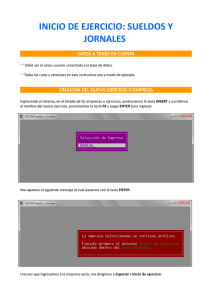
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE CIENCIAS ESCUELA DE QUÍMICA MANUAL DE CONSULTA RAPIDA DE LOS INSTRUMENTENTOS DEL LABORATORIO Caracas Septiembre 2003 Tabla de Contenidos CROMATÓGRAFO DE GASES “PERKIN ELMER AUTO SYSTEM”. (FIGURA 1) .................................. 4 Figura 1.- Cromatógrafo de gases “Perkin Elmer Auto System” .............................................................. 4 Instrucciones para el manejo del Cromatógrafo. ............................................................................................ 5 Figura 2.- Panel de Control del CG Perkin Elmer Auto System ................................................................ 6 CROMATÓGRAFO DE GASES CHROMPACK-9001. .................................................................................. 6 Figura 3.- Cromatógrafo de gases Chrompack-9001................................................................................. 6 Instrucciones para el manejo del Cromatógrafo. ............................................................................................ 6 INTEGRADOR .................................................................................................................................................. 7 Instrucciones para el manejo del Integrador................................................................................................... 7 Figura 4.- Integrador HP ........................................................................................................................... 8 ESPECTROFOTÓMETRO DE DOBLE HAZ PERKIN ELMER LAMBDA 3B. ........................................... 8 Instrucciones para el manejo del Integrador................................................................................................... 8 Figura 5.- Panel de Control del UV-Visible Perkin Elmer Lambda 3B ..................................................... 8 Figura 6.- Sección donde se coloca las celdas de muestra y referencia .................................................... 9 ESPECTROFOTÓMETRO DE ABSORCIÓN Y EMISIÓN ATÓMICA PERKIN ELMER MODELO 3100. .......................................................................................................................................................................... 10 Figura 7. Espectrofotómetro de Absorción y Emisión Atómica Perkin Elmer modelo 3100 ................... 10 Instrucciones para el manejo ........................................................................................................................ 10 ESPECTROFOTÓMETRO DE ABSORCIÓN Y EMISIÓN ATÓMICA VARIAN TECHTRON MODELO AA6. ................................................................................................................................................................. 12 Instrucciones para el manejo ........................................................................................................................ 12 Figura 8. Espectrofotómetro de Absorción y Emisión Atómica Varian Techtron Modelo AA6 ............... 14 ESPECTROFOTÓMETRO DE INFRARROJO PERKIN ELMER MODELO 1310 . ................................... 14 Instrucciones para el manejo ........................................................................................................................ 14 Figura 9. Espectrofotómetro de Infrarrojo Perkin Elmer Modelo 1310 .................................................. 15 Figura 10.- Celdas desmontables de IR ................................................................................................... 21 INTRODUCCION Este manual fue realizado con la idea de familiarizar y suministrar información básica sobre los equipos disponibles hasta el momento en el laboratorio de instrumental analítico: 1. Cromatografía de Gases. y y Cromatógrafo de gases “Perkin Elmer Auto System”. Cromatógrafo de gases Chrompack-9001. 2. Espectroscopía de Absorción Molécular en el UV-Visible. y Espectrofotómetro de UV-Visible de doble haz Perkin Elmer Lambda 3B. 3. Espectroscopía Atómica basada en la Atomización con Llama. y y Espectrofotómetro de Absorción y Emisión Atómica Varian Techtron Modelo AA6. Espectrofotómetro de Absorción y Emisión Atómica Perkin Elmer modelo 3100. 4. Espectroscopía de Infrarrojo. y Espectrofotómetro de Infrarrojo Perkin Elmer Modelo 1310 . MANUAL DE CONSULTA RAPIDA CROMATÓGRAFO DE GASES “PERKIN ELMER AUTO SYSTEM”. (FIGURA 1) - Detector de Ionización a la Llama ( FID ). - Gas portador: N2 - Columna empacada. Especificaciones de la columna empacada: (variable) Fase estacionaria: Película líquida: 5% Carbowax 20M. Soporte sólido: Chromosorb G, AW DMCS 80/100 ALLTECH # 8011/2 La materia prima para la mayoría de los soportes de cromatografía de gases es la diatomita, también denominada tierra de diatomáceas. Chromosorb G: para separar compuestos polares. Por su baja área superficial y sus características de dureza y resistencia a la manipulación es un posible y adecuado sustituto del Chromosorb W. Debido a su menor superficie y densidad elevada, El Chromosorb G se utiliza con una impregnación más baja de la fase líquida. Una carga de 5% de fase líquida sobre el Chromosorb G corresponde al 12% en el Chromosorb W. Figura 1.- Cromatógrafo de gases “Perkin Elmer Auto System” Instrucciones para el manejo del Cromatógrafo. 1. Abrir las bombonas de gases de aire, hidrógeno y nitrógeno. 2. Encender el aparato en el interruptor N. 3. Colocar la temperatura del detector, 200 ºC, para ello presionar la tecla (DET TEMP), asignar la temperatura y (ENTER). 4. Asignar la temperatura de trabajo del puerto de inyección, también 200 ºC, para ello presionar la tecla (INJ TEMP), asignar la temperatura y (ENTER). 5. Asignar la temperatura de la columna a 60°C ( temperatura inicial) para ello presionar la tecla (OVEN TEMP), asignar la temperatura y (ENTER). 6. Después de asignar las temperaturas, encender el detector. Para ello las válvulas de H2 y aire deben estar cerradas, luego abrir la válvula de H2 en el sentido contrario a las agujas del reloj. Encender el detector para ello se observa el voltaje del detector presionando la tecla (AUTOZERO), (1) y (ENTER). Colocar el encendedor sobre la salida del detector y presiónalo ligeramente hasta observar un reflejo de luz roja sobre la superficie metálica de la salida del detector. Seguidamente rota en el sentido contrario a las agujas del reloj la válvula de aire poco a poco hasta que escuches una pequeña explosión la cual indica que el detector esta encendido. Para verificar que el detector esta encendido debes observar si existe voltaje en el detector y colocando una pipeta en la salida del mismo (si el vidrio esta empañado de vapor de agua, el detector está encendido). Si no, vuelve a intentar el procedimiento para encenderlo. 7. Si se requiere programación de temperatura para obtener una mejor resolución de las bandas cromatográficas: Asignar la temperatura 1 con la tecla (OVEN TEMP) y luego (ENTER). Asignar el tiempo 1 con la tecla (TIME) y luego (ENTER). Asignar la rampa de calentamiento con la tecla (RATE) a un valor de 42º/min y (ENTER). Asignar la temperatura 2 con la tecla (OVEN TEMP) y luego (ENTER). Asignar el tiempo 2 con la tecla (TIME) y luego (ENTER). 8. Para que la programación de temperatura se ejecute después de la inyección debes presionar la tecla (RUN). 9. Al terminar la jornada de trabajo: Apagar el detector para ello presionar las teclas (AUTOZERO), (0) Y (ENTER). Apagar la temperatura del detector para ello presionar las teclas (DET TEMP), (0) Y (ENTER). Apagar la temperatura del puerto de inyección para ello presionar las teclas (INJ TEMP), (0) Y (ENTER). Apagar la temperatura de la columna para ello presionar las teclas (OVEN TEMP), (0) Y (ENTER). Esperar 15 min hasta que la temperatura de la columna halla disminuido hasta 25ºC. Cerrar las bombonas de aire, H2, y N2, y aire. Cerrar las perillas P y S de los flujos de gases H2 y aire que entran al detector. Apaga el instrumental en el suiche N. Figura 2.- Panel de Control del CG Perkin Elmer Auto System CROMATÓGRAFO DE GASES CHROMPACK-9001. Posee dos tipos de detectores: Un detector de Ionización a la Llama (FID ) y Un detector de Conductividad Térmica (TCD). Gas portador: N2 Columna capilar. Figura 3.- Cromatógrafo de gases Chrompack-9001 Instrucciones para el manejo del Cromatógrafo. 1. Abrir las bombonas de gases de aire, hidrógeno y nitrógeno. 2. Prender ambos switches. 3. Colocar en página 1 las condiciones de operación tales como temperatura del detector (250°C), temperatura del puerto de inyección ( 250°C) y temperatura de la columna (80°C). 4. Cuando se llega a las condiciones establecidas ( se observa en STATUS) y el indicador se coloca en verde, se enciende el detector FID. Para ello se emplean los tres controles de la izquierda : aire, make up e hidrógeno de la siguiente manera: 5. Se abre completamente la llave de aire. Se abre completa la llave de hidrógeno. 6. Se verifica que el make up este cerrado. Se hace la ignición con el switche de encendido. Se verifica que el detector este prendido observando el voltaje del mismo, esto puede verse en la en la pagina de STATUS dándole a la flecha ↑ dos veces. El voltaje debe subir notablemente sobre 0,9 (El detector no necesariamente suena al prenderse) 7. Una vez verificado se abre el make up completamente. Se observa que el voltaje sube a 15 al menos. Dejar estabilizar el voltaje antes de comenzar a trabajar. 8. Para apagar: se cierran los gases en el equipo, se apagan los switches del equipo y luego se cierra el gas de las bombonas. Notas de Interés: y y El volumen de inyección apropiado es de 0,5 uL . El rango permite evitar la saturación del pico. Se cambia en la pag 2, en la parte del electrómetro y los números pueden ser del 1-20, 2 o 3 es adecuado. INTEGRADOR Instrucciones para el manejo del Integrador 1. 2. 3. 4. 5. 6. Pulsando list list el integrador informa las condiciones de su operación. La atenuación del pico se fija en el integrador. Colocando attn x enter. X típica entre 5-8. A menor atenuación mayor es el tamaño del pico y viceversa. El cero del papel se coloca: cero 0 enter. El ch sp permite modificar la velocidad del papel: 1 indica una velocidad de 1 cm por min. Cuando se desea medir el ancho del pico este parámetro debe modificarse para que la medición no tenga tanto error. Se modifica colocando en el integrador ch sp x enter. X debe probarse ( 2 o 3). Si el sistema presenta mucho ruido puede disminuirse con el thrh. 7. 8. Para registrar el cromatograma después de hacer la inyección pulsar el botón star del integrador. Al terminar el cromatograma, si no necesita la información del área de pico, pulse stop, scape. De lo contrario pulse solo stop. Figura 4.- Integrador HP ESPECTROFOTÓMETRO DE DOBLE HAZ PERKIN ELMER LAMBDA 3B. Instrucciones para el manejo del Integrador 1. 2. 3. 4. En la parte de atrás encender el equipo. Encender la lámpara en los botones (UV on) y (Vis on). Permitir 30 min de calentamiento. Hacer la Corrección de Fondo con un blanco de agua y la referencia de agua con la finalidad de calibrar el equipo. 5. Presione la tecla SAFE MEN, hasta que el display indique C. 6. Presione la tecla RUN. Figura 5.- Panel de Control del UV-Visible Perkin Elmer Lambda 3B Barrido de Longitudes de Onda. 7. Encender la computadora y el monitor. 8. Teclear la clave PECSS + Enter. 9. Teclear (F10). 10. Teclear SCAN. 11. Se hace un barrido con agua, da una línea continua en cero absorbancia. 12. Colocar el rango de longitudes de onda 850 a 350nm, teclear enter. 13. Colocar el rango de las absorbancias –0,1 a 0,1, teclear (enter) 14. Luego hacer el barrido de longitudes de onda del patrón, para realizar un nuevo barrido 15. Teclear (ESCAPE) (F10). 16. Colocar el rango de longitudes de onda, dependiendo del color reflejado, teclear (enter) 17. Colocar el rango de las absorbancias, teclear (enter) Figura 6.- Sección donde se coloca las celdas de muestra y referencia Visualización de la Longitud de Onda Máxima 18. Una vez realizado el barrido, presione las teclas (ESC) (HOME) 19. SI EL ESPECTRO NO QUEDO BIEN PRESIONAR LAS TECLAS 20. (F9), (X) Y (ENTER) Impresión del Espectro. 21. Presionar la tecla ON LINE en la impresora. 22. En la computadora presionar la tecla PRINT SCREN. Salir del Programa . 23. Presionar las teclas (STOP) + (ENTER). 24. Escribir cd.. Medidas de la Longitud de Ondas Fijas. Modo absorbancia. 1. 2. 3. 4. Seleccione ABS oprimiendo la tecla del modo. Seleccione la longitud de onda deseada y oprima la tecla de GOTO λ. Inserte la muestra del blanco y la referencia apropiada y presione la tecla AUTOZERO. Luego medir la absorbancia del patrón. ESPECTROFOTÓMETRO DE ABSORCIÓN Y EMISIÓN ATÓMICA PERKIN ELMER MODELO 3100. Figura 7. Espectrofotómetro de Absorción y Emisión Atómica Perkin Elmer modelo 3100 Instrucciones para el manejo Modo de absorción. 1. Encender el equipo en el interruptor ON. 2. Colocar la lámpara de cátodo hueco y fijar la longitud de onda de trabajo y el paso del haz en 0,2 o 0,7 3. Abrir la bombona de acetileno y encender el compresor de aire. 4. Teclear (Param Entry). Colocar el valor de la corriente en 10 mA. (enter) y fijar el tiempo de integración en 0,2 (enter). 5. Hallar el valor de la máxima señal que puede detectar el fotomultiplicador con la radiación que emite la lámpara para ello se hace lo siguiente: Teclear (AA) (Energy). Variar la perilla de la longitud de onda. Variar las perillas de la lampara. Cuando se satura la señal dar a (ganancia). Verificar que la trayectoria del haz radiación pase por el centro de un papel de filtro. 6. Luego de optimizada la radiación encender la llama. Para ello girar la perilla hasta aire Mantener el botón rojo presionado hasta que encienda la llama. Asignar los flujos de aire y acetileno si la llama es reductora u oxidante. Por ejemplo si la llama es oxidante la relación oxidante/combustible es 7/2. 7. Se halla la posición de la llama óptima para la atomización para ello se utiliza el patrón de menor concentración. Teclear el botón (AA) (Continuos) de esta manera se mide la absorbancia en modo continuo. Aspirar gua destilada y teclear (A/Z), autozero. Con la manguera de succión sumergida en la solución del patrón mover las diferentes posiciones de la llama (hacia arriba, lateral, etc) y ver el valor de la absorbancia, la posición óptima de las perillas debe dar el mayor valor de la absorbancia para el patrón de menor concentración. Luego variar lentamente los flujos de oxidante y combustible hasta obtener el valor máximo de la absorbancia. Finalmente, hallar la posición óptima apagar la llama girar el botón en posición off y verificar el paso del haz de radiación. 8. Luego de optimizada todas las condiciones medir las absorbancias de todos los patrones y la dilución de la muestra. Para ello utilizar el modo de integración de modo que: 9. Teclear (Param Entry), Colocar int time (1) enterData Presionar la tecla Ready para obtener el valor de absorbancia. 10. Apagar el equipo. Para apagar la lampara, teclear: (Param Entry) (0) (enter) Cerrar el gas y apagar el compresor. Sacar y guardar la lámpara. Esquema resumen. HALLAR LA MAXIMA SEÑAL QUE EL FOTOMULTIPLICADOR DETECTA POR LA RADIACION EMITIDA POR LA LAMPARA PRENDER LA LAMPARA MEDIR LAS ABSORBANCIAS HALLAR LA POSICIÓN OPTIMA DE LA LLAMA HASTA OBTENER LA ATOMIZACIÓN MÁS EFECTIVA UTILIZAR PREFERIBLEMENTE EL PATRON DE MENOR CONCENTRACIÓN. Modo de emisión. 1. 2. 3. 4. ENCENDER LA LLAMA Colocar la longitud de onda de trabajo. Teclear el botón (Em). Encender la llama. Colocar el vaso con agua y teclear (A/Z), autozero. 5. 6. 7. 8. 9. 10. Con el patrón de mayor concentración hallar el máximo valor de emisión el cual debe ser cercano a 1. Teclear (Em) (Energy).Si no se observa señal teclear el botón (Gain). Medir el valor de Emisión en modo continuo del patrón de mayor concentración para ello teclear (Em) (Continuos). Variar la perilla de la longitud de onda hasta que el valor de la emisión aumente. Medir el valor de emisión de todos los patrones y la dilución de la muestra. Para ello utilizar el modo de integración como se explico anteriormente. Medidas para la construcción de la curva de calibración. 1. Luego de optimizada las condiciones se mide el valor de la señal (absorbancia o emisión) del patrón de mayor concentración y el patrón de menor concentración. 2. Se mide la señal (absorbancia o emisión) de la muestra. 3. Se busca la dilución óptima de la muestra hasta que la señal este aproximadamente cercana al valor promedio de los patrones de mayor y menor concentración. 4. Luego de obtenida la dilución óptima de la muestra medir simultáneamente bajo las mismas condiciones la señal ( absorbancia o emisión) de todos los patrones y la dilución óptima de la muestra por triplicado en modo integración para ello presionar la tecla (READ) tres veces. Nota: Es conveniente cuando se mide la señal de otra solución de diferente concentración medir antes el blanco del agua el cual debe dar cero señal, si este valor esta desajustado ajustar con la tecla (ZERO). ESPECTROFOTÓMETRO DE ABSORCIÓN Y EMISIÓN ATÓMICA VARIAN TECHTRON MODELO AA6. Instrucciones para el manejo Modo de absorción 1. 2. 3. 4. 5. 6. Encender el equipo para ello pulsar los 3 teclas rojas denotadas como POWER. Colocar la lámpara de cátodo hueco en cualquiera de los 4 módulos disponibles para la lámpara. Asignar el valor de la corriente para ello girar la perilla hasta el valor indicado. Colocar la longitud de onda de trabajo. Colocar el paso de la banda espectral. Abrir la bombona de acetileno y encender el compresor de aire. Hallar el valor de la máxima señal que puede detectar el fotomultiplicador con la radiación que emite la lámpara para ello se hace lo siguiente: Teclear (TRANS) y la tecla DAMP en el modo (A). Verificar que el voltaje del fotomultiplicador este entre 450-500 Volts para ello presionar la tecla (GAIN). Variar la perilla de la longitud de onda hasta alcanzar el máximo valor de señal. Variar las perillas de la lámpara hasta alcanzar el máximo valor de señal. Cuando se satura la señal es decir cuando esta por encima de un valor de 100%T presionar la tecla (ZERO). Verificar que la trayectoria del haz radiación pase por el centro de un papel de filtro. 7. Luego de optimizada la radiación encender la llama. Para encender la llama teclear el botón aire/acetileno y simultáneamente presionar los botones (TEST FLOW) y (IGNITION). Asignar los flujos de aire y acetileno si la llama es reductora u oxidante. Por ejemplo si la llama es oxidante la relación oxidante/combustible es 7/2. 8. Se halla la posición de la llama óptima para la atomización para ello se utiliza el patrón de menor concentración. Pulsar los botones (ABS) y (A) de esta manera se mide la absorbancia en modo continuo. Colocar el vaso con agua y teclear (A/Z), autozero. Con la manguera de succión sumergida en la solución del patrón mover las diferentes posiciones de la llama (hacia arriba, lateral, etc) y ver el valor de la absorbancia, la posición óptima de las perillas debe dar el mayor valor de la absorbancia para el patrón de menor concentración. Por ejemplo cuando se varía la posición de la llama hacia arriba se observa que la absorbancia aumenta hasta que llega un momento que la absorbancia disminuye en ese instante se tiene la zona de la llama donde la atomización es más efectiva de modo que se gira la perilla hasta obtener de nuevo el máximo valor de absorbancia. Luego variar lentamente los flujos de oxidante y combustible hasta obtener con el patrón el valor máximo de la absorbancia. Luego de hallar la posición óptima apagar la llama para ello presionar el botón en posición off y verificar el paso del haz de radiación. 9. Luego de optimizada todas las condiciones medir las absorbancias de todos los patrones y la dilución de la muestra . Para ello utilizar el modo de integración de modo que: Presionar la tecla (3) del modo integración. Presionar la tecla Ready para obtener el valor de absorbancia.Para apagar la lampara, teclear: Girar la perilla del modulo de corriente en posición off. Apagar el equipo para ello pulsar los botones rojos. Cerrar el gas y apagar el compresor. Sacar y guardar la lámpara. Modo de emisión. 11. 12. 13. 14. 15. 16. 17. 18. Colocar la longitud de onda de trabajo. Teclear el botón (Emiss) y el botón (A) de modo continuo. Encender la llama. Colocar el vaso con agua y ajustar a cero emisión con la perilla (Curve Correct). Con el patrón de mayor concentración hallar el máximo valor de emisión el cual debe ser cercano a 1. Medir el valor de Emisión en modo continuo del patrón de mayor concentración con las teclas (Emiss) (A). Variar la perilla de la longitud de onda hasta que el valor de la emisión aumente. Medir el valor de emisión de todos los patrones y la dilución de la muestra. Para ello utilizar el modo de integración como se explico anteriormente. IMPORTANTE: para ajustar a cero emisión con el agua no se utiliza la tecla (ZERO) sino la Perilla (Curve Correct). De modo que no utilizar la tecla ZERO. Figura 8. Espectrofotómetro de Absorción y Emisión Atómica Varian Techtron Modelo AA6 ESPECTROFOTÓMETRO DE INFRARROJO PERKIN ELMER MODELO 1310 . La fuente es un alambre de Ni/Cr Este instrumento es dispersivo de doble haz. El tipo de detector es piroeléctrico. Instrucciones para el manejo a) Lo primero que se hace es una calibración del espectrómetro con una lámina de poliestireno (compuesto con un espectro conocido), para ello se toma un espectro de dicho compuesto y se hace una corrección de las frecuencias de los espectros de la muestra. b) El manejo con el equipo es el siguiente: c) Presionar el botón Chart para ajustar el papel, luego se le da a los botones: ↑ d) Presionar el botón de tiempo de corrida del espectro, hay dos opciones 3min o 12 min. e) Presionar el botón de expansión del espectro en el papel, hay dos opciones 1 (papel completo) o 0,5 (mitad del papel). ↓ f) Presionar el botón Scan para empezar a correr el espectro, el número de ondas empieza en 4000 cm-1 automáticamente. g) Si se quiere parar la corrida del espectro antes de que termine se hace lo siguiente: Presionar Scan. Presionar el botón Wave Number hasta 4000 cm-1 Presionar los botones: ↑ ↓ h) Se varia la atenuación (con un dispositivo llamado atenuador) y la ganancia ( tecla Gain Check) hasta obtener el mejor espectro, es decir con mayor resolución. Por ejemplo las condiciones óptimas del equipo cuando se toma el espectro del poliestireno son las siguientes: atenuación 1 y ganancia 62. Figura 9. Espectrofotómetro de Infrarrojo Perkin Elmer Modelo 1310 Preparación de muestras para su estudio por infrarrojo. La mayoría de las técnicas de preparación de muestras para estudios por espectroscopia infrarroja, requieren la contención del espécimen en una celda o su depósito sobre una placa plana (frecuentemente denominada placa salina o ventana). En ambos casos, es necesario que los materiales utilizados sean transparentes en el intervalo espectral donde se va a trabajar. Muchos materiales transmiten la radiación infrarroja. El grado de transparencia y su rango espectral (el intervalo de frecuencias para el cual son transparentes) determinan la utilidad de un material para una aplicación dada. Los materiales comerciales más utilizados son KBr, KCl, NaCl y CsI. Estos materiales en particular son usados debido a su amplio rango de transmisión y precio moderado. Todos son higroscópicos y deben almacenarse en desecadores cuando no están en uso. Un material similar, pero insensible al agua, es el AgBr el cual, no obstante, es sensible a la luz y debe resguardarse de ella tanto como sea posible. Existen muchos materiales que pueden emplearse cuando existen problemas de ataque químico por parte de la muestra. El CaF2, BaF2, presentan alta resistencia mecánica, insensibilidad al agua y resistencia a los ácidos y a las bases, si bien su rango de transmisión es algo limitado. El ZnS, ZnSe y el CdTe presentan propiedades similares y rangos espectrales algo más amplios, pero tiene índices de refracción elevados ocasionando pérdidas considerables de radiación por reflexión y ciertos artificios espectrales (franjas de interferencia) lo cual restringe su empleo. Técnicas para muestras sólidas. y Pastillas. La muestra, finamente dividida, se mezcla con un material adecuado denominado matriz (usualmente bromuro de potasio) y se somete a presión dentro de un troquel de metal. El resultado es una pastilla sólida en la cual las partículas de la muestra permanecen en suspensión. Típicamente, se requieren entre 0,5 mg y 2,0 mg de muestra. Esta técnica es adecuada para mediciones cuantitativas ya que se puede controlar en gran medida la preparación de la pastilla (peso de la muestra, peso de la matriz, presión aplicada y tiempo de compresión). En el comercio se encuentran disponibles troqueles de varios tamaños, adecuados para preparar pastillas con diámetro de 13 a 0,5 mm. Usualmente, la compresión de la muestra se realiza mediante una prensa hidráulica, aunque existen algunos dispositivos manuales más económicos. El KBr es el material más frecuente utilizado para la matriz si bien están disponibles otros haluros como KCl, CsI y AgI. L aescogencia del material depende de la región espectral de interés, el índice de refracción de la muestra y la posible interacción de la muestra con la matriz. El KBr y el KCl no pueden utilizarse si la muestra contiene cantidades apreciables de agua ya que estas sales son solubles en agua, por ello se debe de guardar en el desecador y colocar una porción en la estufa a 100°C antes de usar. Para obtener una pastilla con una buena transmisión de radiación se requiere que la muestra y la matriz presentan índices de refracción muy similares. Tanto el KCl como el KBr tienen un índice de refracción adecuado para muestras orgánicas. Si el índice de refracción de la muestra y la matriz difieren sensiblemente aparecen distorsiones en el espectro. Cuando en el laboratorio se obtiene un espectro distorsionado y no se puede encontrar causa aparente, debe sospecharse de los índices de refracción y tratar con otra matriz. Preparación. El primer paso consiste en moler la muestra hasta obtener un polvo muy fino. Idealmente, el tamaño de las partículas de la muestra deben ser menor que la mas corta longitud de onda que vaya a utilizar (aproximadamente 2 micrómetros). Si la muestra no logra molerse lo suficiente, el espectro presentará poca resolución y bandas distorsionadas. Molienda seca de muestras mortero: Se colocan 10 a 15 mg de muestra en un mortero de ágata y se muelen mediante un vigoroso movimiento de rotación. Se continúa la molienda hasta lograr una apariencia muy fina (similar al talco). Si la muestra está sujeta a degradación por efecto del calor es recomendable interrumpir la molienda varias veces para evitar el exceso de calentamiento. Debe recordarse que al molerse un material se incrementa su superficie y se favorece la absorción de agua atmosférica lo cual puede forzar a desecar la muestra después de su molienda. Molienda húmeda mediante mortero: Algunas muestras muy duras o difíciles de manejar pueden molerse mejor si se humedecen con un solvente adecuado. Este solvente debe ser fácil de evaporar e incapaz de reaccionar o de alguna manera alterar a la muestra. Frecuentemente se utiliza etanol absoluto grado analítico o espectroscopio. El procedimiento es similar al ya descrito pero la muestra se le agregan varias gotas de solvente directamente en el mortero previo a su molienda. A veces puede ser necesario repetir las adiciones de solvente durante la molienda hasta lograr el tamaño de partículas deseado. Debe permitirse la evaporación total del solvente antes de preparar la pastilla. El material para la matriz de la pastilla se muele por separado y se deseca en estufa con anterioridad a su uso. La cantidad de matriz para una pastilla depende del tamaño de la misma, usualmente se utiliza ente 150 y 200 mg para un troquel 11-13 mm. El contenido de muestra es de 1% a 2%, variando un poco dependiendo de de su naturaleza. Para garantizar la homogeneidad de la mezcla de la muestra y la matriz se recomienda el siguiente procedimiento: se coloca la cantidad de muestra requerida en un mortero y se agrega la matriz en porciones de unos 10 a 20 mg, usando la mano de mortero para mezclar mediante un movimiento circular. Se siguen agregando porciones de matriz y mezclando hasta completar el peso total deseado. Este método favorece la formación de una mezcla homogénea relativamente poco húmeda. Si la muestra soporta el calentamiento, se puede desecar la mezcla en la estufa por una hora antes de preparar la pastilla. La compresión es el paso final para completar la pastilla. Para ello se usa un troquel ( Fig 3.14) en el cual se deposita la muestra tratando de formar una masa pareja y sin aglomeraciones. Esto se consigue colocando el émbolo de compresión y, con la mano, haciendo presión moderada sobre la muestra a la vez que se imprime un movimiento de rotación. Posteriormente, se aplica la presión necesaria para la formación de pastilla (unas 5-8 ton) durante unos 5-10 min. Si se dispone de una línea de vacío es recomendable evacuar la mezcla dentro del troquel por 20-30 segundos antes de aplicar presión. y Suspensiones. Una alternativa a la preparación de pastillas es la suspensión de la muestra, finamente dividida, en un aceite transparente en el infrarrojo. Esta técnica puede remplazar a las pastillas para muestras cerosas difíciles de moler o cuando existe interacción de la muestra con la matriz del haluro. Los aceites empleados usualmente son el aceite mineral ( Nujol) y el perfluorokeroseno (Fluoroluble). Debido a que estos productos Absorben en el infrarrojo los espectros de las muestras quedan afectados presentando bandas adicionales correspondientes a la matriz. Siempre es necesario indicar cuando una muestra se tomó mediante la técnica de suspensiones ya que las bandas adicionales pueden ser mal interpretadas como pertenecientes a la muestra. Preparación de la suspensión. a) Moler una pequeña cantidad de muestra como se indico anteriormente para la preparación de pastillas. Colocarla en un mortero b) Agregar una gota del agente seleccionado para la suspensión ( Nujol, Fluorolube, etc) y mezclar usando la mano de mortero. Agregar una segunda gota y mezclar de nuevo. Continuar hasta obtener una suspensión con apariencia y consistencia de crema. c) Con una espátula plástica transferir la suspensión a una placa de KBr o de otro material adecuado para la toma del espectro infrarrojo. d) Con una segunda placa del material seleccionado, se presiona la suspensión y mediante rotación de las placas se dispersa hasta formar una película plana. e) Se colocan las placas en un portamuestra y se toma el espectro infrarrojo. y Películas de evaporación. En esta técnica la muestra se disuelve o suspende en un solvente volátil para luego depositarla sobre una placa de KBr o similar. Después de la evaporación del solvente se obtiene una película delgada que puede ser usada para su estudio por infrarrojo. La calidad del espectro obtenido por esta vía es variable. Como ya se indicó para las técnicas precedentes el tamaño de la partícula de la muestra debe ser igual o menor que las longitudes de onda aplicada. Ya que es imposible controlar el tamaño de los cristales que se forman al evaporar el solvente, las muestras cristalinas no suelen dar buenos espectros por esta técnica. Contrariamente, los plásticos, gomas y resinas suelen dar excelentes espectros. Preparación de la película. a) Seleccionar un solvente adecuado ( capaz de disolver la muestra y fácil de evaporar) y disolver una pequeña cantidad de muestra cuidando de no preparar una solución muy diluida. b) Se coloca una gota de solución en una placa de KBr o similar tratando de esparcirla sobre una superficie. Permitir secar y colocar otra gota. Repetir el procedimiento hasta formar una película apreciable. c) Evaporar totalmente los rastros de solvente, bien sea con estufa, pistola de aire o vacío antes de tomar el espectro infrarrojo. d) El proceso de evaporación del solvente juega un papel decisivo sobre la calidad de la película que se forma. En este sentido, es preferible una evaporación lenta ya que suele formar depósitos más homogéneos. La aparición de películas con anillos concéntricos es una característica de una evaporación acelerada. Técnicas para muestras líquidas. Películas capilares. Cuando es suficiente o necesario que el paso de radiación a través de la muestra sea pequeño este es un método adecuado. Típicamente este es el caso de muestras puras (no en solución). Dado que es imposible controlar el grosor de la película que se forma, esta técnica es adecuada solamente para estudios cualitativos. Igualmente, está restringida a líquidos con una volatilidad moderada. Preparación de la película. Se requiere seleccionar dos placas de un material adecuado, tanto por su estabilidad química frente a la muestra como por su intervalo de transmisión espectral. Con un gotero se coloca una o dos gotas sobre una de las placas y la segunda placa se coloca encima imprimiéndose un movimiento de rotación a la vez que se presiona tratando de que la película liquida se extienda y quede libre de burbujas. Posteriormente, se toma el espectro colocando el montaje de las dos placas en un portamuestra adecuado (Debe tenerse precaución al aplicar presión ya que los materiales usados en la confección de las placas para infrarrojo son bastante frágiles). Alternativamente, si el espectro muestra señales muy débiles se debe preparar la muestra de nuevo utilizando mayor cantidad y tratando de no reducir mucho el grosor de la película. En el caso de líquidos viscosos puede utilizarse una sola placa para su preparación. En este caso se usa un tubo capilar o una barra de vidrio para esparcir la muestra y formar la capa. Generalmente, si se deja reposar la película se alisa bastante, lo cual es necesario para obtener un buen espectro. Este procedimiento es adecuado cuando se requiere desecar un poco la película o se debe eliminar solvente ya que al no estar aprisionado entre dos placas se facilita la evaporación de volátiles. y Celdas para líquidos. Cuando se requiere trabajar con líquidos volátiles o soluciones, o es necesario controlar el paso de radiación a través de la muestra se utilizan celdas como portamuestras. En una forma muy simplificada se pueden considerar estas celdas como dos placas paralelas transparentes en el infrarrojo con un espaciador entre ellas. Existen en el mercado dos versiones: las celdas desmontables y las celdas selladas. Celdas desmontables. Como su nombre lo indica este tipo de contenedores, pueden ser totalmente desarmado en sus componentes individuales, lo cual lo hace muy flexibles ya que con un juego de placas de diferentes materiales adecuados para trabajar en el infrarrojo y un juego de espaciadores, es posible trabajar con prácticamente cualquier muestra líquida. Son adecuadas para trabajar tanto cualitativa como cuantitativamente y preferibles a las celdas selladas para líquidos viscosos o materiales corrosivos. En la Figura 10 se muestra un diagrama de una celda comercial desmontable. El llenado de estas celdas se realiza mediante una jeringa. Modo de limpiar las placas de KCl o NaCl. Las placas de KCl o NaCl se limpiaran antes y después de aplicarle la muestra para ello se aplicara el siguiente procedimiento: a) Colocar una servilleta limpia en el mesón y ubicar sobre ella una de las placas de KCl o NaCl. b) Se agrega acetona encima de la placa, se sujeta la placa por los extremos con el dedo pulgar e índice y se frota de una manera suave con movimientos circulares sobre la superficie de la servilleta . Este procedimiento se repite para ambas caras y ambas placas. c) Remover la muestra con una servilleta una vez aplicada Entonces se limpiara siguiendo el procedimiento indicado en la parte superior. Modo de atornillar la celda de Ir para líquidos. a) Se introduce uno de los tornillos parcialmente en la celda, luego los otros dos de la misma forma. b) Posteriormente se ajustan suavemente los tres tornillos sin ejercer presión. c) Nota: cuidar no ejercer presión, ni atornillar demasiado : de lo contrario las placas se romperán. Celdas selladas. Este tipo de celdas es muy parecida en su forma y operación a la celda desmontable con la diferencia de que las ventanas y el separador están sellados formando una sola pieza. Esto presenta la ventaja de permitir manejar muestras muy volátiles que tenderían a escurrir en una celda desmontable. Igualmente la solidez del montaje mantiene constante e invariable el paso de la celda, lo cual la hace adecuada para el trabajo cuantitativo de la más alta precisión y repetibilidad. Sin embargo, son muy difíciles de lavar y muy costosas por lo cual no se recomiendan para muestras corrosivas que puedan atacarlas ni para muestras viscosas que serían muy difíciles de evacuar. En resumen el procedimiento de preparación de muestras sólidas y líquidas en el Laboratorio de Instrumental Analítico es el siguiente: Preparación de muestras líquidas para su estudio por IR. Técnica de la película capilar. Procedimiento: a) Seleccionar las dos placas de KBr y limpiar con acetona como se explico anteriormente. b) Con un gotero se coloca una o dos gotas sobre una de las placas. c) Se coloca la segunda placa sobre la muestra y apretando suavemente se le imprime un ligero movimiento de rotación tratando de aplanar la película y de que no queden burbujas de aire atrapadas en la muestra. d) Se colocan las dos placas en un portamuestra adecuado y se toma el espectro IR . Si el espectro muestra señales muy débiles se debe preparar la muestra de nuevo utilizando mayor cantidad y tratando de no reducir mucho el grosor de la película. Preparación de muestras sólidas para su estudio por IR. Técnica de la Pastilla. Procedimiento: a) Se coloca el KBr previamente pulverizado en la estufa a 100°C por aproximadamente ½ hora para eliminarle el agua absorbida. b) En un mortero de agata se colocan 2-3 mg de muestra molida y se agrega una porción de unos 20 mg de KBr y usando la mano de mortero se mezclan íntimamente hasta lograr una apariencia muy fina (similar al talco). Se repite el procedimiento hasta agregar 200 mg de KBr. c) Se prepara la pastilla en un troquel luego se coloca el troquel en la prensa hidráulica y se aplica la presión necesaria para la formación de la pastilla (unas 5-8 ton) por 2 minutos. d) Se libera presión y se desmonta la pastilla. e) Se monta la pastilla en un soporte adecuado y se toma el espectro IR. Figura 10.- Celdas desmontables de IR