La toxina botulínica tipo A
Anuncio
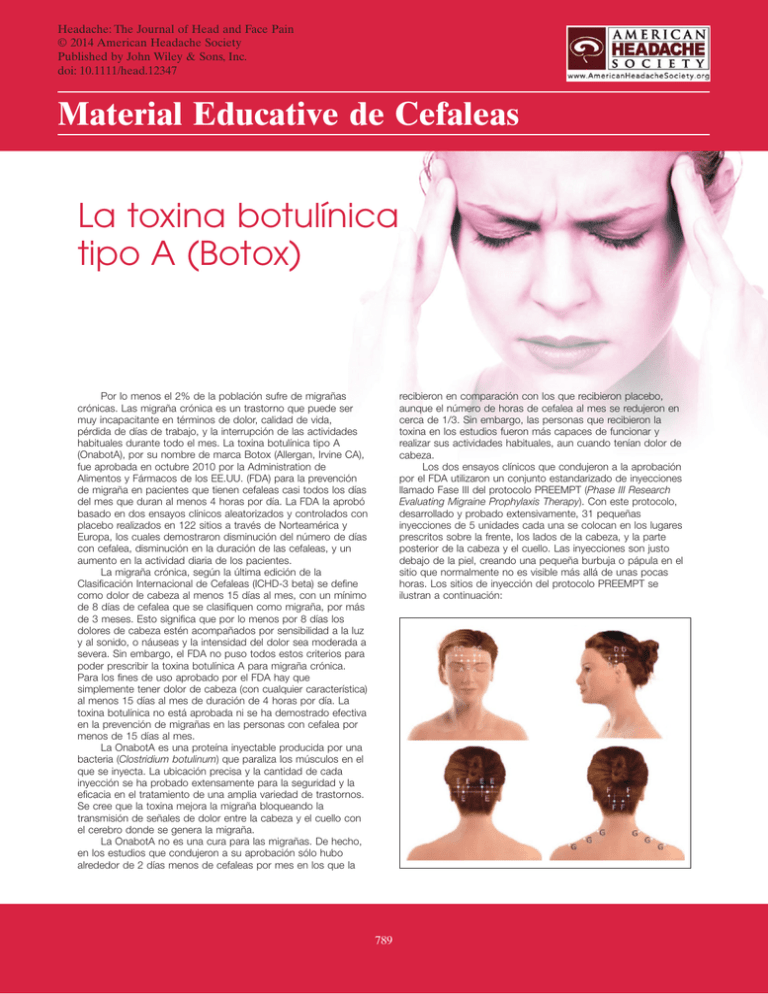
Headache: The Journal of Head and Face Pain © 2014 American Headache Society Published by John Wiley & Sons, Inc. doi: 10.1111/head.12347 Material Educative de Cefaleas La toxina botulínica tipo A (Botox) Por lo menos el 2% de la población sufre de migrañas crónicas. Las migraña crónica es un trastorno que puede ser muy incapacitante en términos de dolor, calidad de vida, pérdida de días de trabajo, y la interrupción de las actividades habituales durante todo el mes. La toxina botulínica tipo A (OnabotA), por su nombre de marca Botox (Allergan, Irvine CA), fue aprobada en octubre 2010 por la Administration de Alimentos y Fármacos de los EE.UU. (FDA) para la prevención de migraña en pacientes que tienen cefaleas casi todos los días del mes que duran al menos 4 horas por día. La FDA la aprobó basado en dos ensayos clínicos aleatorizados y controlados con placebo realizados en 122 sitios a través de Norteamérica y Europa, los cuales demostraron disminución del número de días con cefalea, disminución en la duración de las cefaleas, y un aumento en la actividad diaria de los pacientes. La migraña crónica, según la última edición de la Clasificación Internacional de Cefaleas (ICHD-3 beta) se define como dolor de cabeza al menos 15 días al mes, con un mínimo de 8 días de cefalea que se clasifiquen como migraña, por más de 3 meses. Esto significa que por lo menos por 8 días los dolores de cabeza estén acompañados por sensibilidad a la luz y al sonido, o náuseas y la intensidad del dolor sea moderada a severa. Sin embargo, el FDA no puso todos estos criterios para poder prescribir la toxina botulínica A para migraña crónica. Para los fines de uso aprobado por el FDA hay que simplemente tener dolor de cabeza (con cualquier característica) al menos 15 días al mes de duración de 4 horas por día. La toxina botulínica no está aprobada ni se ha demostrado efectiva en la prevención de migrañas en las personas con cefalea por menos de 15 días al mes. La OnabotA es una proteína inyectable producida por una bacteria (Clostridium botulinum) que paraliza los músculos en el que se inyecta. La ubicación precisa y la cantidad de cada inyección se ha probado extensamente para la seguridad y la eficacia en el tratamiento de una amplia variedad de trastornos. Se cree que la toxina mejora la migraña bloqueando la transmisión de señales de dolor entre la cabeza y el cuello con el cerebro donde se genera la migraña. La OnabotA no es una cura para las migrañas. De hecho, en los estudios que condujeron a su aprobación sólo hubo alrededor de 2 días menos de cefaleas por mes en los que la recibieron en comparación con los que recibieron placebo, aunque el número de horas de cefalea al mes se redujeron en cerca de 1/3. Sin embargo, las personas que recibieron la toxina en los estudios fueron más capaces de funcionar y realizar sus actividades habituales, aun cuando tenían dolor de cabeza. Los dos ensayos clínicos que condujeron a la aprobación por el FDA utilizaron un conjunto estandarizado de inyecciones llamado Fase III del protocolo PREEMPT (Phase III Research Evaluating Migraine Prophylaxis Therapy). Con este protocolo, desarrollado y probado extensivamente, 31 pequeñas inyecciones de 5 unidades cada una se colocan en los lugares prescritos sobre la frente, los lados de la cabeza, y la parte posterior de la cabeza y el cuello. Las inyecciones son justo debajo de la piel, creando una pequeña burbuja o pápula en el sitio que normalmente no es visible más allá de unas pocas horas. Los sitios de inyección del protocolo PREEMPT se ilustran a continuación: 789 790 La cantidad de medicamento aprobado por la FDA para la prevención de la migraña crónica, y administrado en el protocolo PREEMPT, es 155 unidades. Sin embargo, OnabotA sólo viene en frascos de 100 o 200 unidades. En lugar de tirar las 45 unidades restantes en la botella, muchos profesionales se ofrecen para administrar el resto en áreas en las que los pacientes tienen dolor en particular. Esta estrategia de tratamiento adicional se le llama “seguir al dolor”, y también fue utilizada por muchos de los sitios en el programa PREEMPT antes de la aprobación por la FDA. Desafortunadamente, aunque la técnica de “seguir el dolor” se emplea frecuentemente, no se ha establecido si esta proporciona algún beneficio adicional. El protocolo PREEMPT para inyecciones OnabotA es el único patrón de inyección aprobado por la FDA para la migraña crónica, y los médicos están especialmente entrenados en su administración. Aunque OnabotA cosmética es químicamente idéntico al utilizado para la migraña crónica, las cantidades y lugares aprobados para el tratamiento de cefaleas son muy diferentes a las utilizadas para otras indicaciones. La OnabotA generalmente es bien tolerada y sin efectos secundarios sistémicos. Sin embargo, aproximadamente 9% de las personas reportan dolor de cuello, dolores de cabeza en 5%, y un 4% puede tener una caída temporal del párpado llamada ptosis. Alrededor del 3% experimentará dolores musculares, y un 2% tendrá algún tipo de parálisis facial muscular, elevación de cejas, o espasmos musculares. Si alguno de esos ocurre es de poca duración. Los pacientes generalmente notan que no pueden arrugar la frente después de las inyecciones de OnabotA, y cuando pueden hacerlo nuevamente, puede ser una señal de que la droga se está desvaneciendo. La eficacia de OnabotA va disminuyendo a los 3 meses, pero a veces más pronto. Si ocurren efectos secundarios, estos normalmente mucho menos duraderos que los 3 meses de efecto en la prevención de cefaleas. Las personas con enfermedades neuromusculares tienen que ser observadas más de cerca por la posibilidad de efectos secundarios más graves. Las alergias a la OnabotA son poco comunes, pero como con cualquier medicina son posibles, y van desde una reacción local hasta un caso de alergia severa y muerte, se cree que posiblemente estuvo relacionado a otro medicamento que se mezcló con OnabotA. Hay algunos reportes aislados de dificultad para respirar, hablar y tragar. Estos eventos parecían ocurrir en pacientes que estaban siendo inyectados con la toxina en cantidades mayores para otros problemas y no fueron informados en los estudios a gran escala para la migraña crónica. La OnabotA no ha sido probada durante el embarazo, por lo tanto, no debe ser administrada a mujeres embarazadas o en mujeres que puedan quedar embarazadas en los 3 meses después de su administración. No fue probado en los menores de 18 años de edad para la migraña crónica y por lo tanto no está indicado para este grupo más joven. El proceso de inyección es de unos 10-15 minutos, y después, los pacientes son capaces de volver a casa y reanudar sus actividades normales. Ejercicios para el cuello vigoroso, tintes para el cabello, y los permanentes son contraindicados por 24 horas después del procedimiento. La OnabotA es una intervención preventiva efectiva en muchos pacientes con migraña, pero no todos responden. Por esta razón, es importante mantener un diario de días con cefalea, la intensidad y duración, tanto antes como después de recibir la toxina. Los pacientes pueden tomar hasta 4 semanas después de la inyección en notar los beneficios, aunque muchos ven la mejora antes. Después de 2 series de inyecciones, si no hay ninguna mejora, OnabotA probablemente debería ser descontinuada. Para los que responden, las inyecciones se continúan cada 3 meses. Para probar si las inyecciones se pueden descontinuar, las inyecciones no se hacen tan frecuentemente y si los dolores de cabeza no aumentan, el tratamiento puede ser detenido. Después de parar de usar OnabotA, se debe mantener un diario de cefaleas para asegurar que no hay un aumento en la frecuencia de la migraña, la intensidad o duración sin su uso. La migraña crónica es un problema importante para al menos un 2% de la población. Esto tiene un impacto negativo en la calidad de vida de las personas, así como la de sus familias. La toxina botulínica tipo A es la primera intervención aprobada que se ha encontrado que provee una mejora significativa en esta enfermedad. A pesar de no resultar en una cura, representa un avance en el tratamiento eficaz. Deborah Tepper, MD Cleveland Clinic Headache Center Traducido por Cristina M. Cabret-Aymat, MD Para encontrar más recursos, visite la Fundación Americana de la Migraña






