LABORATORIO DE QUIMICA TABLA PERIODICA
Anuncio

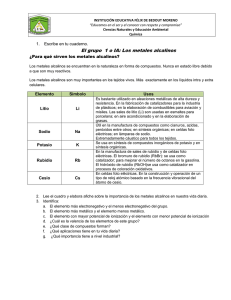
ASIGNATURA: LABORATORIO DE QUIMICA TEMA: TABLA PERIODICA INTEGRANTES: Chucari Martínez Jorge Jesús (072570J) Gamarra Quispe Saúl Abel (072567H) Gonzales Rojas Jonathan Jair (072612L) Mejia Ruiz Paulo Cesar (072574D) Huamani Quispe Miuller (072047D) Romero Medina Gian Pierre (072586B) Segovia Chirre Julio cesar (070569C) Medina Mendivil Jorge Daniel (070521K) Bellavista, 26 de Junio 2008 CONTENIDO: 1) INTRODUCCION 2) OBJETIVOS 3) FUNDAMENTO TEORICO 4) MATERIALES 5) PROCEDIMIENTO 6) DATOS EXPERIMENTALES 7) RESULTADOS 8) ANALISIS DE DATOS 9) DESARROLLO DEL CUESTIONARIO 10) CONCLUSIONES 11) RECOMENDACIONES INTRODUCCION A medida que los científicos han ido conociendo mas y mas elemento, surgió la necesidad de ordenar y agrupar los elementos que se iban descubriendo. Se hicieron muchos intentos de agrupamiento, según se iban repitiendo periódicamente ciertas propiedades y magnitudes físicas, hasta por fin llegar a la tabla periódica actual. La tabla periódica se ha vuelto tan familiar que forma parte del material didáctico para cualquier estudiante, más aún para estudiantes de química, medicina e ingeniería. De la tabla periódica se obtiene información necesaria del elemento químico, en cuanto se refiere a su estructura interna y propiedades, ya sean físicas o químicas. La actual tabla periódica moderna explica en forma detallada y actualizada las propiedades de los elementos químicos, tomando como base a su estructura atómica. Según sus propiedades químicas, los elementos se clasifican en metales y no metales. Hay más elementos metálicos que no metálicos. Los mismos elementos que hay en la tierra existen en otros planetas del espacio sideral. El estudiante debe conocer ambas clases, sus propiedades físicas y químicas importantes; no memorizar, sino familiarizarse, así por ejemplo familiarizarse con la valencia de los principales elementos metálicos y no metálicos, no en forma individual o aislada, sino por grupos o familias (I, II, III, etc) y de ese modo aprender de manera fácil y ágil fórmulas y nombres de los compuestos químicos, que es parte vital del lenguaje químico. Es por ello que invitamos a usted a dar una lectura al presente trabajo, con el motivo que se entere de los diferentes comportamientos que tienen los elementos y compuestos químicos en procesos de laboratorio, e incluso, que suceden en la vida real. 1.-OBJETIVO El objetivo fundamental de la presente práctica de laboratorio es el de realizar un estudio experimental de la Ley Periódica de los Elementos. Esto lo realizaremos mediante diversas pruebas químicas y físicas de las distintas series de elementos de la tabla periódica. Así comprobaremos las propiedades físicas y químicas de los elementos de la tabla periódica, especialmente de los grupos 1A, 2A, 7A, y algunos metales de transición La importancia de esta práctica es evidente ya que en base a la clasificación periódica vamos a estudiar posteriormente los diversos elementos químicos y sus compuestos. 2. FUNDAMENTO TEORICO. 2.1 TABLA PERIODICA. Es el ordenamiento de todo los elementos Químicos, esto gracias a los aportes de MENDELEED, MOSELEY y WERNER. La tabla periódica moderna lo clasifico MOSELEY en 1913 de la siguiente manera “ las propiedades de los elementos químicos están en función creciente a su numero atómico ( Z) y finalmente diseñado por el alemán Químico J WERNER. 2.2 DESCRIPCION GENERAL ¾ 109 elementos reconocidos por la ( IUPAC) ¾ 7 periodos ( también conocidos como niveles) ¾ 16 grupos ( también conocidos como familias ) en estos tenemos , 8 grupos “A” que sus electrones de valencia esta en orbitales “s” y/o “p” y 8 grupos “B” que sus electrones de valencia están en orbitales “d” o “f” . 2.3 CLASIFICACION SEGÚN SU ORIGEN. ¾ ¾ 90 elementos naturales 19 elementos artificiales. 2.4 CLASIFICACION SEGÚN SUS PROPIEDADES. 2.4.1 METALES (84 el elementos en su mayoría) FISICAS: - Son sólidos en su mayoría excepto el (Hg.) liquido a 25 C - de mayor densidad es el Osmio (ρ=22.6g/cm. 3 - posee conductividad eléctrica en ese orden. Ag > Cu > Al > Mg. QUIMICAS: - pierden electrones (fenómeno de la oxidación). -La mayoría se encuentra formando sales y óxidos. 2.4.2 NO METALES ( 22 elementos) FISICAS - Malos conductores. Buenos aislantes. En condiciones ambientales son sólidos y gaseoso, excepto el bromo que es líquido. QUIMICOS - ganan electrones ( fenómeno de la reducción ) - se encuentran formando compuestos orgánicos. 2.5 ENERGIA DE IONIZACION (EI) Es la mínima energía requerida para quitar un electrón del nivel externo de un átomo en estado gaseoso y trasformarse en cation. 2.5 AFINIDAD ELECTRONICA (A E) Es la energía emitida (generalmente) o energía absorbida en casos particulares, cuando un elemento en estado gaseoso gana un electrón. Esta energía esta relacionada directamente con la capacidad del átomo para aceptar uno o masa átomos. 2.6 ELECTRONEGATIVIDAD. Es la fuerza de un átomo para atraer electrones de enlace hacia su núcleo para unirse químicamente con orto átomo / capacidad del átomo para atraer electrones de enlace. 3.- MATERIALES • • • • • • • • • • • • • Tubo de ensayo. Fenolftaleina. Agua destilada. Sodio. Potasio. Cloruro de calcio (2ml). Cloruro de estroncio (2ml). Cloruro de bario (2ml). Gradilla. Ácido sulfúrico. Cloruro de sodio. Bromuro de potasio. Nitrato de arsénico. 4.- PROCEDIMIENTO · IA METALES ALCALINOS: (Li, Na, K, Rb, Cs, Fr) Na + H2O = Na (OH) + H2 ↑ K +H2O = K (OH) + H2 ↑ EXPERIMENTO Nº 1: En un vaso precipitado vertimos 200mL de H2O (destilada), le introducimos un trozo de Na (sodio) y al instante lo tapamos con la luna de reloj y observamos la reacción, dándose así un desprendimiento de H2 (hidrogeno) y de energía a causa de la reacción química (una chispa de fuego), luego le hechamos 3 gotas de fenoltaleína el cual es nuestro indicador, dándole una coloración rojo grosella el cual nos da ha entender que es una base. · IIA METALES ALCALINOS TERREOS: (Be, Mg, Ca, Sr, Ba, Ra) CaCl2 + H2SO4 = Ca SO4 ↓ + 2HCl SrCl2 + H2SO4 = Sr SO4 ↓ + 2HCl BaCl2 + H2SO4 = Ba SO4 ↓ + 2HCl EXPERIMENTO Nº 2; Se tiene tres tubos de ensayo, a uno se le agrega 2mL de CaCl2 (cloruro de calcio), a otro se le agrega 2ml de SrCl2 (cloruro de zirconio), y al ultimo se le agrega 2mL de BaCl2 (cloruro de bario), luego se le agrega a cada tubo 2ml de H2SO4 (acido sulfúrico) dejándolos en reposo en la gradilla para tubos de ensayo. · VIIA HALOGENOS: (F, Cl, Br, I, At) NaCl + AgNO3 = AgCl + NaNO3 KBr + AgNO3 = AgBr + KNO3 Cloro EXPERIMENTO Nº 3: Tenemos dos tubos de ensayo en uno de ellos se vierte 2ml de NaCl y en el otro se vierte 2mL de KBr, luego se le agrega ha ambos 2ml de AgNO3 (nitrato de plata), dejándolo en reposo en la gradilla. 5) DATOS EXPERIMENTALES: 5.1 Para los metales alcalinos, alcalinos térreos y halógenos: Del grupo I A: Li Na ⇒ 2Na + 2H2O (200 ml) K ⇒ 2K +2 H2O (200 ml) Rb Cs Fr → → 2Na (OH) + H2 2K (OH) + H2 Se le añade tres gotas de Fenol taleina (indicador), como comprobante, cambiando la coloración a un rojo grosella indicando que es una base. Del grupo II A: Be Mg Ca ⇒ Ca Cl2 + H2SO4 Sr ⇒ Sr Cl2 + H2SO4 Ba ⇒ Ba Cl2 + H2SO4 → → → CaSO4 + 2HCl (2 ml) SrSO4 + 2HCl (2 ml) BaSO4 + 2HCl (2 ml) Ra Se le añade tres gotas de nitrato de plata (AgNO3) Del grupo VII A: F Cl ⇒ Na Cl + AgNO3 Br ⇒ KBr + H2SO4 → → Ag Cl + NaNO3 AgBr + KNO3 I At Se le añade tres gotas de nitrato de plata (AgNO3) (2 ml) (2 ml) 6.-ANALISIS DE DATOS A) REACCIONES QUÍMICAS Con el Grupo IA Metales Alcalinos Balanceando 2Na + 2H O − − − − > 2Na(OH) + 2H 2 2K + 2H O − − − − > 2K(OH) + 2H 2 2 2 ↑ ↑ Ambas son reacciones de Desplazamiento o sustitución simple De naturaleza explosiva Con el Grupo IIA Metales Alcalinos Térreos Balanceando Precipitado Ca Cl + H S O − − − − > Ca S O + 2H Cl 2 2 4 4 Precipitado Sr Cl + H S O − − − − > Sr S O + 2H Cl 2 2 4 4 Precipitado Ba Cl + H S O − − − − > Ba S O + 2H Cl 2 2 4 4 Precipitado de coloración blanquecina Ambas son reacciones de Doble Desplazamiento o Metátesis Con el Grupo VIIA Halógenos (formadores de Sales) Na Cl + Ag N O − − − − > Ag Cl + Na N O 3 3 Precipitado de coloración blanquecina Precipitado K Br + Ag N O − − − − > Ag Br + K N O 3 3 Ambas son reacciones de Doble Desplazamiento o Metales Molaridad M = n sto V (L ) sol n = número de moles de soluto V = Volumen de la solución Molaridad del Cloruro de Calcio Ca Cl 2 V = 2ml = 0,002 L n = 1 mol M = 1 0,002 mol L M = 0,5*10 2 molar Molaridad del Cloruro de Estroncio Sr Cl V = 2ml = 0,002 L n = 1 mol M = 1 0,002 mol L M = 0,5*10 2 molar Molaridad del Cloruro de Bario Ba Cl 2 V = 2ml = 0,002 L n = 1 mol M = 1 0,002 mol L M = 0,5*10 2 molar Molaridad del Cloruro de Sodio V = 2ml = 0,002 L Na Cl 2 n = 1 mol M = 1 0,002 mol L M = 0,5*10 2 molar Molaridad del Bromuro de Potasio K Br V = 2ml = 0,002 L n = 1 mol M = 1 0,002 M = 0,5*10 2 mol molar L 8.-CUESTIONARIO A.- ¿Que son los metales alcalinos? Los metales alcalinos son aquellos que están situados en el grupo 1 de la tabla periódica. Todos tienen un solo electrón en su nivel energético más externo, con tendencia a perderlo, con lo que forman un Ion monopositivo, M+. Los alcalinos son los del grupo I A y la configuración electrónica del grupo es ns¹. Por ello se dice que se encuentran en la zona "s" de la tabla. B.-Como obtenemos los Metales alcalinos y cuales son sus aplicaciones Estos metales son: Litio (Li), Sodio (Na), Potasio (K), Rubidio (Rb), Cesio (Cs) y Francio (Fr). Los metales alcalinos se obtienen por electrólisis de sales fundidas. Ej: Método de Down para la obtención de sodio a partir de la halita (sal gema, cloruro sódico) 2Na+(l) +2Cl-(l) —> 2Na(s) +Cl2(g) • El litio se utiliza para la síntesis de aluminios de gran resistencia, para esmaltar cerámica, para producir vidrios y como componente de lubricantes y pilas (tiene un gran potencial reductor). En bioquímica es un componente del tejido nervioso y su carencia produce trastornos psiquiátricos, como la depresión bipolar. • El sodio se utiliza en la industria textil, pues sus sales son blanqueantes. Es componente de algunas gasolinas, jabones (como la soda caustica), lámparas de vapor de sodio (que producen una luz amarilla intensa) y puede emplearse como refrigerante en reactores nucleares. A pesar de ser tóxico al ingerirlo es un componente fundamental de las células. La bomba de sodio-potasio es responsable hasta cierto punto de la ósmosis • El potasio se utiliza para producir jabones, vidrios y fertilizantes. Es vital para la transmisión del impulso nervioso • El rubidio se utiliza para eliminar gases en sistemas de vacío. • El cesio es el principal constituyente de células fotoeléctricas. • El francio no tiene apenas peso en la industria. C.- ¿Por qué se produce la precipitación de los metales alcalinos térreos? 3 elementos Metales alcalinotérreos, serie de seis elementos químicos que se encuentran en el grupo 2 (o IIA) del sistema periódico. Son poderosos agentes reductores, es decir, se desprenden fácilmente de los electrones. Son menos reactivos que los metales alcalinos, pero lo suficiente como para no existir libres en la naturaleza. Aunque son bastante frágiles, los metales alcalinotérreos son maleables y dúctiles. Conducen bien la electricidad y cuando se calientan arden fácilmente en el aire. Los metales alcalinotérreos son, por orden de número atómico creciente: berilio, magnesio, calcio, estroncio, bario y radio. Sus óxidos se llaman tierras alcalinas. El nombre de alcalinotérreos proviene del nombre que recibían sus óxidos, tierras, que tienen propiedades básicas (alcalinas). Poseen una electronegatividad ≤ 1,3 según la escala de Pauling. Son metales de baja densidad, coloreados y blandos. Reaccionan con facilidad con halógenos para formar sales iónicas, y con agua (aunque no tan rápidamente como los alcalinos) para formar hidróxidos fuertemente básicos. Todos tienen sólo dos electrones en su nivel energético más externo, con tendencia a perderlos, con lo que forman un Ion dispositivo, M2+.y la configuración electrónica del grupo al cual pertenecen que es el 2a es ns2 D.- ¿Cual es las diferencias entre metales alcalinos y alcalinos térreos? Por empezar los alcalinos son Li, Na, K, Rb, Cs y Fr (están en el grupo 1 de la tabla periódica) Los alcalinotérreos son; Be, Mg, Ca, Sr, Ba, Ra (están en el grupo 2) Diferencias: • Densidad: los del grupo 2 presentan densidades bajas, pero son mayores con respecto a los alcalinos de su mismo periodo • Punto de fusión: los alcalinotérreos presentan un punto de fusión mas elevado • Reactividad: los del grupo dos son menos reactivos mientas que los del grupo 1son altamente reactivos Y otra cosa, los alcalinotérreos presentan dos electrones libres y forman iones con carga positiva doble los alcalinos solo presentan 1 electrón libre E.- ¿Qué son los halógenos? Los elementos halógenos son aquellos que ocupan el grupo 17 del Sistema Periódico. Los halógenos F, Cl, Br, I y At, son elementos volátiles, diatómicos y cuyo color se intensifica al aumentar el número atómico. El flúor es un gas de color amarillo pálido, ligeramente más pesado que aire, corrosivo y de olor penetrante e irritante. El cloro es un gas amarillo verdoso de olor penetrante e irritante. El bromo a la temperatura ambiente es un líquido de color rojo oscuro, tres veces más denso que el agua, que se volatiliza con facilidad produciendo un vapor rojizo venenoso. El yodo es un sólido cristalino a temperatura ambiente, de color negro y brillante, que sublima dando un vapor violeta muy denso, venenoso, con un olor picante como el del cloro. El Astato es un elemento muy inestable que existe sólo en formas radiactivas de vida corta. F.- ¿Cuál es la aplicación de los halógenos? Los derivados del flúor tienen una notable importancia en el ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como el anticongelante freón y la resina teflón, lubricante de notables propiedades mecánicas. Los fluoruros son útiles como insecticidas. Además, pequeñísimas cantidades de flúor añadidas al agua potable previenen la caries dental, razón por la que además suele incluirse en la composición de los dentífricos. El cloro encuentra su principal aplicación como agente de blanqueo en las industrias papelera y textil. Así mismo, se emplea en la esterilización del agua potable y de las piscinas, y en las industrias de colorantes, medicamentos y desinfectantes. Los bromuros actúan médicamente como sedantes, y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas. El yodo, cuya presencia en el organismo humano resulta esencial y cuyo defecto produce bocio, se emplea como antiséptico en caso de heridas y quemaduras. 9-. CONCLUSIONES - La mayoría de los elementos que tenemos en el planeta son metálicos y de estos se aprovecha más su propiedad de conducir la electricidad. -la tabla periódica actual que es la moderna a sido diseñado por el científico alemán J WERNER esto en base al principio propuesto por HENRY , MOSELEY. 10-.RECOMENDACIONES. - Cuando se realice experimentos en laboratorio diferenciar elementos peligrosos. -identificar los riesgos y cuidar los instrumentos que hay en laboratorio.