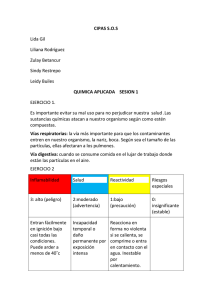
MH0412_QUIMICA INTEGRADA
Anuncio

UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS (Universidad del Perú, DECANA DE AMÉRICA) FACULTAD DE MEDICINA ESCUELA ACADÉMICO PROFESIONAL DE MEDICINA HUMANA DEPARTAMENTO ACADÉMICO DE CIENCIAS DINÁMICAS. SYLLABUS DE QUÍMICA INTEGRADA (Código: MH0412) AÑO ACADÉMICO: 2011 – I PROMOCIÓN INGRESANTES: 2011 CONTENIDO 1. 2. 3. 4. 5. 6. 7. 8. SUMILLA DATOS GENERALES COMPETENCIAS GENERALES PROGRAMACIÓN DE CONTENIDOS METODOLOGÍA DE LA ENSEÑANZA SISTEMA DE EVALUACIÓN BIBLIOGRAFÍA INSTRUCCIONES GENERALES 2011 1. SUMILLA. El Curso de Química Integrada esta dirigido a estudiantes de medicina, con una orientación preferentemente conceptual mas que operativa. Comprende el estudio de las sustancias llamadas orgánicas e inorgánicas, su estructura y propiedades químicas, especialmente de aquellas que forman parte del organismo humano. Está orientado hacia la comprensión, análisis e interpretación de las reacciones químicas biológicas, sus mecanismos de reacción y estereoquímica, teniendo en cuenta al organismo como el medio donde suceden estos eventos. El curso se apoya en el conocimiento previo de los elementos y compuestos inorgánicos y el reconocimiento de los grupos funcionales de utilidad biológica, que servirá como base para el entendimiento y desarrollo adecuado de cursos como bioquímica, fisiología y farmacología. 2. DATOS GENERALES 2.1. CARACTERÍSTICAS DEL CURSO Nombre de la Asignatura Química Integrada Código del Curso MH0412 Año de Estudios Primer Año Créditos 05 Duración del curso 17 Semanas 21 de Marzo del 2011 Fecha de inicio Fecha de término 14 de Julio del 2011 Total de Horas Semestrales 136 Nº total de horas por semana 08 Teoría 04 horas académicas Practica 02 horas académicas Seminario 02 horas académicas Locales Asignados: Teoría Aula A de Bioquímica Practica Laboratorio de Bioquímica A y B Seminario Pabellón de Aulas Horarios: Teoría Lunes 14:00 a 16:00 horas y Jueves 08:00 a 10:00 horas Practica Miércoles 14:00 a 18:00 horas Jueves 16:00 a 18:00 horas Seminario Miércoles 14:00 a 20:00 horas Jueves 10:00 a 20:00 horas Viernes 14:00 a 18:00 horas Número de alumnos: 150 2.2. PERSONAL DOCENTE Responsable del Curso : Coordinadora de Seminarios : Coordinadora de Prácticas : PERSONAL DOCENTE Dra. Ana Delgado Vásquez. Dra. Virginia Villanueva Coz Dra. Dolores Villanueva Zambrano Quím. Miriam Palomino Pacheco Dr. José Durand Velasco Dr. Julio Sánchez Tonohuye Q.F. Gisela Oliveira Bardales Dr. Cristian Andonaire Munaico Dra. Imelda Domínguez Estrada Dra. Rosa Alvarado Merino Dra. Mercedes Guzmán Sánchez Dr. Daniel Angulo Poblete Q.F. Justina Najarro Vargas Dra. Ana E. Delgado Vásquez Dra. Virginia Villanueva Coz Q. F. Gisela Oliveira Bardales Prof. Principal Prof. Principal Prof. Principal Prof. Principal Prof. Asociado Prof. Asociado Prof. Asociado Prof. Auxiliar Prof. Auxiliar Prof. Auxiliar Prof. Auxiliar Prof. Auxiliar Prof. Auxiliar T.C. T.P. T.P. T.C. T.P. T.P. T.C. T.P. T.P. T.P. T.P. T.P. T.C. 3. COMPETENCIAS GENERALES. Al término del curso, el estudiante: - Conceptualiza la estructura de la materia en base a fundamentos químicos para comprender la organización de la naturaleza y del ser humano. - Relaciona los niveles de organización física, química, biológica, social y ecológica de los sistemas vivos. - Obtiene, registra y sistematiza la información para responder a preguntas de carácter científico, consultando fuentes relevantes y realizando experimentos pertinentes. - Comprende la función de los compuestos químicos a través del estudio de la organización de las biomoléculas, para entender la actividad biológica y sirvan de base en su secuencia formativa. - Analiza la actividad del ser humano dentro de su entorno aplicando los conocimientos químicos para comprender el proceso de salud y enfermedad, y contribuir al mejoramiento de la calidad de vida. - Fundamenta opiniones sobre los impactos de la ciencia y la tecnología en su vida cotidiana, asumiendo consideraciones éticas. 4. PROGRAMACIÓN DE CONTENIDOS UNIDAD I: ESTRUCTURA DE LA MATERIA 1. Duración : 2 semanas 2. Competencias Específicas: ‐ Valora la química como una ciencia que explica la composición y transformación de la materia, para conocer la estructura de las biomoléculas a través de los conocimientos químicos, seminarios y procedimientos experimentales para comprender la actividad biológica. ‐ Conoce las propiedades y características de los grupos de elementos, considerando su ubicación en la tabla periódica. ‐ Distingue los diferentes modelos de enlaces interatómicos e intermoleculares, relacionando las propiedades macroscópicas de las sustancias con el tipo de enlace que presentan. CONCEPTUAL PROCEDIMENTAL ACTITUDINAL 1. Introducción al conocimiento de las bases científicas de la vida. Química cuántica: estructura atómica. Comprende el campo de acción de la química y su relación con otras ciencias. Establece la relación que existe entre las propiedades de la materia y los cambios que se dan en ella, por efecto de la energía. Elabora un diagrama conceptual de las bases científicas de la vida Valora la trascendencia de la química en la interpretación de los fenómenos biológicos. Reconoce la importancia del conocimiento de las propiedades de los elementos químicos de la tabla periódica para explicar su comportamiento biológico. las propuestas y 2. Elementos químicos y Identifica personajes más relevantes tabla periódica. relacionados con el desarrollo de la TP Clasifica y describe los elementos químicos de la TP 3. Enlace químico I. 4. Enlace químico II. Identifica y describe los enlaces químicos de las biomoléculas Distingue la naturaleza de los enlaces fuertes y débiles y su importancia en las propiedades físicas y químicas de las biomoléculas. Comprende la naturaleza de las atracciones intermoleculares como fuerzas determinantes en la conformación de las biomoléculas. Analiza los tipos de enlace químico y comprende porque dan estabilidad a los compuestos orgánicos. Reconoce la importancia del conocimiento de las teorías de enlace para explicar el comportamiento de moléculas y compuestos químicos. UNIDAD II: ELEMENTOS QUE CONFORMAN LAS BIOMOLÉCULAS 1. Duración: 3 semanas 2. Competencias Específicas: ‐ Analiza las propiedades de los elementos que conforman las biomoléculas a través del conocimiento químico y seminarios para comprender su rol dentro de la estructura de la materia. ‐ Analiza los ciclos de cada bioelemento y su distribución en el ser humano. ‐ Conoce los metales pesados, los ubica en la tabla periódica y analiza sus propiedades para comprender su mecanismo de acción en el ser humano. - Conoce compuestos de coordinación, escribiendo y leyendo complejos usando ligandos, mono, bi y polidentados analizando su geometría y el enlace químico para entender su importancia biológica en la vida del hombre CONCEPTUAL 5. Hidrógeno. 6. Carbono. 7. Oxigeno y Azufre 8. Nitrógeno y Fósforo 9. Metales pesados PROCEDIMENTAL ACTITUDINAL Analiza las propiedades del hidrogeno como fuente de energía protónica y electrónica. Valora la importancia del hidrógeno en todos los procesos bioquímicos. Analiza la importancia de compuestos de carbono en los compuestos orgánicos. Reconoce al carbono como elemento fundamental de la química orgánica. Distingue las formas de oxigeno, radicales y su importancia en los organismos vivos. Distingue las formas alotrópicas del S, y sus propiedades en los compuestos biológicos. Analiza las implicancias biológicas, fisiológicas y patológicas del O2 en la vida del hombre. Analiza las consecuencias en la naturaleza de la lluvia ácida Conoce el ciclo del nitrogeno, valora la importancia en la vida de plantas y animales. Conoce elementos de fósforo de importancia biológica. Valora los adelantos de la química en el estudio de todos los elementos. Identifica compuestos de metales pesados que tienen efectos tóxicos. UNIDAD III: MECANISMOS DE REACCIÓN QUÍMICA: 1. Duración : 3 semanas 2. Competencias Específicas: Asume conducta ética frente a la problemática del medio ambiente ‐ Comprende los mecanismos de las reacciones químicas biológicas en los procesos metabólicos a través de fundamentos teóricos procedimientos experimentales y seminarios para vincularlo con el funcionamiento de los seres biológicos. ‐ Distingue mecanismos de reacciones orgánicas, analizando las diferencias entre un mecanismo de sustitución nucleofilica uní y bi molecular, mecanismo de eliminación uni y bimolecular y otros, utilizando ejemplos de interés biológico. ‐ Comprende las transformaciones químicas, sus mecanismos y su importancia en los fenómenos biológicos. ‐ Conceptúa compuestos heterocíclicos analizando su nomenclatura y propiedades de los principales compuestos usados en la vida del ser humano. ‐ Identifica y comprende la importancia del agua como molécula integradora vital. ‐ Identifica y comprende los mecanismos moleculares en la regulación ácido – base, identifica las principales moléculas reguladoras en el ser humano. CONCEPTUAL 10. Reacciones químicas. 11. Mecanismos de reacción orgánica. 12. Elementos de transición. Química de coordinación. 13. Compuestos Heterocíclicos. 14. El agua. 15. Ácidos y bases. Equilibrio ácido‐base. PROCEDIMENTAL ACTITUDINAL Describe y clasifica las reacciones químicas y sus mecanismos. Analiza procesos biológicos que se acomodan a estos mecanismos. Valora la trascendencia del avance de los conocimientos para su aplicación en medicina. Reconoce a los diferentes heterociclos en la estructura química de compuestos biológicos naturales. Reconoce la presencia de heterociclos en compuestos de coordinación Elabora un diagrama conceptual de los elementos de transición y compuestos heterocíclicos Asume posición crítica frente a los conocimientos de las reacciones químicas y su aplicación en el medio biológico. Reconoce la presencia de compuestos heterociclicos como núcleos principales de compuestos orgánicos naturales Analiza funciones y propiedades del agua como molécula integradora, de transporte, etc. Comprende el comportamiento del agua en las soluciones biológicas Valora el agua como elemento vital en la vida del ser humano y toma conciencia de su uso racional y las consecuencias de su escasez en el futuro Analiza el comportamiento del agua en las reacciones y el equilibrio ácido – base. Comprende el significado químico - biológico de pH. Reconoce la importancia del equilibrio acido base en los diferentes procesos bioquímicos que se desarrollan en el ser vivo. UNIDAD IV: MOLÉCULAS ORGÁNICAS FUNCIONALES: 1. Duración : 2 semanas 2. Competencias Específicas: ‐ Identifica los principales grupos funcionales y reconoce sus interacciones en las reacciones químicas biológicas a través del análisis estructural de las moléculas. Se reforzará a través de seminarios y procedimientos experimentales para comprender la estructura de las biomoléculas. CONCEPTUAL 16. Grupos Funcionales Oxigenados I: Alcoholes, Fenoles y Éteres 17. Grupos Funcionales Oxigenados II: Aldehídos, Cetonas, Ácidos Carboxílicos, Ésteres y Anhídridos. 18. Grupos Funcionales Nitrogenados: Aminas y Amidas. PROCEDIMENTAL ACTITUDINAL Describe y clasifica los grupos funcionales que se presentan en nuestras moléculas. Valora la trascendencia de los avances de los conocimientos químicos para su aplicación en medicina. Maneja la estructura química y diferencia alcoholes , fenoles, éteres, ácidos carboxílicos, esteres y anhídridos orgánicos Identifica y diferencia moléculas de interés biológico en estos grupos. Elabora un diagrama conceptual de los grupos funcionales. Distingue la utilidad y los peligros que origina el uso inadecuado de alcoholes, aldehídos y otros compuestos orgánicos oxigenados. Reconoce la importancia de los acido carboxílicos en la vida del hombre. Reconoce la utilidad biológica de los compuestos nitrogenados. UNIDAD V: BIOMOLÉCULAS 1. Duración : 5 semanas 2. Competencias Específicas: ‐ Reconoce las estructuras de las biomoléculas a través de fundamentos teóricos, seminarios y procedimientos experimentales para comprender la participación de las mismas en la organización de los seres humanos en situación de salud y enfermedad. ‐ Define estereoquímica, analiza la conformación estructural de los diferentes tipos de isómeros para entender la estabilidad y función de las moléculas ópticamente activas. ‐ Define, clasifica e identifica carbohidratos, aminoácidos, proteínas, glicoproteínas, lípidos, vitaminas y alcaloides, identificando sus formulas químicas y analizando sus propiedades para comprender sus funciones biológicas. ‐ Identifica y comprende los nucleótidos y ácidos nucléicos en cuanto a su estructura y participación en la vida. CONCEPTUAL 19. Estereoquímica y Carbohidratos. 20. Carbohidratos II. 21. Aminoácidos. 22. Proteínas I. 23. Proteínas II 24. Glicoproteínas y Glicosaminoglicanos. 25. Lípidos I 26. Lípidos II 27. Vitaminas y Alcaloides 28. Nucleótidos. PROCEDIMENTAL ACTITUDINAL Conoce las características de la isomería estructural y óptica. Distingue la especificidad y estereo-selectividad de las reacciones bioquímicas. Reconoce la importancia de los carbohidratos como una de las principales biomoléculas en los procesos biológicos. Investiga sobre el uso y la importancia de plásticos biodegradables Investiga sobre disacáridos y, polisacáridos de importancia biológica, analiza su importancia. Analiza y reconoce péptidos, proteínas glicoproteínas. AA, y Elabora un diagrama conceptual de las características químicas de las biomoléculas Reconoce la importancia de aminoácidos en la conformación de péptidos y proteínas y discute su importancia biológica en lo seres vivos. Muestra interés en conocer las funciones de las proteínas en los procesos biológicos del ser vivo. Diferencia la estructura química de aceites, grasas y ceras y los nombra. Investiga el mecanismo de formación de terpenos y también la importancia de terpenos, prostaglandinas, feromonas en la vida del hombre. Identifica vitaminas hidrosolubles y liposolubles analiza su fosforilación química para entender sus efectos fisiológicos. Clasifica alcaloides y los agrupa de acuerdo a su núcleo principal. Debate la importancia de las vitaminas como cofactores en los procesos bioquímicos Reflexiona sobre las ventajas del uso de alcaloides y los efectos tóxicos del uso excesivo. Describe los nucleótidos analiza sus propiedades y los integra a los ácidos nucleícos. Analiza la importancia biológica de estos. Reconoce la importancia de las ácidos nucléicos en la vida. CRONOGRAMA DE ACTIVIDADES: TEORIA UNIDAD I : ESTRUCTURA DE LA MATERIA FECHA TEMA COMPONENTES Introducción. La Física, el sustento de la Química, la Química el sustento de la Biología. Origen de los elementos Clase Inaugural. químicos, su participación en la vida. Escala de Lunes organización de la materia. Interacción materia y energía. Introducción, 21 de Teoría Cuántica: El átomo, el electrón y el protón. Números Química Quántica cuánticos, niveles y subniveles de energía. Función de marzo Elementos químicos Tabla periódica Jueves 24 de marzo Lunes 28 de marzo Enlace químico I Jueves 31 de marzo Enlace químico II Gisela Oliveira B. Ana Delgado V. Miriam Palomino P. UNIDAD II: ELEMENTOS QUE CONFORMAN BIOMOLECULAS El hidrógeno: distribución en el universo, en nuestro planeta y en el ser humano. Ciclo del hidrógeno. Estructura atómica, isótopos. La molécula de hidrógeno. Modalidades Lunes 04 de abril Hidrógeno Jueves 07 de abril Carbono Oxigeno y Lunes 11 de abril Azufre Jueves 14 Onda de DeBroglie, principio de incertidumbre de Heinsenberg. Modelo de Schrodinger. Antecedentes históricos de la clasificación de los elementos químicos. Nociones de Grupo, período y bloque, aplicadas a los elementos químicos en la TP actual.Elementos representativos. Propiedades periódicas: electronegatividad, energía de ionización, afinidad electrónica, radio y volumen atómico y su variación en la TP. Concepto de valencia. Estado de oxidación y número de coordinación. Orbitales atómicos: concepto y modelos de orbitales: “s”, “p” y “d”. Hibridización de los orbitales. Generalidades. Concepto de enlace químico, concepto de molécula. Clasificación y tipos de enlace. Enlace iónico y metálico. Enlace covalente: tipos e interpretación de los mismos. Teoría del Enlace Valencia (TEV) y Teoría del Orbital Molecular (TOM). Energía de enlace y longitud de enlace. Resonancia. Enlaces intermoleculares: fuerzas de Vander Waals, dipolo‐dipolo, dipolo inducido, fuerzas de London; otros tipos de enlaces que estabilizan moléculas orgánicas. Introducción a los puentes disulfuro y puentes de hidrógeno. Concepto, repercusión y aplicación en sistemas biológicos. RESPONSABLE Ana Delgado. José Durand V. de reacción probables: homolítica, heterolítica, por transferencia de protones. El hidrógeno como ión: la actividad y la energía protónica. El hidrógeno fuente de energía protónica y electrónica a nivel mitocondrial. Concepto de respiración. Interacción del hidrógeno con otros elementos. El hidrógeno ecuatorial y axial. Puentes de hidrogeno. El carbono: distribución en nuestro planeta y en el ser humano. Ciclo del carbono. Estructura atómica. Carbono inorgánico, carbonilo, carbenos, carbocationes, carbanión, los óxidos de carbono: CO y CO2 características, propiedades e importancia. Compuestos orgánicos. El Oxígeno: Distribución en el planeta y en el hombre. Ciclo del oxígeno. Estructura atómica y molecular. Isótopos y alótropos. Concepto de oxidación. El oxígeno prototipo oxidante en la naturaleza y en el organismo. Radicales liberados en el proceso oxidativo del oxígeno: triplet, singlet, superóxido, hidroxiperóxido, peróxido de hidrógeno y radical hidroxilo. Sus implicancias biológicas, fisiológicas y patológicas. Antioxidación biológica: moléculas antioxidantes, antioxidación artificial: fármacos. El Azufre: Distribución en el planeta y en el hombre estructura atómica, características físicas, reacciones químicas. Compuestos de interés biológico: sulfidrilos, sulfatos, sulfónicos, etc. Puentes disulfuro. Julio Sánchez T. Dolores Villanueva Z. Cristian Andonaire M. Delgado, Andonaire, de abril 1º EXAMEN TEORICO El nitrógeno: distribución en nuestro planeta y en el organismo. El ciclo del nitrógeno: su participación en la materia orgánica e inorgánica y sus estados de oxidación. Estructura química, isótopos. Compuestos del nitrógeno: nitritos, nitratos, amoníaco, úrea. Aminas y amidas: estructura y propiedades. La creatinina. El NO y el NO2: importancia biológica. El fósforo: ciclo del fósforo, su participación en la materia orgánica e inorgánica. Estructura química. El fósforo como ejemplo de átomo “corchado” (“en crochet”). Ácido fosfórico y sus ésteres, importancia biológica. Otros compuestos del fósforo de interés biológico: fosfatos, fosfatidil inositol, tetráquides y pentáquides. Lunes 18 de abril Nitrógeno y Fósforo Oliveira, Domínguez, Guzmán, Alvarado. Imelda Domínguez E. UNIDAD III: MECANISMOS DE REACCION QUIMICA Lunes 25 de abril Jueves 28 de abril Metales pesados Reacciones químicas Lunes 02 de mayo Jueves 05 de mayo Mecanismos de reacción química Elementos transición. Quim. coordinación Lunes 09 de mayo Compuestos heterocíclicos Jueves 12 de mayo Lunes 16 de mayo Agua 2º EXAMEN Metales pesados, clasificación y características químicas, usos en la industria, fuentes de contaminación y su repercusión en los seres biológicamente organizados.. El Mercurio y plomo, como prototipos. Equilibrio de las reacciones (Leyes de Conservación) Principio de Le Chateliere. Influencia de la naturaleza de los reactantes y del medio donde ocurre la reacción. Ecuaciones químicas y balance. Serie electroquímica. Reacciones, reacciones de óxido‐reducción. Potencial redox. Balanceo de ecuaciones por diferentes métodos. Ejercicios de aplicación. Tipos de Reacciones Químicas: combinación, adición o síntesis, descomposición, desplazamiento simple, de doble desplazamiento o doble sustitución. Ordenamiento molecular, condensación, reacciones redox, ecuaciones químicas. Características de los reactantes e influencia del medio. Compuestos electrofílicos, nucleofílicos Sustitución nucleófilica unimolecular SN1. Sustitución nucleófilica bimolecualr SN2. Reacciones de eliminación E1 y E2. Reacciones de adición.. Ejemplos en los medios biológicos. Oligoelementos: metales de transición (Fe, Cu, Co, Zn, Mn), Selenio. Estructura atómica. Propiedades e importancia biológica de los mismos. Su participación en las moléculas biológicas y en el organismo. Concepto de quelación. Teoría del campo ligando en los sistemas biológicos. Mecanismo de reacción y equilibrio de iones complejos. Compuestos heterocíclicos con nitrógeno, oxígeno y azufre. Estructura, nomenclatura. Heterocíclicos saturados, heterocíclicos aromáticos, pirrol, furano, piridina y tiofeno. Propiedades químicas (comportamiento ácido‐base). Heterocíclicos como compuestos biológicos naturales. Compuestos relacionados con el pirrol. Compuestos relacionados con la pirimidina Generalidades. Ciclo del agua. Estructura molecular e intermolecular (puente de hidrógeno). Estados del agua y Propiedades físicas y químicas. El agua como dipolo, como solvente biológico y su relación con diversos solutos, el agua responsable de la estructura de la membrana celular, el agua y su organización dentro y fuera de la célula, capa de agua no modificable (agua “unstirred”), el agua fuente de energía protónica, el agua molécula integradora. Producto iónico del agua. Transporte de agua (aquaporinas). TEORICO Mercedes Guzmán S. Miriam Palomino P. Justina Najarro V. Mercedes Guzmán S. Virginia Villanueva C. José Durand V. Delgado, Palomino, Villanueva Z, Angulo, Domínguez, Villanueva C, Durand. UNIDAD IV. MOLECULAS ORGANICAS FUNCIONALES Jueves 19 de Ácidos y bases mayo Equilibrio Acido‐base Generalidades. Concepto de ácidos y bases: Arrhenius, Bronsted‐Lowry, Lewis. Ácidos conjugados y bases conjugadas, ácidos fuertes y ácidos débiles.. concepto de pH, determinación de pH en diferentes tipos de soluciones, Soluciones amortiguadoras, Ecuación de Henderson – Hassebalch, su importancia. Regulación del pH: “Buffers” o amortiguadores “in vivo” e “in vitro”. Cristian Andonaire M. Lunes 23 de mayo Grupos funcionales oxigenados I Jueves 26 de mayo Grupos funcionales oxigenados II Alcoholes y fenoles: estructura, nomenclatura. Tipo de alcoholes: Propiedades físicas y químicas. Aplicación y reactividad de los alcoholes más empleados en sistemas biológicos. Polioles: estructura, clasificación, propiedades. Compuestos representativos: glicerol, manitol, sorbito, dolicol. Éteres: concepto, propiedades físicas y químicas. Tioéteres. Compuestos representativos: éter. Éteres cíclicos Aldehídos y cetonas: estructura, nomenclatura, origen, compuestos representativos: formol, cetona. Tautomería ceto enólica, importancia biológica. Ácidos carboxílicos y policarboxílicos: estructura y nomenclatura. Propiedades físicas y químicas, reacciones. Aplicaciones en sistemas biológicos. Ésteres y Tioésteres: propiedades físicas y reacciones químicas, nomenclatura, importancia biológica. Anhídridos: estructura, nomenclatura, origen, propiedades físicas y químicas, compuestos representativos de importancia biológica. Gisela Oliveira B. Justina Najarro V. UNIDAD V : BIOMOLECULAS Lunes 30 de mayo Jueves 02 de junio Lunes 06 de junio Jueves 09 de junio Grupos funcionales nitrogenados Estereoquímica Carbohidratos 3º EXAMEN Aminas: estructura y nomenclatura. Tipos de aminas: primarias, secundarias y terciarias. Reacción con ácidos carboxílicos, hidrólisis. Aminas alifáticas, aminas aromáticas. Aminas biológicas: histamina, serotonina, dopamina. Aminas tóxicas (protaminas). Amidas: nomenclatura, reducción, enlace amida, poliamidas, hidrólisis. Moléculas de importancia biológica. Introducción. Elementos de simetría, configuración. Actividad óptica en compuestos con carbono asimétrico, nomenclatura. Modificaciones racémicas. Isomería geométrica: compuestos cis y trans, su importancia biológica. Conformación y análisis conformacional. Nomenclatura, estereo‐especificidad y estereo‐selectividad, importancia biológica. Carbohidratos: Concepto, naturaleza química de los carbohidratos. Clasificación, familias D y L. Isomería, actividad óptica. Glucosa, estructura química, representación cíclica y conformacional, formación de acetales La glucosa, oxidación y reducción de la glucosa. Formación de ácidos aldáricos. Glucósidos naturales. Formas alfa y beta. Hemiacetales, formas cíclicas. Pentosas y hexosas, furanosa y piranosa. Enlace glucocidico. Disacáridos. Revisión de la molécula de sacarosa, maltosa, lactosa y celobiosa Isómeros de las hexosas. Oligosacáridos, concepto. Polisacáridos de interés biológico. La celulosa, las pectinas y el ácido teicoico. La fibra en los alimentos. TEORICO Daniel Angulo P. Rosa Alvarado M. Ana Delgado V. Delgado, Andonaire, Oliveira, Najarro, Villanueva C, Guzmán, Alvarado, Lunes 13 de junio Aminoácidos Jueves 16 de junio Lunes 20 de junio Jueves 23 de junio Lunes 27 de junio Jueves 30 de junio Lunes 04 de julio Proteínas I Proteínas II Glicoproteinas Lípidos I Lípidos II Vitaminas y alcaloides Aminoácidos: concepto, fórmula estructural (carbono alfa y formas L). Zwitterion, clasificación de los aminoácidos, aminoácidos esenciales y no esenciales. Las propiedades ácido‐base de los aminoácidos. La glicina: estructura y rol en la actividad celular. Enlace peptídico, péptidos: concepto y estructura, clasificación de los péptidos. Punto isoeléctrico Proteínas. Concepto, clasificación, estructura. Los alfa hélice y plegamientos en beta, puentes de hidrógeno y enlaces disulfuro. Significado de estructura primaria, secundaria, terciaria y cuaternaria. Características físicas y químicas. Compuestos de proteínas con otros elementos y moléculas. Lipoproteínas, metilación, acetilación, fosforilación de las cadenas laterales. Metaloproteínas Clasificación funcional de las proteínas. Propiedades físicas y químicas. Características físicas y químicas de las proteínas intracelulares, conformación y estructura. Características y propiedades químicas de algunas proteínas: clatrina, moléculas de adhesión, sistema MDR, citoquinas, inmunoglobulinas, albúmina, proteína C reactiva, proteínas de primera reacción. Glicoproteínas. Revisión del proceso químico de la glicación y glicosilación. Estructura y propiedades químicas de las glicoproteínas, del glicocálix, lectinas, selectinas, integrinas. Fibronectinas, colágeno, elastasa. Estructura química del colágeno, cadenas alfa y los aminoácidos que integran enlaces intra e inter moleculares. Tipos de colágeno, sus propiedades. Elastina, estructura, algunas propiedades químicas. Glicosaminoglicanos, estructura y reacciones químicas. Los proteoglicanos, estructura y propiedades químicas Concepto de lípido y grasa, clasificación de lípidos: relacionados a ac. grasos y no relacionados a ac. grasos. Los ácidos grasos, definición, clasificación de acuerdo al número de carbonos y saturación. Nomenclatura: serie Delta y Omega. Isomería. Clasificación y características de los lípidos no saponificables, los ácidos no saponificables. Alcoholes superóxido, esteroles. Lípidos saponificables, acilgliceroles (mono, di y triglicéridos). Al doxidiglicéridos, glucoglicéridos. Glicerofosfátidos: ácido fosfatídico, ésteres fosfatídicos, lisofosfátidos, inositol fosfátidos, acetil fosfátidos y ésteres alcohólicos lisofosfátidos. Ceras: ésteres esterílicos 23 Aminoácidos. Ácidos grasos de cadena larga saturados: mirístico, palmítico. Ácidos grasos insaturados: mirisleico, palmitoleico, oleico, linoleico, linolénico, araquidónico, tuberculoesteárico. Los ácidos grasos esenciales. Características y propiedades físicas y reacciones químicas Los lípidos de membrana celular, características y función. Los terpenos: isopreno, miristoilación, palmitoilación e isoprenilación de las proteínas. Fosfolípidos: estructura, propiedades físicas y químicas. Clasificación, características y propiedades. Esteroides: estructura y nomenclatura. Escualeno, colesterol, propiedades físicas y químicas. Características en medios biológicos. Prostaglandinas: estructura y propiedades químicas. Las lipoproteínas de interes biológico y peroxidación lipidica Vitaminas: Definición, clasificación, propiedades físicas y químicas, origen. Vitaminas hidrosolubles: estructura química, clasificación, importancia biológica. Vitaminas liposolubles: estructura química, clasificación e importancia biológica. Alcaloides: definición, nomenclatura, clasificación, estado natural, propiedades físicas y químicas. Principales Angulo. Rosa Alvarado M. Dolores Villanueva Z. Daniel Angulo P. José Durand V. Imelda Domínguez E. Julio Sánchez T. Virginia Villanueva Jueves 07 de julio Lunes 11 de julio Jueves 14 de julio Nucleótidos alcaloides, morfina, cocaína, estricnina, nicotina, quinina, sus propiedades y aplicaciones. Taninos, saponinas y antocianinas Nucleósidos: definición. Nucleótidos: definición. Bases de los nucleósidos. Purinas, pirimidinas, origen y estructura química. Nucleótidos: características y propiedades químicas. Ácidos nucleícos: ADN y ARN. Estructura C. Ana Delgado V. 4º EXAMEN TEORICO Delgado, Guzmán, Angulo, Domínguez, Villanueva C, Durand. SUSTITUTORIO TEORIA Delgado, Andonaire, Alvarado PRÁCTICAS Semana 1º 2º 3º 4º 5º 6º 7º 8º 9º 10º 11º 12º 13º 14º 15º Fecha Actividad / Práctica 23/24 Marzo Introducción. Directivas. Trabajo y comportamiento en el laboratorio. Bioseguridad. 30/31 Marzo Identificación y manejo de materiales y equipos de laboratorio. 06/07 Abril Operaciones fundamentales. 13/14 Abril Tabla periódica. 27/28 Abril Soluciones valoradas. 04/05 Mayo Determinación de pH. 11/12 ayo Soluciones amortiguadoras. 18/19 Mayo EVALUACIÓN 25/26 Mayo Alcoholes y fenoles. 01/02 Junio Aldehídos y cetonas. 08/09 Junio Carbohidratos. 15/16 Junio Aminoácidos y proteínas. 22/23 Junio EVALUACIÓN 06/07 Julio Revisión de guías de práctica. 13/14 Julio Entrega de Promedios Finales de Práctica. Profesor Responsable G. Oliveira, J. Najarro, M. Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino Oliveira, Najarro, Palomino G. Oliveira. Q.F. Gisela Oliveira Bardales, (Coordinadora) Quím. Miriam Palomino P. Q.F. Justina Najarro Vargas SEMINARIOS. Dra. Virginia VillanuevaC. Dra. Ana Delgado V. Dr. Cristian Andonaire M. Dr. José Durand V. Dr. Julio Sánchez T. Dra. Rosa Alvarado M. Dra. Imelda Domínguez E. Dra. Mercedes Guzmán S. Dra. Dolores Villanueva Z. Dr. Daniel Angulo P. 1º Distribución de grupos. (29 Marzo – 03 Abril) 2º Organización de la materia. Elementos químicos que conforman las biomoléculas. (05 – 10 Abril) 3º Enlaces (12 – 17 Abril) 4º Hidrógeno y nitrógeno.(19 – 24 Abril) 5º Oxígeno y carbono. Su uso en medicina. (26 ‐ 30 Abril) 6º Metales pesados. (03 – 08 Mayo) 7º Agua. Fuente de energía. (10 – 15 Mayo) 8º Elementos trazas y compuestos órgano metálicos (17 – 22 Mayo) 9º pH. Amortiguadores biológicos. (24 – 29 Mayo) 10º Aminas. Amidas. Tiocompuestos y moléculas orgánicas (31 Mayo – 05 Junio) Hidratos de carbono. (07 – 12 Junio) 11º 12º Proteínas.(21 – 26 Junio) 13º Glicoproteínas. (28 Junio – 03 Julio) 14º 15º Lípidos. Lípidos de membrana (05 – 10 Julio) Vitaminas. ((12 – 17 Julio) 5. METODOLOGÍA DE LA ENSEÑANZA. El curso de Química Integrada se desarrollará con la metodología que induzca la participación activa del estudiante, para tal fin se empleará las siguientes actividades: 4.1. Exposiciones Teóricas: A cargo de los profesores, quienes expondrán conocimientos científicos actualizados para explicar los fundamentos de las reacciones químicas que ocurren en los medios biológicos Las clases serán interactivas. 4.2. Seminarios: Serán desarrollados por grupos de alumnos (que de preferencia no debería ser mayor de 10 estudiantes) con la orientación de un profesor. Donde se orientará los conocimientos teóricos a los aspectos médico‐biológicos. Servirán para que el alumno investigue bibliografía actualizada, aprenda a exponer sus ideas, dialogar y discrepar con terminología científica, integre conocimientos y aprenda a concluir coherentemente. Cada alumno elaborará una carpeta de trabajo con el tema desarrollado, la información bibliográfica y las conclusiones respectivas. 4.3. Prácticas de Laboratorio: El alumno guiado por su profesor podrá realizar experimentos sencillos que lo lleven a explicar y entender los aspectos teóricos de las reacciones químicas. El alumno elaborará de manera individual una carpeta de trabajo con el tema desarrollado, la información, conclusiones y bibliografía respectiva. 6. SISTEMA DE EVALUACIÓN La evaluación del alumno se rige de acuerdo al Reglamento de Evaluación de la Facultad de Medicina: R.R. N° 02698‐CTG del 14.05.01 y modificada con R.R. N° 00553‐R‐02 del 25.01.02. Es continua durante el desarrollo del curso y consiste en: 6.1. Exámenes programados. Teoría: Cuatro exámenes cancelatorios y sus respectivos sustitutorios al final del curso. Seminarios: La nota final es el promedio de las notas de cada seminario; donde se evaluará de forma continua la asistencia participativa, calidad de participación, presentación de artículos y su exposición. Prácticas: La nota final de práctica será el promedio de las notas obtenidas en las prácticas correspondientes donde se evaluará la asistencia, prueba de entrada (10 pasos), la participación activa y esfuerzo personal, y el promedio de las notas de su carpeta de trabajo, las cuales se presentaran en la fechas programadas. 6.4. El sistema de calificación es vigesimal. El medio punto es considerado como un punto a favor del alumno, sólo en el promedio final del curso. 6.5. Habrá dos exámenes de desaprobados, sólo para los exámenes escritos de teoría. Cada alumno podrá rendir hasta dos exámenes siempre y cuando tenga por lo menos dos (02) exámenes aprobados. La nota en estos exámenes no podrá ser mayor al promedio ponderado de las notas obtenidas por los estudiantes que aprobaron el examen correspondiente. Notas inferiores a este promedio conservan su valor. 6.6. Los exámenes que anuló el (los) profesor (es) por encontrar al estudiante en situación dolosa o similar, tendrá un calificativo de cero, sin lugar a sustitución. 6.7. Para aprobar el curso el alumno deberá tener al menos tres exámenes teóricos aprobados y una asistencia a las actividades programadas mayor al 70%. 6.8. La nota promedio final del curso será la suma de: Promedio de los exámenes teóricos : x 0,50 Promedio de las notas de seminario : x 0,25 Promedio de las notas de práctica : x 0,25 6.9. En todos los casos se aplicará la Ley Universitaria y el Reglamento de la Facultad de Medicina, vigentes para el Sistema de Evaluación. 7. BIBLIOGRAFÍA ALLWORTH, W.L. ATKINS, PETER BRADY, JAMES E. BRESNICK, STEPHEN BROWN T.L., LEMAY E. BURNS, RALPH CHANG, RAYMOND. COTTON E. WIKINSON DA SILVA, FRAUSTO FOSTER M.A. HEIN MORRIS HUHEEY, JANES LLOYD, D. MASTERTON W. & SLOWINKY MORTIMER, CHARLES MORRINSON R.T. and BOYD PEARSON D. PINTO CAÑON, G. PONS MUZZO GASTÓN RUSSELL J.B. SYDES P. SOLOMONS J.W SHRIVER ATKINS WHITTEN KENNETH WADE, L.G. YOUNG D. “Estereoquímica y sus aplicaciones en Bioquímica” 2006. “Inorganic Chemistry”. Oxford University. 4ta ed 2000. “Química Básica: Principios y Estructura”. Ed. Limusa, 2da ed. México. “General Chemistry”. 2004. “Química La Ciencia Central”. Ed. Pearson Prentíce Hall Hispanoamericana, 9ra ed. México. “Fundamentos de Química”. 2008. “Química General”. Ed. Mc Graw Hill Interamericana S.A., 7ta ed. México. 2005 “Química inorgánica Avanzada” 5ª.ed. Ed. Mc. Graw Hill. “The biological chemistry of the elements”. “Magnetic Resonante in medicine biology”. “Fundamentos de química”. 2000 Química Inorgánica Ed. Harla. “A first course in organic chemistry”. 2006 “Química General Superior”. Edit. Interamericana. 2006 “Química”. Edit. Iberoamericana. Méjico. 1998. Química Orgánica”. Edit. Fondo Educativo Interamericano. EEUU. 2006 “Técnicas de Laboratorio para el análisis de alimentos”. Edit. Acribia S.A. España. 2006. “Química al alcance de todos”. Ed. Pearson. “Tratado de química física general”. “Química General” 2006 “Mecanismos de Reacción en Química Orgánica. Ed. Reverte. Barcelona. 2007 “Química Orgánica”. Edit. Limusa. “Inorganic Chemistry”. “Química General”. 2007."Química Orgánica" 5a Ed, Pearson. Prentice Hall. Madrid. “Heterocyclic Chemistry”. Páginas del Web para consulta. http://www.whfreeman.com/ochem/INDEX.HTM (Texto Volhardt) http://www.wiley.com/college/chem/Solomons190950 (texto Solomons) http://www.noriega.com. mx (texto de Solomons en español) http://www.acdlabs.com (Para practicar con modelos) Revistas Científicas 9 Mundo científico, hasta el año 2010 9 Investigación y ciencia, hasta el año 2010 9 Science, hasta el año 2010 9 Nature, hasta el año 2010 9 New Scientist, hasta el año 2010 8. INSTRUCCIONES GENERALES. - El ingreso a teorías, seminarios o prácticas tendrán una tolerancia máxima de 10 minutos, después de los cuales se considerará como inasistencia. - La presentación a las prácticas de laboratorio será con mandil y guía de prácticas correspondiente. - Se mantendrá el orden y compostura debida en todas las clases y ambientes. El Departamento Académico de Ciencias Dinámicas como integrante de la Escuela Académico Profesional de Medicina Humana de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos, Decana de América se identifica y hace suyo todo lo expresado en la Misión y Visión de nuestra Institución Matriz y que a continuación publicamos: MISIÓN Somos la comunidad académica de la Universidad Nacional Mayor de San Marcos dedicada a formar profesionales de la salud, capacitar especialistas y prepararlos para la docencia e investigación, buscamos la verdad e interactuamos activamente con inclusión de la diversidad y la pluriculturalidad. Nuestros profesionales del más alto nivel técnico y científico, son integrales, éticos, humanistas, críticos y respetuosos de los derechos humanos y el medio ambiente. Nuestras acciones, ejecutadas dentro del marco de mejoramiento continuo de la calidad educativa, contribuyen a mantener una sociedad saludable para elevar la calidad de vida de la población y lograr el desarrollo sostenible del país. VISIÓN En el año 2011, como integrantes de la Universidad Nacional Mayor de San Marcos, seremos la mejor Facultad de Medicina del país, con una fecunda trayectoria histórica, referentes en el ámbito nacional e internacional en la formación con excelencia académica de profesionales de la salud, lideres en investigación, comprometidos con la sociedad y contribuimos con el desarrollo humano sostenible de nuestra población y la humanidad.