Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura
Anuncio
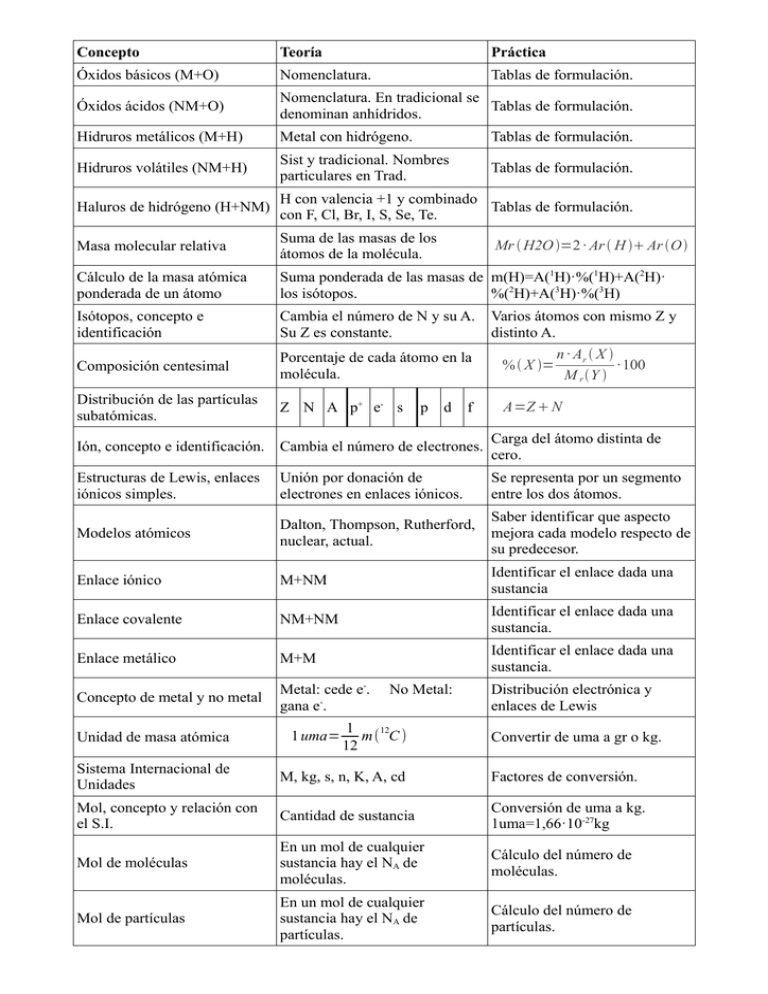
Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura. En tradicional se Tablas de formulación. denominan anhídridos. Hidruros metálicos (M+H) Metal con hidrógeno. Tablas de formulación. Hidruros volátiles (NM+H) Sist y tradicional. Nombres particulares en Trad. Tablas de formulación. Haluros de hidrógeno (H+NM) H con valencia +1 y combinado Tablas de formulación. con F, Cl, Br, I, S, Se, Te. Masa molecular relativa Suma de las masas de los átomos de la molécula. Cálculo de la masa atómica ponderada de un átomo Suma ponderada de las masas de m(H)=A(1H)·%(1H)+A(2H)· los isótopos. %(2H)+A(3H)·%(3H) Isótopos, concepto e identificación Cambia el número de N y su A. Su Z es constante. Composición centesimal Porcentaje de cada átomo en la molécula. % X = Distribución de las partículas subatómicas. Z N A p+ e- s A=Z N p Mr H2O =2 · Ar H Ar O d f Varios átomos con mismo Z y distinto A. n · Ar X · 100 M r Y Ión, concepto e identificación. Cambia el número de electrones. Carga del átomo distinta de cero. Estructuras de Lewis, enlaces iónicos simples. Unión por donación de electrones en enlaces iónicos. Se representa por un segmento entre los dos átomos. Modelos atómicos Dalton, Thompson, Rutherford, nuclear, actual. Saber identificar que aspecto mejora cada modelo respecto de su predecesor. Enlace iónico M+NM Identificar el enlace dada una sustancia Enlace covalente NM+NM Identificar el enlace dada una sustancia. Enlace metálico M+M Identificar el enlace dada una sustancia. Concepto de metal y no metal Metal: cede e-. gana e-. Unidad de masa atómica 1 uma= No Metal: 1 m( 12C ) 12 Distribución electrónica y enlaces de Lewis Convertir de uma a gr o kg. Sistema Internacional de Unidades M, kg, s, n, K, A, cd Factores de conversión. Mol, concepto y relación con el S.I. Cantidad de sustancia Conversión de uma a kg. 1uma=1,66·10-27kg Mol de moléculas En un mol de cualquier sustancia hay el NA de moléculas. Cálculo del número de moléculas. Mol de partículas En un mol de cualquier sustancia hay el NA de partículas. Cálculo del número de partículas. Número de Avogadro 23 N A=6.02 · 10 partículas mol Aplicación en los ejercicios correctamente para su correcta escritura. Magnitudes y unidades en química. Sustancia pura Aquella que no se puede descomponer en otras mediante procedimientos físicos. Sustancia compuesta Aquella que se puede descomponer en otras mediante procedimientos químicos. Mezcla (Sustancia no pura) Combinación de varias sustancias puras, y es posible la separación de éstas mediante procedimientos físicos y mecánicos. Factores de conversión. Factores de conversión. Uso para el cálculo y transformación de las magnitudes. Concepto Teoría Práctica Sales neutras Metal + (F, Cl, Br, I, S, Se, Te) Hojas de formulación. Sales volátiles No metal + (F, Cl, Br, I, S, Se, Te) Hojas de formulación. Hidróxidos Metal + OH-1 Hojas de formulación. Mezcla homogénea Es aquella en la que sus componentes no se perciben a simple vista,ni siquiera con la ayuda del microscopio. Distinguir tipos de mezclas con ejemplos Disolución Mezcla homogénea a nivel molecular o iónico de dos o más sustancias que no reaccionan entre sí. Disolución verdadera Aquellas en las que el tamaño de las partículas del soluto es menor que 10-6mm. Soluto Sustancia que está en menor cantidad en una disolución. Identificar el soluto. Disolvente Sustancia que está en mayor cantidad en una disolución. Identificar el disolvente. Densidad Representación numérica del grado de compactación de una sustancia. d= m V Concentración (en masa) Cantidad de soluto que hay por unidad de volumen de disolución expresado en gramos por litro. C= msoluto g V disolución L Concentración molar (Molaridad) Cantidad de moles de soluto por litro de disolución. M= Molalidad (Opcional) Cantidad de moles de soluto por kilogramo de disolvente. m= Porcentaje en peso Expresión del porcentaje en peso del soluto en la disolución. % peso = Masa de la disolución Masa del soluto más la masa del disolvente. mdisolución =msoluto mdisolvente Porcentaje en volumen Expresión del porcentaje en volumen del soluto en la disolución. % volumen= Teoría cinético-molecular Libro Temperatura Explicación a partir de la teoría cinético-molecular. Presión Explicación a partir de la teoría cinético-molecular. Mezcla heterogénea (concepto) nsoluto V disolución L nsoluto mdisolvente kg msoluto · 100 mdisolución V soluto · 100 V disolución T ( K )=T (ºC )+273,15 Aquella que posee una Distinguir tipos de mezclas con composición no uniforme en la ejemplos cual se pueden distinguir a simple vista sus componentes y está formada por dos o más sustancias, físicamente distintas, distribuidas en forma desigual Suspensiones Tipo especial de mezclas heterogéneas formadas por un sólido disperso en un líquido al que se le denomina fase dispersante. Las partículas dispersas tienen al menos 2·10-4mm. Ejemplo: zumo, pintura, caldo de cocido. Estados de agregación de la materia. Sólido – Líquido – Gas Poder explicarlos a partir de la teoría cinético-molecular. Cambios de estado Puntos de fusión y ebullición. Identificarlos en las gráficas de calentamiento o enfriamiento de una sustancia. Punto de fusión Cambio de sólido a líquido. Identificarlo en una gráfica de calentamiento y distinguir si se trata de una sustancia pura o no. Punto de ebullición Cambio de líquido a gas. Identificarlo en una gráfica de calentamiento y distinguir si se trata de una sustancia pura o no. Solubilidad Máxima cantidad de soluto que puede disolverse en una disolución a una determinada temperatura. Calcular la masa disuelta, la que precipita o la que ha quedado sin disolverse en una disolución. Calentamiento de una sustancia Energía necesaria para aumentar o disminuir la temperatura a una sustancia. Calor latente Calor necesário por unidad de masa para cambiar de estado una sustancia. Calor latente de fusión Calor necesario por unidad de masa para cambiar una sustancia de sólido a líquido. Q=c f ( Jg ) · m Calor necesario por unidad de Calor latente de vaporización masa para cambiar una sustancia de líquido a gas. Q=c v ( Jg )· m Es una constante para cada sustancia y depende del punto. Calor específico Depende de la sustancia y no Calor necesario por unidad de masa y temperatura para aumentar del punto. J o disminuir la energía a una Q=c e · m· (T f −T i ) sustancia. g · ºC Cambios físicos Cambia su aspecto pero no la sustancia. Identificarlo en una reacción química. Cambios químicos Cambia la sustancia. Identificarlo en una reacción química. Reacción química Proceso químico en el cual dos o más sustancias (llamadas reactivos), se transforman en otras sustancias (llamadas productos). ( ¿Qué ocurre en una reacción En una reacción química la ) Explicarlo a partir de la Teoría química? mezcla de los rectivos son inestables cuando hay suficiente energía para romper los enlaces, cinetico-molecular. seguidamente se recombinan los radicales sueltos y forman nuevas sustancias. Choques eficaces No todos los choques provocan rupturas, deben impactar en la dirección adecuada. Energía de ignición Para que una reacción se inicie es Explicarlo a partir de la Teoría necesario que las moléculas se cinetico-molecular. muevan con suficiente energía. Explicar el choque para la ruptura del enlace. Tipos de reacciones químicas Homogéneas y heterogéneas Reacciones homogéneas No cambia el estado de agregación de los productos y reactivos. Reacciones heterogéneas Sí cambia el estado de agregación Identificarlo en una reacción de los productos y reactivos. química. Forma de expresar una reacción química. Mediante una ecuación química. Partes de una reacción química Reactivos → Productos Identificarlo en una reacción química. Reactivos Sustancia que interactúa con otra en una reacción química que da lugar a otras sustancias de propiedades, características y conformación distinta. Identificarlo en una reacción química. Productos Resultado de la transformación de Identificarlo en una reacción los reactivos en una reacción química. química. Clases de reacciones químicas Descomposición, Síntesis, Sustitución, Doble sustitución, Combustión, Neutralización Identificarlas explicando porqué. Síntesis A + B → AB Identificarlas explicando porqué. Descomposición AB → A + B Identificarlas explicando porqué. Sustitución AB + C → CB + A Identificarlas explicando porqué. Doble sustitución AB + CD → AD + CB Identificarlas explicando porqué. Combustión A + O2 → CO2 + H2O Identificarlas explicando porqué. Neutralización Ácido + Base → Sal + H2O Identificarlas explicando porqué. Acción de igualar el número de Ajustar una reacción química átomos en los dos miembros de una ecuación. Identificarlo en una reacción química. Los coeficientes multiplican el compuesto, no modifican su composición. Coeficientes estequiométricos Valor numérico que se le asigna a cada sustáncia en una reacción Escribirlos correctamente. química para igualar el número de átomos. Ley de las proporciones múltiples (Ley de Dalton) Cuando un elemento se combina con otro para dar más de un compuesto, las masas de uno de ellos que se unen a una masa fija del otro están en relación de números enteros y sencillos. Ley de conservación de la masa (Ley de Lavoisier) En una reacción química ordinaria la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos. Nunca pueden aparecer coeficiente fraccionarios en una reacción química. Saber explicar porqué. ∑ mreactivos=∑ m productos Fórmulas y estado físico, núm. de Información que proporciona átomos, núm. de moléculas, núm una ecuación química de moles, volumen relativo, ajustada masas, proporciones. Ley de Avogadro (número) Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. Cálculos químicos Cálculos en reacciones químicas dadas en los productos y reactivos. Cálculos con masas Relación entre el número de moles y la masa. Cálculos con masas relativas Masa molar. Cálculos con moles Relación entre el número de moles y la masa. V Cond. normales=22,4 l V Cond. estándar=24l Cálculos de masas, Mr, n, VCN, VCS, Nº de átomos, Nº de moléculas. m=n · M r M r =∑ mi n= m Mr Cálculos con VCN V CN =n · 22,4 l Cálculos con VCS V CS =n · 24l Cálculos con Nº de átomos Nº átomos=n · N A Cálculos con Nº de moléculas Nº moléculas =n · N A Conversión de unidades de m(C )=12 u a átomo g para el caso del carbono. mol u 6,022 ·10 23 átomos de C 1,66 ·10−24 g de C g g · · =11,997816 de C≡12 de C átomo 1 mol de C 1 uma de C mol mol Concepto Teoría Práctica Ácidos Oxácidos Anhídrido + 1 molécula de agua Tablas de formulación. Iones Poliatómicos Ácido Oxácido sin los protones Tablas de formulación. Ión poliatómico + metal Tablas de formulación. P · V =n · R· T Ejercicios Sales ternarias Ecuación de los gases ideales Molaridad M= nsoluto V disolución L Ejercicios




