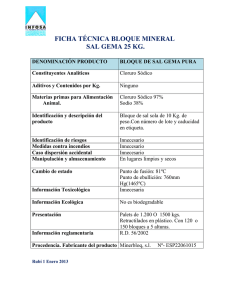
Síntesis del paracetamol
Anuncio
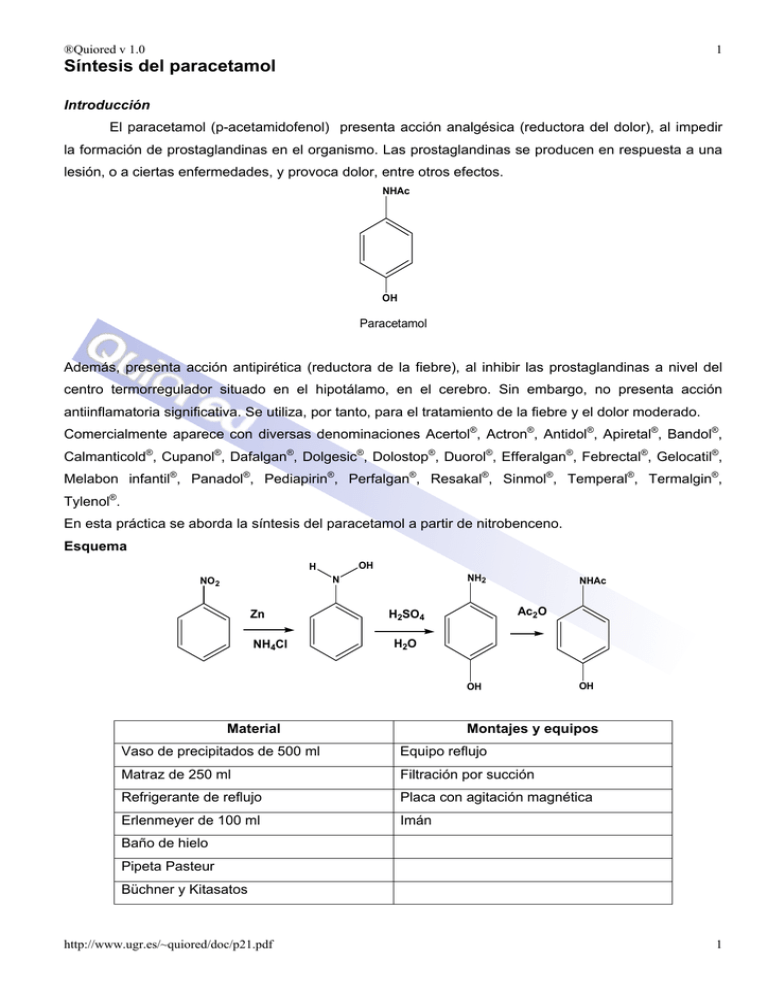
®Quiored v 1.0 1 Síntesis del paracetamol Introducción El paracetamol (p-acetamidofenol) presenta acción analgésica (reductora del dolor), al impedir la formación de prostaglandinas en el organismo. Las prostaglandinas se producen en respuesta a una lesión, o a ciertas enfermedades, y provoca dolor, entre otros efectos. NHAc OH Paracetamol Además, presenta acción antipirética (reductora de la fiebre), al inhibir las prostaglandinas a nivel del centro termorregulador situado en el hipotálamo, en el cerebro. Sin embargo, no presenta acción antiinflamatoria significativa. Se utiliza, por tanto, para el tratamiento de la fiebre y el dolor moderado. Comercialmente aparece con diversas denominaciones Acertol®, Actron®, Antidol®, Apiretal®, Bandol®, Calmanticold®, Cupanol®, Dafalgan®, Dolgesic®, Dolostop®, Duorol®, Efferalgan®, Febrectal®, Gelocatil®, Melabon infantil®, Panadol®, Pediapirin®, Perfalgan®, Resakal®, Sinmol®, Temperal®, Termalgin®, Tylenol®. En esta práctica se aborda la síntesis del paracetamol a partir de nitrobenceno. Esquema OH H NH2 N NO2 Zn NH4Cl NHAc Ac2O H2SO4 H2O OH Material OH Montajes y equipos Vaso de precipitados de 500 ml Equipo reflujo Matraz de 250 ml Filtración por succión Refrigerante de reflujo Placa con agitación magnética Erlenmeyer de 100 ml Imán Baño de hielo Pipeta Pasteur Büchner y Kitasatos http://www.ugr.es/~quiored/doc/p21.pdf 1 ®Quiored v 1.0 2 Reactivos Cantidad Nitrobenceno 8,3 ml NH4Cl 5g Zinc en polvo 12 g Observaciones Cloruro sódico H2SO4 concentrado 4,9 ml Anhídrido acético 3,6 Bicarbonato sódico Acetato de etilo Procedimiento Precauciones: Realizar todos los procesos en vitrina y ajustar las cantidades indicadas en la tabla a las obtenidas por el alumno a) Síntesis de la N-fenilhidroxilamina En un vaso de precipitado de 500 ml se añaden sobre 160 ml de agua , 5 g de cloruro amónico y 8,3 ml de nitrobenceno recién destilado. La mezcla se calienta a 60º agitando vigorosamente y se añaden en pequezas porciones 12 g de zinc en polvo durante unos 10 minutos manteniendo la temperatura entre 60º y 65 º C. Se mantiene la agitación durante 15 minutos más, e inmediatamente se filtra en un Büchner para eliminar el óxido de zinc. El sólido se lava con 20 ml de agua y las aguas de filtrado se transfieren a un erlenmeyer y se saturan con cloruro sódico adicionando aproximadamente 40 g. A continuación se introducen en un baño con hielo hasta la aparición de un precipitado amarillo claro, que se filtra en un Büchner, se pasa unos minutos una corriente de aire y se utiliza en el siguiente paso b) Síntesis del p-nitrofenol A un matraz de 250 ml, enfriado en un baño de hielo, se adicionan 14,8 g de hielo picado, 4,9 ml de ácido sulfúrico concentrado, gota agota, y seguidamente 1,2 g de N-fenilhidroxilamina. A continuación se diluye al mezcla de reacción con 98 ml de agua. Se acopla el refrigerante de reflujo y el conjunto se refluye durante 15 minutos. Al cabo de este tiempo, se lleva hasta temperatura ambiente la reacción, y se neutraliza en frío adicionando una disolución saturada de bicarbonato sódico, se añade cloruro sódico hasta saturación, y se extrae con acetato de etilo (3x20 ml). Se reúnen los extractos orgánicos, se secan con sulfato sódico anhidro y se elimina el disolvente a presión reducida, para obtener un sólido de color rojizo que se emplea en la siguiente etapa c) Síntesis del paracetamol En un erlenmeyer conteniendo 3,3 g de de p-aminofenol y 9 ml de agua, se añaden gota a gota con precaución 3,6 ml de anhídrido acético, agitando constantemente la mezcla. A continuación se calienta en un baño de agua a 60 ºC hasta la disolución completa del sólido. Se mantiene la agitación durante 10 minutos adicionales y seguidamente se enfría la disolución en un baño de hielo http://www.ugr.es/~quiored/doc/p21.pdf 2 ®Quiored v 1.0 3 hasta la aparición de un producto cristalino levemente rosado. Los cristales se filtran en un Büchner y se pesan una vez seco. Se determina el punto de fusión y se calcula el rendimiento global. Bibliografía Quim. Nova. Vol 26, No 2 284-286, 2003 http://www.ugr.es/~quiored/doc/p21.pdf 3