CAPÍTULO VIII VOLUMETRIA REDOX APLICACIONES
Anuncio

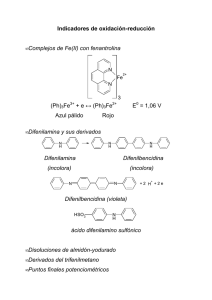
CAPÍTULO VIII VOLUMETRIA REDOX APLICACIONES FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA APLICACIONES REDOX MÉTODOS CON PERMANGANATO Y DICROMATO Estas aplicaciones abarcan sustancias inorgánicas y sustancias orgánicas. Determinación de hierro – Permanganimetría - Dicromatometría Quizá el hierro sea el elemento que se encuentra con mayor frecuencia en el trabajo analítico industrial y por ello su determinación exacta es de interés a la vez práctico y pedagógico. Algunos de los factores que intervienen en la determinación de hierro son comunes a otras valoraciones redox; por ello, una comprensión a fondo de los principios y del razonamiento en que se basa el procedimiento es extremadamente valiosa. La determinación volumétrica de hierro consiste de ordinario en cuatro pasos: 1. Disolución de la muestra de hierro. 2. Reducción cuantitativa de hierro (III) a hierro (II) con un reductor adecuado, seguida de eliminación del exceso del agente reductor. 3. Adición de reactivos especiales, si es necesario, para tener la seguridad de que ocurrirá la reacción apropiada durante la valoración subsiguiente. 4. Y valoración de la solución de hierro (II) con soluciones estándares de permanganato potásico, dicromato potásico o cerio (IV). Disolución de la muestra: Los pasos seguidos para disolver una muestra tendrán que elegirse de modo que sean los adecuados para la muestra de que se trate. En ocasiones se trata de una sal de hierro acuosoluble, pero la mayoría de las muestras que contienen hierro son aleaciones metálicas u óxidos de hierro, que son insolubles en agua. El propio hierro metálico es soluble en ácido nítrico, ácido clorhídrico o ácido sulfúrico y uno u otro de estos disolventes sirve bien para disolver la mayoría de las aleaciones de hierro. Una vez disuelta la muestra, el hierro existirá completa o parcialmente como hierro (III). Reducción de hierro (III) a hierro(II): La valoración final con el oxidante estándar requiere que todo el hierro esté presente como hierro (II). Por ello, el hierro (lII) formado durante la disolución de la muestra ha de ser reducido cuantitativamente a hierro (II) antes de comenzar la valoración. Para efectuar esta reducción se usan varios agentes reductores: sulfuro de hidrógeno, el bióxido de azufre, el cinc metálico, cadmio, plomo y aluminio. Un método simple supone la adición de un exceso muy pequeño de cloruro de estaño (II) a la solución caliente de la muestra de hierro en ácido clorhídrico, seguida de la destrucción del exceso de estaño (II) con mercurio (II). Adición de reactivos especiales: en algunas valoraciones de oxidación-reducción es necesario agregar ciertos reactivos especiales para evitar la reacción del oxidante con otras especies que las sustancias deseadas y para tener la seguridad de que la reacción que se desea transcurre cuantitativamente o que el cambio de color de un indicador en el punto final coincide con el punto de equivalencia teórico. Permanganimetría: Como casi siempre se necesita ácido clorhídrico como disolvente en la preparación de la solución de la muestra, en particular en la disolución de minerales de hierro, existe una fuente potencial de error en la determinación de hierro con permanganato. Para eliminar este error, el método de Zimmermann-Reinhardt empleado consiste en evitar la oxidación inducida del ión cloruro y exige el uso del reactivo de Zimmermann-Reinhardt, contiene sulfato manganoso, ácido fosfórico y ácido sulfúrico. Dicromatometría: En dicromatometría no se produce la interferencia del ión Cl-, como ocurre en la valoración de Fe con KMnO4, debido a que el potencial de oxidación del dicromato no es suficiente para oxidarlo. En esta técnica (a diferencia de la permanganimetría que emplea el reactivo de Zimmermann Reinhardt) se usa una solución sulfo-fosfórica. El ácido sulfúrico da la acidez adecuada para la Capítulo VIIi Volumetria Redox Aplicaciones 2| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA titulación. El ácido fosfórico disminuye la concentración de Fe +3, por medio de la formación de un complejo incoloro, ayudando a que la reacción se complete; elimina el color amarillo del Fe +3 en un medio de ión Cl-. Otra de las diferencias es que el dicromato de potasio no es autoindicador porque si bien tiene poder de tinción, su forma reducida que es el catión crómico no es incolora, sino verde. Por lo tanto necesitan indicadores de óxido-reducción como la difenilamina, ó su sal de sodio. Valoración. La valoración final de hierro (II) puede efectuarse con permanganato, dicromato o cerio (IV). Cada uno de ellos tiene ventajas e inconvenientes, pero se pueden obtener resultados excelentes con los tres valorantes. La valoración habrá de efectuarse muy pronto de la reducción de hierro (III) a hierro (II), porque las soluciones de hierro (II) se oxidan lentamente por el oxigeno atmosférico. Determinación del peróxido de hidrógeno – Permanganimetría El peróxido de hidrógeno reacciona con el permanganato, según la siguiente ecuación: 2 MnO4- + 5 H2O2 + 6 H+ = 5 O2 + 2 Mn+2 + 8 H2O La determinación de la concentración de peróxido de hidrógeno es una volumetría sencilla. El peróxido de hidrógeno se manipula bajo la forma de soluciones acuosas que se llaman comúnmente agua oxigenada. La concentración de dichas soluciones pueden expresarse: a) En gramos de peróxido de hidrógeno por 100 mL de solución. b) En "volúmenes". Comercialmente se usa ésta última forma. Se llama "volúmenes" de agua oxigenada a los mL de oxígeno que libera un mL de la misma, cuando se descompone espontáneamente, según la siguiente ecuación: 2 H2O2 2 H2O + O2 Así por ejemplo: Un agua oxigenada de 10 volúmenes es aquella que al descomponerse, un mL de la misma, según la ecuación anterior, libera 10 mL de O 2. MÉTODOS EN LOS QUE INTERVIENE YODO El elemento yodo existe en varios estados de oxidación analíticamente importantes y que están representados por especies tan conocidas como yoduro, yodo (o ión triyoduro), monocloruro de yodo, yodato y peryodato. Los dos estados de oxidaciones inferiores, a saber, yoduro y yodo (o ion triyoduro). El potencial normal para la semirreacción I2 + 2 e- 2 I- (Eº= + 0,535 v) es bastante menor que para cualquiera de los tres agentes oxidantes examinados anteriormente (permanganato de potasio + 1,51 y dicromato de potasio + 1,33) y ocupa una posición que casi esta en el centro de un cuadro de potenciales normales. No obstante, el ion triyoduro es un agente oxidante suficientemente bueno para reaccionar cuantitativamente con buen número de reductores fuertes como el cloruro estannoso, ácido sulfuroso, sulfuro de hidrógeno y tiosulfato de sodio , que reaccionan cuantitativa y rápidamente con el iodo aún en solución ácida. Con reductores algo más débiles como arsénico trivalente y antimonio trivalente, la reacción es cuantitativa solamente cuando la solución se mantiene neutra o muy débilmente ácida. El potencial normal de oxidación de yodo - yoduro es independiente del pH de la solución, siempre que el pH sea menor que 8; a pH más alto el yodo reacciona con los iones oxhidrilo dando yoduro e hipoyodito, extremadamente inestable; el hipoyodito se transforma rápidamente en yodato y yoduro, por oxidación-reducción (dismutación). I2 + 2 OH- I- + IO- + H2O 3 IO- 2 I- + IO3Mediante la regulación apropiada del pH de la solución, es posible efectuar tanto las yodimetrías como las yodometrías. Por ej. en la reacción arsenito- arseniato: HAsO2 + I2 + 2 H2O H3AsO4 +2 H+ + 2 ILa reacción es reversible. Para valores de pH comprendidos entre 4 y 9, el arsenito puede titularse con solución de yodo. Sin embargo, en soluciones fuertemente ácidas, el arseniato se Capítulo VIIi Volumetria Redox Aplicaciones 3| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA reduce a arsenito y se pone en libertad el yodo. En la titulación con solución de tiosulfato de sodio, el yodo se elimina y la reacción va de derecha a izquierda. Se han ideado dos clasificaciones de los métodos redox en que se utiliza esta semirreacción. En los llamados métodos yodimétricos, una solución de triyoduro, o de yodo disuelto en yoduro potásico, sirve como agente oxidante estándar para sustancias reductoras. Los procedimientos en los cuales se forma triyoduro por reacción de ion yoduro en exceso con algún agente oxidante; seguida de la valoración del ion triyoduro con una solución estándar de tiosulfato sódico. Estas técnicas indirectas se designan comúnmente métodos de análisis yodo-métricos y se destinan a la determinación de sustancias que por si mismas son agentes oxidantes fuertes. El punto final de la valoración yodimétrica está señalado por la primera aparición permanente de yodo libre (triyoduro) en el vaso de valoración y, en un método yodométrico, por la desaparición final de yodo libre. Determinación del punto final: Almidón. En los métodos analíticos en que interviene yodo no son necesarios los indicadores redox normales, porque se dispone de almidón, un indicador interno sensible que experimenta una interacción enormemente específica con yodo. El almidón no ha de estar presente en la solución que se valora hasta que la concentración de yodo libre sea bastante baja, pues grandes cantidades causan coagulación de almidón y promueven su descomposición . Así la solución del indicador almidón no habrá de agregarse hasta tanto que no se llegue exactamente antes del punto final de la valoración en un método yodométrico. Este punto puede determinarse por una valoración previa aproximada o, en la mayoría de los casos, por la intensidad del color natural de yodo o triyoduro en la solución. En una valoración yodimétrica con solución estándar de triyoduro, el indicador almidón puede agregarse al comienzo, pues en el erlenmeyer no existe yodo o ion triyoduro hasta que no se Ilega al punto final. Determinaciones Iodométricas Determinación de cobre Cuando se agrega yoduro potásico en exceso a una solución acídica de cobre (II), ocurren simultáneamente dos reacciones. Primero, el cobre (II) oxida yoduro a ion triyoduro y se reduce a cobre (I). Segundo, el cobre (I) reacciona de inmediato con yoduro y forma un precipitado blanco de yoduro de cobre (I). Se pueden combinar estos dos procesos en la reacción total 2 Cu+2 + 5 I- = 2 CuI(s) + I3- Eº= + 0,32 v Por valoración del triyoduro con una solución estándar de tiosulfato sódico se pueden lograr determinaciones exactas de cobre en muy diversas muestras, entre ellas latones y otras aleaciones El éxito de este método para la determinación de cobre estriba grandemente en la insolubilidad del yoduro de cobre. Numerosos oxidantes pueden determinarse por yodometría, como por ej. sales cúpricas. En este caso el Cu+2 al actuar sobre el KI se reduce a Cu + liberándose una cantidad de I2 que guarda una relación estequiométrica con la sal cúprica que reaccionó: 2 CuSO4 + 4 KI = I2 + 2 CuI + 2 K2SO4 El iodo liberado se titula en una segunda etapa con Na 2S2O3 I2 + 2 Na2S2O3 = 2NaI + Na2S4O6 Del gasto de tiosulfato de sodio se calcula la sal cúprica en forma indirecta: * si la sal cúprica corresponde al iodo liberado, el iodo liberado corresponde a los mL de tiosulfato gastado, entonces la sal cúprica corresponderá a los mL de tiosulfato gastado. La relación fundamental para el cálculo se obtiene relacionando los equivalentes. Si bien el tiosulfato de sodio no reaccionó en ningún momento con la sal cúprica, como el tiosulfato de sodio es reductor y la sal cúprica oxidante (Cu+2 + e- = Cu+) podemos deducir su equivalente. La relación cuando el iodo se titula con solución de tiosulfato de sodio 0,1 N es: 1000 mL de Na2S2O3 0,1 N reducen 0,1 eq de Cu 1000 mL de Na2S2O3 0,1 N reducen 0,1 eq de CuSO4 . 5 H2O La valoración yodométrica de sales cúpricas puede resumirse de la siguiente manera: * Hacer reaccionar la sal cúprica con KI Capítulo VIIi Volumetria Redox Aplicaciones 4| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA * Titular el yodo liberado en la reacción anterior con solución de Na2S2O3 valorada. Pero antes de la titulación se debe cambiar la acidez sulfúrica por acidez acética. Como la sal cúprica tiene como impureza Fe +3 el segundo acondicionamiento consiste en bloquear este catión, porque de lo contrario se libera I2 por oxido-reducción con el Fe dando un resultado erróneo. 2 Fe+3 + 6 KI = I2 + 2 FeI2 + 6 K+ esta cantidad de iodo al titular con tiosulfato de sodio introduce un error El Fe+3 se acompleja con fluoruro de amonio o ácido fosfórico, formándose el ion complejo que carece de acción oxidativa sobre el KI. Determinaciones yodimétricas Determinación de sulfitos Numerosos reductores pueden valorarse por yodimetría como por ej. SO 2, SO3-2 y HSO3-. Todos estos reductores al actuar como tales se oxidan a SO 4-2. La valoración se efectúa en medio sulfúrico y las semireacciones correspondientes son: SO2 + 2 H2O - 2 e- = SO4-2 + 4 H+ mEq SO2 = mM/2 SO3-2 + H2O - 2 e- = SO4-2 + 2 H+ mEq Na2SO3 = mM/2 Al titular con yodo las oxido-reducciones son: I2 + 2 e - = 2 I - I2 + 2 e - = 2 I - SO2 + 2 H2O - 2 e- = SO4-2 + 4 H+ I2 + SO2 + 2 H2O = 2 I- + SO4-2 + 4 H+ SO3-2 + H2O - 2 e- = SO4-2 + 2 H+ I2 + SO3-2 + H2O = 2 I- + SO4-2 + 2 H+ I2 + SO2 + 2 H2O I2 + Na2SO3+ H2O = 2 HI + H2SO4 = 2 HI + Na2SO4 Las determinaciones pueden realizarse por técnica directa o por técnica indirecta por retorno * Técnica directa: se valoran agentes reductores y para ello se emplea como titulante una solución de yodo en medio sulfúrico. Esta técnica tiene el inconveniente que da resultados bajos en la titulación. Esto se debe a: a) pérdidas de SO2 b) oxidación del SO2 con el oxígeno del aire c) reducción con el HI (obtenido en la reacción implicada en la titulación) *Técnica indirecta por retorno: se coloca en el erlenmeyer un volumen exacto de solución de yodo, se acidifica el medio con ácido sulfúrico. Posteriormente se adiciona la muestra problema. El exceso de yodo se titula por retorno con solución de tiosulfato de sodio. Casi al final de la titulación, cuando la solución presenta débil coloración amarilla (por el yodo que queda sin reaccionar), se agrega la solución de almidón (indicador). De esta manera la solución se torna color azul y se continúa titulando con tiosulfato de sodio hasta desaparición del color azul. Capítulo VIIi Volumetria Redox Aplicaciones 5| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA APLICACIONES PERMANGANATO DE POTASIO DIRECTAS EN MEDIO ÁCIDO Fe (II) C2O4H2 C2O4–2 –1 AsO2 (As+3) [Fe (CN)6] –4 H2O2 BaO2 NO2– BO2– SO3–2 Mo+3 Sn (II), Te (IV), U(IV) INDIRECTAS EN MEDIO ÁCIDO Ca como C2O4Ca Cu como CuSCN K como K2NaCo(NO2)6 Na como NaZn(UO2)3(C2H3O2)9.6H2O Fe (III) previa reducción [ Fe (CN)6]-3 previa reducción POR RETORNO EN MEDIO ÁCIDO EN MEDIO NEUTRO O ALCALINO C2O7–2 Ce+IV NO3– S2O6–2 Se (IV) Se (III) – +2 MnO4 etc. al agregar Fe en exceso Compuestos orgánicos (oxidados a CO2 y H2O) NO3– CIO– CIO3– al agregar U+2 en exceso Mn+2 MnO2 PbO2 ; MnO2 al agregar H2C2O4 en exceso IODIMETRÏA COMPONENTE Tiosulfato Sulfuro Arsénico Ácido sulfuroso y sulfitos Estaño Hidrazina REACCIÓN QUÍMICA 2 S2O3--2 + I2 H2 S + I2 AsO2– + 4 OH- + I2 I2 + H2SO3 + H2O Sn+2 + I2 N2H4 + 2 I3 IODOMETRÍA COMPONENTE Hipoclorito Cloro ( también bromo) Clorato (también bromato) Iodato Hierro ( III) Dicromato ( También cromato) Permanganato Peróxido de hidrógeno Cobre ( II) Talio ( III) Oro (III) Arsénico (V) Peryodato Antimonio (V) Dióxido de manganeso Peroxo-sales (ej. k2S2O6) Nitrito Ioduro Capítulo VIIi Volumetria Redox Aplicaciones S4O6-2 + 2 I2 H+ + 2 I- + S AsO4–3 + 2 I- +2 H2O 2 HI + H2SO4 Sn+4 + 2 IN2 + 4 HI REACCIÓN QUÍMICA ClO- + I- + H+ I2 + Cl- + H2O Cl2 + 2 I I2 + 2 Cl+ ClO3 + 6 I + 6 H Cl- + 3 I2 + 3 H2O + IO3 + 5I + 6 H 3I2 + 3 H2O +3 +2 2 Fe + 2I 2 Fe + I2 Cr2O7-2 + 6I- + 14 H+ 2 Cr+3 +3 I2 + 7 H2O + 2 MnO4 + 10I + 16 H 2 Mn+2 + 5 I2+ 8 H2O + H2O2 + 2 I + 2H I2 + 2 H2O 2 Cu+2 + 4 I2 ICu Tl+3 + 3 ITlI + I2 +3 Au + 3 I Aul + I2 AsO4-3 + 2 I- + 2 H+ AsO3-3 + I2 + H2O + H 5IO6 + 7 H + 2 I 4 I2+ 6H2O HSb(OH)6 + 2 I- + 7 H+ SbO+ + 5 H2O + I2 + MnO2 + 2 I + 4 H 2 I2+ Mn +2 + 2 H2O -2 S2O8 + 2 I 2 SO4-2 + I2 + 2HNO2 + 2 I + 2 H 2NO + I2 + 2 H2O I- + 3 Cl2 + 3 H2O IO3- + 6Cl- + H+ IO3- + 5 I- + 6 H+ 3 I2+ 3 H2O 6| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA GUÍA TEÓRICA APLICACIONES REDOX 1) Complete el siguiente cuadro estableciendo las diferencias entre los métodos: DETERMINACIÓN DE HIERRO POR DISTINTOS MÉTODOS PERMANGANIMETRÍA DICROMATOMETRÍA Preparación de la muestra Fundamento Disolusión Reducción Adición de reactivos especiales Valorante Indicador Solución auxiliar (justificación) 2) En la determinación de agua oxigenada mediante permanganimetría: a) ¿Cómo se puede expresar la concentración de las soluciones acuosas de peróxido de hidrógeno? b) Definir volúmenes de agua oxigenada. Escribir la ecuación correspondiente. c) Indicar los cálculo matemáticos para calcular los volúmenes de agua oxigenada mediante los métodos directo e indirecto? Capítulo VIIi Volumetria Redox Aplicaciones 7| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA 3) Complete el siguiente cuadro estableciendo las diferencias entre los métodos: 1- 2- IODIMETRÍA 3- IODOMETRÍA Fundamento Analítos Valorante Soluciones auxiliares Indicador Momento de agregado del indicador Punto final Semireacciones Capítulo VIIi Volumetria Redox Aplicaciones 8| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA TRABAJO PRÁCTICO Nº 8 APLICACIONES DE VOLUMETRÍAS DE OXIDO – REDUCCIÓN PERMANGANIMETRÍA - DICROMATOMETRÍA - YODIMETRÍA YODOMETRÍA Entre las Volumetrías Redox más utilizadas tenemos: PERMANGANIMETRIA: Conjunto de procedimientos volumétricos por los cuales se determinan reductores empleando como titulante una solución valorada de permanganato de potasio en medio ácido. DICROMATOMETRIA: Conjunto de procedimientos volumétricos por los cuales se determinan reductores utilizando dicromato de potasio, como solución valorada en medio ácido. YODIMETRIA: Conjunto de procedimientos volumétricos por los cuales se determinan reductores empleando una solución valorada de yodo, en medio ácido. YODOMETRÍA: Conjunto de procedimientos volumétricos por los cuales se determinan oxidantes en base al siguiente proceso que comprende dos fases: a) El oxidante a determinar se hace reaccionar con una cantidad de KI, que sea excesiva con respecto a la requerida en la oxirreducción con el oxidante. Se libera una cantidad de yodo que guarda relación estequiométrica con la cantidad de oxidante. b) El yodo liberado se titula, empleando una solución valorada de tiosulfato de sodio. PERMANGANIMETRÍA A) DETERMINACIÓN DE HIERRO - METODO DE ZIMMERMAN REINHARDT Una de las aplicaciones más importantes de las titulaciones con permanganato es la determinación de hierro. Los principales minerales de hierro son los óxidos y los óxidos hidratados: la mematita, Fe2O3 ; la magnetita, Fe3O4 ; la goetita, Fe2O3.H2O y la limonita, 2Fe2O3 . 3H2O. El carbonato FeCO3 (siderita) y el sulfuro, FeS (pirita), son de menor importancia. El ácido clorhídrico es el mejor ácido para disolver estos minerales. Los óxidos hidratados se disuelven con rapidez, mientras que la magnetita y la hematita se disuelven más bien lentamente. Antes de la titulación con permanganato, cualquiera sea la cantidad de hierro presente, en forma de hierro (III) se debe reducir a hierro (II). La reducción se puede hacer con cloruro de estaño (II). El cloruro se adiciona a la solución caliente de la muestra y la reducción se nota con la desaparición del color amarillo del ion hierro (III): Sn+2 + 2 Fe+3 Sn+4 + 2 Fe+2 Para asegurar que se complete la reducción se adiciona un ligero exceso de cloruro de estaño (II). Este exceso se debe remover o reaccionará con el permanganato en la titulación. Con este propósito la solución se enfría y se le adiciona con rapidez cloruro de mercurio (II) para oxidar el exceso de ion estaño (II): 2 HgCl2 + Sn+2 Hg2Cl2(s) + Sn+4 + 2 Clblanco El precipitado de cloruro de mercurio (I) (calomel) es pequeño y no interfiere en la titulación. No obstante, si se adiciona un gran exceso de cloruro de estaño (II) , el cloruro de mercurio (I) puede reducirse posteriormente a mercurio libre: Hg2Cl2(s) + Sn+2 Capítulo VIIi Volumetria Redox Aplicaciones 2 Hgº + 2 Cl- + Sn+4 9| FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA negro El mercurio, que en estas condiciones se produce finamente dividido, ocasiona que el precipitado aparezca de color gris a negro. Si el precipitado es oscuro se debe descartar la muestra, ya que el mercurio en este estado se oxidaría durante la titulación. La tendencia a la reducción adicional del Hg2Cl2, se disminuye si la solución se enfría y el HgCl2 se adiciona con rapidez. Por supuesto que si se añade insuficiente SnCl2 no se obtendrá el precipitado de Hg2Cl2, y en tal caso la muestra se debe descartar. Cuando se valora Fe (II) en ácido HCl con permanganato, además de la oxidación deseada de Fe (II), se oxida el ión cloruro, existiendo una fuente potencial de error en la determinación. Un método para eliminar este error consiste en evitar la oxidación del Cl - usando el reactivo de Zimmermann-Reinhardt (ác. sulfúrico, sulfato manganoso, ác. fosfórico). El ácido sulfúrico da la acidez necesaria para la titulación. El sulfato manganoso disminuye el potencial de oxidación del permanganato y actúa como catalizador positivo aumentando la velocidad de reducción del permanganato. El ácido fosfórico disminuye el potencial de oxidación del sistema Fe +3– Fe+2, aumentando el poder reductor del ión Fe +2 y elimina el color amarillo del Fe +3 en un medio de ión Cl-, por formación de un complejo férrico-fosfato incoloro. 2 KMnO4 + 10 FeCl2 + 8 H2SO4 2 MnSO4 + 6 FeCl3 + Fe2(SO4)3 + 2 KCl + 8 H2O B) DETERMINACIÓN DE AGUA OXIGENADA El peróxido de hidrógeno se manipula bajo la forma de soluciones acuosas que se llaman comúnmente agua oxigenada. La concentración de dichas soluciones pueden expresarse: a) En gramos de peróxido de hidrógeno por 100 mL de solución. b) En “volúmenes”. Comercialmente se usa ésta última forma. Se llama “volúmenes” de agua oxigenada a los mL de oxígeno que libera un mL de la misma, cuando se descompone espontáneamente, según la siguiente ecuación: 2 H2O2 2 H2O + O2 2x 34 g 22,4 L -2e- 68 g de H202 ---------------------------- 22400 mL de O2 0,03 g de H202------------------------------ x = 0,03 g x 22400 mL = 9,88 mL 10 volúmenes 68 g 3 g % H202 10 volúmenes Experimentalmente, se comprobó que esta expresión es válida para tener equivalencia entre g%mL y volúmenes. Así por ejemplo: un agua oxigenada de 10 volúmenes es aquella que al descomponerse, un mL de la misma, según la ecuación anterior, libera 10 mL de O 2; un agua oxigenada de 20 volúmenes, es aquella que al descomponerse, un mL de la misma, libera 20 mL de O 2 y así en las otras concentraciones. Todas las soluciones de agua oxigenada, cuando se van a analizar se diluyen, aún el agua oxigenada de 10 volúmenes, pues se trabaja con soluciones de KMnO 4 diluidas, de esa manera se observa un cambio de color del permanganato de potasio. El peróxido de hidrógeno reacciona con el permanganato, según la siguiente ecuación: 2 MnO4- + 5 H2O2 + 6 H+ = 5 O2 + 2 Mn+2 + 8 H2O La determinación de la concentración de peróxido de hidrógeno es una volumetría sencilla. Ejemplo: Titulando 10 mL de agua oxigenada dilución 50 veces, se han gastado 12,5 mL de permanganato de 0,1 N. Expresar la concentración de agua oxigenada de la solución original en g % mL y volúmenes en forma directa e indirecta. 1) Sacar equivalente del agua oxigenada: Capítulo VIIi Volumetria Redox Aplicaciones H2O2 - 2 e- O2 Dilución: 50 veces = (1+49)= (1:50) 10 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA mM = 34 g mEq. = 17 g 2) Aplicar la relación fundamental para expresar el resultado en g % mL. OX 1000 mL KMnO4 0,1 N 12,5 mL KMnO4 0,1N En 10 mL M (1+49) hay En 100 mL M (1+49) hay 1,7 g de H2O2 x = 0,02126 g H2O2 0,02126 g H2O2 x = 0,2126 g H2O2 y multiplicando por 50, debido a la dilución que se hizo, se tiene: 0,2126 x 50 = 10,63 g % mL H2O2 3) Aplicar la relación fundamental para expresar los volúmenes en forma directa: 1000 mL KMnO4 0,1 N 12,5 mL KMnO4 0,1 N En 10 mL M H2O2 En 1 mL M H2O2 OX liberan 560 mL O2 x = 7 mL O2 7 mL O2 x = 0,7 mL O2 y multiplicando por 50, por la dilución que se hizo, se tiene: 0,7 x 50 = 35 volúmenes Nota: En la segunda regla de tres, se lleva a la unidad (1 mL), por concepto de volúmenes. Recordar que en los demás problemas en este paso se lleva a 100 ó 1000 mL, según lo que nos pida el problema. 4) Otra forma de expresar los volúmenes, es en forma indirecta, según la relación: Entonces: 3 g % mL equiv. 10 volúmenes 10,63 g % mL x35,4 = volúmenes 3 g % mL 10 volúmenes DICROMATOMETRÍA Determinación de hierro – Dicromatometría El conjunto de oxidimetrías por las cuales se determinan reductores empleando como titulante una solución valorada de dicromato de potasio en medio ácido, se llama dicromatometría. El K2Cr2O7 (mM= 294,21) es droga patrón primario y un oxidante fuerte, actúa exclusivamente en medio ácido. El ácido preferido es el H2SO4, pero también puede usarse HCl 1 - 2 N. Cr2O7-2 + 6 e- + 14 H+ = 2 Cr+3 + 7 H2O color verde tanto como las de permanganato o las de cerio Las soluciones deanaranjado dicromato no se han color utilizado (IV) en los procedimientos analíticos porque no es un oxidante tan fuerte y por la lentitud de algunas de sus reacciones. Las dicromatometrías necesitan indicadores de óxido reducción como: difenilamina, difenilaminsulfato de sodio, etc. El dicromato de potasio no es autoindicador porque si bien tiene poder de tinción, su forma reducida, el catión crómico, no es incolora, sino verde. Su principal aplicación ha sido la titulación de hierro que consiste en llevar todo el hierro al estado ferroso, para valorarlo con dicromato de potasio en medio ácido. K2Cr2O7 + 6 FeCl2 + 7 H2SO4 = Cr2(SO4)3 + 4 FeCl3 + K2SO4 + Fe2(SO4)3 + 7 H2O En dicromatometría no se produce la interferencia del ión Cl-, como ocurre en la valoración de Fe con KMnO4, debido a que el potencial de oxidación del dicromato no es suficiente para oxidarlo de allí que en esta técnica (a diferencia de la permanganimetría que emplea el reactivo de Zimmermann - Reinhardt) se usa una solución sulfo-fosfórica. El ácido sulfúrico da la acidez adecuada para la titulación. El ácido fosfórico disminuye la concentración de Fe +3, por medio de la formación de un complejo incoloro, ayudando a que la reacción se complete; elimina el color amarillo del Fe +3 en un medio de ión Cl-. Capítulo VIIi Volumetria Redox Aplicaciones 11 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA IODIMETRÍA DETERMINACION IODIMETRICA DE SULFITOS O ANHÍDRIDO SULFUROSO Se llama iodimetría al conjunto de oxidimetrías por las cuales se determinan reductores empleando para ello una solución valorada de yodo 0,1 N. Numerosos reductores pueden determinarse por yodimetría, Damos como ejemplos la determinación yodimétrica de sulfitos y anhídrido sulfuroso. La valoración se realiza en medio sulfúrico y las semiecuaciones que expresan la acción reductora de SO 2, SO3-2 y HSO3- son las siguientes: SO2 + 2 H2O -2e- SO4-2 + 4 H+ SO3-2 + H2O -2e- SO4-2 + 2 H+ HSO3 + H2O -2e SO4-2 + 3 H+ Acoplando las semiecuación de la acción oxidativa del yodo a las semiecuaciones anteriores se tiene la ecuación, en cada caso, de la oxidorreducción aprovechada en la titulación. Para ejecutar las valoraciones yodimétricas se siguen dos técnicas: la directa y por retorno. Técnica Directa Consiste en la oxidación de los sulfitos o anhídrido sulfuroso en medio ácido, a sulfatos mediante una solución valorada de yodo. SO3= + H2O - 2e- SO4= + 2H+ I2 + 2e- 2INa2SO3 + H2O + I2 Na2SO4 + 2 HI SO2 + 2H2O -2e- SO4= + 4H+ I2 +2e- 2ISO2 + 2H2O + I2 H2SO4 + 2 HI Nota: La técnica directa, proporciona resultados bajos, porque se producen pérdidas de SO 2; por oxidación con el O 2 del aire y por oxirreducción con el HI formado en la reacción fundamental. Para obtener resultados más altos se puede seguir la técnica indirecta, que implica un método por retorno. Técnica por retorno 1. Descargar con bureta un exceso de solución valorada de yodo. Agregar el medio ácido y llevar a 100 mL con agua destilada. 2. Dejar caer el analito desde pipeta aforada con el pico lo más próximo a la solución del erlenmeyer. 3. El exceso de yodo se titula por retorno con solución de tiosulfato de sodio. Hacia el final de la titulación se agrega el almidón. Continuar el goteo de tiosulfato de sodio hasta desaparición de la coloración azul. IODOMETRÍA Se llama Yodometría al conjunto de procedimientos volumétricos por los cuales se determinan oxidantes en base a un proceso que consta de dos fases: - En la primera fase, el oxidante problema se hace reaccionar con una cantidad de KI, que sea excesiva con respecto a la requerida para reaccionar cuantitativamente con dicho oxidante problema. Se libera una cantidad de yodo que guarda relación estequiométrica con la cantidad de oxidante. - En la segunda fase del proceso, el yodo liberado, se titula empleando para ello una solución valorada de tiosulfato de sodio o arsenito de sodio. Numerosos oxidantes pueden valorarse por yodometría, por ejemplo; las sales cúpricas. DETERMINACION IODOMETRICA Capítulo VIIi Volumetria Redox Aplicaciones DE COBRE 12 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA La valoración yodométrica de sales cúpricas se resumiría así: 1) Hacer reaccionar la sal cúprica en cuestión con yoduro de potasio: si una solución de Cu+2 es tratada con un exceso de IK, todo el Cu +2 es reducido a Cu+, liberándose un átomo de I2 por cada átomo de Cu+2 presente. Debe haber un exceso de KI para asegurar la reacción cuantitativa del ión Cu+2. 2 CuSO4 + 4 KI 2 ICu + 2 K2SO4 + I2 2) Titular el yodo liberado en la reacción anterior, con tiosulfato de sodio valorado: el yodo liberado, el cual guarda relación estequiométrica con el Cu +2, es dosado con solución valorada de Na2S2O3, usando como indicador solución de almidón. Del gasto de Na 2S2O3 valorado se deduce por cálculo el Cu+2 o la sal cúprica en cuestión. 2 Na2S2O3 + I2 2 NaI + Na2S4O6 2 CuSO4 + 4 KI + 2 Na2S2O3 2 ICu + 2SO4K2 + 2 NaI + Na2S4O6 Pero antes de ejecutar estos procesos, tratándose de la valoración de SO 4Cu2 .5H2O, hay que acondicionar el sistema como se explica a continuación: El primer acondicionamiento consiste en cambiar la acidez sulfúrica de la sal cúprica por acidez acética, adecuada a la yodometría. El segundo acondicionamiento consiste en bloquear el Fe+3 que está contenido como impureza. Caso contrario, se liberaría también una cantidad de I2 por oxireducción, falseando el resultado analítico. 2 Fe+3 + 6 KI I2 + 2 FeI2 + 6 K+ Para evitar la acción oxidativa de la impureza férrica se compleja el hierro (III) con fluoruro de amonio. Se forma, al agregarlo, el ion complejo [FeF6 ]-3 que carece de acción oxidativa sobre el KI. De las ecuaciones que anteceden podemos deducir que: 2 Na2S2O3 relación fundamental: I2 1000 mL de Na2S2O3 0,1 N 1000 mL de Na2S2O3 0,1 N Capítulo VIIi Volumetria Redox Aplicaciones 2 Cu+2 de donde si dividimos por 2 y por 10, obtenemos la +2 P.Eq.Cu 10 ó 6,3 g Cu+2 PEq 10 CuSO4 . 5 H2O 24,9684 g CuSO4 . 5 H2O 13 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA EXPERIENCIAS A REALIZAR OBJETIVOS Determinación yodimétrica de sulfitos y determinación yodométrica de cobre. YOD I METRÍA DETERMINACIÓN YODIMETRICA DE SULFITOS O ANHÍDRIDO SULFUROSO Reactivos: Sulfito de Sodio (muestra) Engrudo de almidón Ácido sulfúrico 3 N Iodo 0,1 N Materiales: Pipetas Erlenmeyers Probeta Bureta color caramelo Embudo Vaso de precipitación Técnica: Medir 10 mL de solución problema (sulfitos o SO2) con pipeta de doble aforo y descargarlos en un erlenmeyer. Agregar agua destilada hasta aproximadamente 70 mL y 2 mL de almidón. Cargar la bureta con I2 0,1 N. Medir en la probeta 10 mL de H2SO4 3 N. Verter el ácido a la solución a valorar y titular rápidamente hasta punto final color azul, que no desaparezca por agitación. Leer el gasto y expresar el resultado en g % mL de SO3Na2 . 7H2O y en g % mL de SO2. mM Na2SO3. 7 H2O = 252 g mM SO2 = 64 g Relaciones fundamentales: 1000 mL de solución 0,1 N de I2 3,203 g de SO2 1000 mL de solución 0,1 N de I2 12,6 g de Na2SO3. 7 H2O Cálculos: Capítulo VIIi Volumetria Redox Aplicaciones 14 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA YODOMETRÍA Reactivos: Sulfato cúprico (muestra) Amoníaco (1+1) Acido acético 50% Acido fosfórico o fluoruro de amonio Ioduro de potasio 10 % Tiosulfato de sodio 0,1 N Engrudo de almidón Materiales: Pipetas Erlenmeyers, Probeta Vaso de precipitación Bureta Embudo. Técnica: Tomar la muestra de CuSO4. 5 H2O sólida y triturarla en mortero. Pesar sobre vidrio de reloj, en balanza de precisión y con cuatro cifras decimales 0,2500g. Pasar cuantitativamente a erlenmeyer de 250 mL, disolver con 50-60 mL de agua destilada. En caso de que la muestra sea líquida: medir 10 mL de la muestra (solución de sulfato cúprico pentahidratado, con pipeta de doble aforo y descargarlo en erlenmeyer). Agregar luego NH3 (1+1) gota a gota hasta formación del complejo azul de SO4[Cu(NH3)4]. Diluir con agua destilada a aproximadamente 70 mL. Hervir la solución azul para expulsar el exceso de NH 3, hasta formación de CuO, precipitado negro. Luego agregar 2-3 mL de ácido acético 50 % y continuar calentando, con lo que la solución se torna límpida y ligeramente celeste por salificación del CuO (se forma acetato de cobre). Retirar y enfriar bajo canilla. Los pasos anteriores tienen la finalidad de transformar la acidez fuerte, acidez sulfúrica, en acidez acética (acidez débil) del compuesto de cobre. Agregar a la solución 0,5 mL de ácido fosfórico ó 1 g aproximadamente de NH 4F (que tiene como finalidad acomplejar el Fe+3, una de las impurezas constantes de las sales cúpricas y evitar que interfiera con el IK, liberando I2 que se sumaría al I2 liberado por el Cu+2). Entonces se forma un complejo ferrifloruro muy poco disociado, que no tiene acción oxidativa sobre el KI. Agregar 10 mL de KI solución al 10 %, medidos con probeta. Se forma un precipitado de CuI y aparece una coloración amarillo parduzco que corresponde al yodo liberado en la oxirreducción. Se carga la bureta con Na2S2O3 0,1 N y agitando por rotación el erlenmeyer se deja caer la solución valorada, gota a gota, hasta coloración amarilla débil. Ahora se añaden 2 mL de solución de engrudo de almidón y se continúa la adición de Na 2S2O3 0,1 N hasta desaparición del color azul. Queda un precipitado blanco en el fondo del erlenmeyer que corresponde al ioduro cuproso. El almidón se agrega hacia el final de la titulación, cuando casi todo el I 2 ha reaccionado con el tiosulfato. De este modo el error por adsorción que es proporcional a la concentración de I 2 se reduce a un mínimo desestimable. Leer el gasto y calcular g % mL de Cu y g % mL de sulfato cúprico penta-hidratado. Relaciones fundamentales: 1000 mL Na2S2O3 0,1 N 6,3 g Cu+2 1000 mL Na2S2O3 0,1 N 24,9 g CuSO4 . 5 H2O Cálculos: Capítulo VIIi Volumetria Redox Aplicaciones 15 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA EJERCITACION APLICACIONES REDOX Para recordar 1000 mL Oxidante N x oxidan mEq x Nx analito x V (L) 1000 mL Reductor N x reducen mEq x Nx analito x V (L) 1000 mL KMnO4 0,1 N oxidan 1,7 g H2O2 g%mL Concentración Directa 1000 mL KMnO4 0,1 N oxidan 560 mL O2 Volúmenes 3 g % ≈ 10 V Indirecta Determinación de H2O2 Volúmenes en forma Directa: 2 H2O2 O2 + 2 H2O 2 x 34 g --------- 22,4 L O2 68 g H2O2 liberan 22.400 mL O2 1,7 g --------- x = 560 mL O2 Volúmenes en forma Indirecta: 68 g H2O2 ---------- 22.400 mL O2 0,03 g ---------- x = 9,88 10 EJERCICIOS A RESOLVER 1- muestra de 0,6894 g de un alimento que contiene hierro (p at.= 55,85) es disuelta en ácido reduciéndose a sal de Fe (II). Luego se valora con K2Cr2O7 0,05 N (mM=294,09), gastándose 36,5 mL del mismo. Calcular g%g de Fe en la muestra original. R= 14,80 g%g de Fe. 2- De una muestra de vinos se toman 15 mL, se la analiza por yodimetría gastándose 7,6 mL de I2 0,02N (fc = 0,9910). Calcular: a) g/L de SO2 (mM= 64) b) meq/L de Na2SO3 (mM: 126) R= a) 0,32 g/L b) 10,04 meq/L 3- En un matraz de 250 mL se miden 10 mL de H2O2 (mM= 34) concentrado y se lleva a volumen. Se toman 15 mL de la dilución y se titulan en medio sulfúrico gastándose 19,2mL de KMnO 4 0,02 N (fc= 0,9875). Expresar la concentración de H2O2 ,respecto de la muestra original en: a) g%mL H2O2 R= a)1,07g%mL b) Volúmenes en forma directa e indirecta b) 3,5 V 4- Se desea saber la cantidad de Na2SO3 .7 H2O (mM= 252,2) contenidos en una pulpa de frutas conservada para la elaboración de un dulce. Se toman 20mL de una dilución 1:2 de la muestra, se le agregan 25 mL de I2 0,01 N y al exceso de éste se lo titula con Na2S2O3 0,01 N (fc=1,0204) gastándose 9 mL. Capítulo VIIi Volumetria Redox Aplicaciones 16 | FACULTAD DE CIENCIAS AGRARIAS – U.N.C. Cátedra de Química Analítica Asignatura: QUÍMICA ANALÍTICA Calcular los g%mL de Na2SO3 .7 H2O contenidos en la pulpa original. R= 0,199 g%mL 5- En una muestra de espinaca se desea saber el contenido de ácido oxálico (mM=90). Se tritura una muestra de 5g de vegetal y se disuelve en agua destilada, llevándola a un volumen de 100mL. De esta dilución se toma una alícuota de 10 mL y se titula con KMnO4 0,1N gastándose 3,2mL. Calcular el contenido de ácido oxálico en g/Kg; ppm y meq/Kg. R= 28,8 g /Kg ; 28800 ppm ; 640meq/Kg 6- Un fungicida para tratamiento de semillas es utilizado como CuSO4 5 H2O comercial. Se pesan 15 g del mismo, y se llevan a 500 mL com água destilada. De esta solución se toma una alícuota de 20 mL y se analiza por yodometría gastando 8,5 mL de Na2S2O3 N/50 en la titulación del yodo liberado. Calcular g%g Cu (p. at.=63,57) R=a) 4,503 g%g Cu Capítulo VIIi Volumetria Redox Aplicaciones 17 |