Control Cinetica Quimica _2Nov11_SOLUCIONADO
Anuncio

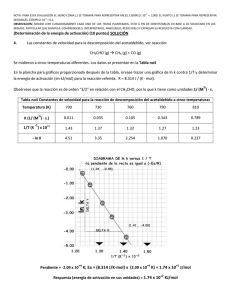
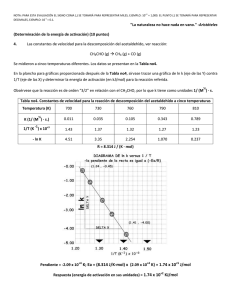
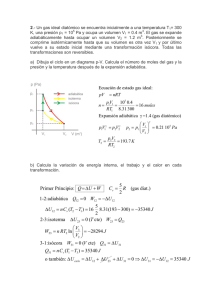
HOJA DE EXAMEN COLEGIO HISPANO INGLÉ INGLÉS Rambla de Santa Cruz, 94 - 38004 – Santa Cruz de Tenerife +34 922 276 056 - Fax: +34 922 278 477 [email protected] Materia: Evaluación: Curso: QUIMICA 1ª 2º Bachillerato Fecha: Alumno: CONTROL de CINETICA QUIMICA 1) Indica, justificando brevemente la respuesta y poniendo ejemplos si lo crees necesario, si son ciertas o falsas las siguientes afirmaciones: a) En cualquier reacción química, todas las concentraciones de los reactivos influyen por igual en la velocidad de reacción. b) Para reacciones diferentes, las unidades de la constante cinética pueden ser diferentes. c) En cualquier reacción química, todos los reactivos desaparecen a la misma velocidad. d) El valor de la velocidad de reacción depende del reactivo utilizado para expresarla. e) Unas posibles unidades de la velocidad de reacción son: mol.L-1.s-1 2) a) b) ¿Cuál será el aumento de velocidad de una reacción en la que se duplica la concentración de reactivo, si la reacción es de segundo orden respecto a él? A 20 °C, la constante de velocidad para la descomposición de una sustancia es 3,2·10-6 s-1, mientras que su valor a 50 °C es de 7,4·10-6 s-1. ¿Calcula la energía de activación de la misma? ¿Podrías decir cuál es el orden total de la reacción? 3) A 600 K, el valor de la constante de velocidad de la descomposición de una sustancia A es: k = 0,55 L mol-1s-1. a) ¿Cuál es la velocidad de descomposición de la sustancia a esta temperatura, si [A] = 3·10-3 mol·L-1? b) Si a 625 K la constante de velocidad es k = 1,50 L mol-1s-1, ¿cuánto vale la energía de activación Ea? c) Fijándote en las unidades de la constante, ¿se puede decir que cinética (su orden) sigue la descomposición de A? 4) La reacción entre cloroformo y cloro: CHCl3 (g) + Cl2 (g) → CCl4 (g) + HCl (g) es de primer orden con respecto al CHCl3 y de orden ½ con respecto al Cl2. Se pide: a) Escribir la ecuación de velocidad para dicha reacción b) ¿Cuál es el orden total de la reacción? c) Indica al menos tres factores que afecten a la velocidad, y explicar en qué sentido la hacen variar. d) Si se añade un catalizador, ¿dónde actúa en la reacción?, ¿qué le ocurre a la energía de activación? ¿por qué? 5) En la reacción 2 NO + 2 H2 → N2 + 2 H2O, a 1100 K, se obtuvieron los siguientes datos:. Calcula el orden de reacción y el valor de la constante de velocidad. 6) OPCIONAL: La reacción A → B es de segundo orden. Cuando la concentración de A es 0,01 M, la velocidad de formación de B es de 2,8·10-4 mol L-1 s-1. a) Calcula la constante de velocidad. b) Si la velocidad de esta reacción se duplica al pasar de 40 °C a 50 °C, calcula la energía de activación del proceso. c) Si la concentración de A desciende desde 10 mol L-1 en el instante inicial hasta 2 moles L-1 a los 50 segundos, calcula la velocidad de desaparición de A. Dato: R = 8,314 J mol-1 K-1 La vida es una obra de teatro que no permite ensayos. Por eso, canta, ríe, llora y vive intensamente cada momento de tu vida….. antes de que el telón baje y la obra termine sin aplausos. Charles Chaplin “La predicción es muy difícil, especialmente si es sobre el futuro” (Niels Böhr) SOLUCIONARIO CONTROL CINETICA QUIMICA 2-Noviembre 2011 Indica, justificando brevemente la respuesta y poniendo ejemplos si lo crees necesario, si son ciertas o falsas las siguientes afirmaciones: a) En cualquier reacción química, todas las concentraciones de los reactivos influyen por igual en la velocidad de reacción. b) Para reacciones diferentes, las unidades de la constante cinética pueden ser diferentes. c) En cualquier reacción química, todos los reactivos desaparecen a la misma velocidad. d) El valor de la velocidad de reacción depende del reactivo utilizado para expresarla. e) Unas posibles unidades de la velocidad de reacción son: mol L-1 s-1 a) FALSO Para una reacción general del tipo aA + bB cC + dD La expresión de la ecuación de velocidad toma la forma Velocidad = k [A]n [B]m Por lo que en el caso más general, en el que n y m sean distintos las variaciones de concentración de A y de B afectarán de forma diferente a la velocidad de reacción. Sólo en el caso en que n y m sean iguales la influencia de ambas concentraciones será la misma. b) VERDADERO Si despejamos la constante cinética k en la ecuación de velocidad, k = Velocidad/([A]n[B]m) veremos que las unidades de k dependen de los valores de n y m. Como estos valores, lo más normal es que sean distintos en distintas reacciones, también lo serán las unidades de k (en el caso particular en que n y m sean iguales, las unidades de k también lo serán) c) FALSO La velocidad de desaparición de los reactivos es proporcional a sus coeficientes estequiométricos, por lo que si en una reacción estos coeficientes son distintos, la velocidad de desaparición también será distinta. Ejemplo: en la reacción N2 + 3H2 2NH3 La velocidad de desaparición del H2 es el triple que la de desaparición del N2, ya que por cada mol que desaparece de H2, desaparecen 3 moles de N2 d) FALSO La velocidad de reacción se define como la variación de la concentración de cualquiera de las sustancias de la reacción por unidad de tiempo, pero para que su valor no varíe con la sustancia elegida, se divide el cociente: ∆[concentración]/Tiempo por el coeficiente estequiométrico En el ejemplo anterior: Vr = - ∆[N2] / T = - 1/3x∆[H2] / T = + 1/2x∆[NH3] / T e) VERDADERO Efectivamente, como la variación de la concentración se mide en moles/litro y el tiempo puede medirse en segundos, las unidades de velocidad de reacción pueden ser: (Moles/litro)/Segundo ¿Cuál será el aumento de velocidad de una reacción en la que se duplica la concentración de reactivo, si la reacción es de segundo orden respecto a él? -2/9- COLEGIO HISPANO INGLES Rambla General Franco, 94 - 38004 – Santa Cruz de Tenerife +34 922 276 056 - Fax: +34 922 278 477 [email protected] A 20 °C, la constante de velocidad para la descomposición de una sustancia es 3,2·10-6 s-1, mientras que su valor a 50 °C es de 7,4·10-6 s-1. ¿Calcula la energía de activación de la misma? ¿Podrías decir cuál es el orden total de la reacción? A 600 K, el valor de la constante de velocidad de la descomposición de una sustancia A es: k = -1 -1 0,55 L mol s . a)Cual es la velocidad de descomposición de la sustancia a esta temperatura, si [A] = 3·10-3 mol·L-1? b) Si a 625 K la constante de velocidad es k = 1,50 L mol-1s-1, ¿cuánto vale la energía de activación Ea? c) Fijándote en las unidades de la constante, .serias capaz de decir que cinética (su orden) sigue la descomposición de A? -3/9- En la reacción 2 NO + 2 H2 → N2 + 2 H2O, a 1100 K, se obtuvieron los siguientes datos:. Calcula el orden de reacción y el valor de la constante de velocidad. -4/9- COLEGIO HISPANO INGLES Rambla General Franco, 94 - 38004 – Santa Cruz de Tenerife +34 922 276 056 - Fax: +34 922 278 477 [email protected] La reacción A → B es de segundo orden. Cuando la concentración de A es 0,01 M, la velocidad de formación de B es de 2,8·10-4 mol L-1 s-1. a) Calcula la constante de velocidad. b) Si la velocidad de esta reacción se duplica al pasar de 40 °C a 50 °C, calcula la energía de activación del proceso. c) Si la concentración de A desciende desde 10 mol L-1 en el instante inicial hasta 2 moles L-1 a los 50 segundos, calcula la velocidad de desaparición de A. Dato: R = 8,314 J mol-1 K-1 OTROS PROBLEMAS (para otros exámenes) En una reacción del tipo: aA + bB → Productos, estudiada experimentalmente en el laboratorio, se obtuvieron los siguientes valores: a) Calcula el orden de reacción respecto del compuesto A, del compuesto B, y el orden de reacción global. b) Calcula la constante de velocidad. c) Calcula la energía de activación si se sabe que la constante de velocidad se multiplica por 74 al subir la temperatura de 300 a 400 K. d) Indica la forma en que la presencia de un catalizador afecta a: la velocidad de la reacción, la energía de la reacción, ∆H, ∆S y ∆G. -5/9- -6/9- COLEGIO HISPANO INGLES Rambla General Franco, 94 - 38004 – Santa Cruz de Tenerife +34 922 276 056 - Fax: +34 922 278 477 [email protected] Se determinó experimentalmente que a la reacción: 2A + B → P, sigue la ecuación de velocidad v = k·[B]2. Contesta de forma razonada y justificada si las siguientes proposiciones son verdaderas o falsas: a) La velocidad de desaparición de B es la mitad de la velocidad de formación de P. b) La concentración de P aumenta a medida que disminuyen las concentraciones de A y B. c) El valor de la constante de velocidad es función solamente de la concentración inicial de B. d) El orden total de la reacción es 3. El estudio experimental de una reacción entre los reactivos A y B ha dado los siguientes resultados: Determina: a) la ecuación de velocidad; b) el valor de la constante de velocidad. -7/9- Completa la siguiente tabla de valores correspondientes a una reaccion: A + B → C, que es de primer orden respecto a A y respecto a B. Explica con orden, claridad y detalle el procedimiento. Considerando el diagrama de energía que se muestra, para la reacción: A → B + C, contesta razonada y justificadamente a las siguientes preguntas: a) ¿Cuál puede ser la causa de la diferencia entre la curva 1 y la 2? b) ¿Para cuál de las dos curvas la reacción transcurre a mayor velocidad? c) ¿Qué les sucederá a las constantes de velocidad de reacción si se aumenta la temperatura? d) ¿La reacción es exotérmica o endotérmica? -8/9- COLEGIO HISPANO INGLES Rambla General Franco, 94 - 38004 – Santa Cruz de Tenerife +34 922 276 056 - Fax: +34 922 278 477 [email protected] -9/9-