Bacterias y hongos
Anuncio
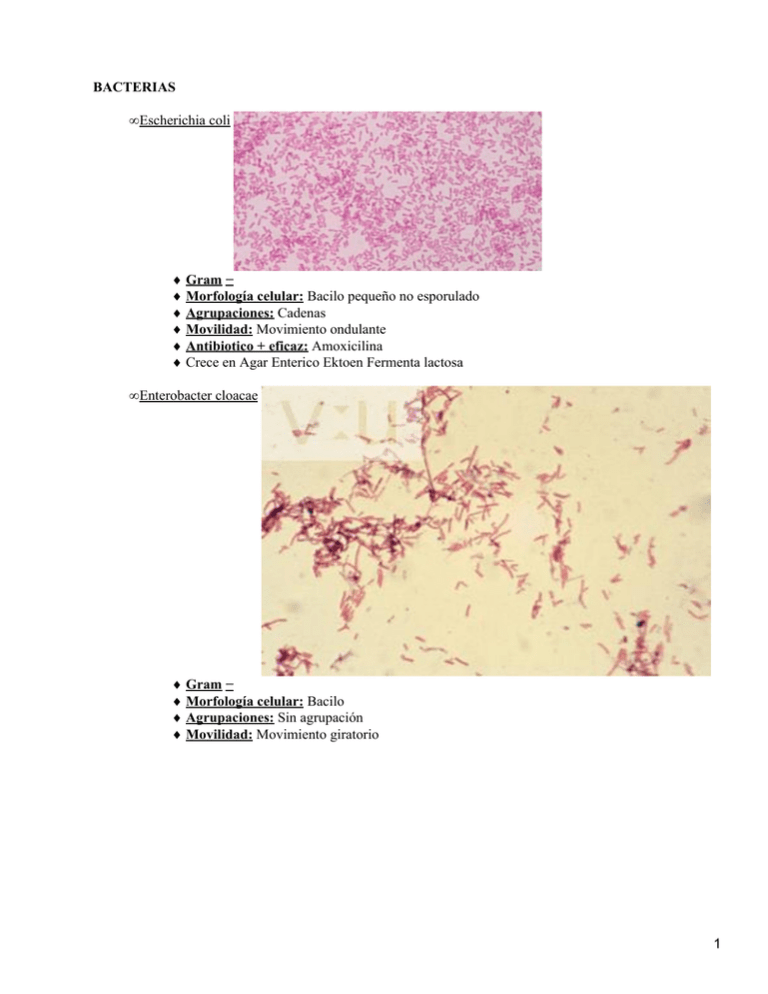
BACTERIAS • Escherichia coli ♦ Gram − ♦ Morfología celular: Bacilo pequeño no esporulado ♦ Agrupaciones: Cadenas ♦ Movilidad: Movimiento ondulante ♦ Antibiotico + eficaz: Amoxicilina ♦ Crece en Agar Enterico Ektoen Fermenta lactosa • Enterobacter cloacae ♦ Gram − ♦ Morfología celular: Bacilo ♦ Agrupaciones: Sin agrupación ♦ Movilidad: Movimiento giratorio 1 • Serratia marcescens ♦ Gram − ♦ Morfología celular: Bacilo pequeño no esporulado ♦ Agrupaciones: ♦ Movilidad: ♦ Crece en Agar Enterico Hektoen Fermenta Lactosa ♦ Degrada Caseina, Tween−80 y DNA • Proteus vulgaris ♦ Gram − ♦ Morfología: Bacilo ♦ Agrupaciones: Parejas ♦ Movilidad: Muy rapidos, movimiento flagelar ♦ Antibiotico + eficaz: Amoxicilina o Kanamicina 2 • Salmonella typhimurium ♦ Gram − ♦ Morfología celular: ♦ Agrupaciones: ♦ Movilidad: ♦ Crece en Agar Glucosa puede vivir con glucosa como unica fuente de carbono ♦ Crece en Agar Enerito Hektoen Reduce el S2O3 a H2S precipita SFe (negro) • Pseudomonas fluorescens ♦ Gram − ♦ Morfología celular: Bacilo ♦ Agrupaciones: ♦ Movilidad: Poca movilidad ♦ Ligero crecimiento en Agar manitol Sal ♦ Crece en Agar Glucosa puede vivir con glucosa como unica fuente de carbono ♦ Crece en Agar Enterico Hektoen no le afectan los acidos biliares • Alcaligenes faecalis 3 ♦ Gram − ♦ Morfología celular: ♦ Agrupaciones: ♦ Movilidad: ♦ Crece en Agar Enterico Hektoen crecimiento leve • Aeromonas hydrophila 4 ♦ Gram − ♦ Morfología celular: Espirilo ♦ Agrupaciones: ♦ Movilidad: ♦ Antibiotico + eficaz: Estreptomicina ♦ Degrada Caseina, Almidon, Twen−80 y DNA 5 • Micrococcus luteus ♦ Gram + ♦ Morfología: coco ♦ Agrupaciones: Tetradas ♦ Movilidad: ♦ Antibiotico + eficaz: Cefalexina ♦ Ligero crecimiento en Agar manitol sal • Bacillus sp. ♦ Gram + ♦ Morfología: Bacilo grande esporulado ♦ Agrupaciones: Cadenas ♦ Movilidad: por vibracion ♦ Antibiotico + eficaz: Cloranfenicol ♦ Degrada Caseina y DNA • Enterococcus faecalis ♦ Gram + ♦ Morfología: Coco ♦ Agrupaciones: Cadenas ♦ Ligero crecimiento en Agar manitol sal 6 • Staphylococcus aureus ♦ Gram + ♦ Morfología: Coco ♦ Agrupaciones: Racimos irregulares ♦ Antibiotico + eficaz: Amoxicilina ♦ Crece en Agar Manitol − Sal HONGOS • Levaduras: ♦ Saccharomyces cerevisiae 7 • Hongos filamentosos: ♦ Penicillum sp. 8 ♦ Aspergillus sp. ♦ Helminthosporium sp. ♦ Pestallotia sp. MEDIOS DE CULTIVO UTILIZADOS: • Definiciones: ♦ Medio sintético o definido: Aquel medio que contiene cantidades conocidas de compuestos químicos. ♦ Medio complejo: Contienen compuestos de composición química poco definida de forma que no podemos precisar qué cantidad exacta y qué especies químicas poseen ♦ Medio líquido (caldo): Suspensiones o soluciones acuosas de los componentes. Los organismos crecen dispersos en el seno del íquido. ♦ Medio sólido (agar): Contiene un agente gelificante que solidifica la solución acuosa, creando un sustrato nutritivo donde se pueden inmovilizar las celulas microbianas. ◊ Crecimiento en césped: Masa uniforme de cultivo superficial. Las células inmovilizadas están muy cercanas ◊ Colonias aisladas: Células inmovilizadas están dispersas Agar−agar: Polisacarido complejo obtenido a partir de algas marinas Agente gelificante más utilizado porque: ◊ Alta resistencia a hidrólisis microbiana ◊ Produce geles transparentes y resistentes a baja concentración 9 ◊ Solidifica a temperaturas inferiores a 45º ♦ Medio semisólido: Baja concentración de agente gelificante, consistencia intermedia entre un medio líquido y n medio sólido. Las células están parcialmente inmovilizadas, pueden desplazarse si poseen amovilidad flagelar activa. ♦ Medio general: Permite el crecimiento de una gran variedad de microorganismos, sin requerimientos especiales para crecer. ♦ Medio enriquecido: Permite el crecimiento de microorganismos con necesidades particulares (sangre, factores de crecimiento etc.) ♦ Medio diferencial: Se le ha incluido componentes que producen un efecto en el medio cuando el organismo realice una determinada actividad, permitiéndonos DIFERENCIAR los microorganismos que pueden realizar esta actividad d lo que no. ♦ Medio selectivo: Debido a su composición y/o condiciones de incubación, el medio selectivo inhibe el crecimiento de un gran número de microorganismos para que pueda crecer uno o pocos microorganismos minoritarios que quedarán selectivados por las condiciones el medio. • TSA: Agar Triptona Soja. ♦ Peptona de caseína 15g/L ♦ Peptona de soja 5 ♦ NaCl 5 ♦ Agar 15 ♦ pH = 7,2 ◊ Medio general, sintético, sólido. ◊ Crecen todas las bacterias utilizadas • Agar Malta: ♦ Glucosa 20 g/L ♦ Extracto de malta 20 ♦ Peptona 1 ♦ Agar 15 ♦ pH = 5,4 . ◊ Medio sintético, sólido. ◊ Selectivo para hongos: ⋅ pH más ácido que para bacterias ⋅ Extracto de malta como componente principal • Caldo inorgánico sintético (CIS) ♦ NaCl 5 g/L ♦ MgSO4 0,2 ♦ NH4H2PO4 1 ♦ K2HPO4 1 ♦ pH = 7,0. ◊ Medio sintético, líquido ◊ Selectivo para organismos no heterótrofos ⋅ Sin compuestos químicos orgánicos ⋅ No crece ningún microorganismo utilizado • Caldo glucosa sales (CGS) ♦ Glucosa 5 g/L ♦ CIS 1 L ♦ pH = 7,0. 10 ◊ Medio sintético, líquido ◊ Selectivo para organismos heterótrofos que tengan la glucosa como UNICA fuente de carbono. ⋅ Unico compuesto quimico organico: glucosa • Caldo extracto de levadura (CEL) ♦ Peptona 5 g/L ♦ Extracto de carne 3 ♦ Extracto de levadura 5 ♦ pH = 7,0. ◊ Medio sintetico, liquido, enriquecido ◊ Tiene muchos nutrientes organicos. • Agar Manitol Sal ♦ Extracto de carne 1 g/L ♦ Peptona de caseína 5 ♦ Peptona de carne 5 ♦ NaCl 75 ♦ D−manitol 10 ♦ Rojo fenol 0,02 ♦ Agar 15 ♦ pH = 7,4 ◊ Medio solido, complejo ◊ Selectivo para bacterias halofilas : Staphylococcus aureus ◊ Diferencial por el rojo fenol : cambia a amarillo si baja el pH (fermentación) • Agar Enterico Hektoen ♦ Proteosa−peptona 12 g/L ♦ Extracto de levadura 3 ♦ Sales biliares 9 ♦ Lactosa 12 ♦ Sacarosa 12 ♦ Salicina 2 ♦ NaCl 5 ♦ NaS2O3 5 ♦ Citrato férrico−amónico 1,5 ♦ Fucsina ácida 0,1 ♦ Azul de bromotimol 0,06 ♦ Agar 15 ♦ pH = 7,5. ◊ Medio solido, complejo ◊ Selectivo para enterobacterias ⋅ Fucsina acida: toxico para gram+ ⋅ Sales biliares: enterobacterias son resistentes a las sales biliares ◊ Diferencial para enterobacterias que metabolicen lactosa, o no. ⋅ Azul de bromotimol cambia de color al acidificarse el medio (lactosa ac. lactico, x ej.) ⋅ NaS2O3 precipita junto con citrato ferrico en presencia de Salmonella pequeños puntos negros en la placa. ◊ Crece E.Coli, S.Marcescens, Salmonella, Pseudomonas (pero no fermentan), A.faecalis (pero no fermentan) 11 • L−Agar ♦ Triptona 10 g/L ♦ Extracto de levadura 5 ♦ NaCl 5 ♦ Agar 15 ♦ pH = 7,0 • Top−Agar ♦ Triptona 10 g/L ♦ KCl 5 ♦ Agar 7 ♦ pH = 7,0. ◊ Medio sintético, semisólido, general. • Agar Mueller−Hinton ♦ Peptona 17,5 g/L ♦ Extracto de carne 5 ♦ Almidón soluble 1,5 ♦ Agar 17 ♦ pH = 7,4. ◊ Medio complejo, sólido, general ◊ Utilizado en antibiograma: • Agar Tween−80 ♦ Peptona 10 g/L ♦ CaCl2 0,1 ♦ NaCl 5 ♦ Tween−80 10 ml ♦ Agar 15 ♦ pH = 7,2. ◊ Medio complejo, sólido. ◊ Diferencial para bacterias que metabolicen Tween−80 (Ac. graso) ◊ Crecen Aeromonas y Serratia. • Agar Caseína ♦ Peptona 10 g/L ♦ NaCl 5 ♦ Extracto de carne 3 ♦ Agar 15 ♦ pH = 7,0. ♦ Una vez estéril y antes de verter en placa, se le añade un 10% de leche descremada. ◊ Medio complejo, sólido ◊ Diferencial para bacterias que metabolicen proteinas ◊ Crecen Serratia, Bacillus y Aeromonas • Agar almidón ♦ Peptona 10 g/L ♦ NaCl 5 ♦ Extracto de carne 3 ♦ Almidón soluble 2 ♦ Agar 15 ♦ pH = 7,0. 12 ◊ Medio complejo, sólido ◊ Diferencial para bacterias que metabolicen polisacaridos ◊ Crecen Aeromonas y Serratia, levemente • Agar DNAsa ♦ Peptona de caseína 15 g/L ♦ Peptona de soja 5 ♦ NaCl 5 ♦ Ácido desoxirribonucleico 2 ♦ Agar 15 ♦ pH= 7,3. ◊ Medio sintético, sólido ◊ Diferencial para bacterias que metabolicen ac. nucleicos ◊ Crecen serratia, Bacillus y Aeromonas • Medio de oxidación −fermentación (O/F) según Hugh y Leifson ♦ Peptona 2 g/L ♦ Glucosa 10 ♦ NaCl 5 ♦ K2HPO4 0,3 ♦ Azul de bromotimol 0,03 ♦ Agar 3 ♦ pH = 7,1. ◊ Medio sintético, semisólido, no selectivo ◊ Diferencial para organismos aerobios y anaerobios ⋅ Indicador: azul de bromotimol ⋅ Color azul: pH básico: • La bacteria no utiliza la glucosa, sino la peptona • Utilización de la peptona liberación de NH4 ! pH ⋅ Color verde: pH neutro: • La bacteria no crece, no metaboliza ningun componente. ⋅ Color amarillo: pH ácido: • La bacteria crece, utilizando la glucosa • Metabolismo de glucosa libera ac. Láctico ! pH ◊ Tubo aerobio/Tubo anaerobio: ⋅ V/V no hay crecimiento. Algunas gram+ no crecen. ⋅ A/A hay siempre crecimiento: Anaerobio facultativo ⋅ A/V no hay crecimiento en anaerobiosis: Aerobio estricto ⋅ Z/V no hay metabolismo de glucosa, sino de peptona ◊ Glucosa en poca cantidad para que no absorba todo el agua • Caldo Rojo Metilo− Voges−Proskauer (MR−VP) ♦ Peptona 7g/L ♦ K2HPO4 5 ♦ Glucosa 5 ♦ pH = 7,0. ◊ Medio sintético, liquido, no selectivo ◊ Diferencial para organismos fermentativos ⋅ RM: determina fermentación acido mixta ⋅ VP: determina fermentación butanodioica TIPOS DE TINCIONES 13 • Tinciones simples: Se utiliza un solo colornte que tiñe por igual a todas las celulas. Se utilizan para observar la morfología, tamaño celular y agrupaciones caracteristicas de las celulas. Dos tipos: ♦ Positivas: El colorante tiñe a la celula; el contraste se realiza con el medio, que será blanco. ♦ Negativas: El colorante tiñe el medio, dejando a las células sin teñir ◊ Azul de lactofenol: Sólo para hongo, colorante vital. ◊ Nigrosina • Tinciones diferenciales: Permiten distinguir entre varios tipos de celulas o entre varios tipos de estructuras de una misma célula en funcion de su respuesta a los colorantes o a la decoloracion. ♦ Tincion de Gram ◊ Primer colorante: violeta cristal ⋅ Gram +: Colorante violeta cristal se queda en la celula no puede traspasar la pared ⋅ Gram −: Colorante violeta cristal se intercambia por alcohol blanco. ◊ Segundo colorante: fucsina basica ⋅ Gram +: violeta+fucsia violeta ⋅ Gram −: blanco+fucsia fucsia ♦ Tincion de cápsulas ◊ Primer colorante: fucsina basica: tiñe todo menos la capsula ◊ Segundo colorante: nigrosina: tiñe el medio capsula queda contrastada en blanco. ♦ Tincion de esporas ◊ Primer colorante: verde de malaquita: tiñe las esporas ◊ Segndo colorante: fucsina basica: tiñe el resto de la celula se observan endosporas dentro de la celula. RECUENTOS MICROBIANOS • Directos: Contar al microscopio las celulas y sacar una media: ♦ NT/nº de cuadrados ♦ Cada cuadrado = 1/5·1/4·1mm = 1/20mm ♦ Superficie = 1/400mm2 ♦ Volumen = 1/400·0,1mm = 1/4000 mm3 ♦ 1mm3 = 10−3cm3 = 10−3 mL ♦ Ecuación total: (NT/nº de cuadrados) · 1/4000 · 10−3 organismos por mL (u.f.c/mL) • Indirectos: Recuento de viables en placa ♦ Hacer aprox. 5 diluciones y sembrar en placas ♦ Seleccionar las placas que tengan entre 30 y 300 org. ♦ Ejemplo: sembramos en una placa 0,1 mL de diluciones 10−1, 10−2, 10−3, 10−4 mL ◊ Aparecen 223 org en la placa de 10−3 mL ◊ 223 · 103 (por la dilucion)· 10(por la cantidad de volumen en la placa) ♦ Inconvenientes: ◊ Sólo contamos los org que han crecido: ⋅ No se cuentan los dañados o muertos ⋅ No se cuentan los que no han tenido sitio que colonizar 14 • Indirectos: Recuento de fagos ♦ El mismo procedimiento que el recuento de viables ♦ Unidades: u.f.p/mL calvas por mL (plaque en ingles) 9.2.1.− RECUENTO DE BACTERIAS VIABLES EN PLACA (POR EXTENSIÓN, SPREAD PLATE). El recuento en placa en superficie se basa en el recuento de las unidades formadoras de colonia que aparecen tras dispersar una alicuota o dilución de la muestra problema en la superficie de una placa de medio sólido: las células viables quedan inmovilizadas en distintos puntos de la superficie del medio, donde crecerán dando lugar a colonias aisladas, si están lo suficientemente dispersas (ejemplos en las fotos siguientes), o a un césped si hay muchas y quedan muy juntas. Existe un límite de fiabilidad establecido para los recuentos en placa de modo que, para que el recuento sea válido, las placas deben contener entre 20 y 200 colonias (30 a 300 en el caso de pour plates). El límite superior se establece porque pueden haber viables en la placa cuyo crecimiento quede inhibido o enmascarado por el desarrollo de otras más rápidas o más eficaces en la captación de nutrientes. El resultado de un recuento de colonias se expresa siempre en número de unidades formadoras de colonia (u.f.c) por mililitro o gramo de muestra, especificando el valor como una sola cifra con uno o dos decimales multiplicado por el orden de magnitud del recuento: INCORRECTO CORRECTO 245.000 células/m 2,5 x 10 ufc/ml 84,9 x 10 ufc/g 8,5 x 10 ufc/g Además, hay que especificar el tipo de recuento de viables en cada caso: medio y condiciones empleadas. La estrategia a seguir queda reflejada en el siguiente esquema, que puede ser 15 válido para la muestra de agua que procesaremos: 10.3.− METABOLISMO FERMENTATIVO DE CARBOHIDRATOS: RUTAS FERMENTATIVAS EN ENTEROBACTERIAS, PRUEBA MR−VP. El tipo de fermentación que lleva a cabo un microorganismo es también un carácter importante en identificación. De las múltiples fermentaciones que llevan a cabo las bacterias, en la Familia Enterobacteriaceae la fermentación se da por una de dos posibles rutas alternativas. La determinación de cual de ellas se usa es importante para distinguir los géneros (Escherichia, Klebsiella, Proteus, Serratia, ...). En la práctica, se analizan los productos finales de la fermentación de la glucosa, después de haber incubado la bacteria en un medio líquido glucosado, para averiguar si: a) La producción de ácidos variados ha rebajado el pH por debajo de 4,2. Esta bajada de pH es característica de la fermentación ácido−mixta y se puede comprobar añadiendo el indicador de pH Rojo de Metilo a una alícuota del caldo glucosado crecido. El Rojo de Metilo es amarillo o anaranjado a pHs superiores a 4,2 y rojo a pHs inferiores (prueba Rojo Metilo, RM) b) En el medio hay butanodiol, el subproducto característico de la fermentación butanodiólica, que se puede revelar mediante una reacción coloreada, añadiendo KOH al 40% (p/v en agua) y ?−naftol (5% p/v en etanol) a otra alícuota del caldo glucosado crecido. En presencia de KOH concentrado el butanodiol se oxida a diacetilo, que en esas condiciones dará un color rojo cereza al tubo: (prueba Voges Proskauer, VP) 10.4.− ENZIMAS RELACIONADOS CON EL OXÍGENO: 16 DETERMINACIÓN DE LAS ACTIVIDADES CITOCROMO OXIDASA Y CATALASA. La presencia de estos dos enzimas es crucial en la identificación de varios grupos de bacterias: la citocromo oxidasa, o simplemente, oxidasa, es una determinación habitual en el proceso de identificación de bacterias Gram−negativas heterotrofas. La determinación de la actividad catalasa es habitual en la identificación de Gram−positivas. • Citocromo−oxidasa: Forma parte de la cadena de transporte electrónico de multitud de bacterias y corresponde a un citocromo de tipo c. Su presencia se puede poner de manifiesto de forma simple haciendo uso del cambio de color que presenta un reactivo específico (Reactivo de la oxidasa−ver Anexo), que pasa de incoloro a violeta oscuro cuando es oxidado específicamente por este tipo de citocromos. Los citocromos de tipo a o b no son reducidos por el reactivo por lo que el cambio de color sólo se observa cuando la bacteria sometida a la prueba posee citocromos tipo c. En la determinación es conveniente usar asas de vidrio o palillos de madera estériles para recoger el crecimiento bacteriano, pues el uso de asas metálicas puede dar lugar a falsos positivos. También es conveniente usar cultivos obtenidos en medios sin carbohidratos. • Catalasa: la catalasa es uno de los enzimas que intervienen en el proceso de detoxificación de las células expuestas a condiciones aerobias y, en particular, descompone el peróxido de hidrógeno (H2O2) en agua y oxígeno. Es un enzima hémico que está presente en muchas (pero no todas) de las bacterias capaces de desarrollarse en presencia de O2. 2 H2O2 2 H2O + O2 Es fácil de detectar por la producción de burbujas de oxígeno que acompaña a la actividad. PRÁCTICA 12. IDENTIFICACIÓN DE MICROORGANISMOS MEDIANTE SISTEMAS MINIATURIZADOS. La identificación microbiana puede realizarse atendiendo a dos tipos de determinaciones: a) Caracterización fenotípica: pruebas morfológicas, estructurales, enzimáticas, nutricionales, composición de ácidos grasos celulares, etc... b) Caracterización genotípica: hibridación con sondas filogenéticas específicas, determinación de perfiles de resticción y/o amplificación de su DNA genómico, etc... La identificación requiere siempre la existencia de una clasificación previa y la disponibilidad de una base de datos lo suficientemente amplia y sólida como para ofrecer resultados fiables. En muchos laboratorios, la identificación de aislados microbianos es una tarea rutinaria que ha de aplicarse a cientos de cepas continuamente, de manera que el volumen de materiales y procedimientos implicados en esta actividad hacen necesario disponer de sistemas rápidos, miniaturizados y estandarizados para identificar eficazmente los microorganismos problema. La mayoría de estos métodos realizan una identificación basada en la caracterización del fenotipo del microorganismo y consisten en placas o galerias de pequeños tubos o pocillos que contienen cantidades mínimas de medios de cultivo adecuados para la determinación de una o varias características concretas y pueden ser incubados en condiciones aerobias o anaerobias con facilidad. 17 Se inoculan con suspensiones preparadas a partir de colonias aisladas y ofrecen resultados válidos en plazos de tiempo que van desde un máximo de 24 h hasta mínimos de 4 h de incubación. Para utilizar estos sistemas es necesario conocer algunas caracteristicas básicas del microorganismo que se pretende identificar: si se trata de una bacteria o un hongo, si la bacteria es Gram−positiva o Gram−negativa, y, a veces, su morfología celular o la reacción a la prueba de la oxidasa o del O/F. Los resultados obtenidos mediante estos métodos se suelen codificar con una clave numérica abreviada que se introduce en la base de datos y ofrece un resultado de identificación, con la fiabilidad de la misma y recomendando pruebas adicionales si la identificación no es concluyente. Algunos de los sistemas comprenden también lectores automatizados de las placas. Todos estos sistemas suelen estar muy orientados a especies microbianas de importancia clínica, pues es éste el ámbito que más uso hace de la identificación miniaturizada. No cualquier tipo de bacteria se puede identificar con estos sistemas. Como ilustración del uso de tales métodos, llevaremos a cabo la identificación de cuatro cepas bacterianas haciendo uso del sistema EnteroSystem 18R. Este sistema permite la identificación rápida de bacterias Gram−negativas, oxidasa negativas (presuntas enterobacterias) de interés sanitario, incluyendo: Escherichia, Shigella, Edwardsiella, Citrobacter, Salmonella, Klebsiella, Enterobacter, Serratia, Proteus, Providencia, Morganella y Yersinia. Contiene 18 pruebas que se realizan en una placa con 18 pocillos que se inoculan con una suspensión bacteriana y ofrece resultados tras 8−24 h de incubación a 35−37ºC. Pruebas: 1.−galactosidasa: Es el enzima que hidroliza el disacárido lactosa en glucosa y galactosa. Se ensaya con un sustrato artificial, el orto−nitro−fenil ?−galactopiranósido (ONPG), que, al ser hidrolizado por el enzima, produce un compuesto de color amarillo, el orto−nitrofenol. 2.− Lisina descarboxilasa. 3.− Ornitina descarboxilasa 4.− Arginina descarboxilasa. Estos tres enzimas actúan sobre los correspondientes aminoácidos descarboxilandolos y convirtiéndolos en diaminas, que tienen un efecto alcalinizante en el medio. Esta alcalinización se detecta con un indicador que vira de amarillo a rojo. 5.− Fenilalanina desaminasa: Este enzima desamina la fenilalanina, produciendo ácido fenilpirúvico, que otorga al medio un color marrón oscuro−negro. 6.− Citrato: 18 El uso de citrato como única fuente de carbono y energía produce una alcalinización del medio que se registra por la presencia de azul de bromotimol. 7.− Ureasa: +El enzima ureasa hidroliza la urea formando CO2 y NH4 , lo que produce una intensa alcalinización del medio que se traduce en el viraje del indicador de pH a fucsia. 8.− Producción de H2S a partir de tiosulfato. Al igual que en el medio Hektoen (ver práctica 5), la producción de H2S se detecta por la formación de SFe, negro, que aparece como consecuencia de la presencia de sales de hierro en el medio. 9.− Malonato La utilización de malonato produce los mismos efectos que la de citrato. 10.− Voges−Proskauer. Permite detectar la formación de butanodiol en la fermentación de la glucosa por el método que se ha visto en la página 65. 11.− Producción de indol a partir de triptófano. Mediante la triptofanasa, el triptófano es degradado, formándose indol como residuo. Este compuesto puede detectarse usando el reactivo de Kovac para el indol (p−dimetil aminobenzaldehido en isoamílico−HCL, ver anexo), que produce color rojo en su presencia. 12−18.− Fermentación de carbohidratos En estos pocillos se puede observar la acidificación que se produce cuando los carbohidratos que contienen son fermentados, virando el indicador a amarillo. Los resultados, en grupos de tres, se codifican numéricamente del siguiente modo: • Prueba negativa 0 puntos • Primera prueba del trío positiva 1 punto. • Segunda prueba del trío positiva 2 puntos • Tercera prueba del trío positiva 4 puntos. A continuación se suman los puntos de cada trío de pruebas y se obtiene un número de 6 cifras que será el código para buscar la identificación que le corresponda a la cepa en la base de datos. 19