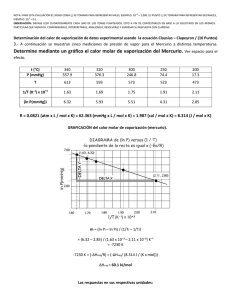
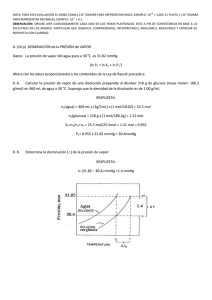
61 ρ = ϕ ρ ρ ρ h
Anuncio
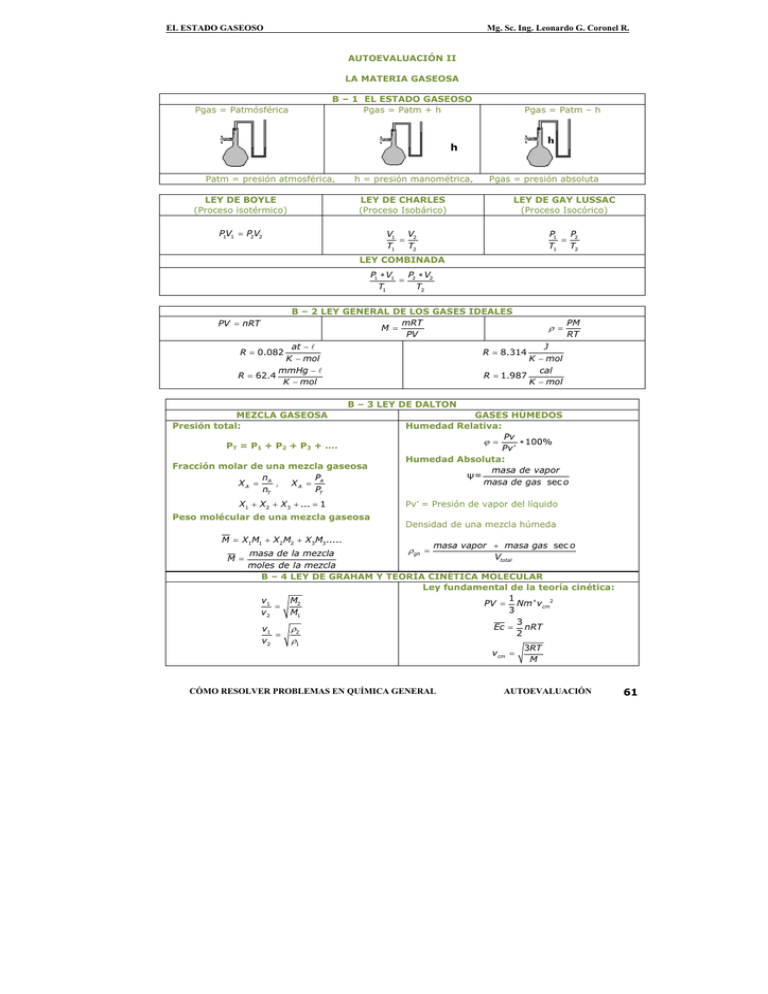
EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN II LA MATERIA GASEOSA B – 1 EL ESTADO GASEOSO Pgas = Patm + h Pgas = Patmósférica Pgas = Patm – h h h Patm = presión atmosférica, h = presión manométrica, Pgas = presión absoluta LEY DE BOYLE (Proceso isotérmico) LEY DE CHARLES (Proceso Isobárico) LEY DE GAY LUSSAC (Proceso Isocórico) P1V1 = P2V2 V1 V2 = T1 T2 P1 P = 2 T1 T2 LEY COMBINADA P1 ∗ V1 P ∗ V2 = 2 T1 T2 PV = nRT B – 2 LEY GENERAL DE LOS GASES IDEALES mRT M = PV at − A K − mol mmHg − A R = 62.4 K − mol ρ = PM RT J K − mol cal R = 1.987 K − mol R = 0.082 R = 8.314 B – 3 LEY DE DALTON MEZCLA GASEOSA Presión total: PT = P1 + P2 + P3 + …. Fracción molar de una mezcla gaseosa n P XA = A , XA = A nT PT X1 + X2 + X3 + ... = 1 Peso molécular de una mezcla gaseosa GASES HÚMEDOS Humedad Relativa: Pv ϕ = ∗ 100% Pv ∗ Humedad Absoluta: masa de vapor ψ= masa de gas sec o Pv∗ = Presión de vapor del líquido Densidad de una mezcla húmeda M = X1M1 + X2 M2 + X3M3..... M = masa vapor + masa gas sec o ρ gh = masa de la mezcla Vtotal moles de la mezcla B – 4 LEY DE GRAHAM Y TEORÍA CINÉTICA MOLECULAR Ley fundamental de la teoría cinética: 1 v1 M2 PV = Nm ' vcm2 = 3 v2 M1 3 Ec = nRT v1 ρ2 2 = v2 ρ1 3RT vcm = M CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 61 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. B – 5 GASES REALES Ecuación de J.C. van der Waals ⎛ n2 a ⎞ ⎜ P + 2 ⎟ (V − nb ) = nRT Para n moles V ⎠ ⎝ a ⎞ ⎛ ⎜ P + 2 ⎟ (V − b ) = RT Para 1 mol V ⎠ ⎝ Covolumen b = 4 VM GAS B – 6 CONSTANTES DE VAN DER WAALS a [A2atm/mol2] b [A/mol] Helio 0.0341 0.0237 Argón Oxígeno Nitrógeno Agua Amoniaco Anhídrido sulfuroso Tetracloruro de carbono Anhídrido carbónico 1.35 1.32 1.38 5.46 4.17 6.71 20.39 3.60 0.0322 0.0312 0.0394 0.0305 0.0371 0.0564 0.1383 0.0438 B – 7 PRESIÓN DE VAPOR DEL AGUA Temperatura (oC) 0 5 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Presión (mmHg) 4.6 6.5 9.2 9.8 10.5 11.2 12.0 12.8 13.6 14.5 15.5 16.5 17.5 18.7 19.8 21.1 22.4 23.8 25.2 Temperatura (oC) 27 28 29 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 62 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL Presión (mmHg) 26.7 28.3 30.0 31.8 42.2 55.3 71.9 92.5 118.0 149.4 187.5 233.7 289.7 355.1 433.6 525.8 633.9 760.0 906.1 AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 1 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) El proceso isobárico fue desarrollado por: i) Charles ii) Boyle iii) Gay Lussac iv) ninguno c) La fracción molar del hidrógeno en una mezcla de 50 mg de hidrógeno y 50 mg de helio es: (H =1; He = 4) i) 0.67 ii) 0.25 iii) 0.33 iv) ninguno e) ¿Cuál de las siguientes unidades corresponde a unidades de presión? i) lb/pulg ii) Newton − m iii) pulg de agua iv) Ninguno g) Un gas real tiene comportamiento ideal a: i) altas T y altas P ii) bajas P y altas T iii) bajas T y altas P iv) ninguno i) La presión manométrica a 10 m de profundidad de un lago (ρH2O = 1 g/ml), donde la presión barométrica es de 700 mmHg es: i) 14.23 PSI ii) 28.93 PSI iii) 0.470 PSI iv) ninguno b) La unidad de presión en el sistema internacional de unidades es: i) mmHg ii) atm iii) Pascal iv) ninguno d) En un experimento a 15 °C la constante de Boyle fue de 22500 mmHg-cm3, por tanto la presión correspondiente a 0.6 dm3 es: i) 0.725 PSI ii) 2.551 PSI iii) 918.367 PSI iv) ninguno f) 2 g de oxígeno en condiciones normales ocupa un volumen de: i) 22.4 litros ii) 1.4 litros iii) 11.2 litros iv) ninguno h) La energía cinética promedio de 1 mol de aire a 300 K es de: (N = 79% y O = 21% V/V) i) 61.166 J ii) 2494.2 J iii) 3741.3 J iv) ninguno j) Determine la densidad del helio en condiciones de P y T estándar. i) 1.290 g/A ii) 1.290 g/cm3 iii) 0.179 g/A iv) ninguno 2. (20 puntos) Una vasija, contiene aire en condiciones normales, si se somete a calentamiento hasta 104 °F a presión constante. ¿Qué porcentaje de aire se expulsa de la vasija como consecuencia del calentamiento? 3. (20 puntos) Un recipiente de acero de 20 litros de capacidad contiene una mezcla de acetileno y metano. Si la presión manométrica de la mezcla de gases es de 5 PSI y la mezcla contiene una quinta parte de acetileno, a) determine el peso molecular promedio de la mezcla, b) las presiones absolutas de cada uno de los gases componentes de la mezcla. 4. (20 puntos) Un edificio requiere de la provisión de aire acondicionado. Se estima que el consumo diario es de 12000 L. El aire requerido está a 15 ºC y una humedad relativa de 40 %. El aire disponible tiene una temperatura de 22 ºC y una humedad relativa de 20 %. La presión en el interior del edificio es 5 % menor que la atmosférica local (495 mm Hg). Calcular a) El volumen diario necesario de aire a ser bombeada desde el exterior; b) La cantidad de agua necesaria que debe ser condensada o evaporada; c) La masa de aire húmeda consumida en el edificio. Pv*, 22 ºC = 19.8 mm Hg y Pv*, 15 ºC = 12.8 mm Hg respectivamente. Considerar que el Maire = 28.9 g/mol. Masas Atómicas: H = 1, O = 16 5. (20 puntos) El propietario de un automóvil nota que una de las llantas tiene baja presión manométrica y se acerca a un taller mecánico, en el cual evidencia que la presión manométrica es de 18 PSI, y por sus características técnicas de los neumáticos de la llanta hace aumentar la presión manométrica a 28 PSI. Si este proceso fue a temperatura constante de 20 °C, Determine el porcentaje de volumen de aire incrementado a la llanta considerando que el incremento de masa de aire fue en un 50% respecto a su masa inicial. CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 63 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 2 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) En un proceso isocórico la densidad del hidrógeno gaseoso: i) aumenta ii) disminuye iii) permanece constante iv) ninguno c) En condiciones normales el volumen molar de un gas ideal es de: i) 24.2 litros ii) 22.4 litros iii) 2240 ml iv) ninguno e) La velocidad de difusión de dos gases varía en forma inversamente proporcional a: i) raíz cuadrada de sus pesos moleculares ii) raíz cuadrada de sus presiones iii) sus fracciones molares iv) ninguno g) En las mismas condiciones de volumen, temperatura y masa, se tiene gas oxígeno y gas nitrógeno. La relación PO2 y PN2 es: i) 0.785 ii) 0.875 iii) 1.785 iv) ninguno i) Las unidades de la constante “a” en ⎡ an2 ⎤ ⎢ p + 2 ⎥ son: V ⎦ ⎣ i) mol 2 A2 ii) 2 iii) mol ∗ A 2 A2 mol 2 iv) ninguno b) Si la densidad de un gas ideal es 0.21 g/A en C. N. Su densidad a 498 mmHg y 104 ºF es: i) 0.12 g/A ii) 1.02 g/A iii) 2.10 g/A iv) ninguno d) La presión manométrica de un gas ideal es de 10 pulg de agua, por tanto su presión absoluta es: i) 800 mmHg ii) 567 mmHg iii) 700 mmHg iv) Ninguno f) Si el peso molecular promedio de una mezcla de metano e hidrógeno es 10, la fracción molar del hidrógeno es: i) 0.16 ii) 0.22 iii) 0.43 iv) ninguno h) La fracción molar del metano de una mezcla gaseosa formada por 2 g de oxígeno y dos gramos de metano es: i) 0.75 ii) 0.25 iii) 0.67 iv) ninguno j) La ecuación de Van der waals para un mol de gas real es: a ⎞ a ⎞ ⎛ ⎛ i) ⎜ P − 2 ⎟ (V − b ) = RT ii) ⎜ P − 2 ⎟ (V + b ) = RT V ⎠ V ⎠ ⎝ ⎝ a ⎞ ⎛ iii) ⎜ P + 2 ⎟ (V − b ) = RT V ⎠ ⎝ iv) ninguno 2. (20 puntos) Un corredor de autos, infla con aire los neumáticos de su vehículo para participar en el circuito de Pucarani. En el instante de inflar sus neumáticos, la temperatura es de 6 ºC y la presión manométrica es de 30 PSI. Durante la competencia, el volumen del neumático aumenta de 27.3 litros a 27.8 litros y la temperatura del aire en los neumáticos es de 55 ºC. Si el neumático soporta 31 PSI de presión manométrica como máximo. ¿El neumático soporta dicha presión? Considere la presión barométrica de 480 mmHg. 3. (20 puntos) Un litro de un gas A a la presión de 2 atm y 2 litros de un gas B a 3 atm de presión, se mezclan en un frasco de 4 litros para formar una mezcla gaseosa. Calcular: a) la presión final de la mezcla gaseosa, si los gases se encuentran a la misma temperatura tanto al inicio como al final del proceso, b) el peso molecular promedio de la mezcla gaseosa, si los gases A y B juntos pesan 24 g y los mismos a una temperatura constante de 60 ºC, c) la presión total de la mezcla gaseosa, cuando la temperatura del gas A a 27 ºC y la del gas B es de 260.6 ºF y en la mezcla es de 60 ºC. 4. (20 puntos) Un frasco de 2 dm3 contiene una mezcla de hidrógeno y monóxido de carbono a 10 ºC y 786 torr, si la humedad relativa de dicha mezcla gaseosa es del 75%, calcular: a) la masa de vapor de agua que se halla contenida en dicho volumen, en libras, b) la masa de monóxido de carbono, ya que la mezcla contiene 0.12 g de hidrógeno. La presión de vapor de agua a 10 ºC es de 9.21 mmHg. 5. (20 puntos) Un gas desconocido se difunde a una velocidad de 8 mililitros por segundo, en un aparato de difusión, donde el metano lo acechón una velocidad de 12 mililitros por segundo. ¿Cuál es el peso molecular del gas desconocido? 64 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 3 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a)La constante universal de los gases ideales es: J N i) 8.314 ii) 8.314 K − mol K − mol cal iv) ninguno iii) 1.987 K − mol b) La humedad relativa del aire húmedo es del 100 % a 25 ºC y 700 mmHg. La humedad absoluta del sistema es: (Pv∗ a 25 ºC = 23.76 mmHg) i) 0.0671 gvapor/gaire ii) 0.0345 gvapor/gaire iii) 0.0789 gvapor/gaire iv) ninguno c) Una mezcla gaseosa tiene una composición másica de 20% de metano y 80% de etano, el peso molecular promedio es: i) 25.32 g/mol ii) 22.22 g/mol iii) 20.68 g/mol iv) ninguno d) La presión absoluta en el fondo de una probeta de 25 cm de altura que contiene mercurio es: i) 250 mmHg ii) 745 mmHg iii) 1010 mmHg iv) Ninguno e) La velocidad cuadrática media de 1 mol de oxígeno a 300 K es: i) 3.45 km/s ii) 0.484 km/s iii) 0.245 km/s iv) ninguno f) La presión absoluta de un gas ideal es negativa cuando: ii) Pgas < Pman i) Pgas > Pman iv) ninguno iii) Pgas = Pman g) La presión barométrica se define como: i) Patm – Pman ii) Pgas iii) Pabsoluta iv) Patm h) Tres atmósferas de presión equivalen a: i) 1485 mmHg ii) 30.99 m H2O iii) 54 PSI iv) 0.003 Pa i) Un gas real tiene comportamiento ideal bajo las siguientes condiciones: i) T altas y P altas ii) P bajas y T altas iii) T bajas y P bajas iv) ninguno j) La presión barométrica en la ciudad de La Paz, es mayor que en: i) Cochabamba ii) El Alto iii) Puerto de Ilo iv) ninguno 2. (20 puntos) A un recipiente de volumen desconocido se confinan 2160 g de una mezcla de metano y acetileno de peso molecular promedio 18 g/mol, ejerciendo una presión manométrica de 2 PSI. Por destilación fraccionada se consigue extraer el 90% en masa de metano y 10% en masa de acetileno, sin variar el volumen ni la temperatura. Sin embargo se observa que la presión manométrica se reduce a 1 PSI. ¿Cuál es el peso molecular de la mezcla gaseosa que queda en el recipiente? 3. (20 puntos) 5 litros de aire saturado al 60 % de vapor de alcohol etílico a 30 °C y 5 atm de presión están contenidos en un recipiente, al cuál se introduce 3 g de alcohol líquido. Calcular: a) la humedad relativa final, cuando se expande a 20 litros y la temperatura aumenta a 40 °C y b) la presión total final. Las presiones de vapor de alcohol etílico a 30 y 40 °C son 78.8 y 135.3 torr respectivamente. 4. (20 puntos) Un recipiente de 250 ml contiene Kripton a 500 torr y otro recipiente de 450 ml, contiene helio a 950 torr. Se mezcla el contenido de ambos gases, abriendo la llave que los conecta. Si el proceso es isotérmico, calcule; a) la presión total final, b) las fracciones molares de cada gas, c) el peso molecular de la mezcla gaseosa. 5. (20 puntos) Un volumen de nitrógeno pasa en 20 segundos por el orificio de un efusímetro. Bajo las mismas condiciones de presión y temperatura un volumen igual de una mezcla de oxígeno y anhídrido carbónico se demora 24 segundos. Calcular la fracción molar de la mezcla gaseosa. CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 65 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 4 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) ¿Cuál es la presión manométrica en una probeta de 50 cm de profundidad cuando se llena totalmente a 25 ºC con agua? i) 36.76 mmHg ii) 495.00 mmHg iii) 760.00 mmHg iv) ninguno b) Un tanque de acero contiene nitrógeno a 25 ºC y a una presión de 10 atm. Calcular la presión absoluta a 150 ºC i) 147.00 PSI ii) 54.57 PSI iii) 208.66 PSI iv) ninguno c)5 g de un gas ideal ocupan 2 litros a 20 ºC y 7.35 PSI de presión, su volumen en condiciones normales es: i) 3.27 litros ii) 0.93 litros iii) 2.55 litros iv) ninguno d) La densidad de un determinado gas ideal a 30 ºC y 1.3 atm de presión es 0.027 g/ml. ¿Cuál es su peso molecular? i) 516 g/mol ii) 51.6 g/mol iii) 5.16 g/mol iv) Ninguno e) Un bar es una de las unidades de presión cuya equivalencia es: ii) 1000 atm i) 105 Pa iii) 1.013 mmHg iv) ninguno f) El peso molecular de una mezcla gaseosa disminuye cuado: i) aumenta la temperatura ii) disminuye la presión iii) aumenta el volumen iv) ninguno g) Según la Ley de Boyle, la humedad relativa de un gas húmedo,……, cuando aumenta la presión. i) aumenta ii) disminuye iii) permanece constante iv) ninguno h) La energía cinética promedio de 1 mol de aire a 300 K es de: (N = 79% y O = 21% V/V) i) 61.166 J ii) 2494.2 J iii) 3741.3 J iv) ninguno i) La presión del oxígeno en una mezcla de gases, es de 300 mmHg, y su fracción molar es 0.2. La presión total del sistema es: i) 1500 mmHg ii) 375 mmHg iii) 600 mmHg iv) ninguno j) Si el peso molecular promedio de una mezcla de helio y nitrógeno es 20, la fracción molar del helio es: i) 0.33 ii) 0.68 iii) 0.44 iv) ninguno 2. (20 puntos) La masa molecular promedio de 5 lb de masa de una mezcla gaseosa, formada por oxígeno y metano es de 22.4 g/mol y la presión total es de 12 atm, calcular: a) las presiones parciales de dichos gases, b) si se extrae un cuarto de masa de oxígeno y tres cuartos de masa de metano ¿Cuál es la nueva presión absoluta de esta mezcla gaseosa? 3. (20 puntos) Uno de los ambientes de los laboratorios de Ingeniería de Materiales de la UMSA tiene las siguientes dimensiones 4 m ∗ 12 m ∗ 3 m, donde la temperatura ambiente es 68 ºF y la humedad relativa de 60%. Si la presión de vapor de agua a 68 ºF es de 17.4 mmHg, determinar: a) la humedad absoluta de dicho ambiente, b) la densidad del aire húmedo. 4. (20 puntos) Un auxiliar de química de la carrera de Ingeniería Química de la UMSA, recoge 1 litro de nitrógeno sobre acetona a 20 ºC y 850 mmHg, el gas obtenido tiene una humedad relativa del 75%, calcular: a) la masa de acetona que se ha evaporado, b) la masa de acetona que retorna al estado líquido si el gas se comprime isotérmicamente hasta 5 atm, c) a partir de las condiciones iniciales calcule el volumen de nitrógeno seco en C.N. (la presión de vapor de la acetona a 20 ºC es de 198 mmHg). 5. (20 puntos) El cloro se escapa a través de una pequeña abertura a una rapidez de 1/6 de la del hidrógeno, en las mismas condiciones de presión y temperatura. Sabiendo que 1 litro de hidrógeno tiene una masa de 0.0899 g. Calcular la densidad del cloro. 66 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 5 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) La presión parcial del H2 de 4 g de hidrógeno y 2 g de helio en un recipiente a 1 atm es: i) 0.25 atm ii) 0.75 atm iii) 0.5 atm iv) 0.8 atm c) ¿Dónde se difunde más rápidamente el hidrógeno? i) en el aire ii) en nitrógeno iii) en oxígeno iv) en metano b) Si la fracción molar del O2, en una mezcla con H2 es 0.20, el peso molecular de la mezcla es: i) 4 g/mol ii) 6 g/mol iii) 8 g/mol iv) ninguno d) Si a nivel del mar, la presión manométrica de un gas es −10 pulg de agua, su presión absoluta es: i) 800 mmHg ii) 567 mmHg iii) 700 mmHg iv) Ninguno e) Si la densidad de un gas “A” respecto al H2 en C.N. es 4.5, Su peso molecular es: i) 9 g/mol ii) 12 g/mol iii) 16 g/mol iv) ninguno f) Si la presión manométrica de un gas es 110 torr. en “El Alto”, la presión absoluta es mayor en: i) La Paz ii) Santa Cruz iii) Arica iv) son iguales g) La presión manométrica de un gas ideal es negativa cuando: ii) Pgas < Patm i) Pgas > Patm iv) ninguno iii) Pgas = Patm h) ¿Cuál de las siguientes unidades corresponde a unidades de presión? b) Newton − m a) lb/pulg3 c) pulg de agua d) Ninguno i) La unidades de la constante “b” en [V − nb] es: j) Una probeta de 1.5 cm2 de sección transversal contiene 100 ml de Hg, La presión en el fondo es: i) 27.59 PSI ii) 30.22 PSI iii) 40.33 PSI iv) ninguno i) mol 2 A2 iii) mol 2 ∗ A2 ii) A2 mol 2 iv) ninguno 2. (20 puntos) Se infla la llanta de un automóvil con aire inicialmente a 10 ºC y a presión atmosférica normal. Durante el proceso, el aire se comprime a 28% de su volumen inicial y su temperatura aumenta a 40 ºC. ¿Cuál es la presión del aire? Después de manejar el automóvil a altas velocidades, la temperatura del aire de la llanta aumenta a 85 ºC y el volumen interior de la llanta aumenta 2%. ¿Cuál es la nueva presión manométrica y absoluta de la llanta? 3. (20 puntos) Un experimentador estudia una mezcla gaseosa compuesta por 40% en masa de CO2 y el resto NO, se encuentra en un recipiente de 20 litros. Si se agrega un 60% en masa de la mezcla gaseosa su temperatura se incrementa en 20 ºC yla presión final resulta el doble del valor inicial. Calcular: a) La temperatura final de la mezcla gaseosa en grados Celsius, b) la masa inicial de la mezcla gaseosa a la presión inicial de 1 atm. 4. (20 puntos) Un auxiliar de química de la carrera de Ingeniería Química de la UMSA, recoge 1 litro de nitrógeno sobre acetona a 20 ºC y 850 mmHg, el gas obtenido tiene una humedad relativa del 75%, calcular: a) la masa de acetona que se ha evaporado, b) la masa de acetona que retorna al estado líquido si el gas se comprime isotérmicamente hasta 5 atm, c) a partir de las condiciones iniciales calcule el volumen de nitrógeno seco en C.N. (la presión de vapor de la acetona a 20 ºC es de 198 mmHg). 5. (20 puntos) El cloro se escapa a través de una pequeña abertura a una rapidez de 1/6 de la del hidrógeno, en las mismas condiciones de presión y temperatura. Sabiendo que 1 litro de hidrógeno tiene una masa de 0.0899 g. Calcular la densidad del cloro. CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 67 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 6 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) Al comprimir un gas hasta ½ de su volumen b) Cuando los gases se encuentran a una inicial, la suma de presiones es 10 atm. La presión determinada presión y temperatura constante, se final del gas a temperatura constante es: cumple que %Xi = %V/V, se deduce a partir de i) 3.33 atm ii) 6.67 atm la: iii) 5 atm iv) ninguno a) Ley de amagat b) Ley de Dalton c)Ley de Avogadro d) ninguno c) El hidrógeno se difunde en una relación de d) La presión de un gas ideal es de 1.78∗105 Pa, velocidad igual a 5 respecto a un gas ideal. El por tanto su presión en torr es: peso molecular del gas ideal es: i) 800 torr ii) 1567 torr i) 75 g/mol ii) 0.25 g/mol iii) 1700 torr iv) Ninguno iii) 50 g/mol iv) ninguno e) La denominada constante de Boltzman es una f) Un gas húmedo contiene 20 g de vapor de relación de dos constantes, esta relación es: agua y 898 g de oxígeno. La humedad absoluta es: N i) R∗NA ii) A R ii) 44.9 g O2/H2O i) 0.022 g H2O/gO2 iii) 44.9 iv) ninguno iii) R N A iv) ninguno g) El peso molecular de 0.235 libras de un gas ideal confinados en un recipiente de 50 litros en condiciones normales es: i) 16.55 g/mol ii) 32.76 g/mol iii) 47.73 g/mol iv) ninguno i) En un recipiente rígido se observa que la presión manométrica aumenta cuando la temperatura se incrementa, esta experimentación fue estudiada por: i) Dalton ii) Charles iii) Amagat iv) ninguno h) Se recoge 1 m3 de aire húmedo, la cual contiene 15 g de agua a 495 mmHg y 25 ºC. La humedad relativa del ambiente es: (Pv = 25.76 mmHg) i) 23.76% ii) 35.07 % iii) 65.22 % iv) ninguno j) Si el peso molecular promedio de una mezcla de hidrógeno y oxígeno es 10, la fracción molar del hidrógeno es: i) 0.16 ii) 0.73 iii) 0.33 iv) ninguno 2. (20 puntos) Sube una burbuja de gas desde el fondo en un lago con agua limpia a una profundidad de 4.2 m y a una temperatura de 5 ºC hasta la superficie donde la temperatura del agua es de 12 ºC. ¿Cuál es el cociente de los diámetros de la burbuja en los dos puntos? (suponga que la burbuja de gas está en equilibrio térmico con el agua en los dos puntos. 3. (20 puntos) Una muestra de 100 ml de gas seco medido a 20 ºC y a 750 mmHg ocupó un volumen de 104 ml, cuando se recogió sobre agua a 25 ºC y 750 mmHg. Calcular: a) la presión de vapor de agua a 25 ºC, b) la humedad relativa del gas, c) la humedad absoluta, la presión de vapor de agua a 25 ºC es23.76 mmHg. 4. (20 puntos) Dos gases anhídrido hiposulfuroso y sulfuro de hidrógeno ingresan por los extremos de un tubo horizontal de 100 cm de longitud. El tubo es cerrado y los gases se difunden hacia su encuentro. Considerando la sección uniforme del tubo, en que punto aparecerá azufre elemental, producto de la reacción entre los dos gases. 5. (20 puntos) En el laboratorio de química general de la facultad de Ingeniería de la UMSA, se ha instalado el sistema mostrado en la figura. Si el proceso se lleva a cabo a temperatura constante de 20 ºC, determinar: a) la presión absoluta del sistema y b) la longitud del líquido manométrico del manómetro inclinado, cuando accidentalmente se pierde 3.82 g de masa de aire. (ρKerosene = 0.82 g/ml) L = 50 cm S = 150 cm d = 40 68 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL aire kerosene 30º AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 7 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) En un proceso isotérmico, cuando la presión b) ¿Cuál de los siguientes gases tiene mayor aumenta, la densidad del hidrógeno gaseoso: velocidad cuadrática media a 500 K? i) aumenta ii) disminuye i) acetileno ii) ciclo propano iii) benceno iv) nitrógeno iii) permanece constante iv) ninguno c) La relación de fracciones molares del oxígeno d) La constante universal de los gases ideales en respecto al helio es de 4. La fracción molar del unidades del sistema internacional es helio es: atm − A atm − A ii) 0.082 i) 0.082 i) 0.20 ii) 0.80 K − mol K − mol iii) 0.16 iv) 0.64 J iii) 8.314 iv) Ninguno K − mol e) La masa molecular de una mezcla de gases es f) Una burbuja de 1 pulg de diámetro se halla a de 15 g/mol, a 0 ºC si la temperatura aumenta a 10 m de profundidad de un mar de agua dulce, 60 ºC, La masa molecular de esta mezcla: cuando asciende a la superficie su volumen: i) aumenta ii) disminuye i) aumenta ii) disminuye iii) permanece constante iv) ninguno iii) permanece constante iv) ninguno g) El proceso denominado isocórico fue estudiado h) El peso molecular de un gas “x” de densidad por: relativa 0.137, en C.N. es: i) Boyle ii) Charles i) 2 g/mol ii) 4 g/mol iii) Gay Lussac iv) Dalton iii) 16 g/mol iv) 26 g/ mol j) un gas tiene una velocidad cuadrática media de i) ¿Cuál de los siguientes gases tiene mayor 1.2 km/s a 300 K, su peso molecular es: presión? i) 2 g/mol ii) 4 g/mol i) O2 a 1000 torr ii) N2 a 20 PSI iv) He a 1∗104 Pa iii) 16 g/mol iv) ninguno iii) H2 a 1.2 atm 2. (20 puntos) El neumático de una bicicleta se llena con aire a una presión manométrica de 550 KPa a 20 ºC. ¿Cuál es la presión manométrica del neumático después de manejarla en un día soleado cuando la temperatura del aire es de 40 ºC? (suponga que el volumen no cambia y recuerde que la presión manométrica significa la presión absoluta en el neumático menos la presión atmosférica. Además considere que la presión atmosférica permanece constante e igual a 101 KPa. 3. (20 puntos) Una mezcla gaseosa de nitrógeno y vapor de agua se introduce en un matraz sin aire que contiene un deshidratante sólido, si la presión de 495 torr al comienzo, decae después de un tiempo a una presión de equilibrio de 471 torr. Calcular: a) la composición molar de la mezcla gaseosa original, b) el volumen del matraz. Si el agua deshidratante sufre un aumento de masa de 0.20 g a 25 ºC. (Desprecie el volumen del agente deshidratante). 5. (20 puntos) Se tiene una muestra de dos gases diferentes A y B. El peso molecular de A es el doble que el de B. Si ambas muestras contienen el mismo número de moléculas por litro, siendo la velocidad cuadrática media de A el doble que la de B y la presión e B es 3 atm. ¿Cuál es la presión de B? CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL h = 30 cm 4. (20 puntos) 4. (20 puntos) En el laboratorio de Química General de la Facultad de Ingeniería de la UMSA, se hacen burbujear 2.7 mg de hidrógeno seco sobre agua, luego el sistema se estabiliza a 15 ºC de acuerdo con la figura, en la cual h es 10 cm. Si el volumen ocupado por el gas es de 40 ml. Determinar: a) la fracción molar del hidrógeno, b) la densidad de la mezcla húmeda, c) la humedad relativa, d) la humedad absoluta. La presión de vapor a 15 ºC es de 12.80 mmHg. H2O AUTOEVALUACIÓN 69 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 1 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) El proceso isobárico fue desarrollado por: i) Charles ii) Boyle iii) Gay Lussac iv) ninguno Recordando las leyes de los gases ideales: Charles: Realiza sus experimentaciones a presión constante cuya ley nos dice: “ A presión y número de moles constante, el volumen de un gas ideal varía en forma directamente proporcional a la temperatura absoluta”. Este proceso se conoce como proceso isobárico. Boyle: Realiza sus experimentos a temperatura constante cuya ley dice: “A temperatura y número de moles constante, el volumen de un gas ideal varia en forma inversamente proporcional a la presión absoluta” Este proceso se conoce como proceso isotérmico. Gay Lussac: Realiza sus experimentos a volumen constante cuya ley dice: “A volumen y número de moles constante, la presión de un gas ideal varia en forma directamente proporcional a la temperatura absoluta” Este proceso se conoce como proceso isocórico. Rpta.- (i) b) La unidad de presión en el sistema internacional de unidades es: i) mmHg ii) atm iii) Pascal iv) ninguno Por definición: P = F ⎡ N ⎤ = A ⎢⎣ m2 ⎥⎦ Recuerde que 1 Pascal = 1 Pa = 1 N/m2 que es la unidad en el sistema internacional. Rpta.- (iii) c) La fracción molar del hidrógeno en una mezcla de 50 mg de hidrógeno y 50 mg de helio es: (H =1; He = 4) i) 0.67 ii) 0.25 Por definición: X H = 2 50mgHe ∗ iii) 0.33 iv) ninguno nH2 nH2 + nHe 1gHe 1molHe ∗ = 0.0125molHe 1000mgHe 4gHe X H2 = y 50mgHe ∗ 1gHe 1molHe ∗ = 0.0125molHe 1000mgHe 4gHe 0.025 = 0.67 0.025 + 0.0125 Rpta.- (i) d) En un experimento a 15 °C la constante de Boyle fue de 22500 mmHg-cm3, por tanto la presión correspondiente a 0.6 dm3 es: i) 0.725 PSI ii) 2.551 PSI iii) 918.367 PSI iv) ninguno La constante de Boyle en las unidades correspondientes es: 22500mmHg − cm3 ∗ 1A = 22.5mmHg − A 1000cm3 70 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. y 0.6 dm3 = 0.6 litros De la expresión: PV = K P = K 22.5mmHg − A 1atm 14.7PSI = ∗ ∗ = 0.725PSI V 0.6A 760mmHg 1atm Rpta.- (i) e) ¿Cuál de las siguientes unidades corresponde a unidades de presión? i) lb/pulg ii) Newton − m iii) pulg de agua iv) Ninguno Por definición: P = F ⎡ N ⎤ = A ⎢⎣ m2 ⎥⎦ Por lo visto (i) y (ii) no son respuestas, en cambio (iii) pulg H2O, es una unidad de presión, recuerde que Evangelista Torricelly, obtuvo el mmHg, al estudiar su famoso barómetro de estudio. Rpta.- (iii) f) 2 g de oxígeno en condiciones normales ocupa un volumen de: i) 22.4 litros ii) 1.4 litros iii) 11.2 litros iv) ninguno Realizando cálculos: 2gO2 ∗ 1molO2 22.4AO2 ∗ = 1.4litrosO2 32gO2 1molO2 Rpta.- (ii) g) Un gas real tiene comportamiento ideal a: i) altas T y altas P ii) bajas P y altas T iii) bajas T y altas P iv) ninguno Los gases reales que tienen comportamiento ideal también suelen conocerse con el nombre de gases perfectos por ejemplo el oxígeno, hidrógeno, nitrógeno. En cambio algunos gases reales requieren de ciertas condiciones como ser bajas presiones y altas temperaturas para que tengan comportamiento ideal. Rpta.- (ii) h) La energía cinética promedio de 1 mol de aire a 300 K es de: (N = 79% y O = 21% V/V) i) 61.166 J ii) 2494.2 J iii) 3741.3 J iv) ninguno Por definición: 3 nRT 2 3 J Ec = ∗ 1mol ∗ 8.314 ∗ 300K = 3741.3J 2 K − mol Ec = Rpta.- (iii) i) La presión manométrica a 10 m de profundidad de un lago (ρH2O = 1 g/ml), donde la presión barométrica es de 700 mmHg es: i) 14.23 PSI ii) 28.93 PSI iii) 0.470 PSI iv) ninguno En realidad la presión manométrica es 10 mH2O, convirtiendo al sistema inglés: h = 10mH2O ∗ 1atm 14.7PSI ∗ = 14.23PSI 10.33mH2O 1atm Rpta.- (i) CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 71 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. j) Determine la densidad del helio en condiciones de P y T estándar. ii) 1.290 g/cm3 i) 1.290 g/A iii) 0.179 g/A iv) ninguno De acuerdo a la ecuación de estado. PV = ρ = PM = RT m RT M 1atm ∗ 4 g mol = 0.179g / A atm − A ∗ 273K 0.082 K − mol Rpta.- (iii) 2. (20 puntos) Una vasija, contiene aire en condiciones normales, si se somete a calentamiento hasta 104 °F a presión constante. ¿Qué porcentaje de aire se expulsa de la vasija como consecuencia del calentamiento? Solución.- 1 Patm 2 Patm 3 Se calienta a 104 ºF = 313 K T = 313 K P = 1 atm T = 273 K P = 1 atm Cuando se calienta la vasija, la presión y el volumen permanecen constantes, sin embargo, el calentamiento del aire hace que se expulse una cierta cantidad. Se efectúa entonces el siguiente balance: m1 = m2 + m3 Donde m1, es la masa de aire inicial en la vasija, m2, es la masa de aire que aún queda en la vasija y m3 es la vasija que es expulsada por el calentamiento del aire. Por tanto el porcentaje de aire expulsado es: %aire expulsado = m3 ∗ 100% m1 De acuerdo a la ecuación de estado: m1 = MPV MPV y m2 = RT1 RT2 La masa extraida es m3: m1 = m3 = m1 − m2 = MPV RT1 MPV MPV MPV ⎛ 1 1⎞ − = ⎜ − ⎟ RT1 RT2 R ⎝ T1 T2 ⎠ El porcentaje de aire expulsado es: %aire exp ulsado = m3 ∗ 100% m1 Rpta.-12.78% 3. (20 puntos) Un recipiente de acero de 20 litros de capacidad contiene una mezcla de acetileno y metano. Si la presión manométrica de la mezcla de gases es de 5 PSI y el recipiente contiene una quinta parte de acetileno en masa, a) determine el peso molecular promedio de la mezcla, b) las presiones absolutas de cada uno de los gases componentes de la mezcla. 72 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. V = 20 A Solución.h = 5 PSI a) Considerando una masa total m de la mezcla y sabiendo que el número de moles totales en la mezcla es: nT = n1 + n2 m m1 m2 = + M1 M2 M m 15 m 45 m = + 26 16 M m ⎛ 0.2 0.8 ⎞ m ⎛ 0.2 0.8 ⎞ = m⎜ + = m⎜ + ⎟ ⎟ 16 ⎠ M 16 ⎠ M ⎝ 26 ⎝ 26 Simplificando y despejando el peso molecular promedio de la mezcla gaseosa: M = 17.33g / mol Para calcular las presiones absolutas de cada uno de los gases determinaremos la presión total y las fracciones molares de cada uno de los gases: De la figura, la presión total de la mezcla es: PT = Patm + h Siendo: h = 5PSI ∗ 760mmHg = 258.50mmHg 14.7PSI Y la presión total: PT = 760mmHg + 258.5mmHg = 1018.50mmHg Las fracciones molares determinamos a partir de: X C2H2 = n = nT 0.2m 26 = 0.13 m 17.33 X CH4 = 1 − 0.13 = 0.87 b) Por tanto las presiones parciales son: PC2H2 = 0.13 ∗ 1018.50mmHg = 132.41mmHg PCH4 = 0.87 ∗ 1018.50mmHg = 886.10mmHg Rpta.- a) 17 33 g/mol, b) 132.41 mmHg y 886.10 mmHg 4. (20 puntos) Un edificio requiere de la provisión de aire acondicionado. Se estima que el consumo diario es de 12000 litros. El aire requerido está a 15 ºC y una humedad relativa de 40 %. El aire disponible tiene una temperatura de 22 ºC y una humedad relativa de 20 %. La presión en el interior del edificio es 5 % menor que la atmosférica local (495 mm Hg). Calcular a) El volumen diario necesario de aire a ser bombeada desde el exterior; b) La cantidad de agua necesaria que debe ser condensada o evaporada; c) La CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 73 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. masa de aire húmeda consumida en el edificio. Pv*, 22 ºC = 19.8 mm Hg y Pv*, 15 ºC = 12.8 mm Hg respectivamente. Considerar que el Maire = 28.9 g/mol. Masas Atómicas: H = 1, O = 16. Solución.Estado T (K) Pv (mmHg) Inicial Final 295 288 19.8 12.8 Humedad relativa (%) 20 40 P (mmHg) V (litros) 495 470.25 V1 12000 a) Para las condiciones finales: Pv = 12.8∗0.40 = 5.12 mmHg Pairesec o = PT − Pv = 470.25 − 5.12 = 465.13 mmHg Para las condiciones iniciales Pv = 19.8∗0.20 = 3.96 Pairesec o = PT − Pv = 495 − 3.96 = 491.04 mmHg Cálculo del volumen inicial.- Aplicando la ecuación combinada: = P2 ∗ V2 ∗ T1 465.13 mmHg ∗ 12000 A ∗ 295 K = = 11643.09A P1 ∗ T2 491.04 mmHg ∗ 288 K b) Cálculo de las masas de agua (en fase vapor).- Empleando la ecuación de los gases ideales y despejando para la masa: Para las condiciones iniciales: mH2O (1) = P ∗V ∗ M = R ∗T (19.8 ∗ 0.2) mmHg ∗ 11643.09 A ∗ 18 62.4 mmHg − A ∗ 295 K mol K g mol = 45.08 g Para las condiciones finales mH2O (2) = P ∗V ∗ M = R ∗T (12.8 ∗ 0.4) mmHg ∗ 12000 A ∗ 18 62.4 mmHg − A ∗ 288 K mol K g mol = 61.54 g Por tanto, la masa necesaria de agua para evaporar y alcanzar las condiciones requeridas es: mH2Oevap = mH2O(2) − mH2O(1) = 61.54 − 45.08 ) = 16.46 g c) maire sec o = Paire sec o (2) ∗ V ∗ Maire R ∗T = 465.13mmHg ∗ 12000 A ∗ 28.9 62.4 mmHg − A ∗ 288 K mol K La masa de aire húmedo que se consume es: g mol = 8975.87 g mah = 8975.87g + 45.08g = 9020.95g Rpta.- a) 11643.09 litros, b) 16.46 g, c) 9020. 95 g 5. (20 puntos) El propietario de un automóvil nota que una de las llantas tiene baja presión manométrica y se acerca a un taller mecánico, en el cual evidencia que la presión manométrica es de 18 PSI, y por sus características técnicas de los neumáticos de la llanta hace aumentar la presión manométrica a 28 PSI. Si este proceso fue a temperatura constante de 20 °C, Determine el porcentaje de volumen de aire incrementado a la llanta 74 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. considerando que el incremento de masa de aire fue en un 50% respecto a su masa inicial. Solución.T = 293 K m1 = mo m2 = 0.5 mo + mo m2 = 1.5 mo h = 18 PSI h = 28 PSI CONDICIONES FINALES CONDICIONES INICIALES El porcentaje de volumen de aire incrementado a la llanta se determina a partir de la siguiente relación: %∆V = ∆V ∗ 100% V1 (1) Donde ∆V = V2 – V1 De acuerdo a la ecuación de estado: PV = m RT M En condiciones iniciales: P1 = Patm + h = 14.7 PSI + 18 PSI = 32.7 PSI V1 = ⇒ m1RT MP1 En condiciones finales: P2 = Patm + h = 14.7 PSI + 28 PSI = 42.7 PSI ⇒ m RT V2 = 2 MP2 ∆V = m2 RT m1RT − MP2 MP1 Por lo que, reemplazando en la ecuación (1) los datos del problema: mo ⎛ 1.5mo ⎞ RT − ⎜ ⎟ 42.7PSI 32.7PSI ⎠ M ⎝ ∗ 100% %∆V = mo ⎛ ⎞ RT ⎜ ⎟ ⎝ 32.7PSI ⎠ M Simplificando inclusive mo, 1.5 1 − %∆V = 42.7 32.7 ∗ 100% = 14.87% 1 32.7 Rpta.- 14.87% CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 75 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. SOLUCIÓN AUTOEVALUACIÓN 2 (Tiempo: 90 minutos) a) En un proceso isocórico la densidad del hidrógeno gaseoso: i) aumenta ii) disminuye iii) permanece constante iv) ninguno b) Si la densidad de un gas ideal es 0.21 g/A en C. N. Su densidad a 498 mmHg y 104 ºF es: i) 0.12 g/A ii) 1.02 g/A iii) 2.10 g/ iv) ninguno c) En condiciones normales el volumen molar de un gas ideal es de: i) 24.2 litros ii) 22.4 litros iii) 2240 ml iv) ninguno d) La presión manométrica de un gas ideal es de 10 pulg de agua, por tanto su presión absoluta es: i) 800 mmHg ii) 567 mmHg iii) 700 mmHg iv) Ninguno e) La velocidad de difusión de dos gases varía en forma inversamente proporcional a: i) raíz cuadrada de sus pesos moleculares iii) sus fracciones molares ii) raíz cuadrada de sus presiones iv) ninguno Rpta.- (i) f) Si el peso molecular promedio de una mezcla de metano e hidrógeno es 10, la fracción molar del hidrógeno es: i) 0.16 ii) 0.22 iii) 0.43 iv) ninguno Sean: metano = 1 (M = 16 g/mol) e hidrógeno = 2 (M = 2 g/mol), por definición: X1M1 + X2 M2 = 10 (1) X1 + X2 = 1 (2) De (1): En (1) X1 = 1 − X 2 16(1 − X2 ) + 2 X2 = 10 Resolviendo: 6 = 0.42856.. 14 X2 = y X2 = 0.43 X1 = 0.57 Rpta.- (iii) g) En las mismas condiciones de volumen, temperatura y masa, se tiene gas oxígeno y gas nitrógeno. La relación PO2 y PN2 es: i) 0.785 ii) 0.875 iii) 1.785 iv) ninguno Puesto que el oxígeno y el nitrógeno se hallan a la misma temperatura, el mismo volumen y tienen la misma masa, relacionamos sus presiones considerando la ecuación de estado: PV = Dividiendo: PO2V PN2V = m RT M mRT MO2 mRT MN2 = MN2 MO2 = 28 = 0.875 32 Rpta.- (ii) 76 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. h) La fracción molar del metano de una mezcla gaseosa formada por 2 g de oxígeno y dos gramos de metano es: i) 0.75 ii) 0.25 iii) 0.67 iv) ninguno Determinamos los moles de cada gas: nO2 = 2 2 = 0.0625mol y nCH4 = = 0.125mol 32 16 0.125mol X CH4 = = 0.6666... 0.1875mol X CH4 = 0.67 Rpta.- (iii) ⎡ an2 ⎤ I) Las unidades de la constante “a” en ⎢ p + 2 ⎥ son: V ⎦ ⎣ i) mol 2 A2 ii) A2 mol 2 iii) mol 2 ∗ A2 iv) ninguno Se trata de realizar análisis dimensional, siendo la unidad del corchete presión (atm), por tanto: an2 = [ atm] V2 Despejando a: a= [ atm] ⎣⎡A2 ⎦⎤ ⎡⎣mol 2 ⎤⎦ ⎡ atm − A2 ⎤ =⎢ ⎥ 2 ⎣ mol ⎦ Rpta.- (iv) j) La ecuación de Van der waals para un mol de gas real es: a ⎞ ⎛ i) ⎜ P − 2 ⎟ (V − b ) = RT V ⎠ ⎝ a ⎞ ⎛ ii) ⎜ P − 2 ⎟ (V + b ) = RT V ⎠ ⎝ a ⎞ ⎛ iii) ⎜ P + 2 ⎟ (V − b ) = RT V ⎠ ⎝ iv) ninguno Rpta.- (iii) 2. (20 puntos) Un corredor de autos, infla con aire los neumáticos de su vehículo para participar en el circuito de Pucarani. En el instante de inflar sus neumáticos, la temperatura es de 6 ºC y la presión manométrica es de 30 PSI. Durante la competencia, el volumen del neumático aumenta de 27.3 litros a 27.8 litros y la temperatura del aire en los neumáticos es de 55 ºC. Si el neumático soporta 31 PSI de presión manométrica como máximo. ¿El neumático soporta dicha presión? Considere la presión barométrica de 480 mmHg. h = 30 PSI h2 = ¿? T1 = 6 + 273 = 279 K V1 = 27.3 litros CONDICIONES INICIALES T2 = 55 + 273 = 328 K V2 = 27.8 litros CONDICIONES FINALES La presión límite del neumático es 31 PSI, así que nos ocuparemos de determinar la presión manométrica en las condiciones finales. La presión absoluta en condiciones iniciales es: P1 = Patm + h1 Siendo Patm = 480 mmHg y la presión manométrica: CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 77 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. h1 = 30PSI ∗ 760mmHg ∗ 1551.02mmHg 14.7PSI P1 = 480mmHg + 1551.02mmHg = 2031.02mmHg Considerando la ley combinada, calcularemos la presión absoluta en condiciones finales: P2V2 PV = 1 1 T2 T1 P2 = T2 V1 328K 27.3A ∗ ∗ P1 = ∗ ∗ 2031.02mmHg = 2344.78mmHg T1 V2 279K 27.8A La nueva presión manométrica es: h2 = P2 − Patm = 2344.78mmHg − 480mmHg = 1864.78mmHg En unidades del sistema inglés: 1864.78mmHg ∗ 14.7PSI = 36.07PSI 760mmHg Rpta.- El neumático no soporta dicha presión manométrica, puesto que h2 > 30 PSI 3. (20 puntos) Un litro de un gas A a la presión de 2 atm y 2 litros de un gas B a 3 atm de presión, se mezclan en un frasco de 4 litros para formar una mezcla gaseosa. Calcular: a) la presión final de la mezcla gaseosa, si los gases se encuentran a la misma temperatura tanto al inicio como al final del proceso, b) el peso molecular promedio de la mezcla gaseosa, si los gases A y B juntos pesan 24 g y los mismos a una temperatura constante de 60 ºC, c) la presión total de la mezcla gaseosa, cuando la temperatura del gas A a 27 ºC y la del gas B es de 260.6 ºF y en la mezcla es de 60 ºC. Solución.- a) A B PA = 2 atm VA = 1 litro A PB = 3 atm VB = 2 litros PT = ¿? VA = 4 litros B CONDICIONES FINALES CONDICIONES INICIALES Puesto que el proceso es a temperatura constante, la presión total en condiciones finales se puede determinar a partir de la ecuación de estado: PT = nT RT V Siendo el número de moles totales: nT = nA + nB PA ∗ VA P ∗V y nB = B B RT RT 1 nT = ( P ∗ VA + PB ∗ VB ) RT A 1 RT PT = ( P ∗ V1 + P2 ∗ V2 ) ∗ RT 1 V nA = 78 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL (1) AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Reemplazando datos: PT = (2 ∗ 1 + 3 ∗ 2) atm − A 4A = 2atm b) el peso molecular promedio de la mezcla gaseosa, si los gases A y B juntos pesan 24 g y los mismos a una temperatura constante de 60 ºC. El peso molecular de la mezcla gaseosa se calcula con la expresión: M = mT , siendo mT = nT 24 g y el número de moles determinamos con la expresión (1), donde T = 333 K nT = (2 ∗ 1 + 3 ∗ 2) atm − A = 0.293mol atm − A ∗ 333K K − mol 24g = 81.91g / mol M = 0.293mol 0.082 c) La presión total de la mezcla gaseosa, cuando la temperatura del gas A a 27 ºC y la del gas B es de 260.6 ºF y en la mezcla es de 60 ºC. Con estas nuevas condiciones de temperatura determinaremos el número de moles en condiciones iniciales, para el gas A la temperatura es de 27 + 273 = 300 K nA = 2atm ∗ 1A = 0.0813mol atm − A ∗ 300K 0.082 K − mol Para el gas B la temperatura es de: ºC = 5 (260.6 − 32) = 127º 9 TB = 127 + 273 = 400 K nB = 3atm ∗ 2A = 0.183mol atm − A ∗ 400K 0.082 K − mol nT = 0,0813 + 0.183 = 0.264 mol La presión total a 60 ºC = 333 K es: PT = 0.264mol ∗ 0.082 4A atm − A ∗ 333K K − mol = 1.80atm Rpta.- a) 2 atm, b) 81.91 g /mol, c) 1.8 atm 4. (20 puntos) Un frasco de 2 dm3 contiene una mezcla de hidrógeno y monóxido de carbono a 10 ºC y 786 torr, si la humedad relativa de dicha mezcla gaseosa es del 75%, calcular: a) la masa de vapor de agua que se halla contenida en dicho volumen, en libras, b) la masa de monóxido de carbono, ya que la mezcla contiene 0.12 g de hidrógeno. La presión de vapor de agua a 10 ºC es de 9.21 mmHg. V=2A H2 CO T = 283 K P = 786 torr ϕ = 75% CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 79 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. a) La masa de vapor de agua que se halla contenida en dicho volumen, en libras. La masa de vapor de agua se calcula con la ecuación de estado: PvV = m RT , donde la presión de M vapor del agua Pv es: Pv = m= ϕ 100 75 ∗ 9.21mmHg = 6.9mmHg 100 ∗ Pv ∗ = MH 2O ∗ Pv ∗ V 18g / mol ∗ 6.9mmHg ∗ 2A = = 0.014 gH2O mmHg − A R ∗T ∗ 283 K 62.4 mol K En libras: m = 0.014g ∗ 1lb = 3.09 ∗ 10−5 lbH2O 453.6g b) la masa de monóxido de carbono, ya que la mezcla contiene 0.12 g de hidrógeno. La presión de vapor de agua a 10 ºC es de 9.21 mmHg. La masa de monóxido de carbono se determina calculando la masa total o el número de moles totales de la mezcla de acuerdo a: PM ∗ V = nM RT Donde: nM = nH2 + nCO Y la presión de la mezcla PM PM = Pt – Pv = 786 mmHg – 6.9 mmHg = 779.1 mmHg nM = PM ∗V = RT 779.1mmHg ∗ 2A = 0.088mol mmHg − A ∗ 283K K − mol 62.4 El número de moles de hidrógeno es: n= 0.12gH2 = 0.06mol 2g / mol nCO = 0.088 − 0.06 = 0.028mol Y la masa de monóxido de carbono es: m = nM = 0.028mol ∗ 28g / mol = 0.784gCO Rpta.- 3.09∗10−5 lb, b) 0.784 f 5. (20 puntos) Un gas desconocido se difunde a una velocidad de 8 mililitros por segundo, en un aparato de difusión, donde el metano lo hace con una velocidad de 12 mililitros por segundo. ¿Cuál es el peso molecular del gas desconocido? Solución.- Aplicamos la ley de Graham: v1 = v2 M2 M1 Donde: gas desconocido = 1 y el metano = 2, v1 = 8 ml/s, v2 = 12 ml/s, M1 = ¿? Reemplazando datos: 8ml / s = 12ml / s 16 M1 ⇒ 0.4444 = 16 ⇒ M1 = 36.0g / mol M1 El peso molecular del gas desconocido es 36.0 g/mol. Rpta.- 36.0 g/mol 80 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 3 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) La constante universal de los gases ideales es: i) 8.314 J K − mol ii) 8.314 N K − mol iii) 1.987 J K − mol iv) ninguno La constante universal de los gases ideales se ha determinado en condiciones de presión y temperatura estándar o condiciones normales. P = 1 atm = 1.013∗105 N/m2, T = 273 K y el volumen molar = 22.4 A/mol = 22.4∗10−3 m3/mol Reemplazando datos: R= 5 PVm 1.013 ∗ 10 = T N ∗ 22.4 ∗ 10−3 273K m2 m3 mol = 8.314 J K − mol Rpta.- (i) b) La humedad relativa del aire húmedo es del 100 % a 25 ºC y 700 mmHg. La humedad absoluta del sistema es: (Pv∗ a 25 ºC = 23.76 mmHg) i) 0.0671 gvapor/gaire ii) 0.0345 gvapor/gaire iii) 0.0789 gvapor/gaire iv) ninguno Para calcular la humedad absoluta, determinamos las masas del aire (M = 29 g/mol) y del agua (M = 18 g/mol) a partir de la ecuación de estado. mH2O maire MH2O PV V = MH2O PV 18 ∗ 23.76gH2O RT = = = 0.0218gH2O / gaire Maire PaireV Maire Paire 29 ∗ 676.24gaire RT Rpta.- (iv) c) Una mezcla gaseosa tiene una composición másica de 20% de metano y 80% de etano, el peso molecular promedio es: i) 25.32 g/mol ii) 22.22 g/mol iii) 20.68 g/mol v) ninguno Si metano = A y etano = B y aplicando la siguiente relación de moles: Por definición: n = nM = n1 + n2 m M mM 0.2mM 0.8mM = + M 16 30 Simplificando mM, 1 = 0.0125 + 0.027 = 0.0395 M M = 25.32g / mol d) La presión absoluta en el fondo de una probeta de 25 cm de altura que contiene mercurio es: i) 250 mmHg ii) 745 mmHg CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL iii) 1010 mmHg iv) Ninguno AUTOEVALUACIÓN 81 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. P = Patm + h Pabs = 760mmHg + 250mmHg = 1010mmHg Rpta.- (iii) e) La velocidad cuadrática media de 1 mol de oxígeno a 300 K es: i) 3.45 km/s ii) 0.484 km/s v = 3RT = M iii) 0.245 km/s iv) ninguno J ∗ 300K K − mol = 483.56m / s −3 32 ∗ 10 kg / mol 3 ∗ 8.314 483.56 m 1km ∗ = 0.484km / s s 1000m Rpta.- (ii) f) La presión absoluta de un gas ideal es negativa cuando: i) Pgas > Pman ii) Pgas < iii) Pgas = Pman Pman iv) ninguno La presión absoluta no es negativa bajo cualquier condición de presión y temperatura, recuerdelo, la presión absoluta nunca es negativa. Rpta.- (iv) g) La presión barométrica se define como: i) Patm – Pman ii) Pgas iii) Pabsoluta iv) Patm La presión barométrica es más conocida como presión atmosférica. Rpta.- (iv) h) Tres atmósferas de presión equivalen a: i) 1485 mmHg ii) 30.99 m H2O 3atm ∗ iii) 54 PSI 760mmHg = 2280mmHg , 1atm 3atm ∗ iv) 0.003 Pa 10.33mH2O = 30.99mH2O 1atm Rpta.- (ii) i) Un gas real tiene comportamiento ideal bajo las siguientes condiciones: i) T altas y P altas ii) P bajas y T altas iii) T bajas y P bajas iv) ninguno Los gases reales que tienen comportamiento ideal también suelen conocerse con el nombre de gases perfectos por ejemplo el oxígeno, hidrógeno, nitrógeno. En cambio algunos gases reales requieren de ciertas condiciones como ser bajas presiones y altas temperaturas para que tengan comportamiento ideal. Rpta.- (ii) j) La presión barométrica en la ciudad de La Paz, es mayor que en: i) Cochabamba ii) El Alto iii) Puerto de Ilo iv) ninguno La presión barométrica depende de la altura, a mayor altura la presión disminuye, La Paz está a más altura que la ciudad de Cochabamba, el Puerto de Ilo. Por tanto está claro que está más bajo que El Alto, entonces la presión atmosférica en La Paz es mayor que la presión atmosférica de El Alto. Rpta.- (ii) 2. (20 puntos) A un recipiente de volumen desconocido se confinan 2160 g de una mezcla de metano y acetileno de peso molecular promedio 18 g/mol, ejerciendo una presión manométrica de 2 PSI. Por destilación fraccionada se consigue extraer el 90% en masa de 82 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. metano y 10% en masa de acetileno, sin variar el volumen ni la temperatura. Sin embargo se observa que la presión manométrica se reduce a 1 PSI. ¿Cuál es el peso molecular de la mezcla gaseosa que queda en el recipiente? Solución.- Por definición de masa molecular promedio y fracciones molares se tiene: (1) MCH4 X CH4 + MC2H2 X C2H2 = 18g / mol CH4 C2H2 (2) X CH4 + XC2H2 = 1 Reemplazando pesos moleculares del metano 16 g/mol y del acetileno 26 g/mol: 16 X CH4 + 26 XC2H2 = 18 , además sabiendo que X CH4 = 1 − X C2H2 ( ) 16 1 − X C2H2 + 26 X C2H2 = 18 ⇒ 10 XC2H2 = 2 El número de moles totales es: n = X C2H2 = 0.2 y X CH4 = 0.8 m 2160g = = 120mol , el número de moles de cada gas 18 g mol M es: XA = nCH4 = 120mol ∗ 0.80 = 96mol nA nT nC2H2 = 120mol ∗ 0.20 = 24mol Las masas iniciales de cada gas son: mCH4 = 96molCH4 ∗ 16g = 1536gCH4 1molCH4 y mC2H2 = 24molC2 H2 ∗ 26g = 624gC2 H2 1molC2 H2 Puesto que se extrae el 90% en masa de metano queda en el recipiente el 10% y si se extrae el 10% en masa de acetileno quedará el 90%, esto es: 1536gCH4 ∗ 10g = 153.6gCH4 100g y 624gC2 H2 ∗ 90gC2 H2 = 561.6gC2 H2 100gC2 H2 La masa total de la mezcla que queda en el recipiente es: 153.6 g + 561.6 g = 715.2 g Y el número de moles de cada gas es: 153.6gCH4 ∗ 1molCH4 = 9.6molCH4 16gCH4 y 561.6gC2 H2 ∗ 1molC2 H2 = 21.6molC2 H2 26gC2 H2 El número de moles que queda en el recipiente es: 9.6 mol + 21.6 mol = 31.2mol La masa molecular de la mezcla de gases que queda en el recipiente es: M = 715.2g = 22.92g / mol 31.2mol Rpta.- 22.92 g/mol 3. (20 puntos) 5 litros de aire saturado al 60 % de vapor de alcohol etílico a 30 °C y 5 atm de presión están contenidos en un recipiente, al cuál se introduce 3 g de alcohol líquido. Calcular: a) la humedad relativa final, cuando se expande a 20 l y la temperatura aumenta a 40 °C y b) la presión total final. Las presiones de vapor de alcohol etílico a 30 y 40 °C son 78.8 y 135.3 torr respectivamente CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 83 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Solución.Condiciones iniciales Condiciones finales V1 = 5litros ϕ1 = 100% V2 = 20litros T1 = 30°C = 303K T2 = 40°C = 313K P1 = 5atm = 3800mmHg PV ∗ = 135.3mmHg ∗ PV = 78.8mmHg a) La presión de vapor del alcohol es: Pv = 60 ∗ 78.8mmHg = 47.28mmHg , por tanto la 100 masa de alcohol en condiciones iniciales es: m= MPvV 46 g mol ∗ 47.28mmHg ∗ 5A = = 0.575gC2 H5OH mmHg − A RT ∗ 303K 62.4 K − mol La masa de alcohol etílico en condiciones finales es de (3 + 0.575) g = 3.575 gC2H5OH Estamos en condiciones de calcular la presión parcial de vapor de C2H5OH, esto es: Pv = mRT = MV mmHg − A ∗ 313K K − mol = 75.90mmHg g 46 mol ∗ 20A 3.575g ∗ 62.4 La humedad relativa en condiciones finales es: ϕ = 75.90mmHg ∗ 100% = 56.10% 135.3mmHg b) Para calcular la presión final total, consideraremos la ley combinada en base a los datos del aire. La presión del aire seco en condiciones iniciales es: PT – Pv = 3800 mmHg – 47.28 mmHg = 3752.72 mmHg Y la presión final del oxígeno es: P2 = T2 V1 313K 5A ∗ ∗ P1 = ∗ ∗ 3752.72mmHg = 969.14mmHg 303K 20A T1 V2 La presión final del sistema es: 969.14 mmHg + 75.90 mmHg = 1045.04 mmHg o 1.375 atm Rpta.- a) ϕ = 56.10% y b) PT = 1045.04 mmHg o 1.375 atm 4. (20 puntos) Un recipiente de 250 ml contiene Kripton a 500 torr y otro recipiente de 450 ml, contiene helio a 950 torr. Se mezcla el contenido de ambos gases, abriendo la llave que los conecta. Si el proceso es isotérmico, calcule; a) la presión total final, b) las fracciones molares de cada gas, c) el peso molecular de la mezcla gaseosa. Solución.- V1 = 250 ml P2 = 500 mmHg KRIPTON V2 = 450 ml P2 = 950 mmHg HELIO Abriendo la llave que los conecta V = 700 ml a) P2 b) XKr y XHe = ¿? c) M = ¿? 84 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. a) la presión total final La presión final de la mezcla gaseosa se determina con la ecuación: PM = nT RT , siendo el VM número de moles totales: nKr = PV 500mmHg ∗ 0.25A 125 PV 950mmHg ∗ 0.45A 427.5 y nHe = = = = = RT RT RT RT RT RT 1 (125 + 427.5) ∗ RT PM = RT = 789.29mmHg 0.70A b) las fracciones molares de cada gas El número de moles totales es: nT = 1 (125 + 427.5) RT La fracción molar del kripton es: X Kr = 125 125 RT RT + 427.5 RT = 0.226.. = 0.23 La fracción molar del helio es: X Kr = 125 125 RT RT + 427.5 RT = 0.226.. = 0.23 c) el peso molecular de la mezcla gaseosa. M = X Kr MKr + X He MHe M = 0.23 ∗ 83.80 + 0.73 ∗ 4 = 22.19g / mol Rpta.- 22.19 g/mol 5. (20 puntos) Un volumen de nitrógeno pasa en 20 segundos por el orificio de un efusímetro. Bajo las mismas condiciones de presión y temperatura un volumen igual de una mezcla de oxígeno y anhídrido carbónico se demora 24 segundos. Calcular la fracción molar de la mezcla gaseosa. Solución.- Consideremos que el nitrógeno es 1 (M = 28 g/mol) y la mezcla gaseosa O2 y CO2 es = 2 (M = ¿?, de acuerdo a la Ley de Graham: v1 = v2 M2 M1 ⇒ V 20 = V 24 M2 28 M2 = 1.44 ∗ 28g / mol = 40.32g / mol MO2 XO2 + MCO2 X CO2 = 40.32 (1) X O2 + X CO2 = 1 ⇒ X O2 = 1 − X CO2 (2) en (1) 32(1 − XCO2 ) + 44 X CO2 = 40.32 Resolviendo: X CO2 = 0.693... = 0.69 y X O2 = 0.31 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 85 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 4 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) ¿Cuál es la presión manométrica en una probeta de 50 cm de profundidad cuando se llena totalmente a 25 ºC con agua? i) 36.76 mmHg ii) 495.00 mmHg iii) 760.00 mmHg iv) ninguno La presión manométrica en mmHg es: hHg ∗ ρHg = hH2O ∗ ρH2O 500 mmH2O hHg = 500mm ∗ 1 g ml = 36.76mmHg 13.6 g ml Rpta.- (i) b) Un tanque de acero contiene nitrógeno a 25 ºC y a una presión de 10 atm. Calcular la presión absoluta a 150 ºC i) 147.00 PSI ii) 54.57 PSI iii) 208.66 PSI iv) ninguno Un tanque de acero significa una variación despreciable de volumen, por lo que aplicamos la ley de Gay Lussac, P1 P = 2 T1 T2 P2 = T2 423K 14.7PSI ∗ P1 = ∗ 10atm = 14.195atm ∗ 208.66PSI T1 298K 1atm Rpta.- (iii) c) 5 g de un gas ideal ocupan 2 litros a 20 ºC y 7.35 PSI de presión, su volumen en condiciones normales es: i) 3.27 litros ii) 0.93 litros iii) 2.55 litros Calculamos el peso molecular del gas, sabiendo que: 7.35PSI ∗ PV = M = mRT = PV iv) ninguno 760mmHg = 380mmHg 14.7PSI m RT M mmHg − A ∗ 293K K − mol = 120.28g / mol 380mmHg ∗ 2A 5g ∗ 62.4 Por tanto: 5g ∗ 1mol 22.4A ∗ = 0.931litros 120.28g 1mol Rpta.- (ii) d) La densidad de un determinado gas ideal a 30 ºC y 1.3 atm de presión es 0.027 g/ml. ¿Cuál es su peso molecular? i) 516 g/mol ii) 51.6 g/mol 86 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL iii) 5.16 g/mol iv) ninguno AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. PV = M = ρ ∗ R ∗T P = m RT M atm − A ∗ 303K K − mol = 516.0g / A 1.3atm 27 g A ∗ 0.082 Rpta.- (i) e) Un bar es una de las unidades de presión cuya equivalencia es: i) 105 Pa ii) 1000 atm iii) 1.013 mmHg iv) ninguno 1 bar = 1∗105 Pa Rpta.- (i) f) El peso molecular de una mezcla gaseosa disminuye cuado: i) aumenta la temperatura ii) disminuye la presión iii) aumenta el volumen iv) ninguno El peso molecular de una mezcla gaseosa solo varía con la composición de sus componentes, no es función de las variables de estado como P, T y V. Rpta.- (iv) g) Según la Ley de Boyle, la humedad relativa de un gas húmedo,……, cuando aumenta la presión. i) aumenta ii) disminuye iii) permanece constante iv) ninguno La humedad relativa varía con la presión y temperatura, en este caso a temperatura constante (Ley de Boyle) sabemos que a mayor presión menor volumen, por lo que la humedad relativa aumenta, inclusive se satura de vapor de agua) Rpta.- (i) h) La energía cinética promedio de 1 mol de aire a 300 K es de: (N = 79% y O = 21% V/V) i) 61.166 J ii) 2494.2 J iii) 3741.3 J iv) ninguno Por definición: 3 nRT 2 3 J Ec = ∗ 1mol ∗ 8.314 ∗ 300K = 3741.3J 2 K − mol Ec = Rpta.- (iii) i) La presión del oxígeno en una mezcla de gases, es de 300 mmHg, y su fracción molar es 0.2. La presión total del sistema es: i) 1500 mmHg ii) 375 mmHg iii) 600 mmHg iv) ninguno Por definición: PA = X A ∗ PT PT = 300mmHg = 1500mmHg 0.2 Rpta.- (i) j) Si el peso molecular promedio de una mezcla de helio y nitrógeno es 20, la fracción molar del helio es: i) 0.33 ii) 0.68 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL iii) 0.44 iv) ninguno AUTOEVALUACIÓN 87 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Sean: helio = 1 (M = 4 g/mol) e nitrógeno = 2 (M = 28 g/mol), por definición: (1) X1M1 + X2 M2 = 10 (2) X1 + X2 = 1 De (1): En (1) X1 = 1 − X 2 4(1 − X2 ) + 28 X2 = 20 Resolviendo: X2 = 6 = 0.666...... 14 X2 = 0.67 y X1 = 0.33 Rpta.- (i) 2. (20 puntos) La masa molecular promedio de 5 lb de masa de una mezcla gaseosa, formada por oxígeno y metano es de 22.4 g/mol y la presión total es de 12 atm, calcular: a) las presiones parciales de dichos gases, b) si se extrae un cuarto de masa de oxígeno y tres cuartos de masa de metano ¿Cuál es la nueva presión absoluta de esta mezcla gaseosa? Solución.- a) Calcular las presiones parciales de dichos gases. Considerando que el oxígeno = 1 (M = 32 g/mol), el metano = 2 (M = 16 g/mol) Planteando las siguientes ecuaciones, sabiendo que: 5lb ∗ 454.6g = 2268g 1lb m1 + m2 = 2268g En la ecuación (1) por definición de n = (1) m , m = nM M 32n1 + 16n2 = 2268 (2) n1 + n2 = nT (3) Pero m 2268g = = 101.25 M 22.4 g mol nT = n1 + n2 = 101.25 (4) Resolviendo las ecuaciones (2) y (4): 32n1 + 16n2 = 2268 n1 + n2 = 101.25 n1 = 40.50mol y X2 = n2 = 60.75mol 60.75mol = 0.60 y X1 = 0.40 101.25mol Las presiones parciales son: PCH4 = 12atm ∗ 0.60 = 7.20atm y PO2 = 12atm ∗ 0.40 = 4.80atm b) si se extrae un cuarto de masa de oxígeno y tres cuartos de masa de metano ¿Cuál es la nueva presión absoluta de esta mezcla gaseosa? 88 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Las masas de oxígeno y de metano inicialmente son: y m1 = 32 ∗ 40.50 = 1296g m2 = 16 ∗ 60.75 = 972g Si extraemos ¼ de masa de oxígeno queda ¾ de masa de oxígeno. 1296gO2 ∗ 3 = 972gO2 4 Si extraemos ¾ de masa de metano, queda ¼ de masa de metano. 972gCH4 ∗ El número total de moles es: nT = 1 = 243gCH4 4 972 243 + = 45.56mol 32 16 Gráficamente se tiene la siguiente interpretación: V2 = V T2 = T n2= 45.56 mol P2 = ¿? V1 = V T1 = T n1= 101.25 mol P1 = 12 atm CONDICIONES INICIALES P1V = n1RT CONDICIONES FINALES (1) P2V = n2 RT (2) Dividiendo las ecuaciones (2) / (1) P2V n RT = 2 P1V n1RT Simplificando: P2 = 12atm ∗ 45.56mol = 5.40atm 101.25mol Rpta.- a) 7.20 y 4.80 atm, b) 5.40 atm 3. (20 puntos) Uno de los ambientes de los laboratorios de Ingeniería de Materiales de la UMSA tiene las siguientes dimensiones 4 m ∗ 12 m ∗ 3 m, donde la temperatura ambiente es 68 ºF y la humedad relativa de 60%. Si la presión de vapor de agua a 68 ºF es de 17.4 mmHg, determinar: a) la humedad absoluta de dicho ambiente, b) la densidad del aire húmedo. Solución: 3m 12 m V = 12∗4∗3 m3 = 144 m3 V = 144000litros T = 68 ºF = 20 ºC = 293 K 4m La humedad absoluta se calcula a partir de la siguiente expresión matemática: CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 89 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. ψ = masadecapordeagua masadeaire La masa de vapor de agua y de aire se determina con la ecuación de estado: mv = Donde: Pv = MPvV RT y maire = MPaireV RT 60 ∗ 17.4mmHg = 10.44mmHg y Paire = 495mmHg − 10.44mmHg = 484.56mmHg 100 y V = 144000 A mv = mv = 18g / mol ∗ 10.44mmHg ∗ 144000A = 1480.07g mmHg − A 62.4 ∗ 293K K − mol 29g / mol ∗ 484.56mmHg ∗ 144000A = 110676.61g mmHg − A 62.4 ∗ 293K K − mol ψ = 1480.07gH2O = 0.0134gH2O / gaire 110676.61gaire La densidad del aire húmedo es: ρ airehúmedo = 1480.07g + 110676.61g = 0.779g / A 144000A Rpta.- a) 0.0134, b) 0.779 g/A 4.- 12 g de yodo gaseoso de densidad 4.66 g/cm3, se colocan en un matraz de 1 litro. El matraz, se llena entonces con nitrógeno a 20 ºC y 750 mmHg y se cierra, se calienta ahora hasta 200 ºC, temperatura a la cual el yodo está vaporizado. ¿Cuál es la presión final? Solución.- YODO V = 1 litro T = 473 K P2 = ¿? Mezcla N2 y I2 V = 1 litro T = 293 K P = 750 mmHg N2 I2 CONDICIONES INICIALES CONDICIONES FINALES Para calcular la presión final, aplicaremos la ecuación de estado: P2 = nT RT V Donde el número de moles totales determinamos a partir de las condiciones iniciales del problema. Moles de yodo gaseoso: Moles de nitrógeno gaseoso: n1 = 12gI2 ∗ n= PV = RT 1molI2 = 0.047molI2 254gI2 750mmHg ∗ 1A = 0.041molN2 mmHg − A ∗ 293K K − mol 62.4 90 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Siendo la presión total: P2 = (0.047 + 0.041) mol ∗ 62.4 1A mmHg − A ∗ 473K K − mol = 2597.34mmHg P2 = 2597.34mmHg ∗ 1atm = 3.42atm 760mmHg Rpta.- 3.42 atm 5. (20 puntos) El cloro se escapa a través de una pequeña abertura a una rapidez de 1/6 de la del hidrógeno, en las mismas condiciones de presión y temperatura. Sabiendo que 1 litro de hidrógeno tiene una masa de 0.0899 g. Calcular la densidad del cloro. Solución.- Si el cloro es = 1 y el hidrógeno 2, además ρhidrógeno = 0.0899g / A Aplicando la ley de difusión/efusión de gases de Graham, se tiene: v2 = v1 v1 = ρ1 ρ2 (1) v 1 v ⇒ 2 = 6 , reemplazando en (1) 6 2 v1 6= ρ1 ρ2 ρ1 = 0.0899g / A ∗ 36 = 3.24g / A pta.- 3.24 g/A CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 91 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 5 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) La presión parcial del H2 de 4 g de hidrógeno y 2 g de helio en un recipiente a 1 atm es: i) 0.25 atm ii) 0.75 atm iii) 0.5 atm iv) 0.8 atm Calculamos la fracción molar del hidrógeno, sabiendo que el hidrógeno = 1 (M = 2 g/mol) y helio = 2 (M = 4 g/mol) n1 = m 4 = = 2mol M 2 X1 = y n2 = m 2 = = 0.5mol M 4 2 = 0.80 2.5 La presión parcial del hidrógeno es: P1 = X1 ∗ PT = 0.80 ∗ 1atm = 0.80atm Rpta.- (iv) b) Si la fracción molar del O2, en una mezcla con H2 es 0.20, el peso molecular de la mezcla es: i) 4 g/mol ii) 6 g/mol iii) 8 g/mol iv) ninguno La fracción molar del hidrógeno es: X H2 = 1 − 0.20 = 0.80 M = 0.20 ∗ 32 + 0.80 ∗ 2 = 8g / mol Rpta.- (iii) c) ¿Dónde se difunde más rápidamente el hidrógeno? i) en el aire ii) en nitrógeno iii) en oxígeno iv) en metano Recordemos que difusión es la expansión de un gas a travéz de otro medio gaseoso, los gases se difunden más rapidamente en gases menos densos. Aire (M = 29 g/mol), Nitrógeno (M = 28 g/mol), Oxígeno (M = 32 g/mol) y metano (M = 16 g/mol) Rpta.- (iv) d) Si a nivel del mar, la presión manométrica de un gas es −10 pulg de agua, su presión absoluta es: i) 800 mmHg ii) 567 mmHg iii) 700 mmHg iv) Ninguno Gráficamente su interpretación es: h = 10 pulg La presión absoluta del gas se calcula a partir de un balance de presiónes que el lector conoce: H2O Pabs = Patm − h La presión manométrica en mmHg es: 92 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. 10 pu lg∗ h= 25.4mm = 254mm 1pu lg 254mm ∗ 1 g cm3 13.6 g cm3 = 18.676mmHg Pabs = 760mmHg − 18.68mmHg = 741.32mmHg Rpta.- (iv) e) Si la densidad de un gas “A” respecto al H2 en C.N. es 4.5, Su peso molecular es: i) 9 g/mol ii) 12 g/mol iii) 16 g/mol iv) ninguno Por definición: ρ = PM RT Por condición del problema: ρ x = 4.5ρH 2 Reemplazando la anterior expresión: PMH2 PMx = 4.5 ∗ RT RT Mx = 4.5 ∗ 2g / mol = 9g / mol Rpta.- (i) f) Si la presión manométrica de un gas es 110 torr en “El Alto”, la presión absoluta es mayor en: i) La Paz ii) Santa Cruz iii) Arica iv) son iguales La presión absoluta de un gas es igual en todas partes, lo que varía es la presión manométrica y la presión atmosférica. Rpta.- (iv) g) La presión manométrica de un gas ideal es negativa cuando: i) Pgas > Patm ii) Pgas < iii) Pgas = Patm atm iv) ninguno La presión manométrica es negativa cuando la presión atmosférica es mayor que la presión absoluta de un gas ideal. Rpta.- (ii) h) ¿Cuál de las siguientes unidades corresponde a unidades de presión? i) lb/pulg3 ii) Newton − m iii) pulg de agua iv) Ninguno La unidad de presión es: pulg de agua. Rpta.- (iii) i) La unidades de la constante “b” en [V − nb] es: i) mol 2 A2 ii) A2 mol 2 De acuerdo al análisis dimensional: iii) mol 2 ∗ A2 iv) ninguno nb = [ A ] CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 93 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Por lo que: b= A mol Rpta.- (iv) j) Una probeta de 1.5 cm2 de sección transversal contiene 100 ml de Hg, La presión en el fondo es: i) 27.59 PSI ii) 30.22 PSI iii) 40.33 PSI iv) ninguno La presión en el fondo es la presión absoluta producida por el peso del mercurio y la presión atmosférica, esto es: P = F A 2 ⎛ 1m ⎞ −4 2 A = 1.5cm2 ∗ ⎜ ⎟ = 1.5 ∗ 10 m ⎝ 100cm ⎠ 100mlHg ∗ P = 13.6g mg = 1360gHg , pero: P = 1ml A 1.36Kg ∗ 9.8m / s2 = 8.89 ∗ 104 N / m2 1.5 ∗ 10−4 m2 8.89 ∗ 104 N / m2 ∗ 1atm = 0.877atm 1.013 ∗ 105 N / m2 P = 1atm + 0.877atm = 1.877atm ∗ 14.7PSI = 27.59PSI 1atm Rpta.- (i) 2. (20 puntos) Un gas que se considera ideal contiene 20% en masa de hidrógeno, 36% en masa de oxígeno y el resto helio. Calcular: a) El peso molecular de la mezcla gaseosa, b) la densidad de la mezcla gaseosa a la presión de 495 mmHg y a la temperatura de 15 ºC, c) las presiones parciales de cada gas en la mezcla. Solución.- a) Puesto que la composición de los gases está en masa, consideraremos la suma de moles de cada uno de los gases de acuerdo a la siguiente ecuación: nH2 + nO2 + nHe = nT Conociendo que: n= m , M Además que el hidrógeno = 1 (M = 2 g/mol), oxígeno = 2 (M = 32 g/mol), helio = 3 (M = 4 g/mol), m1 = 0.20 m, m2 = 0.36 m y m3 = 0.44 m 0.2m 0.36m 0.44m m + + = 2 32 4 M Simplificando m y efectuando cálculos, se tiene: M = 4.52g / mol 94 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. b) la densidad de la mezcla gaseosa a la presión de 495 mmHg y a la temperatura de 15 ºC Aplicando la ecuación de estado: PV = ρ = m PM ∗ RT ⇒ ρ = M RT 495mmHg ∗ 4.52g / mol = 0.124g / A mmHg − A 62.4 ∗ 288K −K − mol c) las presiones parciales de cada gas en la mezcla. ρ = PM RT Considerando 1 g de mezcla: n1 = 0.2g = 0.1mol , 2g / mol n2 = n3 = 0.36g = 0.011mol , 32g / mol 0.44g = 0.11mol 4g / mol X H2 = 0.1 = 0.45 0.221 X O2 = 0.011 = 0.05 0.221 X He = 0.11 = 0.50 0.221 PH2 = 0.45∗495 mmHg = 222.75 mmHg PO2 = 0.05∗495 mmHg = 24.75 mmHg PHe = 0.5∗495 mmHg = 247.5 mmHg Rpta.- a) 4.52 g/mol, b) 0.124 g/A, PH2 =222.75mmHg 3. (20 puntos) Un experimentador estudia una mezcla gaseosa compuesta por 40% en masa de CO2 y el resto NO, se encuentra en un recipiente de 20 litros. Si se agrega un 60% en masa de la mezcla gaseosa su temperatura se incrementa en 20 ºC y la presión final resulta el doble del valor inicial. Calcular: a) La temperatura final de la mezcla gaseosa en grados Celsius, b) la masa inicial de la mezcla gaseosa a la presión inicial de 1 atm. Solución.+ 60% P/P V1 = 20 A t1 = t P1 = P m1 = m CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL V2 = 20 A t2 = t + 20 ºC P1 = 2P m2 = 1.6m1 AUTOEVALUACIÓN 95 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. 40% CO2 y 60% NO 40% CO2 y 60% NO Considerando la ecuación general de los gases ideales para ambos estados (inicial y final) P1V1 = m1 M ∗ RT1 (1) y P2V2 = m2 M ∗ RT2 (2) Dividiendo (2) / (1) reemplazando sus datos respectivos: 2P ∗ V = P ∗V 1.6m ∗ RT2 M m ∗ RT1 M Simplificando las variables: T2 = 1.25T1 Puesto que T = t + 273: t + 20 + 273 = 1.25(t + 273) t = −193º C La temperatura final es: t2 = t + 20 = −193 + 20 = −173º C b) la masa inicial de la mezcla gaseosa a la presión inicial de 1 atm. P = 1 atm, T = 80 K, V = 20 A y el peso molecular es: Sea CO2 = 1 (M = 44 g/mol) y NO = 2 (M = 30 g/mol) n1 + n2 = nT m Puesto que: n = M 0.40m 0.60m m + = 44 30 M Simplificando m y efectuando cálculos: M = 34.375g / mol m= MPV 34.375g / mol ∗ 1atm ∗ 20A = = 104.80g atm − A RT 0.082 ∗ 80K K − mol Rpta.- a) t = − 173 ºC, m = 104.80 g 4. (20 puntos) Un auxiliar de química de la carrera de Ingeniería Química de la UMSA, recoge 1 litro de nitrógeno sobre acetona a 20 ºC y 850 mmHg, el gas obtenido tiene una humedad relativa del 75%, calcular: a) la masa de acetona que se ha evaporado, b) la masa de acetona que retorna al estado líquido si el gas se comprime isotérmicamente hasta 5 atm, c) a partir de las condiciones iniciales calcule el volumen de nitrógeno seco en C.N. (la presión de vapor de la acetona a 20 ºC es de 198 mmHg). 96 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Solución.- El gráfico nos permite dar una buena interpretación del problema. a) la masa de acetona que se ha evaporado determinamos con la ecuación de estado. mv = V = 1 A N2 T = 20 ªC = 293 K P = 850 mmHg = Pv + PN2 ϕ = 75% MvPvV RT Donde Mv es el peso molecular de la acetona CH3COCH3 = 58 g/mol, Pv es la presión de vapor igual a: Pv = 75 ∗ 198mmHg = 148.5mmHg 100 Por tanto: mv = 58g / mol ∗ 148.5mmHg ∗ 1A = 0.471gCH3COCH3 mmHg − A 62.4 ∗ 293K K − mol b) Cuando comprimimos a 5 atm de presión a temperatura constante, el volumen disminuye, por tanto el gas se satura con vapor de acetona siendo la humedad relativa del 100%, por lo que se debe calcular el volumen del gas en las nuevas condiciones para volver aplicar la ecuación de estado y determinar la masa de vapor de acetona. P1V1 = P2V2 Donde P1 = (850 – 148.5) mmHg = 701.5 mmHg, V1 = 1 litro, P2 = (3800 – 198) mmHg = 3602 mmHg V2 = mv = 701.5mmHg ∗ 1A = 0.195A 3602mmHg 58g / mol ∗ 198mmHg ∗ 0.195A = 0.122gCH3COCH3 mmHg − A 62.4 ∗ 293K K − mol La masa de acetona que retorna al estado líquido es: mv = 0.471g − 0.122g = 0.349g c) A partir de las condiciones iniciales calcule el volumen de nitrógeno seco en C.N. V1 = 1 A N2 V3 = ¿? T1 = 20 ºC = 293 K P = 850 mmHg = Pv + PN2 ϕ = 75% P1 = 701.5 mmHg T3 = 273 K P3 = 760 mmHg P3V3 PV = 1 1 T3 T1 V3 = 701.5mmHg ∗ 1A ∗ 273K = 0.86A 760mmHg ∗ 293K Rpta.- 0.471g, b) 0.349 g, c) 0.86 litros CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 97 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. 5. (20 puntos) Cierto gas se encuentra a una presión de 650 mmHg a 35 ºC, teniendo en cuenta que la velocidad del gas con respecto al oxígeno es de 2.83, calcular: a) la densidad del gas, b) el número de moléculas por litro. Solución.- a) Para hallar la densidad del gas vamos ha considerar la ley general de los gases ideales. PM RT ρ = Considerando que el gas es = 1 (M1 = ¿?), y el oxígeno = 2 (M2 = 32 g/mol), aplicamos la ley de Graham, para hallar el peso molecular del gas y a partir de ello la densidad de este gas con la ecuación de estado. v1 = v2 M2 M1 Reemplazando datos y efectuando operaciones: (2.83) 2 = M2 M1 De donde: M1 = 4 g/mol ρ = 0.135 650mmHg ∗ 4g / mol = 0.135g / A mmHg − A 62.4 ∗ 308K K − mol g 1mol 6.023 ∗ 1023 moléculas ∗ ∗ = 2.03 ∗ 1022 moléculas A 4g 1mol Rpta.- a) 4 g/mol, b) 2.03∗1022 moléculas 98 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 6 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) Al comprimir un gas hasta ½ de su volumen inicial, la suma de presiones es 10 atm. La presión final del gas a temperatura constante es: i) 3.33 atm ii) 6.67 atm iii) 5 atm iv) ninguno Sean: V1 = Vo, V2 = ½ Vo, P1 + P2 = 10 atm Considerando la Ley de Boyle: (1) P1 ∗ V1 = P2 ∗ V2 V P2 V = 1 = o = 2 , P2 = 2P1 1 V P1 V2 2 o Reemplazando en (1) P1 + 2P1 = 10 P1 = 3.3333…. P1 = 3.33 atm P2 = 6.67 atm Rpta.- (ii) b) Cuando los gases se encuentran a una determinada presión y temperatura constante, se cumple que %Xi = %V/V, se deduce a partir de la: i) Ley de amagat ii) Ley de Dalton iii) Ley de Avogadro iv) ninguno A partir de la Ley de Amagat que nos dice que a presión y temperatura constante: VT = V1 + V2 + ……. Sus relaciones volumétricas es igual a sus relaciones molares: Donde X1 = n1 , por tanto se cumple que: nT V1 n = 1 VT nT %V / V = % X i Rpta.- (i) c) El hidrógeno se difunde en una relación de velocidad igual a 5 respecto a un gas ideal. El peso molecular del gas ideal es: i) 75 g/mol ii) 25 g/mol iii) 50 g/mol De acuerdo a la Ley de Graham, se tiene: v1 = v2 iv) ninguno M2 , donde Hidrógeno = 1 (M = 2 g/mol) M1 y el gas ideal es 2 v1 =5= v2 M2 M1 M2 = 25 M1 M2 = 50 g/mol CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL Rpta.- (iii) AUTOEVALUACIÓN 99 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. d) La presión de un gas ideal es de 1.78∗105 Pa, por tanto su presión en torr es: i) 800 torr ii) 1567 torr iii) 1700 torr iv) Ninguno Realizando factores de conversión: 1.78 ∗ 105 Pa = 1atm 760mmHg ∗ = 1335.44mmHg 1atm 1.013 ∗ 105 Pa 1335.44 mmHg = 1335.44 torr Rpta.- (iv) e) La denominada constante de Boltzman es una relación de dos constantes, esta relación es: i) R∗NA ii) NA iii) R N A R iv) ninguno R La constante de Boltzman es la relación K = NA Rpta.- (iii) f) Un gas húmedo contiene 20 g de vapor de agua y 898 g de oxígeno. La humedad absoluta es: i) 0.022 g H2O/gO2 ii) 44.9 g O2/H2O iii) 44.9 iv) ninguno Por definición la humedad absoluta es: ψ = masadevapordeagua masa deg as sec o ⇒ ψ = 20gH2O gH2O = 0.022... 898gO2 gO2 Rpta.- (i) g) El peso molecular de 0.235 libras de un gas ideal confinado en un recipiente de 50 litros en condiciones normales es: i) 16.55 g/mol ii) 32.76 g/mol iii) 47.73 g/mol iv) ninguno Por definición: PV = Además: 0.235lb ∗ m RT M ⇒ M = mRT PV 453.6g = 106.596g 1lb M = atm − A ∗ 273K K − mol = 47.73g / mol 1atm ∗ 50A 106.596g ∗ 0.082 Rpta.- (iii) h) Se recoge 1 m3 de aire húmedo, la cual contiene 15 g de agua a 495 mmHg y 25 ºC. La humedad relativa del ambiente es: (Pv = 25.76 mmHg) i) 23.76% ii) 35.07 % iii) 65.22 % iv) ninguno La humedad relativa se calcula a partir de la siguiente ecuación: ϕ = Pv ∗ 100% Pv ∗ Donde Pv es la presión de vapor de agua que se determina con la ecuación de estado. PvV = Pv = mRT = MV m RT M mmHg − A ∗ 298K K − mol = 15.496mmHg 18g / mol ∗ 1000A 15g ∗ 62.4 100 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. ϕ = 15.496mmHg ∗ 100% = 65.22% 23.76mmHg Rpta.- (iii) i) En un recipiente rígido se observa que la presión manométrica aumenta cuando la temperatura se incrementa, esta experimentación fue estudiada por: i) Dalton ii) Charles iii) Amagat iv) ninguno Un “recipiente rígido” significa que la variación de su volumen con la temperatura es despreciable, por lo que se puede considerar un proceso a volumen constante, ya que la presión manométrica aumenta y obviamente la presión absoluta tambieén se incrementa con el aumento de la temperatura, esta experimentación fue estudiada por Gay Lussac. Rpta.- (iv) j) Si el peso molecular promedio de una mezcla de hidrógeno y oxígeno es 10, la fracción molar del hidrógeno es: i) 0.16 ii) 0.73 iii) 0.33 iv) ninguno Escribimos las ecuaciones que relacionan el peso molecular de una mezcla con las fracciones molares de sus componentes: Sean hidrógeno = 1 (M = 2 g/mol), oxígeno = 2 (M = 32 g/mol) X1M1 + X2 M2 = 10 (1) X1 + X 2 = 1 (2) De la ecuación (2) X2 = 1 − X1 , reemplazando en (1) 2 X1 + (1 − X1 )32 = 10 Resolviendo: X1 = 22 = 0.733... = 0.73 30 La fracción molar del hidrógeno en la mezcla gaseosa es 0.73 Rpta.- (iii) 2. (20 puntos) Sube una burbuja de gas desde el fondo en un lago con agua limpia a una profundidad de 4.2 m y a una temperatura de 5 ºC hasta la superficie donde la temperatura del agua es de 12 ºC. ¿Cuál es el cociente de los diámetros de la burbuja en los dos puntos? (suponga que la burbuja de gas está en equilibrio térmico con el agua en los dos puntos. Solución.- Por los datos del problema, P2 = 760 mmHg calcularemos la relación de volúmenes 2 T2 = 285 K final e inicial, considerando la ley combinada: h = 4.2 m P1V1 PV = 2 2 T1 T2 1 ⇒ V2 P T = 1 ∗ 2 V1 P2 T1 V2 1069mmHg 285K = ∗ = 1.44 V1 760mmHg 278K P1 = 760 mmHg + h T1 = 278 K Puesto que las burbujas tienen forma esférica, la delación de diámetros es: V = π 6 d3 ⇒ π π d23 = 1.44 3 6 d1 6 ⇒ d2 = 1.13 d1 Rpta.- d2/d1 = 1.13 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 101 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. 3. (20 puntos) Una muestra de 100 ml de aire medido a 20 ºC y a 750 mmHg ocupó un volumen de 104 ml, cuando se recogió sobre agua a 25 ºC y 750 mmHg. Calcular: a) la presión de vapor de agua a 25 ºC, b) la humedad relativa del gas, c) la humedad absoluta, la presión de vapor de agua a 25 V2 = 104 ml gas húmedo ºC es 23.76 mmHg. T2 = 25 ºC = 298 K P2 = 750 mmHg = Pv + Pg Solución.- Una ilustración del proceso es que se muestra en la figura. ϕ = ¿? CONDICIONES FINALES a) La presión de vapor de agua a 25 ºC Gas seco Está claro que la presión de vapor calculamos a partir de la ley de Dalton H2O PT = Pgas + Pv CONDICIONES INICIALES La presión del aire seco determinamos con la ley combinada: P2V2 PV = 1 1 T2 T1 ⇒ P2 = V1 = 100 ml aire seco T1 = 20 ºC = 293 K P1 = 750 mmHg T2 V1 298K 100ml ∗ ∗ P1 = ∗ ∗ 750mmHg = 733.46mmHg 293K 104ml T1 V2 Pv = 750mmHg − 733.46mmHg = 16.54mmHg b) La humedad relativa del gas: ϕ = 16.54mmHg ∗ 100% = 69.61% 23.76mmHg c) La humedad absoluta: ψ = PvVMv mv PvMv RT = = PgasVMgas mgas PgasMgas RT ⇒ ψ = 16.54 ∗ 18 = 0.014gH2O / gaire 733.46 ∗ 29 Rpta.- a) 16.54 mmHg, b) 69.61% c) 0.014 4. (20 puntos) Dos gases anhídrido sulfuroso y sulfuro de hidrógeno ingresan por los extremos de un tubo horizontal de 100 cm de longitud. El tubo es cerrado y los gases se difunden hacia su encuentro. Considerando la sección uniforme del tubo, en que punto aparecerá azufre elemental, producto de la reacción entre los dos gases. NH4Cl (sólido) ¿en donde? SH2 SO2 1.00 m Solución.- Si consideramos que al anhídrido hiposulfuroso = 1 (M1 = 48 g/mol) y el sulfuro de hidrógeno = 2 (M = 34 g/mol), la aparición del azufre elemental será a menos de 50 cm respecto al SO, esta hipótesis es como consecuencia de que los gases más densos se difunden con menos rapidez que los gases menos densos. Por tanto de acuerdo a la Ley de Graham. 102 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. v1 = v2 M2 M1 Puesto que el tiempo de difusión es el mismo se tiene que: x1 t = x2 t x1 = 0.73 x2 (1) 34 64 (2) x1 + x2 = 100cm 0.73x2 + x2 = 100 x2 = 57.8cm Respecto al anhídrido hiposulfuroso: x1 = 100 − 57.8 = 42.2cm Tal como era de esperarse. Rpta.- 42.2 cm 5. (20 puntos) En el laboratorio de química general de la facultad de Ingeniería de la UMSA, se ha instalado el sistema mostrado en la figura. Si el proceso se lleva a cabo a temperatura constante de 20 ºC, determinar: a) la presión absoluta del sistema y b) la longitud del líquido manométrico del manómetro inclinado, cuando accidentalmente se pierde 3.82 g de masa de aire. (ρKerosene = 0.82 g/ml) Solución.- El lector debe preferentemente trabajar con manómetro normal, observe que la altura manométrica es 75 cm. L = 50 cm d = 40 cm Patm S = 150 cm aire kerosene 1 L = 150 cm h = 150∗sen30º = 75 cm 30º 2 Solución.- a) Cuando la válvula “A” está cerrada, la presión del gas se determina realizado balance de presiones, es decir, consideraremos los puntos 1 y 2 en el manómetro inclinado: P1 = P2 P1 = Pgas P2 = 495 mmHg + h 750mm ∗ 0.82 g ml h= = 45.22mmHg 13.6 g ml La presión del sistema es: Pgas = 495mmHg + 45.22mmHg = 540.22mmHg La masa inicial de aire es: CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 103 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. m= PVM 540.22mmHg ∗ 62.83A ∗ 29g / mol = = 53.82gaire mmHg − A RT 62.4 ∗ 293K K − mol b) La nueva presión manométrica cuando se pierde 3.82 g de aire es: mRT P = = MV mmHg − A ∗ 293K K − mol = 501.715mmHg 29g / mol ∗ 62.83A 50g ∗ 62.4 h 1 2 kerosene 30º h = Patm − Pgas = 501.715mmHg − 495mmHg = 6.515mmHg La presión manométrica en cm de kerosene es: hK = 6.515mm ∗ 13.6g / ml = 108.05mmK 0.82g / ml En cm de kerosene es: 10.805 cm Finalmente, la longitud en el manómetro inclinado es: L2 = h2 10.805cm = = 21.61cm sen30º sen30º Rpta.- a) Pgas = 540.22mmHg, b) L2 = 21.61 cm 104 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. AUTOEVALUACIÓN 7 (Tiempo: 90 minutos) 1. (20 puntos) Analizando las siguientes preguntas y resolviendo sistemáticamente los problemas, subraye la respuesta que usted considere correcta. a) En un proceso isotérmico, cuando la presión aumenta, la densidad del hidrógeno gaseoso: i) aumenta ii) disminuye iii) permanece constante La densidad de un gas depende del volumen, recuerde que ρ = iv) ninguno m , un aumento en el V volumen de un gas, hace que disminuya su densidad y una disminución de volumen hace incrementar la densidad. Por tanto en un proceso isotérmico (Ley de BOYLE) a mayor presión el volumen disminuye, por tanto la densidad se incrementa. Rpta.- (i) b) ¿Cuál de los siguientes gases tiene mayor velocidad cuadrática media a 500 K? i) acetileno Según la ecuación: v = ii) ciclo propano iii) benceno iv) nitrógeno 3RT , Cuanto mayor es el peso molecular de un gas, su velocidad M es menor, revisando los pesos moleculares de los gases: M(acetileno, C2H2) = 26 g/mol, M(ciclopropano, C3H6) = 42, M(bencenoC6H6) = 78 g/mol), vemos que el acetileno es el gas menos denso, por lo que es el acetileno el que tiene mayor velocidad cuadrática media. (i) c) La relación de fracciones molares del oxígeno respecto al helio es de 4. La fracción molar del helio es: i) 0.20 ii) 0.80 iii) 0.16 iv) 0.64 Considerando que el oxígeno = 1 y el helio = 2, De (1): X1 =4 X2 (1) X1 + X 2 = 1 (2) Además, X1 = 4 X2 , reemplazando en (2) 4 X2 + X2 = 1 X2 = 0.20 La fracción molar del helio es: 0.20 Rpta.- (i) d) La constante universal de los gases ideales en unidades del sistema internacional es i) 0.082 atm − A K − mol ii) 1.987 cal K − mol iii) 8.314 J K − mol iv) ninguno La constante universal de los gases ideales se ha determinado en condiciones de presión y temperatura estándar o condiciones normales. P = 1 atm = 1.013∗105 N/m2, T = 273 K y el volumen molar = 22.4 A/mol = 22.4∗10−3 m3/mol CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 105 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. Reemplazando datos: R= 5 −3 PVm 1.013 ∗ 10 N m2 ∗ 22.4 ∗ 10 = 273K T m3 mol = 8.314 J K − mol Rpta.- (iii) e) La masa molecular de una mezcla de gases es de 15 g/mol, a 0 ºC si la temperatura aumenta a 60 ºC, La masa molecular de esta mezcla: i) aumenta ii) disminuye iii) permanece constante iv) ninguno La masa molecular de los gases no aumenta ni disminuye por cambios de cualquiera de las variables involucrados en un proceso determinado, es constante Rpta.- (iii) f) Una burbuja de 1 pulg de diámetro se halla a 10 m de profundidad de un mar de agua dulce, cuando asciende a la superficie su volumen: i) aumenta ii) disminuye iii) permanece constante iv) ninguno Puesto que no se tiene ninguna información acerca de la temperatura, vamos a considerar proceso isotérmico. Recordemos también que la presión atmosférica es de 1 atm, ya que tampoco se tiene ninguna información al respecto. Por tanto la presión a 10 m de profundidad es mayor a la presión en la superficie del agua. Si la burbuja asciende hacia la superficie su presión disminuye, por lo que su volumen aumenta. Rpta.- (i) g) El proceso denominado isocórico fue estudiado por: i) Boyle ii) Charles iii) Gay Lussac iv) Dalton El proceso isocórico es a volumen constante que fue estudiada por Gay Lussac Rpta.- (iii) h) El peso molecular de un gas “x” de densidad relativa 0.137, en C.N. es: i) 2 g/mol ii) 4 g/mol iii) 16 g/mol iv) 26 g/ mol Recordemos que la densidad relativa de un gas está dada por la expresión: ρ rel = ρx ρ aire La densidad absoluta del gas “x” es: ρ x = 0.137 ∗ 1.3g / A = 0.178g / A El peso molecular se determina con la ecuación de estado: M = ρ xRT P = atm − A ∗ 273K K − mol = 3.98... = 4.0 1atm 0.178g / A ∗ 0.082 Rpta.- (ii) i) ¿Cuál de los siguientes gases tiene mayor presión? i) O2 a 1000 torr ii) N2 a 20 PSI iii) H2 a 1.2 atm iv) He a 1∗104 Pa Convertiremos a una sola unidad, por ejemplo a mmHg para relacionar cada presión: 20PSI ∗ 760mmHg 760mmHg = 1034mmHg , 1.2atm ∗ = 912mmHg 14.7PSI 1atm 760mmHg 1 ∗ 104 Pa ∗ = 75.02mmHg 1.013 ∗ 105 Pa Rpta.- (ii) 106 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. j) un gas tiene una velocidad cuadrática media de 1.2 km/s a 300 K, su peso molecular es: i) 2 g/mol ii) 4 g/mol iii) 16 g/mo iv) ninguno Considerando la expresión: M = v = 3RT = v2 3RT M J ∗ 300K K − mol = 5.20 ∗ 10−3 Kg / mol 2 (1200m / s ) 3 ∗ 8.314 M = 5.20 ∗ 10−3 Kg / mol ∗ 1000g = 5.20g / mol 1kg Rpta.- (iv) 2. (20 puntos) El neumático de una bicicleta se llena con aire a una presión manométrica de 550 KPa a 20 ºC, a) ¿Cuál es la presión manométrica del neumático después de manejarla en un día soleado cuando la temperatura del aire es de 40 ºC? (suponga que el volumen no cambia y recuerde que la presión manométrica significa la presión absoluta en el neumático menos la presión atmosférica. Además considere que la presión atmosférica permanece constante e igual a 101 KPa, b) determine la masa de aire que contiene el neumático de la bicicleta considerando que el diámetro de la llanta es 60 cm y que el diámetro interior del neumático es de 1 pulgada Solución.- Puesto que el cambio es a volumen constante, aplicaremos la ley de Gay Lussac, pero previamente determinaremos la presión absoluta del neumático en condiciones iniciales, de acuerdo al siguiente esquema: h1 = 550 kPa T1 = 293 K m1 = mo V1 = V h1 = 550 KPa CONDICIONES INICIALES h2 = ¿? T2 = 313 K m2 = mo V2 = V h2 = ¿? CONDICIONES FINALES P1 = h1 + Patm = 550KPa + 101KPa = 651KPa Después de manejarla la presión final es: P2 = T2 313K ∗ P1 = ∗ 651KPa = 695.44KPa T1 293K Finalmente la presión manométrica final es: h2 = P2 − Patm = 695.44KPa − 101KPa = 594.44KPa Puesto que la masa de aire en el neumático es constante, no hay cambio de volumen y tampoco pérdida de masa, se tiene que: m= PVM RT Donde: CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 107 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. P1 = 651KPa ∗ 1000Pa 1atm ∗ = 6.43atm 1KPa 1.013 ∗ 105 Pa El volumen del neumático determinamos de la siguiente manera: El perímetro del neumático es entonces: P = 2πR = 2∗π 30 cm = 188.50 cm D = 60 cm Si desarrollamos el neumático se tiene aproximadamente la forma de un cilindro: d = 2.54 cm P = 188.50 cm El volumen es entonces: V = π 4 d2h = π 4 ∗ (2.54cm ) ∗ 188.5cm = 955.14cm3 2 Y la masa: m= 6.43atm ∗ 0.955A ∗ 29g / mol = 7.41g atm − A 0.082 ∗ 293K K − mol Rpta.- a) 594.44 KPa, b) 7.41 g 3. (20 puntos) Una mezcla gaseosa de nitrógeno y vapor de agua se introduce en un matraz sin aire que contiene un deshidratante sólido, si la presión de 495 torr al comienzo, decae después de un tiempo a una presión de equilibrio de 471 torr. Calcular: a) la composición molar de la mezcla gaseosa original, b) el volumen del matraz, si el agente deshidratante sufre un aumento de masa de 0.20 g a 25 ºC. (Desprecie el volumen del agente deshidratante). Solución.- De acuerdo al problema se tiene el siguiente esquema: Mezcla gaseosa N2 y vapor de H2O PT = P 1 + Pv 495 mmHg CONDICIONES INICIALES AGENTE DESHIDRATANTE N2 P2 = 471 mmHg magua = 0.20 H2O T2 = 25 ºC CONDICIONES FINALES Del análisis anterior deducimos que la presión del nitrógeno es 471 mmHg y del vapor de agua es 24 mmHg. a) La composición molar de la mezcla es entonces: X N2 = 471mmHg 24mmHg = 0.951 y X H2O = = 0.049 495mmHg 495mmHg b) para determinar el volumen del matraz, se tienen los siguientes datos: masa de vapor de agua = 0.20 g, temperatura de 298 K, presión de vapor de agua = 24 mmHg, por tanto: V = mRT = PM mmHg − A ∗ 298K K − mol = 8.60A 24mmHg ∗ 18g / mol 0.20g ∗ 62.4 108 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. h = 10 cm 4. (20 puntos) En el laboratorio de Química General de la Facultad de Ingeniería de la UMSA, se hacen burbujear 2.7 mg de hidrógeno seco sobre agua, luego el sistema se estabiliza a 15 ºC de acuerdo con la figura, en la cual h es 10 cm. Si el volumen ocupado por el gas es de 40 ml. Determinar: a) la fracción molar del hidrógeno, b) la densidad de la mezcla húmeda, c) la humedad relativa, d) la humedad absoluta. La presión de vapor a 15 ºC es de 12.80 mmHg. Solución.Para determinar la fracción molar de la mezcla gaseosa recogida en agua calcularemos la masa de vapor de agua. H2O Realizando balance de presiones: h = 10 cm PA = PB A PA = Patm + h (1) PB = PH2 + Pv (2) Donde: Patm = 495 mmHg, Pv = Presión de vapor del agua = ¿?, h = 10 cm H2O y la presión del hidrógeno es: B H2O PH2 = mRT = MV mmHg − A ∗ 288K K − mol = 494.21mmHg 2g / mol ∗ 0.040A 0.0022g ∗ 62.4 La presión manométrica es: h= 100mm ∗ 1g / ml = 7.35mmHg 13.6g / ml Igualando (1) = (2) Patm + h = PH2 + Pv Pv = 495mmHg + 7.35mmHg − 494.21mmHg = 8.14mmHg La masa de vapor de agua es: m= MPvV 18g / mol ∗ 8.14mmHg ∗ 0.04A = = 3.26 ∗ 10−4 gH2O mmHg − A RT 62.4 ∗ 288K K − mol nH2 = nH2O = 0.0022g = 1.1 ∗ 10−3 gH2 2g / mol 3.26 ∗ 10−4 g = 1.81 ∗ 10−5 mol 18g / mol Por tanto la fracción molar del hidrógeno es: X H2 = 1.1 ∗ 10−3 = 0.984 y X H2O = 1 − 0.984 = 0.016 1.1 ∗ 10−3 + 1.81 ∗ 10−5 mol b) La densidad de la mezcla húmeda es: CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN 109 EL ESTADO GASEOSO Mg. Sc. Ing. Leonardo G. Coronel R. ρ = 0.0022g + 3.26 ∗ 10−4 g = 0.03g / A 0.04A c) La humedad relativa es: ϕ = Pv 8.14mmHg ∗ 100% = ∗ 100% = 63.59% 12.8mmHg Pv ∗ d) La humedad absoluta es: ψ = 3.26 ∗ 10−4 gH2O = 0.148gH2O / g gas 0.0022ggas Rpta.- a) 0.016, b) 0.03, c) 63.59%, d) 0.148 5. (20 puntos) Se tiene una muestra de dos gases diferentes A y B. El peso molecular de A es el doble que el de B. Si ambas muestras contienen el mismo número de moléculas por litro, siendo la velocidad cuadrática media de A el doble que la de B y la presión de B es 3 atm. ¿Cuál es la presión de B? Solución.- Considerando los datos del problema: MA = 2MB, NA = NB, VA = VB, vcmA = 2 vcmB, PB = 3 atm PA = ¿?. Ahora recordemos la ecuación fundamental de la teoría cinética molecular: 1 Nm ' v 2 3 1 M 2 PV = N v 3 NA PV = Además: m = M y por tanto: NA Para el gas A = 1 y para el gas B = 2 se tiene: P1V = M 1 N 1v2 3 1 NA 1 (1) P2V = M2 2 1 N v 3 2 NA 2 (2) Reemplazando datos y dividiendo (1) / (2): 1 2M2 N (2v2 )2 P2V 3 NA = 1 M2 2 P1V N v 3 NA 2 ⇒ P2 =8 P1 La presión de B es entonces: P2 = PB = 24 atm Rpta.- 24 atm 110 CÓMO RESOLVER PROBLEMAS EN QUÍMICA GENERAL AUTOEVALUACIÓN