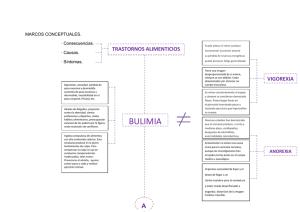
RET 24.qxd (Page 1)
Anuncio

Revisión de los cambios endocrinos en la anorexia nerviosa R.K. St0ving, J. Hangaard, M. Hansen-Nord, C. Hagen Resumen. La anorexia nerviosa es un síndrome de etiología desconocida. Se asocia con múltiples anormalidades endocrinas. Las monoaminas hipotalámicas (especialmente la serotonina), los neuropéptidos (especialmente el neuropéptido Y y la colecisto-quinina) y la leptina participan en la regulación del apetito humano, y se transforman de diversas formas en la anorexia nerviosa. Sin embargo, aún queda por clarificar si la alteración de la regulación del apetito es secundaria o etiológica. Parece que el hambre trae como consecuencia un aumento en la secreción de la hormona de emisión de corticotropina y propiomela-nocortina, no obstante, hay evidencias de que puede mantener e intensificar la anorexia, la actividad física excesiva y la amenorrea. La amenorrea hipotalámica, que es un criterio de diagnóstico en la anorexia nerviosa, tiene otras implicaciones y no únicamente el bajo peso y el ejercicio. La resistencia de la hormona del crecimiento con una baja producción del factor de crecimiento I similar a la insulina y una secreción de la hormona de crecimiento elevada reflejan una insuficiencia nutricional. La terapia nutricional de los pacientes con anorexia nerviosa puede mejorarse con la administración de un agente anabólico como la hormona del crecimiento o el factor I de crecimiento similar a la insulina. Hasta ahora, no se ha demostrado que ninguna de las anormalidades endocrinas sea primaria, sin embargo, hay una evidencia creciente de que alguna de ellas puedan formar parte de ese círculo vicioso. INTRODUCCIÓN La anorexia nerviosa (AN) es un síndrome que se ajusta a los siguientes criterios de diagnóstico: 1- pérdida de peso hasta un 85% menos que el correspondiente a la edad y la altura; 2- temor intenso a la obesidad; 3- visión trastornada del cuerpo y 4- en mujeres con menstruación, amenorrea de al menos tres meses. (Asociación Americana de Psiquiatría, 1994). Debido a la diferente selección de pacientes y a otras limitaciones metodológicas, los datos epidemiológicos son bastante ambiguos. La mayoría de los estudios resultan en frecuencias de 0.5-2 por 1000 mujeres (Hoek, 1991), con la mayor incidencia entre mujeres de 15-19 años (Joergensen,1992; Nielsen, 1990). Algunos estudios han observado un aumento de la incidencia (Moller et al.,1994), pero un meta-análisis no confirmó este aumento (Fombonne, 1995). El índice de mortalidad se estima entre un 2 y un 10% durante un período de 5-10 años, en los que el suicidio suma casi la mitad RET, Revista de Toxicomanías. Nº. 24 - 2000 de las muertes. En el estudio de seguimiento más largo, se halló una tasa de mortalidad de un 18% tras un periodo de observación de 33 años de promedio, de los que el 5% eran suicidios (Theander, 1983). Después de un periodo de inanición prolongada ocurren múltiples cambios endocrinos y metabólicos, para conservar la energía y la proteína. Varios de los hallazgos discrinos en pacientes con AN pueden por tanto atribuirse a mecanismos de adaptación. El hipotálamo juega un papel fundamental en las reacciones emocionales y contiene el centro más importante de las sensaciones de hambre y de saciedad. La lesión en el hipotálamo en el ser humano puede tener como resultado tanto los extremos de sobrealimentación (Reeves y Plum, 1969) como de baja alimentación (Heron y Johnston, 1976). La disfunción hipotalámica aparece en numerosos estudios endocrinolóEste artículo ha sido publicado en el Journal of Psychiatric Research 33 (1999) 139-152 3 gicos de la AN. Basándonos en esta premisa, quisiéramos hacer una revisión crítica de los aspectos endocrinos de la AN, y tratar brevemente las implicaciones etiológicas y terapéuticas. 2. Los péptidos reguladores del apetito En los últimos años, un gran número de péptidos gastrointestinales se han ido aislando del hipotálamo (tabla 1), pero su papel biológico en el CNS no está elucidado del todo. Hay no obstante una evidencia creciente de que bastantes de estos péptidos forman parte de la regulación del apetito. La colecistoquinina (CCK) es un neuropéptido inductor de la saciedad. Este efecto se ha demostrado en numerosos modelos animales (Dourish et al., 1989) y en estudios humanos (en Pi Sunyer et al., 1982; Smith et al., 1995). Sin embargo, se discute la cuestión de si una ingesta reducida de alimento proviene en realidad de un efecto anoréxico específico o de un efecto tóxico inespecífico. La información sobre la concentración basal de serum de la CCK en AN (Harty et al., 1990) es contradictoria. La concentración en el fluido cerebroespinal (CSF) se presenta normal (Gerner y Yamada,1982). Hay un aumento postprandial más rápido y más fuerte en s-CCK en pacientes con AN que en individuos normales (Harty et al., 1991; Philip et al., 1991). Una saciedad demasiado rápida y fuerte inducida por la CCK se ha propuesto como factor etiológico en la AN. Existen varias observaciones que contradicen esta hipótesis. En primer lugar, se han encontrado aumentos postprandiales de CCK normales en AN (Pirke et al., 1994; Geracioti et al, 1992). En segundo lugar, el modelo de estimulación de CCK se vuelve normal cuando se recupera el peso normal (Harty et al., 1991), lo que sugiere que la regulación anormal de CCK es un fenómeno secundario. En tercer lugar, la concentración hipotalámica de CCK en animales no estaba en relación con las condiciones nutricio-nales (Schneider et al., 1979). Y por último, un experimento animal demostró que una infusión continua de CCK no tenía casi ninguna influencia en la ingesta total de alimento, en cuanto que el consumo reducido de calorías en cada comida quedaba compensado por un aumento en la frecuencia de las comidas (West et al., 1984). 4 El neuropéptido-Y (NPY) es un neuropéptido estimulante del apetito con un efecto más específico, potente, y prolongado que cualquier otra sustancia (Stanley et al., 1986). En las mediciones en vivo han demostrado que la emisión de NPY del hipotálamo paraventricular aumenta durante el hambre y disminuye durante las comidas (Kalra et al., 1991). El efecto estimulante del apetito del NPY queda inhibido por la hormona emisora de corticoprotina (CRH) (Menzaghi et al., 1993; McCarthy et al., 1993). Hay una evidencia creciente de que existe un equilibrio dinámico entre la actividad neuronal del NPY y la CRH, y que ese sistema es importante para la regulación del consumo de alimentos (Liu et al., 1994). Por tanto es una hipótesis bastante obvia el considerar que la inhibición anormalmente aumentada por medio de la CRH de la actividad del NPY juega un papel en la patogénesis de la AN (Kaye et al.,1989; Menzaghi et al., 1993).se ha demostrado un aumento de CSF-NPY en pacientes con AN (Kaye et al., 1990). Además, la concentración CSF de NPY no se normaliza hasta mucho después de la normalización del peso y con frecuencia hasta el retorno de la menstruación (Kaye et al, 1990). Hace veinte años, experimentos de parabiosis con ratas genéticamente obesas demostraron la evidencia de la existencia de un potente factor humeral de la saciedad del que carecían los mutantes (Coleman, 1978). Este producto de gen obeso ha sido recientemente identificado (Zhang et al., 1994) y denominado leptina. La leptina solamente se segrega por las células grasas, y el receptor se expresa en el hipotálamo, en donde se le supone que actúa en el control de la alimentación (Considine et al., 1996). Existe una evidencia de que en el efecto supresor del apetito de la leptina interviene una inhibición de la secreción del NPY (Stephens et al.,1995; Schwartz et al., 1996). Sin embargo, no parece que el NPY sea el único intermediario, puesto que las ratas deficientes en NPY también responden a una administración exógena de leptina (Erikson et al., 1996). En los humanos, la expresión de leptina mRNA y de concentración de serum de leptina es correlativa a la masa de grasa corporal en los obesos y en los individuos de peso normal (Considine et al., 1996; Maffei et al., 1995). En los pacientes con AN hay un descenso del nivel de leptina en RET, Revista de Toxicomanías. Nº. 24 - 2000 Tabla 1. Ateraciones endocrina en la Anorexia Nerviosa Nivel Hipotalamico Substancia Monoaminas Catecolaminas Referencias Dato contradictorio Dato contradictorio Opiáceos Hormonas Gastrointestinal peptidos Serotonina Dato contradictorio β-endorfina Dato contradictorio Corticotropina Liberada Incrementado Hormona Gonadotropina Liberada Disminuido Hormona Crecimiento hormona liberada Incrementado hormonas Tireotropina hormona Liberada Disminuido Hormonas Colecistokinina Dato contradictorio Neuropeptido Y Peptido Histidin Metionina Somatostatin Incrementado Incrementado Dato contradictorio Peptido vasoactivo intestinal Incrementado Pituitario anterior Periférico Peptidos Esteroides Peptidos van Binbergen et al., 1990; Marshall y Kelch, 1979; Ceda et al., 1981 Scacchi et al., 1997 Kiriike et al., 1987; Bando et al., 1989 Harty eí al., 1991; Phillip et al., 1991 Geracioti, Jr. et al., 1989 Kaye et al., 1990; Kaye et al., 1989 Harty et al., 1991 Ghigo et al., 1994; Kaye et al., 1988 Gerneretal., 1982 Gerner et al., 1984 Adrenocorticotropina Dato contradictorio Gwirtsman et al., 1989; Gold et al., 1986 Brambillaet al., 1993 Gonadotropinas Hormona de crecimiento Tireotropina Prolactina Disminuido Incrementado Dato contradictorio Inalterado Boyar et al., 1974 Ferrari et al., 1990; Masuda et al., 1988 Kiyohara et al., 1989; Bannai et al., 1988 Natoli et al., 1985; Skrabanek et al., 1981; Williams, 1977 Cortisol Incrementado Estradiol Disminuido Boyar et al., 1977; Vierhapper et al, 1990; Walshet al., 1987 van Binsbergen et al., 1990; Devlin et al., 1989; Buvatet al, 1984 Rappaport et al., 1980; Counts et al., 1992; Argente et al., 1997 Blickle et al., 1984; de Rosa et al, 1983 Stephan et al., 1982 Blickle et al., 1984; Abell et al., 1987 Hebebrand et al., 1995; Grinspoon et al, 1996; St0vinget al., 1988 Croxson y Ibbertson, 1977; Bannai et al., 1988 Perdida de insulina en Disminuido el factor de crecimiento I Insulina Disminuido Glucagon Leptina Dato contradictorio Disminuido Triodotironina Disminuido serum (Hebebrant et al, 1995) y de CSF (Mantzoros et al., 1997) como reflejo de la baja reserva de grasa. Sin embargo, Hebebrant et al (1995) descubrieron que había escasa relación entre el nivel de leptina y el BMI, lo que sugería que podía deberse a una subpoblación hiperleptiRET, Revista de Toxicomanías. Nº. 24 - 2000 van Binsbergen et al., 1991; Grossetal., 1979; Barry y Klawans, 1976 Dopamina Johnston et al., 1984; Kaye et al, 1984b; Gillberg, 1983 Hassanyeh y Marshall, 1991; Kaye et al., 1991; Brewertonet al., 1987 Brambillaet al., 1991; de Marinis et al., 1994; Baranowska, 1990 Hotta et al., 1986; Smith et al., 1989 némica entre los pacientes anoréxicos, y que unas tasas cognitivas moderadas en los comedores moderados se relacionaban con el nivel de leptina independientemente del porcntaje de grasa en el cuerpo (vonPritz et al., 1997). El conocimiento sobre las proteínas de enlace de leptina y 5 la sensibilidad todavía está muy limitado. Recientemente se ha demostrado que unas proporciones significativamente más altas de leptina total circulan en relación a los individuos delgados comparadas con las de los individuos obesos (Sinha et al.,1996). Es factible que las proteínas de enlace de leptina pudieran ellas mismas participar en la regulación del comportamiento en la alimentación. Hay evidencia de cambio en la regulación del apetito peptidérgico en AN, sin embargo, no está claro el papel etiológico que produce. En la AN es muy poco frecuente la pérdida de apetito (Asociación Americana de Psiquiatría, 1994). A pesar del consumo reducido de alimentos, presentan un aumento en el interés por los alimentos que es una característica reconocida. Por ejemplo los pacientes se dedican a menudo a preparar comidas para otros (Halmi, 1978). 3. Sistemas monoaminérgicos Los neurotransmisores monoaminérgicos clásicos desarrollan funciones neuroendocrinas del hipotálamo, incluyendo el comportamiento de control de la alimentación y las funciones reproductivas. Durante muchos años se ha mantenido un intenso debate sobre sus posibles relaciones con los trastornos de la alimentación. Cada vez hay mayores evidencias que indican que la epinefrina hipota-lámica (Leibowitz et al., 1988) y la serontonina (5-hidro-xitripamina, 5 HT) (Paez y Leibowitz, 1993) en circunstancias particulares inducen o estimulan la anore-xia, mientras que la noreprinefrina (NE) incrementa el consumo de alimentos mediante los receptores alfa-2 (Goldman et al., 1985; Leibowitz et al., 1985). En los enfermos que padecen de AN los niveles de NE en serum se presentan elevados (van Binsbergen et al., 1991) y sin cambios en CSF (Kaye et al., 1984), mientras que en los pacientes anoréxicos recuperados hace tiempo el nivel NE en CSF aparece disminuido (Kaye et al.,1984). Los informes sobre la excreción urinaria de metabolitos de cateco-lamina son conflictivos (Gross et al., 1979; Johnston et al., 1984). En pacientes anoréxicos la respuesta de catecola-mina a cambios de postura y ejercicio físico no difería de los controles (van Binsbergen et al., 1991). El Tres-metoxi-4-hidroxifeniletileneglicol (MHPG) es uno de los prin- 6 cipales metabolitos de NE y se cree que la emisión urinaria de MHPG refleja el metabolismo central de NE mejor que cualquiera de los metabolitos de catecolamina (Maas y Landis,1971). Ocurre que el MHGP urinario aparece reducido en AN (Gross et al., 1979; Johnston et al., 1984). Durante el tratamiento nutricional y psicológico el nivel de MHGP aumenta (Rieder et al., 1982) correlativamente a un descenso en los síntomas depresivos (Halmi et al.,1978; Biederman et al., 1984). Sin embargo, otras investigaciones han mostrado que el MHPG urinario refleja el peso corporal mejor que los porcentajes de depresión (Abraham et al, 1981). Puede que la disparidad existente entre los datos se deba a la diferente actividad física y a los regímenes alimenticios. Se ha sugerido que la actividad física excesiva compensa el descenso en el volumen de catecolamina hipotalámica provocado por la inanición (Brooks et al., 1990; Pirke et al., 1993). Además, una dieta estrictamente controlada, una observación intensa y unos regímenes de actividad restringida pueden estresar a los pacientes con AN en distintos grados. Aunque desde los años sesenta se viene estudiando extensivamente la asociación entre la psicosis y la actividad dopaminérgica, la teoría de la dopamina (DA) sigue siendo atractiva. Unas dosis altas de anfetamina provocan un comportamiento psicótico y anoréxico, en el que la DA juega un papel fundamental (Baez,1974; Klawans y Margolin, 1975). Partiendo de la analogía fenomenológica entre la psicosis provocada por la anfetamina y la anorexia nerviosa, se ha especulado que el aumento de actividad dopaminérgica desempeña una función en la psicopatolo-gía de la AN. Esto ya había sido revisado (Barry y Klawans, 1976), y en los últimos años ninguna noticia importante ha aparecido en este campo. Durante la década pasada, el mayor interés en la monoamina se centró en el 5HT que proporcionaba las fuentes más prometedoras para potenciales teorías etiológicas. Los estudios de microinjertos en el hipotálamo en animales han mostrado que la actividad serotonérgica central reduce el consumo de alimentos (Paez y Leibowitz, 1993; Leibowitz et al., 1993). Los estudios de mapas han identificado el núcleo hipotalámico medial como la ubicación anatómica crítica donde se media este efecto serotonérgico (Leibowitz et al., RET, Revista de Toxicomanías. Nº. 24 - 2000 1990). Existe la evidencia de que el 5HT y el NE interac-túan de una manera antagónica en las mismas neuronas hipotalámicas mediales (Paez y Leibowitz, 1993). Los datos de los estudios de animales indican que los efectos serotonérgicos y los norepinefrinérgicos son selectivos y preferentemente reducen respectivamente el estímulo de consumo de carbohidratos, mientras que apenas afectan al consumo de proteínas y grasas (Wurtman y Wurtman, 1979; Leibowitz et al., 1989; Rogacki et al., 1989). Además se ha demostrado que la NE actúa sobre la cantidad de comidas y no sobre la frecuencia de comidas (Leibowitz et al., 1985). En los pacientes con AN la concentración de 5HT en suero se eleva (Hassanyeh y Marshall, 1991) y la concentración de precursores 5HT se disminuye (Coppen et al., 1976), por lo que cabe deducir que los pacientes anoréxicos han incrementado la actividad 5HT, que puede formar parte en la patogénesis. A la inversa, se ha descubierto que el nivel del principal meta-bolito 5HT, 5 hidroxindolacetato (5HIAA), se reduce en el CSF (Kaye et al., 1984) y en la orina (Gillberg, 1983; Riederer et al., 1982) proporcionando así la evidencia de la disminución de la actividad serotonérgica en la AN. En uno de los estudios los niveles de 5HIAA volvieron a su medida normal cuando los pacientes recuperaron peso (Kaye et al., 1984) lo que sugiere que la baja concentración de metabolitos está relacionada con la nutrición. La medición de la respuesta del PRL a los agentes serotonérgicos depara resultados conflictivos (Goodwin et al., 1989; Brewerton et al., 1987) con lo que no queda resuelta la cuestión de la respuesta serotonérgica de las vías hipotalámicas-pituitarias. Obviamente, hay una necesidad de estudios genéticos moleculares sobre sistemas aminérgicos, sin embargo, hasta ahora hay un número de informes limitado y no se ha identificado un polimorfismo etiológico (Hinney et al., 1997 a, b, c,). La posibilidad de que un mecanismo mono-aminérgico pudiera tener implicaciones en la AN plantea perspectivas terapéuticas. Los inhibidores serotonérgicos de readmisión selectivos en combinación con la psicoterapia son efectivos para el tratamiento del comportamiento bulímico (Robinson et al., 1985; Blouin et al, 1988), aunque todavía queda por comprobar su utilidad a largo plazo. RET, Revista de Toxicomanías. Nº. 24 - 2000 Pero hasta ahora la farmacoterapia de la AN ha estado totalmente en desacuerdo. Los agentes antidopaminérgicos (Vandereycken y Pierloot, 1982; Daily y Sargant, 1960) así como los fármacos antiadrenérgicos (Redmon et al., 1976), serotonérgicos (Kaye et al., 1991 b) o antisero-tonérgicos (Vigersky y Loiraux, 1977; Goldberg et al., 1996) han fracasado al intentar demostrar algún efecto convincente. Estas pruebas no apoyan que la desregulación monoaminérgica deba tener una importancia fundamental en la patofisiología de la AN. 4. Axis adrenal-pituitario-hipotalámico Los pacientes con AN tienen una elevada concentración de serum de cortisol (Baranowska, 1990; Vierhapper et al., 1990) que es en parte resultado del aumento de secreción de cortisol (Walsh et al, 1987), y en parte del aumento de la media de vida del cortisol debido al hipo-metabolismo (Boyar et al., 1977). Una constante en las comprobaciones en pacientes con AN es una respuesta de cortisol normal a la estimulación con adrenocorticotropi-na (ACTH) y una respuesta más débil a la estimulación con CRH, que es consecuente con la hipersecreción de CRH (Walsh et al., 1987; Gold et al, 1986). Esta hipótesis se apoya en el descubrimiento de que los pacientes tienen un aumento de los niveles CRH en CSF (Gwirtsman et al., 1989; Hotta et al., 1986). La hipersecreción de CRH podría ser un mecanismo de compensación que contraresta la resistencia al cortisol (Kontula et al., 1982). Esto se sustenta en el hecho clínico de que los anoréxicos, pese a su pronunciada hipercolesterolemia, no muestran nuca las características clásicas de adiposidad (cushingoid). Otra explicación para estos descubrimientos podría ser que los pacientes carecen del sustrato metabólico para la grasa adiposa y la distribución de líquidos (King et al., 1993). Sin embargo, un estudio de la respuesta ACTH-cortisol a un antagonista competitivo glucocorticoide sugiere que el hipercortisolismo refleja más una hipersecreción de CRH que una resistecia al cortisol (King et al., 1993). La mayoría de los pacientes con AN tienen una supresión anormal de cortisol durante el test de supresión de dexamethasona (DST) (Gerner y Gwirtsman, 1981; Muller et al., 1987). El potencial de predicción de este test ha sido compraba- 7 do. En los estados graves de AN, el DST no tiene una relevancia clínica (Hidalgo-Rodrigo et al., 1991; Schweitzer et al., 1990). No obstante, en pacientes con recuperación de peso, el test parece tener un valor de pronóstico, pues una no-supresión persistente se asociaba a malos resultados (Herpetz-Dahlman y Remschmidt, 1990)y podía por tanto reflejar una situación de estrés continuada que no conseguía corregirse durante la realimentación. El ACTH y los opioides derivan de la misma hormona, propiomelanocortina (POMC). El aumento en la secreción de ACTH viene precedido por la activación del sistema POMC. El sistema de opioides tiene una influencia directa o indirecta sobre el comportamiento alimentario y el nivel de actividad física. En los animales la administración central de opioides estimula el consumo de alimentos por vía de los receptores en el núcleo paraven-tricular (Lanthier et al., 1985), y el opiáceo antagonista, la naxolona reduce el consumo de alimentos (Woods y Lebowitz, 1985). En los obesos y en los comedores compulsivos flacos la naxolona disminuye el consumo de alimentos (Drenwnosky et al., 1992), mientras que la infusión de naxolona en pacientes anoréxicos durante la realimentación aumenta la ganancia de peso (Moore et al., 1981). Sin embargo, todos los pacientes del último estudio estaban también en tratamiento con otros antidepresivos y, además, el grupo de control no era a ciegas (Moore et al., 1981). Como la ingestión de opioides en animales se antagonizaba con bloqueadores de receptores -adrenérgicos (Tepperman et al., 1981), el ejemplo parece en parte estar mediado por NE (Jhanwar-Uniyal et al., 1984). En anoréxicos la estimulación de adrenérgicos -2 con clonidina ha mostrado una respuesta de endorfina embotada (Brambilla et al., 1991), que es compatible con el aumento de tono noradrenérgico y la baja regulación de los receptores -2 postsinápticos. Pero otros investigadores han informado de un aumento de la respuesta de endorfina (Brambilla et al., 1987), y una disminución de la actividad noradrener-gica central (Gerner y Gwirtsman, 1981) que sugiere que esto podría llevar a una inhibición reducida de secreción de CRH y contribuir por tanto a la hipercolesterolemia en la AN (Gerner y Gwirtsman, 1981). 8 En numerosos estudios de animales, se ha demostrado que las micro-inyecciones centrales de CRH activan las mismas áreas cerebrales que las de la exposición a estrés (Imaki et al., 1993), y causan anorexia, aumento de la actividad motora y disminución de la actividad sexual (Krahn et al., 1988; Wiersma et al., 1995), que se invierte con los antagonistas CRH (Krahn et al., 1986; Heinrichs et al., 1994). Estos efectos se asemejan a la respuesta de comportamiento ante el estrés. Además, la exposición al estrés tiene como resultado una hipersecreción de CRH (Shibasaki et al., 1993) y se ha sugerido incluso que los estresantes tempranos exhiben una hipersecreción de CRH persistente (Copian et al., 1996). Tales observaciones demuestran que el CRH es un regulador fisiológico y/o un mediador de la respuesta al estrés. Los efectos conductuales del CRH no pueden bloquearse con la dexamethasona (Heinrichs et al., 1994), la hipofisectomía (Koob y Bloom, 1985), o la vagotomía (Gosnell et al., 1983), lo cual sugiere que el CRH representa un papel neurotrópico directo y ejerce los efectos conductuales independientemente del ACTH o del nervio vago. No obstante, las glándulas adrenales juegan un papel esencial de modulación, ya que los animales adrenalecto-mizados no respondían a la infusión central de CRH (Gosnell et al., 1983), y la transcripción de CRH paraven-tricular inducida por estrés se modulaba con glucocor-ticoides (Imaki et al., 1995). Basándose en estos estudios con animales y con humanos, se ha plantado la hipótesis de que la hipersecreción de CRH tiene implicaciones patofisiológicas en la AN (Krahn y Gosnell, 1989). Sin embargo, esta hipótesis presenta varios puntos débiles. En primer lugar, está todavía por aclarar si los efectos del CRH son únicamente efímeros (Krahn et al, 1990; Husley et al., 1995) o si se mantiene durante una hipersecreción crónica de CRH (Arase et al., 1988). Estudios de realimentación de pacientes anoréxicos han mostrado que independientemente del peso inicial, los aumentos de peso de tan sólo un 10% pueden asociarse con una normalización en la secreción de cortisol (Doerr et al., 1980; Fitcher et al., 1982). Aunque el eje CRH-ACTH-cortisol aparezca como consecución del hambre, sigue existiendo una evidencia que apoya la RET, Revista de Toxicomanías. Nº. 24 - 2000 hipótesis de que la hipersecreción de CRH podría formar parte de un círculo vicioso que mantiene el estado de demacración, si el organismo no puede iniciar un mecanismo todavía desconocido para contrarrestar los efectos conductuales del CRH. 5. Axis ovárico-pituitario- hipotalámico Aproximadamente el 10% de los pacientes con AN son varones, pero lo que sigue concierne sólo a las mujeres. La amenorrea es uno de los criterios de diagnóstico de la AN (Organización Mundial de la Salud, 1992; Asociación Americana de Psiquiatría, 1994). Se utiliza en la práctica clínica como un indicador de recuperación, aunque en casos de anorexia prolongada los ovarios pueden atrofiarse (Treasure et al., 1988) con una amenorrea persistente como consecuencia (Marshall y Fraser, 1971; Warren y Vande-Wiele, 1973; Ohzeki et al., 1989). El modelo circadiano de secreción de gonadotropina en AN se asemeja al del estado prepubertal (Allouche et al., 1991; van Binsbergen et al., 1990), y se normaliza con la administración de dosis bajas de hormona emisora de gonadotropina pulsátil (GnRH) (Marshall y Kelch, 1979; Giusti et al., 1988). Por tanto, la amenorrea en AN se relaciona con una emisión hipotalámica de GnRH deficiente y disrítmica. Pese a que el grado de modelo de inmadurez de secreción de la hormona luteinítica (LH) no tiene correlación hasta el extremo de pérdida de peso (Katz et al., 1977), está bien documentada la necesidad de un mínimo peso corporal crítico para el funcionamiento y mantenimiento de los ciclos menstruales normales (Frish y Me Arthur, 1974). En el tejido graso los andrógenos se aromatizan en estrógenos. Con lo que la escasa masa de grasa corporal en la AN contribuye sin duda a la hipoestrogenemia, y consecuentemente al fallo en la estimulación de la respuesta positiva de las gonadotropinas. De acuerdo con esto, el nivel basal de LH al igual que la respuesta del LH al GnRH están en correlación con el porcentaje de grasa corporal (Jeuniewic et al., 1978). Sin embargo, la substitución del estradiol no consiguió corregir la secreción anormal de gonadotropina (Buva et al., 1984; Wakeling et al., 1977) y, además, la hipótesis de la grasa corporal crítica no explica la observación de que a menudo la amenorrea precede a la RET, Revista de Toxicomanías. Nº. 24 - 2000 pérdida de peso (Hurd et al., 1977) y persiste después de la recuperación del peso (Lecomte et al., 1984). En oposición a estos artículos, se ha discutido que los cambios en la secreción de gonadotropina ocurren tras una pérdida de peso corporal de tan sólo 2 kg (Fitcher et al., 1986) con lo que vuelven difícil decidir si en realidad la amenorrea precede o coincide con el inicio de la AN y si la recuperación de peso se completa totalmente después del tratamiento . Existe además una evidencia creciente de que existen algunos otros factores independientes de la grasa corporal que están relacionados con la patogénesis de la amenorrea en la AN. En un estudio anticipado se ha descubierto que la presencia del comportamiento anoréxico emerge como un correlativo más fuerte que el peso corporal (Falk y Halmi, 1982). En las mujeres con menstruación regular, está bien documentado que los opioides endógenos (Gennazzani et al., 1993) al igual que la dopamina (Andersen et al., 1987) están relacionados con la modulación inhibitoria hipotalámica de emisión de GnRH. Se ha propuesto que un aumento en la actividad opioide hipotalámica juega un papel esencial en la patogénesis de la amenorrea en mujeres flacas no anoréxicas (Gennazzani et al., 1995; Grossman et al., 1982), en la amenorrea asociada al ejercicio (Me Arthur et al., 1993; Samuels et al., 1991), y en los trastornos depresivos (Rish et al., 1983). Todos estos trastornos parecen características prominentes del síndrome de la AN. También parece que el aumento de la supresión dopaminérgica está relacionada con la amenorrea de estos trastornos, y la administración de un antagonista dopaminérgico, la metoclopramida, consigue restaurar la secreción de gonadotropina en mujeres con peso normal y con amenorrea hipotalámica (Djursing et al., 1986). Sin embargo, en pacientes con AN ni el tratamiento con el antagonista de opioides (García -Rubi et al., 1992; Armenau et al., 1992) ni el antagonista de dopamina (Golden y Shenker, 1994) pueden restaurar la secreción de LH. La razón podría ser que sólo se antagoniza uno de los varios supresores de GnRH. Nosotros no tenemos conocimiento de que nadie haya investigado el efecto combinado del bloqueo de opioide y dopamina. Anteriormente ya hemos comentado la leptina en relación con el comportamiento alimentario. Y lo que es 9 más, la leptina ha demostrado ser un factor reproductor importante. Los ratones homocigóticos (ob/ob) con déficit de leptina son siempre estériles sin posibilidad de ciclos de estro. El adelgazamiento de estos ratones en el peso normal no corrige su esterilidad, pero la administración de leptina recombinada lleva a la ovulación y al embarazo (Chehab et al., 1996). Además la administración de leptina a ratones normales declaradamente hambrientos induce a cambios en la secreción de gonadotropina (Ahima et al., 1996). Estos descubrimientos indican que la leptina puede ser una señal de mediación de adipocitos que relaciona el estado nutricional con los reguladores hipotalámicos de la función reproductora. Se generó recientemente la evidencia de que se necesitaba un nivel crítico de leptina para mantener la menstruación en mujeres de muy bajo peso (Kopp et al., 1997). El serum leptina en mujeres con una menstruación regular exhibe una variación diurna con elevación nocturna (Sinha et al., 1996) y sorprendentemente las atletas con peso normal eso no se daba (Laughlin y Yen, 1997) así como en las pacientes con AN (Stoving et al., Yen, 1997). Tales observaciones sugieren que la ausencia de oscilaciones de la leptina tienen un significado particular en la amenorrea hipotalámica de la AN. 6. Axis (IGF-I) I factor de crecimiento-tipo-insulina(GH) hormona de crecimiento-hipota-lámico En la AN en condiciones básales aumenta el nivel de serum GH. Actualmente este hecho ha quedado establecido en numerosos estudios (Masuda et al., 1988, de Rosa et al., 1983; Ferrari et al., 1990). Aunque los efectos metabó-licos de la GH se relacionan con el modelo de secreción pulsátil (Hamilton, 1995), el análisis de la pulsatilidad se ha llevado a cabo en un sólo estudio de siete pacientes durante 12h de muestra de sangre (Scacchi et al., 1997). Estos datos sugieren que el aumento de la secreción de la GH es el resultado de un incremento en la frecuencia de los pulsos de secreción (Sacchi et al., 1997), que podrían deberse a un aumento de las frecuencias de descarga de GHRH. No obstante, este análisis se realizó utilizando el algoritmo de Cluster que proporciona información limitada sobre los movimientos secretorios neuroendocrinos, 10 por que no tiene en cuenta la retirada de la GH (Veldhuis y Johnson, 1986). Las técnicas nuevas, tales como el análisis de deconvolución, que frena matemáticamente el impacto de cinética de la retirada-hormonal para dejar al descubierto los movimientos secretorios de la pituitaria GH todavía no se han aplicado a los datos de los pacientes con AN. La simulación farmacológica de la secreción de la GH con la hormona de emisión-hormona de crecimiento tiene como resultado un aumento de la respuesta en pacientes de AN (Rolla et al, 1990b; Lomeo et al., 1989). Dada la cambiante inhibición somatoestacinérgica la respuesta a la estimulación de GHRH muestra una variabilidad muy alta (Thorner et al., 1990). En pacientes anoréxicos, se ha demostrado que el aumento de actividad colinérgica hipotalámica lleva consigo una consecuente disminución de la inhibición atostinérgica (Rolla et al., 1990a, 1991) La influencia de la somatoestatina puede minimizarse combinando la GHRH con un inhibidor acetilcolines-terase, la pyridostigmina (Mazza et al., 1989). Los datos de esta combinación de tests sugieren que la hipersecre-ción de GH en la AN se debe más a una disminución de la inhibición somatoestacinérgica que al aumento de estimulación de GHRH (Ghigo et al., 1994). Los experimentos de estimulación con clonidina indican, con unas pocas excepciones (Nussbaum et al., 1990) un control normal a través de receptor de -2 de emisión de la GH (Brambilla et al., 1987). La estimulación con agentes dopaminérgicos una respuesta de la GH embotada (Bando et al, 1989), compatible con la hipótesis de que la actividad dopami-nérgica se aumenta y que los receptores están menos regulados. En pacientes anoréxicos la GH puede ser estimulada mediante la TRH (Kiriike et al., 1987; Maeda et al., 1976) y por la GnRH (Maeda et al., 1987) lo cual indica que las células somatotrópicas expresan los receptores TRH y GnRH. No obstante se desconoce la importancia de esta anormalidad. Si se sigue una estimulación indirecta de la GH con arginina o una hipoglicemia causada por insulina, se observa un debilitamiento en la emisión de la GH, y se considera que está causado por un alto nivel de cortisol y una disminución del serum triodotironina RET, Revista de Toxicomanías. Nº. 24 - 2000 (T3) (Brauman y Gregoire, 1975; Nakagawa et al, 1985). La concentración de serum de GH y cortisol puede, en sujetos normales, suprimirse con una descarga de glucosa, pero en pacientes con AN, se observa un incremento paradójico (Blickle et al, 1984; Tamai et al., 1991). Hay quienes han sugerido que la respuesta anormal a la glucosa puede reflejar una regulación del apetito hipotalámico cambiada (Tamai et al., 1991). Ocho días de tratamiento oral con T3 en pacientes con AN redujeron el nivel de la GH (Valcavi et al., 1990) lo cual indica que la baja concentración de T3 por sí misma puede facilitar una secreción anormal de la GH. Una de las acciones primarias de la GH es estimular la síntesis de IGF-I. La concentración total de IGFI en la AN es baja, pese a la elevada concentración de la GH (Rappaport et al., 1990). Esto es coherente con la hipótesis de la demacración causa un estado de resistencia de la GH. La hipótesis de la resistencia de la GH se apoya también en el descubrimiento de un menor nivel de una proteína-vinculante circulante de la GH (GHPB) en la AN (Counts et al., 1992; Argente et al., 1997), pues la GHPB representa el dominio extracelular del receptor GH, y se cree que refleja la sensibilidad de la GH (Herington et al., 1986), La resistencia a la acción de la GH también se conoce en otras formas de malnutrición (Solimán et al., 1986) especialmente en enfermedades críticas (Ross et al., 1991; Voerman et al., 1992; Bentham et al., 1993). El IGF-I interviene en alguno de los efectos metabólicos de la GH. La hipersecreción de GH en anoréxicos no tiene como resultado unas manifestaciones acromegálicas, probablemente por que la concentración de serum de IGF-I está constantemente baja. Sin embargo, se ha demostrado que la sensibilidad del IGF-I aumenta con una mayor regulación de los receptores del IGF-I (Hochberg et al., 1992). El IGF-I circulante está casi totalmente ligado a unas proteínas vinculantes específicas (IGFBPs), de las cuales la IGFBP-3 es la más importante. Por analogía con muchas otras hormonas, se cree que la fracción sin ligar del IGF-I es la forma biológicamente activa. Sorprendentemente, hace poco tiempo se declaró que era normal el nivel libre de IGFI en la AN (Argente et al., 1997). Pero este descubrimiento todavía no lo han confirmado otros investigadoRET, Revista de Toxicomanías. Nº. 24 - 2000 res, y hay problemas metodológicos para medir la fracción libre de IGF-I (Frystyk et al., 1995). En una enfermedad crítica en condiciones catabólicas diferentes, se ha demostrado la presencia de proteasas circulantes de IGFBP (Davies et al., 1991; Davenport et al., 1992). Se cree que el aumento de proteolisis de IGFBP aumenta la biodispo-nibilidad de IGF-I (Baxter, 1997). En test de radioinmuni-dad, el IGFBP fragmentado no se distingue de los IGFBPs nativos (Baxter, 1996). Se ha propuesto recientemente que el nivel de IGF-I bajo en el serum de pacientes con AN no estaba asociado con un aumento de la proteolisis de IGFBP (St0ving et al.,1998). Así pues, la biodisponibili-dad de IGF-I en AN podría ser diferente de otros síndromes de resistencia de la GH catabólica en otras enfermedades críticas. Se piensa que las consecuencias de la resistencia de la GH con un nivel inapropiadamente bajo del IGFI son protectoras, puesto que reforzar los efectos metabólicos directos de la GH a favor de los efectos dependientes indirectos del IGF-I conduce probablemente a la movilización de energía más que al crecimiento. Sin embargo, cuando se alimenta intensivamente a un paciente enfermo grave, el catabolismo de proteínas continúa y aumenta la lipogené-sis (Streat et al, 1987, Benthan et al, 1993). En esta situación, la resistencia de la GH se puede considerar como una reacción de estrés estereotipada, como el llamado auto-canibalismo que es auto-destructivo y con recuperación tardía. En los últimos 10 años, numerosas pruebas de control placebo han demostrado que recombinando la GH humana (rh) y/o el rhIGF-I en dosis farmacológicas se puede prevenir la pérdida de proteínas en pacientes graves malnutridos (Ziegler et al., 1990,1992; Byrne et al., 1993; Cioffi et al., 1994). No obstante, hay que recalcar que los estudios de población son pequeños y heterogéneos. Y además, los efectos beneficiosos se han evaluado siguiendo unos cuantos parámetros metabólicos, mientras la mayoría de los estudios presentados hasta ahora tienen escasas o carecen de conclusiones finales. En un pequeño estudio de control placebo, la administración de rhGHRH aumentaba el consumo de alimentos en pacientes anoréxi-cos (Vaccarino er al., 1994). Recientemente, se ha presentado el primer estudio sobre tratamiento con rhGH en 11 pacientes con AN. Durante 28 días, 12 pacientes estuvieron en tratamiento en una prueba doblemente a ciegas, y se llegó a la conclusión de que el tratamiento con rhGH aceleraba la recuperación y acortaba la hospitalización (Hill et al., 1997). Obviamente la rhGHR , la rhGH, o la rhIGF-I pueden tener un potencial de estimulación anabólica en el tratamiento inicial de pacientes con demacración grave. no tiene efectos estimulantes en sujetos normales o en otros sujetos con síndromes de T3 bajo (Mori er al., 1990). En las mujeres con pérdida de peso simple asociada a la amenorrea, ha quedado claro recientemente que las inyecciones de TRH causaban un incremento en la secreción de gonadotropina (Morishita et al., 1991) lo cual sugiere que una secreción debilitada de TRH forma parte de la patogénesis de la amenorrea hipotalámica. 7. Axis tiroideo-pituitario-hipotalámico 8. Conclusiones y perspectivas El 'síndrome de baja T3' caracterizado por un descenso notable de la triodotironina (T3), la tiroxina normal o debajo de lo normal (T4) y el nivel de tirotropina basal normal (TSH) es una constante en la AN (Kiyohara et al., 1989; Bannai et al., 1988; Croxson e Ibbertson, 1977), y es un estado que se conoce bien en otras formas de nutrición deficiente(Turkay et al., 1995). Se ha observado una hipotireosis inducida por yodido en casos de AN (Haraguchi et al.,1986), pero es infrecuente. El hipotrio-dotiroidismo se atribuye en primer lugar a una de-yodiza-ción periférica disminuida del T4, y un aumento de formación simultáneo del metabolito inactivo inverso T3(rT3). No obstante, el nivel de T3 alto no va siempre acompañado de un rT3 elevado, lo cual sugiere que debe de haber otros mecanismos involucrados. Hay evidencia de que un nivel bajo de IGF-I (Jorgensen et al., 1994) al igual que la hipercortisolemia (Bannai et al., 1988; Hangaard et al., 1996) contribuyen a ese estado. Aunque el triodotiroidismo es reversible (Tamai et al., 1986) y probablemente adaptativo, no se puede excluir la presencia de una desregulación simultánea del TRH central. En varios estudios de AN se ha observado una respuesta embotada y atrasada de TSH al TRH administrado exógenamente (Matsubayashi et al., 1988; Kiriike et al., 1987; Bandi et ak.,1989) así como en pacientes de peso normal con buli-mia (Gwirtsman et al., 1983) o con enfermedades de depresión (Loosen, 1985). Así pues, el bajo nivel de T3 puede deberse tambión a la disminución de secreción tiroi-dal en respuesta al TSH, que es indicativo de una perturbación hipotalámica-pituitaria-tiroidal. Esta hipótesis se apoya además en el descubrimiento de que en la AN, la TSH puede ser estimulada por una prohormona TRH que Únicamente en el margen de una semana se añaden nuevos e interesantes datos al gran conjunto de literatura sobre trastornos endocrinos en la AN. Obviamente, existen aún muchos problemas metodológicos a considerar a la hora de interpretar las observaciones endocrinológicas. Los modelos de anorexia en animales, el aumento de la actividad motora, y la disminución en la receptividad sexual no tienen necesariamente que ser modelos adecuados para la AN. Las concentraciones de serum de monoa-minas y péptidos reflejan la secreción pituitaria, pero pueden ser un mal indicador de lo que ocurre en las fisuras sinápticas. El valor de los parámetros de CSF está limitado tanto como que no puede conocerse la contribución de la médula espinal. En pacientes con AN las variaciones pequeñas de peso van unidas a respuestas relevantes en las catecolaminas de serum (Lessem et al., 1989), en la lepti-na (Hebebrand et al., 1997), el cortisol (Fitcher et al, 1982), la gonadotropina (Katz et al., 1977), y la GH (Argente et al., 1997) lo cual indica que el tiempo en que se realizaron las respectivas investigaciones es de una importancia crítica y puede ser la causa de discrepancias en algunos trabajos. Y por último, aunque igual de importante, la mayoría de los modelos describen sólo uno o dos sistemas específicos entre todos los que hay, con lo que tenemos un conocimiento limitado sobre las interacciones entre estos sistemas. Anteriormente, hemos tratado algunos sistemas interactivos, pero parece ser un problema casi irresoluble trazar el mapa de la suma de las numerosas vías interactivas. Las dos preguntas más importantes son: 1) ¿desempeñan algún papel las anormalidades endocrinas en la etiología?, 12 RET, Revista de Toxicomanías. Nº. 24 - 2000 Reacción de estrés Disfunción hipotalámica 1998). Las drogas antipsicóticas y los antidepresivos se han utilizado por lo general sin éxito, así también, la terapéutica potencial de los agentes anabólicos adjuntivos en combinación con apoyo nutricional y régimenes de comportamiento necesitan todavía una mayor investigación. Reconocimientos Factores genéticos, sociales y psicológicos Anorexia y cambios metabólicos secundarios Círculo vicioso patogenésico hipotético en la anorexia nerviosa y 2) ¿qué mejoras terapéuticas pueden extraerse de esos descubrimientos? La AN puede comenzar por una combinación compleja de factores genéticos, sociales y psicológicos. Una vez iniciada, la pérdida de peso, la reacción de estrés y la disfunción hipotalámica interactúan mutuamente unas con otras. Por ejemplo, el hambre y la pérdida de peso ponen en marcha unos mecanismos de adaptación que pueden causar daños en los órganos, y que pueden también afectar la función hipotalámica. La hipersecreción de CRH y de POMC puede ser el resultado de una pérdida de peso, una perturbación hipotalámica y así mismo de unos trastornos psicopatológicos subyacentes. No obstante, existen evidencias de que la activación del CRH-POMC puede intensificar y mantener la anorexia, la hiperactividad motora y la amenorrea (Krahn y Gosnell,1989), y en condiciones apropiadas, puede llevar a desarrollar una AN. El sistema CRH-POMC, que podría ser sólo un ejemplo de muchos que encajan en este modelo, aparece ilustrado en la fig. 1. Este hipotético círculo vicioso puede interrumpirse terapéuticamente a nivel tanto psicológico como somático. Sin embargo sólo se ha logrado un pequeño progreso en el tratamiento de la AN (Bergh y Sodersten, RET, Revista de Toxicomanías. Nº. 24 - 2000 La realización de este estudio ha sido gracias a la Fundación Health Insurance "danmark" Copenhagen, Dinamarca. Nuestro agradecimiento a Janne Dyhr y Chris Harris por su corrección lingüística. BIBLIOGRAFÍA Abraham SF, Beumont PJ, Cobbin DM, Catecholamine metabolism and body weight in anorexia nervosa, British Journal of Psychiatry 1981; 138:244-47 Ahima RS, Prabakaran D, Mantzoros C, Qu D. Lowell B, Maratos Flier E, Fuer JS, Role of leptin in the neuroenocrine response to fasting, Nature 1996;382:250-52 Allouche J, Bennet A, Barbe P, Plantavid M, Carón P, Louvet JP, LH pulsatility and in vitro bioactivity in women with anorexia nervosa related hypothalamic amenorrhea, Acta Endocrinolgica Copenhagen 1991;i25:614-20 American Psychiatric Association, Diagnostic and Statistical Manual of Mental Disoders DSM-1V; Washington DC: American Psychiatric Press, 1994 Andersen AN, Hagen C, Lange P, Boesgaard S, Djursing H, Eldrup E, Micic S, Dopaminergic regulation of gonadotropin levéis and pulsatility in normal women, Fertility and Sterility 1987;47:391-97 Arase K, York DA, Shimizu H, Shargill N, Bray GA, Effects of corticotropinreleasing factor on food intake and brown adipose tissue thermogenesis in rats, American Journal of Physiology 1988;255:E255-59 Argente J, Caballo N, Barrios V, Muñoz MT, Pozo J, Chowen JA, Morande G, Hernández M, Múltiple endocrine abnormalities of the growth hormone and insulin-like growth factor axis in patients with anorexia nervosa: Effects of short- and long-term weight recuperation, Journal of Clinícal Endocrinology and Metabolism 1997;82:2084-92 Armeanu MC, Berkhout GM, Schoemaker J, Pulsadle luteinizing hormone secretion in hypothalamic amenorrhea, anorexia nervosa, and plycystic disease during naltrexone treatment, Fertility and Sterility 1992;57:762-70 Baez L, Role of catecholamines in the anorectic effects of amphetamine in rats, Psychopharmacologia 1974;35:91-8 Bando H, Yamasaki R, Saito S, Evaluation of hypothalamic-pituitary function in a combination of tests with four hypothalamic releasing hormones and Ldopa in normal subjects and in patients with hypothalamic and/or pituitary disorders, Endocrinology Japan 1989:36:705-20 Bannai C, Kuzuya N, Koide Y, Fujita T, Itakura M, Kawai K, Yamashita K.Assessment of the relationship between serum thyroid hormone levéis and peripheral metabolism in patiens with anorexia nervosa, Endocrinology Japan 1988;35:455-62 Baranowska B, Are disturbances in opioid and adrenergic systems involved in the hormonal dysfunction of anorexia nervosa ¿ Psychoeneuroendocrinology 13 1990;15:317-79 Barry VC, Klawans HL, On the role of dopanine in the pathophysiology of anorexia nervosa, Journal of Neutral transmission 1976;38:107-22 Baxter CB, Acquired growth hormone insensivity and insulin-like growth factor I bioavailibility, Endocrinology and Metabolism 1997;4:65-9 Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Baurer TL, Caro JF, Serum immunore-active-leptin concentrations in normal-weight and obese humans (see comments), The New England Journal of Medicine 1996b;334:292-95 Baxter RC, Molecular aspects of insulin-like growth factor binding proteins, In: LeRoith D, editor, Advances in Molecular and Cellular Endocrinology, JA1 Press, 1996; P 123-59 Coplan JD, Andrews MW, Rosemblum MW, Rosemblum LA, Owens MJ, Friedman S, Gorman JM, Nemeroff CB, Persistent elevations of cerebrospinal fluid concetrations of corticotropin-releasing factor in adult non human primates exposed to early-life stressors: implications for the pathopsychology of mood and anxiety disorders, Proceeding of the National Academy of Sciences of the United States of America 1996;31:1619-23 Bentham J, Rodriguez Arnao J, Ross RJ, Acquired growth hormone resistance in patients with hypercatabolism, Hormone Research 1993;40:87-91 Coppea AJ, Gupta RK, Eccleston EG, Wood KM, Wakeling A, Plasmatryptop-han in anorexia nervosa, Lancet 1976;¿¿,961 Bergh C, Soderstein P, Anorexia nervosa: rediscovery of a disorder, Lancet 1998;351:1427-29 Counts DR, Gwirstsman H, Carlsson LM, Lesem M, Cutter GB, The effect of anorexia nervosa and refeeding on growth hormone-binding protein, the insulin-like growth factors IGFs and the IGF binding proteins, Journal of Clinical Enocrinology and Metabolism 1992;75:762-67 Biederman J, Herzog DB, Rivinus TM, Ferber RA, Harper GP, Orsulak PJ, Harmatz JS, Schildkraut JJ, Urinary MHPG in anorexia nervosa patients with and without a concomitant major depressive disorder, Journal of Psychiatric Research 1984;18:149-60 Blickle JF, Reville P, Stephan F, Meyer P, Demangeat C, Sapin R, The role of insulin, glucagon and growth hormone in the regulation of plasma glucose and free fatty acid levels in anorexia nervosa, Hormone Metabolism Research 1984;16:336-40 Blouin AG, Blouin JH, Perez EL, Bushnik T, Zuro C, Mulder E, Treatment of bulimia with fenfluramine and desipramine, Journal of Clinical Psychopharmacology 1988;8:261-69 Boyar RM, Hellman LD, Roffward H, Katz J, Zumoff B, O'Connor J, Bradlow HL, Fukushima DK, Cortisol secretion and metabolism in anorexia nervosa, The Engalnd Journal of Medicine 1977;296:190-93 Brambilla F, Lampertico M, Sali L, Cavagnini F, Initti C, Maggioni M, Candolfi C, Panerai AE, Muller EE, Clonidine stimulation in anorexia nervosa: growth hormone, Cortisol, and "B'endorphin responses, Psychiatry Research 1987;20:19-31 Brauman H, Gregoire F, The growth hormone response to insulin induced hypoglycaemia in anorexia nervosa and control underweight or normal subjects, European Journal of Clinical Investigation 1975;5:289-95 Brewerton TD, Mueller EA, Brandt HA, Lesem MD, Murphy DL, Jimerson DC, Evidence for serotonin dysregulation in anorexia nervosa, Scientific Prodeedings of the American Psychiatric Association 1987;140:NR195 Broocks A, Liu J, Pirke KM, Semistarvation-induced hyperactivity ompensates for decreased norepinephrine and dopamine turnover in the mediobasal hypothalamus of the rat. Journal of Neutral Transmission 1990;79:113-24 Buvat J, Buvat Herbaut M, Lemaire A, Racadot A, Fourlinnie JC, Comparison of estrogen priming effects with body weight restoration effects on the gonadotropin pattern of patients with anorexia nervosa, Hormone Research 1984;20:224-30 Byrne TA, Morrissey TB, Gatzen C, Benfell K, Nattakom TV, Scheltinga MR, LeBoff MS, Ziegler TR, Wilmore DW, Anabolic therapy with growth hormone accelerates protein gain in surgical patients requiring nutritional rehabilitation, A nalsof Surgery 1993;218:400-16 Chehab FF, Lim ME, Lu R, Correction of the sterility defect i i homozygous obese female mice by treatment with the human recombinan' leptin, Nature Genetics 1996;12:318-20 Cioffi WG, Gore DC, Rue LW, 3rd, Carrougher G, Guler HP, McManus WF, Pruitt BA, Insulin-like growth factor-1 lowers protein oxidation in patients with thermal injury, Annal of Surgery 1994;220:310-16 Coleman DL, Obese and diabetes: Two mutant genes causing diabetes-obesity syndromes in mice, Diabetologia 1978;14:141-48 Considine RV, Considine EL, Williams CJ, Hyde TM, Caro JF, The hypothalamic leptin receptor in humans, Identification of incidential sequence polimorp-hisms and absence of the db/db mouse and fa/fa rat mutations, Diabetes 1996a;19:992-94 14 Croxson MS, Ibbertson HK, Low serum triiodothyronine T3; and hypothyroidism in anorexia nervosa, Journal of Clinical Endocrinology and Metabolism 1977;44:167-74 Dally PJ, Sargabt WA, A new treatment of anorexia nervosa, British Medical Journal 1960; 1770-73 Davenport ML, Isley WL, Pucilowska JB, Pemberton LB, Lyman B, Underwood LE, Clemmons DR, Insulin-like growth factor binding protein3 proteolysis and Metabolism 1992;75:590-95 Davies SC, Wass JA, Ross RJ, Cotterill AM, Buchanan CR, Coulson VJ, Holly JM, The induction of a specific protease for insulin-like growth factor binding protein-3 in the circulation during severe illness, Journal of Endocrinology 1991;130:469-73 De Rosa G, Corsello SM, de Rosa E, Delia Casa S, Ruffili MP, Grasso P, Pasargiklan E, Endocrine study of anorexia nervosa, Experimental and Clinical Endocrinology 1983;82:160-72 DeVile CJ, Sufraz R, Lask BD, Stanhope R, Occult intracraneal tumours mas-queading as early onset anorexia nervosa, British Medical Journal 1995;311:1359-60 Djursing H, Hagen C, Andrersen AN, Nyholm HC, Petersen K, Prolonged dopamine receptor blockade in normoprolactinemic amenorrhea: a oubleblind placebo study.Fertility and Sterility 1986;46:840-45 Doerr P, Ficher M, Pirke KM, Lund R, Relationship between weight gain and hypothalamic pituitary adrenal function in patients with anorexia nervosa, Journal of Steroid Biochemistry of satiety by blockade of brain cholecystokinin CCK-B; receptors, Science 1989;245:1 509-11 Drewnoski A, Krahn DD, Demitrack MA, Nairn K, Gosnell BA, Taste responses and preferences for sweet high-fat foods: evidence for opioid involvement, Physiology and Behavior 1992;51:371-79 Erickson JC, Clegg KE, Palmiter RD, Sensitivity to leptin and susceptibility to seizures of mice lacking neuropeptide Y, Nature 1996;381:415-18 Falk JR, Halmi KA, Amenorrhea in anorexia nervosa: examination of the critical body weight hypothesis, Biological Psychiatry 1982;17:799-806 Ferrari E, Fraschini F, Brambilla F, Hormonal circadian rhythms in eating disorders, Biological Psychiatry 1990;27:1007-20 Fichter MM, Doerr P, Pirke KM, Lund R, Behavior, attitude, nutrition and endocrinology in anorexia nervosa, Acta Psychiatrica Scandinavica 1982;66:429-44 Fichter MM, Pirke KM, Holsboer F, Weight loss causes neuroendocrine disturbances: experimental study in health starving subjects, Psychiatry Research 1986;17:61-72 Fonbonne E, Anorexia nervosa, No evidence of an increase, British Journal of Psyciatry 1995;166:462-71 Frisch RE, McArthur JW, Menstrual cycles: fatness as a determinant of mini- RET, Revista de Toxicomanías. Nº. 24 - 2000 mum weight for necessary for their maintenance or onset, Science 1974;185:949-51 Frystyk J, Dinesen B, Orskov H, Non-competitive time-resolved immunofluo-rometric assays for determination of human insulin-like growth factor I and II, Growth Regulation 1995;5:169-76 Garcia Rubi E, Vazquez Aleman D, Mendez JP, Salinal JL, GarzaFlores J, Ponce de Leon S, Perez Palacios G, Ulloa Aguirre A, The effects of opioid blockade and GnRH administration upon luteinzing hormone secretion in patients with anorexia nervosa during the stages of weight loss and weight recovery, Clinical Endocrinology 1992;37:520-28 Genazzani AD, Petraglaia M, Volpogni C, Gamba O, Genazzani AR, Naltrexone treatment restores menstrual cylces in patients with weight lossrelated amenorrhea, Fertility and Sterility 1995;64:951-56 Genazzani AR, Genazzani AD, Volpogni C, Pianazzi F, Li GA, Surico N, Petraglia F, Opioid control of gonadotrophin secretion in humans. Human Reproduction 1993;8 Suppl 2:151-53 Geracioti TD, Jr. Liddle RA, Altemus M, Demitrack MA, Gold PW, Regulation of appetite cholecystokinin secretion in anorexia nervosa. American Journal of Psychiatry 1992;149:958-61 Gerncr RH, Gwirtsman HE, Abnormalities of dexamethsone supression test and urinary MHPG in anorexia nervosa, American Journal of Psychiatry 1981;138:650-53 Gerner RH, Yamada T, Altered neuropeptide concentrations in cerebrospinal fluid of psychiatric patients. Brain Research 1982;238:298-302 Ghigo E, Arvat E, Gianotti L, Nicolosi M, Valetto MR, Avagnina , Bellitti D, Rolla M, Muller EE, Camanni F, Arginine but not pyridostigmine, a cholineste-rase inhibitor, enhances the GHRH- induced GH rise in patients with anorexia nervosa, Biological Psychiatry 1994;36:69-695 Gillberg C, Low dopamine and serotonin levels in anorexia nervosa (letter) American Journal of Psychiatry 1983;140:948-49 Giusti M, Torre R, Traverso L, Cavagnaro P, Attanasio R, Giordano G, Endogenous opioi blockade and gonadotropin secretion: role of pulsatile luteinizing hormone-releasing hormone administration in anorexia nervosa and weight loss amenorrhea, Fertility and Sterility 1988;49:797-801 Gold PW, Gwirtsman H, Avgerinos PC, Nieman LK, Gallueci WT, Kaye W, Jimerson D, Ebert M, Rittmaster R, Loriaux DL, et al, Abnormal hypothalamic-pituitary-adrenal function in anorexia nervosa, Pathophysiologic mechanisms in underweight and weight corrected patients, The New England Journal of Medicine 1986;314:1335-42 Goldberg SG, Halmi KA, Eckert ED, Cyproheptadine in anorexia nervosa, British Journal of Psychiatry 1996;134:67-70 Golden NH, Shenker IR, Amenorrhea in anorexia nervosa, Neuroendocrine control of hupothalamic dysfunction, International Journal of Eating Disorders 1994;16:53-60 Goldman CK, Marino L, Leibowitz SF, Postsynaptic a2-noradrenergic receptors mediate feeding induced by paraventricular nucleus injection of norepinephrine and clonidine, European Journal of Pharmacology 1985; 115:11-9 Goodwin GM, Shapiro CM, Bennie J, Dick H, Carroll S, Fink G, The neuroendocrine responses and psychological effects of infusion of L-tryptophan in anorexia nervosa, Psychological Medicine 1989;19:857-64 Gosnell BA, Morley JE, Levine AS, Adrenal moulation of the inhibitory effect of corticotropin releasing factor on feeding, Peptides 1983;4:807-12 ties in bulimia, American Journal of Psychiatry 1983;140:559-63 Gwirtsman HE, Kaye WH, George DT, Jimerson DC, Ebert MH, Gold PW, Central and peripheral ACTH and Cortisol levels in anorexia nervosa and bulimia, Archives of General Psychiatry 1989;46:61-9 Halmi KA, Anorexia nervosa: recent investigations, Annual Review of Medicine 1978a;29:137-48 Halmi KA, Dekirmenjian H, Davis JM, Casper R, Goldberg S, Catecholamine metabolism in anorexia nervosa, Archives of General Psychiatry 1978b;35:458-60 Hamilton J, A question of rhythm: recent advances in growth hormone research, Canadian Medical Association Journal 1995;153:585-8 Hangaad J, Andersen M, Grodum E, Koldkaer O, Hagen C, Pulsatile thyrotropin secretion in patients with Addision disease during variable glucocorticoid, Journal of Clinical Endocrinology and Metabolism 1996;81:2502-7 Haraguchi K, Aida K, Akasu F, Takazawa K, Onaya T, Iodide induced hypothyroisdim in a patient with anorexia nervosa, Endocrinology Japan 1986;33:61-5 Harty RF, Pearson PH, Solomon TE, McGuigan JE, Chelecystokinin, vasoactive intetestinal peptide and peptide histidine methionine responses in feeding in anorexia nervosa, Regulatory Peptides 1991;36:141-50 Hassanyyeh F, Marxhall EF, Measures of serotonin metabolism in anorexia nervosa, Acta Psychiatrica Scanidinavica 1991;84:561-3 Hebebrand J, van der Heyden J, Devos R, Kopp W, Herpertz S, Remschmidt H, Herzog W, Plasma concentrations of obese protein in anorexia nervosa (letter), Lancet 1995;346:1624-5 Heberbrand J. Blum WF, Barth N, Coners H, Englaro P, Juul A, Ziegler A, Warlike A, Rascher W, Remschmidt H, Leptin levels in patients with anorexia nervosa are reduced in the acute stage and elevated upon short-term weight restoration (see comments), Molecular Psychiatry 1997;2:330-4 Heinrichs SC, Menzaghi F, Pich EM, Baldwin HA, Rassnick S, Bntton KT, Koob GF.Anti-stress action of a corticotropin-releasing factor antagonist on behavioral reactivity to stressors of varying type and intensity. Neuropharmacology 1994; 11:179-86 Herington AC, Ymer S, Stevenson J, Identification and characterization of specific binding proteins for growth hormone in normal sera, Journal of Clinical Investigation 1986;77:1817-23 Heron GB, Johnston DA, Hypothalmic tumor presenting as anorexia nervosa, American Journal of Psychiatry 1976;133:580-2 Herpertz Dahlmann B, Remschmidt H, (The prognostic value of the dexamethasone suppression test for the course of anorexia nervosa - comparison with depressive-diseases) Zeithschrift Kinder Jugenpsychiatric 1990;18:5-11 Hidalgo Rodrigo MI, Diaz Gonzalez RJ, Cabranes Diaz JA, Hidalgo Rodrigo MA, Santiago Cuervos M (Clinical application of the dexamethasone suppression test in the differentiation of subgroups in anorexia nervosa), Actas LusoEspafiolas De Neurologia, Psiquiatria y Ciencias Afines I991;19:l 15-21 Hill KK, Bucuvalas J, McClain C, Krycio R, Alfaro MP, Maloney MJ, Growth hormone treatment in anorexia ervosa (Abstract), Annual Meeting American Psychiatric Association, San Diego, California USA, May 1997 Hinney A, Barth N, Ziegel A, von Prittwit A, Hamann A, Hennighausen K, Prike KM, Heils A. Rosenkranz K, Roth, H, Coners H, Mayer H, Herzog W, Siegfried A, Lehmkuhl G, Poustka F, Schmidt MH, Schafer H, Grzeschik KH, Lesch KP, Lentes KU, Remschmid H, Hebebrand J, Serotonin trasporter gene-linked polymorphic region:allele distributions in relationship to body wight and in anorexia nervosa, Life Sciences 1997a;61 :P L 295-303 Grossman A, Moult PJ, Mclntyre H, Evans J, Silverstone T, Rees LH, Besser GM, Opiate medication of amenorrhea in hyperprolactinaemia and in weight-loss related amenorrhea, Clinical Endocrinology 1982;17:379-88 Hinney A, Lentes KU, Rosenkrarz K, Barth N, Roth H, Ziegel A, Hennighausen K, Coners H, Wurmser H, Jacob K , Romer G, Winnikes U, Mayer H, Herzog W, Lehmkuhl G, Poustka F, Schmidt MH, Blum WF, Pirke KM, Schafer F, Grzeschik KH, Remschmidt H, Hebebrand J, B3-adrenergic-receptor allele distributions in children, adolescents, and young adults with obesity, underweight or anorexia nervosa, International Jo urnal of Obesity 1979b;21:224-30 Gwirtsman HE, Roy Byrne P, Yager J, Gerner RH, Neuroendodrine abnormali- Hinney A, Ziegler A, Northen MM, Remschmidt H, Hebebrand J, 5-HT2A Gross HA, Lake CR, Ebert MH, Ziegler MG, Kopin IJ, Catecholamine metabolism in primary anorexia nervosa, Journal of Clinical Endocrinology and Metabolism 1979;49:805-9 RET, Revista de Toxicomanías. Nº. 24 - 2000 15 receptor gene polymorphisms, anorexia nervosa, and obesity (letter), Lancet 1997c;350:1324-5 Hochberg Z, Hertz P, Colin V, Ish Shalom S, Yeshurun C, Youdin MB, Amit T, The distal axis of growth hormone GH; in nutritional disorders: GH-binding protein, insulin-like growth factor-1 IGF-1 and IGF-1 receptors in obesity and anorexia nervosa, Metabolism 1992;41:106-12 Hoek HW, The incidence and prevalence of anorexia nervosa and bulimia nervosa in primary care, Psychological Medicine 1991;21:455-60 Hotta M, Shibasaki T, Masuda A, Imaki T, Demura H, Ling N, Shizume K, The rsponses of plasma adrenocorticotropin and cotisol to corticotropinreleasing hormone CRH: and cerebrospinal fluid immunoreactive CRH in anorexia nervosa patients, Journal of Clinical Endocrinology and Metabolism 1986;62:319-24 Hulsey MG, Pless CM, Martin RJ, ICV administration of anti-corticotropinrele-asing factor antisense oligonucleotide: effects on deeding behavior and body weight, Regulatory Peptides 1995;59:241-6 Kaye WH, Weltzin TE, Hsu LK, Bulik CM, An open trial fluoxetine in patients with anorexia nervosa, Journal of Clinical Psychiatry 1991b;52:464-71 Kiriike N, Nishiwaki S, Izumiya Y, Maeda Y, Kawakita Y, Thyrotropin, prolactin, and growth hormone responses to thyrotropin releasing hormone in anorexia nervosa and bulimia, Biological Psychiatry 1987;22:167-76 Kiyohara K, Tamai H, Takaichi Y, Nakagawa T, Kumagai LF, Decreased thyroidal triiodothyrone secretion in patients with anorexia nervosa: influence of weight recovery, American Journal of Clinical Nutrition 1989;50:767-72 Klawans HL, Margolin DI, Amphetamine-induced hypersensivity in guinea pigs, Implications in psychosis and human movement disorders, Archives of General Psychiatry 1975;32:725-32 Hurd HP, Palumbo PJ, Gharib H, Hypothalamic-endocrine dysfunction in anorexia nervosa, Mayo Clinical Proceeings 1977;52:711-6 Kling MA, Demitrack MA, Whitfield HI, Jr, Kalogeras KT, Listwak SJ, DeBellis MD, Chrousos GP, Gold PW, Brandt HA, Effects of the glucorticoid antagonist RU 486 on pituitary-adrenal function in patients with anorexia nervosa and healthy volunteers: enhancement of plasma ACTH and corisol secretion in underweight patients, Neuroendocrinology 1993;57:1082-91 lmak T, Shibasaki T, Hotta M, Demura H, Intracerebroventricular administration of corticotropin releasing factor induces c-fos mRNA induction after stress, Brain Research 1993;616:114-25 Kontula K, Andersson LC, Huttunen M, Pelkonen R, Reduced level of cellular glucocorticoid receptors in patients with anorexia nervosa, Hormone Metabolism Research 1982;14:619-20 Imaki T, Xiao Quan W, Shibasaki T, Yamada K,Harada S, Chikada N, Naruse M, Demura H, Stress induced activation of neuronal activity and corticotropin-releasing factor gene expression in the paraventricular nucleus is modulated by glucocorticoids in rats, Journal of Clinical Investigation 1995;96:231-8 Koob GF, Bloom FE, Corticotropin-releasing factor and behavior, Federation Proceedings 1985;44:259-63 Jeuniewic N, Brown GM, Garfinkel PE, Moldofski H, Hypothalamic function as related to body-weight and body fat in anorexia nervosa, Psychosomatic Medicine 1978;40:187-98 Jhanwar-Uniyal M, Woods JS, Levin BE, Leibowitz SF, Cannula mapping and biochemical studies of hypothalamic opiate and noradrenergic systems in relation to eating behavior, Proceedings of East Psychologic Associatin 1984;55:106 Joergensen J, The epidemiology of eating disorders in fyn Country, Denmark, 1977-86, Acta Psychiatrica Scandinavica 1992;85:30-4 Johnston JL, Leiter LA, Burrow GN, Garfinkel PE, Anderson GH, Excretion of urinary catecholamine metabolites in anorexia nervosa: effect of body composition and energy intake, American Journal of Clinical Nutrition 1984;40:1001-6 Jorgensen JO, Moller J, Laursen T, Orskov H, Christiansen JS, Weeke J, Growth hormone administration stimulates energy expenditure and extrathyroidal conversion of thyroxine to triiothyronine in a dose-dependent manner and suppresses circadian thyrotrophin levels: studies in GH-deficient adults, Clinical Endocrinology 1994;41:609-14 Kaira SP, Dube MG, Sahu A, Phelps CP, Kalra PS, Neuropeptide Y secretion increases in the paraventricular nucleus in association with increased appetite for food, Proceedings of the National Academy of Sciences of the United States of America 1991;88:10931-5 Katz JL, Boyar RM, Roffwarg H, Hellman L, Weiner H, LHRH responsiveness in anorexia nervosa: intactness despite prepubertal circadian LH pattern, Psychosomatic Medicine 1977;39:241-51 Kaye WH, Ebert MH, Raleigh M, Lake R, Abnormalities in CNS monoamine metabolism in anorexia nervosa, Archives of General Psychiatry 1984;41:350-5 Kaye WH, Berrettini WH, Gwirtsman HE, Gold PW, George DT, Jimerston DC, Ebert MH, Contribution of CNS neuropeptide NPY, CRH, and bendorphin alterations to psychophysiological, Bulletin 1989;25:433-8 Kaye WH, Berrettini WH, Gwirtsman HE,George DT, Altered cerebroespinal fluid neuropeptide Y and YY immunoreactivity in anorexia nervosa and bulimia nervosa, Archives of General Psychiatry 1990;47:548-56 Kaye WH, Berrettini WH, Gwirtsman HE.George DT, Ebert MH, Altered serotonin activity in anorexia nervosa after long-term weight restoration, Does elevated cerrebroespinal fluid 5-hydroxyindoleacetic acid corelate with rigid and obssesive behavior;, Archives of General Psychiatry 1991a;48:556-62 16 Koob GF, Bloom FE, von Prittwitz S, Ziegler A, Lubbert H, Emons G, Herzog W, Herpetz S, Deter HC, Remschmidt H, Hebebrand J, Low leptin levels predict amenorrhea in underweight and eating dosordered females (see comments), Molecular Psychiatry 1997;2:335-40 Krahn DD, Gosnell BA, Grace M, Levine AS, CRF antagonist partially reverses CRF -and stress-induced effects on feeding, Brain Research Bulletin 1986;17:285-9 Krahn DD, Gosnell BA, Levine AS, Morley JE, Behavioral effects of corticotropin-releasing factor: localization and characterization of central effects, Brain Research 1988;443:63-9 Krahn DD, Gosnell BA,Majchrzak MJ, The anorectic aeffects of CRH and restraint stress decrease with repeated exposures, Biological Psychiatry 1990;27:1094-102 Krahn DD, Gosnell BA Corticotropin-releasing hormone: possible role in eating disorder, Psychiatric Medicine 1989;7:235-45 Lanthier D, Stanley BG, Leibowith SF, Feeding elicted by central morphine injection: sites of action in the brain, Proceeding of East Psychological Associations 1985,56:30 Laughlin GA, Yen SSC, Hypoleptinema in women athletes: Absence of a diurnal rhythm with amenorrehea, Journa of Clinical Endocrinology and Metabolism 1997;82:318-21 Lecomte P, Kabir Gros N, Lansac J (Gonoda function in anorexia nervosa patients in the postcritical phase) Annual Endocrinology Paris 1984;45:397-401 Leibowitz SF, Brown O, Tretter JR, Kirschgessner A, Norepinephrine, clonidi-ne, and tricyclic antidepressants selectively stimulate carbohydrate ingestion through norradrenergic system of the paraventricular nucleus, Pharmacology, Biochemistry and Behavior 1985;23:541-50 Leibowitz SF, Sladek C, Spencer L, Tempel D, Neuropeptide Y, epinephrine and norepinephrine in the paraventricular nucleus: stimulation of feeding and the release of corticosterone, vasopressin and glucose, Brain Research Bulletin 1988;21:905-12 Leibowitz SF, Weiss GF, Walsh UA, Viswanath D, Medical hypothalamic serotonin: role in circadian patterns of feeding and macronutrient selection, Brain Research 1989;503:132-40 Leibowitz SF, Weiss GF, Suth JS, Medical hypothalamic nuclei mediate serotonin's effect on feeding behavior, Pharmacology, Biochemistry and Behavior 1990;37:735-42 Leibowitz SF, Alexander JT, Cheung WK, Weiss GF, Effcts of serotonin and the serotonin blocker metergoline on meal patterns and macronutrient selection, Pharmacology, Biochemistry and Behavior 1993;45:185-94 RET, Revista de Toxicomanías. Nº. 24 - 2000 Lesem MD, George DT, Kaye WH, Goldstein DS, Jimerson DC, State related changes in norepinephrine regulation in anorexia nervosa, Biological Psychiatry 1989;25:509-12 Moore R, Mills IH, Forster A: Naloxone in the treatment of anorexia nervosa: effect on weight gain and lipolysis, Journal of the Proceedings of the Royal Society of Medicine 1981 ;74:129-31 Liu JP, Clarke 1J, Funder JW, Engler D, Studies of the secretion of corticotropin-releasing factor and argine vasopressin into the hypophysial-portal circulation of the conscious sheep, II, The central noradrenergic and neuropeptide, Y pathways cause immediate and prolonged hypothalamic-pituitary-adrenal activation, Potential incolvement in the pseudo-Cushing's syndrome ofenodgenus depression and anorexia nervosa, Journal of Clinical Investigation 1994;93:1439-50 Mori M, Murakami M, Satoh T, Miyashita K, Iriuchijma T, Yamada M, Inukai T, Kobayashi I, A possible direct precursor of thytropin-releasing hormone, pGlu-His-Pro_Gly, stimulates prolactin secretion in anorexia nervosa, Journal of Clinical Endocrinology and Metabolism 1990;71:252-5 Lomeo A, Mazzochi G, Sesarego P, Torre R, Delmonte P, Giusti M, Growth hormone and prolactin response to growth hormone-releasing in anorexia nervosa, Recenti Progressi in Medicina 1989;80:569-73 Loosen PT, The TRH-induced TSH response in psychiatric patients: a possible neuroendocrine marker, Psychoneuoendocrinology 1985;10:237-60 Mass JW, Landis DH, The metabolism of circulatory norepinephrine by human subjects, Journal of Pharmacology and Experimental Therapeutics 1971;177:600-12 Maeda K, Kato Y, Yamaguchi N, Chihara K, Ohgo S, Growth hormone release following thyrotrophin releasing hormone injection into patients with anorexia nervosa, Acta Endocrinologica Copenhagen 1976;81:1-8 Maeda K, Tanimoto K, Chihara K, Abnormal growth hormone releasing following luteinizing hormone release hormone in anorexia nervosa, Japan Journal of Psychiatry and Neurology 1987;41:41-5 Maffei M, Halaas J, Ravussin E, Pratley RE, Lee GH, Zhang Y, Fei H, Kim S, Lallone R, Ranganathan S, et al, Leptin levels in human and rodent: meassu-rement of plasma leptin and ob RNA in obese and weight-reduced subjects, Nature Medicine 1995;1:1155-61 Morisha H, Takemoto M, Higuchi K, Yoshida J, Aono T, Pituitary hormone response to thyrotropin releasing hormone in secondary amenorrheic women associated with weight loss, Fertility and Sterility 1991;56:434-9 Muller EE, Cavagnini F, Panerai AE, Massironi R, Ferrari E, Brambilla F, Neuroendocrine measures in anorexia nervsa: comparisons with primary affective disorders, Advances in Biochemical Psychopharmacology 1987;43:261-71 Nakagawa K, Matsubara M, Obara T, Kubo M, Akikawa K, Responses of pituitary and adrenal medulla to insulin-induced hypoglycemia in patients with anorexia nervosa, Endocrinology Japan 1985;32:719-24 Nielsen S, The epidemiology of anorexia nervosa in Denmark from 1973 to 1987: a nationwide register study of psychiatric admission, Acta Psychiatrica Scandinavica 1990;81:507-14 Nussbaum MP, Blenhten SL, Chasalow FI, Jacobson MS, Shenker IR, Feldman J, Blunted SL, Chasalow FI, Jacobson MS, Shenker IR, Feldman J, Blunted growth hormone responses to clonidine in adolescent girls with early anorexia nervosa, Evidence for an early hypothalamic defect, Journal of Adolescent HealthCare 1990;11:145-8 Ohzeki T, Egi S, Kagawa J, Nagafuchi S, Igarashi Y, Hanaki K, Ishitani N, Motozumi Wakatusuki H, Sunaguchi M, Prolonged supression of gonadropin secretion after weight recovery in an anorectic patient with Turner's syndrome: reduced gonadal function in anorexia nervosa is independent in part on nutrition, Hormone Metabolism, Research 1989;21:626-9 Mantzoros CS, Flier JS, Lesem MD, Brewerton TD, Jimerson DC, Cerebrospinal fluid leptin in anorexia nervosa, Correlations with nutritional status and potential role in resistance to weight gain, Journal of Clinical Endocrinology and Metabolism 1997;82:1845-51 Paez X, Lebowitz SF, Changes in extracellular PVN monoamines and macronu-trient intake after idazoxan or fluoxetine injection, Pharmacology, Biochemistry and Behavior 1993;46:933-41 Marshal JC, Fraser TR, Amenorrhoea in anorexia nervosa: assessment and treatment with clomiphene citrate, British Medical Journal 1971;4:590-2 Phillipp E, Pirke KM, Kellner MB, Krieg JC, Disturbed cholecystokin secretion in patients with eating disorders, Life Sciences 1991;48:2443-50 Marshall JC, Kelch RP, Low dose pulsatile gonadotropin-releasing hormone in anorexia nervosa: a mode of human pubertal development, Journal of Clinical Endocrinology and Metabolism 1979;49:712-8 Pi Sunyer X, Kissleff HR, Thornton J, Smith GP, C-terminal octapeptide of cholecystokin decreases food intake in obese men, Physiology and Behavior 1982;29:627-30 Masuda A, Shibasaki T, Hotta M, Suematsu H, Shizume K, Study on the mechanism of abnormal growth hormone GH; secretion in anorexia nervosa: no evidence of involvement of a low somatomedin-C level in the abnormal GH secretion, Journal of Endocrinological Investigation 1988; 11:297-302 Pirke KM, Broocks A, Wilckens T, Marquard R, Schweiger U, Starvationinduced hyperactivity in the rat: the role of endocrine and neurotransmiter changes, Neurosciences and Biobehavioral Reviews 1993;17:287-94 Matsubayashi S, Tamai H, Uehata S, Kobayashi N, Mori K, Nakagawa T, Kumagai LF, Anorexia nervosa with elevated serum TSH, Psychosomatic Medicine 1988;50:600-6 Mazza E, Ghigo E, Goffi S, Procopio M, Imperiale E, Arvat E, Bellone J, Boghen MF, Muller EE, Camanni F, Effect of the potentiation of cholinergic activity on the variability in individual GH response to GH-releasing hormone, Journal of Endocrinological Investigation 1989;12:795-8 Pike KM, Kellner MB, Friess E, Krieg JC, Ficher MM, Satiety and cholecysto-kinin, International Journal of Eating Disorders 1994;15:63-9 Rappaport R, Prevot C, Czernichow P, Somatomedin activity and growth hormone secretion, I, Changes related to body weight in anorexia nervosa, Acta Pediatrica Scandica 1980;69:37-41 Redmond DE, Jr, Swann A, Heninger GR, Letter: Phenoxybenzamine in anorexia nervosa, Lancet 1976;2:307 McArthur JW, Turnbull BA, Pehrson J, Bauman M, Henley K, Turner A, Evans WJ, Bullen BA, Skrinar GS, Nalmefene enhances LH secretion in a proportion of oligo-amenorrheic athletes, Acta Endocrinologica Copenhagen 1993;128:325-33 Reeves AG, Plum F, Hyperphagia, rage, and dementia accompanying a ventromedial hypothalamic neoplasm, Archives of Neurology 1969;20:616-24 Riederer P, Tofly K, Kruzik P, Excrection of biogenic amine metabolites in anorexia nervosa, Clinica Chimica Acta 1982;123:27-32 McArthy HD, McKibbin PE, Perkins AV, Linton EA, Williams G, Alterations in hypothalamic NPY and CRF in anorexia tumorbearing rats, American Journal of Physiology 1993;264:E638-43 Risch SC, Janowsky DS, Judd LL, Gillin JC, McClure SF, The role of endogenous opioid systems in neuroendocrine regulation, Psychiatr Clin North American 1983;6:429-41 Menzaghi F, Heinrichs SC, Pich EM, Tilders FJ, Koob GF, Functional impairment of hypothalamic corticotropin-releasing facto neurons with immunotarge-ted toxins enhances food intake induced by neuropeptide Y, Brain Research 1993;618:76-82 Robinson PH, Checkley SA, Russell GF, Suppression of eating by fenfluramine in patients with bulimia nervosa, British Journal of Psychiatry 1985;146:169-76 Moller Madsen SM, Nystrup J (Incresed incidence of anorexia nervosa in Denmark) Ugeskrift for Laeger 1994;156:3291-3 RET, Revista de Toxicomanías. Nº. 24 - 2000 Rogacki N, Weiss GF, Fueg A, Suh JS, Pal S, Impact of hypothalamic serotonin on macrountrient intake, Annals of the New York Academic of Sciences 1989;575:619-21 17 Rolla M, Andreoni A, Belliti D, Ferdeghini M, Cristofani R, MuIIer EE, Effects of cholinergic muscarinic antagonist pirenzepine on GH response to GHRH 1-40 in patients with anorexia nervosa, Enocrinologia Experimentalis 1990a;24:195-204 IGF-I and IGFBP-3 in patients with anorexia nervosa are not associated with increases IGFBP-3 proteolytic activity (Abstract) IV European Congress of Endocrinology, European Federation of Endocrine Societies, Sevilla, Spain, May 1998 Rolla M, Andreoni A, Belliti D,Ferdeghini M, Ferrannini E, Failure of glucose infusion to suppress the exaggereted GH response to GHRH in patients with anorexia nervosa, Biological Psychiatry 1990b;27:215-22 Steat SJ, Beddoe AH, Hill GL, Aggressive nutritional support does not prevent protein loss despite fat gain in septic intensive care patients, Journal of Trauma 1987;27:262-6 Rolla M, Andreoni A, Belliti D.Cristofani R, Ferdeghini M, Muller EE, Blockade of cholinergic muscarinic receptors by pirenzepine and GHRHindu-ced GH secretion in the acute and recovery phase of anorexia nervosa and atypical eating disorders, Biological Psychiatry 1991;29:1079-91 Tamai H, Mori K, Matsubayashi S, Kiyihara K, Nakagawa T, Okimura MC, Walter RM, Jr, Kumagai LF, Nagataki S, Hypothalamic-pituitary-throidal dysfunctions in anorexia nervosa, Psychotherapi and Psychosomatics 1986;46:127-31 Ross R, Miell J, Freeman E, Jones J, Matthews D, Preece M, Buchanan C, Critically ill patients have high basal growth hormone levelswith attenuated oscillatory activity associated with low levels of insulin like growth factorI, Clinical Endocrinology 1991;35:47-54 Tamai H, Kobayashi N, Uehata S, Komaki G, Nakagawa T, Serum CCK responses to 50 mg oral glucose load in anorexia nervosa (Abstract), Fourth International Conference on Eating Disorders 1990: p Al 16 Samuels MH, Sanborn CF, Hofeldt F, Robbins R, The role of endogenus opiates in athletic amenorrhea, Fertility and Sterility 1991;55:507-12 Scachi M, Pincelli AI, Caumo A, Tomasi P, Delitala G, Baldi G, Cavagnini F, Spontaneous nocturnal growth hormone secretion in anorexia nervosa, Journal of Clinical Endocrinology and Metabolism 1997;82:3225-9 Schneider BS, Monahan JW, Hirsch J, Brain cholecystokin and nutritional status in rats and mice, Journal of Clinical Investigation 1979;64:1348-56 Schwartz MW, Baskin DG, Bukowski TR, Kujper JL, Foster D, Lasser G, Prunkard DE, Porte D, Jr, Woods SC, Seeley RJ, Weigle DS, Specificity of lep-tin action on elevated blood glucose levels and hypothalamic neuropeptide Y gene expression in ob/ob mice, Diabetes 1996;45:531-5 Schweitzer I, Szmukler GI, Maguire KP, Harrison LC, Tuckwell V, Davies BM, The dexamethasone suppression test in anorexia nervosa, The influence of weight, depression test in anorexia nervosa, The influence of weight, depression, adrenocorticotrophic hormone and dexamethasone, British Journal of Psychiatric 1990;157:713-7 Shibasaki T, Imaki T, Hotta M, Ling N, Demura H, Psychological stress increases arousal through brain corticotropin-releasing hormone without significant increase in adrenocorticotropin and catecholamine secretion, Brain Research 1993;618:71-5 Tamai H, Kiyohara K, Mukuda T, Kobayashi N, Komaki G, Nakagawa T, Kumagai LF, Aoki TT, Resposes of growth hormone and Cortisol to intravenous glucose loaing test in patient with anorexia nervosa, Metabolism 1991;40:31-4 Tepperman FS, Hirst M, Gowdey CW, A probable role for norepinephrine in feeding after hypothalamic injection of morphine, Pharmacol Ciochem Behavior 1981:15:555-8 Theander S, Research on outcome and prognosis of anorexia nervosa and some results from a Swedish long-term study, Int Journal of Eating Disorders 1983;2:167-74 Thorner MO, Vance ML, Hartman ML, Holl RW, Evans WS, Veldhuis JD, Van Cauter E, Copinschi G, Bowers CY, Physiological role of somatostatin on growth hormone regulation in humans, Metabolism 1990;39:40-2 Treasure JL, Wheeler M, King EA, Gordon PA, Russell GF, Weight gain and reproductive function: ultrasonographic and endocrine features in anorexia nervosa, Clinical Endocrinology 1988;29:607-16 Turkay S, Kus S, Gokalp A, Baskin E, Onal A, Effects of protein enregy malnutrition on circulation thyroid hormones, Indian Pediatrics 1995;32:193-7 Vacarino FJ, Kennedy SH, Ralevski E, Black R, The effects of growth hormone-releasing factor on food consumption in anorexia nervosa patients and normals, Biological Psychiatry 1994;35:446-51 Sinha MK, Opentanova I, Ohannesian JP, Kolaczynski JW, Heiman ML, Opentanova I, Ohannesian JP, Kolacznski JW, Heiman ML, Hale J, Becker GW, Bowsher RR, Stephens TW, Caro JF, Evidence of free and bound leptin in human circulation, Studies in lean and obese subjects and during shortterm fasting, Journal of Clinical Investigation 1996a;98:1277-82 Valcavi R, Zini M, Portioli I, Triiodothyronine administration reduces serum growth hormone levesl and growth hormone responses to thytropin-releasing hormone in patients with anorexia nervosa, Psychoneuroendocrinology 1990;15:287-95 Sinha MK, Ohannesian JP, Hieman ML, Kriauciunas A, Stephens TW, Magosin S, Marco C, Caro JF, Nocturnal rise of leptin in lean, obese, and non-insulin-dependent diabetes mellitus subjects, Journal of Clinical Investigation 1996b;97:1344-7 Van Binsbergen CJ, Coelingh Bennink HJ, Odink J, Haspels AA, Koppeschaar HP, A comparative and longitudinal study on endocrine changes related to ovarian function in patients with anorexia nervosa. Journal of Clinical Endocrinology and Metabolism 1990;71:705-11 Smith GP, Greenberg D, Falusco JD, Plasma levels of cholecystokinin produced by statiating doses of exogenous CCK-8, Proceedings of the Society of Neurosciences 1995 (Abstract) van Bisbergen CJ, Odink J, Van der Beek EJ, Westenberg HM, Bennink HJ, Biogenic amines in anorexia nervosa: circadian rhythm in urinary excretion an influence of posture and physical task loaf on plasma catecholamines, Psychosomatic Medicine 1991;53:440-52 Soliman AT, Hassan AEI, Aref MK, Hintz RL, Rosenfeld RG, Rogol AD, Serum insulin-like growth factor I and II concentrations and growth hormone and insulin response to arginine infusions in children with proten-energy malnutrition before and after nutritional rehabilitation, Pediatric Research 1986;20:l 122-30 Vandereycken W, Pierloot R, Pimozide combined with behavior therapy in the sort-term treatment of anorexia nervosa, A doube-blind placebo-controlled cross-over study, Acta Psychiatrica Scandinavica 1982;66:445-50 Stanley BG, Kykouli SE, Lampert S, Leibowitz SF, Neuropeptie Y chronical injected into the hypothalamus: a powerfull neurochemical induder of hyperp-hagia and obesity, Peptides 1986;7:1189-92 Velhuis JD, Johnson ML, Cluster analysis: a simple, versatile, and robust algorithm for endocrine pulse detection, American Journal of Physiology 1986;250:E486-93 Vierhapper H, Kiss A, Nowotny P. Wiesnagrotzki S, Mooder C, Waldhausl W, Metabolism of Cortisol in anorexia nervosa, Acta Endocrinologica Copenhagen 1990;122:753-8 Stephens TW, Basinski M, Bristow PK, The role neuropeptide Y in the antiobe-sity action of the obese gene, Nature 1995;377:530-2 Stoving RK, Vinten J, Handberg Aa, Ebbesen EN, Hangaard J, Hansen-Nord M, Kristiansen J, Hagen C, Diurnal variation of the serum leptin concetration in patiens with anorexia nervosa, Clinical Endocrinology 1998;48:761-8 Stoving RK, Flyvbjerg A, Hangaard J, Fisker S, Hagen C, Low serum levels of 18 Vigersky RA, Loriaux DL, The effect of cyproheptadine in anorexia nervosa: A double-blind trial, In: Vigersky RA, editor, Anorexia nervosa, New York: Raven Press 1977, p349-56 Voerman HJ, Strack van Schijndel RJ, de Boer H, van der Veen EA, Thijs LG, Growth hormone: secretion and administration in catabolic adult patients, with emphasis on the critically ill patient, Netherlands Journal of Medicine RET, Revista de Toxicomanías. Nº. 24 - 2000 l992;;41:229-44 von Prittwitz S, Blum WF, Ziegel A, Scharmann S, Remschmidt H, Hebebrand J, Restrained eating is associated with low leptin levels in underweight females. Molecular Psychiatry 1997;2:420-2 Wakeling A, DeSouza V, Beardwood CJ, Effects of administered estrogen on luteinizing hormone release in subjects with anorexia nervosa in acute and recovery stages, In: Vigersky RA editor, Anorexia nervosa, New York: Raven Press 1977, p 199-210 Ziegler TR, Young LS, Ferrari Baliviera E, Demling RGH, Wilmore DW, Use of human growth hormone with nutritional support in a critical care unit, Journal of Parenteral Enteral Nutrition 1990;14:574-81 Ziegler TR, Rorabeau JL, Yoiung LS, Fong Y, Marano M, Lowry SF, Wilmore DW, Recombinant human growth hormone enhances the metabolic efficacy of parenteral nutrition: a double-blind, randomized controlled study, Journal of Clinical Endocrinology and Metabolism 1992;74:865-73 Walsh BT, Roose SP, Katz JL, Dyrenfurth I, Wright L, Vande Wiele R, Glassman AH Hypothalamic pituitary-adrenal-cortical activity in anorexia nervosa and bulimia, Psychoneuroendocrinology 1987;12:131-40 Warren MP, Vande RL, Clinical and metabolic features of anorexia nervosa, Am J Obstet Gynecol 1973;117:435-49 West DB, Fey D, Woods SC, Cholecystokinin persistenly suppresses meal size but not food intake in free feeding rats, American Journal of Physiology 1984;246:R776-87 Wiersma A, Baauw AD, Bohus B, Koolhaas JM, Behavioral activation produced by CRH but not a helical CRH CRH-receptor antagonist; when microinfused into the central nucleus of the amygdala under stress-free conditions, Psychoneuroendocrinology 1995;20:423-32 Woods JS, Lebowitz SF, Hypothalamic sites sensitive to morphine and naloxone: effects on feeding behavior, Pharmacol Biochem Behav 1985;23:4318 Wold Helath Organization WHO, Clinical description and guidelines In: International Statistical Classification of Diseases and Related Health Problems ICD- 10 1992;pp 352-3 Wurtman JJ, Wurtman RJ, Drugs that enhance central serotoninergic transmission dimish elective carbohydrate consumption by rats, Life Sciences 1979;24:895-903 Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM, Positional cloning of the mouse obese gene and its human homo-logue, Nature 1994;372:425-32 RET, Revista de Toxicomanías. Nº. 24 - 2000 19