3 - AMyD
Anuncio

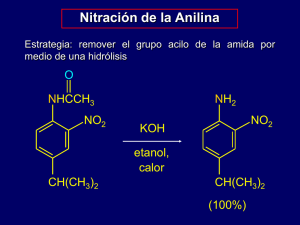
Reacciones de aminas Reacciones de las aminas Las reacciones de las aminas casi siempre involucran al par de electrones libre del nitrógeno. Como una base: N •• H X Como un nucleófilo: N •• C X Reacciones de las aminas Nucleofilo: 1. Reacciones de polialquilación. Reacciones de eliminación (Hofmann y Cope) 2. Reacción con aldehídos y cetonas 3. Reacción con derivados de ácidos carboxílicos: cloruros de acilo, anhídridos y ésteres Reacciones de aminas con halogenuros de alquilo Reacciones con halogenuros de alquilo Las aminas actuan como nucleófilos con los halogenuros de alquilo R2 R2 R1 N •• + R •• + •• – N R + •• X •• R1 X •• •• •• H H R2 R R1 N •• + H + Ejemplo: exceso de amina NH2 + ClCH2 (4 mol) (1 mol) NaHCO3 90°C NHCH2 (85-87%) Ejemplo: exceso del halogenuro de alquilo CH2NH2 metanol + 3CH3I calor + CH2N(CH3)3 (99%) I – La eliminación de Hofmann August Wilhelm von Hofmann químico alemán Eliminación de Hofmann Reactivos: hidróxido de una sal de amonio cuaternaria Producto: alqueno Eliminación anti Grupo saliente: trialquilamina Regioselectividad: opuesta a la regla de Zaitsev, aplicándose la regla de Hofmann. Hidróxidos cuaternarios de amonio Se preparan al tratar halogenuros cuaternarios de amonio con óxido de plata acuoso + CH2N(CH3)3 Ag2O I – H2O, CH3OH + CH2N(CH3)3 – HO Eliminación de Hofmann Los hidróxidos cuaternarios de amonio, cuando son calentados, presentan una reacción de eliminación + CH2N(CH3)3 – HO 160°C CH2 + N(CH3)3 + H2O (69%) 1. Hofmann, A. W. Ann. Chem. Pharm. 1851, 78, 253–286. 2. Hofmann, A. W. Ann. Chem. Pharm. 1851, 79, 11–39. Mecanismo – •• •• O •• H O H H H a b CH2 CH2 + N(CH3)3 • N(CH3)3 • Regioselectividad Regla de Hofmann La eliminación ocurre en la dirección que da lugar al doble enlace menos sustituído. b a b CH3CHCH2CH3 – + HO N(CH3)3 H2C CHCH2CH3 (95%) calor + CH3CH CHCH3 (5%) No hay reacción (:NH2- es un mal grupo saliente) + (95 %) + (5%) N(CH3)3 Más impedido Menos accesible Menos impedido Más accesible Más impedido Menos accesible Menos impedido Más accesible Regioselectividad van der Waals Parece ser que los factores estéricos (tensión de van der Waals) son los que controlan la regioselectividad. Johannes Diderik van der Waals El Estado de Transición que da lugar al 1-buteno ésta menos impedido que el ET que da lugar a los diastereoisómeros cis o trans-2-buteno Regioselectividad H CH3CH2 H H H HO: - + N(CH3)3 H CH3CH2 H C C H Producto principal El grupo mas voluminoso se encuentra entre dos átomos de H Regioselectividad H CH3 H CH3 HO: H - + N(CH3)3 CH3 H H C C CH3 Producto minoritario El grupo más voluminoso se encuentra entre un átomo de H y un grupo CH3 http://www.expertsmind.com/CMSImages/1206_Hofmann%20elimination%20of%20a%20secondary%20amine2.png Eliminación de Hofmann 1) Ag2O 2) calor ó 1) Ag2O 5% 1) Ag2O 2) calor Eliminación de Hofmann calor, reflujo 1) AgOH 2) calor 3) calor 2) calor trans-cicloocteno cis-cicloocteno https://en.wikipedia.org/wiki/Hofmann_elimination#/media/File:Trans-cycloocteneSynthesis.svg Zaitsev's rule (or Satzeff rule, Saytzev rule) Zaitsev Aleksander Mikhaylovich Zaitsev https://en.wikipedia.org/wiki/Alexander_Mikhaylovich_Zaytsev#/media/File:Alexander_Mikhaylovich_Zaytsev.jpg Nombre del Compuesto Estructura Calor de Hidrogenación Molar Grado de Sustitución en kJ/mol en kcal/mol Etileno 137 32.8 No sustituído 1-Buteno 127 30.3 Monosustituído trans-2-Buteno 116 27.6 Disustituído 2-Metil-2-buteno 113 26.9 Trisustituído 2,3-Dimetil-2-buteno 111 26.6 Tetrasustituído https://en.wikipedia.org/wiki/Zaitsev%27s_rule#/media/File:Example_of_Zaitsev%27s_Rule.png https://en.wikipedia.org/wiki/Zaitsev%27s_rule#/media/File:Formation_of_the_Hofmann_Product.png https://en.wikipedia.org/wiki/Zaitsev%27s_rule#/media/File:Example_of_the_Hofmann_Elimination_Reaction.png ELIMINACIÓN DE ZAITSEV (Alexander Mikhaylovich Zaitsev) O Br Na H O CALOR + 19 % ELIMINACIÓN DE HOFMANN (August Wilhelm von Hofmann) 81 % ¿Eliminación de ZAITSEV o de HOFMANN? https://en.wikipedia.org/wiki/Zaitsev%27s_rule#/media/File:Formation_of_Hofmann_Product_Based_on_Stereoch emistry.png https://en.wikipedia.org/wiki/Zaitsev%27s_rule#/media/File:Explanation_for_Formation_of_Hofmann_Product_Bas ed_on_Stereochemistry.png En cada una de las siguientes aminas se lleva a cabo una serie repetitiva de: a) Una metilación exhaustiva (exceso de yoduro de metilo). b) Una eliminación de Hofmann. En la mayoría de los casos, esto permite eliminar el átomo de N en forma de trimetilamina. Para los siguientes compuestos indique si el átomo de N puede ser eliminado o no y a través de cuantas series repetitivas de eliminaciones de Hofmann. Finalmente dibuje la estructura del producto final después de que se a) Una b) 4.-todas En metilación eliminación cadalas una exhaustiva de deHofmann. las siguientes (exceso aminas de yoduro se de lleva metilo). a cabo una serie repetitiva de: completaron eliminaciones. Estructura del Estructura de la ¿Se puede eliminar el ¿Número de producto: amina: átomo de N? eliminaciones? Si 3 N N Si 3 ELIMINACIÓN DE COPE Arthur Clay Cope (1909-1966) Varias reacciones químicas importantes llevan su nombre : 1) Transposición de Cope 2) Eliminación de Cope OXIDOS DE AMINA. ELIMINACIÓN DE COPE (SINPERIPLANAR) calor Diastereoisómero eritro Isómero Z (90 %) calor Diastereoisómero treo Isómero E (93 %) calor Importancia de los mecanismos de reacción Estructuras de (Eritro)-2,3-difenil-1-bromo-butanamina (Treo)-2,3-difenil-1-bromobutanamina El Besilato de atracurio es un relajante del músculo esquelético, el cual se administra por via intravenosa, y tienen una duración intermedia (anestésico). El Besilato de atracurio se designa como bencenosulfonato de 2-(2-carboxietil)-1,2,3,4-tetrahidro-6,7-dimetoxi-2-metilo ó veratrilisoquinolinio, pentametileno éster. PM 1243,49 Fórmula molecular C65H82N2O18S2. Besilato de atracurio USP es de color blanco a casi blanco y sólido higroscópico. Tarea: dar los mecanismos de todas las reacciones utilizadas para formar el Besilato de atracurio A diferencia de la mayoría de los agentes relajantes neuromusculares no despolarizantes que se metabolizan a través del hígado, atracurio (Tracium) se elimina de la circulación sistémica a través de 1) Una eliminación de Hofmann. 2) La hidrólisis del éster A una determinada temperatura y pH, el fármaco se metaboliza de forma espontánea. aclaramiento de atracurio, por lo tanto, no depende de la función del órgano y se puede administrar a los pacientes con enfermedad hepática o renal Tarea: dar la estructura del producto final de las dos reacciones que se llevan a la temperatura corporal y en el pH fisiológico http://srnalife.blogspot.mx/2009/09/hofmann-elimination.html Reconocimiento facial para identificar alumnos aburridos Un profesor de ciencias de la Universidad de Sichuan, Wei Xiaoyong, ha desarrollado un sistema de reconocimiento facial para determinar el nivel de interés de los alumnos en sus clases. Esta herramienta es capaz de identificar las emociones en el rostro de los estudiantes para indicar si están felices, con actitud neutral o aburridos. http://computerhoy.com/noticias/software/reconocimiento-facial-identificar-alumnosaburridos-51034 Andres Bustamante Los primeros inventos del Dr. Chun Ga Arilaminas Sustitución Electrofílica Aromática SEA Nitración de la Anilina Grupo NH2: 1) Es un activante muy fuerte por efecto +R 2) No solo activa al anillo hacia la SEA, sino que también hace que el anillo se oxide con facilidad 3) La nitración de la anilina en forma directa, falla debido al caracter oxidante del ácido nítrico, obteniéndose un alquitrán negro Bromación de la Anilina 2,4,6-tribromoanilina Sólido color amarillo Nitración de la Anilina Estrategia: se disminuye la reactividad de la anilina convirtiendo al grupo NH2 en un grupo amida –C(O)NH2 O NH2 O O CH3COCCH3 CH(CH3)2 NHCCH3 (98%) CH(CH3)2 (se puede usar cloruro de acetilo en lugar de anhidrido acético) Mapa de potencial electrostático Programa Spartan Mapa de potencial electrostático Programa Spartan BENCENO MONOSUSTITUIDO Ph-Y Y: -OCH3 -NH-C(O)-CH3 -C6H5 -CH3 -H -F -Cl -Br -C(O)-OH -NO2 -+N(CH3)3 CLORACIÓNa NITRACIÓNb BROMACIÓNc 9.7 x 106 6.2 x 105 4.2 x 102 3.4 x 102 1 7.4 x 10-1 1 x 10-1 7.2 x 10-2 ---------------- ----------3.5 x 10 2.2 x 10 1 1.4 x 10-1 3.1 x 10-2 2.8 x 10-2 ----------1.5 x 10-8 ----------1.3 x 10 3.6 x 10 1 ---------------7.5 x 10-3 1.6 x 10-5 1.6 x 10-5 NOMBRE DEL COMPUESTO Anisol Acetanilida Bifenilo Tolueno Benceno Fluorobenceno Clorobenceno Bromobenceno Ácido benzoico Nitrobenceno Sal de trimetilanilinio (a) Cl2 en ácido acético a 25ºC. (b) HNO3 en anhídrido acético a 25ºC. (c) HBrO en HClO4, mezcla dioxano-agua (50%-50%), a 25ºC. Nitración de la Anilina Estrategia: nitrar a la amida formada en el primer paso O O NHCCH3 H CH(CH3)2 NHCCH3 NO2 HNO3 CH(CH3)2 (94%) Nitración de la Anilina Estrategia: remover el grupo acilo de la amida por medio de una hidrólisis O NH2 NHCCH3 NO2 NO2 KOH etanol, calor CH(CH3)2 CH(CH3)2 (100%) Halogenación de arilaminas Se lleva a cabo con facilidad sin necesidad de proteger al grupo amino, pero es difícil de limitar esta reacción a la monohalogenación NH2 NH2 Br2 Br Br ácido acético CO2H CO2H (82%) Monohalogenación de arilaminas Para lograr esta reacción se disminuye la reactividad de la arilamina convirtiéndo el grupo NH2 en un grupo amida –C(O)-NH2, lo cual permite limitar esta reacción a una monosustitución O O NHCCH3 NHCCH3 CH3 CH3 Cl2 ácido acético Cl (74%) Sulfonación de Anilina. Síntesis del ácido sulfanílico FORMACIÓN DEL ELECTRÓFILO PRIMERA REACCIÓN: FORMACIÓN DEL ÁCIDO SULFÁMICO SEGUNDA REACCIÓN: SEA Reacciones de Friedel-Crafts El grupo amino de una arilamina deben ser protegidos como una amida para poder llevar a cabo la reacción de Friedel-Crafts O O NHCCH3 CH2CH3 NHCCH3 O CH2CH3 CH3CCl AlCl3 C O CH3 (57%) La benzocaína es un anestésico local utilizado comúnmente como un analgésico tópico o en pastillas para la tos http://medicinal-chemistrynotes.blogspot.mx/2012/01/medici nal-chemistry-of-benzocaine.html TAREA Procaína es un medicamento anestésico local de tipo éster-amino. Se utiliza sobre todo para reducir el dolor de la inyección intramuscular de penicilina, y también se utiliza en odontología. SINTESIS QUÍMICA DE LA PROCAÍNA https://en.wikipedia.org/wiki/Paracetamol#/media/File:Paracetamol_Electron_Map.png SÍNTESIS QUÍMICA PARACETAMOL H2SO4 / H2O H2, Pd (C) FORMACIÓN DE AMIDAS SULFONAMIDAS Oscar Heinrich Daniel Hinsberg Químico alemán Amina 1ª- (ÁCIDO) Amina 2ª- Neuralizado con la base Soluble en agua Sólido insoluble Amina 3ª- (no se aisla) Soluble en agua Amina primaria Soluble Insoluble Amina secundaria Insoluble No hay reacción Amina terciaria Insoluble Soluble FORMACIÓN DE AMIDAS CARBOXAMIDAS SULFONAMIDAS Preparación de amidas Las aminas no reaccionan con los ácidos carboxílicos para formar amidas. La única reacción que ocurre es un equilibrio ácido-base. O O RCOH + R'NH2 – RCO + + R'NH3 calor O RCNHR' + H2O Ejemplo O COH + H2N 225°C O + H2O CNH (80-84%) Reacciones de los Cloruros de Acilo Los cloruros de acilo reaccionan con el amoniaco y las aminas para formar amidas: O O RCCl + R'2NH + HO– RCNR'2 + H2O H + Cl– O A través de: R C Cl NR'2 Reaccion de Schotten-Baumann Eugen Baumann Carl Schotten (1846 – 1896) (1853 – 1910) Schotten, C.; Berichte der deutschen chemischen Gesellschaft.1884,17: 2544. Baumann, E.,; Berichte der deutschen chemischen Gesellschaft. 1886,19: 3218. Reaccion de Schotten-Baumann Ejemplo O O C6H5CCl + HN NaOH H2O C6H5CN (87-91%) Reacciones de los anhídridos de ácido Los anhídridos de ácidos reaccionan con amoniaco o aminas para formar amidas: O O O RCOCR RCNR'2 + RCO– + 2R'2NH H + R'2NH2 O A través de: O R NR'2 C OCR O Ejemplo O O CH3COCCH3 + H2N CH(CH3)2 O CH3CNH CH(CH3)2 (98%) SULFONAMIDAS DROGAS SULFAS como antimetabolitos Conferencia de Teherán en 1943 Primer ministro británico, Winston Churchill,, preocupado por la finalización de la estrategia para la guerra contra la Alemania nazi, se reunió con el Presidente de los Estados Unidos, Franklin Delanor Roosevelt, y Joseph Stalin, Secretario General de la Comité central del Partido Comunista de la Unión Soviética El primer ministro británico, Winston Churchill, (69 años), tuvo dos episodios de neumonía en 1943, el primero de ellos en febrero. Villa del general Eisenhower, cerca de Cartago, Se complicó el cuadro, Churchil se quejaba de un dolor de garganta. Al día siguiente, la temperatura se elevó a 101 ° F. Una máquina portátil de rayos X reveló una sombra en el pulmón; fue neumonía de nuevo. Inmediatamente a Churchill se le dio el nuevo antibiótico fabricado por la firma británica de Mayo y Baker; Los comprimidos se conocen simplemente como "M & B '. Churchill tuvo un leve ataque al corazón, pero su condición mejoró y durante su convalecencia leyó la novela Orgullo y prejuicio. Él se vio comprometido en sus hábitos Solo bebía whisky con soda No fumó puros Él es citado diciendo: "Estimada enfermera, le ruego recordar que el hombre no puede vivir solo con M & B”. Sus médicos, eran Lord Moran y el Dr Bedford (también eran M & B) http://www.chm.bris.ac.uk/motm/sulfanilamide2/sulfanilamideh.htm Posteriormente Churchill emitió un comunicado diciendo "llegaron de todas partes como por arte de magia, excelentes enfermeras y las autoridades médicas más estrictas en el Mediterráneo. “Este admirable M & B, de la que no sufri ningúna reacción adversa, se utilizó en la primera oportunidad posible y después de una semana con fiebre, los intrusos fueron rechazados". Con el tiempo que ha transcurrido, aún no está claro si el fármaco utilizado fue de M & B 693, la sulfapiridina, o M & B 760, sulfatiazol, aunque es muy probable que haya sido el primero (prontosil) Gerhard Domagk Primera Guerra Mundial estalló en 1914, Gerhard Domagk (1895-1964) era un estudiante de medicina en Kiel. De inmediato se unió al ejército alemán y que el otoño luchó en la Primera Batalla de Ypres. Transferido al frente del este, fue herido en la pierna. http://archivos.idiomamedico.net/ FILES/images_DIACME/thumb/c/ c1/1939_Domagk.jpg/300px1939_Domagk.jpg Después de la convalecencia, regresó a la vanguardia como asistente médico en hospitales de campaña. Vio cómo los soldados heridos fácilmente contrajeron la gangrena por una infección bacteriana. Él juró que haría todo lo posible para curar estas infecciones. Pacientes: 1) En 1935, Hildegarde Domagk de 6 años de edad, cayó en las escaleras; la aguja que llevaba fue impulsada en su mano hasta la muñeca. A pesar de la extirpación quirúrgica de la aguja, una infección por estreptococo (Streptococcus) se propago través de su brazo; parecía como si la amputación del brazo fuera su única oportunidad. Gerhard Domagk trató a su hija con prontosil y la infección se remitió. 2) El paciente que dio lugar a la mayoría de los titulares de la prensa, fue Franklin Roosevelt Jr. (22 años), hijo del Presidente de los Estados Unidos. Cayó enfermo con dolor de garganta séptica en diciembre de 1936 y después de las inyecciones con prontosil se recuperó por completo Southwest harbor, ME-Following a week's cruise in New England waters on the Amberjack II, President Roosevelt and three of his sons were joined by Mrs. Roosevelt and a party of friends at Southwest Harbor, ME, on June 25. Left to right in front, following the First Lady's arrival on the Amberjack II are Mrs. Roosevelt, the Chief Executive and James Roosevelt, their eldest son. Left to right, second row, are Mrs. Nancy Cook, a friend, and Franklin D. Jr., and John Roosevelt (facing forward), sons. Diagram reference: - L. Colebrook and M. Kenny, The Lancet, (1936), 1319-1322. Una pequeña cantidad de prontosil brillante de color rojo (colecciones de la Chemical Heritage Foundation) En 1935, el equipo de Daniel Bovet (Instituto Pasteur de París) Descubrió que la sulfanilamida (4-aminobencenosulfonamida), era activo, tanto in vitro como in vivo. Prontosil enzimas intestinales en el cuerpo humano Sulfanilamida PRINCIPIO ACTIVO Daniel Bovet (1907 –1992) https://en.wikipedia.org/wiki/Daniel_Bovet#/media/File:Daniel_Bovet_nobel.jpg ÁCIDO FÓLICO: FACTOR DE CRECIMIENTO ÁCIDO FÓLICO (Vitamina B9) Factor de crecimiento http://dept.lamar.edu/chemistry/martincb/folic%20acid.gif ÁCIDO FÓLICO: FACTOR DE CRECIMIENTO ÁCIDO para-AMINO BENZOÍCO PTERIDINA ÁCIDO GLUTÁMICO Sulfanilamida Ácido p-aminobenzoíco http://chemistry.elmhurst.edu/vchembook/images2/653synfolic.gif NH-R R-NH2 NH-R Sulfadiazina, antibiótico ¿Cuál es la sulfa que todavía se usa? Bactrim (sulfametoxazol y trimetoprim) es un antibiótico Tarea: proponer la síntesis química de la sulfa a partir de benceno y 3amino-5-metilisoxazol Difosfato de dihidropteroato + APAB Dihidropteroato sintetasa La sulfonamida no permite que se incorpore el ácido fólico a la síntesis Ácido dihidropteroíco Ácido dihidrofólico Dihidrofolato reductasa Ácido tetrahidrofólico Timidina ADN El trimetoprim bloquea esta enzima Sulfa and trimethoprim-like drugs - antimetabolites acting as carbonic anhydrase, dihydropteroate synthase and dihydrofolate reductase inhibitors. Capasso, C.; and Supuran, C.T.; J Enzyme Inhib Med Chem., 2014,3, 379-387. FORMACIÓN DE IMINAS O N + R Z R' en H N H Z H N Z Z + R H H O H R' REACTIVO PRODUCTO N H H N H AMONIACO H N R AMINA PRIMARIA H NH2 IMINA R H R H N R R IMINA BASE DE SCHIFF R' N H N NH2 HIDRAZINA H R' NH2 HIDRAZONA R R' O N + R Z R' en H N H N Z + R H Z H N Ph H Z H O H R' PRODUCTO REACTIVO H N N Ph H H N H N Ph FENILHIDRAZINA R OH H N OH H HIDROXILAMINA O N C NH2 H O H N N C NH2 H H R' N FENILHIDRAZONA OH OXIMA R R' N H N SEMICARBAZIDA R R' C O NH2 SEMICARBAZONA O H 3C C N + H N O H CH3 H O H + H 3C H Kobs (min-1) pH C O H CH3 Oxindole Synthesis via Palladium-catalyzed C-H Functionalization Magano, J.; Jason, E.K.; Shine, R.J.; and Chen, M.H.; Org. Synth. 2013, 90, 74-86 http://www.orgsyn.org/content/figures/V90P0074-4.gif FORMACIÓN DE ENAMINAS Formación Enaminas Después de la adición de R2NH, el proton se pierde en el átomo de carbono adyacente R R O O C H + R2NH H C NH HO H N C C + N H H C H R N H2 O C + H3O+ C C H R R R R R C H H C H Gilbert Stork (1921 - ) Químico orgánico belga que radica los Estados Unidos enamina imina Aminas secundarias más utilizadas piperidina pirrolidina morfolina Sal de iminio 1er. Paso. Activación del grupo carbonilo 2o. Paso. Adición de la amina 2ª 3er. Paso. Equilibrios ácido base Formación de agua como grupo saliente 4o. Paso. Eliminación de agua y del protón del carbono β para formar la enamina (pasando por la sal de iminio) Mapa de potencial electrostático Programa Spartan Paso 1 Paso 2 Paso 3 Trabajo final No son usuales las reacciones de enaminas con aldehídos, pero si se han reportado ADICIÓN DE MICHAEL: ADICIÓN-1,4 4 3 2 1 Reacción Hajos–Parrish–Eder–Sauer–Wiechert Wang, Zerong (2009). Comprehensive organic name reactions and reagents. Hoboken, N.J.: John Wiley. Reacciones de Nitrosación Ion nitrosonio Formación del ion nitrosonio y de una sal de diazonio Challis and Ridd, J. Chem. Soc., 1962, 5197, 5208; Challis et al., ibid., 1962, 5203 N2O3 + H2O → 2 HNO2 https://es.wikipedia.org/wiki/%C3%93xido_de_nitr%C3%B3geno_(III) Theoretical Investigation of N-Nitrosation Mechanism of Amino Acids Mediated by N2O3 Zhi Sun, Yong Dong Liu, Ru Gang Zhong http://ieeexplore.ieee.org/stamp/stamp.jsp?arnumber=5163680 Nitrosación de Alquilaminas Ion nitrito, ácido nitroso y el cation nitrosilo – •• •• O •• •• N •• O •• H + •• O H •• •• + H •• O •• H O •• N H H •• + •• + N + •• O •• O •• ION NITROSONIO H •• N •• O •• Catión nitrosilo y nitrosación R2 R2 R1 N •• H + •• + N •• R1 + N O •• ION NITROSONIO H •• N •• O •• Nitrosación de alquilaminas secundarias R2 R1 R2 + N •• N •• O •• R1 H R1 R2 N •• H •• N •• •• O •• O •• N + H +•• + N •• + la nitrosación de aminas secundarias forma una N-nitroso amina Aminas 1as. + HONO (solución ácida en frio): Se desprende N2 a partir de una solución transparente Aminas 2as. + HONO (solución ácida en frio) Se observa la formación de un aceite insoluble (N-Nitrosamina) Aminas 3as. + HONO (solución ácida en frio) Se observa una disolución clara (Formación de una sal de amonio) tautomería Alcoholes Alquenos R-X Catión diazonio Una N-Nitrosamina (un aceite color amarillo) Ejemplo •• (CH3)2NH NaNO2, HCl H2O •• (CH3)2N •• N (88-90%) NITROSAMINA •• O •• Algunas N-nitroso aminas (CH3)2N N O N-nitrosodimetilamina (curtido de pieles) N N N N O N-nitrosopirrolidina (nitrito para curar tocino) N O N-nitrosonornicotina (humo del tabaco) Grupo activante Rearreglo Fischer–Hepp Fue descrita en 1886 Otto Philipp Fischer (1852–1932) Eduard Hepp (1851 – 1917) N-(n-butil)-N-fenil-N-nitrosoamina N-(n-butil)-N-p-nitrosofenilamina N-(n-butil)-N-p-nitrosofenilanilina O Fischer, E Hepp. Ber Deutsch chem Ges 1886,19,2991 https://en.wikipedia.org/wiki/Fischer%E2%80%93Hepp_rearrangement#/media/File:Fischerhepp.png Kinetics and mechanism of the Fischer–Hepp rearrangement and denitrosation. Part 10. Reactions of 3-methoxy-N-methyl-N-nitrosoaniline Williams, D.L.H.; J. Chem. Soc., Perkin Trans. 2, 1982, 801-804 Cikotiene, I., Jonusis, M.; and Jakubkiene, V.; Beilstein J Org Chem.,2013,9,1819–1825 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3778328/ http://www.wikiwand.com/en/Bamberger_rearrangement Nitrosación de alquilaminas primarias R H + N R •• N •• O •• •• N H H H H + +•• N •• O •• •• O •• N + H R N •• •• + Es análogo a la nitrosación de aminas secundarias a partir de este punto Nitrosación de alquilaminas primarias R R •• N •• N H •• O •• + •• N •• + N O H H H R R •• N •• •• N •• + O H H + •• •N • H + H N + •• • O• H Nitrosación de alquilaminas primarias La nitrosación de una alquilamina primaria da una sal de un ion alquildiazonio El proceso se llama diazoación R •• N •• N H •• O + H H R + N N •• + • O •• • H Iones alquildiazonio R + N N •• R + + •• N N •• Los iones de alquildiazonio pierde con facilidad N2 para dar carbocationes Ejemplo: Nitrosación de la 1,1-dimetilpropilamina NH2 + N HONO N – N2 OH H2O + (80%) + (3%) (2%) Nitrosación de alquilaminas Hasta el momento solo hay una reacción química útil asociada con la nitrosación de alquilaminas terciarias R R N •• R R HONO R + N R •• N •• O •• Rearreglo o transposición de Tiffeneau–Demyanov 1901 Nikolai Demyanov químico ruso 1937 Marc Émile Pierre Adolphe Tiffeneau químico francés Anhídrido nitroso Producto principal R = H ó CH3 pH = 3.5 a 4.0 (3R)-1-amino,2,3-dimetil-2-pentanol Mezcla de diastereoisómeros (4R)-4-metil-3-hexanona 4-metil-2-hexanona 87 % R Isómero Eritro Isómero Treo https://www2.chemistry.msu.edu/faculty/reusch/virttxtjml/rearrang.htm Nitrosación de arilaminas Sales de diazonio Nitrosación de arilaminas terciarias La reacción que se lleva a cabo es una SEA N(CH2CH3)2 1. NaNO2, HCl, H2O, 8°C N(CH2CH3)2 2. HO– N (95%) O Nitrosación de N-alquilarilaminas Es similar a las alquilaminas secundarias; se obtienen N-nitrosoaminas NaNO2, HCl, H2O, 10°C NHCH3 N O NCH3 (87-93%) Nitrosación de arilaminas primarias Se obtienen iones de aril diazonio Los iones aril diazonio son mucho más estables que los iones de alquildiazonio La mayoría de los iones de aril diazonio son estables bajo las condiciones en las que se forman (0-10°C), pero si se calentan se descomponen formando cationes arilio + RN + ArN N rápido lento N + R Ar + N2 + + N2 Ejemplo (CH3)2CH NH2 NaNO2, H2SO4 H2O, 0-5°C (CH3)2CH + N N HSO4– Origen sintético de las sales de arildiazonio Ar H Nitración SEA Ar NO2 Reducción Ar NH2 Diazoación Ar + N N Transformaciones sintéticas de las sales de arildiazonio Transformaciones de las sales de arildiazonio Cl Ar Ar Br I + N N Ar H Ar CN Ar Ar Ar Ar OH Ar NO2 F Mecanismo por formación carbocatión arilio Carbocatión arilio + Mecanismo: carbocatión arilo 1) Preparación de fenoles Ar + N N H2O, calor Ar OH + N N Ejemplo NH2 (CH3)2CH 1. NaNO2, H2SO4 H2O, 0-5°C 2. H2O, calor OH (CH3)2CH (73%) Equivalente a una SN1 Mecanismo: carbocatión arilo 2) Preparación de los fluoruros de arilo Ar + N N HBF4 (ó HPF6) Ar F + N N CALOR Se calienta el sal del tetrafluoroborato del ion diazonio; este proceso se conoce como reacción de BalzSchiemann (químicos alemanes Günther Schiemann y Günther Balz). Ejemplo NH2 1. NaNO2, HCl, H2O, 0-5°C CCH2CH3 2. HBF4 3. calor O F CCH2CH3 O (68%) piridina Fluorodediazonization in ionic liquid solvents: new life for the Balz-Schiemann reaction K. K. Laali, V. J. Gettwert, J. Fluorine Chem., 2001, 107, 31-34. [emim][BF4] Mecanismo: carbocatión arilo 3) Preparación de nitrocompuestos Ar + N NaNO2 N CALOR Ar NO2 + N N Transformaciones de las sales de arildiazonio Mecanismo por radicales libres sin catalizador Ar Cl Ar Br I + N N Ar H Ar CN Ar Ar Ar Ar OH Ar NO2 F Mecanismo: radicales libres 1) Preparación de los yoduros de arilo Es por medio de la reacción de una sal de arildiazonio con yoduro de potasio Ar + N N KI Ar I + N N Ejemplo NH2 Br 1. NaNO2, HCl H2O, 0-5°C I Br 2. KI, temp. amb. (72-83%) A New, One-Step, Effective Protocol for the Iodination of Aromatic and Heterocyclic Compounds via Aprotic Diazotization of Amines E. A. Krasnokutskaya, N. I. Semenischeva, V. D. Filimonov, P. Knochel, Synthesis, 2007, 81-84. Transformaciones de las sales de aril diazonio El ácido hipofosforoso (H3PO2) reduce a las sales de diazonio; otros reactivos que se pueden emplear son etanol y borohidruro de sodio. Esta reacción se conoce como desaminación reductiva Ar + N N NaBH4 Ar H + N N Ejemplo [C6H5N2+]Cl- + H3PO2 + H2O → C6H6 + N2 + H3PO3 + HCl H NH2 CH3 NaNO2, H2SO4, H3PO2 CH3 (70-75%) + H3PO3 Transformaciones de las sales de arildiazonio Mecanismo por radicales libres con catalizador (sales cuprosas) Ar Cl Ar Br I Ar Ar Ar Ar + N N Ar H Ar OH CN Ar NO2 F Mecanismo: radicales libres con sales cuprosas Preparación de cloruros o bromuros de arilo y derivados de benzonitrilo Ar Cl Ar -N Ar N CN -N -N N Ar Br + N N N Los cloruros o bromuros de arilo se preparan al calentar la sal de diazonio con cloruro de cobre (I) o bien bromuro de cobre (I) Reacciones de Sandmeyer CuX (halogenuros de cobre(I)) Traugott Sandmeyer, investigador suizo (1854 – 1922) http://wps.prenhall.com/wps/media/objects/340/348272/Instructor_Resources/Chapter_19/Text_Images/FG19_13-024UN.JPG Ejemplo NH2 1. NaNO2, HCl, H2O, 0-5°C NO2 Cl 2. CuCl, calor NO2 (68-71%) Ejemplo NH2 Cl 1. NaNO2, HBr, H2O, 0-10°C Br Cl 2. CuBr, calor (89-95%) Catalytic Sandmeyer Bromination Irina P. Beletskaya*, Alexander S. Sigeev, Alexander S. Peregudov, Pavel V. Petrovskii *I. P. Beletskaya, A. S. Sigeev, A. S. Peregudov, P. V. Petrovskii,Synthesis, 2007, 2534-2538. Preparación de Aril Nitrilos Ar + N Cu(CN)2 N Ar CN + N N Los arilnitrilo se preparan cuando una sal de diazonio se hace reaccionar con cianuro de cobre (I) bajo calentamiento Este es otro tipo de la reacción Sandmeyer Ejemplo NH2 CH3 1. NaNO2, HCl, H2O, 0°C CN CH3 2. CuCN, calor (64-70%) calor calor HCl HBr http://chem.libretexts.org/Core/Organic_Chemistry/Amines/Reactivity_of_Amines/Reactions_of_Aryl_Diazonium_Salts Lo que hace valiosas a las sales de diazonio Permiten 1) La introducción de los siguientes sustituyentes en el anillo bencénico: OH, F, I, y CN 2) Obtener patrones de sustitución en el anillo que de otra manera serían muy difíciles de obtener ¿Cómo se podría sintetizar el siguiente compuesto? Ejemplo NH2 NH2 Br2 NaNO2, H2SO4, Br H2O, CH3CH2OH Br H2O H Br (100%) Br Br (74-77%) Br ¿Cómo llevaría a cabo las siguientes transformaciones? Reacciones de Azo acoplamiento Azo ACOPLAMIENTO Las sales de diazonio son electrófilos débiles. Solo reaccionan con compuestos aromáticos fuertemente activados hacia la sustitucion electrofílica aromática. Ar + N N + Ar' H Ar N N Ar' Un compuesto azo Ar' debe tener un grupo electrodonador fuerte como OH, OR, o NR2. Ejemplo OH + + C6H5N N OH N N-C6H5 Cl– Reacción SEA Anaranjado I COLORANTES AZOÍCOS USADOS EN LA INDUSTRIA ALIMENTICIA En la teoría del color se dice que dos colores son denominados complementarios si, al ser mezclados en una proporción dada el resultado de la mezcla es un color neutral (gris, blanco, o negro). https://es.wikipedia.org/wiki/Colores_complementarios#/media/File:RGBWheel_ext.svg Alta energía E = hn Baja energía http://www.eii.uva.es/organica/qoi/tema-11/imagenes/tema11-T1.png http://2.bp.blogspot.com/-DxUisc-9Fv0/UldbQSu_M3I/AAAAAAAAWDk/M90drDu2ihs/s1600/Los+fotones.jpg * (Antienlace) * (Antienlace) n (No enlace) (Enlace) (Enlace) Los grupos cromóforos son los grupos funcionales de la molécula responsables de la absorción. Principalmente son: dobles y triples enlaces carbono-carbono, sistemas aromáticos, grupo carbonilo, imino (C=N), diazo (N=N), nitro y enlaces CY (Y es un átomo con pares libres). http://www.scielo.br/img/fbpe/qn/v25n1/10428f1.gif Los grupos auxocromos son sustituyentes del cromóforo y alteran λmax y/o ϵmax. Son auxocromos los grupos metilo, halógenos, hidroxi, alcoxi, amino. Los grupos auxocromo tienen los siguientes efectos sobre los cromóforos: • Desplazamiento batocrómico. La absorción del cromóforo se desplaza hacia mayores longitudes de onda (hacia el rojo). • Desplazamiento hipsocrómico. La absorción del cromóforo se desplaza hacia menores logitudes de onda (hacia el azul). • Efecto hipsocrómico. Aumenta ϵmax, presentando la banda mayor intensidad. Incoloro Amarillo Además de influir en la solubilidad, los grupos auxocromos son sustituyentes del anillo que son esenciales al proporcionar colores en la molécula de colorante. Adición de grupos electrodonadores a la estructura del azobenceno tiene un efecto batocrómico (cf. OH vs NH2). La adición de grupos electrodonadores (NH2) y grupos electroatractores (NO2) colocados en posiciones en las que se extienda la conjugación dan lugar a un efecto batocrómico. Aumentar el número de grupos electroatractores conjugados con el electrodonador tiene un efecto batocrómico Los efectos de un grupo amino como grupo electrodonador se mejoran mediante la adición de grupos alquilo al átomo de N Grupo cromóforo Amarillo Absorbió: violeta Rojo metilo Absorbió: verde El azul de tripano, azul de tripán o azul tripán: es un colorante azoico que se utiliza en tinciones histológicas para ensayos de viabilidad que permiten diferenciar células vivas de células muertas. Las células vivas o tejidos: con la membrana celular intacta no se colorean debido a que la membrana celular es selectiva respecto a qué compuestos pueden atravesarla. En las células viables, con membrana intacta, no se incorpora el azul de tripano; Por el contrario, sí atraviesa la membrana de las células muertas. Por lo tanto, las células muertas se muestran de un distintivo color azul bajo el microscopio (típicamente, empleando una cámara de Neubauer para contarlas). Observación al microscopio óptico deHyaloperonospora parasitica dentro de una hoja de Arabidopsis thaliana mediante la tinción con azul de tripano. https://en.wikipedia.org/wiki/Trypan_blue Azul de tripano : SC- 216028. ( A) Células sin teñir KNRK (B ) Células KNRK teñidas con azul de tripano: SC- 216 028 que muestra tinción nuclear de células muertas. http://www.scbt.com/datasheet-216028-trypan-blue.html Family of monomeric, reactive, and polymeric benzotriazoles WO 1997012882 A2 Maria Pablita Dillon, Olan Stanley Fruchey, James Ralph Sounik, Richard Vicari, William Wilson Wilkison Hoechst Celanese Corp Synthesis and properties of bis(hetaryl)azo dyes Mingxing Wang, Kazumasa Funabiki and Masaki Matsui* M. Wang, K. Funabiki, M. Matsui, Dyes and Pigments, 2003, 57, 77-86. Unsymmetrical and symmetrical bis(hetaryl)azo dyes were prepared by diazotisation-coupling and oxidation reactions in moderate yields. Their absorption maxima were observed in the range of 427631 nm, being more bathochromic than the corresponding non-hetarylazo derivatives. Análisis espectroscópico de Aminas Espectroscopía de Infrarrojo La banda de alargamiento del enlace N—H aparece en el intervalo de 3000-3500 cm-1 Las aminas primarias dan dos señalesen esta región, una para una vibración de alargamiento simétrico, y la otra para un alargamiento antiasimétrico H R N H R H simétrico N H antiasimétrico Espectroscopía de Infrarrojo -1 Transmitancia (%) Número de onda , cm RNH2 Las aminas primarias dan dos señales por alargamiento del enlace N—H Espectroscopía de Infrarrojo -1 Transmitancia (%) Número de onda , cm R2NH RMN-1H Desplazamientos químicos en: H3C CH2NH2 H3C d3.9 ppm N C H Está más protegido que O CH2OH d 4.7 ppm C H Diferencia en desplazamientos químicos entre alcoholes y aminas RMN-1H RMN-13C Diferencia en desplazamientos químicos entre alcoholes y aminas RMN-13C Los carbonos unidos a N están más protegidos que los unidos a O CH3NH2 d 26.9 ppm CH3OH d 48.0 ppm UV-VIS Un grupo amino en un anillo bencénico desplaza la max a una longitud de onda más larga. La protonación del N da lugar a un espectro de UV que se parece al del benceno + NH3 NH2 max 204 nm 256 nm max 230 nm 280 nm max 203 nm 254 nm Espectrometría de Masas Los compuestos que solo contienen tienen pesos moleculares pares. C, H, y O Si esta presente un número impar de átomos de N, el peso molecular sera impar. Un pico de un ion molecular con un valor m/z impar sugiere que la muestra que está siendo analizada contiene N. Espectrometría de Masas •• El nitrógeno estabiliza a los carbocationes, los cuales dirigen los patrones de fragmentación (CH3)2NCH2CH2CH2CH3 e– •+ (CH3)2NCH2CH2CH2CH3 + (CH3)2N CH2 + •CH2CH2CH3 Espectrometría de Masas •• El nitrógeno estabiliza a los carbocationes, los cuales dirigen los patrones de fragmentación. CH3NHCH2CH2CH(CH3)2 e– •+ CH3NHCH2CH2CH(CH3)2 + CH3NH CH2 + •CH2CH(CH3)2 Isotopo 14 15 Masa Atómica (ma/u) Abundancia Natural (% átomo) Espin Nuclear (I) Momento Magnético (μ/μN) N 14.003 074 005 2(9) 99.632 (7) 1 0.4037607 N 15.000 108 898 4(9) 0.368 (7) 1 /2 -0.2831892 Intensidad relativa Los pesos moleculares de los compuestos orgánicos son casi siempre par Pesos moleculares impares resultan cuando hay nitrógeno en el compuesto Trietilamina masa/carga (m/z) masa/carga (m/z) Intensidad relativa masa/carga (m/z) Intensidad relativa Intensidad relativa Bencilmetilamina, amina secundaria. El pico del ion molecular es un número impar. El pico base se origina por la ruptura del enlace C-C adyacente al enlace C-N masa/carga (m/z) El ion molecular es de abundancia baja o inclusive no se llega a detectar Cuando este se llega a observar tiene una masa impar Esta masa impar (cuando está presente un número impar de átomos de nitrógeno) indica la presencia de una amina (regla de nitrógeno) Los fragmentos importantes surgen de la ruptura del enlace carbono-carbono o carbono-hidrógeno adyacente al nitrógeno (disociación a) Intensidad relativa masa/carga (m/z) Butil propil amina Ion iminio Butil propil amina Ion iminio Intensidad relativa cocaina masa/carga (m/z) agosto