12. Sustitucion Nucleofilica
Anuncio

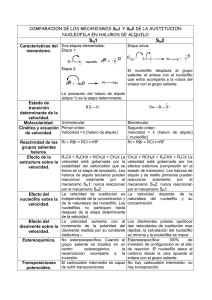
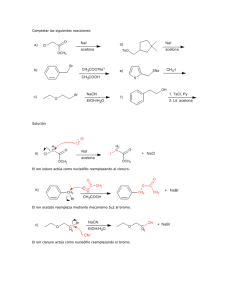
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica ITESM-ca, Depto. C.B. Academia Química Tarea. Sustitución Nucleofílica Alifática Objetivos Describir e identificar las características fundamentales de la sustitución nucleofílica alifática unimolecular (SN1) y bimolecular (SN2), mediante del análisis de la naturaleza del sustrato, del nucleófilo, grupo saliente y el solvente. Predecir de una serie de reacciones de sustitución nucleofílica alifática el tipo de cinética S N1 ó SN2 por la cual transcurre el mecanismo y/o el producto(s) formado(s). Describir el mecanismo de reacción de sustitución electrofílica aromática y predecir el producto de algunas de estas reacciones. 1. 2. 3. 4. 5. ¿En qué consiste la cinética de sustitución nucleofílica bimolecular (SN2) y porque se le conoce así? Escriba el mecanismo de sustitución nucleofílica bimolecular. ¿A que se le llama reacción concertada? ¿Cuál es el factor determinante para la reactividad relativa de los sustratos en la cinética SN2? ¿Cuál de los siguientes es el menos reactivo en una SN2? H CH2I I H Br CH3CH2OTos 6. El mejor nucleófilo en una sustitución nucleofílica cuando el sustrato es primario es: CH3CO2 H2O HO (CH3)3CO 7. ¿Cuál es el mejor solvente en una SN2? HMPA CHCl3 H2O CH3CH2OH 8. ¿En qué consiste la cinética de sustitución nucleofílica unimolecular (SN1) y porque se le conoce así? 9. Escribir el mecanismo de sustitución nucleofílica unimolecular. 10. ¿Cuál de los siguientes es el menos reactivo en una SN1? Cl F CH3CHCH3 Br PhCHCH3 (CH3)3C I 11. 12. 13. 14. ¿Qué significa el término racemización y cual es la razón que justifica su existencia? ¿Qué significa el término transposición y cual es la razón que justifica su existencia? ¿Cuál es el paso determinante de la velocidad en una cinética SN1? Cada uno de los carbocationes siguientes es capaz de transponerse a otro más estable. Escribir la estructura del carbocatión más estable después de la transposición. a. CH3CH2CH2+ + b. (CH3)2 CHCHCH3 + c. (CH3)3CCHCH3 d. (CH3CH2)3CCH2+ Academia de Química Departamento de Ciencias Básicas ITESM-CQ. Página 1 e. Considera el siguiente par de reacciones para contester las preguntas de la 15-20 a. Br KI acetone I + KBr KI I + KBr acetone 15. El bromuro de alquilo en los reactivos en estas reacciones se clasifica como: a. 3 b. 2 c. 1 d. 4 b. Br 16. El solvente en estas reacciones es: a. No polar aprótico b. Ligeramente polar aprótico c. Polar prótico d. No polar prótico 17. El nucleófilo de esta reacción es: + a. K b. Gpo. alquilo c. Br d. I 18. ¿Qué sucedería a la velocidad de la reacción si se duplica la concentración del KI? a. El mecanismo de reacción cambia b. Disminuye a la mitad la velocidad de la reacción c. No tiene efecto en la velocidad de la reacción d. Duplica la velocidad de la reacción 19. ¿Cuál reacción es más rápida? a. b. 20. El mecanismo de esta reacción es: a. SN2 b. SN1 21. Realiza una tabla comparativa entre ambos mecanismos de sustitución nucleofílica alifática e identifica el tipo de cinética que sigue cada una de las siguientes reacciones, escribe el mecanismo de sustitución nucleofílica e indica el(os) producto(s) resultante(s): a. (S)-Cloruro de sec-butilo + NH3 en agua b. bromuro de isobutilo + NaI en DMSO c. Cloruro de ciclopentilo + KOH en agua d. Bromuro de neopentilo + Acido fórmico en etanol e. 1-bromo-3-terbutil-ciclohexano + K SH en acetona 22. ¿Cuál de las siguientes reacciones es más rápida? a. (CH ) C 33 b. (CH3)3C Cl Cl 70% H2O 30% CH3OH 50% H2O 50% acetone (CH3)3C (CH3)3C OH + HCl OH + HCl Academia de Química Departamento de Ciencias Básicas ITESM-CQ. Página 2 23. Predecir los productos principales cuando el benceno reacciona con los siguientes reactivos: a. Bromuro de terbutilo, AlCl3 b. Cloruro de benzoilo , AlCl3 24. Considera la siguiente reacción y contesta las preguntas: CH2CH3 CH3CH2Cl + AlCl3 HCl a. Dibuja la estructura del electrófilo de esta reacción b. ¿Cuál es la función del AlCl3 en la reacción? c. Escribe el mecanismo de esta reacción Respuestas 1. SN2 representa un mecanismo de una reacción de sustitución nucleofílica alifática, donde S representa la sustitución, N la palabra nucleófilo y 2 la palabra bimolecular, dado que dos reactivos (tanto grupo saliente como el nucleófilo) participan en la etapa que conduce al estado de transición limitante de la velocidad. Dicho mecanismo consiste en el ataque del nucleófilo al centro del reactivo desde el lado de la molécula apuesto al grupo saliente, dando lugar a la inversión del producto y la pérdida simultánea del grupo saliente para obtener un sólo producto con configuración invertida. 2. - Nu + R-Gs Ataque nucleofílico Por atrás + Nu transición -...... R ........ Gs — Nu R + Gs un solo producto con inversión de la configuración R=gpo alquilo que no sea terciario Gs= grupo saliente Nu =Nucleófilo 3. A una reacción donde la ruptura del enlace y la formación del enlace ocurren simultáneamente. 4. El factor determinante en la reactividad relativa es el factor estérico, es decir entre más sustituyentes tenga el radical, mayor impedimento habrá para un ataque nucleofílico del lado opuesto al del grupo saliente. Aunque también influye el carácter básico del nucleófilo así como del grupo saliente. 5. 6. 7. 8. SN1 representa un mecanismo de una reacción de sustitución nucleofílica alifática, donde S representa la sustitución, N la palabra nucleófilo y 1 la palabra unimolecular, dado que un solo reactivo (grupo saliente) participa en la etapa que conduce al estado de transición limitante de la velocidad. Dicho mecanismo consiste en la ruptura total del enlace entre el carbono y el grupo saliente antes de que se inicie el enlace con el nucleófilo. Es decir es una reacción que ocurre en dos etapas, formando dos productos con configuración invertida (mezcla racémica) o un solo producto transpuesto. Academia de Química Departamento de Ciencias Básicas ITESM-CQ. Página 3 9. Paso 1. R-Gs Lento (determinante de la velocidad de reacción) + R + Gs Ruptura heterolítica, liberación del grupo saliente y formación del carbocatión (observar si hay posibilidad de transposición) Paso 2. Muy rápido (no contribuye en la velocidad de reacción) R + - + Nu — Nu R (inversión configuración) racemización R - Nu (retención configuración) O transposición R = todos excepto metilo o la mayoría de los gpos. alquilo primarios (pueden ser primarios cuando hay posibilidad de transposición) Gs = grupo saliente Nu = Nucleófilo 10. 11. Significa la formación de una mezcla de dos isómeros que son imágenes especulares (enantiómeros). Y existen por la capacidad de un centro quiral de admitir en diferente posición espacial a los átomos. 12. Significa el movimiento de un par de electrones para distribuir una carga positiva, con el consiguiente desplazo de átomos (pueden ser protones o grupos metilo). Es decir la formación de carbocationes más estables (más sustituidos). La razón que justifica su existencia radica en la distribución de carga, a manera de disminuir la polaridad de la molécula, perfectamente ilustrada en la estabilidad de los carbocationes. 13. La velocidad de disociación del grupo saliente o la formación del carbocatión. 14. + a. CH3CHCH3 + b. (CH3)2 CCH2 CH3 + c. (CH3)2CCH(CH3)2 + d. (CH3CH2)2 CCH2CH2CH3 e. 15. 16. 17. 18. 19. 20. c b d d b a 21. a. (S)-Cloruro de sec-butilo + NH3 en agua secbutilamina (mezcla racémica) + HCl El sustrato es un cloruro de alquilo secundario (el cual puede proceder como S N2 o como SN1), en presencia del nucleófilo moderado amoniaco (NH3) y en medio polar prótico (buen disolvente para reacciones S N1). Según éste Academia de Química Departamento de Ciencias Básicas ITESM-CQ. Página 4 análisis se predice que esta reacción se lleva a cabo por SN1. Como el sustrato no puede transponerse dado que no formará un carbocatión más estable, se formarán dos productos (uno con configuración invertida y otro que la retiene y como el sustrato es quiral, los productos son un par de enantiómeros) b. bromuro de isobutilo + NaI en DMSO Yoduro de isobutilo (configuración invertida) + NaBr El sustrato es un halogenuro de alquilo primario, en presencia del ión yoduro (un buen nucleófilo). Como los carbocationes primarios son tan inestables que nunca se forman en solución, no es posible que se lleve a como una reacción SN1. El DMSO (dimetilsulfóxido) un disolvente polar aprótico, constituye un buen disolvente para llevar a cabo reacciones SN2. Según éste análisis se predice que esta reacción se lleva a cabo por un mecanismo SN2 y formará un solo producto de configuración invertida (aunque esto sólo es valioso si el carbono unido al Yodo es quiral) c. Cloruro de ciclopentilo + KOH en agua ciclopentanol (mezcla racémica) + KCl El sustr ato es un halogenuro de alquilo secundario (el cual puede proceder como S N2 o como SN1), en presencia de un buen nucleófilo OH y en medio polar prótico (buen disolvente para reacciones S N1). Según éste análisis se predice que esta reacción se lleva a cabo por S N1. Como el sustrato no puede transponerse dado que no formará un carbocatión más estable, se formarán un producto (dado que no es quiral) d. Bromuro de neopentilo + Acido fórmico en etanol metanoato de terpentilo El sustrato es un halogenuro de alquilo primario, en presencia del ión formiato (un nucleófilo moderado). Aunque los carbocationes primarios son tan inestables que nunca se forman en solución, el disolvente es polar prótico que favorece SN1 y hay posibilidad de transposición a un carbocatión más estable (terpentilo), Por lo que la reacción se llevará a cabo por un mecanismo SN1, formando un producto transpuesto (dado que no es quiral) - e. 1-bromo-3-terbutil-ciclohexano + K SH + KBr SN2 - en acetona 3-terbutil-ciclohexanotiol (configuración invertida) 22. La a, ya que el solvente es más polar 23. a. Terbutilbenceno b. Benzofenona 24. + CH3CH2 a. b. Es un ácido de Lewis que cataliza la ionización del halogenuro de alquilo para formar el carbocatión electrófilo c. _ + CH3CH2 Cl + AlCl3 CH3CH2 AlCl4 CH2CH3 + CH3CH2 H + _ Cl CH2CH3 + HCl H Academia de Química Departamento de Ciencias Básicas ITESM-CQ. Página 5