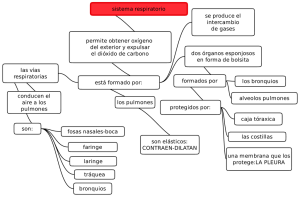
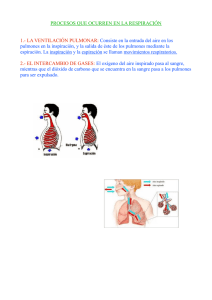
gases y respiracion
Anuncio

TEORIA CINÉTICA DE LOS GASES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. Puesto que éste es el caso para cualquier gas real a baja ideales a baja densidad LEY DE GAY-LUSSAC Se trata de una ecuación que relaciona las variables de estado, en todo cambio que sufre un gas, pero con la única condición obligatoria de permanecer Ley de Gay-Lussac. Esta ley establece, que, a volumen constante, la presión de constante la masa. Es decir, es una ecuación que muestra la interdependencia entre una masa fija de un gas dado es directamente proporcional a la temperatura kelvin. la presión, temperatura y volumen de una masa fija de gas. LEY DE BOYLE La ley de Boyle establece que a temperatura constante (Proceso P1 P = 2 T1 T2 Isotermico) , la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente. Esto quiere decir que si el volumen del contenedor aumenta, la presión en su interior disminuye y, viceversa, si el ECUACIÓN UNIVERSAL DE LOS GASES volumen del contenedor disminuye, la presión en su interior aumenta. PV = P V 11 2 2 Las tres leyes anteriores se pueden resumir en una ecuación: Pv = nRT LEY DE CHARLES La ley de Charles establece que a presión constante (Proceso isobárico) el volumen de un gas es directamente proporcional a su temperatura absoluta, Da la relación entre la presión p, el volumen V y la temperatura T de asumiendo que la presión de mantiene constante. Esto quiere decir que en un recipiente flexible que se mantiene a presión constante, el aumento de temperatura conlleva un aumento del volumen. V V 1= 2 T T 1 2 .lit cal J n moles de un gas ideal., R = 0.082 atm mol º k = 1,98 mol º K = 8,314 mol º K Debe ponerse cuidado y atención en el uso de esta ecuación porque las magnitudes que aparecen en ella deben estar en la forma apropiada y en las Ing. Magno Cuba Atahua unidades correctas. La presión es la presión absoluta en newtons por metro cuadrado, el volumen en metros cúbicos y la temperatura es la temperatura absoluta en kelvins. Características de un Gas Ideal Se considera que un gas ideal presenta las siguientes características: P = Presión total P = Presión al gas A A PB = Presión al gas B Pn = Presión al gas n - El número de moléculas es despreciable comparado con el volumen total de un ∴ La presión parcial del gas A gas. - No hay fuerza de atracción entre las moléculas. P = xa .P A - Las colisiones son perfectamente elásticas. Donde: -Evitando las temperaturas extremadamente bajas y las presiones muy elevadas, P = A Presión molar A por presión total podemos considerar que los gases reales se comportan como gases ideales. LEY DE LAS PRESIONES PARCIALES La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica Fracción Molar: n = A n x= A n Número de moles de A de un determinado gas en una mezcla se llama presión parcial, p. La presión total n = Total del número de moles. de la mezcla se calcula simplemente sumando las presiones parciales de todos los DIFUSIÓN DE LOS GASES gases que la componen. Por ejemplo, la presión atmosférica es: Es el flujo neto de energía, materia, átomos o moléculas desde una zona de Presión atmosférica (760 mm de Hg) = pO2 (160 mm Hg) + pN2 (593 mm Hg) + mayor concentración a otra de menor concentración, tendente a producir una pCO2 (0.3 mm Hg) + pH2O (alrededor de 8 mm de Hg) (1) distribución homogénea. P = P + PB + ....... + Pn A grandes masas de material, la difusión es un proceso molecular, que depende Donde: exclusivamente de los movimientos aleatorios de las moléculas individuales. La A diferencia de la agitación, que es un proceso en el que se mezclan Ing. Magno Cuba Atahua velocidad de difusión es, por tanto, directamente proporcional a la velocidad media de las moléculas. En el caso de los gases, esta velocidad media es mayor en Donde D se denomina constante de difusión. El valor de D depende de átomo o moléculas que se difunde o del disolvente o medio, como se muestra en la tabla moléculas más pequeñas, al ser inversamente proporcional a la raíz cuadrada de la masa molecular; por otra parte, la velocidad aumenta intensamente con una subida XIII: TABLA XIII de temperatura. ∴ La difusión se realiza describiendo la distancia cuadrática media (radio con Valores tipicos de la constante de difusion D a 20 ºC = 293 ºK molecula Disolvente D (m2 s-1) Oxigeno (O2) Aire 1.8 x 10 -5 Oxigeno (O2) Agua 1.0 x 10 -9 Hidrogeno (H2) Aire 6.4 x 10 -5 Hemoglobina Agua 6.4 x 10 -11 que se difunde un gas). Donde: X = radio. X 2 M = 2 DT M = masa molecular. D = constante de difusión del gas. T = tiempo. COMPLIANCIA Nota: La constante depende del átomo o las moléculas. Es la relación entre el volumen del aire almacenado y las sobre presión a la que La difusión también es “vital” para procesos biológicos como la respiración o la esta sometido. digestión humana. C=V P Esta magnitud define las características de un elemento elástico hueco. La DIFUSIÓN.- la difusión es el flujo neto de átomos o moléculas de las zonas de mayor concentración a las de menor concentración la distancia cuadrática media, compliancia total del sistema respiratorio se calcula con la formula. x2cm , se relaciona con el tiempo mediante. 1=1 + 1 C Ct Cp X2 = 2 D t Donde: Ct = la compliancia toráxica y Cp = Compliancia pulmonar. Ing. Magno Cuba Atahua TENSION SUPERFICIAL DE LOS ALVEOLOS.- Si r es l radio del alveolo y T la tensión del liquido que lo tapiza, la presión alveolar se calcula con la formula. P = 2T r El liquido que baña las paredes alveolares se llama Surfactante. Cuando los pulmones carecen de este liquido, o esta inactivo, los alvéolos se aplastan RESPIRACIÓN HUMANA En la respiración normal, el diafragma se desplaza hacia abajo aumentando el volumen de la cavidad torácica y de acuerdo con la Ec. Pv = nRT, rebajando la presión en el interior de los pulmones. Durante la inspiración esta presión desciende unos 3mmHg por debajo de la presión atmosférica, la cual impulsa el aire en los pulmones venciendo la resistencia que presentan al flujo los conductos por los que circula el aire. Durante la espiración, el diafragma se eleva, con lo que disminuye el volumen de la cavidad torácica y sube la presión en los pulmones unos 3 mmHg por encima de la presión atmosférica. Esto obliga al aire a salir de los pulmones. Por consiguiente, la presión del aire en los pulmones es normalmente muy próxima a la presión atmosférica, de modo que las presiones parciales del oxígeno y del nitrógeno en los pulmones son 0,209 y 0,781 atm, respectivamente. Problemas: 1.- Un cilindro contiene 0.6 m3 de oxigeno a una temperatura de 25 ºC y una presión de 2200 PSI. A).- Que volumen ocupa este gas a 35ºC y a la presión atmosférica. B).- Un hombre está respirando oxigeno Ing. Magno Cuba Atahua puro mediante una mascarilla a razón de 8 lt/min. 3 ¿Cuánto durara el oxigeno? (1 lit = 0.0354 pies ). saquitos que separa el espacio ocupado por aire de los capilares sanguíneos tiene unos 0.25x10-4m de grosor. Los capilares tienen un radio de unos 5x10-6m a).2.- Un cilindro de aire comprimido puede abastecer de suponiendo que el oxigeno se difunde a través de las aire durante 5 horas a un buzo en Paracas donde la membranas y de la sangre como como lo hace en el agua temperatura es de 30ºC. ¿Cuánto durará el cilindro en ¿Qué tiempo promedio se requiere para que el oxígeno se la laguna de Titicaca si se sumerge 20m debajo del difunda desde el centro de un alvéolo hasta el centro agua, si la temperatura es de 5ºC? de un capilar?. 3.-Un buzo que utiliza aire comprimido está trabajando 6.- El aire de los pulmones a 35 m por debajo de la superficie del agua a).- Cual (aire alveolar) tiene una es la presión de su tanque en PSI, b).- La capacidad de composición diferente del sus pulmones es de 6.2 lt. Hallar el volumen que aire atmosférico. ocuparía el aire contenido en sus pulmones si subiera Por ejemplo, la presión súbitamente a la superficie? parcial del dióxido de carbono en el aire alveolar 4.-El tanque de un buzo contiene oxigeno para 4hrs a la es 40 mmHg. ¿Cuál es el porcentaje de CO2 en el aire presión atmosférica y 25ºC, si este buzo tiene que alveolar? trabajar en el lago Morococha donde la presión mmHg. Pco2= Xco2(Patm-Pa); Presión alveolar = 47 atmosférica es de 700 mmhg y la temperatura es -5ºC y y a 20 metros por debajo de la superficie. ¿Cuánto tiempo durará el tanque? 5.- Loa alvéolos pulmonares son pequeños saquitos de aire de unos 10-4 m de radio, la membrana de estos Ing. Magno Cuba Atahua 7.-Si un alpinista debe subir al Huascaran y de acuerdo 0.2 lt/cm de H2O. Calcular la presión pulmonar cuando a las recomendaciones médicas le han informado que no se introduce 200cm3 de aire en los pulmones. debe pasar la presión parcial del oxigeno en sus 11.- ¿Cuánto tiempo puede vivir una persona con el aire alvéolos no debe pasar de 100 mmHg ¿Hasta qué altura contenido en una habitación cerrada de 3x3x3 m3, debe subir sin comprometer su salud?. Si la temperatura suponiendo que mientras esta en reposos consume en el lugar es de 23ªc? Fórmula para determinar la 5lit./min ( La respuesta no es verídica ya que aparecen Presión Local PAtm = Po e −0.0342 h / T efectos adoptivos y cambios de tasa de utilización del CO2). 8.-Mientras realiza una actividad suave, una persona respira 10lt de aire por minuto y utiliza oxigeno en cantidad de 10 mlt.min.Kg a).- Halle la fracción molar de o2 en el aire espirado (una vez seco) por una persona de 150 lb (68 kg) y la correspondiente Po2 en los pulmones b).- Repita el calculo para la misma persona cuando realiza una actividad pesada (Un atleta) quien consume 70 mlt/min.kg de o2 utilizando un volumen de 113 lit. de aire por minuto. 9.-En Huancayo la presión atmosférica es de 500 mmHg cual es la presión parcial de O2 y N2 de las personas que habitan en el lugar. 10.- La compliancia del aparato respiratorio de un hombre normal es 0.1 lt/cm de H2O y la pulmonar es de Ing. Magno Cuba Atahua