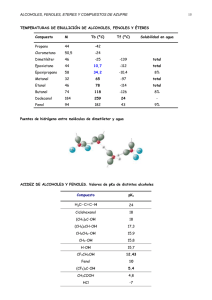
R C R OH R Na° 2 H R C R R O Na
Anuncio

Trabajo Práctico N°6 ALCOHOLES y FENOLES - AMINAS INTRODUCCIÓN TEÓRICA Alcoholes i- Acidez: El átomo de hidrógeno del hidroxilo de un alcohol es débilmente ácido (más débil aún que el agua), pero lo suficiente como para que un alcohol reaccione con metales alcalinos (Na, K, etc.), desplazando H2 y formando el correspondiente alcóxido metálico, sal cuyo anión (alcóxido) es una base más fuerte que el hidroxilo. La presencia de la base fuerte puede ser puesta en evidencia mediante un indicador adecuado, por ejemplo fenoftaleína (rojo-violaceo). R R R C OH + R Na° C O-+Na + 1 H2 2 R R ii- Oxidación de alcoholes: La naturaleza de los productos originados en estas reacciones depende del tipo de alcohol y del tipo de oxidante utilizado. Los alcoholes primarios frente a K2Cr2O7 en solución ácida generan aldehidos, aunque también se produce en cierta extensión la oxidación posterior de estos a ácidos. O Cr 2(SO 4)3 + 7 H2O + 3 R-C + K 2 SO 4 H 3 RCH 2OH + Cr 2O 7K 2 + 4 H 2SO 4 Los alcoholes secundarios, oxidados en las condiciones mencionadas, originan cetonas; y los terciarios no se oxidan fácilmente bajo dichas condiciones. iii- Deshidratación de alcoholes: La deshidratación puede ocurrir en forma intra- o intermolecular. La facilidad de deshidratación intramolecular depende de la sustitución sobre el carbono que lleva el OH: los alcoholes terciarios reaccionan más rápidamente (más fácil) que los secundarios, y estos que los primarios. CH3 CH3 H C OH H2 SO4 CH3 C CH2 CH2 1 CH3 + H2O En otras palabras, esta reacción es tanto más fácil cuanto más estable sea el ion carbonio que se forma como intermediario. Fenoles i-Acidez: En el caso de los fenoles, el átomo de H es débilmente ácido, pero más que el de los alcoholes. Esto puede ponerse en evidencia frente a soluciones diluidas de NaOH o de Na2CO3: los fenoles se salifican, formándose fenóxidos de sodio solubles en agua. -+ O Na OH + NaOH + H2O iii- Sustitución electrofílica en el anillo aromático: El -OH activa el núcleo aromático, es decir, lo torna más reactivo frente al ataque de un electrófilo, y orienta a las posiciones o- y p-. Asi, los fenoles son fácilmente nitrados sin la necesidad de emplear un catalizador. OH OH OH NO2 + HNO 3 + + H2O NO2 iv- Reacción con FeCl3 Los fenoles (asi como los enoles: -C=C-OH), forman complejos con el ión Fe+3 en solución neutra, intensamente coloreados (entre violeta y verde). El ensayo es utilizado como prueba cualitativa de la presencia de fenoles, pero tambien dan resultado positivo aquellas sustancias que pueden existir en forma enólica. ....OH .. ..OH 6 + Fe+3 Fe+3 6 2 AMINAS Pueden considerarse como derivados del NH3 , en el que uno o más hidrógenos has sido reemplazados por grupos alquílicos o arílicos, o por ambos grupos. Según el número de hidrógenos sustituidos se las clasifica en aminas primarias, secundarias y terciarias: NH3 R-NH2 R2NH R 3N Efectuando igual sustitución en las sales y bases de amonio se obtienen las sales o bases de amonio primarias, secundarias, terciarias y cuaternarias: RNH3+ X- R2NH2+ X- R4+ X- R3NH+ X- (cuando X es un halógeno:sales de amonio, con X=OH son bases de amonio) i- Basicidad Las aminas tienen caracter básico debido a la presencia de un par de electrones no compartidos sobre el nitrógeno (aceptor de protones: base de Brønsted , dador de electrones:base de Lewis). + .. CH3-NH2 + H-O-H .H. CH3-NH2 - OH hidróxido de metilamonio metilamina Por esta razón las aminas son solubles en agua (la solubilidad disminuye a medida que aumenta la longitud de la cadena carbonada), y se combinan con los ácidos dando lugar a la obtención de las sales de amonio correspondientes. + .. CH3-NH2 + H-Cl .H. CH3-NH2 Cl- cloruro de metilamonio metilamina Las aminas aromáticas son bases más débiles que las alifáticas e incluso que el NH3. ii- Oxidación Las aminas alifáticas primarias y secundarias dan por oxidación productos complejos y carentes de utilidad. Las terciarias dan óxidos de amina moderadamente estables. 3 Oxidac. xx (CH3)3N: xOx xx (CH3)3N: N-óxido de trimetilamina (CH3)3N-O metilamina La oxidación de las aminas aromáticas primarias es de utilidad en síntesis orgánica pues según las condiciones de reación y la naturaleza del agente oxidante, se pueden obtener productos definidos como : H-N-OH NH2 [Ox] [Ox] [Ox] fenilhidroxilamina anilina NO2 NO nitrosobenceno nitrobenceno iii- Reacción con HNO2 La reacción de las aminas con el acido nitroso permite la diferenciación pues las aminas primarias dan un alcohol (o fenol) y desprendimiento de N2; las secundarias forman un liquido oleoso (nitroso compuestos) y las terciarias no reaccionan o se descomponen en diversos subproductos. CH 3 -CH 2 -NH 2 + CH 3 -CH 2 -OH etanol O=N-OH etilamina (CH 3 )2 NH + O=N-OH (CH 3 ) 2 N-N=O + dimetilnitrosamina dimetilamina + N 2 + H 2O H 2O Las aminas aromáticas primarias reaccionan en dos formas: a) Si la reacción se realiza en caliente se produce fenol y se desprende nitrógeno gaseoso: NH 2 OH + + O=N-OH anilina N2 + H 2O fenol b) Si la reacción se produce en frío y en medio ácido se forma una sal de diazonio estable a bajas temperaturas: + NH + 3 Cl - N N Cl + O=N-OH cloruro de anilinio - cloruro de benzodiazonio 4 Los compuestos de diazonio son importantes en la industria de los colorantes (colorantes azóicos) y síntesis orgánica. N N + OH N. . N. . fenol colorante azóico sal de diazonio 5 OH I- Parte experimental ALCOHOLES 1-Reacción entre un alcohol primario y dicromato de potasio (Cr2O7K2): En dos tubos de ensayo coloque 2 ml de solución de dicromato de potasio (Cr2O7K2) al 5% y 5 gotas de ácido sulfúrico al 20%. En uno de los tubos agregue algunas gotas de metanol, y en el otro algunas gotas de etanol. Entibie a la llama, y perciba el olor característico del formol, y el aroma a manzanas verdes del etanal, en cada caso. Formule las ecuaciones correspondientes en cada caso. 2. Reacción con sodio (Na): En un tubo de ensayo seco coloque 2 ml de etanol anhidro, agregue un pequeño trozo (limpio) de sodio, del tamaño de un perdigón. Observe la reacción que tiene lugar. Una vez finalizada la misma, agregue una gota de solución de fenoftaleína al 0,5% en metanol. Interprete los fenómenos observados. 3-Deshidratacion intramolecular: En cada uno de los 3 tubos coloque 0,5 ml de solución de bromo en tetracloruro de carbono (Br2 en CCl4) al 2%, a continuación el alcohol correspondiente y agregue luego con mucho cuidado gotas de H2SO4. Colóquelos enseguida en un baño maría de 50 °C. Ensaye con los siguientes alcoholes: a) Etanol (usar 4 gotas ca. 2,5 mmoles) b) 2-propanol (usar 5 gotas ca. 2,5 mmoles) c) ter-butanol (usar 6 gotas ca. 2,5 mmoles) Agítelos en forma pareja; y mida el tiempo necesario para la decoloración de las soluciones; relacione los valores obtenidos, con la facilidad de deshidratación intramolecular de los alcoholes. FENOLES 1-Caracter ácido: A pocos cristales de fenol colocados en un tubo de ensayo (Cuidado: el fenol causa quemaduras al tomar contacto con la piel) o, si se usa una solución de fenol al 90%, a algunas gotas , agregue 1 ml de agua destilada y luego gota a gota, agitando, solución de hidróxido de sodio (NaOH ) al 10%. Observe. Acidifique por agregado de solución de ácido sulfúrico (SO4H2) al 20%. Interprete con ecuaciones. 2-Activacion del anillo aromático: En dos tubos de ensayo secos coloque: 1er. tubo: Aproximadamente 0,1 gr. de fenol cristalizado; 2do. tubo: 10 gotas de benceno. Agregue a cada tubo 0,5 ml de ácido sulfúrico concentrado, y entibie en baño maría a 50-60°C. durante 10 min. Agregue a continuación, OPERANDO BAJO CAMPANA, CON PRECAUCION, 10 gotas de ácido nítrico puro en cada tubo. Agítelos, observe cualquier cambio. Si es necesario caliéntelos 10 – 15 min. a 50 – 60 °C a baño maría. Diluya el contenido de ambos tubos con 5 ml de agua destilada; agite nuevamente y observe. Registre sus resultados e interprete con ecuaciones. 3-Reaccion con cloruro férrico (FeCl3): Coloque en un tubo de ensayo unas pequeña cantidad de fenol, agregue 2 ml de agua destilada para disolverlo. Agregue gotas de solución de FeCl3 al 1% . Coloque en otro tubo de ensayo unas pequeña cantidad de ácido salicílico, agregue unas gotas de etanol para disolverlo. Agregue gotas de solución de FeCl3 al 1% . Observe, registre sus resultados e interprete con ecuaciones. AMINAS 1- Carácter básico: a) En dos tubos de ensayo coloque, respectivamente, 1ml de solución al 5 % de NaOH, y 1ml de solución al 5% de HCl (o de H2SO4).agregue a cada tubo 3-5 gotas de anilina. Interprete su observación. 6 b) (Practique la reacción en la campana ) En otro tubo de ensayo coloque unas gotas de solución al 5% de NaOH, agregue un pequeño cristal de clorhidrato de metilamina. Agite y entibie. Perciba el olor característico de las aminas de bajo peso molecular. 2- Reacción con sales cúpricas: En dos tubos de ensayo coloque, respectivamente, una gota de solución de SO4Cu al 10%. A un tubo agrégue una gota de solución de anilina; al otro tubo añada dos cristales de cloruro de metilamonio. Observe e interprete sus resultados. 3- Reacción con el ácido nitroso: a) En un tubo de ensayo coloque pocos cristales de clorhidrato de metilamina; agregue 3ml de solución al 5% de HCl; enfríe en baño de hielo-agua, y añádale 10-20 gotas de solución acuosa de NaNO2 al 10%, previamente enfriada. Agite durante pocos minutos en el baño a 0-5ºC, para dar tiempo a que se lleve a cabo la reacción. A continuación, caliente suavemente el contenido del tubo, sin llegar a ebullición. Observe e interprete. b) En otro tubo coloque una gota de anilina, 1 ml de agua destilada y 4 gotas de H2SO4 concentrado. Enfríe bien, en baño de agua-hielo. Mientras la solución obtenida esta bien fría agregue, agitando, 20 gotas de solución de NaNO2 al 10% . Agite la solución durante unos minutos en el baño a 0-5 °C. Divida la solución obtenida en dos porciones: A una de ellas, agregue gotas de solución alcalina de fenol o de betanaftol. A la segunda porción, caliéntela suavemente, como hizo en el ensayo anterior. Interprete con ecuaciones los fenómenos que observe. 7 II-Cuestionario ALCOHOLES, FENOLES, ETERES y AMINAS Temario: Nomenclarura. Propiedades físicas de los alcoholes. Diferenciación de alcoholes primarios, secundarios y terciarios. Reacciones de oxidación y deshidratación. Reactivos de Grignard. Comparación entre alcoholes alifáticos o aromaticos y fenoles. Acidez. Reacciones de sustitución nucleofílica alifática. Dioles. Bibliografía: William H. Brown, "Introducción a la Química Orgánica". Compañía Editorial Continental, México, 2002. -H. Hart; D. J. Hart, L. E. Craine, “Quimica orgánica”, McGrawHill Interamericana, 5ta ed. 1995, México - Guía de Trabajos Prácticos - Clases teóricas. 1) Nombrar los siguientes compuestos de acuerdo a las reglas IUPAC: OH CH2 OH a) CH2 -CH3 OH c) b) e) d) CH2-OH CH2-OH OH f) g) CH3-CH-O-CH2-CH3 CH3-CH-CH2-CH=CH2 OH i) h) CH3-O-CH2-CH2-CH-CH3 CH3 CH3 CH3 CH2-Br j) CH3-C-OH CH3 Cl k) CH3 CH2-OH m) l) CH3 2) Ordene los siguientes compuestos de acuerdo a su acidez creciente. Justifique: a) CH3-C-OH OH OH NO2 O2N b) c) d) H3C-OH CH3 NO2 3) ¿Cómo puede distinguir entre 1-hexanol , 3-metil-3-pentanol y 3-metil-2-pentanol mediante: a) Reactividad relativa de los alcoholes con H2SO4 (conc). b) Oxidación? 4) Indique mediante reacciones químicas como podría aprovechar las propiedades químicas de los siguientes compuestos para diferenciarlos: a) b) c) d) e) CH-OH CH2 Cl CH3 CH2 Clorobenceno de 1-clorohexano 1-Clorohexano de 1-hexanol Fenol de alcohol bencílico 1-Pentanol de 3-pentanol Eter etílico de etanol 8 5) Complete los siguientes reacciones, representando la estructura del compuesto inical y nombrando el/los productos: a) 2-Propanol + Na b) sec-Butanol + K2Cr2O7 c) 2-Butanol + Ac. propanoico d) 1-Butanol + IMgCH3 e) Alcohol bencilico + Cloruro de acetilo f) Fenol + NaOH g) Fenol + HNO3 + H2SO4 6) Complete las siguientes reacciones: a) CH3-CH2-Cl + KOH b) Bromuro de t-butilo + KOH Cl c) + HNO3 + H2SO4 d) CH3-CH2-Cl + CH3-CH2-ONa 7) a) Escriba las fórmulas generales de las aminas primarias, secundarias y terciarias. Represente un ejemplo de cada una y nómbrelas. b) Ordene según basicidad creciente y fundamente su respuesta: H2O , NH3 , O2N NH2 , , R2NH RNH2 , NH2 c) Proponga un método para demostrar la basicidad de una amina. Escriba ecuaciones si es necesario. 8) Observar, completar y nombrar: a) Las aminas son reactivos .. R-X + R-X NH3 R-X b) NH2 + Br2(ac) 9 R-X c) ¿Qué grupos sustituyentes aumentan y cuales disminuyen la basicidad de la anilina? Justifique. d) Indique el producto de las siguientes reacciones: RNH2 + HNO2 R2NH + HNO2 R3N + HNO2 NH2 + HNO2 10 Quimica Orgánica Alcoholes y Fenoles -- Ejercicios Adicionales 1) Un alcohol utilizado para la esterilización de suelos previa a la siembra posee 62,1% C, 10,3%H y 27,6%O un PM=58. Se sabe que dicho compuesto adiciona un mol de cloro y que su oxidación suave da como producto un aldehído. a) ¿Cuál será la estructura de dicho compuesto?. b) Nombrarlo según IUPAC. c) Representar el producto de su oxidación suave. Prediga si presenta resonancia, y en caso afirmativo representar todas sus estructuras resonates, así como el híbrido de resonancia. ¿Qué otro producto se hubiera formado con una oxidación más fuerte del alcohol? d) Calcular el número de oxidación de todos los átomos de carbono del compuesto problema y los productos de oxidación suave y fuerte, indicando si alguno de ellos presenta isomería geométrica y/u óptica. 2) El 2-etil-1,3-hexanodiol es un repelente de insectos conocido como "Etohexadiol" Con respecto a dicho compuesto: a) Represente su reacción con: i) Dicromato de potasio (en medio ácido). ii) Sodio metálico. iii) Hidróxido de sodio. iv) Hidrógeno carbonato de sodio. b) Representar todos sus isómeros de posición. c) Representar todos sus isómeros ópticos posibles, indicando cuáles son entre sí enantiómeros, diasteroisómeros o compuestos meso. 3) Representar las reacciones del 1-butanol y el 2-butanol con dicromato de potasio en medio ácido, balanceándolas mediante el método del ión-electrón. 4) El "Dicofol" y el "Clorfenetol" son dos acaricidas utilizados en frutas, vegetales y algodón. Sus estructuras son las siguientes: OH Cl C OH Cl Cl C CCl 3 CH3 Dicofol Clorfenetol a) Nómbrelos según IUPAC. b) En caso de que se produzcan represente sus reacciones con: i) Dicromato de potasio (en medio ácido). ii) Sodio metálico. iii) Hidróxido de sodio. iv) Acido sulfúrico concentrado. 11 Cl 5) Dados los siguientes compuestos, ordenarlos según su acidéz creciente. Justificando adecuadamente con los efectos electrónicos inductivos y de resonancia según corresponda: a) 1-pentanol b) fenol c) 2-pentanol d) 2,2-dimetil-1-propanol e) p-nitrofenol f) p-aminofenol. 6) a) Representar todos los alcoholes posibles que posean una composición centesimal de 68,2%C; 13,6%H y 18,2%O y un peso molecular igual a 88. b) Representar la reacción de c/u de ellos con H2SO4(c). c) Representar la reacción de c/u de ellos con HCl. c) Representar la reacción entre los productos obtenidos en (b) con Br2. d) Representar la reacción entre los productos obtenidos en (b) con HCl. 7) Los dinitrofenoles son una amplia familia de insecticidas entre los cuales se encuentran el DNOC (2-metil-4,6-dinitrofenol; un insecticida de contacto que también actúa como veneno estomacal y ovicida en ciertos insectos) y el DINOSEB (El 2-(1-metilpropil)-4,6dinitrofenol; con gran actividad herbicida). Representar pára c/u de ellos sus reacciones frente a: a) Sodio metálico. b) Hidróxido de sodio. c) Hidrógeno carbonato de sodio. d) Solución de cloruro férrico. 12