Nitro y sulfocompuestos_MASS_T4 - q
Anuncio
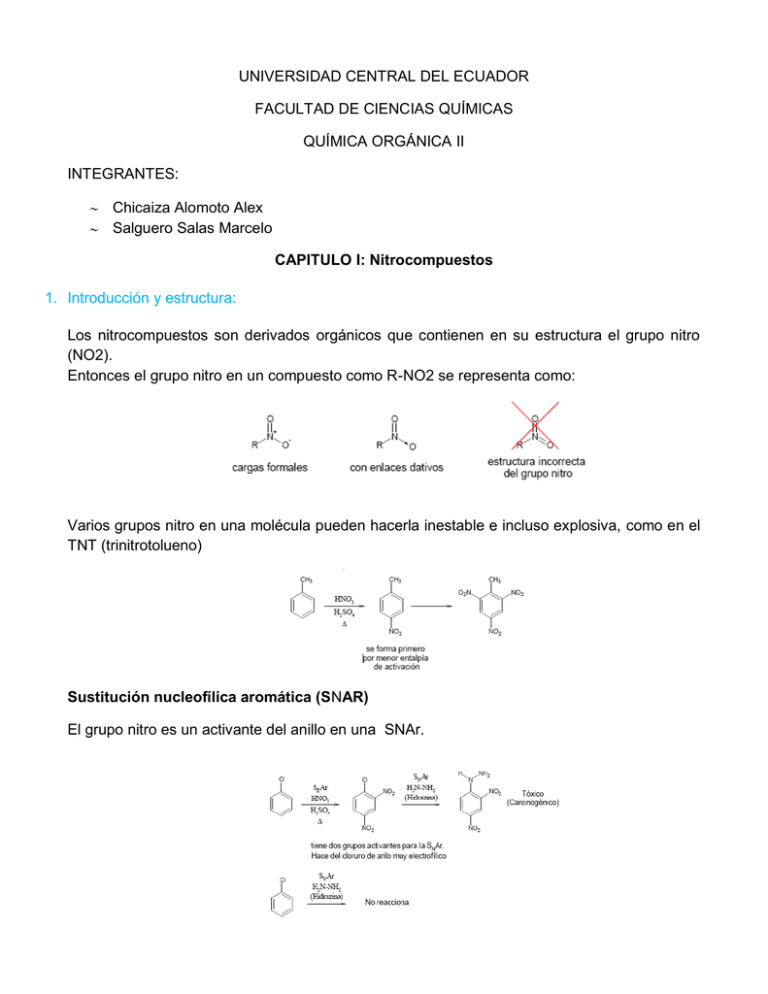
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUÍMICA ORGÁNICA II INTEGRANTES: Chicaiza Alomoto Alex Salguero Salas Marcelo CAPITULO I: Nitrocompuestos 1. Introducción y estructura: Los nitrocompuestos son derivados orgánicos que contienen en su estructura el grupo nitro (NO2). Entonces el grupo nitro en un compuesto como R-NO2 se representa como: Varios grupos nitro en una molécula pueden hacerla inestable e incluso explosiva, como en el TNT (trinitrotolueno) Sustitución nucleofílica aromática (SNAR) El grupo nitro es un activante del anillo en una SNAr. 2,4-dinitrofenilhidrazina. Las hidrazonas derivadas de compuestos carbonílicos son usualmente compuestos estables y cristalinos, usados para confirmar la identidad de aldehídos y cetonas. Ejemplo: antes de la era RMN era muy difícil de distinguir Entonces para distinguir se formaban las 2,4-dinitrofenilhidrazonas correspondientes: Orientación de la reacción de nitración: Retro síntesis Entonces El mecanismo involucra una adición – eliminación cuyo intermedio está estabilizado por el grupo nitro: Estabilización del intermediario es preferencial en posición orto: Esquema del mecanismo: el átomo de cloro en posición meta no se elimina, ya que no existe la misma estabilización. La formación de nitrofenoles también se hace a partir de cloronitrobenceno: Sustitución electrofilica aromática (SEAR) La nitración del núcleo aromático es importante porque es un método fácil y conveniente de añadir un grupo amino. La reacción se detiene después de que el grupo nitro se añade. La segunda nitración es posible pero cuando condiciones más fuertes se emplean. El segundo grupo nitro se introduce en posición meta-. metaones de posiciones o y p- (por ello orienta meta-). Grupo nitro toma electrones y desactiva electrófilo Entonces no es bueno en reacciones de ataque electrofílico Generación del electrófilo: El ion nitronio presenta hibridación sp en átomo de N y es isoelectrónico con CO2 2. Propiedades físicas: Estos compuestos suelen tener muy elevados puntos de ebullición. Los nitrocompuestos suelen presentarse en estado líquido y sólido normalmente. Tienen una insolubilidad completa en el agua. Estos compuestos suelen ser venenosos. 3. Propiedades químicas El grupo nitro atrae fuertemente los electrones, es por esta característica que comúnmente se utiliza los nitrocompuestos en las reacciones químicas. Como consecuencia de la estructura del grupo nitro, el nitrógeno atrae a los electrones del enlace C-N, lo que origina una especial reactividad de los hidrógenos en posición α: Los electrones del enlace H-C se desplazan al carbono y el hidrógeno es separable como protón. Los protones α al grupo nitro se caracterizan por ser particularmente ácidos, por ejemplo, el nitrometano, con un pKa 10.3, es más ácido que el agua y que los alcoholes, como el metanol y etanol (pKa ~ 16), incluso es más ácido que el malonato de dietilo (pKa ~ 13). Por lo tanto, es claro que el efecto inductivo que ejerce el grupo nitro sobre estos protones es claramente mucho más fuerte que el que ejerce dos carbonilos en posición relativa 1,3, por lo tanto, bases como los hidróxidos (Na, K) y los alcóxidos son capaces de abstraer completamente este protón. La elevada acidez del nitrometano se explica por la eficaz deslocalización de la carga negativa debida al efecto inductivo y resonante electrón-atrayente que posee el grupo nitro. El nitrometano se disuelve en una disolución acuosa de NaOH porque se transforma completamente en su base conjugada. 4. Síntesis Preparacion de nitrocompuestos alifáticos: A diferencia de la nitración de hidrocarburos aromáticos, los hidrocarburos saturados alifáticos son inertes a los agentes nitrantes convencionales en condiciones normales. En condiciones forzadas hay ruptura de enlace C-C y se generan múltiples nitrocompuestos de bajo peso molecular. La nitración en fase gaseosa se usa inicialmente desde 1940’s en la preparación de mononitroalcanos. Este método no es práctico para el laboratorio. 1. Reacción con alquilnitritos – formación de arilnitrometanos (vía carbanión) 2. Adición regioselectiva de yoduro de nitroilo a alquenos, seguida de eliminación inducida por base. 3. -nitrocetonas (existen otros métodos) Nitración directa de cetonas genera gran variedad de sub-productos de oxidación. Entonces se usan enolatos, enolacetatos o enoléteres. Como agente nitrante, principalmente un acilnitrato. (Ejercicio: cómo se prepara acetilnitrato a partir de anhídrido acético y ácido nítrico –mecanismo) 4. Ruptura de anillo de 2-nitrocetonas por un nucleófilo para generar nitrocompuestos funcionalizados. Ejemplo: apertura de anillo con ROH – KF 5. Nitración de haluros de alquilo usando nitritos AgNO2 (nitrito de plata) Reacción de Victor Meyer NaNO2 (nitrito de sodio) Reacción de Kornblum KNO2 (nitrito de potasio) Genera mezcla de nitroalcano + alquilnitrito que se separan por destilación. 5. Analisis: físico, químico y espectroscópico (IR, H-RMN, Masas) o Infrarrojo: Los grupos nitros presentan un estiramiento de nitrógeno carbono en la zona de la huella digital que va desde 600 a 1400 cm-1. se diferencia de las aminas porque estas aparte de tener el estiramiento de nitrógeno carbono en la zona de la huella digital que va desde 600 a 1400 cm-1, también posee un estiramiento característico de nitrógeno hidrógeno en 3300 cm-1 señal que es ancha y con varios picos. o Espectroscopia de masas: La presencia de nitrógeno en un compuesto hace que el ión molecular tenga una masa molecular impar. Un número impar de átomos de nitrógeno también produce este mismo efecto. o H-RMN: Del grupo nitro no se puede dar ninguna descripción ya que el este grupo no posee ningún protón ni estructura. 6. Aplicaciones Los nitrocompuestos aromáticos tienen pocos usos directos que no sean en la fabricación de explosivos o como disolventes. Su mayor consumo corresponde a la reducción a derivados de la anilina que se utilizan en la fabricación de colorantes, pigmentos, insecticidas, textiles (poliamida resistente al calor: ―Nomex‖), plásticos, resinas, elastómeros (poliuretano), productos farmacéuticos, reguladores del crecimiento de las plantas, aditivos para combustibles, aceleradores del caucho y antioxidantes. CAPITULO II: Compuestos de Azufre 1. Introducción. Características generales de los compuestos Compuestos Orgánicos del Azufre: Los compuestos orgánicos derivados del azufre constituyen un grupo importante de compuestos químicos de utilidad en la industria química, particularmente en la industria de los colorantes, de los fármacos y de los detergentes. Los compuestos de azufre análogos a alcoholes y éteres son los tioles y tioéteres o sulfuros, pero como el azufre tiene orbitales d vacíos y puede albergar más de 4 pares de electrones a su alrededor, puede sufrir, además, reacciones propias que no se dan en alcoholes y éteres Los mercaptanos o tioalcoholes: Se encuentran en el petróleo crudo (tioles volátiles que le confieren al gas líquido el olor desagradable que permite detectar salideros), en algunos animales (zorrillo y mofeta) y plantas. No forman puentes de hidrógeno fuertes pues el azufre es un elemento menos electronegativo que el oxígeno y por tanto son menos polares que los alcoholes, poseen temperaturas de ebullición menores que éstos. Los Tioeteres: En química orgánica, un tioéter (o sulfuro) es un compuesto que contiene el grupo funcional formado por un puente de azufre entre dos cadens carbonadas (R-S-R' o R1-S-R2) como se muestra a la derecha. Siendo el azufre análogo de un grupo eter (R-O-R'), este grupo funcional es llamado grupo tioéter o grupo sulfuro. Tradicionalmente los tioles son denominados mercaptanos. Como muchos otros compuestos que contienen azufre, los tioéteres volátiles tienen olores característicos desagradables. Un tioéter es similar a un éter, conteniendo un átomo de azufre en vez de un átomo de oxígeno. Debido a que el oxígeno y el azufre pertenecen al grupo de los anfígenoss en la tabla periódica, las propiedades químicas y reactividad de los éteres y tioéteres tienen algunos puntos en común pero en general la reactividad de los tioles es mayor al ser mayor su acidez y capacidad de oxidación. Este grupo funcional es importante en biología, en especial en el aminoácido metionina y el cofactor biotina. Existen también otros compuestos azufrados como son: Las sulfonas son derivados de la 4,4-diaminodifenilsulfona que es también llamado dapsona, con propiedades farmacológicas comunes como medicamentos contra la lepra. Una disulfona de importancia comercial para el sector farmacéutico es la droga sulfonal, que tiene propiedades sedantes y soporífero (induce el sueño), las estructuras de estos compuestos azufrados es: Los ácidos sulfónicos pueden considerarse que tienen un origen del ácido sulfúrico, en el cual un grupo hidroxilo ha sido sustituido por un grupo alquilo o arilo. Por lo tanto, su fórmula general es de la forma: Al igual que el ácido sulfúrico, los ácidos sulfónicos se hallan disociados completamente y poseen una fuerza ácida semejante. Los ácidos sulfónicos son los productos finales de los tioles catalizada con ácidos, de acuerdo a la siguiente secuencia: El grupo –HSO3 de los ácidos sulfónicos es comparable al grupo –COOH de los ácidos carboxílicos. Por lo tanto, se neutralizan con bases y se convierten en cloruros de ácido y ésteres correspondientes. Las amidas del ácido sulfanílico son las denominadas sulfonamidas o sulfas y han adquirido considerable importancia en medicina como agentes antimicrobianos. La fórmula general de una sulfonamida es la siguiente: Las sulfonamidas se diferencian en los radicales hidrocarbonados, por ejemplo, el sulfatiazol contiene un hidrógeno y un radical tiazol, mientras que la sulfanilamida contiene dos hidrógenos. 2. Estructura. Tioles: R-S-H En química orgánica, un tiol es un compuesto que contiene el grupo funcional formado por un átomo de azufre y un átomo de hidrógeno (-SH). Siendo el azufre análogo de un grupo alcohol (-OH), este grupo funcional es llamado grupo tiol o grupo sulfhidrilo. Tradicionalmente los tioles son denominados mercaptanos. El término mercaptano viene del latín mercurius captans, que significa 'capturado por mercurio', debido a que el grupo –SH se une fuertemente al elemento mercurio. Tioeteres: R—S—R Un tioeter consiste en un átomo de azufre con hibridación sp3 unido a dos carbonos con hibridación sp3. El azufre es un elemento más electronegativo que el carbono por lo que la el enlace carbono azufre se encuentra polarizado hacia el azufre. 3. Propiedades físicas: Tioles: Olor: Muchos tioles son líquidos incoloros que tienen un olor parecido al del ajo. El olor de tioles es a menudo fuerte y repulsivo, en particular los de bajo peso molecular. Los tioles se unen fuertemente a las proteínas de la piel y son responsables de la intolerable persistencia de olores producidos por las mofetas. Los distribuidores de gas natural comenzaron añadiendo diversas formas de tioles acres, por lo general etanotiol o tert-butiltiol, al gas natural que es inodoro, después de la mortífera explosión de 1937 en el New London School en New London, Texas. Los tioles son también responsables de una clase de fallos en los vinos causados por la reacción no deseada entre el azufre y la levadura. Sin embargo, no todos los tioles tienen olores desagradables. Por ejemplo, los mercaptanos del pomelo son un tiol monoterpenoide responsables del aroma característico de este. Puntos de ebullición y solubilidad: Debido a la pequeña diferencia de electronegatividad entre el azufre y el hidrógeno, un enlace S-H es prácticamente apolar covalente. Por lo tanto, el enlace S-H en los tioles tiene menormomento dipolar en comparación con el enlace O-H del alcohol. Los tioles muestran poca asociación por enlaces de hidrógeno con el agua y las moléculas entre sí. Por lo tanto tienenpuntos de ebullición inferiores y son menos solubles en agua y otros disolventes polares que los alcoholes de similar peso molecular pero siendo tan solubles y con similares puntos de ebullición como los sulfuros isoméricos. Tioeteres: Los sufuros son poco solubles, poco reactivos, incoloros, insolubles en agua, solubles en alcohol, tienen olores fuertes característicos, generalmente muy desagradables. Muchos tioles son líquidos incoloros que tienen un olor parecido al del ajo. El olor de tioles es a menudo fuerte y repulsivo, en particular los de bajo peso molecular. Pese a esto, no todos los tioles tienen olores desagradables. Por ejemplo, los mercaptanos del pomelo son un tiol monoterpenoide responsables del aroma característico de este. Punto de ebullición y solubilidad: Debido a la pequeña diferencia de electronegatividad entre el azufre y el hidrógeno, un enlace S-H es prácticamente apolar covalente. Por lo tanto, el enlace S-H en los tioles tiene menor momento dipolar en comparación con el enlace O-H del alcohol. Los tioles muestran poca asociación por enlaces de hidrógeno con el agua y las moléculas entre sí. Por lo tanto tienen puntos de ebullición inferiores y son menos solubles en agua y otros disolventes polares que los alcoholes de similar peso molecular pero siendo tan solubles y con similares puntos de ebullición como los sulfuros isoméricos. 4. Propiedades químicas: Tioles: Acidez El átomo de azufre de un tiol es muy nucleofílico, bastante más que el átomo de oxígeno del alcohol. El grupo tiol es bastante ácido, con el pKa habitualmente alrededor de 10 a 11. En la presencia de una base se forma un anión tiolato, que es un muy potente nucleófilo. El grupo y su correspondiente anión son fácilmente oxidados por reactivos como el bromo para dar disulfuro orgánico (R-S-S-R). 2R-SH + Br2 → R-S-S-R + 2HBr La oxidación por reactivos más poderosos como el hipoclorito de sodio o peróxido de hidrógeno resulta en ácidos sulfónicos (RSO3H). 2R-SH + 2H2O2 → RSO3H + 2H2O Reacciones El grupo tiol es el análogo del azufre al grupo hidroxilo (-OH) que se encuentran en los alcoholes. Debido a que el azufre y el oxígeno pertenecen al mismo grupo de la tabla periódica, comparten algunas propiedades de enlace similares. Al igual que el alcohol, en general la forma desprotonada RS − (llamado tiolato) es químicamente más reactiva que la forma tiol protonada RSH. La química de tioles está relacionada con la de los alcoholes: los tioles forman tioéteres, tioacetales ytioésteres, que son análogos a los éteres, acetales y ésteres. Por otra parte, un grupo tiol puede reaccionar con un alqueno para formar un tioéter. (De hecho, bioquímicamente, los grupos tiol pueden reaccionar con grupos vinilo para formar un enlace tioéter.) Tioeteres: Reactividad: Mientras que los éteres son generalmente estables, los tioéteres (R-S-R) se oxidan fácilmente a sulfóxidos (R-S(=O)-R), los que pueden ser oxidados más aún a sulfonas (R-S(=O)2-R). Por ejemplo, el sulfuro de dimetilo puede ser oxidado como sigue: S(CH3)2 + O → OS(CH3)2 OS(CH3)2 + O → O2S(CH3)2 Los oxidantes típicos incluyen a los peróxidos. Como por ejemplo el sulfuro de metilo y propilo. 5. Síntesis Tioles: Los métodos utilizados para sintetizar tioles son análogos a los utilizados para la síntesis de alcoholes y éteres. Las reacciones son más rápidas y de mayor rendimiento porque los aniones de azufre son mejores nucleófilos que los átomos de oxígeno. Los tioles se forman cuando un haloalcano se calienta con una solución de hidrosulfuro de sodio CH3CH2Br + NaSH calentada en etanol (ac.) + → CH3CH2SH + NaBr Además, los disulfuros pueden reducirse fácilmente por agentes reductores como el hidruro de litio aluminio en éter seco o hidruro de boro litio,para formar dos tioles. R-S-S-R' → R-SH + R'-SH Tioeter: Los tioéteres suelen prepararse por la alquilación de los tioles: R-Br + HS-R' → R-S-R' + HBr Tales reacciones se aceleran en presencia de una base, la que convierte al tiol en un tiolato, mucho más nucleofílico. Un método alternativo de síntesis incluye la adición de tiol a un alqueno, típicamente catalizada por radicales libres: R-CH=CH2 + HS-R' → R-CH2-CH2-S-R' Los tioéteres también pueden ser preparados vía el rearreglo de Pummerer. Métodos de preparación: Reacciones 1_Reacciones ácido-base: Comportamiento como ácidos y formación de sales. Son ácidos más fuertes que los alcoholes. RSH+NaOHNaRS+OH2 2- Reacciones de Sustitución Nucleofílica Apenas ocurren reacciones competitivas de eliminación porque el átomo de azufre es mayor y más polarizable en el anión mercaptida (R'-S-) que el de oxígeno en los alcóxidos (R-O-), luego resulta un mejor nucleófilo. 3_ Reacciones de Oxidación En los alcoholes la oxidación ocurre en el carbono, en los tioles ocurre en el azufre debido a la mayor facilidad a la oxidación del enlace SH que el enlace O-H en los alcoholes. La oxidación a disulfuros de los tioalcoholes es una reacción biológica de importancia. A partir del amino ácido Cisteina se forma la Cistina. Los ácidos alquilsulfónicos también se preparan a partir de halogenuros de alquilo o alquenos. 6. Análisis: físico, químico y espectroscópico (IR, H-RMN, Masas) Tioles: o Infrarrojo: La frecuencia de alargamiento S—H de los tioles da origen a una banda débil en el intervalo 2550 a 2700 cm-1 o Espectrometría de masas: Para realizar la interpretación de los espectros de masas de compuestos de azufre nos podemos auxiliar por la observación de un pico M+2 debido a la presencia de isótopo de masa 34 de azufre. La ruta principal de fragmentación de los tioles es análoga a la de los alcoholes. o RMN de 1H: Debido a su electronegatividad menor a lo del oxígeno el azufre protege los protones vecinos más que el oxígeno. Por tanto, los protones de un grupo CH2 S aparecen a campo más alto que el de un grupo CH2OH. Tioeteres: o Infrarrojo: La vibración de alargamiento de C—S—C de los sulfuros produce un pico débil en el intervalo de 600 a 700 cm-1, lo que nos indica que esta señal va a aparecer en la zona de la huella digital. o Espectrometría de masas: Para un tioeter o sulfuro se pierde un radical alquilo de su ión molecular para formar un catión estabilizado por el oxígeno que es el más estable. Así el fragmento más abundante es el que contenga en su estructura al átomo de azufre. Como en otros compuestos sulfurados, se puede inferir la presencia del azufre por un pico en m/z = M + 2 o RMN de 1H.: El desplazamiento químico del protón en la unidad H—C—O—C de un éter es muy parecido al del protón en la unidad H—C—O—H de un alcohol. Lo típico es un intervalo de desplazamiento de 3.2 a 4.0. el protón de la unidad H—C—S—C de un sulfuro aparece en un campo más alto que el protón correspondiente a un éster, porque el azufre es menos electronegativo que el oxígeno. La oxidación de un sulfuro a un sulfóxido o sulfona se acompaña por una disminución de la protección de H—C—S—C de alrededor de 0,3 a 0,5 ppm para cada oxidación. 7. Aplicaciones Tioles: Se utiliza como agente reductor suave para destoxificar peróxidos y mantener los residuos de cisteína de la hemoglobina Se los emplea como base de surfactantes Se emplea en algunas formulas para shampo Se aplican en pesticidas Para limpieza de metales Se suele aplicarlo también en algunos colorantes Para la fabricación de algunos cosméticos. Tioeteres: Se usa en multitud de procesos industriales como producción de ácido sulfúrico para baterías, la fabricación de pólvora el vulcanizado del caucho. usos como fungicida en la manufactura de fosfatos fertilizantes. Bibliografía: Libros: o [1] McMurray, J. E., J. H. Musser, I. Fleming, J. Fortunak and C. Nubling. Org. Synth. Coll. 6, 799 (1988). o [2] Quifioa, E. y Riguera, R. "Cuestiones y ejercicios de Química Orgánica" Ed. Mc Graw Hill Interamericana de España, 1996. o [3] Agronornov, A. E. y colaboradoes. "Problemas y Ejercicios en Química Orgánica" Ed. Reverté, 1978. Páginas web; buscador (Google): o [1]http://www.bibliotecadonbosco.com.ar/organica1/COMPUESTOS%20ORGANICOS% 20DEL%20AZUFRE.pdf o [2] http://www.ugr.es/~quiored/qog/grup_fun/tioeteres.htm o [3] http://ingquimicauv.webcindario.com/Todos/tioles.htm o [4] http://es.wikipedia.org/wiki/Tiol o [5] http://es.wikipedia.org/wiki/Tio%C3%A9ter o [6]http://gavilan.uis.edu.co/~jurbina/docencia/QO2/pdfs/QO2-Nitrocompuestos.p







