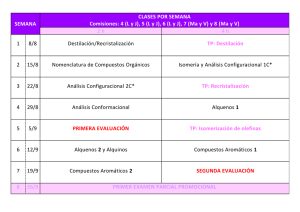
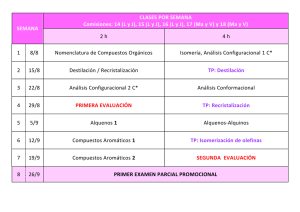
universidad nacional abierta ya distancia escuela de
Anuncio
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA ESCUELA DE CIENCIAS BÁSICAS TECNOLOGÍA E INGENIERÍA PROGRAMA DE QUÍMICA 401587 – DERIVADOS HALOGENADOS Qco. GERMÁN BARRERA VALENZUELA (Autor) Qca. LADY YOHANA ROSERO (Acreditadora) BOGOTÁ Junio de 2013 1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS ASPECTOS DE PROPIEDAD INTELECTUAL Y VERSIONAMIENTO El presente módulo fue diseñado en el año 2013 por el Químico GERMAN BARRERA VALENZUELA, docente de la UNAD, adscrito a la Escuela de Ciencias Básicas, Tecnología e Ingeniería en el Cead JOSE ACEVEDO GÓMEZ de Bogotá y actualmente Director del curso 401587 Derivados Halogenados del Programa de Química. Adaptado a los últimos lineamientos emitidos por la UNAD, entrega esta actualización, con el fin de que pueda ser publicada en los Repositorios autorizados de la Universidad. Este documento se puede copiar, distribuir y comunicar públicamente bajo las condiciones siguientes: • Reconocimiento. Debe reconocer los créditos de la obra de la manera especificada por el autor o el licenciador (pero no de una manera que sugiera que tiene su apoyo o apoyan el uso que hace de su obra). • No comercial. No puede utilizar esta obra para fines comerciales. • Sin obras derivadas. No se puede alterar, transformar o generar una obra derivada a partir de esta obra. • Al reutilizar o distribuir la obra, tiene que dejar bien claro los términos de la licencia de esta obra. • Alguna de estas condiciones puede no aplicarse si se obtiene el permiso del titular de los derechos de autor. • Nada en esta menoscaba o restringe los derechos morales del autor. 2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS INTRODUCCIÓN El presente modulo está dirigido a estudiantes de programas de pregrado que oferta la UNAD, bajo la modalidad de educación superior a distancia. El material está estructurado en dos unidades que son las temáticas macro del curso académico. . El contenido de cada una de las partes fue seleccionado, teniendo en cuenta los saberes mínimos que se esperaría debe alcanzar un estudiante de la Universidad Nacional Abierta y a Distancia en el campo de los Derivados Halogenados Para el mejor aprovechamiento de este material, se recomienda que el estudiante posea como conocimientos previos: química orgánica del bachillerato, química general e hidrocarburos. El modulo se caracteriza porque en cada lección se presentan ejemplos modelo del tema en estudio; al final de cada capítulo se exponen ejercicios con respuesta, que permite a los estudiantes contextualizarse en diversas áreas del conocimiento, con el fin de fortalecer las temáticas propias del curso. Al final de cada unidad se presenta una Autoevaluación de un nivel medio-alto, las cuales permiten verificar los alcances de los estudiantes en las temáticas analizadas y detectar las debilidades y así centrarse en éstas, con el fin de alcanzar las metas propuestas. Finalmente, el Material pretende servir como guía de aprendizaje autónomo, se recomienda apoyar este proceso por medio de lecturas especializadas, ayudas audiovisuales, visitas a sitios Web, entre otros, para así lograr una efectiva comprensión, interiorización y aplicación de las temáticas estudiadas. 3 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS INDICE DE CONTENIDO UNIDAD UNO: DERIVADOS HALOGENADOS, ALCOHOLES Y FENOLES CAPÍTULO 1 HALOGENUROS DE ALQUILO Y DE ARILO PÁGINA LECCIÓN No. NOMBRE DE LA LECCIÓN 1 Estructura y nomenclatura de los halogenuros de alquilo 7 2 Propiedades físicas de los halogenuros de alquilo 10 3 Preparación de halogenuros de alquilo 13 4 Reacciones de los halogenuros de alquilo 15 5 Halogenuros de arilo 20 CAPÍTULO 2 ALCOHOLES 6 Estructura y nomenclatura de los alcoholes 23 7 Propiedades físicas de los alcoholes 26 8 Propiedades químicas de los alcoholes 28 9 Preparación de alcoholes 31 10 Reacciones de los alcoholes 35 CAPÍTULO 3 FENOLES 11 Estructura y nomenclatura de los fenoles 37 12 Propiedades físicas de los fenoles 39 13 Preparación de fenoles 40 14 Reacciones de los fenoles 42 15 Acidez de los fenoles 45 4 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS UNIDAD DOS: ETERES, ALDEHIDOS Y CETONAS CAPÍTULO 4 ETERES LECCIÓN No. PÁGINA NOMBRE DE LA LECCIÓN 16 Estructura y nomenclatura de los éteres 47 17 Propiedades físicas de los éteres 51 18 Preparación de éteres 52 19 Reacciones de los éteres 59 20 Eteres cíclicos 61 CAPÍTULO 5 ALDEHIDOS 21 Estructura de los aldehídos 66 22 Nomenclatura de los aldehídos 67 23 Propiedades físicas de los aldehídos 71 24 Preparación de aldehídos 73 25 Reacciones de los aldehídos 75 CAPÍTULO 6 CETONAS 26 Estructura de las cetonas 81 27 Nomenclatura de las cetonas 82 28 Propiedades físicas de las cetonas 86 29 Preparación de cetonas 88 30 Reacciones de las cetonas 93 Bibliografía 97 5 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS UNIDAD 1 Nombre de la Unidad DERIVADOS HALOGENADOS, ALCOHOLES Y FENOLES Introducción La primera unidad comprende el estudio de tres grupos funcionales de la química orgánica. El primero es el grupo halógeno unido a un hidrocarburo alifático o aromático, el segundo es el grupo – OH unido a un hidrocarburo alifático y el tercero es el grupo – OH unido directamente a un hidrocarburo aromático. En las tres familias de compuestos se estudian sus propiedades físicas y químicas, preparación y reacciones con sus respectivos mecanismos. Justificación El estudio de la química orgánica no solo incorpora nuevos conocimientos, sino también el desarrollo de competencias que tienen que ver con el desempeño profesional del químico, tales como analizar problemáticas, compartir perspectivas teóricas y debatir enfoques, categorías, métodos y procedimientos para elaborar nuevos productos, o desarrollar investigación técnica y científica; razones que constituyen los criterios para la resolución de problemas dentro del campo especifico del saber donde se espera que se desempeñe el profesional egresado en Química de la UNAD. Intencionalidades Formativas Proveer al estudiante de química de los fundamentos conceptuales y prácticos de la química orgánica, para la comprensión de sus principios y sus herramientas a partir de su aplicación en la ciencia y la tecnología. Denominación de capítulos 1. DERIVADOS HALOGENADOS 2. ALCOHOLES 3. FENOLES 6 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 1: DERIVADOS HALOGENADOS Introducción Los derivados halogenados se dividen en halogenuros de alquilo y halogenuros de arilo. Los primeros son alifáticos y los segundos son de carácter aromático; difieren entre sí tanto en su preparación y obtención como en sus propiedades físicas. La mayoría de los halogenuros de arilo son muy inertes en contraste con los halogenuros de alquilo que son muy reactivos. LECCION 1. ESTRUCTURA Y NOMENCLATURA DE LOS HALOGENUROS DE ALQUILO1 1.1 Estructura. Los halogenuros de alquilo son compuestos de fórmula general R–X, en donde R es cualquier grupo alquilo y X es un halógeno tal como Flúor (F), Cloro (Cl), Bromo (Br) o Yodo (I). El grupo funcional halógeno es el que define la estructura y determina las propiedades de esta familia de compuestos. El enlace carbono-halógeno en un halogenuro de alquilo es el resultado de un traslape de un orbital hibrido sp3 del carbono con un orbital del halógeno. Por tanto, los átomos de carbono del halogenuro de alquilo tienen una geometría aproximadamente tetraédrica, con ángulos de enlace H–C–X cercanos a 109°. Como los halógenos son más electronegativos que el carbono, el enlace C–X es polar; el átomo de carbono tiene una carga ligeramente positiva (δ+) y el halógeno una carga ligeramente negativa (δ-). Esta polaridad da como resultado un momento dipolar apreciable lo cual significa que el átomo de carbono en el haluro de alquilo se debe comportar como electrófilo en las reacciones polares. 1.2 Nomenclatura. En la nomenclatura de la IUPAC los halogenuros de alquilo se nombran de acuerdo con las siguientes reglas: Regla 1: se elige la cadena de carbonos más larga que contiene el halógeno. Si hay un doble o triple enlace, la cadena principal los debe contener. Regla 2: la cadena principal se numera a partir del extremo más cercano al grupo halógeno. Si existe un doble o triple enlace, este tiene prioridad sobre el halógeno, 1 Morrison, R. y R. Boyd. Química Orgánica, Fondo Educativo Interamericano, Bogotá, 1976. 7 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS y la cadena se empieza a numerar por el extremo más cercano al doble o triple enlace. Regla 3: se nombra primero el halógeno indicando su posición, luego los demás sustituyentes, seguido del nombre del hidrocarburo que forma la cadena principal. Ejemplos: CH3–CH2–CH2–CH2–Cl 1-clorobutano 2-bromo-2-metilbutano 1-cloro-2-metilpropano Si hay presentes más de un halógeno del mismo tipo, se numera cada uno y se usa el prefijo di-, tri-, tetra- por ejemplo: CH3Cl CH2Cl2 CHCl3 CCl4 clorometano di-clorometano tri-clorometano tetra-clorometano Si hay distintos halógenos, se numeran todos y se citan en orden alfabético al escribir el nombre. Por ejemplo: 8 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 1.3 Nomenclatura común Los halogenuros de alquilo también se pueden nombrar con nombres comunes, indicando el nombre del halógeno seguido del nombre común del radical alquílico. Ejemplos: CH3–Br CH2=CHCl CH2=CH–CH2Br Bromuro de metilo cloruro de vinilo bromuro de alilo Cloruro de ciclohexilo 9 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCIÓN 2: PROPIEDADES FÍSICAS DE LOS HALOGENUROS DE ALQUILO2 Punto de ebullición Los halogenuros de alquilo tienen densidades y puntos de ebullición más altos que los alcanos de igual número de carbonos; esto se debe al mayor peso molecular de los halogenuros. Para un mismo grupo alquilo, la densidad y el punto de ebullición aumentan con el aumento del peso atómico del halógeno. Fórmula Peso molecular CH3F CH3Cl CH3Br CH3I 34 50,5 95 141,90 CH3CH2F CH3CH2Cl CH3CH2Br CH3CH2I 48 64,5 109 155,90 Densidad Punto de ebullición ºC 0,920 1,732 2,279 -78 -24 5 43 0,910 1,430 1,933 -32 12 38 72 Tabla 2.1 Propiedades físicas de los halogenuros de alquilo Solubilidad Son insolubles en agua debido a que sus moléculas no forman puentes de hidrógeno y solubles en solventes orgánicos como benceno, éter y cloroformo. Densidad Los cloruros y los fluoruros son menos densos que el agua, mientras que los bromuros y los yoduros son más densos que el agua. Para un mismo halógeno la densidad disminuye a medida que aumenta el tamaño del grupo alquilo. 2 www.slideshare.net/.../halogenurosdealquilo 10 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS En cuanto a las propiedades químicas se puede señalar que los halogenuros de alquilo intervienen en la obtención de muchos compuestos como alcoholes, éteres, aldehídos, ácidos, aminas e hidrocarburos. Reaccionan con un buen número de Bases de Lewis orgánicas e Inorgánicas, pues tiene dos electrones que nadie comparte, como los iones hidróxido (:OH -); cianuros (:CN-); amoniaco (:NH3) y acetiluros (R–C≡C:) Fuentes Industriales. A escala industrial, los halogenuros de alquilo se preparan generalmente por halogenación directa de hidrocarburos. El cloro-eteno, mas conocido como cloruro de vinilo, se prepara a partir del eteno (etileno): CH2=CH2 + Cl2 Etileno CH2=CHCl + HCl cloruro de vinilo Aplicaciones industriales Los halogenuros de alquilo se emplean como solventes industriales, anestésicos en medicina, propulsores de aerosoles, refrigerantes y plaguicidas. Sin embargo, casi todos son tóxicos por lo que su uso ha sido restringido. Algunos ejemplos de halogenuros importantes son los siguientes: Algunos derivados polihalogenados se conocen con el nombre de Freones, que son empleados como gases refrigerentes o como gases dispersantes en recipientes de aerosoles. Ejemplos: Triclorometano Freón 11; Diclrorofluorometano Freón 12; Octofluorciclobutano Freón C – 318, etc. Otros compuestos orgánicos policlorados son utilizados como insecticidas, entre los más corrientes citamos el DDT, Clordano, Clordeno, heptacloro, gammexano, aldrin, etc. 11 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS El Cloroformo es un líquido empleado como anestésico general, pero es muy tóxico posiblemente cancerígeno, es un buen disolvente. El yodoformo sólido amarillo, se utiliza como antiséptico. El Cloruro de Etilo se emplea como anestésico local, aplicado en forma de aerosol. Tanto el percloroetileno como el tricloroetileno, se emplean en la industria de lavado en seco. 12 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 3: PREPARACION DE HALOGENUROS DE ALQUILO3 3.1 A partir de alcoholes Por lo general, los halogenuros de alquilo se preparan a partir de alcoholes, en donde el grupo –OH del alcohol es sustituido por el halógeno de una molécula de HX. R–OH + HX R–X + H2O Mecanismo de la reacción: Esta reacción ocurre más fácil cuando se realiza con alcoholes terciarios. Los alcoholes primarios y secundaros también reaccionan, pero con velocidades menores y a mayores temperaturas. La conversión de alcoholes primarios y secundarios en halogenuros de alquilo es mejor cuando se utilizan haluros inorgánicos, como el cloruro de tionilo (SOCl2) o el tribromuro de fósforo (PBr3) CH3–CH2–CH2–OH + PBr3 3 CH3–CH2–CH2–Br http://organica1.org/teoria1411/11.ppt 13 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 3.2 Adición de haluros de hidrógeno a alquenos Esta reacción sigue sigue la regla de Markovnikov; el hidrógeno del ácido se une al carbono del doble enlace con mayor número de hidrógenos. El efecto peróxido Cuando la reacción anterior ocurre en presencia de peróxido de hidrógeno, H2O2, el hidrógeno del HX se une al carbono del doble enlace con menor número de hidrógenos, en lo que se constituye como una reacción antiMarkovnikov. CH3–CH═CH2 + HCl CH3–CH2–CH2–Cl Bromación alílica de alquenos. Los alquenos reaccionan con la N-bromosuccinimida (NBS) en presencia de la luz y forman productos resultantes de la sustitución del hidrogeno por bromo, en la posición alílica, que es junto al doble enlace. Por ejemplo, el ciclohexeno da el 3bromociclohexeno con 85% de rendimiento. 14 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 4. REACCIONES DE LOS HALOGENUROS DE ALQUILO 4 El enlace carbono-halógeno en los halogenuros de alquilo es polar; el átomo de carbono unido al halógeno posee carga parcial positiva, es decir, que está en condiciones de aceptar los electrones de una base o de un nucleófilo (del griego afinidad por los núcleos). El grupo halógeno es una base extremadamente débil y puede sustituirse fácilmente por otras base más fuertes. La reacción típica de los halogenuros de alquilo es la sustitución nucleofílica: 4.1 Sustitución nucleofílica Los halogenuros de alquilo reaccionan con un gran número de reactivos nucleofílicos, tanto inorgánicos como orgánicos, para generar una amplia variedad de productos importantes. Los nucleófilos no solo incluyen iones negativos, tales como hidróxido, alcóxido y cianuro, sino también bases como el amoniaco y sustancias neutras como el agua. Formación de alcoholes Los halogenuros de alquilo reaccionan con hidróxido de sodio en medio acuoso o con el agua para formar alcoholes 4 R : X + :OH- R : OH + :X- R : X + H2O R : OH + HX Morrison, R. Química orgánica 15 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: CH3Br + NaOH CH3OH + NaBr Bromuro de metilo metanol C6H5CH2Cl + NaOH C6H5CH2OH + NaCl Cloruro de bencilo alcohol bencílico Formación de éteres (síntesis de Williamson) Los halogenuros de alquilo reaccionan con los alcóxidos de sodio ( Na+ -OR) para formar éteres R:X + - OR’- R – O – R’ + X- Ejemplos: H3C – Br + Na+ : O – CH3 H3C – O – CH3 + NaBr Bromuro de metilo di-metiléter Formación de nitrilos Los halogenuros de alquilo reaccionan con el ion cianuro (CN-) para formar nitrilos (R–C≡N) R : X + : CN- R–C≡N + X- Ejemplos: CH3CH2Br + HCN CH3CH2C≡N + HBr 16 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Bromuro de etilo propanonitrilo CH3CH2CH2Cl + HCN CH3CH2CH2C≡N Cloruro de propilo butanonitrilo Formación de aminas Los halogenuros de alquilo reaccionan con amoniaco para formar aminas primarias, o con otras amnas para formar aminas secundaria y terciarias. R : X + :NH3 R : X + :NH2R’ R–NH2 + HX R : X + :NHR’R’’ amina secundaria R–NH–R’ amina primaria R–NR’R’’ amina terciaria Ejemplos: CH3CH2CH2Cl + :NH3 CH3CH2CH2NH2 Cloruro de propilo CH3Br + CH3NH2 propilamina (CH3)2NH + HBr Dimetilamina CH3Br + (CH3)2NH (CH3)3N + HBr Trimetilamina 4.2 Eliminación5 Los halogenuros de alquilo se convierten en alquenos por deshidrohalogenación: eliminación del átomo de halógeno, junto con un hidrógeno de un carbono adyacente 5 http://organica1.org/qo1/Mo-cap7.htm 17 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Mecanismo de la reacción: El halógeno abandona la molécula como ión halogenuro, por lo que debe llevar consigo una carga negativa. En hidrógeno es extraído por la base como un protón, de modo que el par de electrones libres queda disponible para formar un segundo enlace Facilidad de deshidrohalogenación de los halogenuros de alquilo: 3º > 2º > 1º Ejemplos: CH3CH2CH2Cl + KOH (alc) CH3CH═CH2 + KCl + H2O Cloruro de n-propilo CH3CH2CH2CH2Br + KOH (alc) Bromuro de n-butilo propeno CH3CH2CH═CH2 (único producto) 1-buteno 18 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 4.3 Preparación del reactivo de Grignard Cuando se pone en contacto un halogenuro de alquilo en éter etílico seco, (C2H5)2O, con virutas de magnesio se produce una reacción vigorosa: la solución se torna lechosa, comienza a hervir y el magnesio metalico se disuelve gradualmente. La solución resultante se conoce como reactivo de Grignard, en honor al químico francés Víctor Grignarg, de la universidad de Lyons, quien obtuvo el premio nóbel de química en 1912 por su descubrimiento. Es uno de los reactivos más útiles y versátiles que conoce el químico en síntesis orgánica. R–X + Mg (éter) R–MgX Ejemplos: CH3I + Mg (éter) CH3MgI Yoduro de metilo yoduro de metilmagnesio CH3CH2Br + Mg (éter) CH3CH2MgBr Bromuro de etilo bromuro de etilmagnesio CH3CH2CH2Cl + Mg (éter) Cloruro de n-propilo CH3CH2CH2MgCl cloruro de propilmagnesio 19 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 5. HALOGENUROS DE ARILO6 5.1 Estructura y nomenclatura Los halogenuros de arilo son compuestos que contienen halógeno unido directamente a un anillo aromático. Tienen la fórmula general Ar–X, en donde Ar es fenilo, fenilo sustituido o cualquier grupo arilo. Para nombrarlos se indica el nombre del halógeno seguida de la palabra benceno, si se trata de halogenuros monosustituidos. En caso de halogenuros disustituidos o polisustituidos se utilizan números o los prefijos orto, meta o para. Ejemplos: bromobenceno clorobenceno 2-metil-4nitroclorobenceno 1-bromo-4-clorobenceno (p-bromoclorobenceno) 1,3-dibromobenceno (m-dibromobenceno) 5.2 Propiedades físicas Las propiedades físicas de los halogenuros de arilo son similares a las de los halogenuros de alquilo correspondientes. Así por ejemplo, el clorobenceno y el bromobenceno tienen puntos de ebullición casi iguales a los del cloruro y bromuro de n-hexilo, respectivamente; tal como los halogenuros de alquilo, los de arilo son insolubles en agua y solubles en solventes orgánicos. 5.3 Preparación 6 Morrison, R. Química Orgánica 20 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Los halogenuros de arilo se preparan por halogenación directa del anillo aromático o por reemplazo del nitrógeno de una sal de diazonio. La preparación con sales de diazonio es más importante que la halogenación directa. La obtención de fluoruros y yoduros es posible con sales de diazonio, mientras que por halogenación directa es poco factible. En segundo lugar, la halogenación directa produce una mezcla de isómeros orto y para. Con sales de diazonio ArH + HNO3 ArNO2 ArNH2 (por reducción) ArNH2 + HONO ArN2+ (SAL DE DIAZONIO) ArN2+ + BF4- ArF + N2 ArN2+ + CuCl ArCl + N2 ArN2+ + CuBr ArBr + N2 ArN2+ + I- ArI + N2 Ejemplo: + KI Halogenación ArH + X2 ArX + HX X2 = Cl2, Br2 Ejemplo: 5.4 Reacciones 21 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Los halogenuros de arilo, a diferencia de los halogenuros de alquilo, no dan reacciones de sustitución nucleofílica o lo hacen con extrema dificultad. Sin embargo, los halogenuros de arilo se someten con facilidad a la sustitución nucleofílica si el anillo aromático contiene, además del halógeno ciertos grupos adicionales ubicados adecuadamente: grupos que atraen electrones, tales como – NO2, –NO o –CN, en posiciones orto o para con respecto al halógeno. Sustitución nucleofílica aromática Ar : X + :Z Ar : Z + :X- (Ar debe contener grupos que atraen electrones, en posiciones orto y/o para con respecto a –X) Ejemplo: + NaOH p-nitroclorobenceno p-nitrofenol Formación del reactivo de Grignard Al igual que los halogenuros de alquilo, los halogenuros de arilo reaccionan con magnesio metálico en éter seco para dar los correspondientes reactivos de Grignard. ArBr + Mg (éter seco) ArCl + Mg (éter seco) ArMgBr (bromuro de aril magnesio) ArMgCl (cloruro de aril magnesio) 22 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 2: ALCOHOLES7 Los alcoholes son compuestos de fórmula general R–OH, en donde R es cualquier grupo alquilo. El grupo alquilo puede ser de cadena abierta o cíclico; puede contener un doble enlace, un átomo de halógeno o un anillo aromático, siempre y cuando el anillo aromático no esté directamente unido al grupo OH, caso en el cual los compuestos formados se llaman fenoles. LECCION 6. ESTRUCTURA Y NOMENCLATURA DE LOS ALCOHOLES Los alcoholes se consideran como derivados del agua, en cuya estructura se ha sustituido un H por un grupo –CH3, originándose así un alcohol. El agua es una molécula con un ángulo H-O-H de 104.3 , es decir, es una molécula polar. El hidrógeno posee un volumen mucho menor que el grupo metilo. Al sustituir el H por este grupo, se aumenta el ángulo de enlace H-O-CH3 a 107 , disminuyendo un poco la polaridad de esta molécula con respecto a la del H 2O. La presencia de un átomo de oxígeno más electronegativo que el C y el H polariza la molécula y facilita su reactividad con otras moléculas. Otro aspecto importante de esta estructura es que el oxígeno dispone de un par de electrones libres, constituyéndose así en una base de Lewis (agente nucleofílico). La polaridad de la molécula de los alcoholes y la presencia del par de electrones libres sobre el oxígeno hacen que estos compuestos sean muy reactivos. 6.1 Clasificación de los alcoholes Según el tipo de carbono al cual está unido el grupo hidroxilo en la cadena, los alcoholes se clasifican en primarios, secundarios y terciarios. Un alcohol es primario si el grupo –OH está unido a un carbono primario, por ej. el etanol (CH3-CH2-OH). 7 http://www.quimicaorganica.org/alcoholes.html 23 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: Un alcohol es secundario si el grupo –OH está unido a un carbono secundario, por ej. el 2-propanol (CH3-CHOH-CH3) Un alcohol es terciario cuando el grupo –OH se une a un carbono terciario, por ej. el 2-metil-2-propanol o ter-butanol. (CH3-C-CH3OH-CH3) 6.2 Nomenclatura de los alcoholes El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas: 1. Se elige la cadena más larga que contenga el grupo hidroxilo. Se nombra reemplazando la terminación o del alcano correspondiente por ol. 2. La cadena se numera, empezando por el extremo más cercano al grupo funcional –OH. 3. Los otros grupos unidos a la cadena principal se indican también por medio de números. 24 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: CH3OH CH3CH═CHCH2CH2OH Metanol 3-penten-1-ol C6H5CH2CH2OH 2-feniletanol 3-metil-2-butanol ClCH2CH2OH ciclohexanol 2-cloroetanol Para los alcoholes simples (C1 – C4) se emplean mas a menudo los nombres comunes, para lo cual se emplea la palabra alcohol seguida del nombre del grupo alquílico. Ejemplos: CH3OH Alcohol metílico CH3CH2OH CH3CHOHCH3 alcohol etílico alcohol isopropílico 25 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 7: PROPIEDADES FISICAS DE LOS ALCOHOLES Punto de ebullición El punto de ebullición de los alcoholes es más alto que el de los hidrocarburos y el de los halogenuros de peso molecular similar, debido a que los alcoholes forman puentes de hidrógeno consigo mismo y con las moléculas de agua. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Solubilidad Los alcoholes de bajo peso molecular son muy solubles en agua, esto puede explicarse si se tiene en cuenta que un compuesto que forma puentes de hidrógeno consigo mismo también forma puentes de hidrógeno con el agua. Esto trae como consecuencia una alta solubilidad en agua. A partir del butanol, los alcoholes se van haciendo menos solubles en agua. Esta se debe a que el carácter no polar de la cadena carbonada predomina. La solubilidad en agua de los alcoholes aumenta al aumentar el número de grupos –OH. De esta manera, los dioles y trioles son muy solubles. Densidad La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos. Nombre Punto de fusiónºC Punto de Densidad ebullición ºC (g/mL) Metanol -97,5 64,5 0,793 1-propanol -126 97,8 0,804 2-propanol -86 82,3 0,789 1-butanol -90 117 0,810 2-butanol -114 99,5 0,806 2-metil-1propanol -108 107,3 0,802 26 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 2-metil-2propanol 25,5 82,8 0,789 1-pentanol -78,5 138 0,817 Ciclohexanol 24 161,5 0,962 Tabla 7.1 Propiedades físicas de los alcoholes Puentes de hidrógeno La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2propanol. alcohol-alcohol alcohol-agua 27 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 8: PREPARACION DE ALCOHOLES 8.1 Fuentes industriales Hay dos fuentes principales para obtener alcoholes simples: la hidratación de alquenos, obtenidos del craking del petróleo, y la fermentación de carbohidratos. Hidratación de alquenos. Los alquenos pueden convertirse fácilmente en alcoholes por adición directa de agua o por adición de ácido sulfúrico, seguida de una hidrólisis. Con este proceso, solamente se pueden obtener aquellos alcoholes cuya formación es concordante con la regla de Markovnikov. Petróleo cracking RCH═CH2 RCH(OH)CH3 hidratación Adición de Markovnikov Ejemplo: Petróleo cracking CH2═CH2 + H2O Etileno CH3CH2OH alcohol etílico Fermentación de carbohidratos. La fermentación de azúcares con levadura, el proceso químico sintético más antiguo empleado por el hombre, sigue siendo de gran importancia para la preparación de alcohol etílico. Los azúcares provienen principalmente de las melazas de la caña de azúcar o del almidón que se obtiene de varios granos o tubérculos, como la cebada, el maíz, la yuca etc. La siguiente es la reacción que expresa la fermentación la glucosa, la cual proviene de la sacarosa o azúcar de caña. Azúcares C6H12O6 fermentación Glucosa 2CH3CH2OH + 2CO2 alcohol etílico 8.2 Hidrólisis de halogenuros de alquilo R–X + H2O R–OH + HX Ejemplos: CH3CH2Br + H2O Bromuro de etilo CH3CH2OH + HBr alcohol etílico 28 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS + H2O Cloruro de bencilo Alcohol bencílco 8.3 Síntesis de Grignard8 Los compuestos carbonílicos (aldehídos y cetonas) reaccionan con el reactivo de Grignard para dar alcoholes mediante el siguiente mecanismo: Alcohol primario Alcohol secundario Alcohol terciario 8 http://organica1.org/qo1/ok/alcohol/alco114.htm 29 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: H–CHO + CH3 MgBr CH3–CH2OH etanol CH3CHO + CH3 MgBr CH3CH(OH)CH3 sec-propanol CH3COCH3 + CH3 MgBr (CH3)3C(OH) ter-butanol 30 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 9: REACCIONES DE LOS ALCOHOLES 9 Los alcoholes pueden experimentar reacciones de deshidratación para formar alquenos, oxidaciones para dar cetonas y aldehídos, sustituciones para crear haluros de alquilo, y reacciones de reducción para producir alcanos. Las reacciones de los alcoholes pueden implicar la ruptura del enlace C–OH, con remoción del grupo –OH; o bien la ruptura del enlace O–H, con la eliminación del átomo de hidrógeno. Los dos tipos de reacción pueden ser de sustitución, en la que otro grupo reemplaza el –OH o el –H, o bien de eliminación, en la que se forma un doble enlace. 9.1 Reacción con halogenuros de hidrógeno Los alcoholes reaccionan con los haluros de hidrógeno para formar halogenuros de alquilo mediante una reacción de sustitución: R–OH + H–X R–X + H2O Reactividad de HX: HI > HBr > HCl Reactividad de ROH: alílico > bencílico > 3º > 2º > 1º Mecanismo de la reacción: Ejemplo: + HBr Alcohol ter-butílico 9 Bromuro de terbutilo www.organica1.org/teoria1411/11.ppt 31 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 9.2 Deshidratación Los alcoholes en medio ácido pueden perder una molécula de agua y producir un alqueno, mediante una reacción de eliminación: Reactividad de ROH: 3º > 2º > 1º Ejemplos: CH3CH2CH(OH)CH3 + H2SO4 2-butanol CH3CH═CHCH3 (producto principal) 2-buteno CH3CH2CH2OH + H2SO4 CH3CH═CH2 n- propanol propeno 9.3 Formación de alcóxidos Los alcoholes reaccionan con el sodio metálico para formar alcóxidos de sodio; estos compuestos son importantes en la síntesis de Williamson, para la preparación de éteres. RO–H + M RO- — M+ + 1/2H2 M = Na, K, Mg, Al Reactividad de ROH: CH3OH > 1º > 2º > 3º Ejemplo: CH3CH2OH + Na Etanol CH3CH2Na + 1/2H2 etóxido de sodio 32 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 9.4 Oxidación En química orgánica el aumento del número de enlaces con el oxígeno se considera una oxidación. Los alcanos se pueden oxidar a alcoholes (1 enlace con el oxígeno) y éstos a su vez se pueden oxidar a aldehídos o cetonas (2 enlaces con el oxígeno). Los aldehídos se pueden oxidar con posterioridad al ácido carboxílico (3 enlaces con el oxígeno). Los alcoholes terciarios no se pueden oxidar. Oxidación de alcohol primario a aldehído La oxidación de alcoholes primarios a aldehídos se puede conseguir utilizando clorocromato de piridinio (PCC) como agentes oxidante. El PCC es una mezcla de óxido de cromo (VI), piridina y HCl. Ejemplo: CH3CH2CH2OH + CrO3 + piridina + HCL Propanol CH3CH2CHO propanaldehído 33 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Oxidación de alcoholes primarios a ácidos carboxílicos: Los alcoholes primarios se pueden oxidar al aldehído o al ácido carboxílico utilizando oxidantes fuertes como el dicromato de potasio (K 2Cr2O7) o el permanganato de potasio KMnO4. R–CH2OH + KMnO4 R–COOH Ejemplo: CH3CH2OH + KMnO4 Alcohol etílico CH3COOH ácido acético Oxidación de alcoholes secundarios a cetonas: Por medio del ácido crómico, obtenido a partir del dicromato de sodio en ácido sulfúrico, los alcoholes secundarios se oxidan a cetonas: 9.5 Formación de ésteres Ejemplo: CH3CH2OH + CH3COOH Alcohol etílico ácido acético CH3COOCH2CH3 acetato de etilo 34 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 10: GLICOLES Y ESTEROIDES10 10.1 Glicoles Los glicoles o dioles son alcoholes con dos grupos hidroxilo. Se forman por la adición de dos grupos hidroxilo al doble enlace de los alquenos: KMnO4, -OH alqueno alcoxilación glicol Los glicoles se nombran agregando la palabra glicol al nombre del alqueno del cual deriva, como por ejemplo: 3CH2═CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2MnO2 + KOH Etileno CH3CH2═CH2 etilén glicol Propileno CH3CH(OH)CH2(OH) propilén glicol Los glicoles son líquidos de elevado punto de ebullición, solubles en agua, inodoros e incoloros. Se usan ampliamente en la industria farmacéutica por su capacidad para disolver otros productos orgánicos, como aromas y colorantes. 10.2 Esteroides Los esteroides se derivan del ciclopentanoperhidrofenantreno o esterano cuya fórmula es: Esterano 10 Morrison, R. Química Orgánica 35 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Las sustancias derivadas de este núcleo, los esteroles, son alcoholes. Poseen grupos metilo (–CH3) en las posiciones 10 y 13, así como un hidroxilo o carbonilo en el carbono 3; generalmente existe también una cadena hidrocarbonada lateral en el carbono 17; la longitud de dicha cadena y la presencia de metilos, hidroxilos o carbonilos determina las diferentes estructuras de estas sustancias. El colesterol, notorio como la sustancia que se deposita en las paredes de las arterias y como el constituyente principal de los cálculos biliares, es un alcohol del tipo conocido como un esterol. Colesterol La hormona sexual femenina, progesterona, y la hormona sexual masculina, testosterona, también son esteroles Testosterona Progesterona 36 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 3. FENOLES Los fenoles son compuestos que presentan uno o varios OH- unidos a un anillo bencénico. Son compuestos típicamente aromáticos. Las diferencias estructurales entre fenoles y alcoholes se deben a que el OH, en los fenoles, está unido a un carbono con hibridación sp2, mientras que en un alcohol, el OH está ligado a un carbono con hibridación sp3. Este hecho provoca diferencias en los hidrógenos unidos al oxígeno; el fenol cede el hidrógeno con más facilidad que el alcohol, y por consiguiente, los fenoles son más ácidos (Ka aprox 10-10), que los alcoholes (Ka aprox 10-16/10-18). De otra parte, el grupo –OH de los fenoles está más fuertemente ligado al anillo bencénico que el –OH al carbono de los alcoholes. Estas diferencias hacen que a las dos clases de compuestos se les agrupe en familias diferentes. LECCION 11: ESTRUCTURA Y NOMENCLATURA DE LOS FENOLES11 Los fenoles son compuestos de fórmula general Ar–OH en donde Ar– es fenilo, fenilo sustituido o cualquier grupo arilo. Los fenoles difieren de los alcoholes por tener el grupo –OH directamente unido a un anillo aromático, siendo el fenol el más sencillo de la familia. Fenol Nomenclatura Los fenoles se nombran como derivados del miembro más sencillo de la familia, el fenol. Los metilfenoles reciben el nombre especial de cresoles. Ocasionalmente se denominan los fenoles como hidroxi-compuestos. 11 Morrison, R. Química Orgánica. 37 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 38 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 12: PROPIEDADES FÍSICAS DE LOS FENOLES Los fenoles más sencillos son líquidos o sólidos de bajo punto de fusión; tienen puntos de ebullición bastante elevados, debido a que forman puentes de hidrógeno. El fenol tiene una solubilidad en agua de 9 g por 100 g de agua y la mayoría de los otros fenoles son insolubles en agua. NOMBRE Punto Punto de Solubilidad de ebullición (g/100 g fusión (ºC) H2O) (ºC) Fenol 41 182 9,3 o-cresol (o-metilfenol) 31 191 2,5 m-cresol (m-metilfenol) 11 201 2,6 p-cresol (p-metilfenol) 35 202 2,3 Catecol (o-dihidroxibenceno) 104 246 45 Resorcinol (m-dihidroxibenceno) 110 281 123 Hidroquinona (p-dihidroxibenceno) 173 286 8 o-nitrofenol 45 217 0,2 m-nitrofenol 96 1,4 p-nitrofenol 114 1,7 Tabla 11.1 propiedades físicas de los fenoles 39 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 13: PREPARACION DE FENOLES 13.1 Fuentes industriales La mayoría de los fenoles se prepara industrialmente por los mismos métodos que se emplean en el laboratorio. Sin embargo hay procesos especiales para obtener algunos de estos compuestos a escala comercial, incluyendo al más importante de ellos, el fenol. Por la cantidad en que se produce, el fenol ocupa uno de los lugares más altos en la lista de compuestos aromáticos sintéticos; se utiliza principalmente en la manufactura de polímeros fenol-formaldehído. El proceso Dow para la obtención de fenol en el que se hace reaccionar clorobenceno con hidróxido de sodio acuoso a una temperatura de 360 grados centígrados es el siguiente: C6H5Cl + NaOH C6H5ONa + HCl C6H5OH Clorobenceno fenóxido de sodio fenol Un proceso más moderno para la obtención del fenol utiliza el cumeno (isopropilbenceno), el cual se convierte en hidroperóxido de cumeno por oxidación; este se transforma en fenol y acetona con acido en solución acuosa. Junto con la gran cantidad de fenol producida anualmente, también se obtiene acetona, siendo este proceso una de las principales fuentes de este compuesto. 13.2 Sulfonación del benceno Por sulfonación del benceno, con H2SO4 concentrado y a altas temperaturas: 40 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 13.3 Hidrólisis de sales de Diazonio 13.4 Obtención de derivados del Fenol Reacción de Friedel – Crafts: (a) alquilación y (b) acilación 41 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 14: REACCIONES DE LOS FENOLES 14.1 Formación de sales Los fenoles se comportan como sustancias ácidas y reaccionan con las bases como el hidróxido de sodio, para formar sales (fenóxidos) y agua. ArOH + NaOH ArO-Na+ + H2O Ejemplo: C6H5OH + NaOH C6H5ONa + H2O Fenol fenóxido de sodio 14.2 Formación de ésteres Los fenoles reaccionan con los cloruros de ácido para formar ésteres: ArOH + RCOCl RCOOAr Ejemplo: 14.3 Formación de éteres (síntesis de Williamson) Las sales de los fenoles (fenóxidos) reaccionan con los halogenuros de alquilo para producir los aril-alquil-éteres: ArO- + R–X Ar–O–R + X42 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplo: 14.4 Sustitución en el anillo aromático El enlace Ar–OH es muy fuerte y es muy difícil sustituir el grupo OH por otros grupos funcionales. Sin embargo, en los fenoles, el grupo OH activa poderosamente el anillo bencénico y dirige otros grupos a las posiciones orto-para en las reacciones de sustitución. Halogenación. 43 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Nitración C6H5OH + HNO2 o-nitrofenol + p-nitrofenol Sulfonación C6H5OH + H2SO4 ácido o-fenolsulfónico + ácido p-fenolsulfónico Alquilación Oxidación: Obtención de quinonas 44 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 15: ACIDEZ DE LOS FENOLES La acidez de los compuestos es la tendencia a ceder protones, H +. Esta tendencia se expresa cuantitativamente mediante la ecuación de la constante de equilibrio, que para el caso de los ácidos se puede expresar en la siguiente forma: HA + H2O H3O+ + A- Ka = [H3O+] [A-] / [HA] Si Ka es grande, la acidez es grande y por el contrario, si Ka es pequeña, es porque la sustancia es poco ácida. Valores de Ka Ácidos minerales Ka 1 Ácidos carboxílicos Ka Fenoles Ka 10-10 Agua Ka 10-14 Alcoholes Ka 10-16 a 10-18 10-3 a 10-5 Las constantes indican que los ácidos minerales son fuertes y tienden a ceder más fácilmente los protones. Los ácidos carboxílicos, de menor fortaleza se consideran como ácidos débiles; luego siguen los fenoles y por último los alcoholes. A causa de esta acidez, los fenoles y los alcoholes reaccionan con las bases fuertes y forman sales. Los fenoles producen fenóxidos y los alcoholes originan alcóxidos. Estas sustancias, son intermediarias para la obtención de éteres mediante la síntesis de Williamson. ArOH + NaOH Fenol ROH + NaOH Alcohol ArO-Na+ + H2O fenóxido RO-Na + H2O alcóxido 45 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS UNIDAD 2 Nombre de la Unidad ETERES, ALDEHIDOS Y CETONAS Introducción La segunda unidad comprende el estudio de otros tres grupos funcionales de la química orgánica; los éteres y los compuestos carbonílicos, los aldehídos y las cetonas. En las tres familias de compuestos se estudian sus propiedades físicas y químicas, preparación y reacciones con sus respectivos mecanismos. Justificación El estudio de la química orgánica no solo incorpora nuevos conocimientos, sino también el desarrollo de competencias que tienen que ver con el desempeño profesional del químico, tales como analizar problemáticas, compartir perspectivas teóricas y debatir enfoques, categorías, métodos y procedimientos para elaborar nuevos productos, o desarrollar investigación técnica y científica; razones que constituyen los criterios para la resolución de problemas dentro del campo especifico del saber donde se espera que se desempeñe el profesional egresado en Química de la UNAD. Intencionalidades Formativas Proveer al estudiante de química de los fundamentos conceptuales y prácticos de la química orgánica, para la comprensión de sus principios y sus herramientas a partir de su aplicación en la ciencia y la tecnología. Denominación de capítulos 4. ETERES 5. ALDEHIDOS 6. CETONAS 46 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 4. ETERES LECCION 16: ESTRUCTURA Y NOMENCLATURA DE LOS ETERES12 Los éteres son compuestos de fórmula general R – O – R, Ar – O – R o Ar – O –Ar Ejemplos: Eteres de fórmula general R – O – R (éteres alifáticos) CH3 – O – CH3 CH3 – O – CH2CH3 dimetil-éter etil-metil-éter (los dos radicales alquilo son idénticos) (los dos radicales alquilo son diferentes) (éteres simétricos) (éteres asimétricos) Eteres de fórmula general Ar – O – R (éteres aromáticos asimétricos) OCH3 Anisol fenil-metil-éter 12 http://www.quimicaorganica.org/eteres-teoria/index.php 47 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Eteres de fórmula general Ar – O –Ar (éteres aromáticos simétricos) Difenil-éter Los éteres son moléculas de estructura similar al agua y a los alcoholes. El ángulo entre los enlaces C-O-C es mayor que en el agua debido a las repulsiones estéricas entre grupos voluminosos. 16.2 Nomenclatura13 La nomenclatura IUPAC de los éteres consiste en nombrar alfabéticamente los dos grupos alquilo o arilo que están unidos al oxígeno, terminando el nombre en éter. Veamos algunos ejemplos: 13 www.quimicaorganica.org/...nomenclatura-eteres/reglas-iupac 48 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). La cadena mas pequeña se nombra como un sustituyente alcoxi (metoxi, etoxi etc.) seguida del nombre de la cadena principal, la de mayor longitud, la cual se nombra como un alcano. Ejemplos: 49 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejercicios de nomenclatura Escriba el nombre de las siguientes estructuras: 50 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 17: PROPIEDADES FÍSICAS DE LOS ETERES14 Los puntos de ebullición de los éteres son similares a los de los alcanos de pesos moleculares comparables y mucho más bajos que los de los alcoholes isómeros. Comparemos, por ejemplo, los puntos de ebullición del n-heptano (98ºC), el metil n-pentil éter (100ºC) y el alcohol hexílico (157ºC). el mayor punto de ebullición del alcohol se debe a los puentes de hidrógeno que mantienen firmemente unidas las moléculas de los alcoholes. Tabla No. 17.1 propiedades físicas de los éteres Por otra parte, los éteres presentan una solubilidad en agua comparable a la de los alcoholes: tanto el dietil éter como el alcohol n-butílico, por ejemplo, tienen una solubilidad de unos 8 g por 100 g de agua. La solubilidad de los alcoholes inferiores se debe a los puentes de hidrógeno entre moléculas de agua y de alcohol; es probable que la solubilidad de los éteres en agua se debe a la misma causa. La importante solubilidad en agua se explica por los puentes de hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del éter. 14 http://132.248.103.112/organica/qo1/ok/eteres/eter2.htm 51 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 18: PREPARACION DE ETERES15 18.1 fuentes industriales Deshidratación de alcoholes. Varios éteres simétricos con grupos alquilo menores se preparan a gran escala, principalmente para uso como disolventes. El más importante de éstos es el dietil éter, el disolvente empleado comúnmente en la extracción y preparación de los reactivos de Grignard; otros son el diisopropil éter y el di-n-butil éter. Estos éteres se preparan por reacción de los alcoholes correspondientes con ácido sulfúrico. Al perderse una molécula de agua por cada par de moléculas de alcohol, esta reacción es una especie de deshidratación. La deshidratación para dar éteres en vez de alquenos se controla por la elección de las condiciones de reacción. Por ejemplo, se prepara etileno por calentamiento de alcohol etílico con ácido sulfúrico concentrado a 180ºC; el dietil éter, en cambio, se prepara por calentamiento del mismo alcohol a 140ºC, agregando continuamente etanol para mantener el exceso. La deshidratación se suele limitar a la preparación de éteres simétricos, ya que una combinación de dos alcoholes da normalmente una mezcla de tres éteres. La formación de éteres por deshidratación es un ejemplo de sustitución nucleofílica que tiene como sustrato al alcohol protonado, y como nucleófilo, una segunda molécula de alcohol. La mayoría de los éteres alifáticos se convierten lentamente en peróxidos al contacto con el aire. Aunque están presentes en concentraciones bajas, estos peróxidos son muy peligrosos, puesto que son inestables y pueden producir explosiones violentas durante las destilaciones que normalmente siguen a las extracciones con éter. 15 http://132.248.103.112/organica/qo1/ok/eteres/eter3.htm 52 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS La presencia de peróxidos se detecta por la formación de una coloración roja cuando se agita el éter con una solución acuosa de sulfato ferrosoamoniaco y tiocianato de potasio; el peróxido oxida el ion ferroso a férrico, que reacciona con el ión tiocianato para dar el color rojo sangre característico del ion complejo. Hay varias formas de eliminar los peróxidos de los éteres, incluyendo un lavado con soluciones de ión ferroso (que reduce iso peróxidos) o la destilación con ácido sulfúrico concentrado que los oxida) Para emplearlo en la preparación de reactivos de Grignard, el éter (generalmente el dietílico) debe estar libre de agua y alcohol. El llamado éter absoluto se puede preparar por destilación del éter ordinario con H2SO4 concentrado (para eliminar agua, alcohol y los peróxidos). Comercialmente existe éter anhidro de tan buena calidad que sólo necesita tratamiento con sodio para adecuarse a la reacción de Grignard. El uso de dietil éter es muy peligroso, aun cuando esté libre de peróxidos: es muy volátil e inflamable, por lo que se debe tener precauciones especiales en su manipulación. 18.2 Síntesis de Williamson16 En el laboratorio, la síntesis de Williamson para éteres es importante por su versatilidad: puede emplearse tanto para obtener éteres simétricos como asimétricos. En la síntesis de Williamson se hace reaccionar un halogenuro de alquilo (halgenuro de alquilio sustituido) con un alcóxido o un fenóxido de sodio: 16 http://132.248.103.112/organica/qo1/ok/eteres/eter7.htm 53 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Para la preparación de aril metil éteres se suele utilizar sulfato de metilo, (CH3)2SO4, en lugar de halogenuros de alquilo, que son más costosos. La síntesis de Wlliamson implica la sustitución nucleofílca de un ion alcóxido o fenóxido por un ion halogenuro, y es estrictamente análoga a la preparación de alcoholes por tratamiento de halogenuros de alquilo con hidróxido acuoso. En general no pueden utilizarse los halogenuros de arilo, debido a su poca reactividad hacia la sustitución nucleofílica. Los alcóxidos de sodio se obtienen por acción directa del sodio metálico sobre alcoholes secos: Por otra parte, debido a la apreciable acidez de los fenoles, los fenóxidos de sodio se preparan por la acción del hidróxido de sodio acuoso sobre fenoles: 54 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Si se desea obtener un éter dialquílico asimétrico, podemos elegir entre dos combinaciones de reactivos; una de ellas es casi siempre superior a la otra. En la preparación del t-butil-etil-éter, por ejemplo, son lógicas las combinaciones siguientes: ¿Cuál elegimos? Como siempre, consideremos el peligro de una competencia de la eliminación con la sustitución deseada; en este caso, la eliminación debe ser particularmente seria, debido a la fuerte basicidad del alcóxido. Por consiguiente, descartaremos el uso de un halogenuro terciario, que debe dar principalmente o en su totalidad el producto de la eliminación; debemos emplear la otra combinación. La desventaja de la reacción lenta entre el sodio y el alcohol t-butílico. En la preparación del alcóxido queda compensada por la tendencia del halogenuro primario a experimentar sustitución, en vez de eliminación. Al programar una síntesis de Williamson para un dialquil éter, debemos recordar siempre que la tendencia de los halogenuros de alquilo a la deshidrohalogenación es 3º > 2º > 1º. Para la preparación de un alquil aril éter hay también dos combinaciones a tener en cuenta, pero en general una puede rechazarse de inmediato. Por 55 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS ejemplos, el fenil n-propil éter únicamente puede prepararse a partir del halogenuro de alquilo y el fenóxido puesto que el halogenuro de arilo es muy poco reactivo con los alcóxidos. Puesto que los alcóxidos y fenóxidos se preparan con los alcoholes y fenoles correspondientes, y los halogenuros de alquilo con alcoholes, la síntesis de Williamson implica la obtención de un éter mediante dos alcoholes. 18.3 Deshidratación de alcoholes La deshidratación se suele limitar a la preparación de éteres simétricos. Dos moléculas de alcohol en medio ácido pueden reaccionar para dar un éter, perdiendose una molécula de agua. 56 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS La reacción suele transcurrir por un mecanismo unimolecular, a través del carbocatión, con todos los problemas que ello conlleva de transposiciones y/o eliminación en competencia. La temperatura es un factor muy importante: Generalmente se hace usando ácido sulfúrico concentrado como deshidratador, en caliente. El vapor obtenido se lava con solución de NaOH o de KOH para eliminar los vapores ácidos y luego se pasa por un tubo secador con CaCl 2 anhidro para secar el producto, y se recoge usando un refrigerante con mezcla frigorífica de hielo y sal, ya que el éter ebulle a 36 grados. 18.4 Alcoximercuración-desmercuración Los alquenos reaccionan con el trifluoroacetato mercúrico en presencia de un alcohol para dar compuestos alcoximercúricos, que se transforman en éteres por reducción. 57 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Apreciaremos que este proceso de dos etapas es el análogo exacto de la síntesis de alcoholes por oximercuración. En lugar de agua, emplearemos un alcohol, que, no casualmente, puede desempeñar el mismo papel. En vez de ntroducir el grupo hidroxilo para lograr un alcohol, introducimos el grupo alcóxido para obtener un éter. Este ejemplo de alcoximercuración-desmercuración se reduce a la adición, según Markovnikov, de un alcohol a un doble enlace carbono-carbono. La alcoximercuración-desmercuración tiene todas las ventajas que apreciaremos para su contrapartida: rapidez, comodidad, alto rendimiento y ausencia virtual de transposiciones. En comparación con la síntesis de Williamson, ofrece una gran ventaja: no hay una reacción de eliminación que compita, por lo cual puede utilzarse para la síntesis de casi todo tipo de éter alquílico, excepto los di-t-alquil éteres, por razones estéricas, evidentemente. Por ejemplo: Aquí se observa el empleo del trifluoroacetato de mercurio, en vez del acetato utilizado en la preparación de alcoholes. Con un alcohol voluminoso secundario o terciario como disolvente, se necesita el trifluoroacetato, para asegurar un buen rendimiento en éter. Ejercicios Escriba la ecuación química para cada una de las siguientes reacciones: (a) t-butóxido de potasio + yoduro de etilo (b) fenóxido de sodio + bromuro de metilo (c) bromuro de bencilo + fenóxido de sodio (d) alcohol etílico + H2SO4 (130ºC) 58 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 19: REACCIONES DE LOS ETERES 19.1 Con hidrácidos (HCl Y HBr) Los éteres reaccionan con HCl y HBr para dar los correspondientes cloruros o brumoros de alquilo. En el caso de que uno de los grupos del éter sea el fenilo (alquil-fenil éter) se obtiene haluro de alquilo y fenol, pero el fenol no reacciona para dar haluro. La escisión procede sólo en condiciones bastante enérgicas: se necesitan ácidos concentrados (por lo general HI o HBr) y temperaturas elevadas. Inicialmente, un alquil éter da un halogenuro de alquilo y un alcohol, el cual puede seguir reaccionando para formar un segundo halogenuro de alquilo. Debido a la baja reactividad del enlace entre el oxígeno y el anillo aromático, un alquil aril éter sufre ruptura del enlace alquilo-oxígeno y produce un fenol y un halogenuro de alquilo. Por ejemplo: 59 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 19.2 Reacciones de autooxidación En presencia del oxígeno del aíre los éteres se oxidan lentamente para dar hidroperóxidos y peróxidos de alquilo. Ejercicios etil metil éter + HI exceso (caliente) C6H5OC2H5 + HBr concentardo, caliente 60 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 20: ETERES CICLICOS Los éteres cíclicos se forman sustituyendo un -CH2- por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefio oxa- seguido del nombre del ciclo. Ejemplos: Los éteres cíclicos se comportan como los éteres acíclicos. La química del grupo funcional éter es la misma, si dicho grupo está en una cadena abierta o si se encuentra en un anillo. Por ejemplo, los éteres cíclicos comunes como el tetrahidrofurano y el dioxano a menudo se usan como disolventes debido a que son inertes, aunque pueden romperse con ácidos fuertes. El único grupo de éteres cíclicos que se comportan de manera diferente de como lo hacen los éteres de cadena abierta es el formado por los anillos de tres miembros que contienen oxígeno, llamados epóxidos u oxiranos. La tensión en el anillo de éter de tres miembros ocasiona que los epóxidos sean reactivos y les confiere una reactividad química única. 61 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS EPOXIDOS Los epóxidos son éteres cíclicos de tres miembros formados principalmente por la oxidación con peroxiácidos de los alquenos correspondientes. El nombre común del epóxido se forma añadiendo óxido al nombre del alqueno que se ha oxidado. Ejemplo: 20.1 Preparación de epóxidos17 A partir de halohidrinas La conversión de halohidrinas en epóxidos por la acción de una base es una adaptación de la síntesis de Williamson. Se obtiene un compuesto cíclico porque el alcohol y el halogenuro casualmente forman parte de la misma molécula. En presencia del hidróxido existe una pequeña proporción del alcohol como alcóxido, que desplaza al ion halogenuro de otra parte de la misma molécula para generar el éter cíclico. 17 http://132.248.103.112/organica/qo1/ok/eteres/eter11.htm 62 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Puesto que las halohidrinas casi siempre se preparan a partir de alquenos por adición de halógeno y agua al doble enlace-carbono, este método implica la conversión de un alqueno en un epóxido. Peroxidación de dobles enlaces carbono-carbono. Como alternativa, puede oxidarse el doble enlace directamente a epóxido mediante e ácido peroxibenzoico: Al abandonar el compuesto no saturado no alqueno simple en clorofórmica, reaccionan y el epóxido. peroxiácido y el necesariamente un solución etérea o para dar ácido benzoico Ejemplos: 63 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 20.2 Reacciones de epóxidos Los epóxidos deben su importancia a su elevada reactividad, debida a la facilidad de apertura de su anillo de tres átomos, que está sometido a una gran tensión. Los ángulos de enlace del anillo, que tienen un promedio de 60ºC, son considerablemente menores que el ángulo tetraédrico normal del carbono, de 109.5º, o del correspondiente al oxígeno divalente en éteres de cadena abierta, de 110º Como los átomos no pueden ubicarse para permitir un solapamiento máximo de orbitales, los enlaces resultan más débiles que en un éter ordinario y la molécula es menos estable. Los epóxidos sufren reacciones catalizadas por ácidos con mucha facilidad a diferencia de los éteres corrientes y pueden ser degradados incluso por bases. Algunas de sus reacciones más importantes se enumeran a continuación. Apertura catalizada por ácidos. En presencia de un catalizador ácido los epóxidos son hidrolizados para formar glicoles. Apertura catalizada por bases. A diferencia de los éteres normales, los epóxidos pueden escindirse en condiciones alcalinas. En este caso es el propio epóxido, no el protonado, el que sufre el ataque nucleofílico: 64 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS La menor reactividad del epóxido no protonado es compensada por el reactivo más básico y fuertemente nucleófilo, compatible con la solución alcalina: alcóxidos, fenóxidos, amoniaco, etcétera. Veamos, a modo de ejemplo, la reaccón del óxido de etileno con fenol. Un ácido cataliza la reacción del óxido de etileno con fenol. Un ácido cataliza la reacción, convirtiendo al fenol en ión fenóxido, más fuertemente nucleófilo. 65 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 5. ALDEHIDOS LECCION 21: ESTRUCTURA DE LOS ALDEHIDOS18 Los aldehídos constituyen una clase de sustancias orgánicas que presentan el grupo funcional carbonilo dentro de la estructura de la molécula, acoplado a por lo menos un átomo de hidrógeno. Pueden ser alifáticos o aromáticos dependiendo de si el grupo funcional se acopla a un radical alquilo (R) o arilo (Ar) respectivamente, por el otro enlace disponible. Aldehido aromatico Aldehido alifático El primer miembro de la clase de los aldehídos alifáticos es el metanal o formaldehído (CH2O), y es el único que posee dos átomos de hidrógeno acoplados al grupo carbonilo. Esta diferencia estructural hace que tenga ciertas características que lo distinguen del resto de la clase. El segundo miembro se llama etanal o acetaldehído (CH3CHO) de estructura. En los aldehídos aromáticos el primer miembro es el benzaldehído, con un anillo bencénico acoplado al grupo carbonilo. 18 http://www.org/quimica/aldehidos.html 66 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 22: NOMENCLATURA DE LOS ALDEHIDOS Los nombres IUPAC de los aldehídos siguen la regla general: la cadena más larga que contiene el grupo – CHO se considera la estructura matriz y se nombra reemplazando la terminación ano del alcano correspondiente por al. La posición de un sustituyente se indica por un número, siendo considerado siempre el carbono carbonílico como C – 1. Nomenclatura de los primeros diez aldehídos: Número de carbonos Nomenclatura IUPAC Nombre común Fórmula 1 Metanal Formaldehído HCHO 2 Etanal Acetaldehído CH3CHO 3 Propanal Propionaldehído Propilaldehído C2H5CHO 4 Butanal n-Butiraldehído C3H7CHO 5 Pentanal n-Valeraldehído Amilaldehído n-Pentaldehído C4H9CHO 6 Hexanal Capronaldehído n-Hexaldehído C5H11CHO 7 Heptanal Enantaldehído Heptilaldehído n-Heptaldehído C6H13CHO 8 Octanal Caprilaldehído n-Octilaldehído C7H15CHO 9 Nonanal 10 Decanal Pelargonaldehído C8H17CHO n-Nonilaldehído Caprinaldehído n-Decilaldehído C9H19CHO Tabla 22.1 nomenclatura de los primeros diez aldehídos Fórmula general: CnH2n+1CHO (n = 0, 1, 2, 3, 4, ...) 67 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos de algunos aldehídos: 3-butenal Butanodial 3-hexinodial 68 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS El grupo -CHO unido a un ciclo se llama -carbaldehído. La numeración del ciclo se realiza dando localizador 1 al carbono del ciclo que contiene el grupo aldehído. Ciclohexanocarbaldehído 3-bromo-ciclopentanocarbaldehído Ejercicios Escriba el nombre de los siguientes aldehídos: 69 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 70 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 23: PROPIEDADES FÍSICAS DE LOS ALDEHIDOS Los primeros aldehídos de la serie presentan un olor picante y penetrante, fácilmente distinguible por el olfato. El punto de ebullición de los aldehídos es en general, mas alto que el de los hidrocarburos de peso molecular comparable; mientras que sucede lo contrario para el caso de los alcoholes, así, el acetaldehído con un peso molecular 44 tiene un punto de ebullición de 21°C, mientras que el etanol de peso 46 ebulle a 78°C. La presencia del grupo carbonilo convierte a los aldehídos y cetonas en compuestos polares. Los compuestos de hasta cuatro átomos de carbono, forman puentes de hidrógeno con el agua, lo cual los hace completamente solubles en agua. Igualmente son solubles en solventes orgánicos. Las moléculas de alto peso molecular son poco o no solubles en agua, tienen olores y sabores característicos. Los miembros entre 8 y 14 átomos de carbono se usan fundamentalmente en perfumería. Punto de Ebullición: los puntos de ebullición de los aldehídos y cetonas son mayores que el de los alcanos del mismo peso molecular, pero menores que el de los alcoholes y ácidos carboxílicos comparables. Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intramoleculares en éstos compuestos. (Constantes físicas de algunos aldehidos) Pto. de fusión(ºC) Pto. de ebullición(ºC) Solubilidad (g/100 g de H2O) Metanal -92 -21 Muy soluble Etanal -122 20 Completamente soluble Propanal -81 49 16 Butanal -99 76 7 Pentanal -91 103 - Hexanal -56 129 0.1 Heptanal -45 155 0.02 Benzaldehído -26 178 0,3 Nombre Tabla 23.1. Propiedades físicas de aldehídos 71 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Fuentes industriales Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa, es un polihidroxialdehído. La vainillina, saborizante principal de la vainilla es otro ejemplo de aldehído natural. Probablemente desde el punto de vista industrial el mas importante de los aldehídos sea el formaldehído, un gas de olor picante y medianamente tóxico, que se usa en grandes cantidades para la producción de plásticos termoestables como la bakelita. La solución acuosa de formaldehído se conoce como formol o formalina y se usa ampliamente como desinfectante, en la industria textil y como preservador de tejidos humanos para retardar su descomposición. En la producción de formaldehído a partir del metanol, la materia prima es el gas de síntesis que se obtiene del metano. CH4 + H2O CO + 3 H2 3 CH4 + CO2 + 2 H2 2 H2 + CO CH3OH CH3OH + ½ O2 CH3OH 4 CO + 8 H2 HCHO + H2O HCHO + H2 72 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 24: PREPARACIÓN DE ALDEHÍDOS19 24.1 Oxidación de alcoholes primarios Los agentes oxidantes en medio ácido H2SO4, comúnmente usados son dicromato de potasio K2Cr2O7, permanganato de potasio KMnO4, ácido nítrico caliente, trióxido de cromo CrO3 disuelto en ácido acético glacial. En el caso de aldehídos de bajo punto de ebullición, estos deben destilarse de inmediato, para evitar que la oxidación continúe y se produzca el ácido ó bien se puede utilizar clorocromato de piridinio (PCC) que es un oxidante suave. La oxidación de alcoholes primarios a aldehídos se puede conseguir utilizando clorocromato de piridinio (PCC) como agente oxidante. El PCC es una mezcla de óxido de cromo (VI), piridina y HCl. Ejemplo: 19 http://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r53778.PDF 73 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 24.2 Oxidación de metilbencenos Este método es usado para la preparación de benzaldehído, se trata de la oxidación controlada de los metilbencenos, la cual se realiza con anhídrido crómico en presencia de anhídrido acético como control químico que acetila al intermedio impidiendo que prosiga la oxidación: Ar–CH3 + Cl2 Ar–CHCl2 + H2O/H+ Ar–CHO 24.3 Reducción cloruros de acilo Los cloruros de acilo o cloruros de ácido, son derivados reactivos de los ácidos carboxílicos en los cuales, el grupo hidroxilo o ácido se reemplaza por un átomo de cloro. La reducción se realiza al dejar que reaccione el cloruro de acilo con tricloruro de fósforo (PCl3) o cloruro de tionilo (SOCl2), dicha reducción de cloruros de acilo se realiza mediante el uso de H2/Pd (BaSO4) desactivado o usando hidruro de litio y aluminio desactivado LiAlH 4. 74 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 25: REACCIONES DE LOS ALDEHÍDOS La reacción más importante de los aldehídos es la reacción de adición nucleofílica cuyo mecanismo es el siguiente: La polaridad del grupo funcional carbonilo hace que el carbono quede cargado positivamente, lo cual lo hace susceptible del ataque de un nucleófilo (especie con afinidad por las cargas positivas). 25.1 Reacciones de adición nucleofílica Adición de reactivos de Grignard Ya vimos al estudiar los alcoholes que los aldehídos reaccionan con los reactivos de Grignard dando lugar a alcoholes. Si el aldehído es el metanal obtendremos un alcoholor 1º, si es cualquier otro aldehído se obtiene un alcohol 2º 75 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Adición de cianuro. Formación de cianhidrinas Ejemplo: Cianhidrina de la propanona Adición de alcoholes. Formación de acetales Los aldehídos pueden reaccionar con los alcoholes en presencia de ácido (HCl) dando lugar a la formación de acetales 76 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Adición aldólica Los aldehídos con hidrógenos en presencia de una base diluida (NaOH al 10%) a temperatura ambiente o inferior pierden un protón dando lugar a un nucleófilo que puede atacar al grupo carbonilo de otra molécula de cetona dando lugar a un aldol. Si el aldol experimenta una deshidratación entonces tenemos una condensación aldólica. 25.2 Reacciones de oxidación Los aldehídos oxidan fácilmente y se convierten en el ácido carboxílico respectivo, en presencia de los agentes oxidantes habituales de gran poder como el permanganato de potasio o el dicromato de sodio o el ácido crómico. La reacción general de oxidación de un aldehído es la siguiente: 77 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplo: CH3CHO + KMnO4 CH3COOH Un caso especial de oxidación de los aldehídos es la Reacción de Tollens, también conocida como Ensayo de Tollens, donde como oxidante se emplea el complejo Ag(NH3)2+, siendo un ensayo específico de los aldehídos, lo que nos permite determinar la presencia de un aldehído en una muestra. Este reactivo contiene un ión complejo de plata amoniacal, que se reduce a plata metálica en presencia de aldehídos que son fácilmente oxidados. La plata se deposita y se observa como un espejo sobre las paredes del recipiente donde se realice la prueba. La reacción general es: 2Ag(NH3)2NO3 + NaOH + R – CHO RCOONa + 4NH3 + 2NaNO3 + 2Ag + 2H2O 25.3 Reacciones de reducción Mediante el empleo de agentes reductores los aldehídos se reducen con facilidad a alcoholes primarios. Pueden emplearse una gran variedad de agentes reductores siendo el mas simple la mezcla de hidrógeno y metal (Ni o Pd o Pt). Otros agentes reductores son los hidruros como el NaBH 4 y LiAlH4. La diferencia entre ambos hidruros es que el NaBH4 solo reduce a los aldehidos y cetonas, mientras que el LiAlH4 es más enérgico y puede reducir ésteres y cloruros de ácido a alcoholes secundarios. 78 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Reducción de Clemmensen. Los aldehídos reaccionan con amalgama de zinc-mercurio en medio ácido y se reducen a alcanos. Reducción de Wolf-Kischner. La reacción de la hidrazina con aldehídos genera hidrazonas que sufren descomposición por perdida de nitrógeno cuando se tratan con bases a temperaturas elevadas. El producto de esta reacción es el hidrocarburo correspondiente. 79 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Mecanismo de Wolff Kishner En el mecanismo de Wolff-Kishner se forma la hidrazona, la base sustrae protones del nitrógeno generando un carbanión que se protona rápidamente para dar el hidrocarburo. 80 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS CAPITULO 6. CETONAS LECCION 26: ESTRUCTURA DE LAS CETONAS Las cetonas al igual que los aldehídos presentan el grupo funcional carbonilo pero en un carbono secundario lo cual modifica su reactividad. Son compuestos de fórmula general: Donde R y R´ son radicales alquílicos y/o arílicos. Si los dos radicales son iguales la cetona es simétrica y si los dos radicales son diferentes la cetona es asimétrica. Ejemplos: Cetona simétrica Cetona asimétrica Las cetonas también pueden ser cíclicas como la siguiente: ciclohexanona Las cetonas aromáticas (fenonas) presentan uno o dos anillos aromáticos unidos al grupo carbonilo. Ejemplos: 81 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 27: NOMENCLATURA DE LAS CETONAS20 Los nombres IUPAC de las cetonas siguen las siguientes reglas: 1) Se identifica la cadena más larga que contiene el grupo carbonilo la cual se considera la estructura matriz y se nombra reemplazando la terminación ano del alcano correspondiente por ona. 2) La cadena mas larga se numera empezando por el extremo mas cercano al grupo carbonilo. 3) Los sustituyentes se indican con el número correspondiente y en orden alfabético. En el caso de cetonas cíclicas se asigna el número 1 al carbono carbonílico. La primera cetona de la serie homóloga es la propanona y en este caso no es necesario indicar la posición del carbono carbonílico; la única posible es el segundo carbono de la cadena. propanona La segunda cetona de la serie homóloga es la butanona y tampoco se necesita indicar la posición del grupo carbonilo porque siempre estará ubicado en el carbono 2 de la cadena: butanona 20 ww.quimicaorganica.org/...cetonas/nomenclatura 82 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Las demás cetonas de la serie homóloga sí deben llevar un número para indicar la posición del carbono carbonílico. Así, la siguiente que es la de cinco carbonos puede ser la 2-pentanona o la 3-pentanona. CH3COCH2CH2CH3 CH3CH2COCH2CH3 2-pentanona 3-pentanona Ejemplos: Nomenclatura común de la cetonas Los nombres comunes de las cetonas se derivan de los nombres de los dos radicales unidos al grupo carbonilo, nombrados en orden alfabético, seguido de la palabra cetona. El nombre común de la primera cetona de la serie es la dimetil cetona ya que hay dos grupos metilo unidos al grupo carbonilo. Se acepta universalmente para la cetona mas simple el nombre de acetona. 83 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: Fórmula Nombre común CH3CH2COCH3 etil metil cetona CH3CH2COCH2CH3 dietil cetona CH3CH2COCH2CH2CH3 etil n-propil cetona CH3CH2COC6H5 etil fenil cetona Fenil-metil-cetona Difenil-cetona Bencil-metil-cetona Ciclohexil-metil-cetona Etil-metil-cetona Dimetil-cetona o acetona 84 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejercicios: Escriba el nombre IUPAC y el nombre común para las siguientes cetonas CH3COCH3 CH3COCH2CH3 CH3COCH2CH2CH3 CH3CH2COCH2CH3 85 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 28: PROPIEDADES FÍSICAS DE LAS CETONAS El grupo carbonilo polarizado convierte las cetonas en sustancias polares, por lo que tienen puntos de ebullición mas elevados que los compuestos no polares de peso molecular comparable. No son capaces, por sí mismas, de unirse intermolecularmente por medio de puentes de hidrógeno; como consecuencia, sus puntos de ebullición son inferiores a los de los alcoholes o los ácidos carboxílicos comparables. Las primeras diez son líquidas y a partir del carbono 11 son sólidas. Son solubles en éter, alcohol y cloroformo; la acetona es soluble en agua en cualquier proporción pero las siguientes son menos solubles. Las primeras tienen olor agradable y a medida que aumenta el número de átomos de carbono se vuelve desagradable. Las superiores son inodoras. Todas las cetonas alifáticas son menos densas que el agua. La acetona es muy buen disolvente de esmaltes, yodo y aceites. CETONA Punto de fusión ºC Punto de ebullición ºC Solubilidad g/100 g H2O acetona -94 56 Infinitamente sol. Metil-etil-cetona -86 80 26 2-pentanona -78 102 6.3 3-pentanona -41 101 5 2-hexanona -35 150 2 124 Ligeramente sol. 1.9 3-hexanona Mtil-isobutil-cetona -85 119 acetofenona 21 202 benzofenona 48 308 Tabla 18.1. Propiedades físicas de cetonas 86 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Fuentes industriales La cetona de mayor aplicación industrial es la acetona (propanona) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción del plexiglás, empleándose también en la elaboración de resinas epoxicas y poliuretanos. Otras cetonas industriales son la metil etil cetona (MEK, sigla el inglés) y la ciclohexanona que además de utilizarse como disolvente se utiliza en gran medida para la obtención de la caprolactama que es un monómero en la fabricación del Nylon 6 y también por oxidación da el ácido adípico que se emplea para fabricar el Nylon 66. El alcanfor es una cetona que se encuentra en forma natural y se obtiene de la corteza del árbol del mismo nombre. Tiene un olor fragante y penetrante; conocido desde hace mucho tiempo por sus propiedades medicinales, es un analgésico muy usado en linimentos. Otras dos cetonas naturales, beta-ionona y muscona, se utilizan en perfumería. La beta ionona es la esencia de violetas. La muscona, obtenida de las de las glándulas odoríferas del venado almizclero macho, posee una estructura de anillo con 15 carbonos. 87 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 29: PREPARACIÓN DE CETONAS 24.1 Oxidación de alcoholes secundarios21 Así como los alcoholes primarios se oxidan para producir aldehídos, los alcoholes secundarios se oxidan para producir cetonas. El dicromato de sodio (Na 2Cr2O7) o el ácido de cromo (VI) se utilizan normalmente para oxidar alcoholes secundarios en cetonas. Ambas especies producen ácido crómico (H 2CrO4) que se cree es la especie activa de la mezcla. El primer paso del mecanismo es la formación del éster cromato. La desprotonación y la eliminación del éster cromato produce la cetona oxidada y las especies de cromo reducidas. La reacción puede monitorearse gracias a los cambios de color dado que el reactivo es naranja, pero el de la especie de cromo reducido es verde azulado. 21 www.organica1.org/teoria1411/11.ppt 88 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: 24.2 Acilación de Friedel-Crafts22 Una de las modificaciones más importantes de la reacción de Friedel-Crafts utiliza los cloruros de ácido, en vez de los halogenuros de alquilo. Un grupo acilo, RCO-, se une a un anillo aromático para formar una cetona. El proceso se llama acilación. Como es usual en la reacción de FriedelCrafts, el anillo aromático que sufre la sustitución debe ser, por lo menos, tan reactivo como el halobenceno; requiere la catálisis con cloruro de aluminio u otro ácido de Lewis. 22 http://132.248.103.112/organica/qo1/ok/alde/alde5.htm 89 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS El mecanismo más probable para la acilación de Friedel-Crafts es similar al del carbocatión para la alquilación de Friedel-Crafts, y comprende los pasos siguientes: 1) formación del intermedio electrofílico En primer lugar, el cloruro de ácido reacciona con el catalizador AlCl3 formando un intermedio ácido-base de Lewis, que se rompe heterolíticamente para formar un catión acilo estabilizado por resonancia. 2) reacción entre el benceno y el catión acilo El ión acilo es un electrófilo potente y reacciona con el benceno para formar un catión ciclohexadienilo que pierde el protón para dar lugar a un acilbenceno. 3) formación de la alquil fenil cetona 90 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Ejemplos: 24.3 Ozonólisis de alquenos23 Los alquenos rompen con ozono formando aldehídos y/o cetonas. Si el alqueno tiene hidrógenos vinílicos da aldehídos. Si tiene dos cadenas carbonadas forma cetonas. 23 www.quimicaorganica.org/aldehidos-y-cetonas/preparacion-de-aldehidos-y-cetonas.html 91 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS 24.4 Hidratación de alquinos Los alquinos se pueden hidratar Markovnikov, formando cetonas, o bien antiMarkovnivov, para formara ldehídos. 92 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS LECCION 30: REACCIONES DE LAS CETONAS 24 La reacción más importante de las cetonas es la reacción de adición nucleofílica cuyo mecanismo es el siguiente: La polaridad del grupo funcional carbonilo hace que el carbono quede cargado positivamente, lo cual lo hace susceptible del ataque de un nucleófilo (especie con afinidad por las cargas positivas). Las cetonas se diferencian de los aldehídos porque no experimentan reacciones de oxidación, lo que se debe a la diferencia en sus estructuras: las cetonas no tienen un átomo de hidrógeno unido al carbono carbonílico. 30.1 Reacciones de adición Adición de reactivos de Grignard La reacción de una cetona con el reactivo de Grignard y posterior hidrólisis produce un alcohol terciario: 24 www.ulpgc.es/descargadirecta.php?codigo_archivo=4538 93 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Adición de cianuro. Formación de cianhidrinas Adición de alcoholes. Formación de cetales Las cetonas pueden reaccionar con los alcoholes en presencia de ácido (HCl) dando lugar a la formación de cetales Adición aldólica Las cetonas con hidrógenos en presencia de una base diluida (NaOH al 10%) a temperatura ambiente o inferior pierden un protón dando lugar a un nucleófilo que puede atacar al grupo carbonilo de otra molécula de cetona dando lugar a un aldol. 94 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS (aldol) 30.2 Reducción Mediante el empleo de hidruros como el NaBH4 y LiAlH4 las cetonas se reducen a alcoholes secundarios. Las cetonas se pueden reducir a alcanos mediante la reducción de Clemmensen o la reducción de wolf-Kischner Reducción de Clemmensen 95 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS Reducción de Wolf-Kischner La reacción de la hidrazina con las cetonas genera hidrazonas que sufren descomposición por perdida de nitrógeno cuando se tratan con bases a temperaturas elevadas. El producto de esta reacción es el hidrocarburo correspondiente. Mecanismo de Wolff Kishner En el mecanismo de Wolff-Kishner se forma la hidrazona, la base sustrae protones del nitrógeno generando un carbanión que se protona rápidamente para dar el hidrocarburo. 96 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 401587 – DERIVADOS HALOGENADOS BIBLIOGRAFIA 1. Morrison, R. & Boyd, R. (1998). Química Orgánica. México: Fondo Educativo Interamericano. 2. De la Torre, G. (1995). Química Orgánica. Bogotá: UNISUR. 3. Yurkanis, P. (2008). Química Orgánica. 4. Mc Murry, J. (2004). Química Orgánica. México: Thomson. 5. Stanley, P. (1982). Química Orgánica. México: Mc Graw-Hill. 6. Rakoff, H. (1986). Química Orgánica Fundamental. México: Limusa. 7. Guerrero, J. (1999). Introducción a la Química Orgánica. Bogotá: UNAD. 8. Allinger, N. (1973). Química Orgánica. Barcelona: Reverté. 9. Burton, D. & Routh, J. química Orgánica y Bioquímica. México: Interamericana. 10. Cramm, H. (1982). Química Orgánica (2 ed.). Madrid: Mc Graw Hill. 11. http://www.slideshare.net/.../halogenurosdealquilo 12. http://organica1.org/teoria1411/11.ppt 13. http://organica1.org/qo1/Mo-cap7.htm 14. http://www.quimicaorganica.org/alcoholes.html 15. http://organica1.org/qo1/ok/alcohol/alco114.htm 16. http://www.quimicaorganica.org/eteres-teoria/index.php 17. www.quimicaorganica.org/...nomenclatura-eteres/reglas-iupac 18. http://132.248.103.112/organica/qo1/ok/eteres/eter2.htm 19. http://132.248.103.112/organica/qo1/ok/eteres/eter3.htm 20. http://132.248.103.112/organica/qo1/ok/eteres/eter7.htm 21. http://132.248.103.112/organica/qo1/ok/eteres/eter11.htm 22. http://www.org/quimica/aldehidos.html 23. http://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r53778.PDF 24. http://www.ulpgc.es/descargadirecta.php?codigo_archivo=4538 97