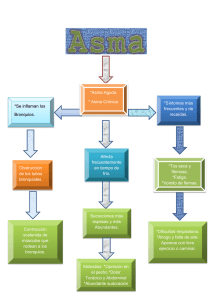
Tratamiento - Alergomurcia
Anuncio

Nuevos tratamientos del ASMA Tratamientos biológicos Definición de Asma grave/ grave/refractaria refractaria (No existe definición de consenso consenso)) “El Asma grave/refractaria grave/refractaria puede definirse como la resistencia al tratamiento intensivo intensivo” ” Holgate ST & Polosa R. Lancet 2006;368:780-93 “Cuando se han excluido otros diagnósticos, diagnósticos, se han tratado las comorbilidades, se han eliminado los desencadenantes y se ha comprobado el cumplimiento,, pese a lo cual hay mal control del cumplimiento asma o más de 2 exacerbaciones al año, año, aún con tratamiento intensivo intensivo,, o sólo pueden mantener el control con CO y por tanto están en riesgo de efectos adversos graves” Bel et al. Thorax 2011;66:910-7. Asma grave (requiere tratamiento a dosis altas) Buen control sólo con tratamiento intensivo Podría responder al tratamiento solucionando ciertos problemas (mal cumplimiento, exposición alergénica continua…) Mal control a pesar de tratamiento intensivo Resistente al tratamiento (asma refractaria) Enfermedades asociadas (ej. trastornos psicológicos, RGE) Taylor et al. Eur Respir J 2008;32:545-54 Tratamiento de mantenimiento (adulto) www.gemasma.com El 53,5 % de los pacientes de la muestra no están controlados, según GINA-2006 Clasificación Control GINA (6 ítems) 53,5% 700 Nº de pacientes 600 34,1% 500 400 300 12,4% 200 100 0 Asma controlada Asma Parcialmente controlada Asma no controlada Olaguibel et al. Respir Res. 2012;13:50. Control Actual del Asma Tiotropio Tiotropio, un paso más en el tratamiento del asma no controlada: Estudio TALC – Tiotropio como alternativa al incremento del glucocorticoide inhalado en pacientes inadecuadamente controlados con una dosis más baja de corticosteroides inhalados (TALC) – Estudio exploratorio financiado por el NHLBI sobre el tratamiento con tiotropio 18 µg (HandiHaler) una vez al día por la mañana Peters SP, et al. N Engl J Med. 2010;363:1715-26 Tiotropio: Estudio TALC Diseño EC aleatorizado, cruzado, doble ciego, triple enmascaramiento, en el que se compara en pacientes no controlados con CSI, la adición de tiotropio al tratamiento con CSI, el aumento de dosis de CSI o la adición de salmeterol al tratamiento con CSI n 210 pacientes Inclusión . . . . Tratamiento Tiotropium 18 µg (Handihaler) una vez al día Beclometasona 160 µg dos veces al día Salmeterol 50 µg dos veces al día Duración 52 semanas Variable ppal PEF matutino Variables 2arias FEV1, mejoría de síntomas, uso de medicación de rescate, exacerbaciones asmáticas, calidad de vida, seguridad Pacientes con asma no controlada* No fumadores FEV1 >40% y ≤70% del teórico Prueba broncodilatadora positiva •FEV1 ≤70%, síntomas ≥ 6 días/sem, uso de bd ≥ 6 d/sem, ≥2 despertares nocturnos Tiotropio: Estudio TALC Inclusión (4 semanas ) Periodo 1 (14 semanas) Periodo 2 (14 semanas ) Lavado (2 semanas) Periodo 3 (14 semanas) Tiotropio Salmeterol CSI doble CSI doble Tiotropio Salmeterol Salmeterol CSI doble Tiotropio Periodo de preinclusión CSI Lavado (2 semanas ) Lavado (2 semanas) Asignación y aleatorización 0 2 4 8 13 18 20 24 Semanas 29 34 36 40 45 50 52 1 2 3 4 5 6 7 8 Visitas 9 10 11 12 13 14 15 Valor basal del periodo de tratamiento 1 Valor basal del periodo de tratamiento 2 Valor basal del periodo de tratamiento 3 Peters SP, et al. N Engl J Med. 2010;363:1715-26 Peters et al. NEJM 2010;363:1715-26 Tiotropio: Estudio TALC CONCLUSIONES Añadir tiotropio al tratamiento con CSI en pacientes con asma no controlada consigue mejorar de forma estadísticamente significativa la función pulmonar y la sintomatología. Estas mejoras son similares a las obtenidas al añadir salmeterol Peters SP, et al. N Engl J Med. 2010;363:1715-26 Estudios de fase III PrimoTinA-asthma® – resultados de eficacia y seguridad Kerstjens y cols. NEJM 2012;367:1198-1207. Diseño del estudio: doble ciego, aleatorizado, controlado con placebo y con grupos paralelos (dos ensayos idénticos) Tratamiento adicional de al menos CSI + LABA Placebo Tiotropio Respimat® 5 µg una vez al día, por las mañanas Visita 0 Visita 1 (selección) Visita 2 (aleatorización) -4 0 Periodo de selección de 4 semanas Visitas 3 y 4 Visitas 5-8 Periodo de tratamiento doble ciego de 48 semanas Tres variables principales: FEV1 máximo (0 - 3 h) a las 24 semanas FEV1 predosis a las 24 semanas Tiempo hasta la primera exacerbación grave del asma en un análisis conjunto tras 48 semanas Visita 9 (fin del tratamiento) 48 Visita 10 52 Seguimiento de 4 semanas Todos los pacientes al menos en tratamiento de mantenimiento con CSI (≥ 800 µg de budesonida o equivalente/día) + LABA 117 centros, 5 continentes Kerstjens y cols. NEJM 2012;367:1198-1207. Principales criterios de inclusión: asma grave mal controlada • Asma: - Diagnosticada con < 40 años, confirmada con HRB, var. PEF o respuesta a SABA/CO 5 años de duración del asma 18 - 75 años No fumador o exfumador desde hace > 1 año y fumara < 10 paquetes-años • No controlada: - A pesar de CSI y LABA y otros posibles medicamentos para el control del asma Obligatorio: CSI ≥ 800 µg de budesonida o equivalente + LABA Permitido: teofilina a dosis estable, modificadores de leucotrienos, omalizumab, corticosteroides orales (≤ 5 mg/día) - No controlada: ACQ7 ≥ 1,5 en la selección y la visita basal - Obstrucción persistente FEV1 posbroncodilatador ≤80 % del valor teórico; FEV1/FVC ≤ 70 % - Al menos un episodio de exacerbación grave del asma en el año anterior, tratado con corticosteroides sistémicos Kerstjens y cols. NEJM 2012;367:1198-1207. Datos demográficos agrupados Placebo (n = 456) Tiotropio Respimat® (n = 456) Total (n = 912) 278 (61,0) 273 (59,9) 551 (60,4) 383 (84,0) 376 (82,5) 759 (83,2) Negros 25 (5,5) 22 (4,8) 47 (5,2) Asiáticos 47 (10,3) 56 (12,3) 103 (11,3) 1 (0,2) 2 (0,4) 3 (0,3) Media de edad, años (DE) 53,8 (12,2) 52,2 (12,5) 53,0 (12,4) Media del IMC (DE)b 28,2 (6,1) 28,2 (5,9) 28,2 (6,0) No fumador, n (%) 352 (77,2) 340 (74,6) 692 (75,9) Mediana de duración del asma, años (intervalo) 28,0 (5,0 - 69,0) 28,0 (5,3 - 72,0) 28,0 (5,0 - 72,0) Mediana de edad al inicio, años (intervalo) 26,0 (0 - 39) 26 (0 - 44) 26 (0 - 44) Total tratadosa Sexo, n (%) Mujeres Raza, n (%) Caucásicos Otros Kerstjens y cols. NEJM 2012;367:1198-1207. Características clínicas agrupadas Total tratados Tiotropio Respimat® (n = 456) Placebo (n = 456) Total (n = 912) FEV1, L media (prebroncodilatador) 1,63 1,58 1,60 FEV1, % del valor teórico (prebroncodilatador) 54,9 54,8 54,8 FEV1, % del valor previsto (posbroncodilatador) 62,0 62,5 62,2 214 (14,7 %) 219 (15,6 %) 217 (15,2 %) FVC, % del valor previsto (posbroncodilatador) 87,3 88,1 87,7 FEV1/FVC % (posbroncodilatador) 59,4 59,0 59,2 FEV1 rev broncodilatador, ml media (%)* Categorías de FEV1 % del valor teórico, n (%) (posbroncodilatador) < 60 % 179 (39,3) 183 (40,1) 362 (39,7) ≥ 60 % a < 80 % 274 (60,0) 264 (57,9) 538 (59,0) ≥ 80 % a < 90 % 3 (0,7) 9 (2,0) 12 (1,3) 62,7 61,3 62,0 Media semanal del PEF (% del valor teórico)** *Obtenido 30 minutos después de cuatro inhalaciones de salbutamol 100 µg. **Última semana antes de la visita 2. Kerstjens y cols. NEJM 2012;367:1198-1207. Ensayo 2: Respuesta del FEV1 (0 a 3 horas) (semana 24) 500 FEV1 [ml] – cambio respecto al periodo basal 450 400 * 350 * * * 300 250 200 * 150 Todos como tratamiento complementario de CSI + LABA 100 50 0 0 0,5 1,0 2,0 Tiempo tras la administración (h) Placebo *p < 0,001 Las barras de error representan errores estándar. 3,0 Tiotropio Respimat® Kerstjens y cols. NEJM 2012;367:1198-1207. Pacientes con al menos una exacerbación grave de asma (%) Exacerbaciones graves del asma (datos agrupados) CR = 0,79; reducción del riesgo del 21 % (p = 0,03) Tiotropio Respimat® n = 122 (26,9 %), Placebo n = 149 (32,8 %), 50 Tiotropio Respimat®: 282 días; Placebo: 226 días (percentil 25) 40 Placebo NNT: 15 30 Tiotropio Respimat® 20 10 Todos como tratamiento complementario de CSI + LABA 0 0 2 5 Pacientes en riesgo 454 435 Placebo Tiotropio 453 430 ® Respimat 5 0 7 5 100 412 388 379 367 356 339 332 319 303 290 282 272 409 401 389 378 363 353 348 339 331 319 308 298 125 150 175 200 Tiempo (días) 225 250 275 300 325 Kerstjens y cols. NEJM 2012;367:1198-1207. Resumen – La adición de tiotropio Respimat® a CSI/LABA logró: . Mejorías en la función pulmonar . Reducción del riesgo de exacerbación y empeoramiento del asma . Ciertas mejorías en la resultados percibidos por los pacientes (ACQ, AQLQ) . Seguridad similar a placebo Kerstjens y cols. NEJM 2012;367:1198-1207. MetaMeta-análisis Cambio en FEV1 máximo Cambio en FVC máxima Tian JW et al. Respiratory Care 2013 MetaMeta-análisis Uso de medicación de alivio Acontecimientos adversos graves Tian JW et al. Respiratory Care 2013 CONCLUSIÓN Añadir tiotropio al tratamiento estándar en pacientes con asma no controlada mejora significativamente la función pulmonar sin aumentar los efectos adversos. Se requieren estudios de larga duración para evaluar los efectos de la adición de tiotropio en las exacerbaciones del asma y la mortalidad. Tian JW et al. Respiratory Care 2013 Casale TB. JACI 2008;121:288-96 Omalizumab en asma alérgica Casale TB. JACI 2008;121:288-96 Omalizumab en asma en adultos y niños • • • Omalizumab was effective in reducing asthma exacerbations and hospitalisations as an adjunctive therapy to inhaled steroids and during steroid tapering phases of clinical trials. Omalizumab was significantly more effective than placebo in increasing the numbers of participants who were able to reduce or withdraw their inhaled steroids. Omalizumab was generally well tolerated, although more injection site reactions were seen with omalizumab. Normansell et al. Cochrane Database Syst Rev. 2014 Jan 13;1:CD003559. Papel del TNF-α α en la patogénesis del asma Brightling C et al. JACI 2008;121:5-10 Resultados de los ensayos clínicos anti-TNFα α Brightling C et al. JACI 2008;121:5-10 IL-5 Haldar P et al. NEJM 2009;360:973-84 ↓43% ↓48% Number of exacerbations in each treatment group (A) Cumulative number of exacerbations with time and (B) Distribution of number of exacerbations. Pavord et al. Lancet 2012; 380:651-9 Eos blood FEV1 Eos sputum ACQ AQLQ Secondary outcomes : Change in blood (A) and sputum (B) eosinophil counts. (C) Change in prebronchodilator FEV1. (D) Change in score on ACQ. (E) Change in score on AQLQ Pavord et al. Lancet 2012; 380:651-9 IL-13 Corren et al. NEJM 2011;365:1088-98 Corren et al. NEJM 2011;365:1088-98 A phase II placebo controlled study of tralokinumab in moderate-to-severe asthma Piper et al. Eur Respir J 2013;41:330-8 A phase II placebo controlled study of tralokinumab in moderate-to-severe asthma ACQ-6 FEV1 Piper et al. Eur Respir J 2013;41:330-8 2 Wenzel et al. N Eng J Med 2013;368:2455-66. 3 Dupilumab therapy was associated with an 87% relative reduction in the proportion of patients with an exacerbation during the 12-week intervention period (the primary end point) (OR 0.08; 95%CI, 0.02 to 0.28) and FEV1 (% predicted) were higher with dupilumab than with placebo (Panel C), and the number of nocturnal awakenings was lower (Panel D). Wenzel et al. N Eng J Med 2013;368:2455-66. Key Pharmacodynamic Markers FeNO Thymus and activationregulated chemokine Eotaxin-3 IgE Wenzel et al. N Eng J Med 2013;368:2455-66. Wenzel et al. N Eng J Med 2013;368:2455-66. Daclizumab improves asthma control in patients with moderate to severe persistent asthma Busse et al. Am Respir Crtit Care Med 2008;178:1002-8. Daclizumab improves asthma control in patients with moderate to severe persistent asthma Busse et al. Am Respir Crtit Care Med 2008;178:1002-8. Daclizumab improves asthma control in patients with moderate to severe persistent asthma Busse et al. Am Respir Crtit Care Med 2008;178:1002-8. Termoplastia Weschler et al. J Allergy Clin Immuol 2013 Weschler et al. J Allergy Clin Immuol 2013 Tratamiento actualizado según los avances