Recurrencia de un carcinoma gástrico de células en anillo de sello
Anuncio

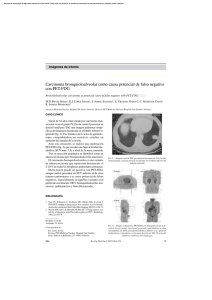
Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. notas clínicas Recurrencia de un carcinoma gástrico de células en anillo de sello demostrada por PET-FDG G. RUIZ-HERNÁNDEZa, R.C. DELGADO-BOLTONa, M.J. RUBIO-PÉREZb, A. JIMÉNEZ-VICIOSOa, M.J. PÉREZ-CASTEJÓNa, J.L. CARRERAS-DELGADOc aInstituto PET FOCUSCAN S.L. Madrid. bClínica de Oncología Médica. ONCOMED. Hospital de Cruz Roja, Córdoba. cServicio de Medicina Nuclear del Hospital Clínico San Carlos, Madrid. Resumen.—Objetivo: Presentar la detección de una recurrencia secundaria a un carcinoma gástrico difuso, con células en anillo de sello e indiferenciado mediante PET-FDG. Material y métodos: Se trataba de un paciente con estadio III diagnosticado en 1994 y tratado con gastrectomía subtotal. En febrero del 2003 se diagnostica recurrencia mediastínica y supraclavicular izquierda, administrándose quimioterapia y radioterapia alcanzando respuesta completa. Tras 6 meses libre de enfermedad, presenta una elevación de marcadores tumorales con pruebas complementarias (endoscopia digestiva alta, gammagrafía ósea y TC) negativas, efectuándose PET-FDG para descartar recurrencia. Resultados: La PET-FDG identificó lesiones probablemente malignas en región supraclavicular derecha y en mediastino, confirmándose dichos hallazgos por seguimiento clínico y la realización de una TC 4 meses más tarde. Conclusiones: Destacamos la detección de recurrencia precoz por PET-FDG en un carcinoma no intestinal gástrico, circunstancia que creemos de interés dada la mayor dificultad de la PET-FDG en la detección de carcinomas productores y/o secretores de moco. PALABRAS CLAVE: PET-FDG. Células en anillo de sello. Cáncer gástrico. Tumores no intestinales o mucinosos. RECURRENT SIGNET-RING CELL GASTRIC CARCINOMA EVIDENCED BY FDG-PET Abstract.—Objective: To present the case report of a patient with undifferentiated and diffuse signet-ring cell gastric carcinoma in which FDG-PET evidenced recurrent disease. Materials and methods: The patient was diagnosed of a stage III gastric carcinoma in 1994 and was treated with a subtotal gastrectomy. In February 2003, recurrent disease was detected in mediastinal and left supraclavicular lymph nodes. The patient was treated with chemotherapy and radiotherapy, Recibido: 11-1-05. Aceptado: 23-3-05. Correspondencia: J.L. CARRERAS DELGADO Servicio de Medicina Nuclear Hospital Clínico San Carlos Profesor Martín Lagos, s/n 28040 Madrid E-mail: [email protected] 326 reaching a complete response. After 6 months free of disease, he presented an elevation of the tumor markers with negative results in conventional imaging methods (upper digestive endoscopy, bone scintigraphy, and CT). An FDG-PET scan was performed to rule out recurrent disease. Results: FDG-PET detected pathologic findings suggestive of malignant disease in right supraclavicular and mediastinal lymph nodes. These findings were confirmed by clinical follow-up and with another CT scan performed 4 months later. Conclusions: In this case report we stress the importance of early recurrence by FDG-PET in a non-intestinal gastric carcinoma. This is of interest given the greater difficulty to detect mucous secreting and/or producing carcinomas with the PET-FDG. KEY WORDS: FDG-PET. Signet ring cell carcinomas. Gastric cancer. Non-intestinal or mucinous tumors. INTRODUCCIÓN Se ha descrito una menor acumulación de FDG en los tumores de contenido mucinoso de diferentes orígenes, incluyendo el cáncer gástrico. Berger et al 1, encuentran una sensibilidad menor del 60 % para la detección de neoplasias mucinosas, con una captación de FDG inversamente proporcional al contenido de mucina del tumor y directamente proporcional a la celularidad del tumor. Al parecer, en los tumores gástricos mucinosos, este fenómeno está relacionado con una menor expresión de los transportadores de la Glut 1 2. Tanto el moco acumulado intra como extracelularmente en los cánceres de estómago, puede dificultar la visualización mediante PET-FDG de las lesiones con escasa formación glandular (subtipo no intestinal de Lauren), entre los que destaca el carcinoma gástrico de células en anillo de sello 3. Presentamos el caso clínico de un paciente con recurrencia por carcinoma gástrico de células en anillo de sello demostrada únicamente por PET-FDG. Rev Esp Med Nucl, 2005;24(5):326-30 40 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ruiz-Hernández G, et al. Recurrencia de un carcinoma gástrico de células en anillo de sello demostrada por PET-FDG CASO CLÍNICO Paciente de 68 años, con antecedentes de gastrectomía subtotal por carcinoma gástrico de células en anillo de sello de tipo indiferenciado en 1994. Tras 9 años libre de enfermedad sufre una recaída en región supraclavicular izquierda y en mediastino en febrero del 2003, efectuándose una exéresis de la metástasis supraclavicular izquierda y administrándose quimioterapia con esquema FLEP (leucovorin, 200 mg/m 2 1.º, 2.º y 3.º días; 5-Flourouracil, 400 mg/m 2, 1.º, 2.º y 3.º días; neoplatin, 75 mg/m 2, 2.º día, y farmorubicina, 60 mg/m 2, 2.º día) cada 21 días, un total de seis ciclos, finalizando último ciclo en agosto del 2003, con respuesta completa por TC. Posteriormente recibió radioterapia con intención radical sobre mediastino y fosa supraclavicular izquierda, con Co 60, con una dosis total de 30 Gy, finalizando en diciembre del mismo año. Después de 6 meses libre de enfermedad, en junio del 2004 se detecta elevación del CEA con valor de 37,2 (normal: 0-5 ng/ml), con pruebas complementarias (endoscopia digestiva alta, gammagrafía ósea y TC de cuerpo entero, negativas, solicitándose un estudio PET-FDG para descartar recurrencia. En las imágenes PET-FDG se observaron acúmulos patológicos del radiotrazador en: región supraclavicular derecha (1,1-2 cm y SUV máx. de 3,3); me- FIG. 1.—Proyecciones coronales del estudio PET-FDG mostrando una hipercaptación patológica del radiotrazador en ventana aortopulmonar (SUV máx. de 5,6). diastino superior (1-1,6 cm y SUV máx. de 3,1); ventana aortopulmonar (1,4-3 cm y SUV máx. de 5,6); e hilio pulmonar derecho (1,1-1,6 cm y SUV máx. de 2,9), sugerentes de malignidad (figs. 1 y 2). Los ha- FIG. 2.—Imágenes volumétricas PET-FDG de cuerpo entero, con acúmulos sugerentes de malignidad en: región supraclavicular derecha; mediastino superior; ventana aorto-pulmonar; e hilio pulmonar derecho. 41 Rev Esp Med Nucl, 2005;24(5):326-30 327 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ruiz-Hernández G, et al. Recurrencia de un carcinoma gástrico de células en anillo de sello demostrada por PET-FDG C A B FIG. 3.—Composición TC-PET-FDG, con cortes transaxiales a nivel de la ventana aortopulmonar. Negatividad de hallazgos en TC (A). Positividad de la prueba PET-FDG (B) y confirmación en TC posterior (C). llazgos de la PET-FDG se confirmaron por TC 4 meses después (fig. 3), decidiéndose administrar quimioterapia de segunda línea con neoplatin 50 mg/m 2, día 1.º y campto 85 mg/m 2 día 1.º, hasta un total de seis ciclos, alcanzando remisión parcial de la enfermedad. DISCUSIÓN Durante los últimos 50 años la incidencia y la mortalidad del cáncer de estómago ha disminuido en la mayoría de países. Esta menor incidencia está basada sobre todo a expensas del carcinoma gástrico de tipo intestinal de la clasificación de Lauren. Sin embargo, según algunos investigadores, parece existir un incremento del número de neoplasias gástricas no intestinales, especialmente del subtipo celular en anillo 328 de sello. Este aumento se ha observado tanto en hombres como en mujeres, así como en americanos de origen africano y también en hombre blanco, contabilizándose desde 1973 hasta el año 2000 un incremento del porcentaje de 0,3 a 1,8 casos por 100.000 personas 4. El carcinoma de células en anillo de sello del estómago se caracteriza por tener un mal pronóstico, (aunque sin diferencias significativas de supervivencia con el resto de cánceres gástricos), así como por ser infiltrante. Es conocida: su capacidad para originar tumores de mayor tamaño y profundidad; su mayor poder de metastatización en el hígado y en los ganglios linfáticos (no así en peritoneo); y su elevada prevalencia en forma de cáncer gástrico precoz 5. Aunque podamos imaginar que únicamente puede aparecer con una localización gástrica, existen algunos case reports en la literatura indexada sobre ade- Rev Esp Med Nucl, 2005;24(5):326-30 42 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ruiz-Hernández G, et al. Recurrencia de un carcinoma gástrico de células en anillo de sello demostrada por PET-FDG nocarcinomas primarios de células en anillo de sello situados a nivel de: mama, colon 6, pulmón 7, páncreas 8 , ampolla de Vater 9, glándulas salivares 10 , piel11, próstata12, vejiga urinaria13, uretra14, cérvix15 y útero16. Se trata de un tumor caracterizado por la gran producción de moco intracelular, pero con características claramente diferenciales al adenocarcinoma mucinoso de estómago. El primero aparece predominantemente en mujeres jóvenes, con un crecimiento difuso y frecuentes metástasis en ovarios y en útero; y con una anatomía patológica en la que destaca un tipo de diferenciación celular funcional productor de moco. El segundo se observa más frecuentemente en hombres mayores, con tendencia al crecimiento masivo o en forma de nidos y a la diseminación peritoneal, destacando dos tipos de diferenciación celular funcional, las células productoras de moco y las mucosecretoras17. En la actualidad todavía no existe un consenso claro sobre la utilización de la PET-FDG en la estadificación y re-estadificación del cáncer gástrico18. Mediante PET-FDG es posible identificar hasta un 75,2 % de los tumores primarios, con mayor dificultad en la detección de tumores en fase precoz y de la afectación ganglionar (sensibilidad del 23 % para la PET-FDG y del 65 % para la TC)19. Con respecto a la recurrencia por cáncer de estómago, existen pocos estudios y con resultados escasamente alentadores. De Potter et al 20 obtienen en su trabajo de 23 pacientes, una sensibilidad, especificidad, valor predictivo positivo y negativo de 70 %, 69 %, 78 % y 60 %, respectivamente. Aunque señalan el valor pronóstico de la PET-FDG, concluyen que dada su escasa sensibilidad y su valor predictivo negativo no constituye una técnica adecuada en el seguimiento del cáncer de estómago. Otros investigadores 21, son más optimistas en el uso de la PET-FDG en la detección de recurrencia (n.º de pacientes = 18), remarcando una posible indicación cuando existe un incremento sérico de marcadores tumorales con TC negativa. Lo que sí parece claro es la presencia de una menor captación de FDG en los tumores escasamente diferenciados y en los carcinomas de células en anillo de sello 3,22. El trabajo que mejor explica este hecho es el de Stahl et al 3. En él se estudia un total de 40 pacientes con carcinoma gástrico localmente avanzado y 10 sujetos control, valorando cualitativa y cuantitativamen43 te la captación de FDG con respecto al tipo histopatológico del tumor (intestinales versus no-intestinales, según la clasificación de Lauren). Tan sólo consiguen detectar 24 de 40 (60 %) de las lesiones primarias, con diferencias significativas (p = 0,01) entre los cánceres de tipo intestinal (83 %) y de tipo no intestinal (41 %). La media del valor del SUV fue superior en los cánceres intestinales que en los no-intestinales (6,7 ± 3,4 frente a 4,8 ± 2,8; p = 0,03), fenómeno íntimamente relacionado con el contenido mucoso de la neoplasia. Concluyen que el patrón difuso de crecimiento del cáncer de estómago, así como la deposición de moco extracelular e intracelular, pueden originar una baja captación de FDG, con la consiguiente disminución de la sensibilidad para la PET. Creemos que nuestro caso clínico es importante porque en él se presenta una recurrencia por carcinoma gástrico de células en anillo de sello, difuso y escasamente diferenciado, diagnosticada por PET-FDG y negativa en TC. BIBLIOGRAFÍA 1. Berger KL, Nicholson SA, Dehdashti F, Siegel BA. FDG PET evaluation of mucinous neoplasms: correlation of FDG uptake with histopathologic features. Am J Roentgenol. 2000;174: 1005-8. 2. Kawamura T, Kusakabe T, Sugino T, Watanabe K, Fukuda T, Nashimoto A, et al. Expression of glucose transporter-1 in human gastric carcinoma. Cancer. 2001;92:634-41. 3. Stahl A, Ott K, Weber WA, Becker K, Link T, Siewert JR, et al. FDG PET imaging of locally advanced gastric carcinomas: correlation with endoscopic and histopathological findings. Eur J Nucl Med Mol Imaging. 2003;30:288-95. 4. Henson DE, Dittus C, Younes M, Nguyen H, Albores-Saavedra J. Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States, 1973-2000: increase in the signet ring cell type. Arch Pathol Lab Med. 2004;128:765-70. 5. Kim DY, Park YK, Joo JK, Ryu SY, Kim YJ, Kim SK, et al. Clinicopathological characteristics of signet ring cell carcinoma of the stomach. ANZ J Surg. 2004;74:1060-4. 6. Chu PG, Weiss LM. Immunohistochemical characterization of signet-ring cell carcinomas of the stomach, breast, and colon. Am J Clin Pathol. 2004;121:884-92. 7. Hiraki A, Ueoka H, Yoshino T, Tabata M, Kiura K, Tanimoto Y, et al. Primary signet-ring cell carcinoma of the lung with histochemical characterization. Anticancer Res. 2002;22:1079-81. 8. Marcy M, Chetaille B, Charafe-Jauffret E, Giovannini M, Delpero JR, Monges G. Signet ring cell carcinoma of the pancreas: a case report. Ann Pathol. 2002;22:314-6. 9. Ramia JM, Mansilla A, Villar J, Muffak K, Garrote D, Ferron JA. Signet ring cell carcinoma of the Vater’s Ampulla. JOP 2004;5:495-7. 10. Ghannoum JE, Freedman PD. Signet-ring cell (mucin-producing) adenocarcinomas of minor salivary glands. Am J Surg Pathol. 2004;28:89-93. Rev Esp Med Nucl, 2005;24(5):326-30 329 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ruiz-Hernández G, et al. Recurrencia de un carcinoma gástrico de células en anillo de sello demostrada por PET-FDG 11. Rutten A, Huschka U, Requena C, Rodriguez-Peralto JL, Requena L. Primary cutaneous signet-ring cell melanoma: a clinico-pathologic and immunohistochemical study of two cases. Am J Dermatopathol. 2003;25:418-22. 12. Uemura M, Nakagawa M, Kanno N, Nishimura K, Miyoshi S, Kawano K. Signet ring-cell carcinoma of the prostate: a case report. Hinyokika Kiyo. 2004;50:645-7. 13. Sugino Y, Kamikawa M, Tsukazaki H, Sanada S, Kawai J. A case of primary signet ring cell carcinoma of the urinary bladder presenting as nocturnal incontinence. Hinyokika Kiyo. 2004;50:343-6. 14. Suzuki K, Morita T, Tokue A. Primary signet ring cell carcinoma of female urethra. Int J Urol. 2001;8:509-12. 15. Kupryjanczyk J, Kujawa M. Signet-ring cells in squamous cell carcinoma of the cervix and in non-neoplastic ectocervical epithelium. Int J Gynecol Cancer. 1992;2:152-6. 16. Moritani S, Ichihara S, Kushima R, Sugiura F, Mushika M, Silverberg SG. Combined signet ring cell and glassy cell carcinoma of the uterine cervix arising in a young Japanese woman: a case report with immunohistochemical and histochemical analyses. Pathol Int. 2004;54:787-92. 330 17. Yang XF, Yang L, Mao XY, Wu DY, Zhang SM, Xin Y. Pathobiological behavior and molecular mechanism of signet ring cell carcinoma and mucinous adenocarcinoma of the stomach: a comparative study. World J Gastroenterol. 2004;10:750-4. 18. Dehdashti F, Siegel BA. Neoplasms of the esophagus and stomach. Semin Nucl Med. 2004;34:198-208. 19. Mochiki E, Kuwano H, Katoh H, Asao T, Oriuchi N, Endo K. Evaluation of 18F-2-deoxy-2-fluoro-D-glucose positron emission tomography for gastric cancer. World J Surg. 2004;28: 247-53. 20. De Potter T, Flamen P, Van Cutsem E, Penninckx F, Filez L, Bormans G, et al. Whole-body PET with FDG for the diagnosis of recurrent gastric cancer. Eur J Nucl Med Mol Imaging. 2002;29:525-9. 21. Jadvar H, Tatlidil R, García AA, Conti PS. Evaluation of recurrent gastric malignancy with F-18-FDG positron emission tomography. Clin Radiol. 2003;58:215-21. 22. Yoshioka T, Yamaguchi K, Kubota K, Saginoya T, Yamazaki T, Ido T, et al. Evaluation of 18F-FDG PET in patients with a, metastatic, or recurrent gastric cancer. J Nucl Med. 2003;44: 690-9. Rev Esp Med Nucl, 2005;24(5):326-30 44