Enlace Químico - Departamento de Química General
Anuncio

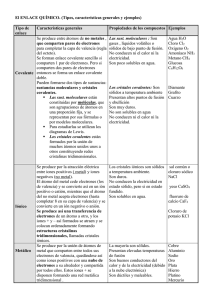
Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e- configuración # de valencia 1A ns1 1 2A ns2 2 3A ns2np1 3 4A ns2np2 4 5A ns2np3 5 6A ns2np4 6 7A ns2np5 7 Principio Básico • Los electrones de valencia interactúan para establecer atracción entre los átomos. • Existen 2 tipos de interacciones. 2 tipos de enlace • Interacciones en las que los electrones se transfieren de un átomo a otro. (Enlace Iónico) • Interacciones en las que los electrones se comparten entre dos átomos de una manera mas o menos equitativa. (Enlace covalente) Los electrones de valencias se transfieren de un átomo a otro. • La transferencia de electrones favorece la formación de iones y los de distinta carga se atraen para formar un enlace iónico o electrovalente. Los electrones de valencia se comparten entre los átomos. • El compartir electrones da origen al enlace covalente. Enlace Iónico Definición, Propiedades y Características. Enlace iónico • Se define como una fuerza de atracción electrostática que mantiene a los iones unidos debido a su diferencia de cargas. • Para formar iones los electrones se transfieren de la capa externa de un átomo a la de otro. • El que pierde electrones queda positivo (catión) y el que gana electrones queda negativo (anión) Reglas para la formación de iones • Los metales forman cationes perdiendo electrones. • Los no metales forman aniones con configuración de gas noble, ganando electrones. • Los metales de transición pierden primero los electrones s y luego los d si es necesario. • En la formación de iones no se suelen perder más de 3 electrones, salvo ciertas excepciones. Estructuras de Lewis en la formación de iones. • Se representan los elementos con sus electrones de valencia. • Los electrones de valencia se representan con puntos o cruces. • El resto del átomo con el símbolo (Kernel) Estructura de Lewis para los elementos representativos y gases nobles Sucede en tres pasos que ocurren de la siguiente manera: Características de compuestos con enlace iónico • Los compuestos conducen la electricidad al estar fundidos o en solución acuosa. • Tienen puntos de fusión elevados. • La mayoría son solubles en agua. • Forman cristales bien definidos. Compuestos iónicos - cristales Características de los compuestos con enlace iónico • La diferencia de electronegatividad entre los átomos que lo forman es grande, igual a 1.7 o mas. (Excepción HF) • Se da de manera común por transferencia de electrones de elementos metálicos de los grupos IA y IIA al O, los halógenos u otros no metales. Características del enlace iónico • No forman verdaderas moléculas, lo que forma son redes cristalinas extendidas, (le da características de dureza, y explica los altos puntos de fusión) • La mayoría son sólidos (en los compuestos covalentes hay mas diversidad). NaCl Enlace iónico Li + F Li+ F - 1s22s1 1s22s22p5 1s22s22p6 Tipos de iones • Los iones se clasifican también por la configuración electrónica que poseen. • De tal manera que se tienen los siguientes tipos que son los mas comunes: – Iones tipo s2, por ejemplo el H- ,el Li+ y el Be2+. – Iones tipo s2p6, por ejemplo los aniones de los no metales, los cationes de los alcalinos desde el sodio y los cationes de los alcalinotérreos desde el magnesio. Tipos de iones – Iones tipo s2d10 como el de algunos metales que se encuentran por debajo del grupo de los no metales y metaloides, que al formar cationes pierden primero los electrones en p, por ejemplo el Pb2+ y el Sn2+. – Iones tipo d10, como el de los metales que tienen lleno el orbital (n-1)d y pierden los electrones del orbital ns, por ejemplo el Zn2+, el Cd2+, el Hg2+, el Au1+, el Cu1+ y la Ag1+ Problemas • Indique el tipo de ion monoatómico que pueden formar los siguientes elementos: – Sc – Ca –N – Zn – Cr Problemas • Prediga la fórmula química de los compuestos iónicos que se forman entre los siguientes pares de elementos: – Mg y Br – F y Al Problemas • Escriba las fórmulas globales y las estructuras de Lewis correspondientes a la unión de los siguientes iónes: – Estroncio (II) y nitruro – Potasio (I) y fluoruro – Magnesio (II) y óxido Atención! • Leer del libro de Chang, 10ma edición las páginas: – 366 a 368 – Resolver hojas de trabajo no. 0 (primeros 2 grupos de ejercicios); iniciar con la 1 y 2 completa. Enlace Covalente Definición, propiedades y características Enlace Covalente • Es una fuerza de atracción que se da entre 2 átomos debido a que un par de electrones con spin opuesto es compartido por los 2 átomos que forman el enlace. • Los electrones de las capas externas son compartidos por los dos átomos enlazados. Un enlace covalente ocurre cuando dos o más átomos comparten uno o más pares de electrones. ¿Por qué compartirían electrones dos átomos? F + 7e- F F F 7e- 8e- 8e- Estructura de Lewis para F2 Enlace covalente simple Pares libres F F Pares libres Enlace covalente simple Pares libres F F Pares libres 9.4 Enlace Covalente • Es el enlace que esta presente en las moléculas diatómicas homonucleares. (hidrógeno H2, oxígeno O2, nitrógeno N2, flúor F2, bromo Br2, yodo I2, cloro Cl2) Enlace covalente • Enlace covalente simple: se comparte una sola pareja de electrones. (ejemplo, hidrógeno) • Enlace covalente doble: se comparten dos pares de electrones entre 2 átomos. (ejemplo, oxígeno que tiene pares de enlace y de no enlace) • Enlace covalente triple: dos átomos comparten 3 pares de electrones (máximo de pares que se pueden compartir), ejemplo, el nitrógeno. Estructura de Lewis para el agua H + O + H Enlace covalente simple H O H or H O H 2e-8e-2e- Doble enlace – dos átomos comparten dos pares de electrones O C O or O O C Enlaces dobles 8e- 8e- 8eEnlaces dobles Triple enlace – dos átomos comparten tres pares de electrones N N 8e- 8eTriple enlace or N N Triple enlace 9.4 Enlace covalente • Los electrones se pueden compartir equitativamente (en las moléculas diatómicas homonucleares hay enlaces covalentes puros), o no (por ejemplo en el HF) H F Propiedades de los compuestos con enlaces covalentes • Este tipo de enlace da origen a verdaderas moléculas. • Son no ionizables y si lo hacen, lo hacen en bajo porcentaje (porcentaje de carácter iónico, no hay nada completamente covalente) Propiedades de los compuestos con enlaces covalentes • No conducen la electricidad en ninguna fase. • Hay una diferencia de electronegatividad pequeña entre los átomos que lo forman (menor a 1.7). • Se forma entre 2 no metales o entre un metaloide y un no metal, (hay algunas excepciones como en el cloruro de bario) Longitud de los enlaces covalentes Longitud Triple enlace < Doble enlace < Enlace simple Problemas • Identifique si los siguientes compuestos son iónicos o covalentes: – Oxido ferroso – Anhídrido sulfúrico – Anhídrido carbónico – Agua – Cloruro de sodio