síntesis de colesterol - USAC – Bioquímica
Anuncio

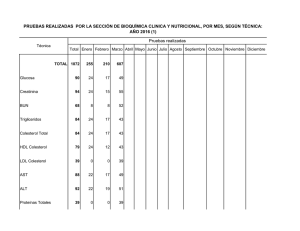
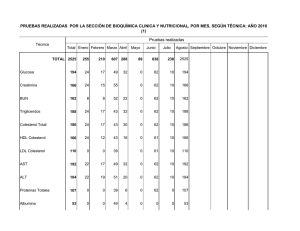
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 SÍNTESIS DE COLESTEROL Dr. Mynor A. Leiva Enríquez Los lípidos que provienen de los alimentos son conducidos por los QUILOMICRONES. Los ACIDOS GRASOS formados en el hígado son luego esterificados para formar TRIGLICÉRIDOS junto con el COLESTEROL son conducidos a los tejidos en las VLDL 3 exterior de la célula proteína proteína con un marcador de carbohidrato doble capa lipídica proteína de un solo lado de la capa capa interior de la célula colesterol proteína que se extiende a través de la capa Conceptos importantes Procedencia: Dieta (aunque el colesterol plasmático varía poco al agregarle el de la dieta) Síntesis Endógena: todas las células sintetizan colesterol Degradación: En los mamíferos, no existe maquinaria de degradación. Eliminación: En forma de Sales biliares o Colesterol libre, eliminado con las heces. Síntesis de mevalonato 2 Acetil-CoA TIOLASA Acetoacetil-CoA + CoA—S Acetoacetil-CoA + Acetil-CoA + H2O HMG-CoA SINTASA HMG-CoA HMG-CoA + 2NADPH + 2H+ HMG-CoA REDUCTASA Mevalonato + 2NADP + CoA--SH Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de mevalonato 2 Acetil-CoA TIOLASA Acetoacetil-CoA + CoA—S Acetoacetil-CoA + Acetil-CoA + H2O HMG-CoA SINTASA HMG-CoA HMG-CoA + 2NADPH + 2H+ HMG-CoA REDUCTASA Mevalonato + 2NADP + CoA--SH Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier El mevalonato y el colesterol formado, inhiben a la HMG-CoA Reductasa en el hígado, mediante activación de un FACTOR TRANSCRIPTOR DE UNA PROTEÍNA FIJADORA DE ELEMENTOS REGULADORES DE ESTEROL que provoca la represión de la transcripción de la HMGCoA REDUCTASA. Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Unidades Isoprenoides Mevalonato + ATP MEVALONATO-5Fosfotransferasa Mevalonato 5-Fosfato + ADP Mevalonato 5-Fosfato + ATP FOSFOMEVALONATO CINASA Mevalonato 5-Di-fosfato + ADP Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana 5-Pirofosfomevalonato + ATP PIROFOSFOMEVALONATO DESCARBOXILASA Iso-pentenil pirofosfato + ADP + CO2 + Pi UNIDAD ISOPRENOIDE. Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Unidades Isoprenoides Síntesis de Escualeno El escualeno se forma por la condensación de seis unidades isopreno: Iso-pentenil pirofosfato Isopentenil pirofosfato ISOMERASA dimetilalil-pirofosfato Dimetilalil-pirofosfato + Isopentenil pirofosfato PRENIL TRANSFERASA Geranil pirofosfato + PPi Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Escualeno Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier En el momento de obtener el FARNESIL pirofosfato, podemos encontrar las siguientes vías alternas (ajenas a la síntesis de Colesterol): PRENILO TRANSFERASA Dolicol TRANS-PRENILO TRANSFERASA Hemo Cadena lateral de la Ubiquinona Proteínas preniladas. Síntesis de Escualeno Geranil pirofosfato + Isopentenil pirofosfato PRENIL TRANSFERASA Farnesil pirofosfato + PPi 2 Farnesil pirofosfato + NADPH + H+ ESCUALENO SINTASA + Mg++ + Mn++ Escualeno + 2 P P i + NADP+ Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Escualeno Geranil pirofosfato + Isopentenil pirofosfato PRENIL TRANSFERASA Farnesil pirofosfato + PPi 2 Farnesil pirofosfato + NADPH + H+ ESCUALENO SINTASA + Mg++ + Mn++ Escualeno + 2 P P i + NADP+ Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Síntesis de Lanosterol El escualeno lineal se cierra para formar el esqueleto esteroideo por la acción en primer lugar de la Escualeno Epoxidasa Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Lanosterol 1ª Fase de la acción de la Oxidoescualeno Ciclasa: El 2,3-Oxidoescualeno se cicla para formar el catión protoesterol. La apertura del epóxido deja un centro deficiente de electrones que en su migración cierran los anillos. Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Síntesis de Lanosterol 2ª Fase de la acción de la Oxidoescualeno Ciclasa: Una serie de migraciones de grupos metilos e hídridos, seguidas por la eliminación de un protón del C9 para formar un doble enlace, forma el Lanosterol neutro. Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Conversión de Lanosterol en Colesterol Es un proceso de 19 pasos, que involucra una oxidación y la pérdida de tres grupos metilo. Para este proceso las enzimas necesitan estar enclavadas en la membrana del retículo endoplasmático. Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Resumen de la conversión de Escualeno a Colesterol Entre las reacciones finales no incluidas… Lanosterol + NADPH O2 14des-metil-lanosterol + O2 NADP NAD 14des-metil-lanosterol Cimosterol Cimosterol ISOMERASA ∆7-24 -colestadienol + NADP O2 Las últimas reacciones finales no incluidas… ∆7-24 -colestadienol + NADP + O2 Desmosterol (24-Dehidrocolesterol) Desmosterol + NADPH ∆24 –REDUCTASA Colesterol Las últimas reacciones finales no incluidas… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Estructura final del COLESTEROL… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Principales derivados Regulación Insulina (en la abundancia) + proteinfosfatasa reductasa cinasa inactiva. HMG-CoA-Reductasa Activa aumento síntesis de colesterol aumento de oxiesteroles menos síntesis de enzima reductasa Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Regulación Glucagón (en la escasez) Aumenta AMP’c Aumenta inhibidor-1-P activo Disminuye proteinfosfatasa --aumenta reductasa cinasa a --se inhibe (por fosforilación) HMG-CoA-reductasa --disminuye síntesis de colesterol Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Regulación de la Transcripción Una familia de factores transcripcionales, llamados SREBP (Sterol Regulatory Element Binding Proteins) regulan la síntesis de colesterol. SREBP-2 regula la síntesis de colesterol responde a los niveles celulares de esteroles Activa la transcripción de los genes de la enzima HMG-CoA Reductasa y del Receptor de LDL SREBP-1c regula la síntesis de ácidos grasos. Regulación de la Transcripción Inducción de HMG-CoA sintasa, HMG-CoA reductasa y del receptor de LDL, requiere la unión de SREBP-1 a la región promotora de los genes que codifican estas proteínas. Niveles bajos de colesterol permiten la liberación de SREBP-1 del ER, por activación de una proteasa, activando la transcripción. Niveles altos de colesterol mantienen inactiva dicha proteasa, reprimiendo la expresión genética de las enzimas mencionadas y del receptor de LDL. ARTERIOSCLEROSIS… el asesino silencioso… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier ARTERIOSCLEROSIS… el asesino silencioso… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier ARTERIOSCLEROSIS… el asesino silencioso… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier ARTERIOSCLEROSIS… el asesino silencioso… Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Fuente: Fundamentos de Bioquímica 2ª. Ed. Voet, Voet, Pratt. Editorial Panamericana Medbioq12.wordpress.com Hasta la próxima semana