11. micropropagación de cactáceas.
Anuncio

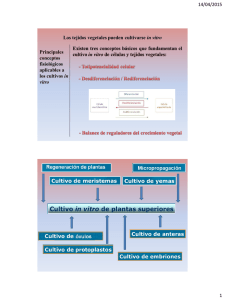
VII Simposium-Taller “Producción y Aprovechamiento del Nopal en el Noreste de México” MICROPROPAGACIÓN DE CACTÁCEAS Ma. del Carmen Ojeda-Zacarías, Humberto Rodríguez-Fuentes y Adriana Gutiérrez-Diéz Maestro-Investigador de la Facultad de Agronomía. Universidad Autónoma de Nuevo León. Campus de Ciencias Agropecuarias, Calle Francisco Villa s/n Col., ExHacienda El Canadá, Escobedo, N.L. C.P. 66054. Tel. 83974588. Correo electrónico: [email protected] Leobardo Iracheta-Donjuan Investigador del Instituto Nacional Investigaciones Forestales, Agrícolas y Pecuarias; Campo Campo Experimental Rosario Izapa,Tuxtla Chico Chiapas, México C.P.30870. RESUMEN La familia cactáceae requiere métodos alternativos de propagación puesto que en condiciones naturales son de lento crecimiento y pobre germinación en su hábitat natural. Los cactus tradicionalmente son propagados a partir de semillas o cortes los cuales suelen ser susceptibles a pudriciones; por lo que en los últimos años el cultivo in vitro se ha utilizado como una herramienta alternativa para la propagación de cactáceas. El objetivo del presente trabajo fue lograr desarrollar una técnica de micropropagación in vitro para Astrophytum capricorne, que garanticé la producción rápida por medio de esta técnica a gran escala. El tratamiento de desinfección que se utilizo fue el adecuado ya que la semilla logro germinar sin problema alguno; por otro lado, con respecto al desarrollo de la micropropagación, se utilizaron varios medios de cultivo para las diversas etapas de desarrollo; para la etapa de inducción se utilizó el medio MS adicionado con NaH2Po4 170 mg l-1 , BAP 3.0 mg l-1, NAA 1.0 mg l-1, 30 g de sacarosa y 5% de agar-gel, presentándose brotes apicales después de dos semanas de permanecer en este medio de cultivo; En cuanto a la etapa de proliferación de brotes se procedió a utilizar dos medios de cultivo con dos citocininas el primero con la adición de BAP y el segundo se adiciono con (BAP y cinetina). La evaluación de este último medio de cultivo presento diferencia significativa para la variable número de brotes. Posteriormente todos los brotes provenientes de los dos medios fueron transferidos al medio que contenía las dos citicininas donde permanecieron por 12 semanas en condiciones controladas de luz y temperatura, en este caso no existió diferencia significativa en la respuesta según el origen de los brotes; para el enraizamiento se utilizaron brotes obtenidos de la etapa anterior los cuales fueron establecidos en el medio de enraizamiento obteniendo buenos resultados a las 10 semanas del establecimiento. Palabras claves: Micropropagación, Astrophytum capricorne, cactáceae. Facultad de Agronomía, UANL y Museo Bernabé de las Casas. Mina, Nuevo León, México. Octubre 24 y 25, 2008 VII Simposium-Taller “Producción y Aprovechamiento del Nopal en el Noreste de México” INTRODUCCIÓN México es el país que alberga la mayor riqueza en especies de la familia Cactáceae ya que estas cumplen un papel muy importante en los aspectos ecológico, cultural, social, medicinal y económico, ya que algunos de sus frutos y tallos forman parte de la dieta alimenticia de los pueblos indígenas de zonas áridas y semiáridas del país; por otro lado, son utilizados como forraje, otras por su rareza y belleza como ornamentales las cuales llegan a tener costos elevados en dólares en Estados Unidos, Europa y Asia; con respecto a sus propiedades curativas contienen sustancias químicas de interés farmacológicos e industrial tales como alcaloides, saponinas y antibióticos, Con respecto al aspecto ecológico son plantas que se adaptan muy bien en suelos pobre de materia orgánica, son plantas que durante el día cierran sus estomas para evitar la evapotranspiración; por la noche los abren para absorber la humedad del aire además tienen en sus raíces micorrizas capaces de fijar el nitrógeno del aire; en cuanto a lo social y cultural es importante señalar que esta diversidad ha sido alterada por la modificación de sus ecosistemas, poniendo en riesgos a varias de ellas en serios problemas de sobrevivencia. Entre los factores que afectan a las poblaciones silvestres se encuentran la ganadería, agricultura, asentamientos humanos, construcciones de vías de comunicación, materiales para construcción y la extracción ilegal de plantas para el comercio nacional e internacional. Esto aunado a la pobre germinación y lento crecimiento en su hábitat natural. La familia comprende unas 2,000 especies de plantas principalmente en América Central y América del Sur, de las cuales alrededor de 715 especies de cactáceas existen en México, de éstas el 80% son endémicas las cuales crecen solamente en nuestro país. Destacan los géneros Mammillaria y Opuntia (los nopales son muy importantes en nuestra cultura) por su diversidad y distribución en el país (Sánchez and Hernández, 2002). Los cactos tradicionalmente son propagados a partir de semillas o cortes, en estos casos las plántulas tienden a ser de lento crecimiento y susceptibles a pudriciones. En contraste, el desarrollo de brotes, in vitro puede ser muy rápido, comparado con las plántulas obtenidas por métodos tradicionales. Las cactáceae son plantas de distribución restringida de lento crecimiento y difícil cultivo, es importante plantear estrategias de conservación y protección mediante técnicas de cultivo de tejidos. Por lo anterior, el objetivo del presente trabajo fue lograr desarrollar una técnica de micropropagación para el establecimiento in vitro de Astrophytum capricorne que garantice la producción rápida in Vitro, debido a que esta especie esta catalogada como una especie endémica y en peligro de extinción según la Norma Oficial NOMECOL-059- 2001. Teniendo como antecedentes programas que se desarrollan en otras instituciones del país para la conservación de especies de cactáceaas en preligo de desaparecer donde no solo se aplica la propagación por semillas sino también utilizando técnicas de Biotecnología vegetal utilizando el cultivo de tejidos vegetales (Chávez, et al., 2006). 144 Facultad de Agronomía, UANL y Museo Bernabé de las Casas. Mina, Nuevo León, México. Octubre 24 y 25, 2008 VII Simposium-Taller “Producción y Aprovechamiento del Nopal en el Noreste de México” MATERIALES Y METODOS Se procedió a seleccionar semillas que presentaban la membrana, con el propósito de obtener explantes en condiciones asépticas, las semillas se sometieron primeramente a un tratamiento de predesinfección, el cual consistió en mantenerlas en alcohol etílico al 96% por un minuto. Posteriormente se colocaron en peroxido de hidrogeno (H2O2) de 11 volúmenes, por 10 minutos, seguidos por una solución de hipoclorito de sodio (NaOCl) cuya presentación es del 6% de ingredientes activo grado comercial preparandose una solución del 20 % v/v; adicionando con dos gotas de Tween-20 por cada 100 ml de solución, con el propósito de obtener una mejor penetración del agente desinfectante, las semillas fueron sometidas por una bomba de vacío por 10 minutos. Una vez trascurrido el tiempo del tratamiento se procedió a realizar tres enjuagues con agua esterilizada bajo la campana de flujo laminar. Las semillas fueron establecidas en el medio de cultivo de (Murashinge Skoog, 1962) y bajo un diseño completamente al azar en un cuarto de incubación a una temperatura de 25 ºC ºC ± 2, con un fotoperiodo de 16 horas luz y ocho de obscuridad este medio fue adicionado con vitaminas y reguladores de crecimiento. Etapa de inducción Se utilizo el medio (MS) adicionado con BAP 3.0 mg l-1, NAA 1.0 ml g-1 y NaH2 PO4 170 mg l-1 se ajusto el pH 5.5, el medio fue dosificado en frascos de vidrio de 130 ml de capacidad, fueron esterilizados a una temperatura de 121 ºC y 15 atmósferas de presión por 15 minutos. Posteriormente las plántulas que germinaron se cortaron a la mitad utilizando únicamente el brote apical el cual fue colocado en frascos de vidrio con los medios de cultivo en estas condiciones permanecieron por 6 semanas, bajo condiciones de controladas de luz y temperatura. Etapa de proliferación de brotes Fueron utilizados dos medios de cultivo en esta etapa, el medio uno fue adicionado con 5.0 mg l-1 de BAP 0.1 mg l-1 de NAA, mientras que el medio dos utilizo la BAP a 0.2 mg l-1 y cinetina a 0.2 mg l-1 adicionado con NaH2PO4 170 mg l-1 además en ambos medios se adiciono una solución de vitaminas. Aquí se trasfirieron inóculos de dos cm de longitud en ambos medios de cultivo, se establecieron ocho repeticiones por tratamiento procediéndose a colocar en un cuatro de incubación con fotoperíodo y temperatura controlada, en estas condiciones permanecieron por 12 semanas. Etapa de enraizamiento Para esta etapa se siguió utilizando el medio MS eliminando los reguladores de crecimiento y al 50% de su concentración original más 2.0 mg l-1 de IBA en estas condiciones estuvieron por 10 semanas. RESULTADOS Y DISCUSIÓN La técnica de desinfección utilizada en este experimento fue la adecuada ya que las semillas lograron germinar sin ningún problema. Lo anterior coincide con lo mencionado por Roca y Mroginski, 1991, quienes mencionan que el NaOCl en 145 Facultad de Agronomía, UANL y Museo Bernabé de las Casas. Mina, Nuevo León, México. Octubre 24 y 25, 2008 VII Simposium-Taller “Producción y Aprovechamiento del Nopal en el Noreste de México” concentraciones de 1% a 3% es un agente muy útil como germicida, por lo que, por mucho tiempo ha sido utilizado como esterilizante superficial en los tejidos vegetales. Etapa de Inducción Después de dos semanas de la siembra se hicieron evidentes la formación de estructuras nodulares semejantes a callo sobre la superficie del corte, lo anterior puede atribuirse a la utilización y combinación de las citocininas y auxinas que estimulan el crecimientote de los callos en cactáceas (Mauseth, 1977). Etapa de proliferación Después de 12 semanas de la siembra se evaluó el número de brotes formados a partir de ambos medios de cultivo. Los resultados se muestran en el Cuadro 1. Cuadro 1. Comparación de medias para la variable número de brotes de Astrophytum capricorne. (Después de 12 semanas de la siembra). Tratamientos Medias BAP y Cinetina 29.50a BAP 8.75 b La diferencia en la respuesta puede atribuirse a que el medio uno tenia una combinación de auxina y citocinina, mientras que el medio dos incluía dos citocininas; se sabe que normalmente en la micropropagación las citocininas se utilizan para romper el reposo de las yemas laterales en cactáceas, se considera que el área meristematica está incluida en el tejido de las areolas (Fay y Gratton, 1991). Posteriormente todos los brotes fueron transferidos al medio dos que contenía las dos citocininas de la misma manera se evaluó el número de brotes después de 12 semanas del subcultivo. El análisis de varianza no mostró diferencia significativa entre tratamientos. La respuesta puede estar relacionada que una vez colocados los brotes del medio uno en el medio dos con alto contenido de citocininas, el número de brotes puede ser incrementado debido a que los meristemos que permanecían parcialmente en reposo, fueron inducidos a la diferenciación de brotes (Ault y Blackmon, 1987). Etapa de enraizamiento Después de 10 semanas que se establecieron en el medio de cultivo para enraizamiento se pudieron observar abundante número de raíces en todas las unidades experimentales. CONCLUSIONES * La técnica de desinfección utilizada fue la adecuada para la especie estudiada. * Se logro desarrollar una técnica de micropropagación para el establecimiento in vitro de Astrophytum capricorne, que garantice la producción rápida in vitro. 146 Facultad de Agronomía, UANL y Museo Bernabé de las Casas. Mina, Nuevo León, México. Octubre 24 y 25, 2008 VII Simposium-Taller “Producción y Aprovechamiento del Nopal en el Noreste de México” REFERENCIAS Ault, J.R. and W.J. Blackmon. 1987. In vitro propagation of Ferocactus acanthodes (Cactaáceae).22:(126-127). Chávez, R., Sánchez, E., Hernández, M . Hernandez –Oria, J.G.& R. Hernández. 2006. Propagación de especies amenazadas de la familia cactáceae del semidesierto Queretaro. Bol. Soc. Latin. Carib.Cact. Suc. 3(2):9-13. Fay,M.F and J Gratton. 1991. Tisuue culture of cacti and other succulents-a literature review and a report of micropropagation of kew. Micropropagation unit, royal botanic gardens. Richmond, Surrey.V.K. Mauseth, J.D. 1977. cactus. Tissue culture: A potential method of propagation. Cact. & Succ. J. (U.S.) 59: 80-81. Murashige,T., and Skoog. 1962. A revised medium for rapid growth and bioassay with tobacco tisuee culture. Physiol. Plant. 15:473-479. Norma Oficial Mexicana NOM-ECOL-059-2001, que determina las especies de flora y fauna silvestres terrestres acuáticas en peligro de extinción, amenazadas, raras y las sujetas a protección especial y que establece especificaciones para su protección. Diario Oficial. Roca, W.M. y L.A. Mroginski. 1991. Establecimiento de cultivo de tejidos in Vitro en : W.M. Roca y L.A. Mroginski (Ed). Cultivo de tejidos en la agricultura. CIAT. Colombia 12-13. Sánchez, E. and M.M. Hernández. 2002. Propagation of Mexicana cacti threatened with extinction. Cactus and Succulent Journal. 74 (1): 17-21. 147 Facultad de Agronomía, UANL y Museo Bernabé de las Casas. Mina, Nuevo León, México. Octubre 24 y 25, 2008