Guía Laboratorio de Análisis Elemental Cualitativo
Anuncio
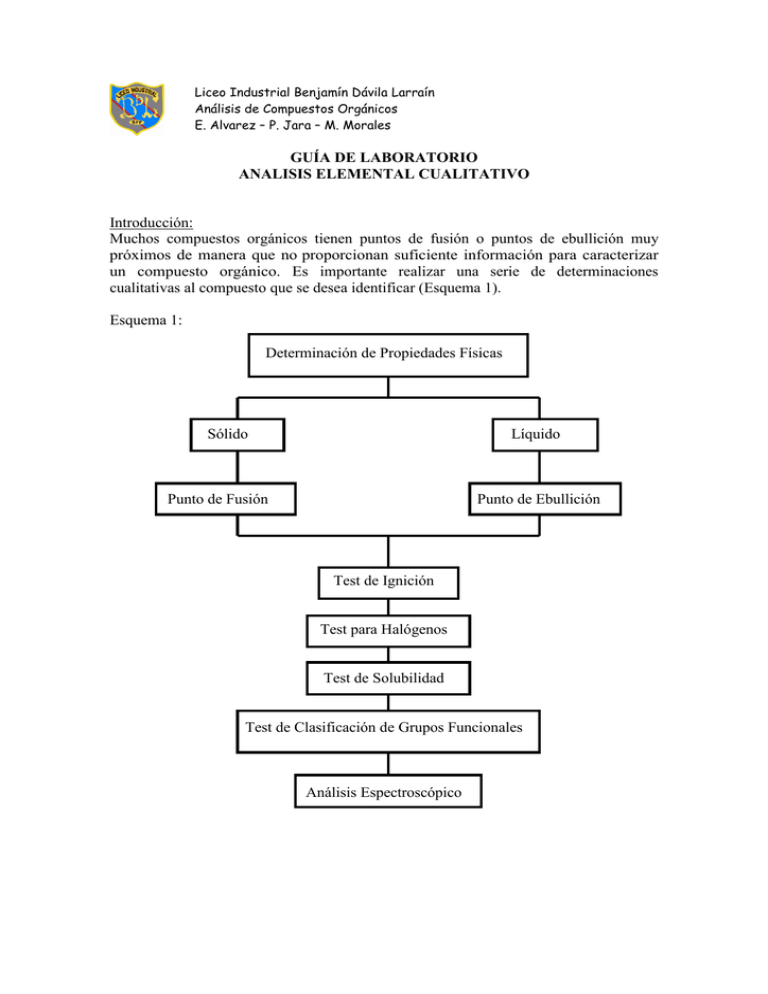
Liceo Industrial Benjamín Dávila Larraín Análisis de Compuestos Orgánicos E. Alvarez – P. Jara – M. Morales GUÍA DE LABORATORIO ANALISIS ELEMENTAL CUALITATIVO Introducción: Muchos compuestos orgánicos tienen puntos de fusión o puntos de ebullición muy próximos de manera que no proporcionan suficiente información para caracterizar un compuesto orgánico. Es importante realizar una serie de determinaciones cualitativas al compuesto que se desea identificar (Esquema 1). Esquema 1: Determinación de Propiedades Físicas Sólido Líquido Punto de Fusión Punto de Ebullición Test de Ignición Test para Halógenos Test de Solubilidad Test de Clasificación de Grupos Funcionales Análisis Espectroscópico Los elementos que se encuentran con más abundancia en los compuestos orgánicos, en el orden aproximado, son C, H, O, Cl, S, Br, I, F, P, siendo la abundancia para los metales Na, K, Ca, Fe, Hg, Cu, etc. El reconocimiento de carbono e hidrógeno se puede llevar a cabo mediante un ensayo previo de ignición o en forma más categórica, calentando la muestra con un oxidante (CuO) y reconociendo el carbono como dióxido de carbono e hidrógeno como agua. El nitrógeno, azufre y halógenos, en compuestos orgánicos, no pueden ser identificados directamente, pues generalmente están unidos mediante enlace covalente y con los más variados estados de oxidación. En consecuencia, el compuesto orgánico debe ser sometido a un tratamiento preliminar, para reducir estos elementos químicos e identificarlos como iones inorgánicos X-, S2- y CN-. Objetivo general: - Conocer las técnicas para la determinación cualitativa de elementos químicos. Objetivos específicos: - Identificar carbono e hidrógeno mediante el método de ignición. Identificar carbono e hidrógeno mediante oxidación catalizada con CuO. Investigar la presencia de nitrógeno, azufre, y halógeno, en una muestra dada mediante el método de fisión alcalina o método de Lassaigne. Teoría: En la caracterización de un compuesto orgánico es esencial conocer los elementos químicos que lo forman. Sin embargo, para que los ensayos cualitativos tradicionales puedan ser aplicados, los elementos deben ser transformados desde su forma covalente, en la que generalmente se encuentran, a iones sencillos. Una gran cantidad de sustancias orgánicas, sometidas a combustión, produce hollín y vapor de agua. Este ensayo no es definitivo, puesto que no todos los compuestos orgánicos dejan residuo. Si la llama que se produce es luminosa y queda un pequeño residuo, es casi seguro que la sustancia que se esta analizando es orgánica (contiene carbono). Simultáneamente, se produce agua en forma de vapor, lo cual confirma la presencia de hidrógeno en la muestra. Los gases de una combustión completa de materia orgánica, deben ser: agua, dióxido de carbono, más otros elementos presentes en ésta. La combustión completa se logra utilizando óxido cúprico como catalizador. Los gases son recibidos en un recipiente que contiene agua de cal (solución decantada de hidróxido de calcio), el dióxido de carbono reacciona con el calcio, formando el carbonato respectivo que se presenta como precipitado en la reacción. Para poder observar el agua, que es producto de la reacción química, se monta un sistema que impide que el vapor de agua escape a la atmosfera; este queda condensado en la pared del tubo en forma de gotas. El oxígeno no se puede determinar por análisis de este tipo. Para determinar la presencia de nitrógeno, azufre o algún halógeno, se somete la muestra a la fusión con sodio (Método de Lassaigne) y sus respectivas variantes, mediante la cual estos elementos se transforman en iones fácilmente identificables. C x H y O z S m N n X l (materia orgánica ) + Na → Na 2 S + NaCN + NaX + NaOH Para el reconocimiento de halógenos se emplea el test de Beilstein, con este se aprecia la coloración verde-azulado de los halogenuros de cobre. Los halógenos, al ser calentados con un alambre de cobre a la llama oxidante del mechero, producen una coloración verde, debido a la formación de haluros de cobre volátiles. Esta propiedad se puede utilizar para confirmar la presencia de halógenos, La prueba no es definitiva, debido a que algunos compuestos orgánicos, que no poseen halógeno, dan también positivo con este test, así que se utiliza sólo para confirmar, después de realizado el ensayo con AgNO3. PARTE EXPERIMENTAL MATERIAL Gradilla con 12 tubos Cápsula de porcelana Mechero, trípode y rejilla Pinza de madera Pinza metálica Espátula Vaso pp. 250 mL Embudo, portaembudo Papel filtro Tubo de bohemia Tubo acodado para tubo de ensayo REACTIVOS Na metálico Agua de cal Nitroprusiato de sodio FeSO4 Ácido acético HNO3 al 10% Acetato de Pb al 10% H2SO4 al 10% AgNO3 al 5% Alambre de Cu CuO Procedimiento: 1) Identificación de carbono por método de ignición: PRECAUCIÓN: UTILIZAR LENTES PROTECTORES. 1.1.- En líquidos: Aplique la llama del mechero a dos gotas de cada uno de los siguientes compuestos (colocadas sobre azulejo): a) Benceno, b) EtOH, c) Glicerina, d) CCl4, e) Éter de petróleo. 1.2.- En sólidos: Sobre un azulejo o en la misma espátula, coloque 0,1 g (una punta de espátula) de cada uno de los siguientes compuestos y aplique la llama directamente. a) Ácido oxálico, b) Sacarosa, c) Urea, d) Carbonato de cálcio, e) Magnesio. 2) Identificación de carbono e hidrógeno mediante oxidación catalizada por CuO. Mase 1.0 g de CuO y caliéntelo fuertemente en una cápsula de porcelana para secarlo. Una vez frío, tome aproximadamente 1/3 del total y mézclelo con 0,1 g de la sustancia problema (por ejemplo, ácido oxálico) y colóquelo en un tubo de ensayo. A continuación, agregue el resto del CuO al tubo de ensayo. Con este tubo, instale un aparataje como el que muestra la figura 1. Figura 1: Caliente el tubo que contiene la muestra. [O ] C + CuO → CO2 ( gas ) CO2 + Ba (OH ) 2 → BaCO3 ( pp. blanco) + H 2 O Este precipitado se disuelve en medio ácido. BaCO3 + HCl → BaCl 2 + CO2 + H 2 O El hidrógeno al oxidarse forma gotas de agua en el tubo. [O ] 4 H + CuO → 2H 2O 3) Método de Laissaigne (Fusión con Na). PRECAUCION: EL SODIO CALIENTE ES UNA SUSTANCIA POTENCIALMENTE PELIGROSA, AUN MÁS, ALGUNOS COMPUESTOS ORGÁNICOS SE DESCOMPONEN VIOLENTAMENTE CUANDO ELLOS SON CALENTADOS CON ESTE METAL. NUNCA DIRIJA EL TUBO DE ENSAYO HACIA UN COMPAÑERO O HACIA UD. Experimento 3.1: Utilizando la espátula, corte un trocito de Na del tamaño aproximado de una lenteja, sujételo con una pinza crisolera, (NO LO TOME CON LA MANO) Y séquelo entre papel filtro. Límpielo de óxido y coloque el sodio en un tubo de ensayo de 5 cm de largo por 0,5 cm de ancho. Caliente el tubo hasta que funda el sodio y sus vapores asciendan hasta la mitad; quítelo de la llama y agregue rápidamente unas 4 gotas o una punta de espátula (0.2 g aproximadamente) de la muestra problema. ∆ C , H , O, N , S , X + Na → NaCN + Na 2 S + NaX + NaOH EtOH + Na → EtONa + H 2 Luego de calentar al rojo durante un minuto, deje enfriar y agregue 1 mL de EtOH; espere un par de minutos. Caliente otra vez el tubo encendiendo el alcohol y, estando el tubo al rojo, sumérjalo rápidamente en un vaso precipitado de 100 mL con unos 20 ml de agua destilada. El tubo debe romperse. Hierva esta solución unos minutos y fíltrela. Debe resultar un líquido incoloro y transparente que debe conservar para los siguientes experimentos: Experimento 3.2: Identificación de azufre, reconocimiento del anión sulfuro (S2-). a) Acidifique unos 2 mL de filtrado con ácido acético y a continuación agregue solución de acetato de Pb. Un precipitado negro o pardo de sulfuro de plomo indica azufre. Na 2 S + (CH 3COO ) 2 Pb → PbS ↓ +2CH 3 COONa b) A otros 2 mL de la solución agregue gotas de disolución de nitroprusiato de Na fresca, o simplemente, un pequeño cristal del reactivo. Un color violeta intenso significa que la solución contiene S2-. Na 2 S + Na 2 [ Fe(CN ) 5 NO] → Na3 [ Fe(CN ) 5 NaSNO] Experimento 3.3: Identificación de nitrógeno, reconocimiento del ion cianuro (CN-). A 2 mL de solución agregue unos cristales de FeSO4. Caliente suavemente unos minutos y agregue gotas de ácido sulfúrico diluido. Un precipitado azul (ferrocianuro férrico o azul de Prusia) o el hecho de que la solución adquiera ese tono azul, indica la presencia de nitrógeno en la muestra problema. 6 NaCN + FeSO4 → Na 4 [ Fe(CN ) 6 ] + Na 2 SO4 3 Na 4 [ Fe(CN ) 6 ] + 2 Fe2 ( SO4 ) 3 → Fe4 [ Fe(CN ) 6 ]3 + 6 Na 2 SO4 Experimento 3: Ensayo de Beilstein. Con el fin de limpiar de impurezas, se calienta el alambre de cobre (doblado en el extremo en forma de anillo) en la llama del mechero. Una vez limpio, se enfría el alambre y se toca con él la sustancia problema. A continuación, se lleva a la llama del mechero. Una coloración verde indica la presencia de halógenos (se debe tener presente las limitaciones del método). Experimento 4: Identificación de halógenos, reconocimiento del ion halogenuro (X-). Acidifique 2 mL de la muestra con ácido nítrico diluido (10%) y hiérvalos por 2 minutos. Deje enfriar y agregue unas gotas de solución de nitrato de plata al 5%; la reacción será positiva si aparece un abundante precipitado de haluro de plata. NaX + AgNO3 → AgX ↓ + NaNO3 - Cloruro de plata: El cloruro de plata es un precipitado blanco, que por acción de la luz se torna violeta oscuro. Este precipitado es soluble en NH4OH y vuelve a precipitar si se agrega ácido nítrico. NaCl + AgNO3 → AgCl ↓ + NaNO3 AgCl + 2 NH 3 → [ Ag ( NH 3 ) 2 ]Cl [ Ag ( NH 3 ) 2 ]Cl + HNO3 → AgCl ↓ +2 NH 4 NO3 - Bromuro de plata: El bromuro de plata es un precipitado amarillo crema. Es parcialmente soluble en NH4OH. NaBr + AgNO3 → AgBr ↓ + NaNO3 - Yoduro de plata: El yoduro de plata es un precipitado amarillo que es insoluble en NH4OH. NaI + AgNO3 → AgI ↓ + NaNO3







