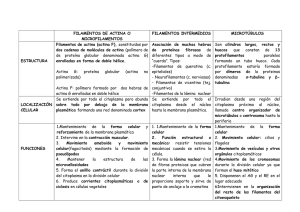
efectos de filamentos de actina sobre la estructura y lisis de
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k 2 151 517 kInt. Cl. : C12Q 1/28, C12N 9/76 11 Número de publicación: 7 51 ESPAÑA C12N 5/00, G01N 31/00 G01N 33/48, G01N 33/86 C07K 1/00, A61K 31/00 A61K 38/00 k TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 93919997.2 kFecha de presentación : 13.08.1993 kNúmero de publicación de la solicitud: 0 655 089 kFecha de publicación de la solicitud: 31.05.1995 T3 86 86 87 87 k 54 Tı́tulo: Efectos de filamentos de actina sobre la estructura y lisis de coágulos de fibrina. k 73 Titular/es: k 72 Inventor/es: Janmey, Paul A.; k 74 Agente: Elzaburu Márquez, Alberto 30 Prioridad: 14.08.1992 US 929203 BRIGHAM AND WOMEN’S HOSPITAL 75 Francis Street Boston, Massachusetts 02115, US 45 Fecha de la publicación de la mención BOPI: 01.01.2001 ES 2 151 517 T3 45 Fecha de la publicación del folleto de patente: 01.01.2001 Aviso: k k Lamb, Jennifer A.; Lind, Stuart E. y Stossel, Thomas P. k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 ES 2 151 517 T3 DESCRIPCION Efectos de filamentos de actina sobre la estructura y lisis de coágulos de fibrina. Campo de la invención La invención se refiere, en general, a métodos terapéuticos y diagnósticos para el tratamiento de pacientes con lesión en los tejidos, en los que la actina extracelular libre está asociada con coágulos sanguı́neos. La presente invención se refiere a un método para determinar la cantidad de actina presente en un coágulo de fibrina. El método implica la determinación in vitro de la cantidad de actina en el coágulo, por incubación de dicho coágulo in vitro con proteı́nas que fijan actina. La invención se refiere especı́ficamente a la incubación de tales coágulos en presencia de las proteı́nas del plasma que fijan actina, gelsolina y proteı́na que fija vitamina D. La invención se dirige también a métodos para retirar la actina de los coágulos sanguı́neos in vivo, por administración de proteı́nas que fijan actina a sujetos con coágulos sanguı́neos. Fundamentos de la invención La lesión en los tejidos da como resultado la activación de la cascada de coagulación, que conduce a la deposición de fibrina. Durante los eventos inflamatorios, moléculas que no se encuentran normalmente en el plasma pueden acceder al espacio extracelular, afectando potencialmente a la coagulación de la sangre. Algunas de estas moléculas pueden proceder de la acción de las proteasas celulares sobre los componentes normales del plasma (por ejemplo, el fibrinógeno), la liberación de gránulos de células inflamatorias o la ruptura de las membranas del plasma celular. Estudios extensos acerca de los efectos de los productos de degradación del fibrinógeno sobre la formación de coágulos de fibrina (Shen et al., J. Biol. Chem. 252, 6184 (1977)) han suministrado información importante acerca de los mecanismos por los que los eventos inflamatorios conducen a alteraciones en el proceso de coagulación de la sangre. Las moléculas que alteran la formación de geles de fibrina y la estructura de los coágulos (Dhall et al., Thromb. Haemost. 35, 737 (1976); Carr y Gabriel, J. Lab. Clin. Med. 96, 985 (1980); Gabriel et al., J. Lab. Clin. Med. 101, 545 (1983); Chow et al., Thromb. Res. 29, 243 (1983); Carr et al., J. Lab. Clin. Med. 110, 747 (1987); Kamykowski et al., Biophys. Chem. 13, 25 (1981); Procyk y King, Biopolymers 29, 559 (1990)), pueden jugar un papel en la determinación de la eficacia hemostática de los coágulos de fibrina, ası́ como de su capacidad para mediar en la fibrinolisis dependiente de la fibrina (Suenson y Petersen, Biochim. Biophys. Acta 870, 510 (1986); Dhall et al., Thromb. Haemost. 49, 42 (1983)). La lesión en los tejidos animales da como resultado la liberación de actina al espacio extracelular, incluyendo la corriente sanguı́nea. La actina es la proteı́na más abundante en las células animales y constituye 10 a 20 % de la proteı́na de muchas células nucleadas y 30 % de la proteı́na de las células de los músculos. Las moléculas de actina fijan, cada una de ellas, una molécula de ATP y se autoensamblan para dar filamentos largos, 2 5 10 15 20 25 30 35 40 45 50 55 60 65 2 durante lo cual el ATP se hidroliza a ADP. Aunque aproximadamente la mitad de la actina de las células que no son de los músculos es actina-F (la forma de filamento de doble hélice, de tipo de varilla, que se ensambla a partir de los monómeros de actina-G), las condiciones iónicas de los fluidos extracelulares favorecen la polimerización de la actina, de modo que virtualmente toda la actina liberada a la sangre desde las células que mueren, cabrı́a esperar que se polimerizase en filamentos (Lind et al., Am. Rev. Respir. Dis. 138, 429-34 (1988)). En soluciones purificadas, en ausencia de proteı́nas que acortan los filamentos, los filamentos de actina pueden alcanzar fácilmente longitudes de varios micrómetros. Sin embargo, si alguna fracción de la actina liberada de las células lesionadas fuese desnaturalizada irreversiblemente, o bien se uniese a una de las proteı́nas intracelulares que fijan actina, discutidas a continuación, esta actina permanecerı́a monomérica. Se ha encontrado actina a concentraciones micromolares en el plasma o suero de animales y seres humanos que experimentan una variedad de tipos de lesión en los tejidos (Smith et al., J. Lab. Clin. Med. 110, 189 (1987); Smith et al., Am. J. Pathol. 130, 261 (1988); Smith et al., Blood 72, 214 (1988); Goldschmidt-Clermont et al., Gastroenterology 94, 1454 (1988); Lee et al., Hepatology 7, 825 (1987); Lee et al., Circ. Shock 28, 249 (1989); Lind et al., Am. Rev. Resp. Dis. 138, 429 (1988)). In vitro, esta proteı́na globular se ensambla para dar filamentos del tipo de varilla, de muchos micrómetros de longitud; e in vivo, experimenta intercambios rápidos entre formas monoméricas y poliméricas, un proceso regulado en el citoplasma por varias proteı́nas que fijan actina (Stossel et al., Ann. Rev. Cell Biol. 1, 353 (1985)). Cuando se añaden a soluciones de fibrinógeno, los filamentos de actina pueden interferir con el proceso de formación de coágulos de fibrina, al impedir estéricamente la difusión de protofibrillas de fibrina para dar lugar a haces (Janmey et al., Biochim. Biophys. Acta 841, 151 (1985)). Debido a las grandes cantidades de actina que hay en las células, la liberación de la actina de las células que mueren suministra suficiente actina para que tenga un efecto significativo sobre el micromedio, por aumento de la viscosidad de los fluidos extracelulares del plasma, por atrapamiento de las células, por otros efectos tóxicos todavı́a no identificados, y, como se discute más abajo, por cambio de las propiedades fisicoquı́micas de los coágulos de fibrina. La incorporación de actina extracelular libre es tóxica para los tejidos animales, y especialmente para los sistemas renal y cardiopulmonar (Harper et al., Clin. Res. 36, 625A (1988); Haddad et al., Proc. Natl. Acad. Sci. USA 87, 1381-85 (1990)). El fallo renal agudo es una complicación de una lesión muscular, y las infiltraciones de actina en ratas causan elevaciones transitorias del BUN y de los niveles de creatinina, coherentes con el fallo renal. Además, puesto que cada molécula de actina extracelular en un filamento tiene una molécula de ADP asociada con ella, la presencia de actina extracelular en la sangre puede tender a inducir o aumentar la agregación de las plaquetas, en una 3 ES 2 151 517 T3 manera que puede no ser ventajosa para el hospedante (Lind et al., Am. Rev. Respir. Dis. 138, 429-34 (1988); Scarborough et al., Biochem. Biophys. Res. Commun. 100, 1314-19 (1981)). Hay muchas proteı́nas que de un modo natural se asocian con la actina (para una revisión de las proteı́nas que fijan actina, véanse Stossel et al., Ann. Rev. Cell Biol. 1, 353-402 (1985); Pollars et al., Ann. Rev. Biochem. 55, 987-1035 (1986)). Se cree, sin embargo, que hay dos proteı́nas, gelsolina (también llamada “brevina” y “factor despolimerizante de la actina”) y la proteı́na que fija vitamina D (también llamada globulina Gc) (DBP), que son principalmente responsables de la fijación de actina extracelular (Janmey et al., Blood 70, 529-30 (1987)). El plasma de la sangre de los mamı́feros contiene concentraciones micromolares de estas dos proteı́nas, que se unen a la actina con alta afinidad (Jammey y Lind, Blood 70, 524 (1987)). Las proteı́nas que fijan actina con alta afinidad se unen a la actina con una Kd inferior a 10−8 . Ambas, gelsolina y DBP, se unen a la actina en el suero y tienen actividad despolimerizante de la actina. La DBP fija preferencialmente la actina monomérica, mientras que la gelsolina fija preferencialmente filamentos de actina. El documento WO-A-9115770 describe un método para disminuir la concentración de actina libre en el plasma de animales, que comprende la administración de proteı́nas que fijan actina, por ejemplo, gelsolina. La gelsolina es una proteı́na multifuncional que fija actina, obtenida del citoplasma y fluidos extracelulares de los mamı́feros. La gelsolina del plasma difiere de la gelsolina celular sólo por la adición de 25 aminoácidos en el extremo amino de la molécula, y ambas gelsolinas son producto de un gen único. La gelsolina del plasma tiene tres sitios de fijación de actina y se une con alta afinidad a la actina-G ó a la actina-F. La gelsolina del plasma fija una segunda molécula de actina con una afinidad mayor que la correspondiente a la fijación de una primera molécula de actina, y por consiguiente, forma complejos 2:1 con preferencia a los complejos 1:1, y fija filamentos con preferencia a monómeros. Cuando se añade a la actina-F, la gelsolina del plasma separa el filamento de un modo no proteolı́tico y permanece unida a un extremo del nuevo filamento formado. Si están presentes moléculas de gelsolina libre, éstas separarán el filamento de actina de manera sucesiva, hasta que sólo haya presentes complejos de actina-gelsolina 2:1, despolimerizando ası́ rápidamente al filamento. Las moléculas de gelsolina libre y complejada (con actina), difieren en sus propiedades funcionales. Aunque la gelsolina libre puede separar los filamentos de actina, los complejos de actinagelsolina no pueden. La función primaria de la gelsolina en el plasma es separar los filamentos de actina. Si la gelsolina está presente en exceso respecto a la actina, sólo resultarán complejos de gelsolinaactina; si la actina está en exceso muy grande, hay oligómeros de actina libre y complejos de gelsolina-actina. La separación de la actina tiene lugar por medio de una escisión no pro- 5 10 15 20 25 30 35 40 45 50 55 60 65 4 teolı́tica del enlace no covalente entre moléculas de actina adyacentes (subunidades). La actividad de separación de la gelsolina se incrementa por concentraciones micromolares de Ca2+ , y se ha puesto de manifiesto que se inhibe por el fosfatidil-inositol-bisfosfato (PIP2) y por el fosfatidil-inositol-monofosfato (PIP). Puesto que las concentraciones de Ca2+ extracelular están a niveles milimolares y los fluidos extracelulares no contienen normalmente PIP ó PIP2 en una forma que inhiba la gelsolina, la gelsolina del plasma es constitutivamente activa en los fluidos extracelulares. La proteı́na que fija vitamina D (DBP), por su parte, tiene un solo sitio de fijación de actina y se une sólo a la actina monomérica (Van Baelin et al., J. Biol. Chem. 255, 2270 (1980); Haddad, J.G., Arch. Biochem. Biophys. 213, 538 (1982)). Ambas, la gelsolina del plasma y la DBP, sirven para desalojar a la actina de la circulación (Lind et al. J. Clin. Invest. 78, 736 (1986); Harper et al., J. Clin. Invest. 79, 1365 (1987); GoldschmidtClermont et al., J. Clin. Invest. 81, 1519 (1988)). Se ha puesto de manifiesto recientemente que la DBP previene la trombosis microvascular ocasionada por la inyección de actina monomérica a animales experimentales (Haddad et al., Proc. Natl. Acad. Sci. USA 87, 1381 (1990)). La gelsolina del plasma y DBP constituyen ası́ un sistema de defensa diseñado para proteger al hospedante frente a los efectos perjudiciales de la actina liberada a la circulación. Se ha sugerido que la unión de actina extracelular a la gelsolina o a DBP protege frente a la formación de actina-F en la circulación, y puede ser el mecanismo por el que dicha actina se hace diana para su eliminación de la corriente sanguı́nea (Lind et al., J. Clin. Invest. 78, 736-42 (1986); Sanger et al., Clin. Res. 36, 625A (1988)). Por ejemplo, es sabido que se encuentran complejos de actina-gelsolina en la circulación después de una lesión del pulmón inducida por ácido oleico en conejos y gatos (Smith et al., Am. J. Path. 130, 261-67 (1988)), y en la hemolisis inducida por fenil-hidrazina en conejos (Smith et al., Blood 72, 214-18 (1988)). En el marco clı́nico, los niveles de gelsolina disminuyen en pacientes que padecen el sı́ndrome de dolor respiratorio de adultos (ARDS) (Lind et al., Am. Rev. Resp. Dis. 138, 429-34 (1988)), y en el plasma de pacientes que padecen infección aguda de malaria falciparum (Smith et al., Blood 72, 214-18 (1988)), y en la sangre de tales pacientes son detectables complejos de gelsolina-actina. Asimismo, se han observado complejos de actina con DBP en el plasma de pacientes que padecen necrosis hepática fulminante (Young et al., J. Lab. Clin. Med. 110, 83 (1987)). También se ha sugerido que una vez que se ha rebasado la capacidad de las proteı́nas del plasma para fijar actina extracelular libre, puede detectarse la formación de filamentos intravasculares y la lesión endotelial (Harper et al., Clin. Res. 36, 625A (1988); Haddad et al., Proc. Natl. Acad. Sci. USA 87, 1381-89 (1990)). La gelsolina ha sido clonada (Kwiatkowski et al., Nature 325, 455-58 (1986); Kwiatkowski et al., J. Cell. Biol. 106, 375-84 (1988)) y se han 3 5 ES 2 151 517 T3 identificado fragmentos de la proteı́na nativa que retienen la capacidad de fijar la actina (Bryan, J., J. Cell Biol. 106, 1553-62 (1988); Yin et al., J. Cell. Biol. 107, 465a (1988), resumen n◦ 2616; Kwiatkowski et al., J. Cell. Biol. 108, 1717-26 (1989); Way et al., J. Cell. Biol. 109, 593-605 (1989)). DBP también ha sido clonada (Cooke et al., J. Clin. Invest. 76, 2420-24 (1985); Yang et al., Proc. Natl. Acad. Sci. USA 82, 7994-98 (1985)). La hemostasis depende de un equilibrio entre la formación y la disolución de coágulos compuestos de redes de fibrina y proporciones variables de otras proteı́nas del plasma y células de la sangre. Estas redes se forman por la polimerización de monómeros de fibrina en protofibrillas, y la posterior asociación lateral de las protofibrillas en haces, que tiene lugar in vivo en una mezcla compleja (y potencialmente variable) de otras proteı́nas. Puesto que la formación de coágulos de fibrina es sensible a los efectos de las macromoléculas que impidan la difusión de las cadenas polı́meras en crecimiento, varias moléculas fisiológicamente importantes, tales como IgG, fibronectina, albúmina, glucosamino-glucanos, etc. (Carr y Gabriel, J. Lab. Clin. Med. 96, 985 (1980); Gabriel et al., J. Lab. Clin. Med. 101, 545 (1983); Carr et al., J. Lab. Clin. Med. 110, 747 (1987); Carr et al., J. Lab. Clin. Med. 107, 199 (1986); Carr et al., Thromb. Res. 45, 539 (1987); Carr et al., Biochemistry 28, 1384 (1989)), alteran la estructura de los geles de fibrina. Muchas de estas sustancias son componentes normales del plasma, y pueden explicar, en parte, las diferencias conocidas entre los coágulos del plasma y los formados a partir de fibrinógeno purificado. Los estudios de estos efectos sobre los coágulos de fibrina han sugerido mecanismos por los que los eventos inflamatorios conducen a alteraciones en el proceso de coagulación de la sangre (Carr, M.E., Thromb. Haemost. 59, 535 (1988)). Sin embargo, los coágulos que se forman en los sitios de lesión en los tejidos es probable que sean diferentes de los preparados a partir de plasma normal, y pueden contener proteı́nas liberadas de plaquetas, glóbulos blancos, células endoteliales u otros tipos de células lesionadas, ası́ como proteı́nas en fase aguda. Mientras que mucha investigación anterior sobre la sangrı́a y las tendencias trombóticas observadas en pacientes que padecen diferentes formas de lesión en los tejidos, se ha centrado en la distorsión de la regulación de los sistemas de coagulación y fibrinolı́tico, conocida conjuntamente como coagulación intravascular diseminada, se ha prestado poca atención a la estructura y función de los coágulos que se forman en tales pacientes, que podrı́an estar alterados de modos clı́nicamente significativos. Por ejemplo, los cambios conformacionales en los coágulos de fibrina pueden volverlos más susceptibles a su ruptura por fuerzas mecánicas, sea que se encuentren de modo natural en el sistema vascular o que se impongan por dispositivos médicos, tales como oxigenadores de membrana o ventiladores mecánicos. Alternativamente, las alteraciones en la estructura de los coágulos pueden afectar a su sensibilidad a la plasmina de las proteı́nas fibrinolı́ticas, volviéndolos resistentes a la acción 4 5 10 15 20 25 30 35 40 45 50 55 60 65 6 de la plasmina, de una manera análoga a la comunicada para un paciente que padecı́a una disfibrinogenemia congénita (Carrell et al., Blood 62, 439 (1983)). La posibilidad de que la actina, y quizá otras proteı́nas intracelulares liberadas durante el trauma de los tejidos, puedan ejercer estos efectos, está sugerida por el hallazgo de que el material liberado de las plaquetas altera tanto la estructura, como la lisis de los coágulos de fibrina in vitro (Dhall et al., Thromb. Haemost. 49, 42 (1983)). Es sabido que la actina deteriora la secuencia normal de coagulación de la sangre y eventos fibrinolı́ticos. Los hallazgos recientes acerca de la interacción de la actina con las proteı́nas fibrinolı́ticas, indican que la actina podrı́a afectar a la estructura y función de los geles de fibrina. La actina es capaz de promover la formación de plasmina cuando se añade a soluciones que contienen Glu-plasminógeno y t-PA (Lind y Smith, J. Biol. Chem. 266, 17673 (1991)). Sin embargo, cuando los coágulos que contienen actina se ponen en un baño de lisis que contiene plasminógeno y t-PA, se inhibe la lisis de los coágulos. Aunque los experimentos con proteı́nas purificadas sugieren que la actina es un inhibidor no competitivo de la plasmina (Lind y Smith, J. Biol. Chem. 266, 5273 (1991)), un efecto de la actina sobre la estructura de los coágulos de fibrina puede también ser responsable de algunos de sus efectos inhibidores sobre la lisis de los coágulos. Se ha puesto de manifiesto anteriormente que la actina interacciona con la fibrina (Laki y Muszbek, Biochim. Biophys. Acta 371, 519 (1974)) y puede reticularse con ella in vitro bajo la acción del Factor XIIIa (Mui y Ganguly, Am. J. Physiol. 233, H346 (1977)). Se ha comunicado que los filamentos de actina alteran la estructura de los coágulos de fibrina, dando como resultado la formación de coágulos finos, menos turbios. La adición de gelsolina, una proteı́na que acorta los filamentos de actina, suprime este efecto, lo que indica que los filamentos de actina se entrelazan con las fibrillas de fibrina, inhibiendo su asociación lateral (Janmey et al., Biochim. Biophys. Acta 841, 151 (1985)). La reologı́a de los coágulos de fibrina es, por consiguiente, un aspecto importante de su funcionamiento fisiológico. La presente invención se basa en el descubrimiento de los efectos de la actina sobre las propiedades mecánicas de los coágulos de fibrina. Un ensayo que pueda utilizarse para evaluar la cantidad de actina en los coágulos de fibrina in vivo, particularmente cuando se ha producido una lesión extensa en los tejidos, tiene valor clı́nico. Tal método puede emplearse como diagnóstico para determinar los regı́menes terapéuticos necesarios para contrarrestar el efecto de la actina extracelular libre en los pacientes que sufren lesiones. Un régimen de tratamiento que elimine la actina de un coágulo que contiene actina, es asimismo de importancia terapéutica respecto al restablecimiento de las propiedades viscoelásticas normales de los coágulos in vivo. Descripción de las figuras Figura 1. Efecto de la actina-F sobre la reologı́a de la fibrina. Aumento del módulo de alma- 7 ES 2 151 517 T3 cenamiento dinámico (G’) después de la adición de trombina al fibrinógeno, medido por deformaciones por cizalladura oscilantes de 2 % de amplitud de deformación y frecuencia angular de 10 rad/s (1,6 Hz). La concentración de fibrinógeno fue 2,0 mg/ml, y la concentración de actina (en mg/ml) fue: 0 (cı́rculos blancos); 0,2 (triángulos blancos); 0,4 (triángulos negros); y 1,0 (cı́rculos negros). Todas las soluciones contenı́an NaCl 150 mM, CaCl2 2,2 mM, ATP 150 µM, MgCl2 1,9 mM, pH 7,4. Se añadió actina-G al fibrinógeno, y 10 s más tarde se añadió 0,1 unidad NIH/ml de trombina. Figura 2. Eliminación del endurecimiento por deformación, producido por la actina-F en geles de fibrina. El módulo de cizalladura de los geles de fibrina que contienen diversas concentraciones de actina-F, a las concentraciones mostradas, se ha medido a lo largo de un intervalo de magnitudes de la deformación, a una frecuencia angular constante de 10 rad/s (1,6 Hz). Las condiciones de reacción y los significados de los sı́mbolos se dan en la leyenda de la Figura 1. Figura 3. El acortamiento de la actina-F por la gelsolina invierte su efecto sobre el endurecimiento por deformación y la histéresis de la fibrina. Se presenta el módulo de cizalladura G’ para medidas a 10 rad/s, a lo largo de un intervalo de amplitudes de deformación que comienza en el 1 % y aumenta a 37 % (A) ó a 30 % (B y C) (cı́rculos blancos). Después de la deformación a la amplitud de deformación máxima, las medidas de G’ se repitieron a amplitudes de deformación máxima secuencialmente decrecientes, para indagar la recuperación de las muestras después de la deformación (cı́rculos negros). Los tres paneles muestran los resultados para: 2 mg/ml de fibrina sola (A); fibrina más 0,2 mg/ml de actina-F (B); y fibrina más oligómeros de actina (complejos de actina-gelsolina, 3:1) (C). Otras condiciones se dan en la leyenda de la Figura 1. Figura 4. Unión de filamentos de actina y complejos a geles de fibrina. Cantidades diversas de actina-F sola marcada con rodamina (cı́rculos blancos) o de actina polimerizada en presencia de DBP (cı́rculos negros) o gelsolina (triángulos), se añadieron al fibrinógeno (2 mg/ml; 6 µM) en T7 (NaCl 100 mM, Tris-Cl 50 mM, pH 7,4), antes de la formación de coágulos por adición de 1,7 unidades NIH/ml de trombina. La relación molar de DBP a actina fue 2:1, y la relación molar de gelsolina a actina fue 1:2 (triángulos negros) o bien 1:12 (triángulos blancos). La actina fijada se retiró de la solución por enrollamiento del coágulo insoluble en una pipeta de vidrio, y la cantidad de actina unida al coágulo se midió a partir de la diferencia entre la fluorescencia de la muestra antes y después de la separación del coágulo, como se describe en el texto. Figura 5. Efecto de Ca2+ y de la longitud de los filamentos de actina sobre la unión de actina a la fibrina. La actina se polimerizó con diversas relaciones molares de gelsolina, para producir filamentos de longitudes medias comprendidas en el intervalo de 34 nm a 2,7 µm. La actina polimerizada a una concentración 6 µM se mezcló con fibrinógeno 6 µM en soluciones que contienen NaCl 100 mM, Tris-Cl 50 mM, pH 7,4, sea con 5 10 15 20 25 30 35 40 45 50 55 60 65 8 CaCl2 3 mM (cı́rculos negros) o sin él (cı́rculos blancos); y la actina unida a la fibrina después de la adición de 1,7 unidades NIH/ml de trombina, se midió como se describe en el texto. Figura 6. Imágenes de fluorescencia confocal (a, c, e, g, h) y de contraste de fase (b, d, f), de coágulos de fibrina que contienen actina. La adición de actina-F marcada con rodamina al fibrinógeno, antes de la formación de coágulos inducida por trombina, dio como resultado filamentos marcados fluorescentemente (panel a). La correspondiente imagen de contraste de fase (panel b) muestra que la fluorescencia de la actina marcada se localiza junto con las hebras de fibrina. La incubación de la rodamina-actina con gelsolina (paneles c y d) antes de la formación de coágulos, dio como resultado un marcaje fluorescente reducido de la red de fibrina. En ausencia de trombina, los filamentos de actina fluorescentes no pueden resolverse con el microscopio confocal (panel e). La correspondiente imagen de contraste de fase (panel f) muestra que no se ha formado un coágulo de fibrina. La inhibición de la polimerización de actina por DBP dio como resultado un marcaje fluorescente reducido de las hebras de fibrina (panel g). La especificidad de la interacción de la actina con la fibrina se pone de manifiesto en el panel h, que muestra la ausencia de fibrina fluorescente cuando se añadió fluoresceı́na-avidina al fibrinógeno, antes de la formación de coágulos inducida por la trombina (panel h). Los paneles c y g se relacionan con datos que muestran la fijación reducida de monómeros de actina complejados con gelsolina y DBP, a geles de fibrina (véanse las Figs. 4 y 5). Barra en el panel h=9 µm para todos los paneles. Figura 7. Efecto de la longitud de los filamentos de actina sobre la reologı́a de la fibrina, durante la lisis de los coágulos con plasmina. Aumento y disminución del módulo de cizalladura dinámica (G’), medido en el péndulo de torsión, de la fibrina sola (cı́rculos blancos) o de la fibrina con actina (cı́rculos negros), en función del tiempo. La concentración de fibrinógeno fue 3 mg/ml y la concentración de actina-F fue 0,25 mg/ml. Los paneles A y B muestran los resultados en ausencia y en presencia de gelsolina, a una relación molar de 1:12 respecto a la actina, respectivamente. Todas las soluciones contienen NaCl 140 mM, Tris-Cl 20 mM, MgCl2 2 mM, CaCl2 2,5 mM, pH 7,4, con 0,4 unidades NIH/ml de trombina, y 0,3 unidades/ml de plasmina. Figura 8. Efecto de la gelsolina externa sobre la liberación de la actina de los coágulos de fibrina. Coágulos que contienen fibrina y actina se prepararon en tubos de vidrio, por adición de 1,5 unidades NIH/ml de trombina. Las concentraciones de ambos, el fibrinógeno y la actina marcada con rodamina, fueron 6 µM (2,0 mg/ml y 0,25 mg/ml, respectivamente). Una vez formados, los coágulos se separaron con pipetas de vidrio, y se sumergieron en baños que contienen tampón B (cı́rculos blancos) ó tampón B + 0,2 mg/ml (2 µM) de gelsolina (cı́rculos negros). La liberación de la actina del coágulo se midió como fluorescencia liberada al medio del baño, como se describe en el texto. La liberación máxima de fluorescencia se obtuvo después de la lisis de los coágulos, 5 9 ES 2 151 517 T3 con 1,3 unidades/ml de plasmina, en el tiempo indicado por la flecha. Sumario de la invención La presente invención se basa en la consideración de los inventores, de que la administración, a los sujetos, de compuestos que fijan actina, o sus derivados biológicamente activos, después de una lesión en los tejidos, proporcionará protección a otros tejidos sanos, por restablecimiento de las propiedades viscoelásticas normales a los coágulos que contienen actina. Es, por tanto, un objetivo de la invención, crear un método para disminuir los niveles de actina en los coágulos formados en la corriente sanguı́nea y en el espacio extracelular de un animal. Es, por consiguiente, un objetivo de la invención, crear un método para liberar la actina en los coágulos que contienen actina formados in vivo. Un objetivo más de la invención es proporcionar tratamientos terapéuticos que puedan emplearse para tratar un animal, con el fin de protegerlo frente a una lesión secundaria en los tejidos, que se produce debido a niveles de actina anormales, tales que se forman in vivo coágulos que contienen actina con propiedades viscoelásticas alteradas. La presente invención se basa también en el descubrimiento de los inventores de que los filamentos de actina atrapados en los coágulos de fibrina pueden eluirse del coágulo por incubación en presencia de una proteı́na que fija actina, y cuantificarse. En consecuencia, la presente invención se dirige también a un procedimiento de importancia terapéutica potencial, en el que se aı́sla plasma de pacientes que sufren lesión en los tejidos, se deja que se formen coágulos, y dichos coágulos se incuban luego en presencia de una proteı́na que fija actina, y se cuantifica la actina liberada de ellos. Este procedimiento proporciona un ensayo para evaluar la cantidad de actina atrapada en los coágulos de fibrina in vivo, en el plasma de pacientes con diversos tipos de lesión en los tejidos. Es, por tanto, un objetivo de la invención crear un método para evaluar con precisión las propiedades de los coágulos en pacientes in vivo, en el que dichos pacientes sufren una extensa lesión en los tejidos, por determinación de la cantidad de filamentos de actina atrapados en dichos coágulos. Descripción de las realizaciones preferidas A fin de facilitar una comprensión más clara y coherente de la memoria descriptiva y las reivindicaciones, que incluya el alcance que se da a los términos empleados, se ofrecen a continuación las siguientes definiciones. Compuesto que fija actina. La expresión “compuesto que fija actina” se entiende que incluye cualquier compuesto, y especialmente cualquier proteı́na (o péptido), que es capaz de fijar la actina, de tal modo que se modifique cualquiera de las muchas funciones de la actina, incluyendo la supresión de la capacidad de los monómeros de actina para polimerizarse en filamentos, y que está sustancialmente libre de contaminantes naturales que se asocien con tal compuesto, sea in vivo (en un hospedante procariótico o eucariótico) o in vitro (como resultado de una sı́ntesis quı́mica). Tales compuestos incluyen, pero sin limitarse a 6 5 10 15 20 25 30 35 40 45 50 55 60 65 10 ellas, proteı́nas extracelulares que fijan actina, tales como la gelsolina y la DBP, y proteı́nas intracelulares que fijan actina, tales como las que más abundan en las células (por ejemplo, miosinas, tropomiosinas, profilina y cofilina) y las que más abundan en células que no sean de los músculos. Los compuestos que fijan actina, dentro del alcance de los métodos de la invención, también incluyen, pero sin limitarse a ellos: a) compuestos que fijan actina, que secuestran predominantemente los monómeros de actina, es decir, fijan los monómeros en un complejo que es resistente a la polimerización (por ejemplo, DBP, profilina, depactina, cofilina, y ADNasa I); b) compuestos que fijan actina, que secuestran monómeros y poseen actividad de separación de filamentos (por ejemplo, gelsolina, villina, fragmina y severina); c) compuestos que fijan actina, que bloquean predominantemente los extremos de los filamentos de actina e impiden el intercambio de monómeros con esos extremos (por ejemplo, proteı́na para protección terminal, β-actinina y acumentina); y d) moléculas no proteináceas que fijan actina, que tienen tales efectos sobre la actina (por ejemplo, citocalasina o sus derivados biológicamente activos, que bloquean los extremos de los filamentos de actina). Si se desea, tales compuestos pueden administrarse al sujeto en forma de una sal farmacéuticamente aceptable. Evento trombótico. La expresión “evento trombótico” se entiende que designa cualquier afección vascular, en la que una oclusión vascular, trombosis, infarto u otra perturbación biológica, da como resultado una fibrinolisis. Coágulo que contiene actina. La expresión “coágulo que contiene actina” se entiende que designa, para los fines de la presente invención, un coágulo de acuerdo con la definición que figura inmediatamente a continuación, en el que el coágulo contiene filamentos de actina y/o monómeros de actina sobre la fibra del coágulo, o filamentos de actina atrapados en los intersticios de la red de fibrina. La actina contenida en el coágulo puede ser el resultado de un atrapamiento, de un enlace covalente, y de otros tipos de enlace, tales como el de hidrógeno, iónico y otros tipos no covalentes de interacción fı́sicoquı́mica. La actina puede también estar contenida en el coágulo como un mero resultado del atrapamiento. Coágulo. El término “coágulo” se entiende que designa, para los fines de esta invención, una masa insoluble, blanda, no rı́gida, que se forma cuando la sangre se gelifica. El término “coágulo” se aplica particularmente a la fase coagulada de la sangre; es decir, la masa roja blanda, consistente, gelatinosa, resultante de la conversión del fibrinógeno en fibrina, que atrapa ası́ los glóbulos rojos (y otros elementos formados) dentro del plasma coagulado. El coágulo puede formarse dentro o fuera del cuerpo. Algunos coágulos pueden parecer amarillos, debido al sedimento de los eritrocitos antes de la aparición de la coagulación. Este tipo de coagulación puede tener lugar cuando se deja que los coágulos se formen fuera del cuerpo. Los coágulos sanguı́neos pueden ser también coágulos de tipo externo, que son coágulos formados fuera de un vaso sanguı́neo. 11 ES 2 151 517 T3 Los coágulos internos se forman dentro de un vaso sanguı́neo. Los coágulos de los músculos pueden formarse por coagulación del plasma del músculo. Un coágulo sanguı́neo puede también estar compuesto de fibrina y plaquetas. Cuando se forma ası́, el coágulo se denomina coágulo lavado o blanco. Lesión en los tejidos. La expresión “lesión en los tejidos” significa, para los fines de esta invención, una lesión en los tejidos que da como resultado una trombosis. Tales lesiones incluyen, pero sin limitarse a ellas, neumonı́a, trauma, infarto de miocardio o infarto de cualquier órgano, pero, en particular, infarto de miocardio, porque el corazón contiene cantidades significativas de actina. Las lesiones por aplastamiento son también relevantes para la presente invención, porque el músculo voluntario contiene cantidades significativas de actina. El tipo de lesión que es relevante para la presente invención es el tipo de lesión que libera actina al espacio extracelular a través de las células de la sangre o de las células de los tejidos fijos, ası́ como la liberación de materiales tromboplásicos, que origina la formación de coágulos de fibrina en tales áreas, de modo que el coágulo de fibrina atrapa la actina. En general, la lesión celular a la que la invención se dirige es una lesión en la que hay inflamación y lesión celular, ası́ como formación de coágulos, de modo que la lesión celular podrı́a ser una fragmentación de neutrófilos o plaquetas en la sangre o daños a órganos fijos como el corazón o el hı́gado. Animal. El término “animal” se entiende que incluye todos los animales en los que la acumulación de actina libre o filamentos de actina en la corriente sanguı́nea o en el espacio extracelular serı́a perjudicial para la fisiologı́a del animal. Los principales entre tales animales son los seres humanos; sin embargo, la invención no pretende limitarse a ellos, estando dentro de la contemplación de la presente invención el tratamiento de cualesquiera animales que puedan experimentar el efecto beneficioso de la invención. Cantidad eficaz. Una “cantidad eficaz” de un compuesto que fija actina es una cantidad suficiente para liberar actina de un coágulo con actina unida, formado en un animal que padece lesión en los tejidos. Una cantidad eficaz de un compuesto que fija actina es también una cantidad que es suficiente para reducir o eliminar la cantidad de actina encontrada en un coágulo que contiene actina in vivo. Sustancialmente libre de contaminantes naturales. Un material se dice que está “sustancialmente libre de contaminantes naturales”, si ha sido sustancialmente purificado de materiales con los que se encuentra normalmente y de un modo natural antes de tal purificación. Los ejemplos de contaminantes naturales con los que podrı́an asociarse los compuestos que fijan actina son: péptidos que no fijan actina, carbohidratos, péptidos glicosilados, lı́pidos, membranas, etc. Un material se dice que está sustancialmente libre de contaminantes naturales, si los contaminantes encontrados normalmente y de un modo natural con la sustancia in vivo o in vitro están sustancialmente ausentes de una muestra 5 10 15 20 25 30 35 40 45 50 55 60 65 12 del material. Por “sustancialmente ausentes” se entiende que tales contaminantes están completamente ausentes o que están presentes a concentraciones tan bajas, que su presencia no interfiere con el efecto deseado del agente activo (en este caso, el compuesto que fija actina) en la preparación, cuando tal preparación se incuba con el coágulo de fibrina que contiene actina al que se dirige la presente invención. Por “sustancialmente ausentes” se entiende también que tales contaminantes están completamente ausentes o que están presentes a concentraciones tan bajas, que su presencia no interfiere con el efecto terapéutico deseado del agente activo (en este caso, el compuesto que fija actina) en la preparación, cuando tal preparación se administra a un animal y no perjudica al animal, como resultado de la administración de la preparación. Administración. El término “administración” se entiende que incluye la introducción de compuestos que fijan actina a cualquier animal, por cualquier medio apropiado conocido en la técnica médica, incluyendo, pero sin limitarse a ellas, la administración entérica y parenteral (por ejemplo, intravenosa). Tratamiento. El término “tratamiento” se entiende que incluye la administración de compuestos que fijan actina a un sujeto, con fines que pueden incluir profilaxis, mejoramiento, prevención o curación de trastornos relacionados con la actina. Incubación. El término “incubación” se entiende que incluye la introducción de compuestos que fijan actina. Sal farmacéuticamente aceptable. La expresión “sal farmacéuticamente aceptable” se entiende que incluye sales de los compuestos que fijan actina de la invención. Tales sales pueden formarse a partir de ácidos o bases farmacéuticamente aceptables, tales como, por ejemplo, ácidos como el sulfúrico, clorhı́drico, nı́trico, fosfórico, etc., o bases como los hidróxidos de metales alcalinos o alcalino-térreos, hidróxidos de amonio, hidróxidos de alquil-amonio, etc. Vehı́culo farmacéuticamente aceptable. La expresión “vehı́culo farmacéuticamente aceptable” se entiende que incluye disolventes, excipientes, diluyentes y similares, que se utilizan como aditivos para preparaciones de los compuestos que fijan actina de la invención, de modo que proporcionen un excipiente o coadyuvante para la administración de tales compuestos. Fragmento. El término “fragmento” se entiende que incluye cualquier porción de una molécula que proporciona un segmento de un compuesto que fija actina, que es capaz de fijar monómeros de actina; el término se entiende que incluye los fragmentos que fijan actina, que están hechos de cualquier fuente, tal como, por ejemplo, de secuencias de péptidos que se encuentran en la naturaleza, secuencias de péptidos sintéticos o sintetizados quı́micamente, y secuencias de péptidos obtenidas por ingenierı́a genética. Además, si tal fragmento es un péptido, un fragmento de un péptido de tal proteı́na que fija actina se entiende que incluye cualquier variante de la proteı́na que fija actina. Variante. Una “variante” de un compuesto tal como un compuesto que fija actina, se entiende 7 13 ES 2 151 517 T3 que se refiere a un compuesto sustancialmente similar en estructura y actividad biológica al compuesto nativo o a uno de sus fragmentos. La actividad biológica de los compuestos de la invención es su capacidad para fijar actina y modificarla a una forma tal que pueda ser liberada de un coágulo de fibrina in vitro. Tal modificación puede ser el resultado de la unión de los compuestos por sı́ mismos, o el resultado de una reacción quı́mica o enzimática que resulta de tal unión. Derivado funcional. Un “derivado funcional” de un compuesto que fija actina es un derivado que posee una actividad biológica que es sustancialmente similar a la actividad biológica del compuesto que fija actina. Por “sustancialmente similar” se entiende la actividad que es cuantitativamente diferente pero cualitativamente igual. Por ejemplo, un derivado funcional de una proteı́na que fija actina de la invención contendrı́a la misma cadena principal de aminoácidos que una proteı́na que fija actina, pero contiene además otras modificaciones, tales como modificaciones posteriores a la traducción, como, por ejemplo, fosfolı́pidos unidos o un carbohidrato enlazado covalentemente, dependiendo de la necesidad de tales modificaciones para la eficiencia del ensayo diagnóstico o el tratamiento terapéutico. Tal como se usa en la presente invención, el término se entiende que incluye también un derivado quı́mico de un compuesto que fija actina. Tales derivados pueden mejorar la solubilidad del compuesto, la absorción, la semivida biológica, etc. Los derivados pueden también disminuir la toxicidad de la molécula, o eliminar o atenuar cualquier efecto secundario no deseable de la molécula, etc. Los derivados, y especı́ficamente restos quı́micos capaces de mediar en tales efectos, están descritos en “Remington’s Pharmaceutical Sciences” (1980). Los procedimientos para acoplar tales restos a una molécula son bien conocidos en la técnica. La expresión “derivado funcional” se entiende que incluye los “fragmentos”, “variantes”, “análogos” o “derivados quı́micos” de una molécula. Análogo. Un “análogo” de los compuestos que fijan actina de la invención se entiende que se refiere a un compuesto sustancialmente similar en su función al compuesto nativo que fija actina o a uno de sus fragmentos. Por ejemplo, un análogo de una proteı́na que fija actina es una proteı́na que no tiene la misma secuencia de aminoácidos que una proteı́na que fija actina, pero que es suficientemente homóloga a una proteı́na que fija actina, como para retener la actividad biológica de tal proteı́na que fija actina. Los Solicitantes han descubierto que hay dos tipos de interacciones actina-fibrina. Una interacción relativamente no especı́fica es debida al atrapamiento de filamentos de actina dentro del gel de fibrina, y un tipo más especı́fico de unión ocurre incluso cuando los filamentos de actina son más cortos que el tamaño medio de poro del gel de fibrina. La adición de la proteı́na que fija vitamina D, que se une a los monómeros de actina e impide su polimerización en filamentos de actina, tiene un efecto sobre la cantidad de actina unida a los coágulos, que se parece al efecto de la gelsolina del plasma. Ambas proteı́nas inhiben la unión, apoyando la idea de que los coágulos de fibrina 8 5 10 15 20 25 30 35 40 45 50 55 60 65 14 atrapan filamentos de actina. El descenso del contenido en el plasma de una u otra proteı́na en la vecindad de un coágulo en formación, darı́a, por tanto, probablemente como resultado cantidades aumentadas de actina asociada con el coágulo. No es sorprendente que algo de actina se una a la fibrina, incluso cuando están presentes concentraciones equimolares de estas proteı́nas que fijan actina, puesto que la reticulación de la actina con la fibrina por medio del Factor XIIIa supone una interacción especı́fica entre actina y fibrina (Muti y Ganguly, Am. J. Physiol. 233, H346 (1977)). Las propiedades reológicas de los coágulos que contienen actina difieren de las de los coágulos de fibrina pura, como cabrı́a esperar cuando se mezclan entre sı́ dos redes de filamentos que se entrelazan. Investigadores anteriores han puesto de manifiesto que las propiedades reológicas de las redes de actina y fibrina difieren tanto cuantitativamente como cualitativamente, y la viscoelasticidad de una mezcla de dos de tales polı́meros es difı́cil de predecir (Janmey et al., J. Cell. Biol. 113, 155-60 (1991); Janmey et al., J. Rheol. 27, 135 (1983)). Los Solicitantes han descubierto que la incorporación de actina a un coágulo de fibrina conduce a una desaparición de una de sus propiedades inusuales, el endurecimiento por deformación, y reduce su capacidad para resistir grandes deformaciones sin cambio estructural. Los coágulos que contienen actina son, por consiguiente, más frágiles que los que carecen de ella. La adición de gelsolina, que gelatiniza la red de actina, impide este efecto, lo que sugiere que la fragilidad de los coágulos de actina/fibrina se debe más a interacciones estéricas entre los dos tipos de filamentos, que a la unión directa actina/fibrina. En términos breves, la actina puede incorporarse a los coágulos de fibrina sin comprometer sus propiedades fı́sicas, en tanto que los filamentos no sean demasiado largos. La gelsolina ejerce, por tanto, un efecto protector sobre los coágulos de fibrina, cuando se añade a la actina antes de que se forme el coágulo de fibrina. Por acortamiento de la actina, la gelsolina disminuye la cantidad de actina asociada con el coágulo y mantiene las propiedades reológicas del coágulo. Adicionalmente, la gelsolina es capaz de acortar los filamentos de actina atrapados en un coágulo de fibrina, permitiendo que buena parte de la actina asociada con el coágulo se difunda desde el coágulo. Estos experimentos también confirman que la actina asociada con el coágulo inhibe la fibrinolisis mediada por plasmina. La eliminación de la actina de un coágulo por la gelsolina del plasma puede, por consiguiente, considerarse que es beneficiosa, en tanto que ayuda al restablecimiento de los mecanismos homeostáticos que regulan la formación y disolución de los coágulos. Por consiguiente, la presente invención se dirige a un método para eliminar o reducir la actina de un coágulo in vivo, por la administración de cantidades eficaces de una proteı́na que fija actina. En una realización preferida, se administran al sujeto que necesita el tratamiento, gelsolina, DBP o sus fragmentos que fijan actina, o una combinación de gelsolina y DBP y/o sus fragmentos que fijan actina. 15 ES 2 151 517 T3 En una realización, los niveles eficaces de compuestos que fijan actina se administran de modo que se libere la actina asociada con los coágulos in vivo, y se contrarreste ası́ el efecto de una excesiva actina extracelular sobre la formación de coágulos in vivo. Por “niveles eficaces de compuestos que fijan actina” se entiende los niveles a los que los efectos tóxicos de la actina extracelular libre sean, como mı́nimo, mejorados. Los efectos tóxicos de la actina extracelular libre son, por lo que se refiere a la presente invención, aquellos efectos tóxicos que constituyen el resultado de alteraciones perjudiciales en las propiedades viscoelásticas o la velocidad de lisis de los coágulos in vivo. Por “actina extracelular excesiva” se entiende una cantidad de actina extracelular que excede la capacidad de las proteı́nas que fijan actina para fijar y desalojar la actina de los fluidos extracelulares, sin un daño incidental secundario a los tejidos o sin producir efectos tóxicos. Por “daño secundario a los tejidos o efectos tóxicos” se entiende el daño a los tejidos o los efectos tóxicos que tienen lugar en tejidos, órganos y células de los mismos, por lo demás sanos, debido a la presencia de coágulos que contienen actina, usualmente como resultado de una lesión primaria de los tejidos en otra parte del cuerpo. En los métodos de la invención, la incorporación de compuestos que fijan actina, tales como la gelsolina, DBP o sus fragmentos que fijan actina, da como resultado la reducción o la eliminación completa de la actina de los coágulos que contienen actina in vivo. Los compuestos que fijan actina pueden conjugarse, sea quı́micamente o por ingenierı́a genética, a fragmentos de otros agentes que hacen que tales compuestos que fijan actina se dirijan a un sitio de acción deseado. Alternativamente, otros compuestos pueden conjugarse, sea quı́micamente o por ingenierı́a genética, a otro compuesto que fija actina o sus fragmentos activos, de modo que se mejore tal compuesto que fija actina o se le impartan propiedades adicionales, especialmente propiedades que mejoren la capacidad del compuesto para promover la liberación de los efectos tóxicos de la actina. Por ejemplo, puesto que la actina promueve la coagulación de la sangre intravascular e inhibe la fibrinolisis, por conjugación del activador del plasminógeno de los tejidos y/o de una antitrombina, tal como la hirudina o sus fragmentos activos, con el compuesto que fija actina, se puede dirigir un agente fibrinolı́tico a los sitios donde la lesión en los tejidos liberaba la actina que promovı́a la formación de coágulos que fijan actina. Las cantidades y regı́menes de administración de los compuestos que fijan actina pueden determinarse fácilmente por las personas con experiencia normal en la técnica clı́nica de tratamiento de los trastornos relacionados con la actina, lesión en los tejidos e inflamación. Generalmente, la dosificación para el tratamiento con el compuesto que fija actina variará dependiendo de consideraciones tales como: tipo de compuesto que fija actina empleado; edad; salud; afecciones que están siendo tratadas; clase de tratamiento concurrente, si es que lo hay, frecuencia del tratamiento y naturaleza del efecto deseado; alcance del daño en el te- 5 10 15 20 25 30 35 40 45 50 55 60 65 16 jido; género; duración de los sı́ntomas; y contraindicaciones, si las hay; ası́ como otras variables que han de ser ajustadas por el médico responsable. La dosis puede administrarse en una o más aplicaciones para obtener los resultados deseados. La dosificación puede calcularse de la siguiente manera. La concentración normal de gelsolina en la sangre es 2,4 µM (2,4 µmol/l) y la concentración normal de DBP en la sangre es 5 µM (5 µmol/l). Para la gelsolina, la capacidad normal de fijación de actina es 4,8 µM. Por consiguiente, la capacidad total de fijación de actina en la sangre (ABC) es aproximadamente 9,8 µmol/l. El volumen de la sangre es 6 % del peso corporal; por tanto, una persona de 70 kg tiene 4,2 l de sangre, y por consiguiente, (4,2 l × 7,5 µmol/l) 31,5 µmol de ABC. Puesto que la DBP y la gelsolina se distribuyen por todo el espacio extracelular (que es 10 % del peso corporal), el cuerpo contiene (7,5 × 7) 52,5 µmol de ABC. Puede desearse administrar entre 32 y 53 µmol de un compuesto que fija actina (ó 0,46 µmol/kg de peso corporal) para cubrir el complejamiento total o agotamiento de la ABC endógena. Puesto que 42,5 mg de actina es igual a 1 µmol, y puesto que hay 4,86 mg de actina por cada gramo de músculo voluntario, cada gramo de músculo contiene 0,114 µmol de actina, ó una destrucción de 460 g de músculo podrı́a neutralizar la ABC total del cuerpo. Sin embargo, puesto que los efectos tóxicos de la actina son presumiblemente locales (por ejemplo, inhibición de la lisis de los coágulos), aislados o determinados por la cinética (por ejemplo, la actina penetra en un órgano en menos tiempo que el necesario para que la neutralicen las proteı́nas de fijación), es probable que una dosis mı́nima teórica tenga que ser ajustada en sentido creciente, para lograr efectos terapéuticos cinéticamente favorables. El efecto cinético puede ser importante, por ejemplo, puesto que la hemolisis de aproximadamente la mitad del eritrón, que liberarı́a sólo 4,2 µmol de actina, reduce agudamente a la mitad la concentración de gelsolina en el plasma (Smith et al., Blood 72, 214-2181 (1988)), sugiriendo un equilibramiento lento entre los compartimientos extravascular y de la sangre. Inversamente, un estado terapéuticamente eficaz, capaz de desintegrar los depósitos locales de actina, puede ser alcanzable por sólo un pulso transitorio de una alta concentración de moléculas que fijan actina. Los compuestos de la invención pueden administrarse en cualquier excipiente farmacológico adecuado para la administración. Pueden administrarse en cualquier forma que propicie condiciones profilácticas, paliativas, preventivas o curativas de la lesión de los tejidos, en seres humanos y animales. Las preparaciones de las proteı́nas que fijan actina de la invención, para administración parenteral, incluyen disolventes estériles acuosos o no acuosos, suspensiones y emulsiones. Ejemplos de disolventes no acuosos son el propilenglicol, polietilenglicol, aceite vegetal, aceite de pescados y ésteres orgánicos inyectables. Los excipientes acuosos incluyen agua, soluciones, emulsiones o suspensiones agua-alcohol, incluyendo solución salina y vehı́culos médicos parenterales tampona9 17 ES 2 151 517 T3 dos, como la solución de cloruro de sodio, solución de dextrosa de Ringer, solución de dextrosa más cloruro de sodio, solución de Ringer que contiene lactosa, o aceites fijos. Los vehı́culos intravenosos incluyen reaprovisionadores de fluidos y nutrientes, reaprovisionadores de electrolitos, tales como los basados en la dextrosa de Ringer y similares. Las proteı́nas que fijan actina de la invención pueden también administrarse por medio de bombas, o en una forma de liberación prolongada, especialmente cuando la lesión primaria se prolonga o demora más bien que hacerse aguda. Un ejemplo en el que la lesión primaria frecuentemente se prolonga o demora más bien que hacerse aguda, es un infarto de miocardio en el que el daño al músculo del corazón no se revela (o persiste) hasta dı́as después del ataque primario al corazón. Las moléculas que fijan actina de la invención pueden suministrarse también a órganos especı́ficos, a alta concentración, por medio de catéteres adecuadamente insertados, o proveyendo tales moléculas como parte de una molécula quimérica (o complejo) que se diseña para dirigirla a órganos especı́ficos. La administración en una forma de liberación prolongada es más conveniente para el paciente, cuando están indicadas inyecciones repetidas durante perı́odos prolongados de tiempo. Por ejemplo, es deseable administrar las proteı́nas que fijan actina de la invención en una forma de liberación prolongada, cuando los métodos de la invención están utilizándose para tratar una enfermedad genética o crónica, basada en un trastorno relacionado con la actina, de modo que se maximice la comodidad del paciente. Las proteı́nas que fijan actina de la invención pueden emplearse en formas de dosificación tales como comprimidos, cápsulas, paquetes de polvo o soluciones lı́quidas para administración oral, si la actividad biológica de la proteı́na no se destruye por el proceso digestivo y si las caracterı́sticas del compuesto permiten que sea absorbido a través del tejido intestinal. Las composiciones farmacéuticas de la presente invención se fabrican de una manera que es conocida en sı́ misma, por ejemplo, por medio de un proceso de mezcla convencional, granulación, preparación de grageas, disolución, liofilización o procedimientos similares. Las composiciones de la presente invención, en sı́ mismas, encuentran utilidad en el control del daño fisiológico inducido por la actina, sea crónico o agudo. Las composiciones de la invención gobiernan los propios mecanismos del cuerpo para hacer frente al exceso de actina en la corriente sanguı́nea o tejidos extracelulares, a su máximo potencial. En una forma de dosificación intravenosa, las composiciones de la presente invención tienen un comienzo de acción suficientemente rápido para ser útil en el manejo agudo del daño potencial de los tejidos. Adicionalmente, una versión de baja potencia es útil en el manejo de trastornos relacionados con la actina suaves o crónicos. Asimismo, las composiciones de la presente invención proporcionan los reactivos necesarios para el ensayo de laboratorio de los niveles de actina en la corriente sanguı́nea o tejidos extracelulares de un animal. 10 5 10 15 20 25 30 35 40 45 50 55 60 65 18 Cantidades eficaces de una proteı́na que fija actina, particularmente DBP, gelsolina o cualquiera de sus fragmentos activos, que estén sustancialmente libres de contaminantes naturales, pueden administrarse a un paciente que ha tenido un infarto de miocardio grave u otro evento trombótico, en un momento y perı́odo a través del cual se revela el daño al corazón o tejido. La cantidad del péptido que ha de administrarse puede determinarse después de analizar la relación de la gelsolina total a la ligada en el plasma del paciente, para hallar la fracción de la gelsolina total que ya ha sido saturada con la actina liberada por las células del corazón que mueren, y calculando la cantidad necesaria para suministrar, como mı́nimo, suficiente capacidad de fijación de actina para devolver esta relación a los valores encontrados en los individuos sanos. Además, los indicadores del daño renal, tales como el BUN del paciente y los niveles de creatinina, pueden controlarse fielmente, y la dosis de la molécula que fija la actina puede ajustarse a un nivel más alto, si es necesario, cuando tales indicadores revelan que se puede estar produciendo un daño renal. Por consiguiente, la presente invención puede utilizarse para administrar compuestos que fijan actina a animales, en niveles suficientes para: (a) prevenir la formación de filamentos de actina; y/o (b) elaborar los filamentos de actina a un estado monomérico “estable”, en cantidades suficientes para tratar y/o prevenir los efectos fisiológicos no deseables de la acumulación o liberación de actina libre a la corriente sanguı́nea. Las moléculas particulares que fijan actina, que son el objeto de los métodos de la invención, son proteı́nas que fijan actina, nativas y recombinantes, purificadas, y otras moléculas que fijan actina no proteináceas, y sus fragmentos biológicamente activos, que se caracterizan por la presencia de dominios singulares de fijación de actina, que poseen la actividad biológica de ser capaces de secuestrar la actina en una forma monomérica, o de desagregar o despolimerizar rápidamente los filamentos de actina, o de cubrir los sitios de la actina libre que son tóxicos a las células hospedantes. Dominios individuales de fijación de actina que poseen esta actividad biológica pueden producirse también por métodos sintéticos, enzimáticos, proteolı́ticos, quı́micos o de ADN recombinante. Los métodos de la invención se basan también, en parte, en el descubrimiento inesperado de los Solicitantes, en el sentido de que un coágulo de fibrina que contiene filamentos de actina, si se incuba en presencia de la proteı́na que fija actina, gelsolina, libera la actina al medio de incubación, en el que la actina puede ser cuantificada. En una realización preferida, la gelsolina, DBP o sus fragmentos que fijan actina, o una combinación de gelsolina y DBP y/o sus fragmentos que fijan actina, se incuban in vitro con el coágulo que contiene actina. En una realización, niveles eficaces de los compuestos que fijan actina se administran de modo que se libere la actina asociada con coágulos formados in vitro, a partir de plasma de sujetos que sufren lesión en los tejidos. Por “niveles eficaces” de compuestos que fijan actina, se entiende niveles 19 ES 2 151 517 T3 a los que la actina asociada con los coágulos pueda liberarse y medirse, y permitir ası́ un diagnóstico de los efectos de un exceso de actina extracelular sobre la formación de coágulos in vivo. Por “exceso” de actina extracelular se entiende una cantidad de actina extracelular que excede la capacidad de las proteı́nas del plasma para fijar y desalojar la actina de los fluidos extracelulares, sin daño secundario a los tejidos o sin producir efectos tóxicos. En una realización preferida de la invención, se retira plasma de un sujeto que sufre lesión en los tejidos y se deja que se formen coágulos in vitro. Las condiciones preferibles para la formación de coágulos se describen en el Ejemplo V. Los coágulos se retiran luego del recipiente en el que se formaron y se incuban con cantidades crecientes de una proteı́na que fija actina, preferiblemente gelsolina o DBP. El coágulo se disuelve en SDS o urea u otro agente solubilizante conocido y luego se somete a electroforesis en gel. Los geles pueden estar basados en poliacrilamida o en cualquiera de los otros medios de tipo gel bien conocidos por los expertos en la técnica, como eficaces para separar las proteı́nas. Después de la electroforesis en gel, se aplica un procedimiento de transferencia Western y la actina liberada del coágulo, si la hay, se detecta con un anticuerpo anti-actina. A fin de evaluar la cantidad de gelsolina necesaria para liberar la actina del coágulo, se añaden diversas cantidades de gelsolina a diversos coágulos, con el fin de evaluar la cantidad necesaria para liberar la mayorı́a de la actina del coágulo o toda ella. Cuando se alcanza la concentración a la que se completa la liberación de la actina o se llega a una meseta, esa cantidad de gelsolina se señala como eficaz. Seguidamente, el medio de incubación procedente del procedimiento en el que se ha añadido la proteı́na de máxima eficacia que fija actina, puede usarse para valorar la cantidad de actina liberada del coágulo, por inmunoprecipitación de los complejos de actina y proteı́na que fija actina en el medio de incubación. Después de la liberación máxima de actina de los coágulos, la cantidad de actina puede valorarse por completo mediante la adición de proteı́na exógena que fija actina, por ejemplo, gelsolina o DBP. Los anticuerpos anti-fijación de actina, tales como el anti-gelsolina o anti-DBP, pueden emplearse para inmunoprecipitar y seguidamente cuantificar los complejos. Alternativamente, pueden utilizarse anticuerpos anti-actina para detectar la actina liberada al medio de incubación, por inmunoprecipitación del complejo de actina y anticuerpo antiactina. En una realización alternativa preferida, se forma un coágulo en un pequeño tubo de cromatografı́a. A través del tubo, se aplica una solución de proteı́na que fija actina, preferiblemente gelsolina o DBP o sus fragmentos. El eluido se mide seguidamente por ELISA estándar o la proteı́na que fija actina se inmunoprecipita, y la presencia de complejos con actina se ensaya por electroforesis en gel, preferiblemente por electroforesis en gel de poliacrilamida. Los parámetros se describen a continuación. El fibrinógeno se prepara a una concentración entre 0,1 y 10,0 mg/ml, preferiblemente 2 a 3 5 10 15 20 25 30 35 40 45 50 55 60 65 20 mg/ml. El pH está entre 6 y 8,5, preferiblemente es 7,4. La fuerza iónica está entre 50 y 500 mM, preferiblemente es 100 mM. El tampón es un tampón de imidazol o Tris. La concentración de calcio está entre 0,1 y 10 mM, preferiblemente es alrededor de 0,3 mM. La concentración de ATP está entre 10 µM y 10 mM. Alrededor de 0,5 ml de fibrinógeno se añade a una columna de cromatografı́a de 1 cm de diámetro y se deja que se forme un coágulo de aproximadamente 1 mm, por adición de entre 0,01 y 10 unidades NIH, preferiblemente 0,1 unidades NIH/ml de trombina. El coágulo ası́ formado es suficientemente fuerte, desde el punto de vista mecánico, para resistir la penetración del fluido sin colapsar, y es suficientemente poroso para permitir que la penetración tenga lugar a una velocidad de aproximadamente 0,2 ml/min. La formación del coágulo requiere aproximadamente 1 a 10 min. Al cabo de un intervalo de tiempo diez veces superior al tiempo de coagulación, se aplica al tubo de cromatografı́a una presión de entre 1 y 10 cm. El nivel del tampón de incubación se ajusta seguidamente hasta que el caudal es de aproximadamente 0,2 ml/min. La presión se ajusta observando el menisco del coágulo. Cuando el menisco del coágulo comienza a colapsar, se reduce ligeramente la presión. Ası́, el fluido es capaz de penetrar, a través del coágulo, en el tampón arriba descrito. Al principio, el tampón no contiene gelsolina. El tampón se emplea para lavar el coágulo, de modo que quede libre de la proteı́na no especı́ficamente retenida. Se añade entonces gelsolina al tampón, y el tampón que contiene gelsolina se pasa, para un lavado a través del coágulo, en aproximadamente 1 a 5 min. Las fracciones eluidas se ensayan para determinar la actina, mediante aplicación de dichas fracciones a un gel, particularmente poliacrilamida con SDS, e inmunotransferencia con un anticuerpo anti-actina. La concentración de gelsolina está entre 50 nM y 5 µM, preferiblemente entre 1 y 5 µM. En un análisis alternativo, puede utilizarse un ensayo de lisis por plasmina para determinar la cantidad de actina liberada y la velocidad de liberación de los coágulos por una proteı́na que fija actina, preferiblemente gelsolina o DBP. Puesto que la actina inhibe la lisis basada en plasmina, la velocidad de lisis de un coágulo puede utilizarse como medida de la liberación de la actina. La velocidad de lisis se incrementa a medida que la actina se elimina de un coágulo que contiene actina. En los casos en que se usa este tipo de ensayo, los coágulos se forman en tubos de cromatografı́a, como se describió anteriormente, o se sacan del tubo y se incuban en un tampón con o sin la proteı́na que fija actina, preferiblemente gelsolina o DBP. Otros métodos alternativos de detección de la actina liberada de un coágulo, aprovechan el parámetro de endurecimiento por deformación. El endurecimiento por deformación puede medirse por métodos descritos con detalle en el material de los ejemplos que figuran más adelante. El endurecimiento por deformación disminuye en los coágulos que contienen actina y puede recuperarse cuando la actina se elimina de los coágulos. Por lo tanto, la liberación de la ac11 21 ES 2 151 517 T3 tina en los coágulos puede cuantificarse por las medidas reológicas descritas en el material de los ejemplos. Las proteı́nas que fijan actina y que están sustancialmente libres de contaminantes naturales pueden aislarse y purificarse a partir de sus fuentes natural o recombinante, de acuerdo con condiciones y procedimientos convencionales en la técnica, usados con anterioridad para aislar dichas proteı́nas, tales como la extracción, precipitación, cromatografı́a, cromatografı́a de afinidad, electroforesis, o similares. Un experto en la técnica puede identificar el dominio o dominios que fijan actina de un compuesto que fija actina, utilizando procedimientos conocidos en la técnica, sin excesiva experimentación, y tales dominios son preferidos en los métodos de la invención. Por ejemplo, derivados de las proteı́nas nativas que fijan actina, o derivados de las proteı́nas que fijan actina producidas por vı́a recombinante, pueden prepararse por escisión proteolı́tica de la proteı́na de longitud completa que fija actina, con proteasas comunes, tales como, por ejemplo, tripsina, quimotripsina y subtilisina. La cromatografı́a de afinidad con actinaresinas derivatizadas puede emplearse para analizar dichos fragmentos respecto a su capacidad de fijación de actina. Cuando se desea la identificación de compuestos o sus fragmentos que poseen actividad de separación de actina, tales compuestos o fragmentos pueden también identificarse utilizando procedimientos conocidos en la técnica, por ejemplo, haciendo un seguimiento de la velocidad de despolimerización de la actina-F marcada con pireno. Asimismo, tales fragmentos pueden identificarse por su homologı́a a otros dominios conocidos que fijan actina o separan actina, en los que pueda predecirse que la función seguirá la homologı́a. Por ejemplo, se sabe que la severina, gelsolina y villina, y en especial los residuos de aminoácidos 40 a 351 en la severina, y los residuos de aminoácidos 63 a 383 en la gelsolina, presentan una extensa homologı́a en el dominio responsable de la actividad de separación de la actina-F. La mitad N-terminal de la gelsolina, por ejemplo, un fragmento trı́ptico N-terminal, conocido como CT45, es capaz de separar la actina-F y contiene dos sitios de fijación de actina. Uno de estos sitios reside en un fragmento quimotrı́ptico, CT15N (residuos 24 a 150 de la gelsolina humana), que fija los extremos de los monómeros y filamentos de actina con alta afinidad; el otro sitio está contenido en el fragmento adyacente CT28N (residuos 151 a 406), que se une al flanco de la actina-F, de una manera regulada por polifosfoinosı́tido. Ninguno de los fragmentos separa los filamentos de actina por sı́ mismos. El polipéptido de gelsolina más pequeño que es capaz de separar la actina-F, abarca los residuos 25 a 165 de la gelsolina del plasma. Otro punto a señalar es que los compuestos tales como las proteı́nas que fijan actina están altamente conservados entre las especies y pueden aislarse fácilmente, en grandes cantidades, del plasma no humano (bovino, porcino) y/o de los tejidos del músculo, y los fragmentos de estas proteı́nas pueden prepararse por vı́a quı́mica 12 5 10 15 20 25 30 35 40 45 50 55 60 65 22 o enzimática, utilizando procedimientos bien conocidos en la técnica. Ası́, tales compuestos que fijan actina pueden administrarse a un sujeto que necesita los métodos terapéuticos de la invención, sin provocar una respuesta inmune importante. Tras esta descripción general de la invención, los siguientes ejemplos describen con más detalle los materiales y métodos usados para realizar la invención. No se pretende que los ejemplos limiten la invención en modo alguno. Ejemplos Materiales. El fibrinógeno (Mosher y Blout, J. Biol. Chem. 248, 6896 (1973)) y la gelsolina (Chaponnier et al., J. Cell. Biol. 103, 1473 (1986)) se purificaron a partir de plasma de sangre humana, y la actina a partir de músculo voluntario de conejo, por métodos descritos con anterioridad (Janmey et al., J. Biol. Chem. 261, 8357 (1986)). La actina se marcó con pireno-yodoacetamida ó con tetrametil-rodamina 5-(y-6)-yodoacetimida (T-488, Molecular Probes, Eugene, OR), como se describe en otro lugar (Symons y Mitchison, J. Cell. Biol. 114, 503 (1991)). La proteı́na que fija vitamina D se preparó a partir de sangre humana, por cromatografı́a de afinidad, utilizando actina-sefarosa (Haddad et al., Anal. Biochem. 146, 96 (1985)), o bien se adquirió en Calbiochem (San Diego, CA). Ambos materiales mostraron una afinidad similar hacia la actina, basada en su capacidad para inhibir la polimerización de la actina, tal como se mide por los cambios de fluorescencia de la actina marcada con pireno. La trombina de plasma humano (T-6759, Sigma Chemical Co., St. Louis, MO) y la plasmina (810655 Kabi Vitrum, Franklin, OH) se diluyeron con agua a 100 unidades/ml y 10 unidades/ml, respectivamente, y se congelaron inmediatamente. Porciones de ellas se derritieron, se mantuvieron a 4◦ C y se utilizaron dentro de las 10 h siguientes. La faloidina marcada con rodamina se obtuvo de Molecular Probes, la avidina marcada con fluoresceı́na de Enzo Diagnostics, NY, y la DNasa 1 de Boehringer Mannheim, Indianapolis, IN. Ejemplo I Medidas viscoelásticas Las propiedades viscoelásticas de los geles de fibrina se determinaron por medidas reológicas, empleando un instrumento Rheometrics o un péndulo de torsión. El principio en que se basan estas medidas es que, cuando se aplica una fuerza en una dirección paralela a la cara de una muestra (una fuerza de cizalladura, o esfuerzo = fuerza/área, expresado en unidades de Pa = 10 dyn/cm2 ), una muestra viscoelástica se deforma en una extensión (la magnitud de la deformación o “strain”, una magnitud sin unidades) que depende del valor del esfuerzo y de la longitud del intervalo de tiempo en que se aplica el esfuerzo. Parte de la energı́a de deformación se almacena elásticamente en el material y parte se disipa por el movimiento viscoso lento de la muestra, que conduce a una deformación irrecuperable después de retirar el esfuerzo. Estas propiedades viscoelásticas pueden describirse cuantitativamente por el módulo de cizalladura: la relación del esfuerzo a la magnitud de la deformación, que es, él mismo, función del tiempo, y para algunos 23 ES 2 151 517 T3 materiales y valores de la deformación, también de la magnitud de la deformación. A menudo, los módulos de cizalladura de almacenamiento y de pérdidas (viscoso) se miden aplicando deformaciones oscilantes, y entonces, los módulos de cizalladura, designados por G’ para el de almacenamiento y G” para el módulo de pérdidas, se calculan a partir de la magnitud y desplazamiento de fase entre los esfuerzos y deformaciones oscilantes. El dispositivo Rheometrics aplica una deformación por cizalladura oscilante a una muestra confinada entre un cono y una placa, y hace posible las medidas del módulo de almacenamiento de la elasticidad, G’, en función del tiempo, de la frecuencia o de la amplitud de deformación. El péndulo de torsión puede medir el módulo de cizalladura dinámico, a partir de la oscilación libre, o bien la deformación por la fuerza de cizalla (relación de la magnitud de la deformación al esfuerzo), a partir de medidas de la deformación (es decir, de la magnitud de la deformación) cuando un esfuerzo de cizalla constante se aplica a una muestra de forma de disco, mantenida entre las placas del péndulo. Los principios del funcionamiento de estos dos instrumentos se describen en otro lugar (Janmey et al., Biochemistry 27, 8218 (1988); Janmey, P., J. Biochem. Biophys. Meth. 22, 41 (1991)). En ambos instrumentos, el gel de fibrina o de fibrina/ actina se forma entre las placas del reómetro, poniendo una cantidad de 400 µl a 800 µl de una solución de la proteı́na en la placa del fondo, inmediatamente después de la adición de trombina para iniciar la polimerización de la fibrina. La concentración de trombina se eligió para dar un tiempo de coagulación de unos pocos minutos, que permitiese colocar la muestra en el reómetro antes de que ocurriera la coagulación. Las medidas se comenzaron tı́picamente un minuto después de que la muestra se pusiera entre las placas, y el tiempo de coagulación fue aproximadamente 3 min. Las medidas de la dependencia de la magnitud de la deformación se hicieron en muestras envejecidas durante 90 min, o al menos 30 veces el tiempo de coagulación, para asegurarse de que la formación de coágulos era prácticamente completa y no cambiarı́a durante el curso de estas medidas. Cuando la actina o los complejos de actina-gelsolina se añadieron a la solución de fibrinógeno, la actina-G se polimerizó primero a actina-F, en presencia o ausencia de gelsolina, por incubación durante 1 h en tampones que contienen MgCl2 2 mM y KCl 150 mM. Propiedades viscoelásticas de los geles de fibrina-actina. La presencia de filamentos de actina durante la polimerización del fibrinógeno afecta fuertemente a las propiedades mecánicas de la red de geles de fibrina. La Figura 1 muestra el efecto sobre el módulo de cizalladura, una medida de la resistencia elástica del coágulo a los esfuerzos de deformación, cuando cantidades crecientes de actina-F se incorporan al coágulo. La actina-F aumenta el módulo de cizalladura en un grado que depende de la concentración de actina. La viscoelasticidad de los propios filamentos de actina puede ser responsable de una parte del aumento del módulo de cizalladura, pero un com- 5 10 15 20 25 30 35 40 45 50 55 60 65 24 ponente significativo procede también de la alteración de la estructura de los geles de fibrina, producida por la inhibición de la formación de haces de protofilamentos anteriormente descrita (Janmey et al., Biochim. Biophys. Acta 841, 151 (1985)). El efecto de la actina-F es hacer el coágulo más fino, y los coágulos finos cabe esperar que tengan módulos de cizalladura más bajos que los coágulos bastos, puesto que contienen filamentos más delgados. Sin embargo, los coágulos finos pueden también presentar módulos de cizalladura elevados si la inhibición de la formación de haces de fibrina está acoplada a un aumento del número de puntos de ramificación (Roberts et al., Biorheology 10, 29 (1973); Rosser et al., Biophys. Chem. 7, 153 (1977)), y módulos de cizalladura altos para coágulos finos han sido comunicados para la fibrina polimerizada en presencia de IgG (Gabriel et al., J. Lab. Clin. Med. 101, 545 (1983)). Una de las propiedades viscoelásticas llamativas de los geles de fibrina es la del endurecimiento por deformación: su módulo de elasticidad aumenta con el crecimiento de las amplitudes de deformación. La Figura 2 muestra que esta caracterı́stica de la reologı́a de la fibrina, que puede ser crucial para su función fisiológica como tapón hemostático flexible, pero resistente a la rotura, se elimina completamente por los filamentos de actina-F largos. No sólo inhibe la actina el endurecimiento por deformación de la fibrina, sino que también reduce la recuperación de la elasticidad de los coágulos. La Figura 3A muestra la reversibilidad casi total del módulo de cizalladura observada cuando un gel de fibrina se deforma primero por incrementos a una magnitud de la deformación máxima grande, y luego experimenta deformaciones sucesivamente más pequeñas. La reproducibilidad de G’ después de estas deformaciones grandes refleja el alto grado de elasticidad de estos geles y su resistencia al fallo mecánico, incluso cuando están fuertemente deformados. La presencia de una cantidad incluso baja (0,2 mg/ml) de actina-F reduce el grado de endurecimiento por deformación y conduce a disminuciones irreversibles de aproximadamente 40 % en el módulo de cizalladura, después de haberse producido la deformación, indicando que los geles de fibrina/actina se dañan por deformaciones en el intervalo que podrı́a ocurrir in vivo (Figura 3B). Este fenómeno requiere filamentos de actina largos, porque cuando los filamentos de actina se acortan por la gelsolina, se observa de nuevo el endurecimiento por deformación, y la recuperación de la elasticidad aumenta a niveles próximos a los de la fibrina sola (Figura 3C). Ejemplo II Experimentos de unión La cantidad de actina unida a la fibrina se midió por la pérdida de fluorescencia de la solución, después de la incorporación de actina marcada con rodamina a 2 mg/ml de coágulos de fibrina. Los coágulos se formaron en tubos de vidrio de borosilicato para cultivo de tejidos, por adición de 1,7 unidades NIH/ml de trombina a 2 mg/ml de fibrinógeno en T7 (NaCl 100 mM, TrisCl 50 mM, pH 7,4) con actina-F, polimerizados en 13 25 ES 2 151 517 T3 Tampón B (Tris 20 mM, ATP 0,5 mM, DTT 0,2 mM, CaCl2 0,2 mM, KCl 150 mM, MgCl2 2 mM, pH 7,4). La gelificación de la fibrina se produjo dentro de un tiempo de 10 min y los coágulos se incubaron durante 1 a 2 h, a 24◦ C. Los coágulos insolubles, que contienen más de 97 % de la fibrina total, se retiraron por enrollamiento en una pipeta de vidrio, y se determinó la fluorescencia de la solución restante. Antes y después de la formación de los coágulos, la fluorescencia se determinó con un espectrómetro de luminiscencia Perkin-Elmer LS-5B, con excitación a 547 nm y emisión a 573 nm. Los ensayos previos de sedimentación de la actina marcada con rodamina indicaron que 15 % de la fluorescencia total no estaba ligada o estaba unida a actina no funcional, y este valor se restó de todas las lecturas. El porcentaje de actina total unida al coágulo de fibrina se calculó como % unido = 100(FL0 -FL1 )/FL0 , donde FL0 es la fluorescencia inicial antes de la polimerización de la fibrina y FL1 es la fluorescencia de la solución menos la del coágulo de fibrina. Unión fibrina-actina. Los ensayos de unión mostraron que la cantidad de actina unida a los coágulos de fibrina depende de la longitud de los filamentos de actina añadidos (Figura 4). En ausencia de proteı́nas que acorten la actina, la unión resulta ser insaturable, y la relación molar de actina a fibrina en el coágulo es mayor que 1:1 a las concentraciones de actina más altas mostradas. Este hallazgo es debido, probablemente, al hecho de que los filamentos de actina polimerizados en ausencia de proteı́nas especı́ficas que fijan actina, alcanzan por lo general longitudes de filamento de varios micrómetros (Pollard y Cooper, Annu. Rev. Biochem. 55, 987 (1986)), y pueden no sólo unirse al coágulo de fibrina, sino quedar enmarañados en él (Janmey et al., Biochim. Biophys. Acta 841, 151 (1985)). Cuando la longitud de los filamentos está limitada por una relación molar de gelsolina de 1:12 (que da como resultado filamentos rematados con gelsolina, cuya longitud media es 32 nm [Janmey et al., J. Biol. Chem. 261, 8357 (1986)]), la unión resulta alcanzar un lı́mite a una relación molar de aproximadamente 2:3 de subunidades de actina a fibrina (Figura 4). Si se impide que la actina se polimerice por incubación de los monómeros de actina-G con la proteı́na DBP que fija monómeros de actina (Figura 4), la cantidad de actina unida al coágulo disminuye fuertemente, pero no se elimina por completo. Resultados similares se observaron cuando se impidió que la actina se polimerizase por medio de DNasa I, que forma complejos fuertes con los monómeros de actina, pero fija la actina en un sitio diferente del que lo hace DBP (datos no mostrados). Estos resultados sugieren que, aunque los filamentos de actina largos pueden estar atrapados de forma no especı́fica en el coágulo de fibrina en formación, también tiene lugar una unión especı́fica de los filamentos cortos y los monómeros complejados. Esta unión se considera que es especı́fica, porque tanto los filamentos de actina cortos (32 nm), como los complejos de monómeros de actina y DBP se unen a coágulos cuyos tamaños medios de poro son de varios micrómetros de diámetro (Rosser et al., Biophys. Chem. 7, 153 (1977)). La afinidad de 14 5 10 15 20 25 30 35 40 45 50 55 60 65 26 los monómeros de actina o de los fragmentos de filamento hacia el gel de fibrina es difı́cil de evaluar con precisión, porque la presencia de la actina perturba la estructura de la matriz a la que se une (Janmey et al., Biochim. Biophys. Acta 841, 151 (1985)), pero los datos de la Figura 4 sugieren que la afinidad es suficientemente grande (Kd<1 µM) para ser significativa a las concentraciones de actina y de fibrina que probablemente se presentan in vivo. El efecto de la longitud del filamento sobre la cantidad de actina-F incorporada al coágulo, se muestra con más detalle en la Figura 5. En este experimento, una cantidad constante de actina (12 µM; 0,5 mg/ml) se polimerizó en presencia de diversas cantidades de gelsolina, y se añadió fibrinógeno 6 µM (2,0 mg/ml) antes de la adición de trombina. Puesto que cada gelsolina nuclea y remata un filamento, y en estas condiciones de la solución no existen filamentos sin rematar, el número medio de subunidades de actina por filamento es igual a la relación actina:gelsolina (Janmey et al., J. Biol. Chem. 261, 8357 (1986)), y la longitud media se calcula a partir del hallazgo de que hay 370 subunidades en un micrómetro de filamento (Hanson y Lowly, J. Mol. Biol. 6, 46 (1963)). Según este cálculo, la longitud media de los filamentos de actina presentes en la solución de polimerización del fibrinógeno estaba en el intervalo de 34 nm a 2,7 µm. Más del 80 por cien de la actina total se unió al coágulo cuando la longitud media del filamento era muy grande, pero incluso los filamentos de actina muy cortos, formados a altas relaciones de gelsolina:actina, se unı́an significativamente. Además, la unión de los filamentos cortos, de longitud inferior a 300 nm, no dependı́a de su longitud, sugiriendo que la interacción no se debe enteramente al atrapamiento del filamento dentro de los poros del gel de fibrina, sino a una interacción especı́fica entre la actina y la fibrina. Estos resultados confirman que la actina se une a la fibrina, en parte, con independencia de las interacciones estéricas. La Figura 5 también muestra que la unión de la actina-F a la fibrina no depende de los cambios en la estructura de la fibrina, originados por concentraciones milimolares de iones calcio. Ejemplo III Microscopı́a confocal 2 mg/ml de fibrinógeno se mezclaron con rodamina-actina 6 µM, en presencia o ausencia de gelsolina o DBP, a relaciones molares con respecto a la actina de 1:4 ó 2:1, respectivamente. La polimerización de la fibrina se inició por adición de 0,1 unidades/ml de trombina, y 10 µl de cada solución se pusieron sobre una platina de microscopio, en una cámara humidificada, que consta de un papel de filtro hidratado en una placa de Petri cubierta. Aproximadamente 5 min después de la adición de la trombina, en un tiempo próximo al tiempo de coagulación, una funda a modo de cubierta se aplicó a la muestra y los bordes se sellaron con esmalte para uñas. En un experimento de control, avidina 10 µM marcada con fluoresceı́na se mezcló con fibrinógeno y la polimerización se inició por adición de trombina. Comenzando un minuto después de la preparación de las platinas, se examinaron las muestras utilizando un micros- 27 ES 2 151 517 T3 copio confocal de láser de barrido Bio-Rad MRC 600, agregado a un microscopio Zeiss Axiovert. Un objetivo Plan-neofluar 100X (NA 1.3) se utilizó para la formación de imagen, y la abertura confocal se puso al valor mı́nimo. Esto ayudó a eliminar la fluorescencia por encima y por debajo del plano del foco, aumentando ası́ la resolución y haciendo posible visualizar las hebras de fibrina individuales. El mismo montaje del láser, ganancia y marcos acumulados se utilizaron para todas las muestras. Esto permitió una comparación más precisa de las intensidades de fluorescencia. Microscopı́a de fluorescencia. La microscopı́a confocal de coágulos de fibrina que contienen actina se realizó para examinar directamente la interacción de la actina con la fibrina. La Figura 6a muestra una imagen de fluorescencia tı́pica, obtenida cuando se añadió actina-F marcada con rodamina a una solución de fibrinógeno, antes de la formación de coágulos, y la Figura 6b muestra la correspondiente imagen de contraste de fase de las hebras de fibrina. La fluorescencia de la actina-F marcada coincide con la estructura de la red de fibrina, demostrando la asociación directa de la rodamina-actina con la fibrina. Imágenes similares se obtuvieron utilizando actina-F marcada con fluoresceı́na (datos no mostrados). La coincidencia de las hebras de actina-F y de fibrina sugiere que estos polı́meros se asocian lateralmente y no interaccionan enteramente por un solapamiento puramente estérico no especı́fico. Cuando la longitud de los filamentos de actina se reduce a 32 nm por medio de la gelsolina, el marcaje fluorescente de la red de fibrina es mucho más débil (Figura 6c) y se ven algunas zonas de fluorescencia brillante, correspondientes a manchas de alta densidad en contraste de fase (Figura 6d). Estas zonas pueden representar sitios en los que los filamentos cortos de actina se fijan o son atrapados en el coágulo. La red de actina-F, en ausencia de fibrina, no puede visualizarse por microscopı́a confocal, puesto que los filamentos de actina delgados (9 nm) formados en estas condiciones no forman haces (Janmey et al., J. Biol. Chem. 261, 8357 (1986)) y por tanto, producen una red demasiado fina para que se resuelva usando microscopı́a confocal (Figuras 6e y 6f). La incubación de la rodamina-actina con DBP antes de la formación de coágulos, redujo significativamente la intensidad del marcaje fluorescente de la fibrina, pero todavı́a era visible un diseño claro de fluorescencia, coincidente con las hebras de fibrina (Figura 6g). Estos resultados son coherentes con los datos de las Figuras 4 y 5, que mostraban la unión reducida, pero todavı́a medible, de monómeros complejados de actina a coágulos de fibrina. La especificidad de la unión de la actina-F a la fibrina está apoyada por el hallazgo de que, cuando se añade fluoresceı́na-avidina a una solución de fibrinógeno, en lugar de actina-F marcada con rodamina, antes de la formación de coágulos, no tiene lugar el marcaje fluorescente de las hebras de fibrina (Figura 6h). Ejemplo IV Experimentos de fibrinolisis Los coágulos de fibrina que contienen actina se sometieron a lisis por dos métodos diferentes. En el primero, la fibrina, con o sin actina, se po- 5 10 15 20 25 30 35 40 45 50 55 60 65 28 limerizó por adición de una concentración relativamente alta de trombina y una concentración relativamente baja de plasmina, elegidas de modo que la gelificación fuese casi completa antes de que pudiera ocurrir una degradación significativa de la fibrina o del fibrinógeno, siguiendo el método de Shen et al. (Shen et al., J. Biol. Chem. 252, 6184 (1977)). Los geles de fibrina se polimerizaron en un péndulo de torsión y las propiedades reológicas de los coágulos se midieron tanto durante la formación de los coágulos como durante su disolución. Las muestras contenı́an 3 g/l de fibrina, 0,42 unidades NIH/ml de trombina y 0,3 CU/ml de plasmina, en soluciones que contienen NaCl 140 mM, Tris-Cl 10 mM, MgCl2 2 mM, CaCl2 2,5 mM, pH 7,4. En el segundo método, los coágulos de fibrina (6 µM), que contienen rodamina-actina filamentosa 6 µM, se formaron en tubos de vidrio de borosilicato para cultivo, por adición de trombina. La coagulación se inició por la adición de trombina (concentración final: 0,8 unidades NIH/ml). Los coágulos se mantuvieron a temperatura ambiente durante 2 h, y luego se retiraron con cuidado de los tubos y se sumergieron en un volumen igual de tampón B (Tris 2 mM, ATP 0,5 mM, CaCl2 2 mM, DTT 0,2 mM, KCl 150 mM, MgCl2 2 mM, pH 7,4), en presencia o ausencia de cantidades fisiológicas de gelsolina (2 µM). A diversos intervalos de tiempo, se retiró la solución que rodea al coágulo y se midió la fluorescencia para determinar la cantidad del marcador de rodamina liberada del coágulo. Efecto de los filamentos de actina sobre la lisis de coágulos de fibrina. La incorporación de actina a un coágulo de fibrina da como resultado la inhibición de su velocidad de lisis por plasmina, tal como se mide por la liberación de fragmentos de fibrina radiactiva (Lind y Smith, J. Biol. Chem. 266, 5273 (1991)), que tiene su manifestación más obvia después de varias horas. Puesto que la pérdida de la integridad estructural de un coágulo (tal como se refleja en su módulo de elasticidad) es una de las primeras consecuencias de la lisis (Shen et al., J. Biol. Chem. 252, 6184 (1977)), se realizaron los experimentos mostrados en la Figura 7 para determinar si el efecto de la actina sobre la lisis del coágulo podrı́a detectarse muy precozmente. La incorporación de filamentos de actina largos (Figura 7A) y cortos (Figura 7B) a los geles de fibrina retardó el crecimiento del módulo de cizalladura durante la formación del coágulo, ası́ como la disminución del módulo de cizalladura inducida por plasmina durante la lisis. Los efectos de los filamentos de actina incorporados (tanto unidos a la fibrina como atrapados estéricamente), se hicieron evidentes 20 min después del comienzo de la lisis. Por consiguiente, los efectos de la incorporación de actina a un coágulo, dan como resultado un cambio más rápido en las propiedades fı́sicas del coágulo en condiciones de lisis, que el que se refleja por la velocidad de liberación de fragmentos de fibrina al baño de lisis. Las medidas viscoelásticas de control confirmaron que la propia actina-F no se degradaba por la plasmina durante el curso temporal de estos experimentos (datos no mostrados). Ejemplo V 15 29 ES 2 151 517 T3 Elución de la actina de los coágulos de fibrina Puesto que es de importancia terapéutica potencial saber si los filamentos de actina atrapados en los coágulos de fibrina pueden eluirse de los mismos, coágulos que contienen actina se incubaron en presencia o ausencia de gelsolina del plasma. El fibrinógeno purificado se preparó a una concentración entre 2 y 3 mg/ml, en un tampón de imidazol o tris. El pH fue 7,4. La fuerza iónica no fue superior a 150 mM y de modo óptimo 100 mM. El calcio estaba presente a una concentración 0,3 mM. La actina estaba presente a una concentración de 6 a 20 µM. ATP estaba presente a una concentración de 10 µM a 10 mM. Fue entonces posible formar un coágulo de 1 mm en una columna de cromatografı́a de 1 cm de diámetro, por taponamiento de la columna, llenado de la misma con 0,5 ml de solución de fibrinógeno y coagulación del fibrinógeno con aproximadamente una décima de unidad NIH/ml de trombina. De este modo, una vez formado el coágulo, tenı́a suficiente resistencia mecánica para soportar la penetración de fluido sin colapsarse y era suficientemente poroso para permitir que la penetración del fluido se realizase a una velocidad de aproximadamente 0,2 ml/min. El coágulo de fibrinógeno se formó en aproximadamente 1 a 10 min. Después de transcurrido diez veces el tiempo de coagulación, se aplicó una presión de entre 1 y 10 centı́metros al tubo de cromatografı́a. Es decir, el fluido empleado para penetrar en el coágulo se mantuvo aproximadamente entre 1 y 10 cm por encima de la parte superior del coágulo. El nivel del tampón de incubación se ajustó entonces hasta que el caudal fuese aproximadamente 0,2 ml/min. Se hizo un seguimiento del menisco del coágulo durante el colapso. Se hizo un seguimiento de la presión observando el menisco del coágulo. Se dejó que el tampón penetrase a través del coágulo. El tampón era idéntico a aquel en el que estaba disuelto el fibrinógeno (el tampón en el que se formó el coágulo). Este tampón no contenı́a gelsolina. El tampón lavó al coágulo, dejándolo libre de 5 10 15 20 25 30 35 40 45 50 55 60 65 16 30 proteı́na no retenida especı́ficamente. Se añadió gelsolina al tampón y se hizo con él un lavado a través del coágulo, durante aproximadamente 1 a 5 min. La actina contenida en el coágulo se separó por la gelsolina y se eluyó. Las fracciones eluidas se analizaron para determinar la actina por electroforesis en gel de poliacrilamida en presencia de SDS, e inmunotransferencia con anticuerpo antiactina. En los primeros experimentos, se hizo un seguimiento espectrofotométrico de la actina marcada fluorescentemente. Por este método, ha sido posible retirar aproximadamente 80 % de la actina total retenida en el coágulo, haciéndole pasar soluciones que contienen gelsolina a concentración entre 1 y 5 µM. Como se muestra en la Figura 8, la incubación de los coágulos que contienen rodamina-actina en concentraciones fisiológicas (2 µM) de gelsolina del plasma, dio como resultado una pérdida de la mayor parte de la actina de los coágulos. Puesto que la fluorescencia de la actina-F marcada con rodamina es más alta que la de la rodamina libre o la de los monómeros de rodamina-actina, la cantidad del marcador liberado al medio puede ser algo subestimada por la fluorescencia del medio en comparación con la de la solución inicial de actina-F marcada. La cantidad de actina marcada que permanece asociada al coágulo es coherente con los resultados que se muestran en la Figura 2. Además, la elución de la actina de los coágulos restableció su susceptibilidad a la lisis mediada por plasmina, como se decidió visualmente. La inspección al cabo de 18 h reveló restos macroscópicos de aquellos coágulos que no habı́an sido expuestos a la gelsolina del plasma, mientras que los coágulos incubados en soluciones que contienen gelsolina del plasma se disolvieron totalmente. La pérdida de la rodamina asociada con el coágulo no refleja la lisis total del coágulo, sino más bien la escisión conocida del dipéptido terminal de la actina marcado con rodamina, por la acción de la plasmina (Mornet y Ue, Proc. Natl. Acad. Sci. USA 81, 3680 (1984)). 31 ES 2 151 517 T3 REIVINDICACIONES 1. Un método para eluir y cuantificar la actina en un coágulo que contiene actina, que comprende las etapas de: (1) retirar plasma de un sujeto que padece lesión en los tejidos; (2) permitir que dicho plasma forme un coágulo in vitro; (3) aislar dicho coágulo formado en la etapa (2); (4) incubar dicho coágulo en un medio lı́quido con un compuesto que fija actina; (5) determinar la cantidad de actina en dicho medio. 2. Uso de, al menos, un compuesto que fija actina, para la preparación de una composición farmacéutica para reducir la cantidad de actina en un coágulo que contiene actina, en un sujeto portador de dicho coágulo que contiene actina. 3. Uso de, al menos, un compuesto que fija actina, para la preparación de una composición farmacéutica para restablecer las propiedades viscoelásticas normales y la susceptibilidad a la lisis mediada por plasmina, a los coágulos formados en un sujeto después de una lesión en los tejidos. 4. El método de acuerdo con la reivindicación 1 ó el uso de acuerdo con la reivindicación 2 ó la reivindicación 3, en el que dicho compuesto que 5 10 15 20 32 fija actina es gelsolina o uno de sus fragmentos activos. 5. El método o uso de acuerdo con la reivindicación 4, en el que dicho fragmento activo es el fragmento quimotrı́ptico CT45. 6. El método o uso de acuerdo con la reivindicación 4, en el que dicho fragmento activo contiene los residuos de aminoácidos 25 a 165 de la gelsolina. 7. El método o uso de acuerdo con la reivindicación 4, en el que dicho fragmento activo contiene los residuos de aminoácidos 1 a 260 de la gelsolina. 8. El método de acuerdo con la reivindicación 1 ó el uso de acuerdo con la reivindicación 2 ó la reivindicación 3, en el que dicho compuesto que fija actina es la proteı́na que fija vitamina D o uno de sus fragmentos activos. 9. El método de acuerdo con la reivindicación 1 ó el uso de acuerdo con la reivindicación 2 ó la reivindicación 3, en el que un compuesto que fija actina es gelsolina o uno de sus fragmentos activos y otro compuesto que fija actina es la proteı́na que fija vitamina D o uno de sus fragmentos activos. 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 17 ES 2 151 517 T3 18 ES 2 151 517 T3 19 ES 2 151 517 T3 20 ES 2 151 517 T3 21 ES 2 151 517 T3 22 ES 2 151 517 T3 23 ES 2 151 517 T3 24 ES 2 151 517 T3 25 ES 2 151 517 T3 26