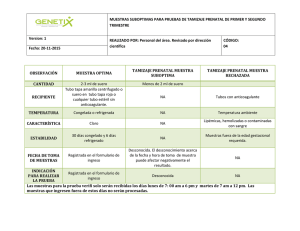
Manual Laboratorio 2012 - Hospital Dr. Hernán Henríquez Aravena
Anuncio

MANUAL DE LABORATORIO [Dirigido a Servicios Clínicos del Hospital Dr. Hernán Henríquez Aravena de Temuco] 2012 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 2 TABLA DE CONTENIDO INTRODUCCION ................................................................................................................................. 9 OBJETIVOS ........................................................................................................................................ 9 DESCRIPCIÓN DE LA UNIDAD DE LABORATORIO CLÍNICO Y SU ORGANIZACIÓN INTERNA ................... 10 HORARIOS DE ATENCION ....................................................................................................................... 10 LABORATORIO DE RUTINA ..................................................................................................................... 10 LABORATORIO DE URGENCIA 24 HORAS ................................................................................................ 11 ENTREGA DE HORA PARA TOMA DE MUESTRA ...................................................................................... 11 TOMA DE MUESTRA ............................................................................................................................. 11 ENTREGA DE RESULTADOS AMBULATORIOS .......................................................................................... 11 ARANCEL DE EXÁMENES ........................................................................................................................ 11 FORMULARIO DE SOLICITUDES DE EXÁMENES ....................................................................................... 11 POLÍTICAS DE CALIDAD DE LA UNIDAD DE LABORATORIO ................................................................. 12 Tiempo de respuesta exámenes de Urgencia ......................................................................................... 12 Tiempo de respuesta exámenes de bacteriologia................................................................................... 12 Reporte de Valores Criticos ................................................................................................................... 13 Confidencialidad de Resultados …………………………………………………………………………………………………..………….14 Consentimiento Informado……………………………………………………………………………………………………………………..15 Participación de Programa Externo de Evaluacion de la Calidad………………………………………………………………16 Registro……………………………………………………………………………………………………………………………………………………16 Sistema Informatico para visualizacion de resultados…………………………………………………………………………….16 PLAN DE CALIDAD............................................................................................................................ 17 EXÁMENES QUE REALIZA EL LABORATORIO ...................................................................................... 20 SANGRE, HEMATOLOGIA ......................................................................................................................................................................... 20 SANGRE, EXAMENES BIOQUIMICOS ....................................................................................................................................................... 20 SANGRE, HORMONAS .............................................................................................................................................................................. 21 LISTA DE EXAMENES DE URGENCIA .................................................................................................. 25 EXÁMENES DERIVADOS A OTROS ESTABLECIMIENTOS: .................................................................... 27 BIOSEGURIDAD EN LA TOMA DE MUESTRAS..................................................................................... 33 BIOSEGURIDAD DEL PACIENTE ............................................................................................................... 33 BIOSEGURIDAD DEL PERSONAL .............................................................................................................. 33 USO DE BARRERAS PROTECTORAS: ........................................................................................................ 33 ÁREA DE TRABAJO Y EQUIPAMIENTO:.................................................................................................... 33 ELIMINACIÓN DE MATERIAL CORTOPUNZANTE. .................................................................................... 34 BIOSEGURIDAD EN TRANSPORTE DE MUESTRAS............................................................................... 34 Condiciones generales de transporte: .................................................................................................... 34 Transporte en correo Neumatico: .......................................................................................................... 34 REGLAS GENERALES DE TOMA DE MUESTRA .................................................................................... 35 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 3 SOLICITUD DE EXÁMENES DE LABORATORIO .......................................................................................... 35 MATERIAL DE TOMA DE MUESTRA ......................................................................................................... 35 TIPOS DE TUBOS PARA TOMA DE MUESTRA ........................................................................................... 35 ANTICOAGULANTES PARA TOMA DE MUESTRA DE SANGRE .................................................................. 35 TIPOS DE TUBOS PARA OBTENCION DE MUESTRA SANGUINEA .............................................................. 36 MEZCLA POR INVERSIÓN ....................................................................................................................... 37 ORDEN DE EXTRACCIÓN ........................................................................................................................ 37 INDICACIONES GENERALES PREVIO A TOMA MUESTRAS EXAMENES DE SANGRE .................................... 38 INSTRUCCIONES A PACIENTES PARA TOMA DE EXAMENES DE LABORATORIO ......................................... 38 CONDICIONES GENERALES PARA TOMA DE MUESTRA ......................................................................... 38 CURVAS DE GLICEMIA O INSULINA......................................................................................................... 39 CONDICIONES PARA LA TOMA DE MUESTRA DE NIVELES DE DROGAS TERAPÉUTICAS............................ 39 CONDICIONES PARA LA TOMA DE MUESTRA DE PROLACTINA ............................................................... 39 ANTÍGENO PROSTÁTICO ESPECÍFICO Y LIBRE ......................................................................................... 39 CONDICIONES PARA LA TOMA DE MUESTRA DE ORINA COMPLETA, SEDIMENTO DE ORINA Y UROCULTIVO EN MUJERES .................................................................................................................... 39 CONDICIONES PARA LA TOMA DE MUESTRA DE ORINA COMPLETA, SEDIMENTO Y/O UROCULTIVO DE PRIMERA MICCIÓN EN HOMBRES .......................................................................................................... 40 INDICACION EXAMEN ORINA DE 24 HRS. ............................................................................................... 40 INDICACION EXAMEN ORINA DE 12 HRS. ............................................................................................... 41 ROTAVIRUS - INSTRUCTIVO PARA TOMA DE MUESTRA .......................................................................... 41 TEST DE GRAHAM .................................................................................................................................. 41 INSTRUCTIVO PARA TOMA DE MUESTRA DE EXAMEN PARASITOLOGICO SERIADO (TMT O PAFS) .......... 42 HEMORRAGIA OCULTA EN DEPOSICIÓN................................................................................................. 42 LEUCOCITOS FECALES ............................................................................................................................ 43 PROCEDIMIENTOS DE TOMA DE MUESTRA ....................................................................................... 44 ASPECTOS GENERALES PARA CUALQUIER MUESTRA ............................................................................ 44 TOMA DE MUESTRA DE SANGRE EN PACIENTES HOSPITALIZADOS .................................................... 45 TOMA DE MUESTRA DE SANGRE EN PACIENTES AMBULATORIOS...................................................... 53 TOMA DE MUESTRA DE DEPOSICIONES Y OTROS PARASITOLOGICOS ................................................ 58 TOMA Y ENVIO DE MUESTRAS PARA CULTIVO .................................................................................. 59 INTRODUCCION: .................................................................................................................................... 59 GENERALIDADES EN LA TOMA DE MUESTRAS PARA CULTIVOS ........................................................................................................... 59 PROCEDIMIENTOS DE TOMA DE MUESTRAS RESPIRATORIAS: ................................................................. 61 LAVADO BRONQUIOALVEOLAR (LBA)..................................................................................................................................... 61 MINILAVADO BRONQUIOALVEOLAR (MiniLBA)..................................................................................................................... 61 ASPIRADO ENDOTRAQUEAL (AET) .......................................................................................................................................... 62 ASPIRADO NASOFARINGEO (ANF) .......................................................................................................................................... 62 MUESTRA DE EXPECTORACIÓN .............................................................................................................................................. 63 MUESTRA DE SECRECION FARINGEA ...................................................................................................................................... 63 PROCEDIMIENTOS DE TOMA DE MUESTRA DE HEMOCULTIVOS Y CATÉTERES VENOSOS CENTRALES (CVC)¡Error! M TOMA DE MUESTRAS DE HEMOCULTIVOS: ........................................................................................................................... 64 MUESTRAS PARA CULTIVO DE CATÉTERES VENOSOS CENTRALES ....................................................................................... 67 PROCEDIMIENTOS DE TOMA DE MUESTRA DE ORINA PARA CULTIVO .................................................... 68 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 4 PROCEDIMIENTO DE TOMA DE MUESTRAS DE LÍQUIDO CEFALORRAQUIDEO......................................... 70 PROCEDIMIENTOS PARA TOMA DE MUESTRAS DE CAVIDADES SEROSAS ............................................... 71 PROCEDIMIENTOS DE TOMA DE MUESTRAS DE TRACTO GENITAL ......................................................... 71 MUESTRAS DEL TRACTO GENITAL MASCULINO .................................................................................................................... 71 MUESTRAS DEL TRACTO GENITAL FEMENINO ....................................................................................................................... 72 PROCEDIMIENTOS DE TOMA DE MUESTRAS DE TRACTO GASTROINTESTINAL ........................................ 73 PROCEDIMIENTOS DE TOMA DE MUESTRAS OCULARES ......................................................................... 75 PROCEDIMIENTOS DE TOMA DE MUESTRAS OTICAS .............................................................................. 76 PROCEDIMIENTOS DE TOMA DE MUESTRAS DE PIEL Y TEJIDOS BLANDOS .............................................. 76 PROCEDIMIENTOS DE TOMA DE MUESTRAS PARA INFECCIÓN ARTICULAR, OSEA Y DE MEDULA OSEA ... 78 PROCEDIMIENTOS DE TOMA DE MUESTRAS DE AGUAS DE DIALISIS....................................................... 80 MUESTRAS PARA ESTUDIO DE TUBERCULOSIS. ................................................................................. 81 CAUSAS DE RECHAZO DE MUESTRAS ................................................................................................ 84 RECHAZO ADMINISTRATIVO ......................................................................................................................... 84 RECHAZO TÉCNICO ..................................................................................................................................... 84 Hemólisis:.............................................................................................................................................. 84 Burbujas de aire .................................................................................................................................... 85 Coágulos................................................................................................................................................ 85 Recomendaciones para mantener "frescas" las muestras: .................................................................. 85 LISTA ALFABETICA DE EXAMENES DE LABORATORIO CON DETALLE DE INFORMACION TÉCNICA......... 87 ÁCIDO LÁCTICO PLASMÁTICO Bioquímica ............................................................................................................................... 87 ÁCIDO LÁCTICO LCR Bioquímica ............................................................................................................................................... 88 ÁCIDO ÚRICO PLASMÁTICO Bioquímica ................................................................................................................................... 89 ÁCIDO ÚRICO ORINA AISLADA Bioquímica .............................................................................................................................. 90 ÀCIDO URICO URINARIO DE 24 HORAS Bioquímica ................................................................................................................ 91 ACIDO VALPROICO, NIVELES DE Bioquímica ............................................................................................................................ 92 ADENOSINDEAMINASA (ADA) Inmunología ............................................................................................................................. 93 ALBÚMINA SÉRICA Bioquímica ................................................................................................................................................. 94 ALBUMINA ORINA Y LCR Bioquímica ........................................................................................................................................ 95 ALFA 1 ANTITRIPSINA AAT Inmunología ................................................................................................................................... 96 ALFAFETOPROTEINA (AFP) Inmunología .................................................................................................................................. 97 AMILASA EN SANGRE Bioquímica ............................................................................................................................................. 98 AMILASA URINARIA ORINA AISLADA Bioquímica .................................................................................................................... 98 AMILASA URINARIA DE 24 HORAS Bioquímica ...................................................................................................................... 100 AMONIO PLASMÁTICO Bioquímica ........................................................................................................................................ 101 ANTICUERPOS ANTI CARDIOLIPINAS (ACA) Inmunología ...................................................................................................... 102 ANTICUERPOS ANTI CENTROMERO Inmunología .................................................................................................................. 103 ANTICUERPOS ANTI CITOPLASMA DE NEUTRÓFILOS (ANCA) Inmunología ........................................................................ 104 ANTICUERPOS ANTI DNA Inmunología ................................................................................................................................... 105 ANTICUERPOS ANTI ENA Inmunología ................................................................................................................................... 106 ANTICUERPOS ANTI ESTREPTOLISINA O ASO Inmunología ................................................................................................... 107 ANTICUERPOS ANTI GLIADINICOS IgG - IgA Inmunología ..................................................................................................... 108 ANTICUERPOS ANTI MITOCONDRIAL AMA Inmunología ...................................................................................................... 109 ANTICUERPOS ANTI MUSCULO LISO ASMA Inmunología ..................................................................................................... 110 ANTICUERPOS ANTI NUCLEARES ANA Inmunología .............................................................................................................. 111 ANTICUERPOS ANTI PEROXIDASA TIROIDEA Anti-TPO Inmunología .................................................................................... 112 ANTICUERPOS ANTIPLAQUETARIOS AAP Inmunología ......................................................................................................... 113 ANTICUERPOS ANTI TIROGLOBULINA Anti-Tg Inmunología ................................................................................................. 113 ANTICUERPOS ANTI TRANSGLUTAMINASA IgA Inmunología .............................................................................................. 114 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 5 ANTIGENO CA-125 (CA-125) Inmunología .............................................................................................................................. 115 ANTIGENO CA 19-9 (CA 19-9) Inmunología ............................................................................................................................ 116 ANTIGENO CARCINO EMBRIONARIO CEA Inmunología ........................................................................................................ 117 ANTIGENO PROSTATICO ESPECIFICO FRACCION LIBRE (PSA LIBRE) Inmunología ........................................................... 118 ANTIGENO PROSTATICO ESPECIFICO – TOTAL (PSA TOTAL) Inmunología ..................................................................... 119 BACILOSCOPIA Y CULTIVO DE KOCH CONTENIDO GASTRICO TBC .................................................................................... 119 BACILOSCOPIA Y CULTIVO DE KOCH EXPECTORACION TBC .............................................................................................. 120 BACILOSCOPIA Y CULTIVO DE KOCH LIQUIDOS TBC .......................................................................................................... 121 BACILOSCOPIA Y CULTIVO DE KOCH ORINA TBC ................................................................................................................ 121 BACILOSCOPIA Y CULTIVO DE KOCH TEJIDOS (ganglio, biopsia de diferentes tejidos) TBC ............................................ 122 BETA HCG, HORMONA GONADOTROFINA CORIONICA Bioquímica ................................................................................... 123 BETA 2 MICROGLOBULINA Inmunología ................................................................................................................................ 124 BILIRRUBINA TOTAL Y DIRECTA Bioquímica ........................................................................................................................... 125 BORDETELLA PERTUSSIS IgG - IgA Inmunología ..................................................................................................................... 126 BRUCELLA, ANTICUERPOS IgM –IgG Inmunología ................................................................................................................. 127 CALCIO Bioquímica .................................................................................................................................................................. 128 CALCIO IONICO Bioquímica ..................................................................................................................................................... 129 CALCIO URINARIO MUESTRA AISLADA Bioquímica ............................................................................................................... 130 CALCIO URINARIO DE 24 HORAS Bioquímica ......................................................................................................................... 131 CARBAMAZEPINA, NIVELES DE Bioquímica............................................................................................................................ 132 CHLAMYDIA PNEUMONIAE AC IgM Inmunología .................................................................................................................. 132 CISTICERCOSIS Inmunología .................................................................................................................................................... 133 CITOMEGALOVIRUS IgG – IgM Inmunología .......................................................................................................................... 133 COLESTEROL EN LIQUIDOS BIOLOGICOS .............................................................................................................................. 134 COLESTEROL TOTAL Bioquímica ............................................................................................................................................. 134 COLESTEROL- HDL Bioquímica ................................................................................................................................................ 135 COLINESTERASA Bioquímica ................................................................................................................................................... 136 COMPLEMENTO C3 – C4 Inmunología .................................................................................................................................... 137 COPROCULTIVO Microbiologia................................................................................................................................................. 138 CORTISOL Bioquímica .............................................................................................................................................................. 139 CORTISOL, ORINA 24 HORAS Bioquímica ............................................................................................................................... 140 CREATINKINASA TOTAL (CK TOTAL) Bioquímica .................................................................................................................... 141 CREATINKINASA MB (CK MB) Bioquímica .............................................................................................................................. 142 CREATININA EN SUERO Bioquímica ........................................................................................................................................ 143 CREATININA URINARIA MUESTRA AISLADA Bioquímica ....................................................................................................... 144 CREATININA CLEARENCE CORREGIDO DE Bioquímica ......................................................................................................... 145 CUERPOS CETÓNICOS EN SANGRE Y ORINA Bioquímica....................................................................................................... 146 CULTIVO CORRIENTE Microbiología ........................................................................................................................................ 147 DENSIDAD URINARIA Orinas .................................................................................................................................................. 148 DHEA-S (SULFATO DE DESHIDROEPIANDROSTERONA) Bioquímica ..................................................................................... 149 DIGOXINA, NIVELES DE Inmunología ...................................................................................................................................... 150 DIMERO-D Coagulación .......................................................................................................................................................... 151 ELECTROFORESIS DE PROTEINAS SERICAS Inmunología ....................................................................................................... 152 ELECTROFORESIS DE PROTEINAS ORINA Inmunología .......................................................................................................... 152 ELECTROLITOS PLASMATICOS Bioquímica ............................................................................................................................. 153 ELECTROLITOS URINARIOS Bioquímica .................................................................................................................................. 154 EPSTEIN BARR VIRUS, Ac. IgM (ANTI VCA IgM) Inmunologia ................................................................................................ 155 EOSINÓFILOS NASALES Hematología ...................................................................................................................................... 156 ESTRADIOL Bioquímica ............................................................................................................................................................ 157 FACTOR REUMATOIDEO Inmunología .................................................................................................................................... 158 FENITOINA, NIVELES DE Bioquímica ....................................................................................................................................... 159 FENOBARBITAL, NIVELES DE Bioquímica................................................................................................................................ 159 FERRITINA Inmunología ........................................................................................................................................................... 160 FIBRINOGENO PLASMATICO, DETERMINACION CUANTITATIVA DE Coagulación .............................................................. 161 FIERRO Bioquímica................................................................................................................................................................... 162 FIERRO Y TIBC (CAPACIDAD TOTAL DE FIJACIÓN DE FIERRO) Bioquímica ........................................................................... 163 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 6 FOSFATASA ALCALINA (ALP) Bioquímica ................................................................................................................................ 164 FÓSFORO Bioquímica............................................................................................................................................................... 165 FÓSFORO URINARIO MUESTRA AISLADA Bioquímica ........................................................................................................... 166 FÓSFORO URINARIO DE 24 HORAS Bioquímica ..................................................................................................................... 167 FSH, HORMONA FOLICULO ESTIMULANTE Bioquímica ........................................................................................................ 168 GAMMA-GLUTAMILTRANSPEPTIDASA (GGT) Bioquímica .................................................................................................... 169 GASES EN SANGRE Bioquímica ............................................................................................................................................... 170 GLUCOSA EN SANGRE Bioquímica .......................................................................................................................................... 171 GLUCOSA EN ORINA AISLADA Bioquímica .................................................................................................................... 172 GLUCOSA EN ORINA DE 24 HORAS Bioquímica .................................................................................................................... 173 HANTA VIRUS TEST RAPIDO Bioquímica ................................................................................................................................ 174 HAPTOGLOBINA Inmunología ................................................................................................................................................. 175 HEMOCULTIVO Microbiología.................................................................................................................................................. 176 HEMOGLOBINA GLICOSILADA (HBA1C) Bioquímica ............................................................................................................... 176 HEMOGRAMA Hematología .................................................................................................................................................... 177 HEMOPHILUS INFLUENZAE TIPO B, ANTICUERPOS ANTI Inmunología ................................................................................ 178 HEMORRAGIAS OCULTAS Parasitologia ................................................................................................................................. 178 HEPATITIS A, ANTICUERPOS IgM Inmunología....................................................................................................................... 179 HEPATITIS B, ANTIGENO DE SUPERFICIE Inmunología .......................................................................................................... 180 HEPATITIS B, TEST RAPIDO Bioquímica .................................................................................................................................. 181 HEPATITIS C, ANTICUERPOS Inmunología .............................................................................................................................. 182 HEPATITIS C, TEST RAPIDO Bioquímica .................................................................................................................................. 183 HERPES SIMPLE 1 VIRUS, SEROLOGIA IgG Inmunologia ........................................................................................................ 184 HERPES SIMPLE 2 VIRUS, SEROLOGIA IgG Inmunologia ........................................................................................................ 185 HIDATIDOSIS IgG Inmunología.............................................................................................................................................. 186 HIV, COMBO ANTIGENO - ANTICUERPO Inmunología ........................................................................................................... 186 HIV TEST RAPIDO Bioquímica .................................................................................................................................................. 187 HTLV I/II, ANTICUERPOS Bioquímica ...................................................................................................................................... 188 INFLUENZA tipo A y B, TEST RAPIDO Bioquímica .................................................................................................................. 189 INMUNOELECTROFORESIS DE SANGRE, CADENAS LIVIANAS Inmunología ......................................................................... 190 INMUNOELECTROFORESIS DE ORINA, CADENAS LIVIANAS Inmunología ............................................................................ 190 INMUNOELECTROFORESIS DE SANGRE, CADENAS PESADAS Inmunología.......................................................................... 191 INMUNOELECTROFORESIS DE ORINA, CADENAS PESADAS Inmunología ............................................................................ 191 INMUNOGLOBULINA IgA – IgM – IgG Inmunología ............................................................................................................... 192 IgE TOTAL Inmunología ............................................................................................................................................................ 193 INSULINA Bioquímica............................................................................................................................................................... 194 INSULINEMIA, CURVA DE (2 MUESTRAS) Bioquímica ........................................................................................................... 195 ION CLORO Bioquímica............................................................................................................................................................ 196 LACTATO DESHIDROGENASA (LDH) Bioquímica .................................................................................................................... 196 LACTATO DESHIDROGENASA (LDH) LIQUIDOS BIOLOGICOS Bioquímica........................................................................... 197 LH, HORMONA LUTEINIZANTE Bioquímica ............................................................................................................................ 198 LIPASA Bioquímica ................................................................................................................................................................... 199 LÍQUIDO ASCÍTICO, CITOQUÍMICO DE Bioquímica ................................................................................................................ 200 LÍQUIDO CEFALORRAQUIDEO, CITOQUÍMICO DE Bioquímica.............................................................................................. 201 LÍQUIDO PLEURAL, CITOQUÍMICO DE Bioquímica ................................................................................................................ 202 LÍQUIDO PLEURAL, pH Bioquímica ......................................................................................................................................... 203 LÍQUIDO SINOVIAL, CITOQUÍMICO DE Bioquímica ............................................................................................................... 204 LITIO, NIVELES PLASMÁTICOS DE Bioquímica ........................................................................................................................ 205 MAGNESIO Bioquímica ............................................................................................................................................................ 206 MAGNESIO ORINA AISLADA Bioquímica ................................................................................................................................ 207 MAGNESIO ORINA 24 HORAS Bioquímica.............................................................................................................................. 208 MICROHEMAGLUTINACIÓN ANTI Treponema pallidum (MHA TP) Serología .................................................................... 209 MIELOGRAMA Hematología .................................................................................................................................................... 210 MICROALBUMINURIA AISLADA Bioquímica ........................................................................................................................... 211 MICROALBUMINURIA DE 24 HORAS Bioquímica................................................................................................................... 212 MYCOPLASMA, ANTICUERPOS IgM –IgG Inmunología .......................................................................................................... 213 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 7 NITROGENO UREICO SANGUINEO (BUN) Bioquímica ........................................................................................................... 214 ORINA COMPLETA Orinas....................................................................................................................................................... 215 PARASITOLÓGICO SERIADO DE DEPOSICIONES Parasitología .............................................................................................. 216 PARASITOLÓGICO EN CONTENIDO DUODENAL Parasitología .............................................................................................. 216 PARATOHORMONA INTACTA (PTH INTACTA) Bioquímica .................................................................................................... 217 PERFIL CRITICO Bioquímica ..................................................................................................................................................... 217 PERFIL LIPIDICO Bioquímica .................................................................................................................................................... 219 pH y BENEDICT EN DEPOSICIONES Parasitología .................................................................................................................. 220 PRE ALBUMINA Inmunología ................................................................................................................................................... 220 PROGESTERONA TOTAL Bioquímica ....................................................................................................................................... 221 PROTEINA C REACTIVA (PCR) Bioquímica .............................................................................................................................. 222 PROTEÍNAS TOTALES SÉRICAS Bioquímica ............................................................................................................................. 223 PROTEINURIA AISLADA Bioquímica ........................................................................................................................................ 224 PROTEINURIA DE 24 HORAS Bioquímica ................................................................................................................................ 225 PROLACTINA Bioquímica ......................................................................................................................................................... 226 PRUEBA DE TOLERANCIA A LA GLUCOSA ORAL (PTGO) Bioquímica .................................................................................... 227 RECUENTO RETICULOCITOS Hematología .............................................................................................................................. 228 ROTAVIRUS, DEPOSICIONES PARA BUSQUEDA DE Inmunología .......................................................................................... 229 RUBEOLA, ANTICUERPOS IgG Inmunología ............................................................................................................................ 230 RUBEOLA, ANTICUERPOS IgM Inmunología ........................................................................................................................... 230 SCREENING METABÓLICO Serología ...................................................................................................................................... 231 SEDIMENTO URINARIO Orinas ............................................................................................................................................... 232 T3 HORMONA TRIYODOTIRONINA Bioquímica ..................................................................................................................... 233 T4 LIBRE, HORMONA TETRAYODOTIRONINA LIBRE Bioquímica .......................................................................................... 234 TSH, HORMONA TIROESTIMULANTE Bioquímica .................................................................................................................. 234 TEST DE GRAHAM Parasitología ............................................................................................................................................. 235 TEST DE MUCOPOLISACARIDOSIS (TEST DE BERRY) Serología ............................................................................................ 236 TEST DE NITROPRUSIATO Serología....................................................................................................................................... 236 TEST DEL SUDOR Serología ..................................................................................................................................................... 237 TESTOSTERONA TOTAL Bioquímica ........................................................................................................................................ 238 TIEMPO DE PROTROMBINA (PT) Coagulación ....................................................................................................................... 239 TIEMPO DE SANGRÍA Coagulación ......................................................................................................................................... 240 TIEMPO DE TROMBOPLASTINA PARCIAL ACTIVADA (TTPA) Coagulación ........................................................................... 241 TOXOPLASMA GONDII, ANTICUERPOS IgG Inmunología....................................................................................................... 242 TOXOPLASMA GONDII, ANTICUERPOS IgM ......................................................................................................................... 243 TRANSAMINASA GLUTÁMICO OXALOACÉTICO (GOT), TRANSAMINASA GLUTÁMICO PIRÚVICO (GPT) Bioquímica ....... 244 TRIGLICÉRIDOS Bioquímica ..................................................................................................................................................... 245 UROCULTIVO…………..…………………………………………………………………………………………………………………………………………..……246 VARICELLA – ZOSTER, VIRUS Inmunología............................................................................................................................ 246 VDRL EN SUERO Serología ...................................................................................................................................................... 247 VDRL EN LCR Serología ........................................................................................................................................................... 248 VELOCIDAD DE SEDIMENTACIÓN GLOBULAR (VHS) Hematología ....................................................................................... 249 VIRUS RESPIRATORIOS, ANTIGENOS POR IFI ADV, VRS, IA, IB, PI-1, PI-2, PI-3, METAPNEUMOVIRUS Inmunología ........ 250 DOCUMENTACIÓN DE REFERENCIA............................................................................................................... 251 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 8 INTRODUCCION El Manual de Exámenes de Laboratorio y Toma de Muestras ha sido confeccionado como un elemento de apoyo para los servicios clínicos, de manera de conocer el funconamiento interno y lograr la mejor utilización del recurso diagnóstico que el laboratorio aporta. Se han incorporado las Normas de Procedimientos del Ministerio de Salud que tienen relación con el manejo de fluidos corporales de alto riesgo y desecho de material cortopunzante; así como también, aspectos administrativos e indicaciones generales que permiten un manejo adecuado de las muestras que serán procesadas en el laboratorio clínico. Al final del manual se ha incorporado un apartado con la descripción de todas las técnicas realizadas en el laboratorio, que incluye los requerimientos de la muestra, tiempos de respuesta y valores de referencia. Este manual se encontrará disponible con todas sus actualizaciones en el sitio web del Hospital. (http://www.hhha.cl/) OBJETIVOS • • • • • • • • Conocer el funcionamiento general del Laboratorio. Conocer los exámenes disponibles tanto en rutina como en turno de 24 horas. Conocer las normas del laboratorio del hospital en cuanto a: o Condiciones del paciente para realizar examen. o Tipo de frasco o tubo, utilización de anticoagulante, jeringa heparinizada, etc. o Cantidad de sangre requerida. o Datos complementarios del paciente, en algunos exámenes se solicita por ejemplo, el peso, la talla, la edad, la temperatura, etc. o Obtener de manera correcta la muestra. Conocer el horario de recepción de muestras en laboratorio y los exámenes que son considerados de urgencia y que se pueden enviar las 24 horas del día. Constatar la correcta rotulación de los frascos y adjuntar la orden de solicitud al ser enviadas las muestras al laboratorio. Informar al personal encargado del transporte de las muestras, sobre las medidas de seguridad en el manejo de estas, uso de receptáculo plástico tapado y frascos en posición vertical, evitando que se destapen o volteen, no utilizar frascos con tapón de algodón. Al recibir el informe de los resultados, interpretarlos y controlarlos por médico residente o tratante, si se presentan valores alterados. Obtener prioritariamente los exámenes de urgencia y preocuparse del control de los resultados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 9 DESCRIPCIÓN DE LA UNIDAD DE LABORATORIO CLÍNICO Y SU ORGANIZACIÓN INTERNA La Unidad de laboratorio clínico del Hospital Dr Hernán Henríquez Aravena de Temuco comprende tanto el área de laboratorio como la toma de muestra. El Laboratorio se encuentra ubicado en el séptimo piso del Edificio Nuevo y la toma de muestra se encuentra ubicada en la planta baja del CDT. Organizacionalmente se encuentra estructurado en distintas secciones de trabajo, cuyo encargado y teléfonos se detallan a continuación: AREA Secretaría ENCARGADO Srta Roxanna Rocha Srta Rubidia Olivero FONO 459021 Jefatura Supervisión Bacteriología Bioquímica Hematología y Coagulación Inmunología Orinas Serología Toma de muestra Tuberculosis Dr. Juan Carlos Araya TM María Inés Henríquez TM Patricia Reydet BQ Marcela González TM Christian Pailañir QF Jaime Inostroza BQ Marcela González TM Marcela Alvarez TM María Inés Henríquez TM Rafael Riffo 458750 458731 459022 459015 459024 459030 459026 459016 459018 459019 HORARIOS DE ATENCION LABORATORIO DE RUTINA La unidad de laboratorio clínico funciona en horario hábil para la recepción de muestras y procesamiento de los exámenes de pacientes ambulatorios o para exámenes no considerados dentro de la cartera de exámenes de urgencia. Horario de lunes a viernes de 8.00 a 16.50 hrs. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 10 LABORATORIO DE URGENCIA 24 HORAS Para la recepción y procesamiento de exámenes de pacientes hospitalizados y de urgencia durante las 24 horas del día (ver exámenes considerados de urgencia en página 25. ENTREGA DE HORA PARA TOMA DE MUESTRA En el caso de requerir toma de muestra los pacientes ambulatorios deben acudir a pedir hora a la Toma de Muestra, mostrando su carnet de identidad y comprobante de hora de atención en policlínico. Horario de lunes a viernes de 10.00 a 16.40 hrs TOMA DE MUESTRA Lunes a viernes desde las 8.00 hasta las 16.30 hrs. ENTREGA DE RESULTADOS AMBULATORIOS Horario de lunes a viernes de 10.30 a 16.40 hrs Se entregan resultados presentando el carnet de identidad del paciente. A excepción de exámenes de carácter confidencial (Ver página 14) ARANCEL DE EXÁMENES El Hospital como integrante de la red pública aplica aranceles de FONASA en Modalidad Institucional. Los usuarios FONASA C, FONASA D, Isapre y particulares deberán cancelar en cualquier caja del establecimiento previo a la atención. FORMULARIO DE SOLICITUDES DE EXÁMENES Sólo se reciben muestras que vengan con el formulario institucional de solicitud de exámenes.. La solicitud de examen de VIH, exámenes bacteriológicos, exámenes de TBC y exámenes de sifilis tienen un formulario especial de uso obligatorio. El laboratorio clínico se reserva el derecho de rechazar órdenes incompletas, ilegibles o que no vengan en formulario institucional. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 11 POLÍTICAS DE CALIDAD DE LA UNIDAD DE LABORATORIO TIEMPO DE RESPUESTA El tiempo de respuesta se define como el tiempo transcurrido entre la recepción de la muestra en el laboratorio y que el examen se ha validado en el sistema informático, por lo que se encuentra disponible. El laboratorio ha definido los tiempos de respuesta para cada examen que realiza, cuyo detalle puede visualizarse en el listado alfabético por examen (ver página 87 en adelante). TIEMPO DE RESPUESTA EXÁMENES DE URGENCIA Tipo de examen Exámenes de urgencia disponibles 24 horas (ver página 11 ) Perfil crítico Hemograma automatizado Pruebas de coagulación Gases arteriales Procedencia Servicios de urgencia adulto, urgencia infantil y urgencia obstétrica. Pabellón y unidades de paciente crítico Pabellón Pabellón Cualquier procedencia Tiempo de respuesta 2 horas 30 minutos 30 minutos 30 minutos 60 minutos TIEMPO DE RESPUESTA EXÁMENES DE BACTERIOLOGIA El tiempo de respuesta de exámenes bacteriológicos depende del tipo de muestra, del desarrollo bacteriano y del tipo de bacteria (s) aislada(s). Los tiempos de respuesta que nuestro Laboratorio compromete son los siguientes: TIEMPO DE RESPUESTA (días hábiles) Negativo Urocultivo Hemocultivo Líquidos Orgánicos Líq peritoneal de peritoneodiálisis Tejidos Secreciones Coprocultivos 1 5 3 5 7 2 2 Cultivo de Hongos VRE Agua de diálisis 15 2 2 Positivo 2o+ Microorg complejo 3 Hasta 4 3 3 o más 3 Hasta 4 3 3 4 o más 4 o más 2 3 Hasta 4 Positivo para salmonella, shigella, yersinia o vibrio: 2 días Búsqueda ECEH 15 días o más (derivado a ISP) 3 3 2 1 Microorganismo 2 2 2 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 12 REPORTE DE VALORES CRITICOS De acuerdo a la política institucional de calidad y seguridad de los pacientes el Laboratorio clínico cuenta con un procedimiento de notificación de valores críticos para pacientes hospitalizados y de los servicios de urgencia, definidos de acuerdo a la situación de riesgo y necesidad de intervención terapéutica oportuna. Cuando un resultado de examen es lo suficientemente desviado de la condición normal como para poner en riesgo la vida del paciente si no se comienza un tratamiento en forma inmediata, el tecnólogo médico del laboratorio responsable del examen deberá avisar telefónicamente al médico o enfermera tratante, EXCEPTO si el resultado previo del examen del paciente ya presentó nivel crítico y fue reportado. Se han definido los siguientes valores críticos en nuestro establecimiento: • Valores críticos cuantitativos: Analito Amilasa Bilirrubina total (RN) BUN Calcio CK total Cloro Creatininemia Fósforo Glucosa Magnesio Potasio Sodio PCO2 arterial pH arterial pH venoso PO2 arterial Hematocrito Hemoglobina Leucocitos Plaquetas Blastos Bioquímica Valor crítico mínimo ------< 6 mg/dL --< 80 mEq/L --- Valor crítico máximo > 500 U/L > 20 mg/dL > 100 mg/dL > 13 mg/dL > 500 U/L > 125 mEq/L > 7 mg/dL * --> 400 mg/dL --> 6 mEq/L > 152 mEq/L < 1 mg/dL < 40 mg/dL < 1 mg/dL <2,8 mEq/L < 125 mEq/L Bioquímica de gases < 20 mm Hg < 7,1 < 7,1 < 40 mm Hg Hematología < 15% < 5 g/dL 3 < 1.500/mm ** 3 < 20.000/mm > 65 mm Hg > 7,59 >7.6 --- > 1.000.000/mm Presencia 3 Coagulación Protrombina TTPA INR > 5 > 120 seg Fármacos Fenitoína Fenobarbital Carbamazepina Litio Acido Valproico > 40 ug/mL > 60 ug/mL > 20 ug/mL > 1,6 mEq/L (> 2 mmol/L) > 150 ug/mL * Excepto caso de paciente con insuficiencia renal crónica y ** Excepto caso de paciente en quimioterapia. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 13 • • • • • • • Valores críticos (cualitativos) del área de microbiología informados a servicio clinico: Hemocultivo positivo (2, 3, 4) Tinción de Gram o cultivo positivo (+) de LCR Tinción de Gram o cultivo positivo (+) de líquidos estériles (peritoneal, pleural, etc.) Tinción de Gram o cultivo positivo (+) de muestras de pabellón. Enfermedad invasiva por Neisseria meningitidis Cultivo o aislamiento positivo para: Corynebacterium diphteriae, Bordetella pertussis(Inmunofluorescecia directa) • Detección positiva de antígenos: Cryptococcus neoformans Streptococcus grupo B Haemophilus influenzae b Neisseria meningitidis A,C,Y, W135 Neisseria meningitidis B/E. coli K1 Streptococcus pneumoniae • Tinción acidoresistente o cultivo positivo para Mycobacterium tubeculosis • Valores críticos (cualitativos) del área de microbiología informado a IAAS: • Toxina A y/o B positiva para Clostridium difficile • Desarrollo de microorganismos IAAS: Serratia spp, Stenotrophomonas maltophila y Burkholderia cepacia. • Recuento > 200 UFC/mL en agua de diálisis, > 2000 UFC/mL el Líquido de diálisis. CONFIDENCIALIDAD DE RESULTADOS Para asegurar la confidencialidad de los resultados el laboratorio ha dispuesto las siguientes políticas: No se entregan resultados de exámenes por teléfono. En el caso de pacientes ambulatorios: los resultados de exámenes se entregan sólo al paciente o a quien este autorice, siempre que presente el carnet de identidad del paciente. En pacientes hospitalizados los resultados se entregan a un funcionario del servicio clínico de procedencia del paciente. En el caso de exámenes de VIH, los resultados se entregan sólo al profesional o médico solicitante. Existe también una categoría de confidencial los siguientes exámenes en la web de laboratorio: • VIH • Hepatitis C • Hepatitis B • Sífilis VDRL Para poder acceder a esta información en la web debe acceder el médico con su clave personal. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 14 CONSENTIMIENTO INFORMADO De acuerdo a la Ley 19.779 y el Reglamento del examen para la detección del Virus de Inmunodeficiencia Humana Decreto Nº 182 de 2005 del Minsal, el laboratorio SOLO procesa examen para determinar presencia de virus de inmunodeficiencia humana (VIH) si la muestra se acompaña del consentimiento informado donde viene codificado el paciente, con firma y nombre del médico tratante. PARTICIPACIÓN EN PROGRAMA EXTERNO DE EVALUACIÓN DE LA CALIDAD Cada año el laboratorio se incorpora en el PEEC realizado por el Instituto de Salud Pública (ISP). Nuestra participación incluye los siguientes programas: • • • • • • • • • • • • • • • • • • • • • • • • • • • Bacteriología Serología de sífilis Micobacterias Serología de VIH Serología de Hepatitis B Serología de Hepatitis C Virus respiratorio Inmunología básica (factor reumatoideo y proteína c reactiva) Inmunología de proteínas ( igg ea. Ief) Autoinmunidad (AAN, antiDNA) Marcadores tumorales (CA 125, CEA, AFP, Ca 19-9) Inmunoglobulina e total Anticuerpos anti ENA Hemoglobinometría (Hb) Coagulación (PT + TTPK) Morfología sanguínea Recuento de reticulocitos Coproparasitológico Serologia de hidatidosis Serologia toxoplasmosis Quimica sanguinea. Quimica orina cualitativa Hormonas tiroideas (T3, TSH y T4 libre) Orina cuantitativa Hemoglobina glicosilada Hormonas de la reproducción (LH, FSH) Colinesterasa MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 15 REGISTROS De acuerdo a Reglamento de Laboratorios Clínicos en revisión que modifica y actualiza DTO. Nº 433 DE 1993: todos los registros de muestras e informes deberán conservarse durante un período de 5 años. SISTEMA INFORMÁTICO PARA VISUALIZACIÓN DE RESULTADOS Los resultados de exámenes de laboratorio se encuentran disponibles vía web en la página www.hhha.cl ∇ Sistemas Locales. Cada servicio tiene una contraseña general con la que puede visualizar e imprimir todos los resultados excepto aquellos confidenciales. Pueden acceder a visualizar todos los exámenes incluidos los confidenciales, los médicos del establecimiento, quienes deben solicitar clave al laboratorio, enviando un correo electrónico a [email protected] con su nombre completo, RUT y servicio clínico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 16 PLAN DE CALIDAD La unidad de laboratorio se encuentra desarrollando e implementando un programa de control de calidad y aseguramiento de la calidad, con el objetivo de otorgar un servicio consistente, de alta calidad y costo efectivo a nuestros clientes, que satisfaga y supere los requerimientos de las entidades acreditadoras. Dentro de nuestro quehacer y como una manera de evidenciar problemas e implementar mejorías tenemos un Plan de Calidad 2011 que involucra el seguimiento de indicadores en distintos niveles de los procesos que afectan al laboratorio: Indicadores preanalíticos • % Rechazo de muestras por causa y por servicio clínico: indicadores que buscan mejorar el uso eficiente de los recursos hospitalarios, día cama, insumos, etc Periodicidad de análisis: trimestral Responsable: supervisor de laboratorio o Nº de rechazos de muestra por hemólisis/número total de muestras o Nº de rechazos de muestras por nivel inadecuado/número total de muestras o Nº de rechazos de muestra por servicio clínico XX/número total de muestra del servicio clínico XX (*) (*)Umbral definido por revisión bibiografica: “Clinical Laboratory Specimen Rejection Association with characteristics the site of patient care and patient`s: Archives of Pathology and Laboratory medicine Vol 131, April 2007 • % Muestra única de hemocultivos: indicador que también busca mejorar la eficiencia en el uso de recursos, en este caso de alto costo para el hospital. Periodicidad de análisis: semestral Responsable: TM Seccion Bacteriologia (Hemocultivos) (*) Umbral definido por revisión bibliográfica: Indicadores analíticos • % de control de calidad interno satisfactorio % de Test con coeficiente de variación mayor que el rango valor establecido para cada técnica analítica al año/ total de Test al año. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 17 Umbral: 90% Responsable: Encargado de Calidad Unidad de Laboratorio Clinico. • % Control de calidad externo satisfactorio o Nº de analitos controlados en el PEEC con resultado satisfactorio/Nº total de analitos controlados en el PEEC. Umbral: 90% Periodicidad de análisis: semestral Responsable de medición: Encargado Calidad Unidad de Laboratorio Clinico Indicadores post analíticos • % Cumplimiento de reporte de VALORES CRÍTICOS CUALITATIVOS Y CUANTITATIVOS Dentro de nuestras prioridades se encuentra el aviso telefónico al médico tratante o enfermera responsable del paciente ante cualquier examen con resultado que involucre un riesgo vital para el paciente. o Nº de exámenes con valor crítico avisado al servicio clínico al mes/Nº total de exámenes por valor crítico al mes Umbral: 100% Periodicidad de análisis: mensual Responsable de medición: Jefe laboratorio • % Urocultivos con desarrollo polimicrobiano por servicio o Nº de urocultivos con desarrollo polimicrobiano por servicio clínico XX/Nº total de urocultivos por servicio clínico XX Umbral: depende de línea base(*) Periodicidad de análisis: trimestral Responsable de medición: TM Seccion Bacteriologia (Urocultivos) (*) Umbral definido por revisión bibliográfica: “Revista Chilena Infectologia Vol 18, Nº 1, 2001” • % Hemocultivos contaminados por servicio o Nº de hemocultivos contaminados por servicio clínico XX/Nº total de hemocultivos por servicio clínico XX Umbral: depende de línea base(*) Periodicidad de análisis: trimestral Responsable de medición: TM Seccion Bacteriologia (Hemocultivos) MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 18 • (*) Umbral definido por revisión bibliográfica: “Manual I.S.P., 1994” % Cultivos de Koch contaminados por muestras y por tubos o Nº de cultivos contaminados por muestras recibidas al año/Nº total de cultivos de koch anuales o Nº de cultivos contaminados por tubos al año/Nº total de cultivos de koch anuales. Umbral: <5% Periodicidad de análisis: anual Responsable de medición: TM Seccion TBC • % Cumplimiento tiempos de respuesta de exámenes de servicios de urgencia o Nº de exámenes de servicios de urgencia con TAT < de 2 horas/Nº total de exámenes de servicios de urgencia Umbral: 90% Periodicidad de análisis: mensual Responsable de medición: Jefe Laboratorio • % Cumplimiento tiempos de respuesta de perfil crítico o Nº de perfiles críticos validados en <30 minutos/Nº total de perfiles críticos Umbral: >90% Periodicidad de análisis: mensual Responsable de medición: Jefe Laboratorio • % Cumplimiento tiempos de respuesta de exámenes de pabellón o Nº de hemogramas y pruebas de coagulación de pabellón validados en <30 minutos/Nº total de hemogramas y pruebas de coagulación de pabellón Umbral: > 90% Periodicidad de análisis: mensual Responsable de medición: Jefe laboratorio MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 19 EXÁMENES QUE REALIZA EL LABORATORIO A continuación se detallan todas las prestaciones del Laboratorio Clínico: CODIGO GLOSA SANGRE, HEMATOLOGIA 03-01-003 Mielograma 03-01-010 Células del lupus, cada muestra 03-01-021 Fibrinógeno 03-01-026 Ferritina 03-01-027 Fibrinógeno, productos de degradación 03-01-028 Fierro sérico 03-01-029 Fierro, capacidad de fijación del 03-01-035 Haptoglobina cuantitativa 03-01-041 Hemoglobina glicosilada 03-01-045 Hemograma 03-01-048 Hemosiderina medular 03-01-054 Carboxihemoglobina 03-01-059 Protrombina e INR 03-01-068 Recuento de reticulocitos 03-01-072 Sangría, tiempo de 03-01-082 Transferrina 03-01-085 Tromboplastina, tiempo parcial 03-01-086 Velocidad de eritrosedimentación SANGRE, EXAMENES BIOQUIMICOS 03-02-004 Acido láctico 03-02-005 Acido úrico 03-02-035 Acido Valproico, nivel plasmático 03-02-060 Albúmina 03-02-008 Amilasa 03-02-010 Amonio 03-02-012 Bilirrubina total 03-02-013 Bilirrubina total y conjugada 03-02-015 Calcio 03-02-016 Calcio iónico 03-02-035 Carbamazepina, nivel plasmático 03-02-067 Colesterol total 03-02-068 Colesterol HDL 03-02-021 Colinesterasa en plasma o sangre total MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 20 03-02-023 03-02-024 03-02-025 03-02-026 03-02-030 03-02-032 03-02-034 03-02-035 03-02-035 03-02-035 03-02-040 03-02-042 03-02-045 03-02-046 03-02-047 03-02-048 03-02-050 03-02-053 03-02-055 03-02-056 03-02-057 03-02-075 03-02-060 03-02-061 03-02-076 03-02-063 03-02-063 03-02-064 Creatinina Creatinina, Clearence Creatinquinasa CK - MB miocárdica Creatinquinasa CK - total Deshidrogenasa láctica total (LDH) Electrolitos plasmáticos Perfil Lipídico Digoxina, nivel plasmático Fenitoína, nivel plasmático Fenobarbital, nivel plasmático Fosfatasas alcalinas totales Fósforo Gamma glutamiltranspeptidasa (GGT) Gases y equilibrio ácido base en sangre Glucosa Glucosa, Prueba de Tolerancia Adenosindeaminasa Lipasa Litio Magnesio Nitrógeno ureico y/o úrea Perfil bioquímico Proteínas totales o albúminas, c/u Proteínas, electroforesis Perfil Hepático) Transaminasas, oxalacética (GOT/AST) Transaminasas Pirúvica (GPT/ALT) Triglicéridos SANGRE, HORMONAS 03-03-006 Cortisol 03-03-008 Dehidroepiandrosterona 03-03-014 Gonadotrofina coriónica, sub-unidad beta 03-03-015 Hormona folículo estimulante (FSH) 03-03-016 Hormona luteinizante (LH) 03-03-017 Insulina 03-03-031 Insulina, curva 03-03-018 Parathormona 03-03-019 Progesterona 03-03-020 Prolactina (PRL) 03-03-022 Testosterona 03-03-024 Tiroestimulante (TSH) 03-03-026 Tiroxina libre (T4L) MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 21 03-03-028 03-03-030 03-05-001 03-05-003 03-05-004 03-05-005 03-05-005 03-05-005 03-05-005 03-05-084 03-05-005 03-05-005 03-05-005 03-05-007 03-05-007 03-05-007 03-05-181 03-05-008 03-05-009 03-05-070 03-05-070 03-05-170 03-05-170 03-05-010 03-05-012 03-05-012 03-05-020 03-05-022 03-05-023 03-05-027 03-05-027 03-05-027 03-05-028 03-02-059 03-05-031 03-05-031 03-05-032 03-06-001 03-06-002 03-06-004 03-06-005 03-06-007 03-06-008 Triyodotironina (T3) Estradiol Alfa -1- antitripsina Alfa fetoproteínas ENA screening Anticuerpos anti centrómero ANCAP ANCAc Anticuerpos anti DNA Anticuerpos anti Cardiolipina (ACA) Anticuerpos anti mitocondriales Anticuerpos anti músculo liso Anticuerpos anti nucleares (ANA) Anticuerpos anti peroxidasa (TPO) Anticuerpos anti plaquetarios Anticuerpos anti tiroglobulinas Anticuerpo anti transglutaminasa (TTG) Antiestreptolisina O Antígeno carcinoembrionario (CEA) Antígeno prostático específico total Antígeno prostático específico libre Antígeno Ca 125 Antígeno Ca 19-9 Beta-2-microglobulina Complemento C3 Complemento C4 Factor reumatoídeo Inmunoelectroforesis cadenas livianas Inmunoelectroforesis cadenas pesadas Inmunoglobulinas IgA Inmunoglobulinas IgG Inmunoglobulinas IgM Inmunoglobulinas IgE Prealbúmina Proteína C reactiva nefelometría Proteína C reactiva por técnicas turbidimétricas Proteínas Bence Jones por electroforesis Baciloscopía orina o líquidos Baciloscopía expectoración Examen directo al fresco Tinción de Gram Coprocultivo Cultivo corriente MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 22 03-06-009 03-06-011 03-06-014 03-06-015 03-06-016 03-06-018 03-06-021 03-06-023 03-06-026 03-06-034 03-06-037 03-06-041 03-06-041 03-06-042 03-06-045 03-06-046 03-06-047 03-06-048 03-06-051 03-06-052 03-06-057 03-06-059 03-06-061 03-06-061 03-06-061 03-06-061 03-06-069 03-06-069 03-06-069 03-06-069 03-06-069 03-06-069 Hemocultivo aerobio Urocultivo Campylobacter, Yersinia, Vibrio, c/u Difteria Neisseria gonorrhoeae (gonococo) Cultivo para bacilo de Koch, Neisseria meningitidis (meningococo) Mycoplasma Antibiograma Clamidias pneumoniae Mycoplasma IgG, IgM, c/u. Treponema pallidum FTA - ABS Treponema pallidum MHA-TP V.D.R.L. Coproparasitario seriado Cryptosporidium Coproparasitario seriado Fasciola Coproparasitario seriado Isospora Coproparasitológico seriado Teleman Graham, examen de Gusanos macroscópicos, diagnóstico de Tenias Diagnostico Coproparasitológico seriado PAFS ELISA Chagas IgG ELISA Cisticercosis IgG en suero y LCR ELISA hidatidosis IgG ELISA toxoplasmosis IgG e IgM Anticuerpos citomegalovirus IgG, IgM Anticuerpos herpes simple I IgG, IgM Anticuerpos herpes simple II IgG, IgM Anticuerpos rubéola IgG, IgM Anticuerpos varicela-zoster Anticuerpos Epstein Barr 03-06-069 03-06-069 03-06-169 03-06-070 Anticuerpos Hanta IgM Anticuerpos HTLV I/II Anticuerpos H.I.V. Antígenos virus respiratorios (adenovirus, influenza A, influenza B, parainfluenza 1, parainfluenza 2, parainfluenza 3 y metapneumovirus por IFI Rotavirus Virus sincicial, por IFI Virus hepatitis A, anticuerpos IgM del Virus hepatitis B, antígeno superficie Virus hepatitis C, anticuerpos (anti HCV) 03-06-170 03-06-270 03-06-074 03-06-079 03-06-081 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 23 03-07-007 03-08-001 03-08-001 03-08-004 03-08-005 03-08-010 03-08-011 03-08-013 03-08-014 03-08-015 03-08-018 03-08-022 03-08-026 03-08-035 03-09-004 03-09-006 03-09-007 03-09-008 03-09-010 03-09-011 03-09-012 03-09-013 03-09-015 03-09-016 03-09-018 03-09-019 03-09-020 03-09-022 03-09-025 03-09-026 03-09-027 03-09-028 03-09-029 03-09-030 Test del sudor Azúcares reductores (Fehling) Test de Benedict Hemorragias ocultas Leucocitos fecales Citológico Directo al fresco, incluye trichomonas) Eosinófilos, recuento de Físico-químico) Glucosa Proteínas totales o albúmina Indice IgG/albúmina Amilasa Creatinina Acido úrico cuantitativo Amilasa cuantitativa Aminoáciduria cualitativo Calcio cuantitativo Creatinina cuantitativa Cuerpos cetónicos Electrolitos Microalbuminuria cuantitativa Fósfaturia Glucosuria Melanogenuria (test de cloruro férrico) Mucopolisacáridos Nitrógeno ureico o urea cuantitativo Orina completa Osmolalidad Osmolaridad Porfirinas, c/u Proteinuria Proteínas de Bence-Jones prueba térmica Urobilinógeno (cuantitativo) MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 24 LISTA DE EXAMENES DE URGENCIA Disponibilidad las 24 horas para pacientes hospitalizados y de urgencia. GLOSA Acido láctico Acido úrico Acido Valproico, nivel plasmático Amilasa Bilirrubina total Bilirrubina total y conjugada Calcio Calcio iónico Carbamazepina, nivel plasmático Carboxihemoglobina Citológico Y Citoquímico líquidos Colinesterasa en plasma o sangre total Coprocultivo Creatinina Creatinquinasa CK - MB miocárdica Creatinquinasa CK - total Cultivos corrientes Electrolitos plasmáticos Fenitoína Niveles plasmáticos Fenobarbital Niveles plasmáticos Fosfatasas alcalinas totales Fósforo Gases y equilibrio ácido base en sangre Glucosa Gonadotrofina coriónica, sub-unidad beta Hanta IgM Anticuerpos Hemocultivo aerobio Hemograma automatizado Hemograma con frotis H.I.V. AnticuerposTest Rápido Nitrógeno ureico y/o úrea OBSERVACIONES SOLO OBSTETRICIA SOLO SE RECIBE MUESTRA. PROCESO EN DIA HABIL SOLO SIEMBRA DE MUESTRA SOLO SE RECIBE MUESTRA. PROCESO EN DIA HABIL SOLO SE RECIBE MUESTRA. PROCESO EN DIA HABIL SOLO SERVICIO URGENCIA OBSTETRICO SOLO RECIEN NACIDOS CON RIESGO DE SEPSIS Y SOSPECHA DE HANTA. DIALISIS DE URGENCIA Y TRANSPLANTE MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 25 Orina completa Proteína C reactiva Proteinuria Pruebas de coagulación (PT y TTPK) Transaminasas, oxalacética (GOT/AST) Transaminasas Pirúvica (GPT/ALT) Urocultivo Virus hepatitis B, antígeno superficie Test rápido Virus hepatitis C, anticuerpos Test rápido Virus respiratorios (adenovirus, influenza A, influenza B, parainfluenza 1, parainfluenza 2, parainfluenza 3 y metapneumovirus por IFI Trigliceridos SOLO MUESTRAS ARO SOLO SIEMBRA DE MUESTRA DIALISIS DE URGENCIA Y TRANSPLANTE DIALISIS DE URGENCIA Y TRANSPLANTE SOLO EN EPOCA CAMPAÑA DE INVIERNO SOLO SERVICIO URGENCIA MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 26 EXÁMENES DERIVADOS A OTROS ESTABLECIMIENTOS: HORARIO DE RECEPCIÓN DE MUESTRAS A DERIVAR NOMBRE EXAMEN CONDICIONES DE DERIVACION DE MUESTRAS Acido metilmalónico, ácido Orótico, cromatografía de axucares. Determinaciones cualitativas de Tomar 10 a 15ml. de orina fresca y enviar inmediatamente al Laboratorio. Adjuntar: Solicitud de examen Solicitud de gasto extraordinario autorizada Certificado de FONASA. El laboratorio envía Muestra de orina fresca a 4ºC en hielo. Solicitud de gasto extraordinario autorizada Lunes a Jueves hasta las 12:00 hrs Resultado en 2 semanas. Ácidos Orgánicos en orina Muestra de orina (6 a 10 ml). Este examen se realiza en USA, en el laboratorio del Dr. T. Law. Para su cancelación se requiere de un cheque dólar por un monto de US$140 a nombre de Children´s Hospital Boston, Lab. Medicine. Por concepto de envío de la muestra se solicitan $50.000 que deben ser cancelados en efectivo o cheque nominativo a Courier DHL. Cualquier consulta llamar a 9781543. Enviar muestra congelada. Lunes a Jueves hasta las 12:00hrs Acilcarnitinas Perfil de Tomar muestra 4 a 5 gotas de sangre seca de talón o vena periférica en papel filtro. Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El Laboratorio envía: Muestras a temperatura ambiente. Solicitud de gasto extraordinario. Lunes a Jueves hasta las 12:00 hrs Resultado en 1 semana. Aminoacidemia Paciente mínimo 3 horas de ayuno. Tomar 1 ml de sangre sin anticoagulante. Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía Suero congelado embalado con refrigerantes para mantener a 4ºC. Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00hrs Resultado en 1 semana. Aminoaciduria Tomar 10 a 15ml. de orina fresca Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía Muestra congelada Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00hrs Resultado 1 semana MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 Resultados en 20 días hábiles. 27 Bandas oligoclonales en LCR y suero. Tomar 3 ml LCR en tubo sin anticoagulante (tapa roja) y 2 ml. sangre en tubo sin anticoagulante (tapa roja). Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía Muestras refrigeradas a 4 ºC Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00 hrs Bartonella de Hessenlae Tomar 1 tubo de sangre sin anticoagulante (tapa roja). Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía Muestras refrigeradas a 4 ºC Solicitud de gasto extraordinario Lunes a Jueves hasta las 14:00 hrs. Brucelosis Serología Tomar 2 Tubos de sangre sin anticoagulante (tapa roja) Adjuntar Formulario de ISP. Certificado de FONASA Boleta de recaudación en caso de FONASA C o D Laboratorio envía muesta de suero a temperatura ambiente. Lunes a Jueves hasta las 12:00 hrs. Carnitina Total Libre y esterificada. 1 cc de sangre venosa en tubo sin anticoagulante. Enviar plasma congelado (-20ºC). El paciente debe tener 3 horas de ayuno. Adjuntar solicitud de gasto extraordinario para beneficiarios FONASA B, C, D. Lunes a Jueves hasta las 12:00hrs Resultado en 2 semanas. Citomegalovirus Antigenemia Tomar 1 tubo con EDTA (tapa lila) 4ml. adulto o 2 ml infantil. ( Si el paciente está neutropénico (mínimo 800 células volumen requerido 10 mL) Enviar de inmediato al laboratorio. NUNCA congelar. Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía Muestra refrigerada a 4 ºC. Solicitud de gasto extraordinario Lunes a Jueves hasta las 14:00hrs. Escherichia coli Verotoxina PCR 1 y 2 Hisopado Rectal ó deposición en tubo estéril sin medio de transporte. Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El Laboratorio envía: Muestras a temperatura ambiente. Solicitud de gasto extraordinario. Lunes a Jueves hasta las 12:00 hrs Espectrometría de masa Tomar 5 a 6 gotas de sangre en papel filtro de recién Lunes a Jueves hasta las 14:00hrs. Inmunofluorescencia Indirecta (IFI) anticuerpos IgG IFI MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 28 nacido. Envolver en papel oscuro. Enviar a temperatura ambiente. Todo paciente debe cancelar este examen en Recaudación $31.500. Y presentar boleta para derivación de examen. Adjuntar solicitud de examen y solicitud de gasto extraordinario firmado por médico tratante y Dirección. Esteatocrito Resultado en 10 días hábiles. Retirar en secretaría Laboratorio Muestra de deposición (tamaño nuez) en Frasco tapa roja sin líquido. Adjuntar: Solicitud de examen Solicitud de gasto extraordinario autorizada Certificado de FONASA. El Laboratorio envía: Muestra Solicitud de gasto extraordinario. Lunes a Miércoles hasta las 11:00 hrs. HANTAVIRUS Confirmación Tubo Bioquímico (Tapa roja largo). Se debe faxear formulario de notificación con el resultado de test rápido a fono -551302 / 551318. El laboratorio envía: Tubo congelado con hielo, aislado en bolsa cerrada. Formulario de Notificación Lunes a Jueves hasta las 12:00 hrs Resultado en 25 días hábiles Hepatitis B Anticore Tomar 1 tubo de sangre sin anticoagulante Tapa roja), idealmente en ayunas. Adjuntar Solicitud de examen Solicitud de gasto extraordinario Boleta de recaudación FONASA código 03-06-076 $7.550) Particular $12.750. Laboratorio envía: Muestra de suero refrigerado. Solicitud gasto extraordinario. Lunes a Miércoles hasta las 12:00 hrs Hepatitis B Carga viral, Antigeno E y anticuerpo E. Tomar 2 tubos de sangre sin anticoagulante (tapa roja). Adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El laboratorio envía 5 a 6 ml. de suero congelado Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00 hrs Hepatitis C PCR, Genotipo, carga viral Tomar 1 tubo de sangre sin anticoagulante, tapa roja de 8 ml en adultos y de 5 ml en niños. Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario autorizado Certificado de FONASA. El Laboratorio envía: 2 a 3 ml. de suero congelado en niños y 4 ml en adultos Adjuntar solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00hr Histocompatibilidad para transplante Adulto: 2 tubos de sangre con EDTA de mínimo 8 ml. Lunes a Jueves hasta las 12:00 hrs Método de Forget MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 29 Niño: 2 tubos de sangre con EDTA de mínimo 4 ml. Adjuntar Formulario ISP “Solicitud exámenes histocompatibilidad para transplante progenitores hematopoyéticos” Laboratorio envía muestras a temperatura ambiente. HIV Carga viral Tomar 1 tubo de sangre con EDTA 6 ml (tubo lila). Señalar hora de toma de muestra y enviar de inmediato al laboratorio. Adjuntar Formulario de Carga Viral que debe indicar código del paciente (el cual consiste el la inicial del primer nombre, los dos apellidos, la fecha de nacimiento, los tres últimos dígitos del Rut y el dígito identificador), nombre y firma del médico solicitante del examen, además la fecha y la hora de la toma de muestra. Lunes a Miércoles hasta las 10:00 hrs Tomar 1 tubo de sangre con EDTA 6 ml (tubo lila). Señalar hora de toma de muestra y enviar de inmediato al laboratorio. Adjuntar Formulario de CD4 que debe indicar el código del paciente (el cual consiste el la inicial del primer nombre, los dos apellidos, la fecha de nacimiento, los tres últimos dígitos del Rut y el dígito identificador), nombre y firma del médico solicitante del examen, además la fecha y la hora de la toma de muestra. Lunes a Miércoles hasta las 10:00 hrs HIV Genotipo Tomar 1 tubo de sangre con EDTA de 8 ml adulto o 5 ml en niños Enviar Plasma congelado a -80ºC Solicitud de examen Solicitud gasto extraordinario Certificado FONASA Boleta de recaudación en caso de FONASA C o D. Lunes a miércoles hasta las 10.00 hrs AM HIV PCR Pediátrico Tomar 1 tubo de 3 ml de sangre con EDTA (lila) Adjuntar: Formulario de ISP para PCR pediátrico que debe indicar el código del paciente (el cual consiste el la inicial del primer nombre, los dos apellidos, la fecha de nacimiento, los tres últimos dígitos del Rut y el dígito identificador), nombre, firma y timbre del médico solicitante. Lunes a Miércoles hasta las 10:00 hrs. Resultado en 25 días hábiles HLA – B27 Tipificación Solicitar hora antes de enviar muestra al fono Red Minsal 255204 Tomar 2 Tubos con EDTA de 6 ml.(tapa lila) Adjuntar: Solicitud de examen Certificado FONASA Boleta de recaudación en caso de FONASA C o D. Laboratorio envía muestra refrigerada. Lunes a Jueves hasta las 12:00 hrs Inmunofenotipo Tomar 2 a 3 tubos con EDTA (Tapa lila). En algunos casos se envía 1 jeringa y placas con muestra de sangre periferica. Adjuntar: Solicitud de examen Formulario de Estudio Inmunofenotipo Certificado FONASA Enviar a temperatura ambiente. Lunes a Jueves hasta las 12:00 hrs Resultado se recepciona a través de correo electrónico. Leptospira Tomar 5 a 8 ml. de sangre en tubo bioquímico (tapa roja). Lunes a Jueves hasta las 12:00hrs Método NucliSens EasyQ HIV-1 HIV CD4 Citometría de flujo PCR alelo-específica MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 30 Adjuntar: Solicitud de examen Formulario ISP firmado por médico tratante http://www.ispch.cl/formularios/frm_exa/nuevos%20sec cion%20espiroquetas/fmuestrassospechadeleptosporosis .pdf Certificado de FONASA. Laboratorio envía: Suero refrigerado Formulario ISP Certificado FONASA Resultado en 7 días hábiles. Leucemia Examen de Biología Molecular PCR T9/22 PCR T15/17 Mutación JAK2 V617F Tomar 2 Tubos con EDTA (Tapa Lila). Adjuntar Solicitud de examen Formulario de Estudio Molecular. Certificado de FONASA El Laboratorio envía la muestra a temperatura ambiente. Lunes a Jueves hasta las 12:00 hrs 7 días hábiles Resultado se recepciona a través de correo electrónico Leucemia FISH cromosoma 22 Se debe solicitar hora antes de enviar muestra al fono 025525376 ó 02-3548515. Tomar mínimo 2ml. de sangre en tubo tapa verde con heparina de sodio. Adjuntar: Solicitud de examen Solicitud de gasto extraordinario autorizada Certificado FONASA. El Laboratorio envía: Muestra refrigerada. Solicitud de gasto extraordinario. Lunes a Jueves hasta las 12:00hrs Resultado 15 días hábiles. Metrotexate, niveles plasmáticos En paciente con tratamiento con heparina, tomar la muestra antes de iniciar la terapia. Verificar que la orden de atención lleve la dosis diaria en mg, antecedentes de la última dosis (hora y mg), y la hora en que se realizó la toma de muestra al paciente. Verificar documentos solicitado. Tubo tapa roja protegido de la luz. No usar tubos con gel separador. Polarización de la fluorescencia, Inmunoensayo cuantitativo Micobacterium TBC PCR en LCR Tomar LCR 1 a 3 ml. en frasco estéril y seco. Orina 5 a 10 ml en frasco estéril Trasladar de inmediato al laboratorio. Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El Laboratorio envía: Muestras refrigeradas. Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00 hrs Resultado en 4 días hábiles. Mucolipidosis. Screening Tomar 1 tubo de sangre sin anticoagulante. Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El Laboratorio envía: Suero congelado Solicitud de gasto extraordinario Lunes a Jueves hasta las 12:00 hrs Tubo tapa roja sin anticoagulante Lunes a Jueves hasta las 12:00 hrs. Rubeola MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 Resultado en 3 semanas. 31 Sarampion Llevar de inmediato al laboratorio Adjuntar Formulario Vigilancia Sarampión Rubéola Test de Metilación Resultados en 7 días hábiles Sangre venosa en tubo con EDTA (Tapa lila). Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario autorizado. Certificado de FONASA. El Laboratorio envía: Muestras a temperatura ambiente. Solicitud de gasto extraordinario. Lunes a Jueves hasta las 14:00 hrs. Test Molecular para X frágil. 1 Tubo con EDTA (Tapa lila). Se debe adjuntar: Solicitud de examen Solicitud de gasto extraordinario Certificado de FONASA. El Laboratorio envía: Muestras a temperatura ambiente. Solicitud de gasto extraordinario. Lunes a Jueves hasta las 12:00hrs Resultado en 45 días hábiles. Toxocara Tomar 1 tubo de hemograma y 1 tubo bioquímico. Adjuntar formulario ISP firmado por médico tratante (formulario para eosinofilias sanguíneas http://www.ispch.cl/formularios/formularios09/F/parasit ologia/6.pdf) y certificado de FONASA. Laboratorio envía: Suero congelado Copia de resultado de hemograma Formulario ISP Certificado FONASA Lunes a Miércoles hasta las 12:00 hrs. Resultado en 7 días hábiles. Retirar resultado en secretaría de Laboratorio. PCR molecular, test de metilación específico ELISA. Confirmación por Westernblot. Vancomicina, niveles plasmáticos Resultado en 10 días hábiles En paciente con tratamiento con heparina, tomar la muestra antes de iniciar la terapia. Verificar que la orden de atención lleve la dosis diaria en mg, antecedentes de la última dosis (hora y mg), y la hora en que se realizó la toma de muestra al paciente. Verificar documentos solicitados. Tomar 1 tubo de sangre sin anticoagulante (tapa roja Distintos Centros a los cuales se derivan muestras: • Laboratorio Barnafi Krause • INTA: Laboratorio de Enfermedades Metabolicas • Pontificia Universidad Catolica de Chile • Laboratorio Clinico Biologia Molecular : Pontificia Universidad Catolica de Chile • Laboratorio de Nutricion: Pontificia Universidad Catolica de Chile • Instituto de Salud Publica (ISP) • Laboratorio de Gastroenterologia: Hospital Clinico Universidad de Chile • Laboratorio Diagnostico Molecular: Universidad Catolica de la Santisima Concepcion • Hospital del Salvador • Laboratorio Citogenetica: Pontificia Universidad Catolica de Chile MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 32 BIOSEGURIDAD EN LA TOMA DE MUESTRAS BIOSEGURIDAD DEL PACIENTE • Verifique si el paciente está preparado para tomarse el examen e indague de situaciones que aumentan riesgo de reacciones adversas: nerviosismo, ayuno prolongado, terapia anticoagulante, quimioterapia, sobrecarga de glucosa. Informe al paciente acerca del procedimiento que le va a realizar y solicite su consentimiento verbal. Si es un paciente ambulatorio, antes de despedirlo verifique que el lugar de la punción ha dejado de sangrar y preocúpese que esté en condiciones de irse caminando, especialmente si es un paciente que no anda acompañado. • • BIOSEGURIDAD DEL PERSONAL USO DE BARRERAS PROTECTORAS: Actividad Elemento de Protección Personal Tomar exámenes de sangre, orina o deposiciones Guantes y lavado de manos Tomar muestras de líquidos biológicos, tejidos o aspirado nasofaríngeo. Lavado de manos, guantes, delantal , lentes y mascarilla facial ÁREA DE TRABAJO Y EQUIPAMIENTO: • • Disponer previamente y de manera ordenada todos los elementos necesarios para la toma de muestra, separar áreas de trabajo limpia y contaminada. Disponer de depósitos de cartón (cajas de bioseguridad) o plásticos para eliminar agujas de punción. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 33 ELIMINACIÓN DE MATERIAL CORTOPUNZANTE. • • • • • Debe ponerse especial precaución en esta etapa, que conlleva mayor riesgo de accidentes cortopunzantes. Soltar la aguja con pinzas, no tocar con las manos. Eliminar las agujas directamente en las cajas de bioseguridad sin recapsular. Eliminar jeringa y aguja completa sin separarlas. Una vez llenas las cajas, sellarlas y enviarlas al incinerador. BIOSEGURIDAD EN TRANSPORTE DE MUESTRAS CONDICIONES GENERALES DE TRANSPORTE: • • • • Capacitar al personal que transporta las muestras acerca de los riesgos involucrados en la actividad que realiza. Transportar las muestras en recipientes cerrados. No se deben manipular las muestras y si es necesario hacerlo USAR guantes. Entregar las muestras al personal adiestrado. TRANSPORTE EN CORREO NEUMATICO: SOLO enviar muestras contenidas en material de plástico y con selle hermético. NUNCA enviar muestras en tubos o frascos de vidrio. Al preparar una bala, embalar muestra en bolsa de plástico sellada. La orden de examen o cualquier otro papel debe ir separada de la muestra. Se rechazarán las muestras derramadas o con solicitud de examen embalada junto a la muestra. Al retirar las muestras de la bala USO OBLIGATORIO de guantes. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 34 REGLAS GENERALES DE TOMA DE MUESTRA SOLICITUD DE EXÁMENES DE LABORATORIO La solicitud de exámenes del laboratorio debe realizarse haciendo uso del formulario institucional y DEBE incluir los siguientes datos: • • • • • • • Nombre completo del paciente Cuenta Corriente Fecha de Nacimiento Servicio Clínico, Consultorio, Hospital. Diagnóstico Exámenes solicitados Previsión • RUT (en caso de recién nacidos incluir número de ficha clínica si no tiene RUT) • Tipo de Muestra y sitio anatómico de origen cuando corresponda (ej.: LCR, líquido pleural, etc.) • Nombre y firma del Médico solicitante • Fecha Debe estar escrita con letra legible para evitar errores de identificación, interpretación de exámenes y extravío de resultados. MATERIAL DE TOMA DE MUESTRA Materiales: Todo material de uso venoso o intra-arterial debe ser estéril y de un solo uso. No se debe usar material desechable reesterilizado. Verificar fecha de expiración previo a uso. TIPOS DE TUBOS PARA TOMA DE MUESTRA ANTICOAGULANTES PARA TOMA DE MUESTRA DE SANGRE Existen múltiples factores involucrados en el proceso de coagulación de la sangre. Los anticoagulantes son sustancias que previenen la formación de coágulos. Existen diferentes tipos de ellos en sólidos y líquidos. Debe seleccionarse siempre el anticoagulante apropiado según el estudio a realizar. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 35 TIPOS DE TUBOS PARA OBTENCION DE MUESTRA SANGUINEA Color de tapa ADITIVO MODO DE ACCION INDICACIONES USO Ninguno Coagulación de sangre y separación de suero mediante centrifugación Mezclar por inversión 5 veces Química sanguínea, inmunología, serología Citrato de sodio Remueve el calcio mediante la formación de sales. Mezclar por inversión 4 veces. Requiere completar nivel de llenado Pruebas de Coagulación, Tapa verde Heparina de sodio o heparina de litio Inactiva trombina y tromboplastina Mezclar por inversión 8 a 10 veces Química sanguínea, estudio de linfocitos Tapa verde claro Tubo con heparina de litio y gel separador heparina de litio; el plasma se separa del resto de la muestra por el gel del fondo del tubo. Mezclar por inversión 8 a 10 veces Química sanguínea, estudio de linfocitos Tapa Lila EDTA Remueve el calcio de la muestra mediante la formación de sales. Mezclar por inversión 8 a 10 veces Requiere completar nivel de llenado Hematología y banco de sangre Agente antiglicolítico, preserva la glucosa durante 5 días Mezclar por inversión 8 a 10 veces. Requiere completar nivel de llenado Tapa roja y/o amarilla Tapa celeste Tapa gris Fluoruro de sodio MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 36 Medición de Glucosa MEZCLA POR INVERSIÓN La mezcla adecuada de la muestra con el anticoagulante es por inversión, según se muestra en la figura. ORDEN DE EXTRACCIÓN Si se realizan varias extracciones al mismo tiempo, es importante extraer en primer lugar las muestras estériles para hemocultivo, después las muestras que no requieren aditivos, seguidas de las muestras de coagulación y finalmente, las muestras que precisan tubos con aditivos. Orden de Extracción Tipo de tubo Tubo sin aditivos (suero) Color 1 Tubo con citrato (coagulación) 2 Ttubo con citrato (VHS) 3 Tubo con heparina (cariotipo) 4 Tubo con EDTA (hemograma) 5 Tubo con oxalato-fluor 6 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 37 INDICACIONES GENERALES PREVIO A TOMA MUESTRAS EXAMENES DE SANGRE Explicar al paciente acerca de la indicación médica del examen, dando instrucciones respecto a la preparación, necesidad de ayuno, tipo de régimen y objetivos del examen. Constatar que el paciente está en las condiciones requeridas para el examen (ayunas u otra) En general los exámenes de sangre se toman en ayunas, pues la ingesta de alimentos puede hacer variar los resultados de algunos exámenes (Ej: glicemia basal) Una vez tomadas las muestras deben ser enviadas a la brevedad al laboratorio, ya que éstas continúan con su metabolismo, al permanecer a temperatura ambiente, produciéndose alteración de los valores reales del paciente. No deben utilizarse frascos que merezcan dudas, sin tapas, sucios o con cantidad insuficiente de anticoagulante. Al tomar la muestra de sangre, evitar la formación de espuma sanguinolenta, ya que esta favorece la coagulación y la hemólisis. Se debe vaciar suavemente la sangre por las paredes del frasco, esta acción evita la hemólisis de la muestra, situación que al ocurrir podría alterar los valores reales del paciente. En la actualidad se utilizan tubos para exámenes sellados al vacío, en los cuales viene indicada la cantidad de muestra requerida, estos se puncionan cuidadosamente en el tapón de goma y se llenan por gradiente de presión con la cantidad de sangre determinada, no siendo necesario realizar presión con el émbolo de la jeringa. En este caso hay que tener la precaución de retirar suavemente la jeringa, evitando acercarla demasiado al rostro, pues se pueden producir pequeñas pulverizaciones de sangre y penetrar en la conjuntiva ocular. INSTRUCCIONES A PACIENTES PARA TOMA DE EXAMENES DE LABORATORIO CONDICIONES GENERALES PARA TOMA DE MUESTRA 1. 2. 3. 4. 5. 6. 7. 8. 9. Llegar completamente en ayunas al Laboratorio Clínico. El ayuno ideal es de 10 a 12 horas. No fumar antes ni durante la realización de exámenes de laboratorio. No ingerir bebidas alcohólicas tres días antes de la realización de los exámenes de Laboratorio. Si está tomando algún medicamento, debe informar en la toma de la muestra el nombre de la droga y la dosis que está tomando. Anote la droga(Fármaco)………………………………………que esta tomando Si se ha realizado un examen de radiología con medio de contraste, NO se realice ningún examen del Laboratorio hasta después de tres días. No realice ninguna actividad física (trotar, ejercicios) antes de la realización de los exámenes. Citación…………………./……………………/ 20…. Dia mes año MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 38 CURVAS DE GLICEMIA O INSULINA 1. 2. 3. 4. Disponer de tiempo suficiente (tres horas) para permanecer en reposo en el laboratorio. Estar completamente en ayuno el día del examen. La noche anterior al día del examen se puede ingerir alimentos hasta las 7:00 p.m. El paciente debe hacerse presente al día siguiente a las 8:00 a.m., en el laboratorio para el inicio del examen. 5. No debe fumar antes ni durante la realización del examen. CONDICIONES PARA LA TOMA DE MUESTRA DE NIVELES DE DROGAS TERAPÉUTICAS 1. Informar en el laboratorio los nombres y las dosis de los medicamentos que está tomando. 2. Idealmente, cuando el paciente usa drogas terapéuticas, se debe tomar la muestra una hora antes de la próxima dosis y/o cuando lo solicite el médico tratante. CONDICIONES PARA LA TOMA DE MUESTRA DE PROLACTINA 1. Venir al laboratorio con un ayuno de 8 horas, 2 horas después de haberse levantado. 2. Evitar situaciones de estrés. 3. Tener abstinencia sexual de 2 días, antes de realizar el examen. ANTÍGENO PROSTÁTICO ESPECÍFICO Y LIBRE 1. La toma de la muestra de sangre debe ser practicada antes de una biopsia prostática, masaje prostático o prostatectomía, o 10 días después de realizados estos procedimientos. 2. Tener abstinencia sexual de 2 días, antes de realizar el examen. CONDICIONES PARA LA TOMA DE MUESTRA DE ORINA COMPLETA, SEDIMENTO DE ORINA Y UROCULTIVO EN MUJERES 1. 2. 3. 4. 5. 6. 7. 8. INSTRUCTIVO PARA TOMA DE MUESTRA Lávese las manos Humedezca dos motas de algodón con agua y dos motas con jabón Lávese los genitales separando los labios, con un algodón embebido en agua jabonosa limpiando de adelante hacia atrás una sola vez, luego deseche el algodón en receptáculo de deshechos Repita el procedimiento con el segundo algodón con agua jabonosa Enjuáguese con las motas de algodón embebidas en agua, procediendo de igual forma; o con la ducha sacando completamente el jabón Séquese con un apósito estéril Colóquese un tampax, si procede; o una mota de algodón haciendo taponamiento vaginal, para impedir contaminación Elimine el primer chorro de orina en el W.C. y, sin cortar la micción, reciba el segundo chorro de MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 39 orina en un frasco estéril de boca ancha, sacando previamente las dos tapas. Llenar hasta la mitad 9. Tape el frasco con precaución, evitando contaminar la muestra y/o derramarla 10. Si obtiene la muestra de orina en su casa, debe traer el frasco estéril entregado por el Laboratorio en una bolsa con hielo antes de 2 horas. 11. Informe si está tomando algún medicamento (antibióticos o analgésicos). CONDICIONES PARA LA TOMA DE MUESTRA DE ORINA COMPLETA, SEDIMENTO Y/O UROCULTIVO DE PRIMERA MICCIÓN EN HOMBRES INSTRUCTIVO PARA TOMA DE MUESTRA 1. Lávese las manos. 2. Humedezca dos motas de algodón con agua y dos motas con jabón líquido. 3. Retire la piel anterior del pene y lave la zona con las motas de algodón embebidas en jabón, en sentido circular y en una sola dirección; deseche los algodones utilizados. 4. Enjuáguese con las motas de algodón embebidas en agua. NO TOQUE LA ZONA ASEADA. 5. Seque con un apósito limpio (si es para urocultivo, el apósito debe ser estéril). 6. Reciba el primer chorro de orina en el frasco que le fue proporcionado por el Laboratorio, llenándolo hasta la mitad; tape el frasco con precaución, evitando contaminar la muestra y/o derramarla. 7. Si obtiene la muestra de orina en su casa, debe traer el frasco solicitado al Laboratorio previamente, en una bolsa con hielo, antes de 2 horas. 8. Informe si está tomando algún medicamento (analgésico, antibióticos). INDICACION EXAMEN ORINA DE 24 HRS. 1. El día previo al examen, a una hora determinada, de preferencia al levantarse, debe vaciar la vejiga orinando a fondo y botar esa orina. 2. De ahí en delante de juntar TODA la orina de cada micción durante las 24 horas siguientes en un envase limpio y seco (ejemplo botella desechable de bebida de tres litros). 3. La última micción debe hacerse a la misma hora que comenzó la recolección y esta se añade a lo recolectado. Por ejemplo: si usted vació su vejiga a las 8:00 AM, botando la orina, debe orinar nuevamente a las 8:00 AM del día siguiente incorporando esta al envase. 4. Durante el periodo de recolección de orina, usted debe ingerir 1 ½ litros de agua de la llave, salvo que su médico tratante disponga de lo contrario. 5. Toda la orina recolectada durante el periodo completo debe guardarse refrigerada. 6. Debe llevar TODA la orina recolectada ANTES DE DOS HORAS al Laboratorio. 7. Etiquetar los receptáculos con nombre completo; Fecha; hora de inicio de recolección de orina; hora de última orina incluida. Pegar esta información en el receptáculo de Orina. ________________________________________________________________ Nombre Completo:……………………………………………………………………………………….. Rut:………………………….. Comenzar a las……………… hrs. del día ……/…../………….. Eliminando esta orina en W.C. Incluir en el bidón o botella la orina de las ………………………hrs. del día siguiente……/……/…… MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 40 INDICACION EXAMEN ORINA DE 12 HRS. 1. Comenzar a las 19:00 hrs. Del dia…/……/………eliminando esta orina en w.c. 2. Juntar orina en bidon o botella limpia (enjuagar solo con agua, sin detergente ni cloro, dejar estilar boca abajo dia ante) resto del dia y toda la noche. 3. Incluir en bidon o botella la orina de las 07:00 hrs. AM del dia siguiente …./…/……… 4. Si es mujer, debe hacer en una bacinica e ir vaciando en bidon o botella y luego enjuagar bacinica solo con agua y secar con nova cada vez. 5. Hacer vida normal, no tomar mas ni menos agua. 6. Toda la orina recolectada durante el periodo completo debe guardarse refrigerada. 7. Debe llevar TODA la orina recolectada ANTES DE DOS HORAS al Laboratorio. 8. Etiquetar el bidón o botella con nombre completo; Fecha; hora de inicio de recolección de orina; hora de ultima orina incluida. Pegar esta información en el receptáculo de Orina. ________________________________________________________________ Nombre Completo:……………………………………………………………………………………….. Rut:………………………….. Incluir en el bidon o botella la orina de las ………………………hrs. del dia siguiente……/……/…… ROTAVIRUS - INSTRUCTIVO PARA TOMA DE MUESTRA Tipo de muestra: Deposición 1. Obtener la muestra por eliminación espontánea. 2. Depositar la muestra en un frasco limpio. 3. La cantidad mínima requerida es ½ cucharadita de té. 4. Recolección de muestra de deposición de pañal. 5. Sacar con la espátula de madera, la desposición más superficial y abundante que contenga el pañal. 6. Se debe obtener la muestra, ojalá recién emitida, para evitar que ésta sea absorbida por el pañal. 7. Sacar mínimo 1/3 de la espátula y depositarla en frasco de boca ancha. 8. Taparlo y meterlo en una bolsa plástica, agregar en ésta cubos de hielo. 9. La muestra debe ser trasladada al Laboratorio antes de dos horas de su obtención. TEST DE GRAHAM 1. 2. 3. 4. INSTRUCTIVO PARA TOMA DE MUESTRA Instructivo previo al procedimiento: La aplicación de esta técnica debe ser efectuada por una persona que no sea el paciente. No se deben aplicar pomadas o polvos-talco en la región anal durante la noche anterior. La toma de muestra se debe efectuar a primera hora de la mañana, antes de bañarse, orinar y/o defecar. Efectúe la técnica durante cinco días seguidos, utilizando una placa diferente cada mañana. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 41 Procedimiento: 5. Desprenda de la placa de vidrio la tira de papel celofán (scotch transparente). 6. Aplique varias veces la tira de papel celofán, por el lado engomado, en todos los alrededores del ano y entre las nalgas. 7. Pegue el scotch bien estirado en la placa de vidrio. 8. Si detecta "pidulle", colóquelo entre el papel celofán (scotch) y la placa de vidrio. 9. Cada día, coloque la placa de vidrio en el envase correspondiente, hasta completar los cinco. 10. Escriba en el envase, con letra muy clara, el nombre, los dos apellidos y la edad del paciente. INSTRUCTIVO PARA TOMA DE MUESTRA DE EXAMEN PARASITOLOGICO SERIADO (TMT O PAFS) Tipo de muestra :Deposición 1. El paciente debe obrar (defecar) en un recipiente limpio y seco, sin mezclar con orina. Si es lactante, tomar del pañal la muestra recién emitida. 2. Coloque una porción del tamaño de una nuez dentro del frasco y mezcle con el líquido que contiene, hasta obtener una emulsión homogénea utilizando la paleta que lleva la caja proporcionada por el Laboratorio. 3. Las muestras deben obtenerse día por medio hasta completar las tres. En caso de no poder obtener las muestras día por medio, puede saltarse uno o dos días y traerlas cuando complete la última muestra recién emitida. HEMORRAGIA OCULTA EN DEPOSICIÓN INSTRUCTIVOS PARA LA TOMA DE MUESTRA TIPO DE MUESTRA: DEPOSICIÓN Requisitos: 1. No recolectar muestra hasta 3 días de terminado el periodo menstrual 2. No recolectar muestra hasta 3 días de terminado sangramiento por hemorroides, hematuria (sangre en orina) 3. Evitar el consumo de aspirina, vitamina C o antiinflmatorio 7 dias antes y durante la recoleccion de la muestra, excepto si su médico tratante le de otras indicaciones. Recoleccion de la muestra : 1. El paciente debe obrar defecar en un recipiente limpio y seco, sin mezclar con orina. 2. Coloque una porción del tamaño de una nuez dentro del frasco proporcionado por el laboratorio 3. Las muestras son recepcionadas en la Unidad de Laboratorio de 8:00-15:30 PM MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 42 LEUCOCITOS FECALES INSTRUCTIVOS PARA LA TOMA DE MUESTRA TIPO DE MUESTRA: DEPOSICIÓN 1. Obtener la muestra por eliminación espontánea. 2. Depositar la muestra en un frasco limpio, entregado por la sección de Toma de Muestra. 3. La muestra debe ser trasladada al Laboratorio, rodeada en hielo, antes de dos horas de su obtención. 4. Cantidad mínima requerida, ½ cucharadita de té. 5. Recolección de muestra de deposición de pañal. 6. Sacar con la espátula de madera, la deposición más superficial y abundante que contenga el pañal. 7. Se debe obtener la muestra, ojala recién emitida para evitar que ésta sea absorbida por el pañal. 8. Sacar mínimo un tercio de la espátula y depositarla en frasco de boca ancha entregado por el Laboratorio. Taparlo con sus dos tapas y meterlo en una bolsa plástica, agregar en ésta cubos de hielo. 9. La muestra debe ser trasladada al Laboratorio, antes de dos horas de su obtención o ser conservada a 4ºC MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 43 PROCEDIMIENTOS DE TOMA DE MUESTRA ASPECTOS GENERALES PARA CUALQUIER MUESTRA Identificación del paciente El enfermero debe asegurarse de que la obtención de la muestra será de la persona indicada en la orden de examen. Los siguientes pasos constituyen un método para asegurar la identificación del paciente. En la Toma de muestra Ambulatoria: • Pedir al paciente que diga su nombre completo y que lo deletree si es un nombre poco frecuente. • Comparar este nombre con el que figura en el de la orden de examen y en las etiquetas de los tubos. • En pacientes hospitalizados: • Al entrar en la habitación, identificarse ante el paciente y decirle que se ha venido a extraerle sangre para realizar algunas pruebas de laboratorio. • Pedir al paciente que diga su nombre completo y que lo deletree si es poco frecuente. • Si el paciente no puede contestar, buscar en brazalete. COMPROBACIÓN DE SÍ EL PACIENTE ESTÁ EN AYUNAS Algunas pruebas requieren que el paciente esté en ayunas o que elimine ciertos alimentos de su dieta antes de la extracción. La duración y el tipo de restricciones dietéticas varían con cada prueba. Estas restricciones son necesarias para asegurar unos resultados precisos de las pruebas. TRANQUILIDAD DEL PACIENTE El enfermero debe ganarse la confianza del paciente y asegurarle que, aunque la punción venosa será ligeramente dolorosa, durará poco. Nunca debe decirse a los pacientes que “esto no dolerá”, y debe advertírseles cuándo la aguja penetra la piel para evitar que se asusten. COMPROBACIÓN DE LA DOCUMENTACIÓN, DE LOS TUBOS Y LAS ETIQUETAS RESPECTIVAS Debe comprobarse si se han seleccionado los tipos y tamaños de tubos apropiados, tarea que se facilita al estar los tapones de los tubos codificados con colores. (ver orden adecuado de extracción de sangre según tipo de anticoagulante). El etiquetado de los tubos debe realizarse DESPUES de obtener las muestras y MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 44 TOMA DE MUESTRA DE SANGRE EN PACIENTES HOSPITALIZADOS Procedimientos descritos por EU Marcela Valenzuela, gestión del cuidado. TOMA DE MUESTRA DE SANGRE POR PUNCION VENOSA PERIFERICA DEFINICION: Consiste en introducir en un vaso sanguíneo (venoso) un catéter o aguja para obtener una de sangre con fin diagnóstico. muestra OBJETIVO: Obtener muestra de sangre para exámenes de laboratorio. MATERIALES: Carro de toma de exámenes con: Jeringas de 10 cc, 20 cc. Tórulas Alcohol al 70% Ligadura Guantes de procedimientos Tela adhesiva Caja de bio-seg Bolsa de desechos Tubos de exámenes Hansaplast PROCEDIMIENTO ACTIVIDADES FUNDAMENTO 1. Reúna el material y llévelo a la unidad del paciente 2. Explique el procedimiento al paciente si éste está consciente con lenguaje claro. Disminuye ansiedad del paciente y logramos su colaboración. 3. Lávese las manos y colóquese guantes de procedimientos. Evita IIH 4. Acomode al paciente, coloque la extremidad elegida sobre superficie plana acojinando la articulación Permite una punción certera. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 45 adyacente y elija el vaso a puncionar. 5. Coloque la ligadura por encima del vaso elegido, lo más Permite que la vena se palpe o se vea arriba posible. con más facilidad. 6. Pincele la piel en un radio de 5 cm con alcohol 70%, siempre desde distal a proximal con movimiento ascendente. Evita IIH 7. Fije la vena con ayuda de una de sus manos. Solicite al paciente que apriete su mano. Evita error en la punción 8. Inserte la aguja con el bisel hacia arriba, puncione la vena y observe el reflujo de sangre. 9. Mantenga fija la aguja durante la extracción. Aspire en forma suave. Evita ruptura del vaso Evitará hemólisis de sangre. 10. Desligue, continúe aspirando y retirando la aguja al mismo tiempo. 11. Realice presión sobre el sitio de punción con tórula seca y selle con tela o hansaplast. Permite cohibir sangramiento. 12. Llene los tubos de exámenes, cuidando de completar nivel de llenado y mezclar por inversión los tubos Obtener muestra con proporción adecuada de anticoagulante y evitar que muestra se coagule. 13. Rotule los tubos con nombre y procedencia al lado del paciente. Evita errores de identificación de muestras. 14. Retírese guantes, lávese las manos, retire el material y registre en hoja de enfermería. CONSIDERACIONES DE ENFERMERIA Tenga siempre presente las precauciones universales. Elija venas de grueso calibre De preferencia venas de las extremidades superiores Elija con calma el vaso que va a puncionar. Dese el tiempo de acomodar a su paciente de modo que le facilite la punción MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 46 TOMA DE MUESTRA DE SANGRE POR VIA VENOSA CENTRAL DEFINICION: Consiste en obtener una muestra de sangre para exámenes de laboratorio a través de un catéter instalado en una vena central (yugular, subclavio, femoral o percutaneo). OBJETIVO: Obtener sangre con fines diagnósticos. MATERIALES: Carro de toma de exámenes con Guantes estériles Tórulas Solución desinfectante Jeringas Agujas Suero fisiológico en ampollas Tapas amarillas Apósitos 10 x 10 Tubos PROCEDIMIENTO: ACTIVIDADES FUNDAMENTO 1. Reúna el material y llévelo a la unidad del paciente. 2. Explique el procedimiento al paciente con lenguaje claro Diminuye ansiedad del paciente 3. Lávese las manos. Previene IIH 4. Observe cuantos lúmenes tiene el catéter y elija uno de ellos de preferencia el proximal 5. Desinfecte la llave de tres pasos o tapas del lúmen elegido con alcohol al 70% 6. Detenga momentáneamente las soluciones que estén perfundiendo por este lumen. 7. Instale jeringa sin aguja y aspire 5 cc de sangre y elimínela. Previene IIH Permite obtener muestra fidedigna. Permite obtener sangre sin residuos de las infusiones que pasan por el catéter. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 47 8. Proceda ahora con otra jeringa a aspirar la cantidad de sangre que necesita para los exámenes y entréguela al ayudante. Cerciorarse de que el ayudante usa guantes para la manipulación de la jeringa y tubos. Prevención de accidentes con fluidos corporales de alto riesgo. 9. El ayudante procederá a llenar los tubos, cuidando de respectar el nivel de llenado marcado y de mezclar por inversión los tubos. Obtener muestra óptima en su proporción muestra/anticoagulante y también evitar coagulación de la muestra Evite formación de coágulos en lumen y mantiene permeabilidad del catéter. 10. Lave el lumen utilizado pasando 10 cc de solución fisiológica 11. Reinicie las infusiones o fleboclisis. 12. Rotule los tubos al lado del pacientecon nombre y procedencia, envíe a laboratorio. 13. Retírese los guantes, lávese las manos, registre en hoja de enfermería. CONSIDERACIONES DE ENFERMERIA Recuerde precauciones universales durante el procedimiento. No “destape” catéteres ocluidos. En catéteres de mas de un lumen, rotule lumen ocluido y selle con tela para no ser usado. Recuerde usar lumen proximal para toma de exámenes. Recuerde cebar lumen por el cual tomó exámenes para mantener permeabilidad. Si no esta pasando soluciones, lave el lumen y cierre el clamp, esto evitará que se tape. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 48 TOMA DE MUESTRA DE SANGRE POR PUNCION ARTERIAL DEFINICION: Consiste en puncionar una arteria para obtener una muestra de sangre arterial. Las arterias elegidas deben ser de preferencia de las extremidades superiores (radial o humeral) OBJETIVO Obtener sangre arterial para exámenes de laboratorio. MATERIALES Guantes de procedimientos Torulas Alcohol 70% Jeringas Jeringa de gases Hansaplast Torulas gasas estériles Tubos para exámenes Hielo Caja de transporte de exámenes. PROCEDIMIENTO ACTIVIDADES FUNDAMENTO 1. Reúna el material y llévelo a la unidad del paciente. 2. Explique el procedimiento al paciente en lenguaje comprensible. Disminuye ansiedad al paciente. 3. Lávese las manos y colóquese guantes de procedimiento. Evita IIH 4. Elija la arteria a puncionar (realice test de allen si utiliza arteria radial) Permite verificar circulación colateral 5. Palpe pulso y proceda a puncionar en ángulo de 45º, aspire la cantidad de sangre necesaria. 6. Retire la aguja aspirando y presione el sitio de punción Evita hematomas. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 49 durante 5 minutos, compruebe que se haya cohibido el sangramiento, deje gasa estéril. 7. Llene los tubos, teniendo especial precaución en respetar los niveles marcados en los tubos. Mezclar tubos por inversión Obtener muestra óptima con proporción adecuada de muestra/anticoagulante. Evita coagulación de la muestra. 8. Rotule tubos con nombre y procedencia, al lado del paciente y envíe a laboratorio Evita errores de rotulación o de cambios de muestras. 9. Retire el material y lávese las manos. Evite IIH 10. Registre en hoja de enfermería CONSIDERACIONES DE ENFERMERIA Recuerde precauciones universales durante el procedimiento. Elija área libre de erosiones cutáneas, con buena circulación. Tenga presente que se trata de una técnica de alto riesgo por la cercanía de nervios que se relacionan con la sensibilidad y motricidad de la extremidad. No olvide que es dolorosa. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 50 TOMA DE MUESTRA DE SANGRE POR CATETER ARTERIAL DEFINICION: Consiste en obtener una muestra de sangre arterial para exámenes de laboratorio a través de un catéter instalado en una arteria. OBJETIVO: Obtener sangre arterial para exámenes de laboratorio. Evaluar gasometría del paciente Evaluar efecto de oxigenoterapia MATERIALES: Carro de exámenes con Jeringas de gases Jeringas. Torulas Alcohol Tapones amarillos Gasas estériles Guantes de procedimiento Apósitos Tela adhesiva Hielo Caja de bio seg PROCEDIMIENTO ACTIVIDADES FUNDAMENTO 1. Reúna el material y llévelo a la unidad del paciente. 2. Explique el procedimiento en lenguaje claro. Disminuye el estrés y ansiedad del paciente. 3. Lávese las manos y colóquese guantes de procedimientos. Previene IIH MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 51 4. Proceda a desinfectar llave tres pasos con alcohol 70%. 5. Abra la llave de tres pasos entre la jeringa y la arteria, aspire 5 cc de sangre y elimínela La primera aspiración es una mezcla de sangre y suero por esto se debe eliminar, así obtendremos exámenes fidedignos. 6. Luego aspire la cantidad de sangre que necesita para los exámenes indicados. 7. Flashee y lave la línea arterial, para ello tire de la cola del transductor hasta que el sistema quede limpio de sangre Recuerde que el suero del transductor debe estar presurizado a 300mmHg para realizar efectivamente el flasheo del sistema. 8. Compruebe que la curva de presión invasiva aparezca en el monitor y realice punto cero si procede. 9. Operador auxiliar debe: - Lavarse las manos y usar guantes de procedimiento. Llenar los tubos de exámenes Colocar la jeringa de gases en hielo Rotular y enviar frascos con el nombre del paciente y procedencia a laboratorio 10. Retire el material, lávese las manos y registre en hoja de enfermería. CONSIDERACIONES DE ENFERMERIA Recuerde precauciones universales durante el procedimiento. Utilice técnica aséptica Los gases arteriales son lábiles a temperatura ambiental por ello se deben enviar pronto al laboratorio y en recipiente con hielo (col-hot). La aspiración de sangre por el catéter debe ser suave para no hemolizar la muestra. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 52 TOMA DE MUESTRA DE SANGRE EN PACIENTES AMBULATORIOS Procedimientos descritos por TM MARIA INES HENRIQUEZ, SUPERVISORA LABORATORIO CLINICO TOMA DE MUESTRA DE SANGRE VENOSA Procedimiento: Toma de Muestra sangre venosa con tubos al vacío Objetivo: Obtención de muestra de sangre venosa periférica Descripción del procedimiento: Selección del sitio de la vena La mayoría de los procedimientos de punción venosa en adultos utilizan las donde se va a realizar la venas situadas en el brazo. La vena cubital media o mediana del codo es la punción que se utiliza con más frecuencia, porque es grande está cercana a la piel y es la menos dolorosa para el paciente. Si la vena no es muy visible ni palpable, realice un suave masaje en el antebrazo (si es el caso), con movimientos desde la muñeca hacia el codo. Observe siempre las dos extremidades superiores (brazos), para elegir el mejor sitio de punción. Ligadura El uso de la liga provoca estasis del retorno venoso, que a su vez aumenta la prominencia de las venas y facilita su punción. Normalmente se utiliza una tira de goma elástica, de 1,25 cm de ancho y 45 cm de largo. La tira de goma debe enrollarse bien ajustada alrededor del brazo del paciente, con el extremo recogido bajo la última vuelta, comenzando entre 7,5 y 10 cm por encima del lugar de la extracción, porque tiene tendencia a pellizcar la piel. Para que los resultados de las pruebas sean válidos, no debe dejarse nunca el compresor en el brazo más de 2 minutos. Limpieza de la zona de punción Se empapa un algodón con alcohol al 70% y se aplica con un movimiento circular, desde el centro de la zona hacia fuera. Se deja secar la piel para evitar la producción de hemólisis en la muestra de sangre y la sensación de escozor que experimenta el paciente cuando se le pincha. Inspección de la aguja y tubo de vacío Se coloca la aguja en el soporte del tubo de vacío, enroscándose en este último hasta que esté apretada con ayuda de su funda. Esta no debe quitarse hasta que el enfermero este listo para extraer la sangre, evitando así la contaminación de la aguja. Cuando todo esté preparado, se extrae la aguja de su funda y se examina especialmente la zona de la punta, para determinar si el extremo está doblado y si el orificio de apertura está libre de partículas que pudieran obstruir el flujo de la sangre. Localizar vena y fijarla para facilitar la punción. Punción y extracción MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 53 La vena se pincha con el bisel de la aguja mirando hacia arriba. Se recomienda un ángulo de entrada con respecto al plano de la superficie de 15 grados. Debe mantenerse el tubo de vacío con una mano, mientras que la otra lo empuja hacia el interior del soporte. El extremo posterior de la aguja pincha entonces el tapón y activa el vacío para extraer la sangre. El tubo debe llenarse hasta que se agote el vacío y cese el flujo de sangre, asegurando de esta manera una relación correcta entre anticoagulante y sangre. Tras llenarse, se saca el tubo del soporte, la válvula de cierre recubre la punta posterior de la aguja, haciendo que cese el flujo de sangre hasta que se inserte el siguiente tubo. Después de extraer el tubo, debe mezclarse inmediatamente la sangre con el anticoagulante, invirtiendo el tubo tres o cuatro veces. La inversión debe hacerse suavemente, para evitar la hemólisis. Ocasionalmente, algún tubo defectuoso no tiene vacío. Si un tubo no se llena y la aguja está dentro de la vena, debe utilizarse otro tubo. Si un tubo comienza a llenarse y se para de repente, debe moverse la aguja ligeramente hacia delante o hacia atrás; normalmente, este ajuste basta para recuperar el flujo de sangre. Sino, se da media vuelta a la aguja y se afloja el compresor, que quizás esté demasiado apretado. No se recomienda hurgar con la aguja porque esto duele al paciente. Si no funciona ninguno de estos procedimientos, debe sacarse la aguja y utilizar otro punto diferente. Soltar Ligadura y retiro de Después de realizada la extracción de sangre, el paciente puede abrir su aguja mano y se libera la liga, lo que permite que se normalice la circulación sanguínea y se reduzca la hemorragia en el lugar de la punción. Aplicar un algodón seco sobre la aguja, que se saca entonces suavemente y con cuidado. Los pacientes sujetos a tratamiento anticoagulante necesitan con frecuencia más tiempo para cortar la hemorragia. La aguja se quita de la camisa con una pinza y se desecha en un contenedor de material cortopunzante. Al finalizar el procedimiento, indíquele al paciente que debe hacer presión en el sitio punzado por lo menos durante cinco minutos. Coloque finalmente una banda adhesiva sobre la herida de la punción. Si el sangrado no se detiene, aplique presión constante sobre la herida durante 10 minutos más. Si el Problema aún no se soluciona, comuníquese Etiquetar las muestras con su superior inmediato o directamente con el médico tratante. Enviar de inmediato al laboratorio. Ventajas del vacío Se obtiene muestras con óptima relación de sangre/anticoagulante. Se evita hemólisis MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 54 Procedimiento: Toma de Muestra sangre venosa con jeringa o mariposa Objetivo: Obtención de muestra de sangre venosa periférica Indicación Suele usarse para venas difíciles. Punción con sistema al vacío frustra. Descripción Selección del sitio de la vena La mayoría de los procedimientos de punción venosa en adultos utilizan las donde se va a realizar la venas situadas en el brazo. La vena cubital media o mediana del codo es la punción que se utiliza con más frecuencia, porque es grande está cercana a la piel y es la menos dolorosa para el paciente. Si la vena no es muy visible ni palpable, realice un suave masaje en el antebrazo (si es el caso), con movimientos desde la muñeca hacia el codo. Observe siempre las dos extremidades superiores (brazos), para elegir el mejor sitio de punción. Ligadura El uso de la liga provoca estasis del retorno venoso, que a su vez aumenta la prominencia de las venas y facilita su punción. Normalmente se utiliza una tira de goma elástica, de 1,25 cm de ancho y 45 cm de largo. La tira de goma debe enrollarse bien ajustada alrededor del brazo del paciente, con el extremo recogido bajo la última vuelta, comenzando entre 7,5 y 10 cm por encima del lugar de la extracción, porque tiene tendencia a pellizcar la piel. Para que los resultados de las pruebas sean válidos, no debe dejarse nunca el compresor en el brazo más de 2 minutos. Limpieza de la zona de Se empapa un algodón con alcohol al 70% y se aplica con un movimiento punción circular, desde el centro de la zona hacia fuera. Se deja secar la piel para evitar la producción de hemólisis en la muestra de sangre y la sensación de escozor que experimenta el paciente cuando se le pincha. Inspección de la aguja y tubo de vacío Se coloca la aguja capsulada en la jeringa, enroscándose hasta que esté apretada. La funda no debe quitarse hasta que el enfermero este listo para extraer la sangre, evitando así la contaminación de la aguja. Cuando todo esté preparado, se extrae la aguja de su funda y se examina especialmente la zona de la punta, para determinar si el extremo está doblado y si el orificio de apertura está libre de partículas que pudieran obstruir el flujo de la sangre. Punción y extracción Coger la jeringa con su mano derecha, y utilizar el índice de su mano izquierda para palpar la vena. Después de localizarla hay que mantener el dedo sobre la vena y guiar a la aguja hasta este punto. Entonces, hay que tirar suavemente del émbolo. Tan pronto como la sangre comience a fluir en la jeringa no hay que volver a mover la aguja. Tras llenarse, se saca el tubo del soporte, la válvula de cierre recubre la punta posterior de la aguja, haciendo que cese el flujo de sangre hasta que MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 55 se inserte el siguiente tubo. Después de extraer el tubo, debe mezclarse inmediatamente la sangre con el anticoagulante, invirtiendo el tubo tres o cuatro veces. La inversión debe hacerse suavemente, para evitar la hemólisis. Ocasionalmente, algún tubo defectuoso no tiene vacío. Si un tubo no se llena y la aguja está dentro de la vena, debe utilizarse otro tubo. Si un tubo comienza a llenarse y se para de repente, debe moverse la aguja ligeramente hacia delante o hacia atrás; normalmente, este ajuste basta para recuperar el flujo de sangre. Sino, se da media vuelta a la aguja y se afloja el compresor, que quizás esté demasiado apretado. No se recomienda hurgar con la aguja porque esto duele al paciente. Si no funciona ninguno de estos procedimientos, debe sacarse la aguja y utilizar otro punto diferente. Soltar Ligadura y retiro de Después de realizada la extracción de sangre, el paciente puede abrir su aguja mano y se libera la liga, lo que permite que se normalice la circulación sanguínea y se reduzca la hemorragia en el lugar de la punción. El enfermero debe aplicar un algodón seco sobre la aguja, que se saca entonces suavemente y con cuidado. El algodón se mantiene firmemente sobre el lugar de la punción unos minutos. Los pacientes sujetos a tratamiento anticoagulante necesitan con frecuencia más tiempo para cortar la hemorragia. La aguja se quita de la jeringa y se desecha en un contenedor de material cortopunzante. Al finalizar el procedimiento, indíquele al paciente que debe hacer presión en el sitio punzado por lo menos durante cinco minutos. Coloque finalmente una banda adhesiva sobre la herida de la punción. Si el sangrado no se detiene, aplique presión constante sobre la herida durante 10 minutos más. Si el Problema aún no se soluciona, comuníquese con sus superior inmediato o directamente con el medico tratante. Etiquetar las muestras Enviar de inmediato al laboratorio Limitaciones Llenado inapropiado de los tubos No hay que quitar los tapones para llenar los tubos de vacío con la jeringa. Hay que pinchar el diafragma del tapón de goma del tubo apropiado y permitir que entre lentamente la cantidad de sangre adecuada. No debe forzarse nunca la entrada de sangre en el tubo. Si el tubo no se llena, puede empujarse suavemente el émbolo de la jeringa, una técnica extremadamente importante. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 56 Procedimiento: Manejo de paciente con reacción adversa a punción venosa Objetivo: Indicación Descripción del procedimiento: Reacciones vasovagales con pérdida de conocimiento, hipotensión, náuseas, vómitos y pérdida de control de esfínteres. • Retire inmediatamente la aguja del lugar de la punción. • Sostenga al apaciente con fuerza para evitar que caiga y se golpee. Solicite ayuda. • Coloque sobre la herida de la punción, un apósito, algodón o gasa con sostenida presión, para evitar que siga sangrando. • Puede acostar al paciente en el suelo o en una camilla y deben levantarse sus piernas (Posición de Trendelemburg). • Coloque un algodón impregnado con alcohol frente a la nariz del paciente. • Permita que el paciente tenga buena ventilación. Abra el cuello de su camisa y desajuste la corbata si es el caso. • El paciente por si solo sabrá cuando podrá incorporarse. • Si las circunstancias lo permiten, haga medición de la presión sanguínea. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 57 TOMA DE MUESTRA DE DEPOSICIONES Y OTROS PARASITOLOGICOS Procedimiento: Indicaciones: MUESTRA PARA REACCION DE BENEDICT Estudio de pacientes con sospecha de sd malabsorción • • Procedimiento: Indicaciones: COPROPARASITOLOGICO SERIADO, PARA FASCIOLA HEPATICA Estudio de pacientes con sospecha de enteroparasitosis específica por fasciola hepática • • • • • Procedimiento: Indicaciones: Deposición en frasco limpio y seco. Llevar inmediatamente al Laboratorio No debe pasar más de dos horas de tomada la muestra. Se debe retirar en el laboratorio el material para recolectar las muestras, que consta de 3 frascos plásticos con tapa hermética con fijador PAF, además de un instructivo para el paciente. Se obtiene 10 muestras de deposición recién emitida día seguidos, que se incorporan sucesivamente al mismo frasco. La cantidad de deposición debe ser equivalente a una cucharadita de té mezclando con el líquido que contiene el frasco. Poner las 10 muestras distribuidas en los 3 frascos y llevar al laboratorio. Si en la deposición se observan parásitos macroscópicos deben ser colocados en un frasco con agua de la llave. COPROPARASITOLOGICO SERIADO PARA CRIPTOSPORIDIUM Estudio de pacientes con sospecha de enteroparasitosis específica por cryptosporidium • Toma de muestra igual que examen coproparasitológico o en frasco limpio 1 muestra de deposición fresca. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 58 TOMA Y ENVIO DE MUESTRAS PARA CULTIVO INTRODUCCION: En la recuperación de microorganismos causantes de infección, lo más importante es la recolección de la muestra para el estudio microbiológico. Esta recolección consta de los siguientes pasos: • Seleccionar el sitio anatómico más adecuado para tomar la muestra • Usar la técnica más apropiada • Poner la muestra recolectada en un envase que favorezca la viabilidad de los microorganismos • causantes del proceso infeccioso, y que evite la filtración o derrame de la muestra, como forma de protección para el personal que la manipulará posteriormente • Enviar la muestra en forma rápida y expedita al laboratorio, y en el caso que esto no sea posible, asegurarse que sea almacenada a la temperatura y en los medios de transporte adecuados Una muestra mal recolectada puede inducir a error en el aislamiento del microorganismo etiológico real, y la recuperación de contaminantes puede llevar a indicar un tratamiento de antibiótico incorrecto. La calidad del trabajo realizado en el laboratorio no puede ser superior a la calidad de la muestra recibida. OBJETIVO: Obtener una muestra de acuerdo a la localización, que permita un óptimo rendimiento del examen bacteriológico, libre de contaminación. Dirigido a: • Médicos que solicitan y realizan el procedimiento de toma de muestras • Enfermeras (os) que realizan o ayudan en la toma de muestras • Técnicos Paramédicos • Otros profesionales • Alumnos de pre y postgrado • Supervisores de Servicios y Unidades que deben cautelar su cumplimiento GENERALIDADES EN LA TOMA DE MUESTRAS PARA CULTIVOS La muestra debe ser tomada con máximas precauciones de asepsia, usando el instrumental adecuado y estéril. La muestra debe ser representativa del proceso infeccioso, es decir, debe tomarse del sitio de infección, evitando la contaminación con tejido adyacente, órganos o secreciones. Se debe obtener una cantidad suficiente de muestra, según el número de exámenes requeridos, y debe ponerse en receptáculos adecuados y estériles. Una vez obtenida la muestra, ésta debe enviarse al laboratorio a la brevedad (en medios de transporte adecuados si el caso lo requiere), debido a que algunos microorganismos tienen baja resistencia a las condiciones ambientales y en otras muestras (orina) la temperatura ambiente favorece la multiplicación bacteriana, induciendo a error en el recuento de colonias. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 59 En lo posible, para que la muestra tenga un valor significativo, ésta debe obtenerse antes de la administración de antibióticos. Esto es especialmente importante en el aislamiento de Streptococcus beta hemolítico (muestras faríngeas), Neisseria gonorrhoeae (cultivos genitourinarios), Haemophilus influenzae y Neisseria meningitidis (L.C.R.). Si el enfermo ya está en tratamiento con antibióticos, idealmente éstos deberán suspenderse por un plazo mínimo de 4 veces la vida media del fármaco y posteriormente tomar la muestra. La muestra debe rotularse en forma adecuada e ir acompañada de una solicitud de examen, en la que se anotará, en forma legible: - Nombre completo del paciente - Edad o Fecha de nacimiento - Nº ficha clínica - Cuenta corriente (si está hospitalizado) - Nº de RUT - Procedencia (si es hospitalizado, indicar servicio; o si es ambulatorio) - Tipo de muestra - Fecha y hora en que se recolectó la muestra - Examen solicitado - Diagnóstico clínico o agente etiológico probable - Si hay tratamiento antibiótico previo o actual, tratamientos concomitantes - Nombre y firma del médico - Otras observaciones (si se trata de una repetición, si es un control, técnica usada en la Obtención de la muestra, etc.) Estos datos son fundamentales en el procesamiento de la muestra, ya que permiten una mejor orientación en la búsqueda del agente etiológico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 60 PROCEDIMIENTOS DE TOMA DE MUESTRAS RESPIRATORIAS: LAVADO BRONQUIOALVEOLAR (LBA) Procedimiento: Toma de Lavado bronquioalveolar Definición: Indicaciones: Descripción del procedimiento: Muestra de secreción del árbol respiratorio inferior obtenida por fibrobroncoscopía. Sospecha de patología endobronquial y pulmonar Estudio citológico, histológico y bacteriológico de patología pulmonar. Estudio de Hongos. • Proceder a realizar la fibrobroncoscopía con técnica aséptica, por el clínico. • Registrar. MINILAVADO BRONQUIOALVEOLAR (MiniLBA) Procedimiento: Definición: Indicaciones: Descripción procedimiento: Toma de Minilavado bronquioalveolar (MiniLBA) Muestra de secreción del árbol respiratorio inferior obtenida a través del tubo endotraqueal Sospecha de Neumonia asociada a ventilación mecánica del • Deben ser tomados con técnica aséptica, a través del tuboendotraqueal. • El tubo endotraqueal debe ser aspirado previo al procedimiento • La sonda de aspiración debe ser lo suficientemente larga para que pueda impactar en un bronquio. • La sonda de aspiración se llenará con solución fisiológica antes de introducir. • Posteriormente se insertará esta sonda a través del tubo endotraqueal hasta que se impacte en un bronquio. Si se desea aspirar secreciones de un pulmón en particular, se deberá colocar al paciente decúbito lateral del lado que se quiere aspirar • Una vez impactada la sonda se deben introducir de 5, 10 a 20 ml. De solución salina 0.9%. La cantidad se determinará si el paciente es neonato, niño o adulto • Después de instilar se debe colocar el kit de aspiración en la sonda y aspirar hasta obtener la muestra que no debería ser menor de 5 ml. • Desconectar el kit de aspiración y tapar • Etiquetar las muestras • Enviar de inmediato al laboratorio especificando que se trata de un mini LBA ya que el proceso de esta muestra es distinto al de otras. • El nivel de corte utilizado es de 104 ufc/ml. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 61 ASPIRADO ENDOTRAQUEAL (AET) Procedimiento: Definición: Indicaciones: Descripción procedimiento: Toma de Aspirado Endotraqueal (AET) Muestra de secreción del árbol respiratorio inferior obtenida a través del tubo endotraqueal Todo paciente con sospecha de Neumonia asociada a ventilación mecánica (NAVM ), conexión a ventilación mecánica más de 48 horas y presencia de criterios clínicos radiológicos, en el cual no se hayan efectuado cambios de tratamiento antimicrobiano durante las últimas 72 horas. del • La muestra debe ser obtenida con técnica aséptica. • El procedimiento debe ser realizado por profesional capacitado en procedimientos sobre la vía aérea. • Se debe aspirar el tubo endotraqueal antes de obtener la muestra • Se obtiene introduciendo sonda de aspiración por el tubo endotraqueal y conectar al otro extremo a un colector o trampa estéril • No se debe instilar suero fisiológico con el fin de facilitar la recolección ya que se diluye la muestra (recuerde que se trata de un cultivo cuantitativo). • Si las secreciones son espesas, se deben aplicar aspiraciones intermitentes hasta conseguir la muestra. • La muestra debe ser enviada inmediatamente a sección bacteriología de la Unidad de Laboratorio Clínico. • Se debe especificar claramente en solicitud de examen: • Examen solicitado: CULTIVO CUANTITATIVO ASPIRADO ENDOTRAQUEAL. • El nivel de corte utilizado es de 106 ufc/ml. ASPIRADO NASOFARINGEO (ANF) Procedimiento: Definición: Indicaciones: Toma de Aspirado Nasofaringeo (ANF) Muestra de secreción del árbol respiratorio superior obtenida mediante la aspiración de secreciones de la nasofaringe Sospecha de infecciones por Bordetella pertussis y estudio de virus respiratorios Descripción del • Tomar el examen con técnica aséptica procedimiento: • Conectar un extremo de la tapa de dos salidas a la bomba o red de aspiración • Conectar el extremo de diámetro menor a la sonda de alimentación • Insertar la sonda en la fosa nasal del paciente aproximadamente 8 cms • Retirar la sonda, repetir el procedimiento en la otra fosa nasal • Aspirar aproximadamente un volumen de 4-5 ml de Buffer tampón PBS frío a través de la sonda para arrastrar toda la secreción • Cambiar la tapa al tubo recolector, anotar los datos del paciente o etiquetar • Enviar de inmediato al Laboratorio con hoja de solicitud de examen. • Si no puede ser enviada de inmediato al laboratotio, guardar refrigerado MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 62 el tubo con la muestra, el tiempo máximo es de 24 hrs, luego debe ser enviado al Laboratorio para su procesamiento. MUESTRA DE EXPECTORACIÓN Procedimiento: Toma de muestra de expectoración Definición: Muestra de secreción del árbol respiratorio superior obtenida mediante la expectoración de secreciones por el paciente Sospecha de infecciones por B.pertussis y estudio de virus respiratorios Sospecha de infecciones bacterianas del tracto respiratorio inferior Sospecha de hongos Indicaciones: Descripción procedimiento: del • El paciente debe lavarse los dientes y realizar enjuagues con agua para limpiar la cavidad oral, con el objeto de eliminar los restos de partículas de alimentos y los gérmenes saprófitos de la cavidad bucal. • En lo posible tomar la primera expectoración de la mañana, mediante tos espontánea o provocada eliminar la expectoración en una caja de boca ancha. • El paciente debe ser asistido en el momento de la obtención de la muestra • La muestra debe ser enviada de inmediato al laboratorio • En la orden de exámen solicitar Gram directo • Evaluación: Si en el Gram se observa más de 25 células epiteliales por campo, indica que hay contaminación orofaríngea y se debe considerar la muestra no representativa, repetirla con buena técnica. MUESTRA DE SECRECION FARINGEA Procedimiento: Toma de muestra de Secreción Faríngea. Definición: Muestra de secreción o exudado faríngeo mediante tórula o hisopo Indicaciones: Sospecha de infección faringoamigdaliana Descripción procedimiento: del • • • • • • Buena iluminación y exposición de la faringe del paciente Deprimir la lengua con bajalengua Frotar la tórula contra la pared posterior de la faringe y las amígdalas tocando cualquier exudado. Evitar tocar la lengua, úvula y pared de la boca Depositar la tórula dentro de un tubo estéril Enviar de inmediato al laboratorio MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 63 PROCEDIMIENTOS DE TOMA DE MUESTRA DE HEMOCULTIVOS Y CATÉTERES VENOSOS CENTRALES (CVC) TOMA DE MUESTRAS DE HEMOCULTIVOS: Procedimiento: Objetivo: Responsables cumplimiento: Definiciones clasificación: Toma de Hemocultivos Obtener una muestra de sangre que permita un óptimo rendimiento del examen, libre de contaminación. de Médicos que lo solicitan Enfermeras, Matronas, Tecnólogos médicos Técnicos Paramédicos Otros profesionales Alumnos de pre y postgrado Supervisores de Servicios y Unidades que deben cautelar su cumplimiento y HEMOCULTIVO: Es un examen microbiológico que permite la detección en el laboratorio, de una bacteremia o fungemia y permite adecuar la terapia antimicrobiana de acuerdo al microorganismo aislado y a la sensibilidad in vitro que éste presente, ya que la terapia, generalmente se inició en forma empírica. CLASIFICACIÓN DE LOS HEMOCULTIVOS: Para pacientes adultos o pediátricos Según la toma de la muestra pueden ser hemocultivos periféricos o centrales (obtenidos a través de catéter venoso central). Según el tipo de microorganismo que se esté investigando (aerobios o anaerobios) Según la metodología del sistema de hemocultivos en métodos manuales, semiautomatizados o automatizados. Indicaciones: • Sospecha de bacteremia o fungemia en pacientes con o sin foco aparente de infección. • Sospecha de infección del SNC. • Lactante menor de 3 meses con hipertermia (mayor de 39.5) • Síndrome febril de más de 4 días de evolución, sin foco clínico evidente. • Pleuroneumonias. • Paciente inmunodeprimido, con fiebre • Sospecha clínica de septicemia. • Cardiopatía, con fiebre, sin foco clínico evidente. • Osteoartritis aguda. • Celulitis facial en niño menor de 5 años. • Pielonefritis Oportunidad e intervalo Lo ideal es tomar la muestra inmediatamente previa al alza febril, sin de la toma de muestras embargo este momento no se puede predecir pero muchas veces coincide MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 64 con un período de calofríos del paciente. Los hemocultivos se pueden obtener al mismo tiempo de diferentes sitios de punción, sin fijar plazos de tiempo entre ellos, sobre todo en pacientes que requieren inicio inmediato de antimicrobianos. La muestra debe obtenerse por punción periférica (venosa o arterial), siempre por una nueva punción Debe ser la primera muestra que debe obtenerse si existe indicación de otros exámenes. En pacientes con terapia antimicrobiana la muestra debe tomarse inmediatamente antes de la próxima dosis de antimicrobiano. Se deben obtener los 2 hemocultivos en un periodo máximo de 24 horas. Medidas para evitar la • Utilizar técnica aséptica estricta en la toma de la muestra, es esencial contaminación de las para evitar contaminación muestras: • Realizar lavado de piel del paciente con agua y jabón. • Utilización de antiséptico aplicando en forma excéntrica desde el sitio de punción elegido • En el caso de los sistemas manuales que no son sellados, se debe destapar el frasco para inocular la muestra, este procedimiento tiene riesgo de contaminación por lo que se debe tener máxima precaución en no tocar las paredes exteriores ni interiores de la botella con la aguja ó jeringa • La mascarilla se utilizará en caso que el operador esté cursando un estado gripal, pero se debe mantener la disciplina en cuanto a no hablar mientras se inocula la muestra • Se acepta un porcentaje de contaminación que varía entre un 2 a 3% • Esta contaminación se atribuye principalmente a una contaminación durante la toma de muestraLa tasa de contaminación de los hemocultivos, constituye un indicador de calidad • La decisión final del significado clínico de un hemocultivo positivo, depende en última instancia de la presentación clínica y del curso de la enfermedad en un paciente determinado. • El Laboratorio evaluará y emitirá un informe semestral, dando a conocer, el porcentaje de contaminación de los hemocultivos tomados en cada Servicio. Número y volumen de Se ha demostrado que en un episodio bacterémico la positividad de dos o las muestras: tres muestras para hemocultivo no tiene diferencia significativa por lo que se recomienda tomar 2 muestras tanto en adultos como en niños. Si se sospecha endocarditis infecciosa, se recomienda tomar 2 hemocultivos, si éstos están negativos a las 24 hrs., obtener un segundo set de 2 hemocultivos más No se debe tomar una muestra de sangre para hemocultivo en forma aislada, dado que disminuye la positividad y complica la evaluación de contaminación. Las recomendaciones son obtener el máximo de volumen que la botella sea capaz de tolerar manteniendo la relación 1:5 a 1:10 entre la muestra y el volumen del medio de cultivo Esta dilución permite neutralizar las propiedades bactericidas de la sangre MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 65 Descripción procedimiento: y de los agentes antimicrobianos que puedan estar presentes en la muestra. Para la gran mayoría de los sistemas automatizados este volumen es de 10 ml para adultos y es variable para los niños según la edad: • Recién nacidos: 1-2 ml • Lactantes de 1 mes a 2 años: 2-3 ml • Niños mayores de 2 años y <12 años: 3-5 ml • Adolescentes: 10 ml • Adultos: 10 ml Las muestras se deben mantener a temperatura ambiente, nunca refrigerar La incubación a 35ºC debe realizarse lo antes posible, pudiendo darse como máximo de tiempo 2 hrs desde que se tomó la muestra. del El procedimiento se realiza con Técnica aséptica: • Reuna el material • Examine cada frasco antes de usar en busca de indicios de daño, contaminación o deterioro como: derrames, turbidez, decoloración u oscurecimiento o el tampón hinchado o hundido, si es así, el frasco se debe devolver. • En el momento de la toma de muestra, el frasco de cultivo debe estar a temperatura ambiente. • Explique el procedimiento al paciente • Realizar lavado de manos clínico con jabón antiséptico. • Colocar guantes de procedimiento o manoplas en caso de riesgo de contacto con sangre. • Prepare la zona a puncionar lave la piel con tórulas con agua y jabón antiséptico desde el centro a la periferia • Desinfectar la zona a puncionar con Alcohol 70%, excepto en los recién nacidos donde se debe usar clorhexidina • Se debe esperar que el antiséptico se seque para que ejerza su acción residual • La punción debe ser efectuada con guantes, que deben ser estériles cuando se requiere palpar nuevamente la vena • Extraer la muestra • Inocular la muestra, previo descontaminar el tapón de goma de la botella con alcohol y esperar que seque. • En el caso de los sistemas manuales que no son sellados, se debe destapar el frasco para inocular la muestra • Eliminar material cortopunzante en contenedor ad-hoc • Rotular muestras (no escriba en el código de barras) consigne: • Nombre completo del paciente • Fecha, hora y servicio o unidad • Vía de obtención de la muestra: periférico, por CVC, etc • N° de muestra I o II • Registrar el procedimiento • Mantención y transporte de las botellas MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 66 • • • • • Mantener a temperatura ambiente Enviar rápidamente al laboratorio Nunca refrigerar Transportar a temperatura ambiente La incubación a 35ºC debe realizarse lo antes posible, pudiendo darse como máximo de tiempo 2 hrs desde que se tomó la muestra. Indicadores de calidad: Nº de hemocultivos contaminados por servicio/ Nº de Hemocultivos Contaminación de tomados por servicio X 100 Hemocultivos Estándar o umbral de 2 a 3% de contaminación de hemocultivos evaluación Bibliografía: Manual de Procedimientos MINSAL 1990 Manual de Prevención y Control de Infecciones Intrahospitalarias MINSAL 1993. MUESTRAS PARA CULTIVO DE CATÉTERES VENOSOS CENTRALES Procedimiento: Definición: Indicaciones: Descripción procedimiento: Toma de Muestras de CVC Cultivo de punta de CVC: cultivo que se toma al retirar el CVC cortando una porción de la punta para cultivo Pacientes con catéter venoso central que presente fiebre 38º C., sin foco aparente que la explique con o sin infección a nivel de la inserción del CVC. del Cuando se retira el CVC: Método semicuantitativo de Maki • Lavado clínico de manos. • Uso de guantes estériles: • Instalar campo estéril. • Cerrar la conexión del catéter. • Limpiar la piel donde se inserta el catéter con alcohol de 70º. • Con una pinza y tijera estéril cortar punto que fija el catéter a la piel y traccionar suavemente hacia el exterior. • Cortar con tijera estéril 3 cm de la punta del catéter, partiendo desde algunos milímetros bajo el nivel subcutáneo del catéter. • Guardar la punta del catéter en un tubo estéril de boca ancha. • Enviar al Laboratorio antes de 2 horas. • Tomar en forma paralela 2 hemocultivos periféricos al paciente (diferentes sitios de punción) para documentar bacteriemia. Interpretación: Si el recuento de colonias es menos de 15 (15 UFC) se interpreta como una contaminación del catéter al momento de retirarlo. Si el recuento es igual o superior a 15 (15 UFC) se interpreta como una colonización significativa del catéter. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 67 Cultivo sitio de inserción CVC: Hacer aseo superficial con gasa y suero fisiológico o agua destilada estéril Exprimir desde los bordes para obtener secreción con una tórula Enviar al laboratorio. Nota: No tomar muestra de sitio de inserción en ausencia de signos inflamatorios locales sugerentes de infección. Cuando permanece el C.V.C.: En el caso que el catéter no es retirado, se recomienda efectuar el tiempo diferencial de la positividad de los hemocultivos. Este método se puede realizar sólo en laboratorios que dispongan de sistemas automatizados. Tiempo diferencial de los hemocultivos: • Preparación de la piel, lavado por arrastre con jabón antiséptico. • Lavado clínico de manos con jabón antiséptico, uso de guantes estériles. • Extraer 1 hemocultivo a través de catéter central y luego un hemocultivo de vena periférica. • Si colapsa el catéter al tomar la muestra central, se debe obtener la misma cantidad via perisferica para que puedan ser comparables los resultados. • Rotular cada una de ellas y enviar al laboratorio. Interpretación: Se ha señalado como indicativo de bacteriemia relacionada a CVC un tiempo diferencial de 2 horas a favor del hemocultivo central con respecto del periférico. PROCEDIMIENTOS DE TOMA DE MUESTRA DE ORINA PARA CULTIVO Procedimiento: Toma de Muestras de Urocultivos Descripción de la norma Preferentemente se debe obtener la primera orina de la mañana (ya que se trata de una muestra más concentrada). De no ser posible, el paciente debe abstenerse de orinar durante las tres horas previas al examen. No forzar la ingestión de líquidos, ya que con ello se diluye la orina, alterando el recuento. Volumen recomendado a recolectar: 25 a 50 ml Volumen mínimo: 3 ml Se debe tomar la muestra siempre previo aseo genital Una vez obtenida la muestra debe procesarse antes de 2 horas Indicaciones: Pacientes con sospecha de infección urinaria Clasificación descripción y Orina de segundo chorro; Recolección de orina en mujeres adultas: del • Tener un frasco estéril proporcionado por el laboratorio MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 68 procedimiento: • Tener a lo menos 3 horas de retención de orina • Separar los labios genitales y mantener los pliegues separados • Realizar higiene genital con agua sola o con jabón neutro • Enjuagar con abundante agua • Colocar tampón vagianl en caso de menstruación o leucorrea. • Secar sin friccionar • Colocar tampón vaginal • Destapar el frasco estéril cuidando de no tocar las partes internas • Comenzar la micción descartando el primer chorro • Sin cortar el chorro de orina, colocar el frasco recolector obteniendo la porción media de la orina • Tapar el frasco y rotular • Enviar al laboratorio. Toma de muestra en varones adultos: • Tener un frasco estéril proporcionado por el laboratorio • Tener a lo menos 3 horas de retención de orina • Lavar con jabón la cabeza del pene empezando por la abertura uretral previa retracción del prepucio • Enjuagar con agua y secar suavemente • Destapar el frasco recolector en el momento de la micción • Sin tocar con los dedos la parte interior • Recolectar la muestra eliminando el primer chorro • Depositar la muestra media del chorro • Rotular muy bien el frasco • Enviar al laboratorio. Orina obtenida mediante recolector pediátrico: • Realizar aseo prolijo con agua y jabón • Aplicar el recolector para obtener la muestra • Tener la precaución de cambiar el recolector cada 30 minutos • Enviar la muestra al laboratorio Orina obtenida a través de catéter vesical permanente: Generalmente los catéteres vesicales están colonizados ya a las 48 hrs de instalados y los microorganismos aislados no necesariamente son el agente causal de la infección urinaria. Toma de muestra pacientes con sonda vesical instalada hace 24 horas: • Limpiar la superficie externa del catéter con alcohol 70%, esperar que se seque para que ejerza su acción. • Efectuar punción en ángulo de 30º • Pinzar el catéter en el momento de tomar la muestra • Depositar la orina en un frasco estéril • Enviar de inmediato al laboratorio. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 69 Toma de muestra en pacientes con sonda vesical instalada hace más de 24 horas: • Cambiar la sonda antes de proceder a tomar la muestra de orina • Tomar ésta antes de conectar la bolsa recolectora • Depositar en un frasco estéril • Enviar de inmediato al laboratorio Punción vesical: Es el método de referencia para la obtención de orina a cultivar ya que evita la contaminación con flora uretral; sin embargo, se reserva para casos especiales por ser un procedimiento invasor. Cateterización vesical transitoria: Se considera una alternativa a la punción vesical pero es también un procedimiento invasor y puede generar arrastre retrógrado de microorganismos. Transporte de la muestra: La orina es un buen medio de cultivo que permite la multiplicación de los microorganismos incrementando el recuento bacteriano, por lo que las muestras deben procesarse antes de las 2 horas de obtenidas. PROCEDIMIENTO DE TOMA DE MUESTRAS DE LÍQUIDO CEFALORRAQUIDEO Procedimiento: Toma de muestra de Líquido cefalorraquídeo (LCR) Definición: Muestra de LCR obtenida por punción lumbar Indicaciones: Sospecha de infección meníngea Descripción procedimiento: del • Lavar la región lumbar del paciente con agua y jabón. • Realizar lavado con agua y jabón antiséptico y posteriormente antisepsia de la piel mediante la realización de movimientos concéntricos que van desde el lugar donde se realiza la punción hacia fuera. • Esperar tiempo de latencia del antiséptico. • Proceder a la punción lumbar con técnica aséptica, por el clínico. • Recolectar el L.C.R. en tres tubos estériles. Utilizar el segundo tubo para el estudio microbiológico ya que el primero tiene más posibilidades de contaminarse con flora cutánea. El otro tubo se utiliza para efectuar estudio citológico, bioquímico, antígenos capsulares, etc. • La cantidad de L.C.R. afecta directamente la sensibilidad del diagnóstico bacteriológico. En general cantidades de 1-3 ml del L.C.R. para el estudio microbiológico son adecuadas, pero si es necesario determinar antígenos capsulares (látex) debe enviarse otro tubo con una cantidad MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 70 similar de L.C.R. • En aquellos casos en que se obtiene escasa cantidad de muestra, se debe consultar al clínico, acerca de cual de los estudios que se realizan con el L.C.R., reviste mayor importancia para el paciente • El transporte se debe realizar lo más pronto posible, en tubos estériles, ya que la mayoría de los microorganismos causantes de meningitis son sensibles a los cambios de temperatura y desecación. PROCEDIMIENTOS PARA TOMA DE MUESTRAS DE CAVIDADES SEROSAS Procedimiento: Definición: Toma de muestra de Líquido pleural, peritoneal, pericárdico, sinovial, etc. Muestra de cavidades serosas que se obtiene por punción. Indicaciones: Sospecha de infección bacteriana o por hongos. Descripción procedimiento: del El líquido pleural, peritoneal, pericárdico, sinovial, etc., se obtienen generalmente por punción cutánea, por lo tanto, se debe realizar un riguroso aseo y antisépsia de la zona que se va a puncionar, para evitar la contaminación de la muestra con la flora flora cutánea y minimizar el riesgo de infección del paciente asociado al procedimiento. La muestra debe ser obtenida por un médico experimentado en la técnica y un asistente, ambos vestidos con ropa estéril, guantes y mascarilla. Se recomienda usar jeringa heparinizada para tomar muestras de L. articular o L. pleural que contengan gran cantidad de proteínas, enviar 1-3 cc. del líquido, en caso de estudio de hongos debe ser tomada sin anticoagulante, ya que este tiene efecto inhibidor. Con respecto a los L. Ascíticos se ha observado una mayor positividad si se envía 5-8 ml en matraz de hemocultivos de adulto. TRANSPORTE: Una vez que el clínico ha obtenido la muestra, en tubos estériles o jeringa, debe ser conducida a la brevedad posible al laboratorio, a temperatura ambiente PROCEDIMIENTOS DE TOMA DE MUESTRAS DE TRACTO GENITAL MUESTRAS DEL TRACTO GENITAL MASCULINO Procedimiento: Toma de muestra de Tracto genital masculino Definición: Muestra de secreción uretral o balanoprepucial masculino. Indicaciones: Sospecha de infección del tracto genital masculino MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 71 Descripción del procedimiento: Secreción uretral: Debe ser matinal antes de orinar Aseo genital con agua y jabón. Si existe secreción abundante, tomar la muestra con tórula desde el inicio de la uretra posterior. Si no se ve secreción, introducir una tórula fina unos 2 a 3 cm dentro de la uretra y rotar suavemente en ambos sentidos, tomar 2 tórulas, una para Gram y otra para cultivo. Si existe secreción escasa: Obtener orina de 1er chorro, de primera micción matinal en frasco de urocultivo Enviar antes de 15 minutos al laboratorio y registrar en solicitud de examen la búsqueda de N. gonorrhoeae. Balanoprepucial: Realizar aseo genital con agua y jabón Retraer el prepucio Tomar con tórula estéril desde el surco balanoprepucial Enviar al laboratorio. MUESTRAS DEL TRACTO GENITAL FEMENINO Procedimiento: Toma de muestra de Tracto genital femenino Indicaciones: Sospecha de infección del tracto genital femenina Descripción del procedimiento: Glándula de Bartholino, para búsqueda de: Bacterias aerobias N .gonorrhoeae Aseo vulvar con agua y jabón Pincelar con povidona yodada Puncionar con técnica aséptica y aspirar pus Eliminar el aire de la jeringa y sellarla Enviar de inmediato al laboratorio. S. vaginal para búsqueda de: Candida spp Gardnerella vaginalis Streptococcus agalactiae Listeria Colocar espéculo sin lubricante Introducir tórula estéril seca Tomar muestra de secreción Enviar al laboratorio. Cervix uterino para búsqueda de N. gonorrhoeae MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 72 Colocar espéculo Limpiar con gasa la secreción vaginal y mucus del cérvix Introducir tórula en endocérvix y rotarla para obtener exudado Enviar de inmediato al laboratorio. Loquios: No se deben cultivar loquios obtenidos desde la vagina, ya que la contaminación con secreción vaginal los hace no representativos de procesos endometriales Fondo de saco de Douglas, para búsqueda de: -Bacterias aerobias -N. gonorrhoeae Limpiar con gasa estéril el fondo de saco vaginal posterior Desinfectar con povidona yodada Puncionar con jeringa estéril y aspirar Enviar al laboratorio. S. uretral para búsqueda de: -N. gonorrhoeae Aseo perineal como en urocultivo. Introducir tórula fina y rotar. Enviar de inmediato al laboratorio. Orina para búsqueda de: N. gonorrhoeae Aseo perineal como en anterior. Tomar muestra de orina del 1er chorro (10 ml) y primera orina de la mañana con técnica aséptica. Llevar de inmediato al laboratorio y registrar en solicitud de examen la búsqueda de N. gonorrhoeae. PROCEDIMIENTOS DE TOMA DE MUESTRAS DE TRACTO GASTROINTESTINAL Procedimiento: Toma de muestra de Coprocultivos Definición: Indicaciones: Diagnóstico etiológico de diarrea aguda bacteriana: Mediante cultivo: Salmonella spp. Shigella spp. Yersinia enterocolitica E.coli enterohemorrágica(ECEH) MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 73 V.cholerae V.parahaemolyticus Mediante tinción de Gram de deposiciones: Campylobacter spp. Mediante detección de toxina: Clostridium difficile Mediante deteccion de toxina: E.coli enterohemorragica(ECEH) Descripción del procedimiento: Toma de muestra La muestra de deposición debe tomarse al comienzo del proceso agudo, no se recomienda realizar coprocultivos en pacientes con más de 3 días de hospitalización, debe estar sin tratamiento antibiótico previo. Idealmente deposición recién emitida, incluyendo productos patológicos (mucus, pus, sangre) en un frasco limpio. Se puede obtener de dos formas, especialmente en niños: 1. Sonda rectal: Se debe emplear una sonda nelaton fina y se aspira con jeringa. 2. Hisopado rectal: Introducir tórula en el recto y rotarla suavemente para obtener materia fecal, ésta debe ser enviada en medio de transporte Cary-Blair. Para pesquisa de toxina A de C. difficile se debe obtener aproximadamente 5 cc de deposición en un frasco limpio (sin fijador) que proporciona el laboratorio. Para detección de toxina ECEH tomar muestra con torula o deposición en frasco limpio sin fijador. En caso de hospitalización por diarrea, se tomará sólo una muestra al ingreso del paciente, ya que se ha demostrado que más de una muestra no aumenta el rendimiento en forma significativa, pero sí aumenta el costo. En pacientes hospitalizados no tomar muestras después de 72 hrs. Se solicita indicar en la orden presencia de sangre en deposiciones. Criterios de rechazo de una muestra: orden incompleta letra ilegible ausencia de medio de transporte pacientes hospitalizados más de 72 hrs que han consultado por SDA Deposición formada. Muestra enviada con fijador MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 74 PROCEDIMIENTOS DE TOMA DE MUESTRAS OCULARES Procedimiento: Toma de muestras oculars Indicaciones: Descripción procedimiento: Estudio en pacientes con presencia de secreción ocular u ojo rojo del Toma de muestra Tomar la muestra para cultivo antes de la aplicación de anestésico tópico. Tomar la muestra con extremo cuidado, con la ayuda de otra persona que inmovilice la cabeza del paciente. Limpiar la superficie externa del ojo con un algodón humedecido en suero fisiológico estéril o agua destilada estéril Luego se frota una tórula estéril humedecida en suero estéril, el fondo de saco conjuntival inferior en dirección hacia el borde interno del ojo evitando el borde de las pestañas Transporte de la muestra: Enviar la muestra inmediatamente al laboratorio. Procedimiento: Toma de Muestra lesión corneal Indicaciones: Descripción procedimiento: Estudio en pacientes con sospecha de infección por hongos del Toma de muestra Retirar material para toma de muestra en laboartorio (placas de agar sangre, chocolate, sabouraud, caldo aerobio, laminas portaobjetos) Muestra debe ser obtenida por oftalmólogo Visualizar la lesión corneal y raspar con espátula de Kimura preferentemente sobre los bordes de la ulcera y aéreas necróticas y/o ulceradas para obtener escamas cornéales. Sembrar de inmediato en placas de agar en forma de C, respetando el siguiente orden: agar sangre, chocolate, caldo sauboraud, lámina para tinción de Gram. Transporte de Muestra Enviar las siembras inmediatamente al laboratorio. Criterios de Rechazo Muestra de secreción ocular Evitar tomar muestras con tratamiento antimicótico previo o colirios anestésicos MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 75 PROCEDIMIENTOS DE TOMA DE MUESTRAS OTICAS Procedimiento: Toma de muestras oticas Indicaciones: Estudio de pacientes con sospecha de otitis externa u otitis media Clasificación Secreción del conducto auditivo externo: muestra obtenida cuando se presenta exudado, es mejor recolectar pus con una tórula fina. Secreción de oído medio: fluido de oído obtenido por Timpanocentesis. Descripción procedimiento: del Toma de muestra Otitis externa Hacer aseo cuidadoso de la piel ( para disminuir flora residente ) Con una tórula estéril y seca, tomar muestras en el mismo sentido del conducto auditivo Enviar al laboratorio. Otitis media No se recomienda la tórula para estudio de otitis media El cultivo del canal auditivo externo no refleja la causa de una otitis media, salvo que la membrana timpánica se haya roto recientemente. En este caso limpiar el conducto auditivo externo con suero fisiológico estéril y tomar muestra con tórula fina, sin contaminar con la superficie externa La muestra de elección es la punción timpánica aspirativa con técnica aséptica que debe ser tomada por especialista otorrinolaringólogo Enviar al laboratorio PROCEDIMIENTOS DE TOMA DE MUESTRAS DE PIEL Y TEJIDOS BLANDOS Procedimiento: Indicaciones: Toma de muestras de piel y tejidos blandos (Herida, abscesos, quemadura, exudados, etc.) El diagnóstico de infección, es clínico y se basa en la presencia de síntomas y signos clínicos en el sitio de la lesión. El cultivo se solicita sólo: Con diagnóstico de infección, si se requiere confirmar la etiología con fines epidemiológicos y/o terapéuticos. Si el clínico decide que el estado del paciente amerita un tratamiento antibiótico sistémico. Infección superficial: existe compromiso de dermis, epidermis y celular puede ser subcutáneo. profunda, Infección profunda: existe compromiso de además de la fascia y músculo, de las pudiendo o no comprometer cavidades u órganos. Clasificación La infección superficial dependiendo estructuras comprometidas. Descripción del Toma de muestras MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 76 procedimiento: Lesiones secas: No se recomienda cultivo. Lesiones costrosas: Aseo de piel con suero fisiológico Remover costra Frotar lesión con tórula humedecida en suero fisiológico estéril. Absceso cerrado: No usar tórula Descontaminar piel con alcohol 70% Puncionar el absceso, aspirar su contenido con jeringa, mínimo 0.5 ml. Celulitis: Descontaminar la piel con alcohol 70% Inyectar 0.5-1.5 ml de suero fisiológico estéril con aguja Nº 21 o jeringa de tuberculina y aspirar Enviar el aspirado en la misma jeringa. Vesículas: Descontaminar piel con alcohol Abrir vesícula con lanceta estéril Tomar muestra de secreción con tórula humedecida en suero fisiológico estéril Colocar en tubo seco estéril. Remover flora superficial de la piel y exudados con gasa y suero fisiológico Con una tórula estéril frotar firmemente los márgenes internos del absceso, en la región más alejada de la piel, pero no del centro mismo del absceso Si el contenido es muy fluido extraer con jeringa. Enviar de inmediato al laboratorio. Superficies quemadas: Los cultivos de superficie quemada solo se justifican si hay signos locales o generales de infección, en tal caso se recomienda hacer biopsia quirúrgica del tejido para cultivo cuantitativo Los cultivos rutinarios de vigilancia de superficies quemadas muestran solamente microorganismos colonizantes, por lo tanto no se justifican. Ulceras: Si no hay evidencia clínica de infección no deben ser cultivadas. Ulceras infectadas Las muestras superficiales de úlceras infectadas no deben ser tomadas con tórula o irrigación con suero fisiológico, ya que inevitablemente están altamente contaminadas por organismos que forman parte de la flora comensal de la piel y por organismos patógenos, que no participan de la infección MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 77 Pié diabético: La muestra adecuada para este tipo de herida es la obtenida por curetaje Curetaje: Hacer aseo con suero fisiológico estéril Debridar el tejido necrótico superficial con hoja de bisturí estéril Obtener muestra profunda a través de curetaje. Punción aspirativa: También son útiles, para este tipo de herida, las muestras obtenidas por punción aspirativa con jeringa, de abscesos o bulas Tienen menor sensibilidad ( 50% ) que las obtenidas por curetaje. Escaras y úlceras tróficas: No se debe cultivar lesiones superficiales ya que éstas están mal vascularizadas Se colonizan y son reservorio de microorganismos intrahospitalarios No llegan los antimicrobianos sistémicos Su tratamiento es local con curaciones o aseo quirúrgico. Si se sospecha que la puerta de entrada de una sepsis sea la escara: Obtener muestra post aseo superficial con gasa y suero fisiológico Eliminar el tejido necrótico Obtener tejido profundo por curetaje o biopsia. Secreción umbilical: Tomar sólo en R.N. Hacer aseo superficial con suero fisiológico Introducir la tórula en el orificio umbilical y rotar suavemente Tejidos: Tomar muestra y depositar en frasco de vidrio, de boca ancha con caldo de cultivo proporcionado por el laboratorio. Para cultivo de hongos enviar pequeños trozos de tejido en tubo esteril sin caldo de cultivo. PROCEDIMIENTOS DE TOMA DE MUESTRAS PARA INFECCIÓN ARTICULAR, OSEA Y DE MEDULA OSEA Procedimiento: Toma de muestras de infecciones articulares y oseas Indicaciones: Descripción procedimiento: Sospecha de artritis séptica, infección de artroplasía de caderas y osteomielitis del Toma de muestras Líquido articular Tomar una muestra de líquido articular e inocular directamente en frasco de hemocultivo pediátrico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 78 Artritis séptica Si existe sospecha de artritis de etiología tuberculosa, debe tomarse la muestra con heparina; 1 gota de solución de heparina al 5% estéril, para 5 ml de líquido. Diagnóstico de infección de artroplastía de cadera Punción aspirativa: Si existen evidencias clínicas y radiológicas de infección protésica, la punción aspirativa articular para obtener líquido para cultivo, es una ayuda valiosa para el estudio diagnóstico (la sensibilidad es de 50 a 70% y especificidad de 80%). Tomar una muestra y vaciar en frasco de hemocultivo pediatrico y enviar a laboratorio. Nota: Si desea Tinción de Gram, se debe enviar fracción de muestra en jeringa o frasco estéril. Osteomielitis aguda Cultivo intraoperatorio: Se deben tomar tres muestras, de sitios representativos, como 1 muestra de cápsula articular y 2 de membranas alrededor de los componentes protésicos, depositar las muestras en frascos de vidrio de boca ancha, con caldo de cultivo proporcionado por el laboratorio (cada muestra en un frasco). La tinción de Gram tiene alta especificidad pero muy baja sensibilidad (98% versus 12%). Muestra intraoperatoria de tejido sinovial o tejido óseo: Las muestras de tejido óseo o sinovial, obtenidas por procedimiento quirúrgico, deben ser inoculadas en frasco de vidrio, de boca ancha, con caldo de cultivo. Muestra por punción percutánea: Las muestras osteoarticulares, por punción percutánea bajo visión radiológicas, deben ser inoculadas en frasco de vidrio, de boca ancha, con caldo de cultivo. Nota: en caso de sospecha de bacteremia simultánea, obtener muestra de sangre para hemocultivos. Mielocultivo Tomar la muestra de médula ósea, con técnica aséptica. Inocular un caldo de hemocultivo pediátrico automatizado Transporte: Las muestras tomadas, deben ser enviadas inmediatamente al Laboratorio Central MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 79 PROCEDIMIENTOS DE TOMA DE MUESTRAS DE AGUAS DE DIALISIS Los controles microbiológicos en los Centros de Diálisis deben hacerse a lo menos semestralmente. La Unidad de Diálisis, la Unidad de IIH y el Laboratorio de Microbiología han determinado realizar mensualmente estos controles, estipulando que, el primer jueves de cada mes serán tomadas las muestras y enviadas al Laboratorio para su procedimiento La Unidad de Hemodiálisis cuenta con 7 máquinas y además, existe una en cada unidad de paciente crítico (UCI, UCICQ y UTI Adultos) Cantidad de muestras para cultivo: 1. 2. Unidad de Hemodiálisis crónico • 1 muestra obtenida de agua post filtración de ablandamiento • 1 muestra previo entrada a la primera máquina de diálisis (Pre-procedimiento) • 1 muestra previo entrada a la última máquina Unidad Hemodiálisis aguda: • • • − 1 muestra en UCI 1 muestra en UTI 1 muestra en UCI CQ Líquido de diálisis (Post procedimiento): • • • • 1 muestra para cada máquina o monitor de diálisis (7 en total) 1 muestra al primer paciente del mes que se dialice en UCI adultos 1 muestra al primer paciente del mes que se dialice en UTI adultos 1 muestra al primer paciente del mes que se dialice en UCICQ Método de obtención de muestra: − − − − Abrir la válvula y dejar fluir el agua por 2 minutos Con técnica aséptica tomar un volumen de 5 ml en frasco estéril que proporcionará el Laboratorio. Si se ha sanitizado, se debe hacer flush por toda la línea de agua por 15 minutos previo a la toma de muestra. Enviar al Laboratorio Interpretación: − − El recuento en agua de diálisis no debe exceder 200 UFC/ml El recuento bacteriano en líquido de diálisis no debe exceder 2000 UFC/ml Todo recuento superior a estos límites será informado a la brevedad a la Unidad respectiva y al Comité de Vigilancia en MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 80 MUESTRAS PARA ESTUDIO DE TUBERCULOSIS. Procedimiento: MUESTRA EXPECTORACION PARA ESTUDIO TBC Indicaciones: Diagnóstico en pacientes sintomáticos y control de tratamiento Número de muestras: Para diagnóstico en pacientes sintomáticos; dos muestras (una inmediata y la otra matinal en ayuna). Para control de tratamiento: una muestra mensual, la primera muestra de control debe ser enviada al mes de iniciado el tratamiento. Toma de muestra: Rotular la base del envase con el nombre completo del paciente y procedencia. Instruir al paciente que produzca el esputo bronquial de las profundidades del pecho.( inspirar profundamente. Retener un momento la respiración y toser fuertemente para tomar la muestra). Recalcar al paciente que las muestras deben ser matinales Informar al paciente que debe depositar dos o tres esputos recogidos directamente en el envase, cuidando que no se derrame en las manos, ni se escurra por las paredes exteriores del envase. No dejar transcurrir más de 7 días entre la recolección y procesamiento de la Conservación de la muestra muestra, conservándola siempre en refrigerador protegido de la luz. Procedimiento: MUESTRA CONTENIDO GASTRICO PARA ESTUDIO TBC Indicaciones: Diagnóstico en pacientes sintomáticos. Número de muestras: Dos muestras seriadas. Toma de muestra: Envase: Tubo estéril. Momento de extracción Por la mañana, estando el paciente en ayuno 12 horas. En lactantes se hará en momentos previo a su ingestión de leche. Técnica: Sondeo gástrico con sonda nasal o bucal adecuado y aspiración con jeringa. Cantidad: 2-10 ml. Conservación: La muestra debe enviarse inmediatamente al Laboratorio. Procedimiento: Indicaciones: MUESTRA ORINA PARA ESTUDIO TBC Diagnóstico en pacientes sintomáticos y control de tratamiento MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 81 Número de muestras: Para diagnostico: 6 muestras en días seguidos. Para control de tratamiento: 3 muestras en días seguidos, en forma mensual mientras dure el tratamiento. Envase: Frasco estéril. Cantidad: 100 a 200 mL. Momento de recolección Conservación: Debe recogerse la primera orina de la mañana, orina de segundo chorro. Previo aseo genital con agua. La muestra debe ser procesada inmediatamente por lo tanto una vez obtenida, debe ser enviada inmediatamente al Laboratorio. NOTA: Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis. Procedimiento: Indicaciones: LIQUIDO CEFALORRAQUIDEO Diagnóstico en pacientes sintomáticos La obtención de material esta reservado al personal Médico. Cantidad y momento de recolección: 1 ml. cuando el Médico tratante crea conveniente. Envase: Frasco estéril Conservación: Enviar en forma inmediata a Laboratorio para ser procesada. NOTA: Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis. Procedimiento: Indicaciones: LIQUIDO PLEURAL, ASCITICO, ARTICULAR LAVADO BRONCOALVEOLAR PARA ESTUDIO TBC Diagnóstico en pacientes sintomáticos. 1.- La obtención de material está reservada al personal Médico. 2.- Número de muestras: las que el Médico tratante crea convenientes. 3.- Envase. Estéril, de capacidad adecuada para la cantidad de la muestra. 4.- Conservación: Enviar en forma inmediata a Laboratorio para ser procesada. NOTA: Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 82 Procedimiento: Indicaciones: MUESTRAS DE TEJIDO: (GANGLIO, BIOPSIAS DE DIFERENTES ÓRGANOS) Diagnóstico en pacientes sintomáticos. Colocar un trozo de muestra en un tubo estéril, no mezclar con ningún tipo de preservante, en caso de ser posible pueden también obtenerse muestras mediante aspiración por jeringas y transportarlas en forma rápida al laboratorio. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 83 CAUSAS DE RECHAZO DE MUESTRAS RECHAZO ADMINISTRATIVO • Tubos o contenedores de muestras sin identificación • Identificación incorrecta • Información incompleta en solicitud de examen RECHAZO TÉCNICO Inmediato • Preparación inapropiada del paciente • Procedimiento de toma incorrecta • Recipiente inadecuado • Volumen incorrecto (en tubos con anticoagulantes) • Almacenamiento inadecuado • Interferentes • Transporte inadecuado en correo neumático • Tiempo prolongado desde toma de muestra • Jeringa de gases no sellada • Jeringa de gases con burbujas de aire Posterior a recepción • Hemólisis • Muestra coagulada • Muestra lipémica HEMÓLISIS: La hemólisis es la liberación de la hemoglobina después de la ruptura de los hematíes. Cuando se produce hemólisis, el suero o plasma adquieren un color entre rosa y rojo. Entre las causas de hemólisis se cuentan la anemia hemolítica, la enfermedad hepática y las reacciones postransfusionales. Otra causa es la manera como se ha extraído la muestra de sangre. En la punción venosa, por ejemplo, la hemólisis puede producirse: • • • • Si se utiliza una aguja demasiado fina Si se fuerza el paso de la sangre por la aguja hacia el tubo Si se agita el tubo con demasiada energía, en lugar de invertirse suavemente Si se extrae sangre de un hematoma MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 84 • Si se tira con demasiada fuerza del émbolo de la jeringa En los microtubos la hemólisis puede producirse: • • Si se dejan residuos de alcohol sobre la piel y se mezclan con la sangre de la muestra. Si se aprieta demasiado fuerte el talón o el dedo, lo que puede producir una ruptura de los hematíes. También puede producirse hemólisis posterior cuando se produce: • • • Permanencia larga de sangre total en un recipiente Contaminación de la sangre con detergentes, agua, reactivos residuales en tubos y cristalería Choque térmico (enfriamiento ó calentamiento excesivo) BURBUJAS DE AIRE Las burbujas de aire pueden alterar en gran medida el valor de la pO2, dependiendo de la cantidad y tamaño de las mismas; cuanto más pequeñas sean las burbujas, mayor será la superficie de contacto con la sangre, y más rápidamente se producirá la variación. Una vez obtenida una muestra deben eliminarse inmediatamente las posibles burbujas que haya en ella, y sellar herméticamente la jeringa con un tapón en el cono. (Hay que retirar la aguja y desecharla). Las muestras de gases en sangre deben ser anaerobias, por tanto, las que contengan burbujas se rechazarán. COÁGULOS Debe rechazarse cualquier muestra que contenga coágulos. Los coágulos tienden a formarse cuando se hace difícil realizar una punción y la sangre no se mezcla bien con la heparina o queda estancada en la aguja. RECOMENDACIONES PARA MANTENER "FRESCAS" LAS MUESTRAS: Las causas más importantes para las alteraciones de las muestras son: • • • • • • Metabolismo de las células sanguíneas. Evaporación. Reacciones químicas. Descomposición por factores microbiológicos. Efecto de la luz. Difusión de gases. Las principales recomendaciones para mantener óptimas las muestras serían: • El transporte rápido y los tiempos de almacenamiento cortos mejoran la fiabilidad de los resultados del laboratorio. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 85 • • Los especimenes y muestras se conservan mejor en refrigeración, con las excepciones a la regla. Los especimenes siempre deben guardarse en contenedores cerrados para evitar la evaporación. Reducir el contacto con el aire hasta donde sea posible. Si esto no se hace, los efectos de evaporación producirán un aumento en la concentración/actividad de todos los componentes no volátiles. Esto aplica particularmente para el caso cuando el volumen de la muestra es relativamente pequeño y el área de la superficie es relativamente grande. • Los agentes de separación (ejemplo, gel) mejoran el rendimiento del suero/plasma y permiten mantenerlos en los tubos originales. • Los contenedores de las muestras que contienen sangre deben mantenerse siempre verticales, el procedimiento de coagulación se acelera. • Evitar guardar sangre entera o total, revisar la información sobre los analitos sensibles. • Evitar la glucólisis en muestras para determinar glucosa y lactato. La glucólisis puede ser evitada utilizando tubos con fluoruro de sodio (tubo tapa gris). • Evitar el efecto de la luz, ésta afectará disminuyendo los valores de bilirrubina, vitamina C. porfirinas, creatincinasa (CK), y ácido fólico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 86 LISTA ALFABETICA DE EXAMENES DE LABORATORIO CON DETALLE DE INFORMACION TÉCNICA ÁCIDO LÁCTICO PLASMÁTICO Bioquímica USO DE LA PRUEBA : Los valores elevados son indicativos de hipoxia celular, se produce en patologías como alcoholismo, coma hepático, shock, hipernatremia, diabetes mellitus, neoplasias y peritonitis. Se ve disminuido en hiponatremia. RANGOS DE REFERENCIA : 4.5 – 19.8 mg/dL. (Adultos) METODO : Enzimático colorimétrico. : Debe tener reposo, por lo menos 30 minutos antes de la prueba. INSTRUCCIONES AL PACIENTE Evitar el ejercicio intenso el día antes de la prueba. Se requiere ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Tomar la muestra sin torniquete, indicar al paciente que no cierre y abra DE TOMA DE MUESTRAS la mano durante la toma de muestra. TIPO DE MUESTRA : Plasma TIPO DE TUBO : Plasma : Tapa gris de 2 ml. (anticoagulante fluoruro de sodio), lleno hasta la marca. VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : RECEPCION Y RECHAZO DE LA : MUESTRA ENTREGA RESULTADOS : LIMITACIONES : 2 mL. o el volumen que indique el tubo Los tubos se deben transportar sumergidos parcialmente en agua/hielo (sin sumergir la tapa del tubo), tapados, en posición vertical, en un recipiente y dentro de un contenedor sólido a prueba de derrames. Evitar la agitación para prevenir la hemólisis. Máximo 30 minutos desde tomada la muestra. La muestra se recibe en horario hábil de Lunes a Viernes hasta las 16 horas. Sólo se recibe en horario de turno en caso de pacientes pediátricos. La muestra será rechazada en los siguientes casos: - Tubo mal rotulado o nombre ilegible. - Tubo de muestra no transportado en condiciones adecuadas - Muestra hemolizada Lunes a Viernes dentro del día. En muestras pediátricas 1 hora despúes de recibida la muestra. La hemólisis invalida la prueba. Fármacos que interfieren: epinefrina (altas dosis), etanol, fructosa, glucosa, metilprednisolona, terbutalina provocan un aumento en la concentración de lactato. Azul de metileno, morfina provocan una disminución. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 87 ÁCIDO LÁCTICO LCR Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : Los valores elevados en LCR indican aumento de la utilización de glucosa y del metabolismo anaeróbico asociado con disminución de la oxigenación cerebral, aumento de la presión intracraneal, o ambas. Esta prueba es auxiliar en el diagnóstico de meningitis y en la identificación de trastornos del Sistema Nervioso Central. 0-25 mg/dL Enzimático colorimétrico. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Explicar al paciente, el procedimiento de extracción de muestra, los riesgos potenciales, beneficios y las actividades posteriores al procedimiento. No se requiere ayuno. Toma de muestra a cargo de un profesional médico. Preguntar si la prueba está disponible antes de tomar la muestra. TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO : : : Líquido céfalo raquídeo (LCR). Plasma : Tubo de vidrio 0.5 mL. ó el volumen que indique el tubo. CONDICIONES TRANSPORTE : Los tubos se deben transportar sumergidos parcialmente en agua/hielo (sin sumergir la tapa del tubo), tapados, en posición vertical, en un recipiente y dentro de un contenedor sólido a prueba de derrames. TIEMPO DE TRANSPORTE : RECEPCION Y RECHAZO DE LA : MUESTRA Máximo 30 minutos desde tomada la muestra. La muestra se recibe en horario hábil de Lunes a Viernes hasta las 16.00 horas. Sólo se recibe en horario de turno en caso de pacientes pediátricos. La muestra será rechazada en los siguientes casos: Tubo de muestra mal rotulado o nombre ilegible. LCR hemáticos con sobrenadante hemolizado. Condiciones de transporte no adecuados Lunes a Viernes dentro del día. En muestras pediátricas 1 hora despúes de recibida la muestra. La hemólisis invalida la prueba. Fármacos que interfieren: epinefrina (altas dosis), etanol, fructosa, glucosa, metilprednisolona, terbutalina provocan un aumento en la concentración de lactato. Azul de metileno, morfina provocan una disminución. ENTREGA RESULTADOS : LIMITACIONES : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 88 ÁCIDO ÚRICO PLASMÁTICO Bioquímica USO DE LA PRUEBA : Se utiliza para el diagnóstico y tratamiento de numerosos desórdenes renales y metabólicos, entre los que se incluyen gota, leucemia, psoriasis, falla renal, mieloma múltiple, linfoma, policitemia, toxemia de embarazo, entre otros. RANGOS DE REFERENCIA : 3.5 – 7.2 mg/dl (hombre) 2.6 - 6.0 mg/dl (mujer) 2.0 – 5.5 mg/dl (niño) METODO : Uricasa. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. Evitar el consumo de café y otros alimentos ricos en cafeína. INSTRUCCIONES AL PERSONAL : Ninguna recomendación especial. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : CONDICIONES DE RECEPCION : Y RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 mL para pacientes pediátricos, 2 a 4mL para pacientes adultos (tubo tapa roja), 3 mL (tubo tapa verde) para servicios de urgencia. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Hasta 4 horas desde la toma de muestra. Las muestras se reciben en horario hábil de Lunes a Viernes hasta las 16.00 horas. En caso de embarazadas con riesgo obstétrico se reciben las 24 horas. La muestra será rechazada en los siguientes casos. Tubo mal etiquetado o nombre ilegible. Muestra hemolizada Tubo de muestra quebrado Dentro del día Muestras lipémicas y muy hemolizadas invalidan la prueba. Fármacos que interfieren: Bloqueadores B-adrenérgicos, cisplatino, corticosteroides, furosemida, tiazidas, epinefrina, etanol, hidroxiurea, teofilina, cafeína producen un aumento del ácido úrico sérico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 89 ÁCIDO ÚRICO ORINA AISLADA Bioquímica USO DE LA PRUEBA : Se utiliza para valorar el origen hiper-uricosúrico de los cálculos urinarios. RANGOS DE REFERENCIA : 37 – 92 mg/dL METODO : Uricasa. INSTRUCCIONES AL PACIENTE : En caso que el paciente traiga la orina de su domicilio se le informa que ésta debe ser la primera orina de la mañana. Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Antes de la recolección de la orina se procede a un aseo con agua y jabón de la zona que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. En el caso de los hombres se le indica que retraiga el prepucio para lavar con agua y jabón la porción distal del pene que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición. Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, para evitar contaminación fecal. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL PERSONAL : Entregar las instrucciones por escrito al paciente ambulatorio. DE TOMA DE MUESTRAS Verifique la correcta rotulación de la muestra antes del envío al Laboratorio. TIPO DE MUESTRA : Orina. TIPO DE TUBO : Orina : Recipiente limpio, tubo de orina proporcionado por el Laboratorio o bolsa colectora (lactantes sin control de esfínter). VOLUMEN MINIMO : 1 mL. CONDICIONES TRANSPORTE : Los frascos o tubos se deben transportar en posición vertical, tapados, en un contenedor o gradilla a temperatura ambiente. Sellar adecuadamente los frascos para transporte en correo neumático. TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra. RECHAZO DE MUESTRA : Muestra mal rotulada o nombre ilegible ENTREGA RESULTADOS : Dentro del día LIMITACIONES : Medicamentos alteran el resultado: cafeína, aminofilina y vitamina C. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 90 ÀCIDO URICO URINARIO DE 24 HORAS Bioquímica USO DE LA PRUEBA : Se utiliza para valorar el origen hiper-uricosúrico de los cálculos urinarios. RANGOS DE REFERENCIA : 250 – 750 mg/24 horas METODO : Uricasa. INSTRUCCIONES AL PACIENTE : Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es muy importante que la recolección de la orina sea completa. Durante el período de recolección, el paciente debe beber líquidos en forma normal a menos que haya recibido otra indicación. No debe beber alcohol. Los pasos a seguir son los siguientes: • Orine a las 7:00 Hrs. de la mañana y elimine esta orina • Recoger, a partir de ese momento, en un recipiente limpio y seco, toda la orina que elimine a lo largo del día, la noche siguiente, incluyendo la primera orina de la mañana siguiente. • Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. La identificación debe contener el nombre y los dos apellidos del paciente escritos con letra legible. • Transportar la orina a la Unidad de Laboratorio Clínico. INSTRUCCIONES AL PERSONAL : Verifique la correcta rotulación de la muestra antes del envío al DE TOMA DE MUESTRAS Laboratorio. Si se envía una alícuota de la recolección, registrar volumen total en solicitud de examen. TIPO DE MUESTRA : Orina de 24 horas. TIPO DE TUBO : Orina : Recipientes limpios y secos. VOLUMEN MINIMO : Toda la orina recolectada en 24 horas o una alícuota de 10 mL. CONDICIONES TRANSPORTE : Temperatura ambiente. No usar correo neumático si se envía toda la recolección o alícuota en tubo de vidrio. TIEMPO DE TRANSPORTE : Máximo 4 horas desde el término de la recolección de la muestra. RECHAZO DE MUESTRA : Muestra mal rotulada o nombre ilegible Condiciones inadecuadas de transporte ENTREGA RESULTADOS : Dentro del día LIMITACIONES : Medicamentos alteran el resultado: cafeína, aminofilina y vitamina C. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 91 ACIDO VALPROICO, NIVELES DE Bioquímica USO DE LA PRUEBA : Droga utilizada como anticonvulsivo de amplio espectro, usado solo o en combinación con otros fármacos, para el tratamiento de crisis de ausencias. La detección de niveles es utilizada para el control y monitoreo del tratamiento de pacientes epilépticos. RANGOS DE REFERENCIA : 50 a 100 ug/mL. ( Rango terapéutico) METODO : Inmunoanálisis turbidimétrico potenciado con microparticulas homogéneas. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Tomar la muestra entre 0 y 30 minutos antes de la dosis. Indicar en la DE TOMA DE MUESTRAS orden hora de la última dosis de Ácido Valproico u otro medicamento. En intoxicaciones la toma de muestra es independiente del horario y la dosis. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : RECEPCION Y RECHAZO DE : MUESTRA ENTREGA RESULTADOS : LIMITACIONES : : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 mL para pacientes pediátricos, 2 a 8 mL para pacientes adultos (tubo tapa roja), 3 mL (tubo tapa verde) para servicios de urgencia. Temperatura ambiente. Hasta 4 horas desde la toma de muestra. Muestra se recibe de Lunes a Viernes hasta las 15.00 horas. La muestra será rechazada en los siguientes casos: - Muestra mal rotulada o nombre ilegible - Muestra hemolizada - tubo de muestra roto - Ingesta de dosis terapéutica previa al examen Dentro del día si muestra ha sido recibida en el laboratorio antes de las 15.00 horas. La hemólisis, lipemia e ictericia invalidan la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 92 ADENOSINDEAMINASA (ADA) Inmunología USO DE LA PRUEBA : La Adenosindeaminasa (ADA) es un marcador de actividad inmunitaria de los linfocitos T, sus niveles dependen tanto de las características del agente etiológico como de las características de la respuesta inmune del paciente. Niveles elevados de ADA se observan en líquido pleural de pacientes con pleuresía tuberculosa, también en pacientes con SIDA, sarcoidosis, algunos linfomas y enfermedades autoinmunes. En líquido cefalorraquídeo y en líquido ascítico valores ↑ son asociados con TBC. RANGOS DE REFERENCIA : METODO : Suero : > 21 U/L. Líquido Pleural : > 28 U/L. LCR : > 7.0 U/L. Colorimétrico de Guisti INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO : Evitar hemólisis de la muestra de sangre. : : : Sangre, Líquido Pleural, Líquido Ascítico, LCR, otros líquidos. Jeringa Heparinizada a Tubo estéril. 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE : : Temperatura ambiente. Enviar al laboratorio antes de 4 horas desde la toma de muestra. Muestras de sangre se reciben de lunes a viernes hasta las 15.30 horas. Muestras de líquidos se reciben las 24 horas Se rechazan muestras purulentas, con hemólisis, lipemia e ictericia 7 días hábiles. RECEPCION Y RECHAZO DE MUESTRA ENTREGA RESULTADOS : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 93 ALBÚMINA SÉRICA Bioquímica USO DE LA PRUEBA : Es una de las dos principales fracciones proteicas de la sangre. Su función es mantener la presión oncótica y el transporte de bilirrubina, ácidos grasos, hormonas y otras sustancias solubles en agua. Aumenta en artritis reumatoide, embarazo, neumonía, entre otras y disminuye en alcoholismo, enfermedad de crohn, glomerulonefritis, entre otras. RANGOS DE REFERENCIA : <4 años >4 y <14 años >14 y ≤60 años >60 años METODO : Verde de bromocresol. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. Consumir una dieta baja en grasas el día antes del examen. Evitar la aplicación prolongada de torniquete. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS 2.8 - 4.4 g/dL 3.8 - 5.4 g/dL 3.5 - 5.0 g/dL 3.4 - 4.8 g/dL TIPO DE MUESTRA TIPO DE TUBO : : Suero Suero VOLUMEN MINIMO : CONDICIONES TRANSPORTE : 2 mL para pacientes pediátricos, 4 mL para pacientes adultos (tubo tapa roja). Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Enviar al laboratorio antes de 4 horas desde la toma de muestra. Las muestras se reciben de lunes a viernes hasta las 16.00 horas. Las muestras se rechazarán en los siguientes casos: - Tubo de muestra mal rotulado o nombre ilegible - Tubo quebrado - muestras hemolizadas, lipémicas, ictéricas. Dentro del día Fármacos que interfieren: Progesterona ↑ albúmina. Alopurinol, clorpropamida, cisplatino, estrógenos, ibuprofeno, nitrofurantoína, anticonceptivos orales, fenitoina, prednisona, ácido valproico, fenilbutazona, producen ↓de la albúmina. RECEPCION Y RECHAZO DE : MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 94 ALBUMINA ORINA Y LCR Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : La albúmina es la principal proteína plasmática en cuanto a cantidad, significando normalmente más de la mitad de las proteínas totales. La albúmina se forma exclusivamente en el hígado y es una proteina de transporte y fijación de calcio, ácidos grasos, bilirrubina, hormonas, vitaminas y fármacos. Orina: hasta 30 mg/L LCR: hasta 350 mg/L Determinación cuantitativa de albúmina en suero, orina humana y LCR, mediante Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Orina LCR Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) : Tubo tapa lila (EDTA) Orina : Frasco o tubo estéril LCR : Tubo estéril 0,5 mL (tubo de 4mL) Temperatura ambiente. Enviar al laboratorio máximo 2 horas desde tomada la muestra. En el laboratorio refrigerar la muestra a 2-8 °C hasta por un máximo de 48 horas, en caso contrario congelar a -20 °C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles 1 día hábil. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 95 ALFA 1 ANTITRIPSINA AAT Inmunología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : La alfa 1 – antitripsina es un inhibidor de proteinasa que inhibe especialmente las serin-proteasas. Tanto el déficit hereditario de alfa 1 – antitripsina como valores elevados durante la reacción de fase aguda están asociados a síndromes específicos. Los estados de déficit de alfa 1 – antitripsina suelen tener causa genética. Las manifestaciones clínicas evidentes, suponen enfermedades hepáticas y pulmonares. Los valores elevados de alfa 1 – antitripsina no están causados por defectos genéticos pero, en la mayoría de los casos, se deben a una reacción de fase aguda ante una infección o inflamación. En este caso, las concentraciones se elevan hasta tres veces de la normalidad. También pueden darse valores elevados durante el embarazo y la siguiente ingestión de ACO. Normal : 82 – 275 mg/dL Determinación cuantitativa de alfa 1 – antitripsina por Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (suero), Sangre (Plasma) Sangre (suero) : Tubo tapa roja o amarilla Sangre (Plasma) VOLUMEN MINIMO CONDICIONES TRANSPORTE : RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : : Tubo tapa lila (EDTA) 0,5 mL (tubo de 4mL) Temperatura ambiente. Enviar al laboratorio máximo 2 horas desde la toma de muestra. Las muestras turbias y lipémicas que no puedan aclararse mediante centrifugación (10 min a 4.000 x g) no deben usarse. En el laboratorio refrigerar la muestra a 2-8 °C hasta por un máximo de 48 horas, en caso contrario congelar a -20 °C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 96 ALFAFETOPROTEINA (AFP) Inmunología USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : La alfafetoproteína se eleva en diferentes enfermedades malignas como hepatocarcinoma y en tumores de células germinales, elevaciones discretas se producen en otras neoplasias (pancreas, intestino y pulmón). Alfafetoproteina es de utilidad para diagnóstico de defecto de tubo neural en el feto. Adultos: 0 a 15.0 ng/mL. El ensayo ARCHITECT AFP es un inmunoanalisis de 2 pasos que utiliza tecnología de inmunoanálisis quimioluminiscente de micropartículas (CMIA) Ayuno de 8 horas antes de la prueba Evitar hemólisis y contaminación microbiana de la muestra. Suero Suero : Tubo tapa roja o amarilla 0,5 mL (tubo de 4mL) Temperatura ambiente. Preparar y etiquetar adecuadamente de acuerdo con las normas vigentes. Máximo 2 horas desde la toma de muestra CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) En el laboratorio refrigerar la muestra a 2-8 °C hasta por un máximo de 48 horas, en caso contrario congelar a -20 °C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. RECHAZO DE MUESTRAS ENTREGA RESULTADOS LIMITACIONES Muestras con hemólisis, lipemia e ictericia. 1 día hábil Muestras de pacientes con terapia de Anticuerpos Monoclonales pueden presentar falsos valores por interferencia con el método. La presencia de Anticuerpos Heterófilos puede interferir en la determinación. : : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 97 AMILASA EN SANGRE Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : INSTRUCCIONES PERSONAL DE TOMA MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : AL : DE VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : RECEPCION Y RECHAZO DE : MUESTRA ENTREGA RESULTADOS : LIMITACIONES : Su determinación es útil en el diagnóstico de pancreatitis aguda, elevándose sus niveles 2 horas después de inicio de ésta, alcanzando el máximo a las 24 horas y recuperando sus niveles normales 2 a 3 días después. Aumenta también en edemas, cáncer pancreático, pulmonar, cetoacidosis diabética, colecistitis aguda, embarazo ectópico, entre otras. Disminuye en absceso hepático, caquexia, cirrosis, colitis ulcerosa, deshidratación, daño renal, alcoholismo, fibrosis quística avanzada, toxemia del embarazo, entre otras. 25 – 125 U/L (adultos) Degradación de sustrato CNPG3. Ayuno de al menos 8 horas. No ingerir alcohol por lo menos 24 horas antes de la prueba. Evitar la hemólisis de la muestra. Suero Suero : Tubo tapa roja o amarilla Suero : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 mL para pacientes pediátricos ( tubo tapa roja), 2 a 4 mL para pacientes adultos (tubo tapa roja), 3 mL (tubo tapa verde) para servicios de urgencia. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Máximo 4 horas desde la obtención de la muestra. Las muestras se reciben las 24 horas del día. La muestra será rechazada en los siguientes casos: - Tubo de muestra mal rotulado o nombre ilegible. - Muestra hemolizada y lipémica. 2 Horas en caso de pacientes de servicios de urgencia. Dentro del día en pacientes hospitalizados. Fármacos que intefieren: alcohol, captopril, cimetidins, corticosteroies, estrógenos, furosemida, ibuprofeno, indometacina, ácido mefenámico, metildopa, nitrofurantoína, anticonceptivos orales, sulfonamidas, tetraciclina, ácido valproico, producen un aumento de la amilasa sérica. AMILASA URINARIA ORINA AISLADA Bioquímica USO DE LA PRUEBA : Su determinación es útil en el diagnóstico de pancreatitis aguda, se eleva varias horas después de indiciado el cuadro y permanece así entre 7 y 10 días después del inicio, debido a esto, es útil al proporcionar evidencia de pancreatitis, una vez que la amilasa sérica a regresado a sus valores normales. RANGOS DE REFERENCIA : 2- 34 U/L MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 98 METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : : TIPO DE TUBO VOLUMEN MINIMO : CONDICIONES TRANSPORTE : RECHAZO DE MUESTRA : ENTREGA RESULTADOS LIMITACIONES : : Degradación de sustrato CNPG3. En caso que el paciente traiga la orina de su domicilio se le informa que ésta debe ser la primera orina de la mañana. Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Antes de la recolección de la orina se procede a un aseo con agua y jabón de la zona que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. En el caso de los hombres se le indica que retraiga el prepucio para lavar con agua y jabón la porción distal del pene que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. Verifique la correcta rotulación de la muestra antes del envío al Laboratorio. Orina segundo chorro. Orina : Recipiente limpio, Tubo de orina proporcionado por el Laboratorio o bolsa colectora (lactantes sin control de esfínter). 5 mL Temperatura ambiente. Enviar al laboratorio máximo 4 horas desde la toma de muestra. La muestra será rechazada en los siguientes casos: - Tubo de muestra mal rotulado o nombre ilegible. - Signo de contaminación. Dentro del día hábil si la muestra se ha recibido antes de las 15.00 hrs El consumo de alcohol etílico, los anticonceptivos orales y algunos diuréticos podrían elevar falsamente los resultados de la prueba. La contaminación por fecas o fluido vaginal invalida la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 99 AMILASA URINARIA DE 24 HORAS Bioquímica USO DE LA PRUEBA : Su determinación es útil en el diagnóstico de pancreatitis aguda, se eleva varias horas después de indiciado el cuadro y permanece así entre 7 y 10 días después del inicio, debido a esto, es útil al proporcionar evidencia de pancreatitis, una vez que la amilasa sérica a regresado a sus valores normales. RANGOS DE REFERENCIA : 24 - 408 U/24 horas METODO : Degradación de sustrato CNPG3. INSTRUCCIONES AL PACIENTE : No ingerir alcohol por lo menos 24 horas antes de la prueba. Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Durante el período de recolección, el paciente debe beber líquidos en forma normal a menos que haya recibido otra indicación y no debe beber alcohol. Los pasos a seguir son los siguientes: • Orine a las 7:00 Hrs. de la mañana y elimine esta orina • Recoger, a partir de ese momento, en un recipiente limpio y seco, toda la orina que elimine a lo largo del día, la noche siguiente, incluyendo la primera orina de la mañana siguiente. • Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. La identificación debe contener el nombre y los dos apellidos del paciente escritos con letra legible. • Transportar la orina a la Unidad de Laboratorio Clínico. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de todos los envases antes del envío al DE TOMA DE MUESTRAS Laboratorio. Si el volumen de orina es medido en la Toma de Muestra, se debe anotar el valor en el formulario de solicitud de examen. TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Orina : Recipientes limpios y secos. VOLUMEN MINIMO : Toda la orina de 24 horas o una alícuota de 10 mL. CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : RECEPCION Y RECHAZO DE : MUESTRA ENTREGA RESULTADOS LIMITACIONES : : Tº ambiente. No utilizar correo neumático para transporte de la recolección completa de orina o alícuotas en tubo de vidrio. Máximo 4 horas desde el término de la recolección de la muestra. Muestras se reciben en horario hábil hasta las 16.00 hrs Rechazo en caso de muestras mal rotulada o nombre ilegible, recolección o condiciones de transporte inadecuadas. Dentro del día hábil si la muestra se ha recibido antes de las 15.00 hrs El consumo de alcohol etílico, los anticonceptivos orales y algunos diuréticos podrían elevar falsamente los resultados de la prueba. La contaminación por fecas o fluido vaginal invalida la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 100 AMONIO PLASMÁTICO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Se observa concentraciones elevadas de Amonio en insuficiencias hepáticas graves, como en el síndrome de Reye, la hepatitis vírica o la cirrosis. 31 – 123 µg/dl Determinación enzimático Se requiere ayuno. No fumar 8 a 10 horas antes de la prueba. Evitar el estrés y el ejercicio extenuante antes de la prueba. Recolectar la muestra SIN TORNIQUETE. Evitar la hemólisis de la muestra. No recolectar durante la hemodiálisis. Sangre (Plasma) Sangre (Plasma) : Tubo tapa lila (EDTA) VOLUMEN MINIMO : 2 mL. o el volumen que indique el tubo. CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : : Transportar sumergidos parcialmente en agua/hielo (sin sumergir la tapa del tubo), tapados, en posición vertical, en un recipiente y dentro de un contenedor sólido a prueba de derrames. Evitar la agitación para prevenir la hemólisis. Máximo 30 minutos desde la toma de la muestra. Las muestras serán rechazadas en caso de: Hemólisis Muestra no transportada en condiciones de T° óptima. Dentro del día en horario hábil RECHAZO DE MUESTRA ENTREGA RESULTADOS : LIMITACIONES : La hemólisis invalida la prueba. Fármacos que interfieren: sales de amonio, barbitúricos, furosemida, tiazidas, acetazolamida, etanol, ácido valproico, producen aumento del amonio en sangre. Kanamicina, lactulosa, levodopa, neomicina, cigarrillo, producen una disminución del amonio en sangre. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 101 ANTICUERPOS ANTI CARDIOLIPINAS (ACA) Inmunología USO DE LA PRUEBA : Sospecha o pesquisa de sindrome antifosfolípido primario o secundario en enfermedades autoinmunes. Trombofilia y aborto espontáneo en grupos de riesgo. RANGOS DE REFERENCIA : IgG <15 unidades IgA <12 unidades IgM <12 unidades METODO : ELISA INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Evitar hemólisis de la muestra de sangre. VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente. Transportar antes de 4 horas de tomada la muestra. RECHAZO DE MUESTRAS Tubo tapa amarilla roja o Se rechazan las muestras en caso de muestra lipémica o hemolizada. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS Sangre (suero) Sangre (suero) : 7 días hábiles. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 102 ANTICUERPOS ANTI CENTROMERO Inmunología USO PREFERENTE DE LA : La presencia de anticuerpos antinucleares puede ser utilizada en PRUEBA conjunción con otros tests serológicos y resultados clínicos para ayudar en el diagnóstico de Lupus Eritematoso Sistémico (LES) y otras enfermedades reumáticas o del tejido conectivo. Está generalmente aceptado que los substratos de líneas celulares son preferibles a las secciones de órganos ya que estas células de división rápida tienen niveles más elevados de ciertos antígenos relevantes desde el punto de vista clínico, incluyendo el centrómero, SS-A(Ro), Scl-70 y PCNA/Ciclina. RANGOS DE REFERENCIA : Negativo METODO : IFI (Ensayo por inmunofluorescencia indirecta) para el screening y la determinación semicuantitativa de anticuerpos centrómero en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Transportar antes de 4 horas de tomada la muestra. CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 103 ANTICUERPOS ANTI CITOPLASMA DE NEUTRÓFILOS (ANCA) Inmunología USO PREFERENTE DE LA : Los test de anticuerpos anticitoplasma del neutrófilo (ANCA) han PRUEBA revolucionado el diagnóstico y el tratamiento de las afecciones vasculares autoinmunes. Los autoanticuerpos pANCA y cANCA han demostrado ser muy útiles desde el punto de vista clínico y ciertamente interesantes desde el punto de vista científico a la hora de detectar enfermedades como la granulomatosis de Wegener (GW) y la glomerulonefritis crescéntica. El patrón perinuclear p-ANCA se encuentra en pacientes con vasculitis y glomerulonefritis, estos autoanticuerpos son dirigidos contra varios antígenos presentes en los gránulos azurófilos de los neutrófilos, siendo su antígeno blanco principal la Mieloperoxidasa (MPO). El patrón citoplasmático c-ANCA se debe a anticuerpos que reconocen a una proteína de ubicación lisosomal llamada Proteinasa 3. Se piensa que los c-ANCA participan en el mecanismo de la injuria, Granulomatosis de Weneger. RANGOS DE REFERENCIA : Negativo <20 Positivo Débil 21 – 30 Positivo de Moderado a Fuerte >30 METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección semi cuantitativa de autoanticuerpos IgG antimieloperoxidasa (MPO) y la detección semi cuantitativa de autoanticuerpos anti serinproteasa 3 (PR-3) en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Transportar antes de 4 horas de tomada la muestra. CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 104 ANTICUERPOS ANTI DNA Inmunología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Los anticuerpos anti-DNA de doble cadena sólo se dan prácticamente de forma exclusiva en pacientes con LES y se consideran como un anticuerpo indicador de esta enfermedad. La presencia de anticuerpos anti-DNA de doble cadena es un indicador importante del LES; sin embargo, la ausencia de estos anticuerpos no hace que se pueda descartar el LES en todos los casos. Los anticuerpos anti-DNA de doble cadena han sido incluidos en la Revisión de los Criterios de 1982 para la Clasificación de LES por un subcomité de la Asociación de Artritis y Reumatismo. Negativo 0-300 UI/mL Positivo Moderado 301-800 UI/mL Positivo Fuerte >801 UI/mL ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección semi cuantitativa de anticuerpos anti-ds DNA (ADN de doble cadena ) en suero humano Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA : RESULTADOS Tubo tapa amarilla roja o 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 105 ANTICUERPOS ANTI ENA Inmunología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Los anticuerpos de Antígenos Nucleares Extraíbles (ENA) pueden suministrar información importante en la diagnosis y prognosis a la hora de evaluar los pacientes que se sospecha que tienen ciertas enfermedades del tejido conectivo como el LES, la escleroderma, el síndrome de Sjogren o polimiositis. Las muestras que dan un resultado negativo en esta prueba de screening sensible pueden ser consideradas negativas para Sm, RNP, SS-A, SS-B, Scl70 y Jo-1. Negativo <20 Positivo Débil 20 – 39 Positivo Moderado 40 – 80 Positivo Fuerte >80 ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección semi cuantitativa de anticuerpos anti-Sm, anti-RNP, anti-SS-A (60kDa y 52kDa), anti-SS-B, anti-Scl-70 y anti-Jo-1 en suero humano Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA : RESULTADOS Tubo tapa amarilla roja o 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 106 ANTICUERPOS ANTI ESTREPTOLISINA O ASO Inmunología USO PREFERENTE DE LA : Las mediciones de la antiestreptolisina O respaldan el diagnóstico de PRUEBA enfermedades causadas por bacterias de la streptococcus (entre otras: fiebre reumática, escarlatina, amigdalitis, glomérulonefritis) y suministran información epidemiológica sobre estas enfermedades. Los streptococcus patógenos están relacionados con impétigo, infección de las vías urinarias, fiebre reumática, así como también, con enfermedades renales. RANGOS DE REFERENCIA : 0-200 UI METODO : Determinación cuantitativa de la antiestreptolisina O (ASL) por Inmuno nefelometría (BN ProSpec) INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) TIPO DE TUBO : Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) : Tubo tapa lila (EDTA) VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADOS : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo de 8 días entre 2 y 8 °C : 4 horas desde la toma de muestra. Se rechazan muestras lipémicas que no puedan aclararse mediante centrifugación (10 min a 4.000 x g) 1 día hábil : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 107 ANTICUERPOS ANTI GLIADINICOS IgG - IgA Inmunología USO PREFERENTE DE LA : La enfermedad celíaca y las enteropatías sensibles al gluten son PRUEBA afecciones crónicas cuya principal manifestación consiste en la inflamación y característico aplanamiento histológico de la mucosa que provoca un síndrome de mala absorción intestinal. La etiología precisa de la enfermedad sigue siendo desconocida, aunque está claro que la gliadina, o la fracción soluble en alcohol del gluten de trigo, es el agente tóxico. Inicialmente, se utilizaba una serie de múltiples biopsias intestinales para diagnosticar los trastornos celíacos y de tipos similares. Hoy en día, se han propuesto los tests serológicos para el muestreo de pacientes con evidencias de enteropatías sensibles al gluten, así como para controlar la adecuación de la dieta. Tanto los anticuerpos de la gliadina IgA como de la IgG son detectables en el suero de pacientes con enteropatías sensibles al gluten. Los anticuerpos de la gliadina IgG parecen ser marcadores más sensibles pero menos específicos de la enfermedad en comparación con los anticuerpos de la clase IgA. Los anticuerpos de la gliadina IgA son menos sensibles pero más específicos. RANGOS DE REFERENCIA : Negativo <20 Positivo Débil 20 – 30 De positivo moderado a Positivo Fuerte >30 METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección semi cuantitativa de anticuerpos gliadina IgG y la detección semi cuantitativa de anticuerpos gliadina IgA en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Llevar al laboratorio antes de 4 horas de tomada la muestra CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 108 ANTICUERPOS ANTI MITOCONDRIAL AMA Inmunología USO PREFERENTE DE LA : La presencia de anticuerpos antinucleares puede ser utilizada en PRUEBA conjunción con otros tests serológicos y resultados clínicos para ayudar en el diagnóstico de Lupus Eritematoso Sistémico (LES) y otras enfermedades reumáticas o del tejido conectivo Se suelen detectar altos niveles de AMA asociados a la cirrosis biliar primaria. Se pueden detectar bajas valoraciones de AMA en otros trastornos hepáticos como la hepatitis crónica activa y la cirrosis criptogénica. RANGOS DE REFERENCIA : Negativo METODO : IFI (ensayo por inmunofluorescencia indirecta) para el screening y la determinación semicuantitativa de anticuerpos antimitocondria (AMA), anti músculo liso (ASMA) y anticuerpos parietales gástricos (GPA), anti membrana basal (MB) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Llevar al laboratorio antes de 4 horas de tomada la muestra CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 109 ANTICUERPOS ANTI MUSCULO LISO ASMA Inmunología USO PREFERENTE DE LA : La presencia de anticuerpos antinucleares puede ser utilizada en PRUEBA conjunción con otros tests serológicos y resultados clínicos para ayudar en el diagnóstico de Lupus Eritematoso Sistémico (LES) y otras enfermedades reumáticas o del tejido conectivo Se encuentran niveles elevados de ASMA en el suero de un 70% de los pacientes con hepatitis crónica activa. Además, el 50% de estos pacientes son ANA positivos, mientras que un 25% presentan valoraciones de AMA bajas. Pueden observarse valoraciones de ASMA bajas en infecciones víricas, tumores malignos e individuos normales. RANGOS DE REFERENCIA : Negativo METODO : IFI (ensayo por inmunofluorescencia indirecta) para el screening y la determinación semicuantitativa de anticuerpos antimitocondria (AMA), anti músculo liso (ASMA) y anticuerpos parietales gástricos (GPA), anti membrana basal (MB) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Llevar al laboratorio antes de 4 horas de tomada la muestra CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días Hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 110 ANTICUERPOS ANTI NUCLEARES ANA Inmunología USO PREFERENTE DE LA : La presencia de anticuerpos antinucleares (ANA) puede ser utilizada en PRUEBA conjunción con otros tests serológicos y resultados clínicos para ayudar en el diagnóstico de Lupus Eritematoso Sistémico (LES) y otras enfermedades reumáticas o del tejido conectivo. Está generalmente aceptado que los substratos de líneas celulares son preferibles a las secciones de órganos ya que estas células de división rápida tienen niveles más elevados de ciertos antígenos relevantes desde el punto de vista clínico, incluyendo el centrómero, SS-A(Ro), Scl-70 y PCNA/Ciclina RANGOS DE REFERENCIA : Negativo METODO : IFI (Ensayo por inmunofluorescencia indirecta) para el screening y la determinación semicuantitativa de anticuerpos Antinucleares (ANA) en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Llevar al laboratorio antes de 4 horas de tomada la muestra CONDICIONES DE RECHAZO DE Se rechazan muestras lipémicas o hemolizadas. MUESTRAS No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso ALMACENAMIENTO contrario congelar a -20°C o a temperatura inferior. Una vez (uso exclusivo de laboratorio) descongeladas las muestras deben agitarse bien antes de utilizarse. TIEMPO ENTREGA : 7 días Hábiles RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 111 ANTICUERPOS ANTI PEROXIDASA TIROIDEA Anti-TPO Inmunología USO PREFERENTE DE LA : Los antiTPO se encuentran en la mayoría de los casos de tiroiditis de PRUEBA Hashimoto, mixedema primario, y enfermedad de Graves Basedow. Se ha demostrado que el antiTPO aparece en la mayoría de los casos de tiroiditis postparto y que la presencia de autoanticuerpos al principio del embarazo estaba asociada a un alto riesgo de hipotiroidismo postparto asintomático. RANGOS DE REFERENCIA : Normal : 0 – 12 UI/mL METODO : Inmunoanalisis quimioluminiscente de microparticulas (CMIA) para determinación cuantitativa de autoanticuerpos IgG antiperoxidasa tiroidea en suero. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA : RESULTADOS 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 2 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 112 ANTICUERPOS ANTIPLAQUETARIOS AAP Inmunología USO PREFERENTE DE LA : Para diagnóstico de Púrpura Trombocitopenia idiopático (PTI) y Púrpura PRUEBA Trombocitopénico Autoinmune neonatal RANGOS DE REFERENCIA : Negativo METODO : Platelets Inmmunofixacion fluorescense test ( PFIST) INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADOS : : 2 mL. Temperatura ambiente. : 4 horas desde la toma de muestra. Muestras con hemólisis, lipemia e ictericia invalidan la prueba. : 15 días hábiles ANTICUERPOS ANTI TIROGLOBULINA Anti-Tg Inmunología USO PREFERENTE DE LA : Los anticuerpos antitiroglobulina están asociados a casos de PRUEBA hipotiroidismo o hipertiroidismo moderado y se encuentran con frecuencia en pacientes con otras enfermedades autoinmunitarias, tales como artritis reumatoide, anemia perniciosa y diabetes tipo I. El anti-Tg se detecta en el 30-60% de los casos de pacientes con carcinoma tiroideo. RANGOS DE REFERENCIA : Normal : 0 – 34 UI/mL METODO : Inmunoanalisis quimiluminiscente de microparticulas (CMIA) para la determinación cuantitativa de autoanticuerpos IgG antitiroglobulina en suero. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 2 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 113 ANTICUERPOS ANTI TRANSGLUTAMINASA IgA Inmunología USO PREFERENTE DE LA : La presencia de anticuerpos anti-h-tTG IgA puede ser utilizada en PRUEBA conjunción con hallazgos clínicos y otras pruebas de laboratorio como ayuda en el diagnóstico de ciertas enteropatías sensibles al gluten, como la enfermedad celíaca y la dermatitis herpetiforme. RANGOS DE REFERENCIA : Negativo 0-30 Ui METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección semi cuantitativa de anticuerpos IgA antitransglutaminasa del endomisio en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA : RESULTADOS 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 7 días Hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 114 ANTIGENO CA-125 (CA-125) Inmunología USO PREFERENTE DE LA : Las concentraciones de CA 125 en suero son útiles en la monitorización de PRUEBA la enfermedad en pacientes con cáncer ovárico epitelial invasivo. Si bien la obtención de valores de CA 125 en persistente aumento se puede asociar a enfermedades malignas y a una respuesta pobre a la terapia, los valores en descenso pueden indicar una respuesta favorable a la terapia. RANGOS DE REFERENCIA : Normal : 0 – 35 UI/mL METODO : Inmunoanalisis quimioluminiscente de microparticulas para la determinacion cuantitativa de CA 125 en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA : RESULTADOS 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 115 ANTIGENO CA 19-9 (CA 19-9) Inmunología USO PREFERENTE DE LA : Se trata de un oligosacárido que en el adulto sano están presentes en la PRUEBA próstata, glándulas bronquiales y salivares normales. También se encuentra presente en el meconio, por lo que se le considera como antígeno oncofetal. Se puede detectar por medio de anticuerpos monoclonales. Su interés clínico reside en la monitorización del postoperatorio de cáncer colorrectal y pancreático y, en general, de carcinomas digestivos. Es menos sensible que el CEA, pero más específico. RANGOS DE REFERENCIA : Normal : < 37 UI/mL METODO : Inmunoensayo de Microparticulas Quimioluminiscentes (CMIA), para la determinación cuantitativa de CA 19-9 en suero humano. INSTRUCCIONES AL PACIENTE : No require ayuno INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA RESULTADOS : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2 - 8°C. por un máximo de 7 días, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse suavemente antes de utilizarse. Evitar múltiples ciclos de congelar/descongelar. 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 116 ANTIGENO CARCINO EMBRIONARIO CEA Inmunología USO DE LA PRUEBA : El análisis de CEA puede ser determinante en la monitorización de pacientes con tumores malignos diagnosticados, en los cuales se observan concentraciones variables de CEA. Un aumento persistente del CEA circulante tras el tratamiento es altamente indicativo de la presencia de metástasis ocultas o enfermedad residual. Un valor de CEA que aumenta persistentemente puede estar asociado con una afección maligna en progresión y una mala respuesta al tratamiento. Un valor de CEA en disminución es generalmente indicativo de un pronóstico favorable y de una buena respuesta al tratamiento. Los pacientes que tienen concentraciones bajas de CEA antes del tratamiento pueden mostrar elevaciones. RANGOS DE REFERENCIA : Normal : 0 – 3 ng/mL METODO : Inmunoanálisi quimioluminiscente de micropartículas (CMIA) para la determinación cuantitativa del antígeno carcinoembrionario (CEA) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra. RECHAZO DE MUESTRAS Tubo tapa roja o amarilla Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : : 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 117 ANTIGENO PROSTATICO ESPECIFICO FRACCION LIBRE (PSA LIBRE) Inmunología USO DE LA PRUEBA : Se utiliza en hombres adultos que presenten valores de PSA total entre 4 ng/ml y 10 ng/ml con clínica negativa. La proporción de PSA libre se puede utilizar como ayuda para distinguir entre un cáncer de próstata y otra enfermedad. El PSA libre SOLO se procesará si el resultado del PSA total se encuentra entre 4 ng/ml y 10 ng/ml. RANGOS DE REFERENCIA : Normal : > 0,19 de razón PSA METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la determinación cuantitativa de antígeno prostático específico (PSA) libre en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra. RECHAZO DE MUESTRAS Tubo tapa roja o amarilla Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : : 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 118 ANTIGENO PROSTATICO ESPECIFICO – TOTAL (PSA TOTAL) Inmunología USO DE LA PRUEBA : Principalmente se utiliza en la detección del cáncer de próstata utilizado junto con el tacto rectal en hombres mayores de 50 años. Además como método auxiliar en el tratamiento de pacientes con cáncer de próstata RANGOS DE REFERENCIA : 0 – 4 ng/mL METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la determinación cuantitativa de PSA total (tanto PSA libre como PSA ligado a alfa-1-antiquimiotripsina) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas.. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : RECHAZO DE MUESTRAS CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra. Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil BACILOSCOPIA Y CULTIVO DE KOCH CONTENIDO GASTRICO TBC USO PREFERENTE PRUEBA : Diagnóstico en pacientes sintomáticos RANGOS DE REFERENCIA : Negativo CANTIDAD DE MUESTRA : 2 muestras seriadas INSTRUCCIONES AL PACIENTE : PROCEDIMIENTO : TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : : : CONDICIONES DE RECEPCION : Y RECHAZO DE MUESTRA ENTREGA RESULTADOS : LIMITACIONES : Ayuna 12 horas, en lactantes se hará en momentos previo a su ingestión de leche. Técnica: Sondeo gástrico con sonda nasal o bucal adecuado y aspiración con jeringa. CONTENIDO GASTRICO Tubo estéril 2-10 ml Precaución ante derrames. La muestra debe ser procesada inmediatamente por lo tanto una vez obtenida, debe ser enviada inmediatamente al Laboratorio. Muestras se reciben de lunes a viernes en horario hábil. Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis”, ver anexo Nº 3. 2 días hábiles Baciloscopía 30 a 60 días cultivo de koch Contaminación de la muestra MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 119 BACILOSCOPIA Y CULTIVO DE KOCH EXPECTORACION TBC USO DE LA PRUEBA : Diagnóstico en pacientes sintomáticos y control de tratamiento RANGOS DE REFERENCIA : Negativo CANTIDAD DE MUESTRAS : Para diagnóstico en pacientes sintomáticos; dos muestras (una inmediata y la otra matinal en ayuna). Para control de tratamiento: una muestra mensual, la primera muestra de control debe ser enviada al mes de iniciado el tratamiento. INSTRUCCIONES AL PACIENTE : Instruir al paciente que produzca el esputo bronquial de las profundidades del pecho. “Inspirar profundamente, retener un momento la respiración y toser fuertemente para tomar la muestra”. Recalcar al paciente que las muestras deben ser matinales Informar al paciente que debe depositar dos o tres esputos recogidos, directamente en el envase, cuidando que no se derrame en las manos, ni se escurra por las paredes exteriores del envase. INSTRUCCIONES AL PERSONAL : Rotular la base del envase con el nombre completo del paciente y DE TOMA DE MUESTRAS procedencia al momento de la entrega. TIPO DE MUESTRA : EXPECTORACION TIPO DE TUBO : Contenedor negro de boca ancha y cierre hermético. Capacidad 30 a 50 ml VOLUMEN MINIMO : 2- 10 ml CONDICIONES TRANSPORTE : Transportar envase en caja sellada con nombre, apellidos, tipo de muestra, procedencia y fecha. La solicitud de examen debe venir fuera de la caja y NO envolviendo las muestras. Proteger de calor excesivo y de luz solar durante traslado. TIEMPO DE TRANSPORTE : No dejar transcurrir más de 7 días entre la recolección y procesamiento de la muestra, conservándola siempre en refrigerador protegido de la luz. CONDICIONES DE RECEPCION : Muestras se reciben de lunes a viernes en horario hábil. Y RECHAZO DE MUESTRA Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis”, ver anexo Nº 3. ENTREGA RESULTADOS : 2 días hábiles Baciloscopía 30 a 60 días cultivo de koch LIMITACIONES : Contaminación de la muestra MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 120 BACILOSCOPIA Y CULTIVO DE KOCH LIQUIDOS TBC USO PREFERENTE DE LA : Diagnóstico en pacientes sintomáticos PRUEBA RANGOS DE REFERENCIA : Negativo CANTIDAD DE MUESTRA : La obtención de material esta reservado al personal Médico. Cantidad y momento de recolección: 1 ml. cuando el Médico tratante crea conveniente. INSTRUCCIONES AL PACIENTE : PROCEDIMIENTO : TIPO DE MUESTRA : LCR, LIQUIDO PLEURAL, ASCITICO, ARTICULAR LAVADO BRONCOALVEOLAR TIPO DE TUBO : Tubo estéril VOLUMEN MINIMO : 1 ml CONDICIONES DE : Precaución ante derrames. TRANSPORTE TIEMPO DE TRANSPORTE : La muestra debe ser procesada inmediatamente por lo tanto una vez obtenida, debe ser enviada inmediatamente al Laboratorio. CONDICIONES DE RECEPCION : Muestras se reciben de lunes a viernes en horario hábil. Y RECHAZO DE MUESTRA Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis”, ver anexo Nº 3. TIEMPO ENTREGA : 2 días hábiles Baciloscopía RESULTADOS 30 a 60 días cultivo de koch LIMITACIONES : Contaminación de la muestra BACILOSCOPIA Y CULTIVO DE KOCH ORINA TBC USO PREFERENTE DE LA : Diagnóstico en pacientes sintomáticos y control de tratamiento PRUEBA RANGOS DE REFERENCIA : Negativo CANTIDAD DE MUESTRAS : Para diagnóstico en pacientes sintomáticos; seis muestras días seguidos Para control de tratamiento: 3 muestras en días seguidos, en forma mensual mientras dure el tratamiento. INSTRUCCIONES AL PACIENTE : Debe recogerse la primera orina de la mañana, orina de segundo chorro. Previo aseo genital con agua. INSTRUCCIONES AL PERSONAL : Entregar frascos de orina estéril rotulados con el nombre completo del DE TOMA DE MUESTRAS paciente y procedencia al momento de la entrega. TIPO DE MUESTRA : ORINA TIPO DE TUBO : Frasco orina estéril con tapa. Capacidad 200 ml VOLUMEN MINIMO : 100-200 ml CONDICIONES DE : Precaución ante derrames. TRANSPORTE TIEMPO DE TRANSPORTE : La muestra debe ser procesada inmediatamente por lo tanto una vez obtenida, debe ser enviada inmediatamente al Laboratorio. CONDICIONES DE RECEPCION : Muestras se reciben de lunes a viernes en horario hábil. Y RECHAZO DE MUESTRA Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis”, ver anexo Nº 3. TIEMPO ENTREGA : 2 días hábiles Baciloscopía RESULTADOS 30 a 60 días cultivo de koch LIMITACIONES : Contaminación de la muestra MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 121 BACILOSCOPIA Y CULTIVO DE KOCH TEJIDOS (ganglio, biopsia de diferentes tejidos) TBC USO PREFERENTE DE LA : Diagnóstico en pacientes sintomáticos PRUEBA RANGOS DE REFERENCIA : Negativo PROCEDIMIENTO : Colocar un trozo de muestra en un tubo estéril, con agua destilada. No mezclar con ningún tipo de preservante, en caso de ser posible pueden también obtenerse muestras mediante aspiración por jeringas y transportarlas en forma rápida al laboratorio. TIPO DE MUESTRA : TEJIDOS TIPO DE TUBO : Tubo estéril VOLUMEN MINIMO : 1 ml CONDICIONES DE : Precaución ante derrames. TRANSPORTE TIEMPO DE TRANSPORTE : La muestra debe ser procesada inmediatamente por lo tanto una vez obtenida, debe ser enviada inmediatamente al Laboratorio. CONDICIONES DE RECEPCION : Muestras se reciben de lunes a viernes en horario hábil. Y RECHAZO DE MUESTRA Todas estas muestras deben venir acompañadas del formulario "Solicitud de Examen Bacteriológico de la Tuberculosis”, ver anexo Nº 3. TIEMPO ENTREGA : 2 días hábiles Baciloscopía RESULTADOS 30 a 60 días cultivo de koch LIMITACIONES : Contaminación de la muestra MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 122 BETA HCG, HORMONA GONADOTROFINA CORIONICA Bioquímica USO DE LA PRUEBA : La detección de la β-hCG se utiliza para la confirmación de embarazos, seguimientos de embarazos anormales (intrauterinos o ectópicos) con mediciones seriadas cuantitativas de β-hCG. Niveles relativamente bajos se asocian a embarazos intrauterinos anormales. Niveles elevados de βhCG se encuentran en Mola Hidatiforme y casos de Cario carcinoma. RANGOS DE REFERENCIA : Adultos: < 5 mIU/mL. METODO : Inmunoensayo de Micropartículas Quimiluminiscentes INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Ayuno de 8 horas. Evitar hemólisis de la muestra. TIPO DE MUESTRA TIPO DE TUBO : : Suero Suero VOLUMEN MINIMO : 2 mL para pacientes pediátricos, 2 a 4mL para pacientes adultos. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente Hasta 4 horas desde la toma de muestra. CONDICIONES DE RECEPCION : Y RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : Tubo tapa roja o amarilla Se reciben las muestras provenientes de servicio urgencia obstétrico, muestras en que se utiliza como marcador tumoral y descarte de embarazo antes de un procedimiento o terapia específico. La muestra será rechazada en los siguientes casos: - Muestra hemolizada, lipémica o ictérica - Condiciones de transporte inadecuado - Diagnóstico rutinario de embarazo 1 día hábil La hemólisis, lipemia e ictericia invalidan la prueba. Muestras de pacientes con terapia de Anticuerpos Monoclonales pueden presentar falsos valores por interferencia con el método. La presencia de Anticuerpos Heterófilos puede interferir en la determinación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 123 BETA 2 MICROGLOBULINA Inmunología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Se produce incremento de concentración sérica de β2 – microglobulina, debido a un aumento de la actividad del sistema inmune, infecciones o enfermedades reumáticas, muerte celular o una menor eliminación de los desechos por daño renal. La concentración sérica de β2 – microglobulina es por tanto, un marcador sensible de la capacidad de filtración glomerular de los riñones, sobretodo en niños. 1 – 3 mg/L Determinación cuantitativa de β2 – microglobulina en suero por Inmuno nefelometría (BN ProSpec) Ayuno de 8 horas. Evitar hemólisis de la muestra de sangre. TIPO DE MUESTRA : TIPO DE TUBO : Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) : Tubo tapa lila (EDTA) VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente. 4 horas desde la toma de muestra. RECHAZO DE MUESTRAS ENTREGA RESULTADOS : Rechazar muestras turbias y lipémicas 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 124 BILIRRUBINA TOTAL Y DIRECTA Bioquímica USO DE LA PRUEBA : Evaluación, clasificación y seguimiento de las ictericias tanto del adulto como neonatales. La hiperbilirrubinemia se clasifica como conjugada y no conjugada. La conjugada es hepática, colestásica, cirrosis biliar primaria, hepatitis, ictericia familiar y la post hepática, por obstrucción biliar por cálculos, cáncer o malformaciones de la vía biliar. La hiperbilirrubinemia no conjugada se clasifica en prehepática (estados hemolíticos y hematomas extensos) y la hepática (síndrome de Gilbert y Crigler-Najjar e ictericia neonatal). RANGOS DE REFERENCIA : Adultos Bilirrubina total: 0.20- 1. 2 mg/dl. Bilirrubina directa: 0.1 – 0.5mg/dL METODO : Bilirrubina total: Método de sal diazónica. Bilirrubina directa: Diazo Reacción. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. Evitar el consumo de alimentos amarillos (zapallo, zanahoria) tres días antes del examen. INSTRUCCIONES AL PERSONAL : Para la toma de muestra en tubos, evitar el uso prolongado del torniquete DE TOMA DE MUESTRAS y la hemólisis de la muestra. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : 2 mL para pacientes pediátricos, 2 a 4mL para pacientes adultos CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Proteger la muestra de la luz. 4 horas desde la toma de muestra. RECHAZO DE MUESTRA : La muestras hemolizadas y lipémicas serán rechazadas ENTREGA RESULTADOS : LIMITACIONES : 2 horas para pacientes de los servicios de urgencia y dentro del día para pacientes hospitalizados y ambulatorios. Medicamentos que alteran el resultado: ácido ascórbico, ácido acetilsalicílico, clorpromazina, eritromicina entre otros. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 125 BORDETELLA PERTUSSIS IgG - IgA Inmunología USO DE LA PRUEBA : La bordetella pertussis pertenece al género de la bordetella, se trata de un pequeño bacilo cocoide gramnegativo. La bordetella pertussis es la causante de la tos ferina, una enfermedad infecciosa extendida por todo el mundo y que se transmite entre las personas mediante infección por gotitas diminutas. Principalmente afecta a niños en edades comprendidas entre 0-4 años y en los lactantes presenta un alto grado de mortalidad (60 % de los fallecimientos se producen en el primer año de vida). RANGOS DE REFERENCIA : Negativa METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la determinación cualitativa y semicuantitativa de anticuerpos IgG e IgA en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Evitar hemólisis de la muestra de sangre. TIPO DE MUESTRA TIPO DE TUBO : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra RECHAZO DE MUESTRAS Tubo tapa roja o amarilla Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : : 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 126 BRUCELLA, ANTICUERPOS IgM –IgG Inmunología USO DE LA PRUEBA : El genero Brucella sp., es una infección ocurrida en humanos que manifiesta con lesiones de piel y mucosas. La enfermedad comienza con fatiga, insomnio, angina, dolor reumaticos, dolor de cabeza, bronquitis y gastritis. RANGOS DE REFERENCIA : Negativo METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la determinación cualitativa y semicuantitativa de anticuerpos IgG e IgM de Brucella en suero humano. INSTRUCCIONES AL PACIENTE : No requiere ayunas INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : Evitar hemólisis de la muestra de sangre. TIPO DE TUBO : Sangre (Suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Llevar al laboratorio antes de 4 horas de tomada la muestra RECHAZO DE MUESTRAS : Tubo tapa roja o amarilla Se rechazan muestras lipémicas o hemolizadas. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO DE RESPUESTA Sangre (Suero) : 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 127 CALCIO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Hay hipercalcemia debida a tumores malignos e hiperparatiroidismo primario y hay hipocalcemia por insuficiencia renal, hipoparatiroidismo, deficiencia de vitamina D e hiperparatiroidismo secundario. <10 días 7.6 - 10.4 mg/dL ≥10 días <2 años 9.0 – 11.0 mg/dL ≥2 y <12 años 8.8 – 10.8 mg/dL ≥12 años 8.4 – 10.2 mg/dL o-Cresolftaleína complexona. Ayuno de al menos 8 horas. No obtener la muestra durante la hemodiálisis. Evitar el uso prolongado del torniquete. TIPO DE MUESTRA TIPO DE TUBO Suero Suero : Suero : : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : Tubo tapa roja o amarilla Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 mL para pacientes pediátricos, 4 mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 4 horas desde la toma de muestra. RECEPCION Y RECHAZO DE : MUESTRA Recepción las 24 horas del día La muestra será rechazada en caso de hemólisis o lipemia ENTREGA RESULTADOS : LIMITACIONES : 2 horas para muestras provenientes de servicios de urgencia y dentro del día para muestras de hospitalizados o ambulatorios. Fármacos que interfieren: antiácidos alcalinos, andrógenos, sales de calcio, furosemida, tiazidas, litio, progesterona, PTH, tamoxifeno, vitamina D y A, aumentan el calcio en sangre. Albuterol, gentamicina, calcitonina, Carbamazepina, corticosteroides furosemida, estrógenos (pacientes post menopaúsicas), glucosa, insulina, sales de magnesio, fenitoina, tetraciclina disminuyen el calcio sérico. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 128 CALCIO IONICO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO : : : : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA : ENTREGA RESULTADOS : LIMITACIONES : : : : Entre el 40 y 50% del calcio total corresponde a calcio iónico, que es la fracción fisiológicamente activa participando en diferentes procesos como transmisión del impulso nervioso, proceso de coagulación, cofactor enzimático y partícipe en la contractilidad muscular. Se puede ver aumentado en procesos patológicos relacionados con alteraciones de PH, tumores secretores de PTH, hipertiroidismo, reposo prolongado y disminuye en hipoparatiroidismo primario, hipernatremia, deficiencia de vitamina D, hemólisis. 4.36 – 5.2 mg/dl Potenciometría con electrodo ión selectivo (CCX de Nova biomedical ) El ayuno no es indispensable. Tomar la muestra evitando el torniquete para prevenir la hemólisis. En caso contrario el torniquete no se realizará por más de 2 minutos. Sangre heparinizada Sangre : Jeringa de 1 ml con heparina de litio Se requiere un volumen mínimo de 0.6 ml de sangre heparinizada y agitada suavemente, inmediatamente de tomada la muestra. Mantener la muestra en bolsa con hielo/agua fría con la jeringa debidamente sellada con tapón de goma adecuado. Debe ser transportada inmediatamente al laboratorio y ser procesada antes de 30 minutos o ser conservada hasta 4 hrs. si es mantenida a 4ªC. La muestra se rechazará en los siguientes casos: - Condiciones de Tª de transporte no adecuados. - Muestra coagulada o con burbujas de aire - Volumen de muestra insuficiente. Pabellón y servicios críticos en 30 minutos. Hospitalizados dentro de 2 horas. Sustancias interferentes: litio e hidroclorotiazida aumentan el calcio iónico así como déficit de vitamina D, anticonvulsivantes.furosemida y heparina lo disminuyen. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 129 CALCIO URINARIO MUESTRA AISLADA Bioquímica USO PREFERENTE DE LA : Hay hipercalcemia debida a tumores malignos e hiperparatiroidismo PRUEBA primario y hay hipocalcemia por insuficiencia renal, hipoparatiroidismo, deficiencia de vitamina D e hiperparatiroidismo secundario. RANGOS DE REFERENCIA : 6.8 – 21.3 mg/dL METODO : o-Cresolftaleína complexona INSTRUCCIONES AL PERSONAL : En caso que el paciente traiga la orina de su domicilio se le informa que DE TOMA DE MUESTRAS ésta debe ser la primera orina de la mañana. Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Antes de la recolección de la orina se procede a un aseo con agua y jabón de la zona que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. En el caso de los hombres se le indica que retraiga el prepucio para lavar con agua y jabón la porción distal del pene que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL PERSONAL : Verifique la correcta rotulación de la muestra antes del envío al DE TOMA DE MUESTRAS Laboratorio. TIPO DE MUESTRA : Orina segundo chorro. TIPO DE TUBO : Orina : Tubo ensayo estéril o frasco recolector de orina nuevo VOLUMEN MINIMO : 5 mL CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra. CONDICIONES DE RECHAZO DE : Las muestras se rechazarán en caso de MUESTRA Contenedor reciclado Traslado inadecuado TIEMPO ENTREGA : Dentro del día RESULTADOS LIMITACIONES : Uso de otro tubo u otro contenedor USADO invalida la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 130 CALCIO URINARIO DE 24 HORAS Bioquímica USO PREFERENTE DE LA : Hay hipercalemia debida a tumores malignos e hiperparatiroidismo PRUEBA primario y hay hipocalcemia por insuficiencia renal, hipoparatiroidismo, deficiencia de vitamina D e hiperparatiroidismo secundario. RANGOS DE REFERENCIA : 100 – 300 mg/24 horas METODO : o-Cresolftaleína complexona INSTRUCCIONES AL PACIENTE : Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Durante el período de recolección, el paciente debe beber líquidos en forma normal a menos que haya recibido otra indicación y no debe beber alcohol. Los pasos a seguir son los siguientes: • Orine a las 7:00 Hrs. de la mañana y elimine esta orina • Recoger, a partir de ese momento, en un recipiente limpio y seco, toda la orina que elimine a lo largo del día, la noche siguiente, incluyendo la primera orina de la mañana siguiente. • Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. La identificación debe contener el nombre y los dos apellidos del paciente escritos con letra legible. • Transportar la orina a la Unidad de Laboratorio Clínico. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de todos los recipientes antes de enviar la DE TOMA DE MUESTRAS muestra al laboratorio. Si el volumen de orina es medido en la Toma de Muestra, se debe anotar el valor en el formulario de solicitud de examen. TIPO DE MUESTRA : Orina de 24 horas. TIPO DE TUBO : Orina : Recipientes limpios y secos, proporcionados por el Laboratorio. VOLUMEN MINIMO : Toda la orina recolectada en 24 horas o una alícuota de 10 mL. CONDICIONES DE : Temperatura ambiente. Guardar la muestra refrigerada hasta que termine TRANSPORTE la prueba. TIEMPO DE TRANSPORTE : Máximo 4 horas desde el término de la recolección de la muestra. Guardar la muestra refrigerada hasta que termine la prueba. CONDICIONES DE RECHAZO DE : Las muestra serán rechazadas en los siguientes casos: MUESTRA - Muestra mal etiquetada o nombre ilegible - ordenes de examen o recipientes empapados en orina TIEMPO ENTREGA : Dentro del día RESULTADOS LIMITACIONES : El uso de recipientes no adecuados, es decir, no entregados por el Laboratorio, invalida la prueba por posible contaminación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 131 CARBAMAZEPINA, NIVELES DE Bioquímica USO PREFERENTE DE LA : Droga utilizada como antiepiléptico y para el tratamiento de la neuralgia PRUEBA del trigémino, la detección de niveles es utilizada para el control y monitoreo del tratamiento de pacientes epilépticos. RANGOS DE REFERENCIA : Adultos: 4 a 12 µg/ml. METODO : Enzimo-inmunoensayo por competición INSTRUCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Tomar la muestra entre 0 y 30 minutos antes de la dosis. Indicar en la DE TOMA DE MUESTRAS orden la hora de la última dosis de Carbamazepina o de otros medicamentos. En intoxicaciones la toma de muestra es independiente del horario y la dosis. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. CONDICIONES DE : Temperatura ambiente TRANSPORTE TIEMPO DE TRANSPORTE : Hasta 4 horas desde la toma de muestra. CONDICIONES DE RECHAZO DE : La muestra será rechazada en caso de hemólisis o lipemia MUESTRA TIEMPO ENTREGA : 1 día hábil RESULTADOS LIMITACIONES : Ingesta de dosis terapéutica previa al examen invalida la prueba. CHLAMYDIA PNEUMONIAE AC IgM Inmunología USO PREFERENTE DE LA : Chlamydia pneumoniae, agente infeccioso que presenta una variedad de PRUEBA manifestaciones clínicas del tracto respiratorio superior e inferior, como faringitis, sinusitis, bronquitis aguda y neumonía. RANGOS DE REFERENCIA : Negativa METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la determinación cualitativa y semicuantitativa de anticuerpos IgM específicos para Chlamydia pneumoniae INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente. Máximo 4 horas desde el término de la recolección de la muestra. Guardar la muestra refrigerada hasta que termine la prueba. Las muestras serán rechazadas en caso de lipemia o hemólisis. CONDICIONES DE RECHAZO DE : MUESTRA ENTREGA RESULTADOS : Dentro del día MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 132 CISTICERCOSIS Inmunología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : Sospecha Cistercosis (infección Tenia spp.) : : : : Negativo ELISA Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre y LCR. : : Suero y LCR (Neurocisticercosis) Suero : Tubo tapa roja o amarilla LCR VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADOS LIMITACIONES : Tubo Esteril : : Suero : 0,5 mL LCR : 0,2 mL Temperatura ambiente. : : 4 horas desde la toma de muestra 7 días hábiles : Con hemólisis, lipemia e ictericia invalidan la prueba. CITOMEGALOVIRUS IgG – IgM Inmunología USO PREFERENTE DE LA : La infección por CMV es generalmente leve y asintomática; sin embargo, PRUEBA en las mujeres embarazadas, en los recién nacidos y en los individuos inmunodeficientes, esta infección puede desarrollar una enfermedad de importancia clínica. RANGOS DE REFERENCIA : IgM: 0 – 0,4 index IgG: 0 – 15 UA/ml METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la determinación semicuantitativa de los anticuerpos IgG e IgM frente al citomegalovirus en suero en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : 4 horas desde la toma de muestra RECHAZO DE MUESTRA : La muestra será rechazada en caso de lipemia y hemólisis. TIEMPO ENTREGA : 1 día hábil RESULTADOS MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 133 COLESTEROL EN LIQUIDOS BIOLOGICOS Bioquímica USO PREFERENTE DE LA : El colesterol en los líquidos biológicos tiene una presencia constante, como PRUEBA lo son también las proteínas, la glucosa, la deshidrogenasa láctica; éstas últimas han servido para la diferenciación entre exudado y transudado. Esta prueba diagnóstica probó ser superior a las tradicionales, demostrando ser más sensible y específica y con una precisión general mayor. RANGOS DE REFERENCIA : Exudado > 60 - Transudado < 60 mg/dL METODO : CHOD-PAP INSTRUCCIONES AL PACIENTE : No requiere ayuno INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Líquido biológico TIPO DE TUBO : Tubo estéril. VOLUMEN MINIMO : 4 mL para pacientes adultos adulto y pediátrico. CONDICIONES DE : Los tubos se deben transportar tapados en posición vertical, en un TRANSPORTE contenedor o gradilla a temperatura ambiente. TIEMPO DE TRANSPORTE : 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : Muestras coaguladas TIEMPO ENTREGA : 1 días hábil RESULTADOS LIMITACIONES : La hemólisis invalida la prueba. COLESTEROL TOTAL Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : INSTRUCCIONES AL PERSONAL TIPO DE MUESTRA TIPO DE TUBO : : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : Medición del riesgo de ateroesclerosis, hipercolesterolemia, enfermedad coronaria entre otros. Se asocia a exámenes como Colesterol HDL, Colesterol LDL y Triglicéridos. ≤ 200 mg/dL (adultos) CHOD-PAP. Ayuno de 12 a 14 horas antes de la prueba. No ingerir alcohol 24 horas antes de la prueba. Consumir una dieta estable en colesterol tres semanas antes de la prueba. La cena anterior a la prueba debe ser con bajo contenido graso y no tener alimentos ricos en colesterol. Evitar la hemólisis de la muestra. Suero Suero : Tubo tapa roja o amarilla 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 4 horas desde la toma de muestra. Muestras lipémicas, ictéricas y muy hemolizadas. Dentro del día. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 134 COLESTEROL- HDL Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES PERSONAL TIPO DE MUESTRA TIPO DE TUBO : : Suero Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 4 horas desde la toma de muestra. La muestra será rechazada en caso de hemólisis, lipemia o muy ictérica. Dentro del día AL : Medición del riesgo de ateroesclerosis e hipercolesterolemia, enfermedad coronaria entre otros. Se asocia a exámenes como Colesterol total, Colesterol LDL y Triglicéridos. Hombres : > 35 mg/dL (adultos) Mujeres : > 40 mg/dL (adultos) Detergente acelerador selectivo de colesterol oxidasa Ayuno de 12 a 14 horas antes de la prueba. No ingerir alcohol 24 horas antes de la prueba. Consumir una dieta estable en colesterol tres semanas antes de la prueba. La cena anterior a la prueba debe ser con bajo contenido graso y no contener alimentos ricos en colesterol. Evitar la hemólisis de la muestra. : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 135 COLINESTERASA Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : La colinesterasa es una hidrolasa que actúa descomponiendo la acetilcolina que es utilizada por las células nerviosas para transmitir estímulos nerviosos. Su determinación se realiza para evaluar la exposición a insecticidas de órgano fosfatos y riesgos de su toxicidad como también en ciertas enfermedades hepáticas. < 40 años 4.3 – 11.2 KU/L > 40 años 5.3 – 12.9 KU/L Reducción del hexacianoferrato No es necesario el ayuno Tomar muestra venosa evitando la hemólisis. : : Suero Suero : Suero : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : Tubo tapa roja o amarilla Tubo tapa verde para servicios de urgencia 2 ml para pacientes pediátricos y 2-4 ml para paciente adulto. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor a prueba de derrames y a temperatura ambiente, no agitar para evitar la hemólisis. 4 horas desde la toma de muestra. La muestra será rechazada en caso de hemólisis. Dentro del día MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 136 COMPLEMENTO C3 – C4 Inmunología USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : El sistema del complemento es una parte de la respuesta inmunológica inespecífica al antígeno. La activación del complemento ocasiona un gasto en los componentes C3 y C4, de tal manera que de una disminución en su concentración se pueden sacar conclusiones diagnósticas. Concentraciones bajas de C3 y C4 en el suero, se observan sobre todo en Lupus eritematoso sistémico (LES), en algunas formas de glomérulonefritis membranoproliferativa y en enfermedades por inmunocomplejos (enfermedad del suero). Los dos componentes del complemento reaccionan como proteínas de fase aguda, por lo cual, pueden presentar concentraciones elevadas en el suero en enfermedades infecciosas. C3 Hombres 99 - 214 mg/mL Mujeres y niños: 86 – 206 mg/mL C4 : Hombres 11 – 51 mg/mL Mujeres y niños 8 – 55 mg/mL Determinación cuantitativa de los factores de complemento (C3/C3c y C4/C4c) en suero por Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : : : : Tubo tapa lila (EDTA) 0,5 mL (tubo de 4mL) Temperatura ambiente. 4 horas desde la toma de muestra. La muestra será rechazada en caso de hemólisis, lipemia o muy ictérica. 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 137 COPROCULTIVO Microbiologia USO DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS : : : : : Diagnóstico etiológico de diarrea aguda bacteriana Sin desarrollo bacteriano Cultivo bacteriano en placas con medio de cultivo La muestra de deposición debe tomarse al comienzo del proceso agudo Debe estar sin tratamiento antibiótico previo Idealmente deposición recién emitida, incluyendo productos patológicos (mucus, pus, sangre) en un frasco limpio. Para pesquisa de toxina A de C. difficile se debe obtener aproximadamente 5 cc de deposición en un frasco limpio (sin fijador) que proporciona el laboratorio. En caso de hospitalización por diarrea, se tomará sólo una muestra al ingreso del paciente, ya que se ha demostrado que más de una muestra no aumenta el rendimiento en forma significativa, pero sí aumenta el costo. TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS Se solicita indicar en la orden presencia de sangre en deposiciones. : DEPOSICION : Tubo con torula en medio de transporte Cary Blair Frasco estéril en caso de muestra obtenida por sonda rectal : --: Transportar a temperatura ambiente. : Inmediato al laboratorio. Deposición formada Tórula sin medio de transporte : 3 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 138 CORTISOL Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES PERSONAL DE TOMA MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Suero Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : : : ENTREGA RESULTADOS LIMITACIONES : : 2 ml para pacientes pediátricos, 4 ml para adultos. Temperatura ambiente. 2 horas desde la toma de muestra. Las muestras serán rechazadas en caso de hemólisis, lipemia e ictericia. También será rechazada una muestra tomada después de las 9 AM. 1 día hábil Las anfetaminas, cortisona, anticonceptivos orales, etanol, nicotina, vasopresina, estrógenos incrementan los niveles de cortisol, lo disminuyen la metirapona, levodopa, dexametasona, carbonato de litio. Los niveles de cortisol no se modifican con la edad, otras situaciones que pueden aumentar los niveles de cortisol son la ansiedad grave, depresión endógena, anorexia nerviosa, alcoholismo, inanición e insuficiencia renal crónica. AL : DE La medición de Cortisol se utiliza para monitorear directamente la función adrenocortical e indirectamente la hipo o hiperfunción de la pituitaria. Niveles elevados de Cortisol son asociados con adenoma suprarrenal, Enfermedad de Cushing, tumor de la pituitaria. Niveles disminuidos de Cortisol puede indicar hipofunción a adrenal o un defecto en la vía metabólica Antes de las 10 AM: 3.7 ---19.4 ug/dl Después de las 5 PM:2.9----17.3 ug/dl Inmunoensayo de de micropartículas /quimioluminiscentes Architect 8200 Ayuno de al menos 8 horas. Por el ritmo circadiano del Cortisol debe respetarse el horario de toma de muestra (antes de las 9 am). Evitar hemólisis de la muestra : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 139 CORTISOL, ORINA 24 HORAS Bioquímica USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE : : : : DE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : TIEMPO RESULTADOS LIMITACIONES : ENTREGA : Evaluación de desórdenes adrenocorticales. ADULTOS: 4.3 - 176 ug./24 hrs. Imnunoensayo de micropartículas quimioluminiscentes. Architect. 8200 Recolección de orina de 24 hrs sin preservantes. (Ver prueba de proteinuria de 24 horas). Si la muestra es llevada a Toma de Muestra y rotulada por el paciente, asegurarse que correspondan los datos del paciente en el rótulo. Orina de 24 horas. Orina : Contenedor Esteril Todo el volumen recolectado para orinas de 24 horas o una alícuota de 10 mL. Los frascos se deben transportar tapados en posición vertical, en un contenedor a temperatura ambiente. No usar correo neumático para transportar alícuotas en tubos de vidrio. 2 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. Tubo o frasco mal rotulado o con nombre ilegible. Tubo o frasco transportado en condiciones inadecuadas. En caso de enviarse una alícuota debe consignarse el volumen en 24 hrs. 2 días hábiles En pacientes que toman anticonceptivos es posible observar valores anormalmente elevados. La prednisona y prednisolona interfieren en el ensayo. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 140 CREATINKINASA TOTAL (CK TOTAL) Bioquímica USO PREFERENTE DE LA : La creatinkinasa en una enzima que se localiza en el tejido muscular y PRUEBA cerebral y refleja el catabolismo tisular debido a traumatismo celular. Esta prueba se realiza para la detección de lesión miocárdica y esquelética o del sistema nervioso central. RANGOS DE REFERENCIA : Hombres 30 ---200 U/L Mujeres: 29 ---168 U/L Niños: 0 ---24 U/L METODO : NAC activado INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. No ingerir alcohol 24 horas antes de la prueba. El ejercicio físico prolongado aumenta el valor de la CK total. INSTRUCCIONES AL : Evitar la hemólisis de la muestra. PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA : TIEMPO ENTREGA : RESULTADOS : Tubo tapa verde para los servicios de urgencia 2 mL para pacientes pediátricos, 4 ml para adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 horas desde la toma de muestra. Las muestras serán rechazadas en caso de hemólisis y la lipemia 2 horas para pacientes de servicios de urgencia. Dentro del día para pacientes hospitalizados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 141 CREATINKINASA MB (CK MB) Bioquímica USO PREFERENTE DE LA : La creatinkinasa en una enzima que se localiza en el tejido muscular y PRUEBA cerebral y refleja el catabolismo tisular debido a traumatismo celular. Esta prueba se realiza para la detección de lesión miocárdica y esquelética o al sistema nervioso central. La fracción MB se encuentra principalmente en el músculo cardiaco, pero también, en menor cantidad, en la lengua, diafragma y músculo esquelético. La prueba por lo general se repite a intervalos de 8 horas para evaluar la evolución de la lesión. RANGOS DE REFERENCIA : < 24 mg/dl. METODO : Cinético de isoenzimas. EQUIPO ARCHITECT. 8200 INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas antes de la toma de muestra. No ingerir alcohol 24 horas antes de la prueba. INSTRUCCIONES AL : Evitar la hemólisis de la muestra. Indicar, en la orden de examen si la PERSONAL DE TOMA DE condición de ayuno no se ha cumplido. MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA : TIEMPO ENTREGA : RESULTADOS : Tubo tapa verde para los servicios de urgencia 2 mL para pacientes pediátricos, 4mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra, como máximo Las muestras serán rechazadas en caso de hemólisis y la lipemia 2 horas para pacientes de servicios de urgencia. Dentro del día para pacientes hospitalizados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 142 CREATININA EN SUERO Bioquímica USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES PERSONAL DE TOMA MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE AL : DE : DE : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA : TIEMPO ENTREGA : RESULTADOS Es un indicador específico de función renal, que muestra el equilibrio entre la formación y la excreción de creatinina. Los valores son un 20 a 40% mayores en las últimas horas de la tarde que en la mañana. La Creatinina se eleva en daño renal, en necrosis músculo-esquelética, trauma, distrofia muscular progresiva, esclerosis lateral amiotrófica, amiotonía, congestiva, dermatomiosis, miastenia gravis, ayuno prolongado y acidosis diabética. Hombres: 0.70 -1.3 mg/dL (adultos) Mujeres: 0.6---1.1mg/dL (adultos) Niños : 0.3----0.7 mg/dl Jaffé cinético. Ayuno de al menos 8 horas. Evitar el ejercicio 8 horas antes y la ingesta de carnes rojas 24 horas antes de la prueba. No obtener la muestra durante la hemodiálisis. Evitar la hemólisis de la muestra. Suero Suero : Suero : Tubo tapa roja o amarilla Tubo tapa verde para los servicios de urgencia 2 mL para pacientes pediátricos, 4 ml para adultos Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra Las muestras serán rechazadas en caso de hemólisis y la lipemia 2 horas para pacientes de servicios de urgencia. Dentro del día para pacientes hospitalizados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 143 CREATININA URINARIA MUESTRA AISLADA Bioquímica USO DE LA PRUEBA : Es un indicador específico de función renal, que muestra el equilibrio entre la formación y la excreción de creatinina. Los valores son un 20 a 40% mayores en las últimas horas de la tarde que en la mañana. La Creatinina se eleva en daño renal, en necrosis músculo-esquelética, trauma, distrofia muscular progresiva, esclerosis lateral amiotrófica, amiotonía, congestiva, dermatomiosis, miastenia gravis, ayuno prolongado y acidosis diabética. RANGOS DE REFERENCIA : 90 – 300 mg/dl. METODO : Jaffé cinetico, EQUIPO ARCHITEC 8200 INSTRUCCIONES AL PACIENTE : En caso de adultos ver instructivo para paciente, página 39. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL : Verifique la correcta rotulación de la muestra antes del envío al PERSONAL DE TOMA DE Laboratorio. MUESTRAS TIPO DE MUESTRA : Orina de segundo chorro. TIPO DE TUBO : Orina : Tubo o frasco de orina proporcionado por el laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). VOLUMEN MINIMO : 10 mL. CONDICIONES DE : Los tubos, frascos y/o botellas, se deben transportar tapados, en TRANSPORTE posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 2 horas desde la toma de muestra. RECHAZO DE MUESTRA : Las muestras serán rechazadas en las siguientes condiciones. Tubo o frasco de orina mal rotulado o con nombre ilegible Tubo o frasco no transportado en condiciones adecuadas. Muestra con evidente signo de contaminación. TIEMPO ENTREGA : Dentro del día en horario hábil RESULTADOS LIMITACIONES : Medicamentos que alteran el resultado: ácido ascórbico, barbitúricos entre otros. Otros interferentes son bilirrubina, hemoglobina, lípidos, proteinas y glucosa elevadas. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 144 CREATININA CLEARENCE CORREGIDO DE Bioquímica USO DE LA PRUEBA : Es un indicador muy específico de la función renal que indica el equilibrio existente entre la formación y excreción de creatinina. RANGOS DE REFERENCIA : 80-120 mLmin/1.73 METODO : Se utilizan muestras de sangre y orina de 24 horas para determinar la velocidad a la cual el riñón depura la creatinina de la sangre (cantidad de sangre depurada en 1 minuto). El valor obtenido mediante una fórmula matemática, se corrige de acuerdo a un estándar de superficie corporal. INSTRUCCIONES AL PACIENTE : Evitar el ejercicio vigoroso 8 horas antes de la prueba. Ayuno de 8 horas antes de la recolección de la muestra de sangre. Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa, ver instructivo para recolección orina 24 horas, página Nº 40) INSTRUCCIONES PERSONAL DE TOMA MUESTRAS TIPO DE MUESTRA TIPO DE TUBO AL : Verificar la correcta rotulación de todos los envases antes del envío al DE Laboratorio. Agregar los datos de peso y talla del paciente a la solicitud de orden de examen. : - Orina de 24 horas o una alícuota de 10 mL. - Sangre (Suero) : Orina : Recipientes limpios y secos para la muestra orina Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : Orina: Toda la orina de 24 horas. Sangre/ 2 mL para pacientes pediátricos y 4 mL para pacientes adultos. CONDICIONES TRANSPORTE : Temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde el término de la recolección de la muestra. RECHAZO DE MUESTRA : Las muestras serán rechazadas en las siguientes casos. - Tubo mal rotulado o con nombre ilegible - Tubo o frasco no transportado en condiciones adecuadas - Muestra bemolizada (Suero) - Recolección inadecuada de orina de 24 hrs. - Falta de datos del paciente como peso, talla y diuresis correcta de 24 hrs. TIEMPO ENTREGA : Dentro del día RESULTADOS LIMITACIONES : La falta de inclusión de toda la orina de 24 horas proporciona resultados errados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 145 CUERPOS CETÓNICOS EN SANGRE Y ORINA Bioquímica USO DE LA PRUEBA : Control de la diabetes y de la cetoacidósis producida por la diabetes. RANGOS DE REFERENCIA : Sangre: Negativo. Orina: Negativo. METODO : Determinación físico-química. EQUIPO URISYS 2400 INSTRUCCIONES AL PACIENTE : Sangre: Ayuno de al menos 8 horas. Orina: En caso que el paciente traiga la orina de su domicilio se le informa que ésta debe ser la primera orina de la mañana. Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Si el paciente es adulto ver instructivo para muestra orina, página 39) Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL : Verifique la correcta rotulación de la muestra antes del envío al PERSONAL DE TOMA DE laboratorio. MUESTRAS TIPO DE MUESTRA : Sangre (Suero) u orina segundo chorro según corresponda. TIPO DE TUBO : Orina : Tubo o frasco de orina proporcionado por el Laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : Sangre: Pediatría: 2 mL, Adultos: 2 a 4 ml Orina: 10 mL. Los tubos, frascos y/o botellas, se deben transportar tapados, en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. 2 horas. RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : Las muestras seran rechazadas en caso de hemólisis y lipemia. Dentro del día. La hemólisis y la lipemia invalidan la técnica. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 146 CULTIVO CORRIENTE Microbiología USO PREFERENTE DE LA : Diagnóstico de infección. PRUEBA Confirmar la etiología con fines epidemiológicos. Necesidad de orientar tratamiento antibiótico. RANGOS DE REFERENCIA : Sin desarrollo bacteriano METODO : Cultivo bacteriano en placas con medio de cultivo INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL : Según tipo de muestra, ver instrucciones en páginas 59 a 78. PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Agua diálisis : Tubo estéril Bilis Contenido gástrico Líquidos Punta catéter Tejidos Aspirado nasofaríngeo Tubo de aspirado Lavado bronquiolveolar Expectoración Caja baciloscopía Secreciones VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE ENTREGA RESULTADOS : Tórula : 1 ml : Transportar tapados, en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. : Inmediato al laboratorio. : Ver tiempos de respuesta de bacteriología en página 12. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 147 DENSIDAD URINARIA Orinas USO PREFERENTE DE PRUEBA RANGOS DE REFERENCIA METODO LA : : : INSTRUCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE : : : DE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO RESULTADOS : : : : ENTREGA : Se utiliza para evaluar equilibrio hidrico y la concentración de orina en el cuerpo. 1.002-1.028 Físico-Químico EQUIPO. URISYS 2400 o DIRUI H 500 Mantener una dieta balanceada, respetar alguna otra indicación medica. Seguir indicaciones para recolección de muestra de orina aislada Orina aislada. Orina : Tubo o frasco de orina proporcionado por el Laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). Orina: 10 mL. Los tubos o frascos se deben traer tapados rotulados, en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. 2 horas. Las muestras serán rechazadas en los siguientes casos.. Tubos o frascos mal rotulados o con nombre ilegible Tubos o frascos transportados en condiciones inadecuadas. Dentro del día MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 148 DHEA-S (SULFATO DE DESHIDROEPIANDROSTERONA) Bioquímica USO PREFERENTE DE LA : El sulfato de deshidroepiandrosterona (DHEA-S) es el andrógeno PRUEBA adrenal más común y actúa como neuroesteroide producido por la corteza adrenal. DHEA-S es un excelente indicador de la producción de andrógenos adrenales. Las concentraciones de DHEA-S disminuyen con la edad y sirven como factor pronostico de enfermedades graves y de la evolución de cáncer de mama. Se encuentran niveles elevados en pacientes con ovario poliquístico y en pacientes con tumores testiculares. RANGOS DE REFERENCIA : Mujeres edad rango ug/dl 11 – 14 8.6 – 169.0 1 5 – 19 6 1. 2 – 493.6 2 0 – 24 134.2 – 407.4 2 5 – 34 9 5. 8 – 511.7 3 5 – 44 7 4. 8 – 410.2 4 5 – 54 5 6. 2 – 282.9 55 – 64 29.7 – 182.2 65 – 70 33.6 – 78.9 Hombres edad rango ug/dl 11 – 14 16.6 – 242.7 1 5 – 19 45.1 – 385.0 2 0 – 24 283.4 – 539.3 2 5 – 34 167.9 – 591.9 3 5 – 44 139.7 – 484.4 4 5 – 54 136.2 – 447.6 55 – 64 48.6 – 361.8 65 – 70 228.5 – 283.6 Niños edad rango ug/dl Menos de 1 semana 24.6 - 302.8 1 a 4 semanas 8.5 – 317.3 1 a 12 meses 31.6 – 214.1 1 a 4 años 32.7 – 276.0 5 a 10 años 24.4 – 209.7 METODO : Inmunoensayo de micropartículas quimioluminiscentes INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : 2 mL. a 4 mL CONDICIONES TRANSPORTE : Temperatura ambiente TIEMPO DE TRANSPORTE : 2 horas desde la toma de muestra. RECHAZO DE MUESTRA : Hemólisis, lipemia o muy ictérica. Falta de datos de paciente como edad, sexo y diagnóstico ENTREGA RESULTADOS : 5 días hábiles LIMITACIONES : La presencia de anticuerpos heterófilos y factor reumatoideo en la muestra puede producir interferencia con el análisis de la muestra MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 149 DIGOXINA, NIVELES DE Inmunología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : La digoxina es un potente glucósido cardíaco, ampliamente prescrito para el tratamiento de pacientes afectados de insuficiencia cardíaca congestiva, así como de pacientes con ciertos tipos de arritmias cardíacas. La intoxicación con digoxina es un problema clínico grave y frecuente. En parte, se debe al hecho de que los glucósidos cardíacos tienen un estrecho margen terapéutico (una diferencia muy pequeña entre las concentraciones terapéuticas y las tóxicas en los tejidos). Unido al estrecho margen terapéutico, hay una marcada variabilidad en la respuesta del paciente a la misma dosis del fármaco, haciendo, a menudo, que sean impredecibles las concentraciones séricas del fármaco. 0,8 – 2,0 ng/mL Inmunoanálisis quimioluminiscente de mircroparticulas (CMIA) para la determinación cuantitativa de la digoxina, un fármaco cardiovascular, en suero humano. Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO RESULTADOS : DE : : : ENTREGA : : Tubo tapa roja o amarilla 0,5 mL (tubo de 4mL) Temperatura ambiente. Antes de 2 horas de tomada la muestra. La muestra serán rechazada en caso de muestra con hemólisis, lipemia o muy ictérica. Dentro del día si la muestra se ha recibido antes de las 15.00 hrs MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 150 DIMERO-D Coagulación USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS La prueba permite realizar evaluaciones de pacientes en los que se sospecha la existencia de coagulación intravascular diseminada o episodios tromboembólicos, incluida la embolia pulmonar (EP) y trombosis venosa profunda (TVP). Adultos y niños: menor de 600 ng/ml. Fluoroinmunoanálisis No requiere ayuno. La punción debe ser atraumática, evitando la formación de hematomas, ligadura prolongada y la hemólisis. Se debe evitar la aspiración de burbujas de aire y la contaminación con líquido tisular. Si en la toma de muestra un paciente necesita más de un tubo, usar en 2º o 3º lugar el tubo para las pruebas de coagulación. Si la toma de muestra es única, desechar la primera porción. Si la extracción se efectúa a través de un catéter, descartar los primeros 20 mL de sangre antes de vaciar al tubo. Se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. TIPO DE MUESTRA Sangre entera o plasma venoso recolectado con K2 EDTA Tubo tapa lila (anticoagulante K2 EDTA) TIPO DE TUBO VOLUMEN MINIMO 2 mL o según la cantidad que indique el tubo (llenar hasta la marca). Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente o en condiciones de refrigeración y evite las temperaturas extremas. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES Inmediato o dentro de 24 horas. Hemólisis, tiempos de transportes mayores a 24 horas Pabellón: 30 minutos, 2 horas para pacientes hospitalizados. Pacientes ambulatorios: 24 horas desde su llegada al laboratorio. Las muestras hemolizadas y con indicios de coágulo invalidan la prueba. No procesar muestras que no se han separado y congelado a -20 º C dentro de 24 horas. No procesar muestras recolectadas con otro anticoagulante. Las muestras refrigeradas y plasmas congelados deben alcanzar la temperatura ambiente antes de procesar. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 151 ELECTROFORESIS DE PROTEINAS SERICAS Inmunología USO PREFERENTE DE LA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de PRUEBA Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : ALBUMINA 3.63 - 4.91 g/dL ALFA1 0.11 - 0.35 g/dL ALFA2 0.65 - 1.17 g/dL BETA 0.74 - 1.26 g/dL GAMMA 0.58 - 1.74 g/dL METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Ayuno de al menos 12 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Sangre VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADOS : : 500 µl de Suero Temperatura ambiente. : 4 horas desde la toma de muestra. Muestras con lipemia e ictericia 7 días hábiles : : Tubo tapa amarilla roja o ELECTROFORESIS DE PROTEINAS ORINA Inmunología USO PREFERENTE DE LA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de PRUEBA Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : Presencia o Ausencia de componente proteico monoclonal. METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Instrucciones de recolección de orina 24 horas. INSTRUCCIONES AL PERSONAL : Verificar Diuresis (volumen total de orina en 24 horas) DE TOMA DE MUESTRAS TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Envase recolector de orina 24 horas. VOLUMEN MINIMO : 200 ml de orina (tomados de la orina 24 horas). CONDICIONES DE : Temperatura ambiente. TRANSPORTE TIEMPO DE TRANSPORTE : 4 horas desde la toma de muestra, (una vez completas las 24 horas de recolección) TIEMPO ENTREGA : 7 días hábiles RESULTADOS LIMITACIONES : No puede ser orina parcial. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 152 ELECTROLITOS PLASMATICOS Bioquímica USO PREFERENTE DE LA : Alteraciones electrolíticas, estudio de hipertensión. PRUEBA RANGOS DE REFERENCIA : Na: 136– 145 meq/L (adultos) K 3.4 – 4.7 meq/L (adultos) C l: 98 – 107meq/L (adultos) METODO : Potenciometría indirecta EQUIPO ARCHITECT 8200 y ARCHITECT 8000 INSTRUCCIONES AL PACIENTE : No es necesario el ayuno. INSTRUCCIONES AL : Evitar la hemólisis de la muestra. No obtener la muestra durante la PERSONAL DE TOMA DE hemodiálisis. MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero : Tubo tapa verde lleno hasta la marca para los servicios de urgencia. VOLUMEN MINIMO : Pediatría: 2 mL Adultos: 2 a 4 mL CONDICIONES DE : Los tubos se deben transportar tapados, en posición vertical, en un TRANSPORTE recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. TIEMPO DE TRANSPORTE : Enviar al laboratorio antes de 1 hora de tomada la muestra. CONDICIONES DE RECHAZO : Las muestras seran rechazadas en caso de hemólisis DE MUESTRA TIEMPO ENTREGA : Pabellón: 30 minutos desde su llegada al laboratorio. Otros servicios RESULTADOS clínicos 2 horas. Pacientes ambulatorios durante el día. LIMITACIONES : Fármacos que interfieren: ↑ Na: ACTH, esteroides anabólicos, andrógenos, clonidina, corticosteroides, estrógenos, metildopa, anticonceptivos orales, fenilbutazona. ↓ Na: Aminoglicósidos, anfotericina B, inhibidores de la ECA, captopril, carbamazepina, clorpropamida, cisplatino, furosemida, tiazidas, espironolactona, fluoxetina, heparina, indometacina, oxitocina, vasopresina, antidepresivos tricíclicos. ↑ K: Inhibidores de la ECA, ciclofosfamida, vincristina, ciclosporina, epinefrina, heparina, litio, manitol, antiinflamatorios no esteroidales, espironolactona, tetraciclina. ↓K: Salbutamol, albuterol, aminoglicosídos, amfotericina, cisplatino, corticosteroides, furosemida, tiazidas, EDTA, glucosa, insulina, levodopa, penicilina G. ↑ Cl: Andrógenos, estrógenos, metildopa, fenilbutazona, tiazidas. ↓ Cl: Bicarbonatos, corticotropina, furosemida, manitol, tiazidas, teofilina. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 153 ELECTROLITOS URINARIOS Bioquímica USO DE LA PRUEBA : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Evaluación de la función renal y en general, trastornos del equilibrio hidroelectrolítico. Na : 40 -220 mEq/24 horas (adultos) 63-177 mEq/24 horas 10-14 años masculino) 41 -115 mEq/24 horas (< 10 años masculino) 20 - 69 mEq/24 horas (< 10 años femenino) 48 -168 mEq/24 horas (10-14 años femenino) K : 25- 125 mEq/24 horas (adultos) Cl: 110-250 mEq/24 horas (adultos) Potenciometría indirecta. Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Durante el período de recolección, el paciente debe beber líquidos en forma normal a menos que haya recibido otra indicación y no debe beber alcohol. Los pasos a seguir son los siguientes: • Orine a las 7:00 Hrs. de la mañana y elimine esta orina. • Recoger, a partir de ese momento, en un recipiente limpio y seco, toda la orina que elimine a lo largo del día, la noche siguiente, incluyendo la primera orina de la mañana siguiente. • Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. La identificación debe contener el nombre y los dos apellidos del paciente escritos con letra legible. • Transportar la orina a la Unidad de Laboratorio Clínico. Verificar la correcta rotulación de todos los envases antes del envío al Laboratorio. TIPO DE MUESTRA TIPO DE TUBO : : Orina de 24 horas. Orina : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA : ENTREGA RESULTADO : LIMITACIONES : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : Tubo o frasco de orina proporcionado por el Laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). Toda la orina de 24 horas o una alícuota de 10 mL. Enviar los recipientes tapados, en posición vertical, para evitar derrames, a temperatura ambiente. Máximo 4 horas desde el término de la recolección de la muestra. Las muestras serán rechazadas en caso de recolección inadecuada de orina de 24 hrs. Dentro del día si muestra se ha recibido antes de las 15.00 hrs Las determinaciones en muestras de orina aislada no son representativas. Los electrolitos urinarios son dependientes de la dieta. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 154 EPSTEIN BARR VIRUS, Ac. IgM (ANTI VCA IgM) Inmunologia USO PREFERENTE DE LA : La infección por EBV (virus de Epstein Barr) es muy común y es transmitida PRUEBA por intercambio de saliva que contiene el virus vivo. Luego de la exposición inicial al virus, hay un periodo de incubación de 1 a 2 meses previo a la enfermedad clínica. El típico síndrome clínico es la Mononucleosis Infecciosa (MI). Característicamente el paciente presenta la triada clásica, fiebre, dolor de faringe y linfadenopatía. En muchos casos, el clínico debe confirmar su diagnostico de MI con el laboratorio, debido a la similitud de síntomas con infecciones a Toxoplasmosis o Citomegalovirus. RANGOS DE REFERENCIA : Negativo METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la determinación cualitativa de anticuerpos clase IgG e IgM al antígeno cápside del Virus de Epstein Barr en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (Suero) TIPO DE TUBO : Sangre (Suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO RESULTADOS : DE : : : ENTREGA : 0,5 mL (tubo de 4mL) Temperatura ambiente. Antes de 4 horas de tomada la muestra. Las muestras seran rechazadas en caso de hemólisis y lipemia. No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 155 EOSINÓFILOS NASALES Hematología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADOS LIMITACIONES : Pesquisa de eosinofilia en cuadros alérgicos. : : : : : : : Negativo. Tinción de Hamsel. Suspender los antihistamínicos 10 días antes de la toma de la muestra. Rotular 2 láminas de vidrio (portaobjetos) con el nombre y los dos apellidos del paciente. Introducir una tórula en una fosa nasal y frotar contra las paredes. Retirar la tórula y con movimientos rotatorios presionar la tórula sobre un portaobjetos, extendiendo la muestra sobre la lámina. Repetir el procedimiento en la otra fosa nasal. Esperar que la muestra seque al aire. Secreción nasal. Lámina de vidrio (portaobjetos). : Abundante secreción Una vez que las láminas estén secas guárdelas en un papel limpio. Evite que las láminas se quiebren. Enviar al laboratorio hasta las 12:00 hrs. del día de la toma de muestra. ----48 horas desde la llegada de la muestra al laboratorio. : Muestras escasas no pueden ser procesadas. : : : : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 156 ESTRADIOL Bioquímica USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : El análisis de los niveles de Estradiol es útil en la evaluación de infertilidad, irregularidades menstruales y precocidad sexual en las mujeres. Se encuentra aumento en caso de feminización de niños, tumores productores de estrógenos, ginecomastia, cirrosis hepática, hipertiroidismo, también en casos de ovario poliquístico. Se encuentra disminuido en caso de hipogonadismo primario y secundario. Adultos: Hombres : 11.0 a 44.0 pg/mL Mujeres Fase Folicular : 21.0 a 251.0 pg/mL Peak Medio Ciclo : 38.0 a 649.0 pg/mL Fase Lútea : 21.0 a 312.0 pg/mL Posmenopáusicas :< 10.0 a 28 pg/mL. Inmunoensayo de Micropartículas Quimiluminiscentes Equipo Architec Ayuno de al menos 8 horas. Evitar hemólisis de la muestra. : : Suero Suero VOLUMEN MINIMO : Pediatría: 2 mL Adultos: 2 a 4 mL Temperatura ambiente. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO RESULTADOS LIMITACIONES DE : : : ENTREGA : : : Tubo tapa roja o amarilla 4 horas desde la toma de muestra. Muestra bemolizada, lipémica o con ictericia Falta de datos del paciente, como por ejemplo etapa de ciclo. 24 horas. El diazepam y clomifeno producen elevación del Estradiol. Los anticonceptivos orales y el megestrol producen disminución de los niveles de Estradiol. La presencia de Anticuerpos Heterófilos puede interferir en la determinación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 157 FACTOR REUMATOIDEO Inmunología : USO PREFERENTE PRUEBA DE LA RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Los FR son autoanticuerpos contra la fracción Fc de la IgG Humana que han sufrido alteraciones en su estructura terciaria. La detección de FR es uno de los criterios para el diagnóstico de la Artritis Reumatoide (AR). Los FR desempeñan un papel importante en el diagnóstico diferencial, para distinguir la AR de otras enfermedades reumáticas. La presencia de concentraciones elevadas de FR se suele asociar con un curso de la enfermedad más grave. Asimismo, los FR pueden aparecer con otras enfermedades reumáticas y no reumáticas, tales como la hepatitis, endocarditis e infecciones parasitarias o virales, así como con otras enfermedades autoinmunes. 0 – 20 UI/mL Determinación cuantitativa de los factores de reumatoides (FR) en suero por Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO TIEMPO ENTREGA RESULTADOS : Tubo tapa lila (EDTA) : : 0,5 mL (tubo de 4mL) Temperatura ambiente. : Antes de 4 horas de tomada la muestra Muestras lipémicas o hemolizadas 1 día hábil : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 158 FENITOINA, NIVELES DE Bioquímica USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA METODO INSTRUCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS : : : : TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : DE : : : : Droga utilizada como antiepiléptico, la detección de niveles es utilizada para el control y monitoreo del tratamiento de pacientes epilépticos (Gran mal). Adultos 10-20 ug/ml Enzimo-inmunoensayo por competición. EQUIPO ARCHITECT 8200 Ayuno de al menos 8 horas. Tomar la muestra entre 0 y 30 minutos antes de la dosis. Indicar en la orden hora de la última dosis de Fenitoina o de otros medicamentos. En intoxicaciones la toma de muestra es independiente del horario y la dosis. Suero Suero : Tubo tapa roja o amarilla 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. Temperatura ambiente. 4 horas desde la toma de muestra. Las muestras serán rechazadas en caso de Ingesta de dosis terapéutica previa al examen (1 hora) y muestras hemolizadas, lipémicas o con ictericia Dentro del día en horario hábil. FENOBARBITAL, NIVELES DE Bioquímica USO PREFERENTE DE LA : Droga utilizada como antiepiléptico, la detección de niveles es utilizada PRUEBA para el control y monitoreo del tratamiento de pacientes epilépticos (Ataques y convulsiones generalizadas). RANGOS DE REFERENCIA : Adultos: 10 a 40 ug/mL. METODO : Enzimo-inmunoensayo por competición. EQUIPO ARCHITECT 8200 INSTRUCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar la hemolisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : DE : : : : : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 ml pediátricos, 4 ml en adultos. Los tubos deben ser transportados tapados en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. 4 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. - Tubo mal rotulado o con nombre ilegible. - Tubo no transportado en condiciones adecuadas. - Muestras hemolizadas, lipémicas o con ictericia - Ingesta de dosis terapéutica previa al examen (1 hora). Dentro del día en horario hábil. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 159 FERRITINA Inmunología USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : La ferritina es una proteína de alta masa molecular, confirmando la relación directa entre la concentración de ferritina sérica y los depósitos de hierro en el organismo. La bibliografía reciente sugiere que la ferritina proporciona medidas más sensibles, específicas y fiables para determinar una ferropenia en los estados iniciales. Las mediciones de la ferritina sérica han resultado _tiles en el control de la recarga de los depósitos férricos en pacientes a los que se les administra hierro de forma oral y para determinar cuando se puede interrumpir la terapia. En los trastornos inflamatorios crónicos, las infecciones y en la insuficiencia renal crónica, se observa un aumento desproporcionado de la concentración de ferritina sérica en relación con los depósitos férricos. 0,8 – 2,0 ng/mL Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la determinación cuantitativa ferritina en suero humano. Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO TIEMPO ENTREGA RESULTADOS : : 0,5 mL (tubo de 4mL) Temperatura ambiente. : : : 4 horas desde la toma de muestra. Las muestras serán rechazadas en caso de lipemia o hemólisis. 1 día hábil. : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 160 FIBRINOGENO PLASMATICO, DETERMINACION CUANTITATIVA DE Coagulación USO PREFERENTE DE LA : Evaluación de la capacidad de coagulación, estudios de las deficiencias de PRUEBA fibrinógeno como: afibrinogenemia, hipofibrinogenemia y disfibrinogenemia congénita, hipofibrinogenemias asociadas a enfermedades como: CID, fibrinolisis sistémicas, pancreatitis y disfunción hepática grave. Como proteína de respuesta en fase aguda su aumento permite evaluar estados inflamatorios, infecciosos traumáticos, embarazos (estados pretrombóticos). Su relación con el desarrollo de enfermedades cardiovasculares permite evaluar el riesgo de Arterioesclerosis, IAM, Accidentes cerebros vasculares. RANGOS DE REFERENCIA : Adultos y niños: 180-350 mg/dl METODO : Óptico-mecánico. INSTRUCCIONES AL PACIENTE : No requiere ayuno INSTRUCCIONES AL PERSONAL : La punción debe ser sin trauma, evitando la formación de hematomas, DE TOMA DE MUESTRAS ligadura prolongada y la hemólisis. Si la punción es traumática y dura mas de 2 minutos .Tomar nueva muestra. Se debe evitar la aspiración de burbujas de aire y la contaminación con líquido tisular. La sangre no debe recolectarse de una vía con un cierre heparinizado. La sangre venosa se debe recolectar con citrato de sodio al 3.2 % en proporción 1:10 Si en la toma de muestra un paciente necesita más de un tubo, usar en 2º o 3º lugar el tubo para las pruebas de coagulación. Si la toma de muestra es única, desechar la primera porción. Se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. Si observa coagulo se debe rechazar la muestra y tomar una nueva. TIPO DE MUESTRA : Sangre. TIPO DE TUBO : Tubo tapa celeste (anticoagulante citrato de sodio 3.2 % VOLUMEN MINIMO : 2 mL o según la cantidad que indique el tubo (llenar hasta la marca). CONDICIONES DE : Los tubos se deben transportar tapados, en posición vertical, en un TRANSPORTE recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente o refrigerada. TIEMPO DE TRANSPORTE : Lo antes posible. Máximo 3 horas. CONDICIONES DE RECHAZO DE : Muestras sobre o bajo nivel no pueden ser procesadas MUESTRA Si observa coagulo una vez mezclada se debe rechazar la muestra y tomar una nueva. Muestras recolectadas en tubos con heparina. ENTREGA RESULTADOS : Pabellón: 45 minutos, 45 a 60 minutos para pacientes de los servicios críticos y otros servicios clínicos. Pacientes ambulatorios: 24 horas desde su llegada al laboratorio. LIMITACIONES : Las muestras hemolizadas y coaguladas invalidan la prueba. Las muestras recolectadas de vías heparinizadas invalidan la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 161 FIERRO Bioquímica USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA METODO INSTRUCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : : VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : : : : : Disminuye en patologías como anemia ferropénica, artritis reumatoide, carcinoma, embarazo, etapa post operatoria. Aumenta en patologías como: anemia aplásica, anemia hemolítica, anemia perniciosa, entre otras. 31-144 µg/dL hombres adultos 25—156 ug/dl mujeres adultos Ferrozina sin desproteinización Ayuno de al menos 8 horas. No obtener la muestra durante la hemodiálisis. Evitar la hemólisis de la muestra. Suero Suero : Tubo tapa roja o amarilla 2 mL para pacientes pediátricos, 2 a 4mL para pacientes adultos. Los tubos deben ser transportados tapados en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. 4 horas desde la toma de muestra. Las muestras serán rechazadas en caso de ingesta de fierro 48 hrs antes de la prueba o muestra hemolizada o lipémica. 1 día hábil La vitamina B12 y la ingesta de fierro en las últimas 48 horas antes de la prueba puede elevar los resultados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 162 FIERRO Y TIBC (CAPACIDAD TOTAL DE FIJACIÓN DE FIERRO) Bioquímica USO DE LA PRUEBA : Prueba que diferencia la anemia secundaria a deficiencia de hierro de otras enfermedades relacionadas con variaciones en la oxidación celular. El TIBC es la cantidad máxima de fierro que puede fijarse a la transferrina, y es útil para diferenciar la anemia (aumento de los valores) de los trastornos con inflamación crónica (valores normales). RANGOS DE REFERENCIA : 250 – 450 µg/dL hombres 250--400 µg/dl mujeres METODO : En esta prueba se agrega fierro al suero del paciente hasta que todos los sitios de unión a la transferrina están ocupados con fierro. A continuación se elimina el exceso de fierro y se determina la cantidad total del resto del fierro (fijado), lo cual permite valorar la capacidad de la transferrina para fijar el fierro. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 12 horas antes de la prueba. INSTRUCCIONES AL PERSONAL : No obtener la muestra durante la hemodiálisis. Evitar la hemólisis de la DE TOMA DE MUESTRAS muestra. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : ENTREGA RESULTADOS LIMITACIONES : : 2 mL para pacientes pediátricos, 2 a 4mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 4 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. - Tubo mal rotulado o con nombre ilegible. - Tubo no transportado en condiciones adecuadas. - Muestra hemolizadas y lipémicas. 1 día hábil La vitamina B12 y la ingesta de fierro en las últimas 48 horas antes de la prueba puede elevar los resultados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 163 FOSFATASA ALCALINA (ALP) Bioquímica USO PREFERENTE DE LA : La fosfatasa alcalina se encuentra en el hueso, hígado, intestino y placenta, PRUEBA se eleva durante períodos de crecimiento óseo, enfermedad hepática y obstrucción de las vías biliares, en colestasis intra o extrahepática (hepatitis, cirrosis biliar, drogas hepatotóxicas, colédoco litiasis, carcinoma de la cabeza del páncreas, carcinoma hepático), en enfermedades óseas como osteítis, raquitismo, osteomalacia, fracturas de consolidación, tumores osteoblásticos e hiperparatiroidismo. También puede elevarse en insuficiencia cardiaca, mononucleosis infecciosa, IM, perforación del intestino y septicemia. RANGOS DE REFERENCIA : Hombres: 40 –150 U/L (adultos) Mujeres: 40 –150 U/L (adultos) Niños: 0 -500 U/L METODO : p-Nitrofenilfosfato. EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Ayuno de 10 a 12 horas antes de la prueba. INSTRUCCIONES AL PERSONAL : Evitar el uso prolongado del torniquete y la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE : MUESTRA TIEMPO RESULTADOS LIMITACIONES ENTREGA : : : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 ml pediátricos, 4 ml en adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 2 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. - Tubo mal rotulado o con nombre ilegible - Tubo no transportado en condiciones adecuadas - Muestra Hemolizadas y Lipémicas 2 horas para pacientes de los servicios de urgencia. Pacientes hospitalizados y ambulatorios durante el día. La falta de ayuno o la exposición de la muestra a temperaturas ambiente por tiempos prolongados, producen resultados falsamente elevados. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 164 FÓSFORO Bioquímica USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : El fósforo inorgánico constituye solo un tercio del fósforo disponible. Es importante para la formación ósea, almacenamiento y liberación de energía, amortiguamiento urinario acido base y en el metabolismo de los carbohidratos. Aumenta en acidosis respiratoria y láctica, cetoacidosis diabética, enfermedad renal aguda o crónica entre otras; Disminuye en alcalosis respiratoria, alcoholismo agudo, desnutrición, diálisis, entre otras. <10 días 4.5 - 9.0 ≥10 días - <2 años 4.5 - 6.7 ≥2 y <12 años 4.5 - 5.5 ≥12 y <60 años 2.7 - 4.5 ≥ 60 años 2.8 - 4.1 Molibdato UV, EQUIPO ARCHITECT 8200 Ayuno de al menos 8 horas. Evitar el consumo excesivo de antiácidos y laxantes/enemas que contengan fosfato de sodio. No obtener muestras después de la hemodiálisis. Evitar la hemólisis de la muestra. Suero Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE : MUESTRA TIEMPO RESULTADOS LIMITACIONES ENTREGA : : : Tubo tapa verde , lleno hasta la marca para los servicios de urgencia 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Antes de 4 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. - Tubo mal rotulado o con nombre ilegible - Tubo no transportado en las condiciones adecuadas - Muestras hemolizadas y lipémicas. 2 horas para pacientes de los servicios de urgencia. Pacientes hospitalizados y ambulatorios durante el día. Los valores séricos varían a lo largo del día, siendo los más bajos en la mañana. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 165 FÓSFORO URINARIO MUESTRA AISLADA Bioquímica USO PREFERENTE DE LA : El fósforo inorgánico constituye sólo un tercio del fósforo disponible. Es PRUEBA importante para la formación ósea, almacenamiento y liberación de energía, amortiguamiento urinario acido base y en el metabolismo de los carbohidratos. Aumenta en acidosis extra renal, fracturas óseas (transitoriamente), hiperparatiroidismo; Disminuye en hipoparatiroidismo o paratiroidectomía, seudoparatiroidismo, entre otras. RANGOS DE REFERENCIA : 40 – 140 mg/dL METODO : Molibdato UV, EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Antes de la recolección de la orina se procede a un aseo con agua y jabón de la zona que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. En el caso de los hombres se le indica que retraiga el prepucio para lavar con agua y jabón la porción distal del pene que rodea el meato urinario, posteriormente se seca la zona evitando que queden restos de fibra en la zona. Se elimina el primer chorro de orina y se recolecta la porción media en el recipiente, la porción final también se elimina. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL PERSONAL : Verifique la correcta rotulación de la muestra antes del envío al DE TOMA DE MUESTRAS Laboratorio. TIPO DE MUESTRA : Orina de segundo chorro. TIPO DE TUBO : Orina : Tubo o frasco de orina proporcionado por el laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). VOLUMEN MINIMO : 10 mL. CONDICIONES DE : Los tubos se deben transportar tapados, en posición vertical, en un TRANSPORTE recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra CONDICIONES DE RECHAZO DE : Las muestras serán rechazadas en los siguientes casos. MUESTRA - Tubo o frasco mal rotulado o con nombre ilegible - Tubo o frasco no transportado en condiciones adecuadas - Muestra con evidente signo de contaminación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 166 TIEMPO RESULTADOS LIMITACIONES ENTREGA : : 2 horas para pacientes de los servicios de urgencia. Pacientes hospitalizados y ambulatorios durante el día. Tubo u otro contenedor usado que no fuese entregado por el laboratorio invalidarán la prueba. FÓSFORO URINARIO DE 24 HORAS Bioquímica USO PREFERENTE DE LA : El fósforo inorgánico constituye sólo un tercio del fósforo disponible. Es PRUEBA importante para la formación ósea, almacenamiento y liberación de energía, amortiguamiento urinario acido base y en el metabolismo de los carbohidratos. Aumenta en acidosis extra renal, fracturas óseas (transitoriamente), hiperparatiroidismo; Disminuye en hipoparatiroidismo o paratiroidectomía, seudoparatiroidismo, entre otras. RANGOS DE REFERENCIA : 0.4– 1.3 gr/24 hrs METODO : Molibdato UV, EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Durante el período de recolección, el paciente debe beber líquidos en forma normal a menos que haya recibido otra indicación. No debe beber alcohol. Los pasos a seguir son los siguientes: • Orine a las 7:00 Hrs. de la mañana y elimine esta orina • Recoger, a partir de ese momento, en un recipiente limpio y seco, toda la orina que elimine a lo largo del día, la noche siguiente, incluyendo la primera orina de la mañana siguiente. • Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. La identificación debe contener el nombre y los dos apellidos del paciente escritos con letra legible. • Transportar la orina a la Unidad de Laboratorio Clínico. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de todos los recipientes antes de enviar la DE TOMA DE MUESTRAS muestra al laboratorio. TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Orina : Recipientes limpios, proporcionados por el Laboratorio VOLUMEN MINIMO : Toda la orina recolectada en 24 horas o una alícuota de 10 mL. CONDICIONES DE : Los recipientes se deben transportar tapados, en posición vertical, dentro TRANSPORTE de un contenedor sólido a prueba de derrames y a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde el término de la recolección de la muestra. CONDICIONES DE RECHAZO DE : Las muestras serán rechazadas en los siguientes casos MUESTRA - Recipiente o frasco mal rotulado o con nombre ilegible - Recipiente o frasco no transportado en condiciones adecuadas. - Incorrecta recolección de orina de 24 hrs. TIEMPO ENTREGA : 2 horas para pacientes de los servicios de urgencia. Pacientes RESULTADOS hospitalizados y ambulatorios durante el día. LIMITACIONES : Uso de recipientes no entregados por el Laboratorio invalidarán la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 167 FSH, HORMONA FOLICULO ESTIMULANTE Bioquímica USO PREFERENTE DE LA : La determinación de esta hormona es útil para conocer la integridad del PRUEBA eje hipotálamo-hipofisiario y como ayuda para catalogar las disfunciones gonadales en primarias o secundarias. RANGOS DE REFERENCIA : Adultos: Hombres : 1.37 a 13.58 mIU/mL Mujeres Fase Folicular: 3.35 a 21.63 mIU/mL Peak Medio Ciclo : 4.97 a 20.82 mIU/mL Fase Lútea: 1.11 a 13.99 mIU/mL Postmenopáusicas: 2.58 a 150.53 mIU/mL METODO : Inmunoensayo de Micropartículas Quimiluminiscentes EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. En lo posible indicar, al personal de toma de muestra, la etapa del ciclo menstrual en que se encuentra la paciente. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra. En lo posible preguntar, al paciente, la DE TOMA DE MUESTRAS etapa del ciclo menstrual en que se encuentra. TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO RESULTADOS : : 2 mL para pacientes pediátricos, 2 a 4 mL para pacientes adultos. Temperatura ambiente. : : Antes de 2 horas desde la toma de muestra Las muestras serán rechazadas en los siguientes casos. Tubo mal rotulado o con nombre ilegible Tubo no transportado en condiciones adecuadas Muestra hemolizadas, Lipémicas o con alto índice icterico. 1 día hábil ENTREGA : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 168 GAMMA-GLUTAMILTRANSPEPTIDASA (GGT) Bioquímica USO PREFERENTE DE LA : Se observan aumentos importantes en enfermedades hepáticas PRUEBA obstructivas y obstrucción post hepática, colestasis intrahepática, cirrosis biliar primaria, atrasia infantil de vías biliares. Aumentos moderados cursan en lesiones ocupantes de espacio y mononucleosis infecciosa; detección de alcoholismo y colestasis durante o inmediatamente después de la gestación. RANGOS DE REFERENCIA : Hombres : 12 – 64 U/L (Adultos). Mujeres : 9 – 36 U/L (Adultos). METODO : Szasz, enzimático colorimétrico. EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas antes de la prueba y abstinencia de alcohol 24 horas antes de la prueba. INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO : DE MUESTRA TIEMPO RESULTADOS LIMITACIONES ENTREGA : : : Tubo tapa verde para servicios de urgencia los 2 mL para pacientes pediátricos, 4 mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Antes de 2 horas desde la toma de muestra. Las muestras serán rechazadas en los siguientes casos. Tubo mal rotulado o con nombre ilegible Tubo no transportado en condiciones adecuadas Muestra hemolizadas o Lipémicas 2 horas para pacientes de los servicios de urgencia. Pacientes hospitalizados y ambulatorios durante el día. Los medicamentos que aumentan la GGT son: fenitoína, fenitoína sódica, fenobarbital, glutetimida y matacualona. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 169 GASES EN SANGRE Bioquímica USO PREFERENTE DE PRUEBA RANGOS DE REFERENCIA LA : Evaluación de la función respiratoria y metabólica y del estado ácido- base. : Parámetros Gas arterial Gas venoso pH 7.35 – 7.45 7.32 – 7.42 PCO2 35 – 45 mmHg 41 – 51 mmHg PO2 75 - 100 mmHg 40 - 51 mmHg HCO3 22 – 26 mEq/L 24 - 28 mEq/L Exceso de bases -3 a +3 -3 a +3 Saturación de O2 > 95% 40 – 70% Potenciometría Debe reposar durante 30 minutos antes de la recolección de la muestra. Gases arteriales: Las arterias frecuentemente utilizadas para la toma de muestra son la cubital y radial. Una vez localizada la arteria por palpación, se elimina la protección de la aguja de la jeringa y se realiza la punción. Al finalizar la punción, retirar la aguja y tapar con el tapón especial, agitar suavemente la jeringa para mezclar la sangre con el anticoagulante. Presionar por unos segundos el lugar de la punción con una gasa o con algodón para detener la salida de la sangre. Dejar colocado un pequeño apósito en la zona de punción. Si se observan burbujas de aire en la jeringa, deben ser eliminadas lo antes posible. Enviar inmediatamente la muestra al laboratorio. Gases venosos: Se realiza el mismo procedimiento que para gases arteriales, siendo la vena cubital la más utilizada. Sangre arterial o venosa (según indicación médica). Sangre : Jeringa con flush de heparina 1 a 3 mL. Transportar la jeringa sellada con tapa roja (sin aguja), en un contenedor refrigerado a 4º C. Menos de 30 minutos de tomada la muestra. Muestra sin sello o con coágulos, burbujas y exceso de heparina. Pabellón 30 minutos y resto máximo 2 horas. METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS : : : : : : : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 170 GLUCOSA EN SANGRE Bioquímica USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES : : : : Para el diagnóstico y seguimiento de trastornos en el metabolismo de los hidratos de carbono (diabetes mellitus, hipoglicemia neonatal, hipoglicemia idiopática). 70 – 105 mg/dL (adultos) 60 – 100 mg/dL (niños) Enzimático (Hexoquinasa). EQUIPO ARCHITECT 8200 Ayuno de 8 a 12 horas antes de la prueba. No administrar hipoglicemiantes orales hasta la obtención de la muestra. Evitar la hemólisis de la muestra. Suero Suero : Suero : Tubo tapa roja o amarilla Tubo tapa verde para pacientes de urgencia. Adultos y pediátricos: 4 mL Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Máximo 1 hora desde la toma de muestra. Muestra mal rotulada, no estar en ayunas, hemolizadas, lipémicas. 2 horas para pacientes de los servicios de urgencia. Pacientes hospitalizados y ambulatorios durante el día. En pacientes diabéticos, la muestra sanguínea debe obtenerse antes del tratamiento con insulina o con hipoglicemiantes orales. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 171 GLUCOSA EN ORINA AISLADA Bioquímica USO PREFERENTE DE LA : La glucosuria aparece cuando el nivel de glucosa en la sangre excede la PRUEBA capacidad de reabsorción de los túbulos renales; es decir el filtrado glomerular contiene más glucosa que la que el túbulo puede reabsorber. La causa más importante de glucosuria es la diabetes mellitus, pero también se observa en otras patologías como: pancreatitis, trombosis coronaria, glucosuria alimenticia, cáncer pancreático, dolor, excitación, hipertiroidismo, tirotoxicosis, gigantismo, acromegalia, síndrome de Cushing, traumatismo encéfalo craneano. RANGOS DE REFERENCIA : 1 – 15 mg/dL. (Adultos). METODO : Enzimático (Hexoquinasa). EQUIPO ARCHITECT 8200 INSTRUCCIONES AL PACIENTE : Para el caso de mujeres se sugiere que no cursen con su período menstrual o leucorrea al momento de recolectar la orina, en caso contrario deben cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. En caso de adultos ver instructivo en página 39. Si el lactante es niña, colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Si el lactante es niño, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de la muestra. TIPO DE MUESTRA : Primera orina de la mañana, segundo chorro. CONTENEDOR : Frascos o botellas limpias VOLUMEN MINIMO : 10 mL. CONDICIONES DE : Los tubos, frascos y botellas se deben transportar tapados en posición TRANSPORTE vertical, en un contenedor o gradilla a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 1 hora desde la toma de muestra RECHAZO DE MUESTRA : Muestra mal rotulada y/o frasco mal sellado TIEMPO ENTREGA : Dentro del día hábil. RESULTADOS LIMITACIONES : Carbamazepina, corticosteroides, furosemida, tiazidas, EDTA, carbonato de litio, ácido nicotínico producen un aumento de la glucosa urinaria. Aspirina, ácido ascórbico, levodopa, dipirona, disminuyen su [ ] urinaria. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 172 GLUCOSA EN ORINA DE 24 HORAS Bioquímica USO DE LA PRUEBA : La glucosuria aparece cuando el nivel de glucosa en la sangre excede la capacidad de reabsorción de los túbulos renales; es decir el filtrado glomerular contiene más glucosa que la que el túbulo puede reabsorber. La causa más importante de glucosuria es la diabetes mellitus, pero también se observa en otras patologías como por ejemplo en la pancreatitis, trombosis coronaria, glucosuria alimenticia, cáncer pancreático, dolor, excitación, hipertiroidismo, tirotoxicosis, gigantismo, acromegalia, síndrome de Cushing, traumatismo encéfalo craneano. RANGOS DE REFERENCIA : 0 – 0,5 g/día METODO : Enzimático (Hexoquinasa). EQUIPO ARCHITEC 8200 INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : Ver instructivo para paciente de recolección orina 24 horas, página 40. Evitar recolección durante periodo menstrual. Verificar la correcta rotulación de la muestra. Si se envía una alícuota de orina al laboratorio, registrar en solicitud de examen el total de diuresis en ml. Toda la orina recolectada en 24 horas o una alícuota de 10 mL. CONTENEDOR : Frascos limpios o Botellas limpias con tapa. VOLUMEN MINIMO : Enviar toda la orina recolectada o una alícuota de 10 mL. CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : Los tubos, frascos y botellas se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Máximo 2 horas desde la toma de muestra. RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : Frasco mal rotulado y mal sellado. Dentro del día hábil. Fármacos que interfieren: carbamazepina, corticosteroides, furosemida, tiazidas, EDTA, carbonato de litio, ácido nicotínico producen un aumento de la glucosa urinaria. Aspirina, ácido ascórbico, levodopa, dipirona, disminuyen su concentración urinaria. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 173 HANTA VIRUS TEST RAPIDO Bioquímica USO PREFERENTE DE LA : Este ensayo detecta la presencia de anticuerpos anti- Puumala Virus., que PRUEBA presenta altísima reactividad cruzada con la cepa Andes, perteneciente a nuestro país. RANGOS DE REFERENCIA : Los resultados pueden ser; Positivo o Negativo. METODO : Inmuno ensayo que detecta la presencia de anticuerpos. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas antes de la prueba INSTRUCCIONES AL : Se debe tomar la bateria completa de exámenes que contempla; PERSONAL DE TOMA DE hemograma con fórmula (tubo tapa lila), test rápido (tubo tapa roja) y tubo MUESTRAS para envío a Santiago (10 ml) con el respectivo formulario. Verificar la correcta rotulación de los tubos. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO RESULTADOS LIMITACIONES : 3 a 5 mL de sangre : Temperatura ambiente : 30 minutos desde la toma de muestra : Se rechazarán las muestras en los siguientes casos: - Muestras sin rotular - Muestras mal rotuladas - Muestras derramadas o manchadas ENTREGA : 2 horas : Este test no es válido en otros liquidos biológicos como; saliva, LCR y orina. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 174 HAPTOGLOBINA Inmunología USO PREFERENTE DE PRUEBA LA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : La haptoglobina se fija a la hemoglobina liberada durante la lisis de eritrocitos. Esta es una proteína de fase aguda y puede alcanzar niveles muy elevados durante estados inflamatorios. 50 - 320 mg/dL Determinación cuantitativa de la Haptoglobina en suero humano, mediante Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) VOLUMEN MINIMO CONDICIONES DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS : Tubo tapa lila (EDTA) : : 0,5 mL (tubo de 4mL) Temperatura ambiente. : : Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestra mal rotulada, hemolizadas, Lipémicas 3 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 175 HEMOCULTIVO Microbiología USO DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE ENTREGA RESULTADOS : : : : : Sospecha de bacteremia en pacientes con o sin foco aparente de infección. Sin desarrollo bacteriano. Cultivo bacteriano en viales de sistema automatizado Bact Alert. Ver instrucciones en página 64 . : Sangre : Vial hemocultivo adulto Médula Vial hemocultivo pediátrico : Recién nacidos: 1-2 ml Lactantes de 1 mes a 2 años: 2-3 ml Niños mayores de 2 años y <12 años: 3-5 ml Adolescentes: 10 ml Adultos: 10 ml : Trasladar no refrigerado : Inmediato al laboratorio. : 5 días hábiles HEMOGLOBINA GLICOSILADA (HBA1C) Bioquímica USO DE LA PRUEBA : Seguimiento a largo plazo de la glicemia en pacientes con Diabetes Mellitus. Proporciona una estimación del riesgo de complicaciones micro y macrovasculares. En su empleo clínico de rutina, por lo general basta en realizar la prueba cada 3 o 4 meses. En situaciones como la diabetes gestacional o al modificar el tratamiento puede ser conveniente medir la HBA1C en intervalos de 2 a 4 semanas. RANGOS DE REFERENCIA : No diabéticos : 4-6 % Diabéticos controlados : 6-8 % Diabéticos no controlados : hasta 20% METODO : La medición de hemoglobina total es colorimétrica y la HbA1c es Inmunoturbidimétrica. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : No requiere instrucciones específicas. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa lila (anticoagulante EDTA) VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADO LIMITACIONES : : : : 4 mL o el tubo lila hasta la marca. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Máximo 4 horas desde la toma de muestra. Muestra mal rotulada y muestra lipémica. 1 día hábil Cualquier situación que produzca una ↓en la vida media de los eritrocitos disminuirá los valores de HBA1C. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 176 HEMOGRAMA Hematología USO DE LA PRUEBA RANGOS DE REFERENCIA : : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : LIMITACIONES : Diagnóstico de patologías hematológicas, infecciones, hemorragias Recuento de eritrocitos: Hombre: 4.6 – 6.2 millón/μL Mujer: 4.2 – 5 millón/μL Hematocrito: Hombre: 39 – 48% Mujer: 36 – 47% Hemoglobina: Hombre: 13 – 16 g/dL Mujer: 12 – 15.6 g/dL HCM: 27 – 31 pg VCM: 82 – 97 fL CHCM: 32 – 36 g/dL Recuento absoluto de leucocitos: 4.5 -11.0 miles/µL. Recuento absoluto de granulocitos: 2.7-7.0 miles /µL. Recuento absoluto de linfocitos: 1.2-3.5 miles/µL. Recuento absoluto de monocitos: 4.0-8.0 miles/µL Fórmula leucocitaria: Basófilos: 0 – 1% Baciliformes: 0 – 4% Linfocitos:30 – 40% Eosinófilos: 2 – 4% Segmentados: 40 – 60% Monocitos: 4- 8% Impedancia: tamaño y recuento celular. Colorimetría: Hemoglobina. Fórmula leucocitaria: Microscopía. Ayuno de al menos 8 horas. Una vez extraída la muestra, se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. Sangre. Tubo tapa lila (anticoagulante Tubo minicollect EDTA). para RN 4 mL para pacientes adultos, 2 mL para pacientes pediátricos y 0.5 mL para RN. Los tubos se deben transportar en posición vertical, tapados, en un contenedor o gradilla a temperatura ambiente. 4 horas desde la toma de la muestra. No se procesan muestras coaguladas y microcoaguladas. 2 horas para servicios de urgencia. Dentro del día para pacientes hospitalizados y ambulatorios. La observación microscópica sólo se realiza a pacientes hemato oncológicos, recién nacidos con sospecha de sepsis, sospecha de hantavirus y perfiles hematológicos con alarmas de blastos. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 177 HEMOPHILUS INFLUENZAE TIPO B, ANTICUERPOS ANTI Inmunología USO DE LA PRUEBA : No repuesta inmune a vacunación con HIB (vacuna Conjugada) RANGOS DE REFERENCIA : Suero ≥ 0,15 µg/mL METODO : ELISA : Ayuno de al menos 8 horas. INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS : Sangre TIPO DE MUESTRA TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : 2 a 8 ml CONDICIONES TRANSPORTE : Temperatura ambiente. : Enviar al laboratorio máximo 4 horas desde la toma de muestra. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) Refrigerar la muestra a 2-8 °C por un máximo de 48 horas, en caso contrario congelar a -20 °C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. RECHAZO DE MUESTRA Muestras purulentas, con hemólisis, lipemia e ictericia ENTREGA RESULTADOS : 30 días corridos. HEMORRAGIAS OCULTAS Parasitologia USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : Para el diagnóstico de hemorragias digestivas. Negativo. Inmunocromatografía INSTRUCCIONES AL PACIENTE Ver Instrucciones a paciente para hemorragia oculta, página 42. : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Verificar que la rotulación de las muestras esté correcta y corresponda al paciente. TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO : Deposición fresca. Frasco limpio, sin aditivos, seco, y de boca ancha con tapa entregado por el laboratorio. 2 grs cada muestra. CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : Los frascos se deben transportar tapados en posición vertical, en un contenedor a temperatura ambiente. 24- 48 horas desde la obtención de la última muestra. ENTREGA RESULTADOS : 2 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 178 HEPATITIS A, ANTICUERPOS IgM Inmunología USO DE LA PRUEBA : La hepatitis A es a una enfermedad autolimitada y con frecuencia constituye un trastorno subclínico, especialmente en niños. Los ensayos para la detección de anticuerpos IgM frente al VHA están indicados como ayuda en el diagnóstico de infecciones por el virus de la hepatitis A agudas o recientes (anticuerpos habitualmente presentes entre 6 y 9 meses). RANGOS DE REFERENCIA : < 0,80 s/co METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la detección cualitativa de anticuerpo IgM frente al virus de la hepatitis A (IgM antiVHA) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Evitar hemólisis de la muestra de sangre. TIPO DE MUESTRA TIPO DE TUBO : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE : Temperatura ambiente. Enviar al laboratorio máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. : 2 días hábiles CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 179 HEPATITIS B, ANTIGENO DE SUPERFICIE Inmunología USO DE LA PRUEBA : Los ensayos para la detección del HBsAg se utilizan en el pesquisaje de HBsAg en sangre y productos sanguíneos para evitar la transmisión del virus de la hepatitis B (VHB) a los receptores de estos productos. Igualmente, estos ensayos se utilizan para diagnosticar posibles infecciones por VHB, así como para hacer un seguimiento de los pacientes ya infectados. De este modo, se puede distinguir entre el paciente con infección pasada y el paciente que se convierte en portador crónico del virus RANGOS DE REFERENCIA : 0 – 2 S/N METODO : Inmunoanálisi quimioluminiscente de micropartículas (CMIA) para la detección de cualitativa del antígeno de superficie del virus de la hepatitis B (HBsAg) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Sangre (suero) Sangre (suero) VOLUMEN MINIMO : 0,5 mL (tubo de 4mL) CONDICIONES TRANSPORTE : : Temperatura ambiente. Enviar al laboratorio máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : : Tubo tapa roja o amarilla Muestras lipémicas o hemolizadas. 1 día hábil Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 180 HEPATITIS B, TEST RAPIDO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS : : : : El virus de Hepatitis B es responsable de cuadros de hepatitis agudas y crónicas. Las hepatitis agudas pueden ser asintomáticas o presentar síntomas de gravedad variable que pueden llegar hasta hepatitis fulminante en algunos casos, por su parte la hepatitis crónica puede también ser asintomática o producir lesiones en el hígado de gravedad mas o menos importante que pueden originar una cirrosis hepática con una posible evolución hacia un hepatocarcinoma. Este test está restringido sólo a pacientes con indicación de diálisis urgente. Los resultados pueden ser; Positivo o Negativo. Inmunocromatografía lateral para la detección del antígeno. Ayuno de 4 horas antes de la prueba. La correcta rotulación de los tubos. TIPO DE MUESTRA TIPO DE TUBO : : Sangre Sangre VOLUMEN MINIMO : 3 a 5 mL de sangre CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente 30 minutos desde la toma de muestra RECHAZO DE MUESTRA : ENTREGA RESULTADOS : LIMITACIONES : Se rechazarán las muestras en los siguientes casos: Muestras sin rotular Muestras mal rotuladas Muestras derramadas o manchadas 2 horas Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. Un resultado negativo en HBs Ag no permite descartar una infección por el virus de la hepattis B esto puede ocurrir en caso de que la concentración de HBs Ag sérica sea menor a la sensibilidad analítica del reactivo. Este test no es válido en otros líquidos biológicos como; saliva, LCR y orina. : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 181 HEPATITIS C, ANTICUERPOS Inmunología USO DE LA PRUEBA : El VHC es un virus que se transmite por vía sanguínea y esta estrechamente ligado a la transfusión de sangre. En estudios serológicos con enzimoinmunoanálisis para la detección de anticuerpos frente a antígenos recombinantes del VHC (anti-VHC) se ha demostrado que el VHC es el agente causal de la mayoría de las hepatitis no A no B (HNANB) transmitidas por vía sanguínea, así como de las adquiridas en la comunidad. La presencia de anti-VHC indica que un individuo puede haberse infectado por el VHC, que puede ser portador de VHC infeccioso o que puede transmitir la infección por VHC. Si bien la mayoría de los individuos infectados permanecen asintomáticos, la infección por VHC puede producir complicaciones como hepatitis crónica, cirrosis o riesgo elevado de carcinoma hepatocelular. La instauración del pesquisaje de anti-VHC en los donantes de sangre mediante EIA ha dado como resultado una notable disminución del riesgo de hepatitis transmitidas por transfusión. RANGOS DE REFERENCIA : 0 – 1 S/co METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la detección cualitativa de los anticuerpos frente al virus de la hepatitis C (anti-VHC) en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Evitar hemólisis de la muestra de sangre. VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 1 día hábil Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. : : : : Sangre (suero) Sangre (suero) : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 182 HEPATITIS C, TEST RAPIDO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : : El virus de la Hepatitis C es responsable de cuadros de hepatitis aguda y crónica aunque la mayoría de las personas que contraen el virus desarrollan a forma crónica. Dependiendo de los años de exposición al virus puede llegar a provocar cirrosis. Este test está restringido sólo a pacientes con indicación de diálisis urgente. Los resultados pueden ser; Positivo o Negativo. Inmuno cromatografía para la detección de anticuerpos anti-HpC. Ayuno de 4 horas antes de la prueba. La correcta rotulación de los tubos. : : Sangre Sangre VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA : : : : ENTREGA RESULTADOS : LIMITACIONES : 3 a 5 mL de sangre Temperatura ambiente 30 minutos desde la toma de muestra Se rechazarán las muestras en los siguientes casos: - Muestras sin rotular - Muestras mal rotuladas - Muestras derramadas o manchadas 2 horas Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. Factores reumáticos y anticuerpos antinucleares pueden dar resultados falsos positivos. Este test no es válido en otros líquidos biológicos como; saliva, LCR y orina. : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 183 HERPES SIMPLE 1 VIRUS, SEROLOGIA IgG Inmunologia USO DE LA PRUEBA : Las infecciones por HSV (virus Herpes Simple) se distribuyen por todo el mundo. Luego de la exposición al virus, el periodo de incubación es de aproximadamente una semana (2 a 26 días). Los signos incluyen Herpes labial y genital. Las infecciones por Herpes en recién nacidos (menos de 6 semanas de edad) son frecuentemente devastadoras. Sin tratamiento, la mortalidad excede el 65%. Muchos de los sobrevivientes quedan con secuelas de desarrollo. La mayor parte de las infecciones se produce durante el parto cuando el neonato atraviesa un canal del parto infectado. HSV-1 se transmite principalmente por las secreciones orales a otras áreas de piel y las infecciones recurrentes son frecuentes. A su entrada en zonas de la piel, el HSV-1 replica e instiga a una respuesta inflamatoria local. La primo infección por HSV-1 suele ser asintomática, pero ocasionalmente se evidencia una irritación leve de las encías, la garganta y/o los ojos. RANGOS DE REFERENCIA : Negativo METODO : IFI (Ensayo por inmunofluorescencia indirecta) para la determinación y valoración de anticuerpos HSV-1 IgG en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE : : CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : 0,5 mL (tubo de 4mL) Temperatura ambiente. Enviar al laboratorio máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 184 HERPES SIMPLE 2 VIRUS, SEROLOGIA IgG Inmunologia USO DE LA PRUEBA : Las infecciones por HSV (virus Herpes Simple) se distribuyen por todo el mundo. Luego de la exposición al virus, el periodo de incubación es de aproximadamente una semana (2 a 26 días). Los signos incluyen Herpes labial y genital. Las infecciones por Herpes en recién nacidos (menos de 6 semanas de edad) son frecuentemente devastadoras. Sin tratamiento, la mortalidad excede el 65%. Muchos de los sobrevivientes quedan con secuelas de desarrollo. La mayor parte de las infecciones se produce durante el parto cuando el neonato atraviesa un canal del parto infectado. El HSV-2 se transmite principalmente por vía de transmisión sexual. La primo infección es más común entre los adolescentes, los homosexuales y prostitutas. La infección por HSV-2 puede afectar el área oral y genital, las regiones perianal y anal, asociándose con fiebre, malestar y anorexia. Las lesiones recurrentes de por HSV-2 suelen ser menos graves que las primo infecciones. RANGOS DE REFERENCIA : Negativa METODO : IFI (Ensayo por inmunofluorescencia indirecta) para la determinación y valoración de anticuerpos HSV-2 IgG en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Enviar al laboratorio máximo 4 horas desde toma de muestra. Refrigerar la muestra a 2-8° C por un máximo de 48 horas, en caso contrario congelar a -20° C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 7 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 185 HIDATIDOSIS IgG Inmunología USO DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADO : : : : : : : Sospecha Hidatidosis (infección Echinococcus granulosos) Negativo ELISA Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Suero Suero : Tubo tapa roja o amarilla : : : 0,5 mL. a 1,0 mL. Temperatura ambiente. Máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8 °C por un máximo de 48 horas, en caso contrario congelar a -20 °C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 5 días hábiles : HIV, COMBO ANTIGENO - ANTICUERPO Inmunología USO DE LA PRUEBA : Ayuda diagnóstica de infecciones por virus de inmunodeficiencia humana tipo 1 y 2. RANGOS DE REFERENCIA : Menor de 1 S/CO es considerado no reactivo METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la detección cualitativa simultánea de antígeno p24 del VIH y de los anticuerpos frente al virus de la inmunodeficiencia humana de tipos 1 y 2 (VIH-1/VIH-2) en suero humano.. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de los tubos con el código del paciente. Verificar uso del formulario de “Solicitud de examen HIV”, ver Anexo Nº2, página ¡Error! Marcador no definido.. Verificar que el formulario antes mencionado esté completo, con todos los datos y firmas del paciente (código, fecha de nacimiento y firma) y del médico que solicita el análisis (nombre legible y firma) TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADO : : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 1 día hábil Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 186 HIV TEST RAPIDO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : : : ENTREGA RESULTADOS : LIMITACIONES : El virus de Inmunodeficiencia Humana (HIV), de los que existen dos subtipos (HIV1 Y HIV2), ha sido reconocido como el agente etiológico de el Síndrome de Inmunodeficiencia Adquirida (SIDA). Este test está restringido a los siguientes casos: Pacientes en trabajo de parto con un embarazo no controlado, Pacientes con indicación de diálisis urgente. Los resultados pueden ser; Positivo o Negativo. Detección de anticuerpos de HIV1 y HIV2 con un Inmunoensayo basado en el principio Inmunocromatografía. Ayuno de 8 horas antes de la prueba Verificar la correcta rotulación de los tubos con el código del paciente. Verificar uso del formulario de “Solicitud de examen HIV”, ver Anexo Nº2, página ¡Error! Marcador no definido.. Verificar que el formulario antes mencionado esté completo, con todos los datos y firmas del paciente (código, fecha de nacimiento y firma) y del médico que solicita el análisis (nombre legible y firma) Sangre Sangre : Tubo tapa roja o amarilla 3 a 5 mL de sangre Temperatura ambiente 30 minutos desde la toma de muestra Se rechazarán las muestras en los siguientes casos: - Muestras sin rotular - Muestras mal rotuladas - Muestras derramadas o manchadas - Muestras sin consentimiento o con consentimiento incompleto. 2 horas Examen confidencial, para visualizar resultado en web de laboratorio se requiere ingreso de médico con con clave personal. Un resultado negativo no puede excluir la posibilidad de infección con HIV. Pueden ocurrir falsos negativos en los siguientes casos: En individuos infectados con HIV muy inmuno deprimidos pueden presentar mediciones de anticuerpos bajo e límite de detección del test. Pacientes que se encuentran en el período de ventana que tienen niveles bajos de anticuerpos. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 187 HTLV I/II, ANTICUERPOS Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : El virus linfotrópico de células T humano, fue el primer retrovirus oncogénico humano conocido. Provoca una hemopatía maligna denominada leucemia/linfoma de células T del adulto (ATL) y desarrolla también una mielopatía subaguda denominada Paraparesia Espástica Tropical (TSP) ó mielopatía asociada al HTLV-I (HAM). Estudios epidemiológicos confirman la presencia de una prevalencia mixta del HTLV-I y del HTLV-II en distintas poblaciones de alto riesgo, como los usuarios de drogas intravenosas y los receptores de transfusiones. Negativo ELISA (Ensayo por inmuno absorción ligado a enzimas) para la detección de anticuerpos contra HTLV-I y HTLV-II en suero humano. Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. : : Sangre (Suero) Sangre (Suero) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) RECHAZO DE MUESTRAS ENTREGA RESULTADOS : : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 5 días hábiles : : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 188 INFLUENZA tipo A y B, TEST RAPIDO Bioquímica USO DE LA PRUEBA : La enfermedad de la gripe normalmente hace acto de presencia con la aparición repentina de fiebre, escalofríos, cefalea, mialgias y tos no productiva. Este examen, es un análisis diferenciado, que permite distinguir los antígenos virales de la Influenza A como los de la Influenza B a partir de una misma muestra procesada, sirviendo para ayuda diagnostica de la infección por unos de los virus. RANGOS DE REFERENCIA : Negativa METODO : Prueba cualitativa inmunocromatográfica para la detección directa de los antígenos de Influenza tipo A y B en muestras de aspirados nasofaríngeos. INSTRUCCIONES AL PACIENTE : Requiere Ayuno INSTRUCCIONES AL PERSONAL : Evitar recogida de muestras sanguinolentas o con contenido de leche u DE TOMA DE MUESTRAS otra sustancia alimenticia. TIPO DE MUESTRA : Aspirado Nasofaríngeo TIPO DE TUBO : Aspirado Nasofaríngeo : Tubo o frasco estéril con 5 ml de PBS VOLUMEN MINIMO : 3,0 mL (aspiración mínima) CONDICIONES TRANSPORTE : Debe realizarse lo más pronto posible después de la recogida, con medio de transporte PBS. TIEMPO DE TRANSPORTE : Máximo 4 horas con refrigeración Muestras con más de 24 horas de la recogida, sin que sean adecuadamente refrigeradas. ENTREGA RESULTADOS ** : ** 2 horas para servicios de urgencia. LIMITACIONES : No recolectar las muestras en recipientes que contengan suero humano, detergente o preservativos, ya que puede causar interferente en la prueba. **IMPORTANTE: Este examen se encuentra disponible SOLO si ha sido recomendado dentro del algoritmo de estudio de casos de infección por virus respiratorio por el MINSAL y por lo tanto es variable su disponibilidad en cada de campaña de invierno. Consultar en laboratorio. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 189 INMUNOELECTROFORESIS DE SANGRE, CADENAS LIVIANAS Inmunología USO DE LA PRUEBA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : ALBUMINA 3.63 - 4.91 g/dL ALFA1 0.11 - 0.35 g/dL ALFA2 0.65 - 1.17 g/dL BETA 0.74 - 1.26 g/dL GAMMA 0.58 - 1.74 g/dL METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Ayuno de 12 horas antes de la prueba (sangre). INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : 500 ul de Suero CONDICIONES TRANSPORTE : Temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra. ENTREGA RESULTADOS : 7 días hábiles LIMITACIONES : Hemólisis, lipemia e ictericia invalidan la prueba. INMUNOELECTROFORESIS DE ORINA, CADENAS LIVIANAS Inmunología USO DE LA PRUEBA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : Presencia o Ausencia de componente proteico monoclonal. METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Instrucciones de recolección de orina 24 horas. INSTRUCCIONES AL PERSONAL : Verificar Diuresis (volumen total de orina en 24 horas) DE TOMA DE MUESTRAS TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Envase recolector de orina 24 horas. VOLUMEN MINIMO : 200 ml de orina (tomados de la orina 24 horas). CONDICIONES TRANSPORTE : Temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra, (una vez completas las 24 horas de recolección) ENTREGA RESULTADOS : 7 días hábiles LIMITACIONES : No puede ser orina parcial. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 190 INMUNOELECTROFORESIS DE SANGRE, CADENAS PESADAS Inmunología USO DE LA PRUEBA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : ALBUMINA 3.63 - 4.91 g/dL ALFA1 0.11 - 0.35 g/dL ALFA2 0.65 - 1.17 g/dL BETA 0.74 - 1.26 g/dL GAMMA 0.58 - 1.74 g/dL METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Ayuno de 12 horas antes de la prueba (sangre). INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : 500 µl de Suero CONDICIONES TRANSPORTE : Temperatura ambiente. TIEMPO DE TRANSPORTE : 4 horas desde la toma de muestra. ENTREGA RESULTADOS : 7 días hábiles LIMITACIONES : Hemólisis, lipemia e ictericia invalidan la prueba. INMUNOELECTROFORESIS DE ORINA, CADENAS PESADAS Inmunología USO DE LA PRUEBA : Neoplasia de Linfocitos B: Mieloma múltiple, Macroglobulinemia de Waldestrom, desnutrición, síndrome nefrótico. RANGOS DE REFERENCIA : Presencia o Ausencia de componente proteico monoclonal. METODO : Método Helena Laboratorios para la separación y cuantificación de proteínas por electroforesis en acetato de celulosa. (TITAN III) INSTRUCCIONES AL PACIENTE : Instrucciones de recolección de orina 24 horas. INSTRUCCIONES AL PERSONAL : Verificar Diuresis (volumen total de orina en 24 horas) DE TOMA DE MUESTRAS TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Envase recolector de orina 24 horas. VOLUMEN MINIMO : 200 ml de orina (tomados de la orina 24 horas). CONDICIONES TRANSPORTE : Temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas desde la toma de muestra, (una vez completas las 24 horas de recolección). ENTREGA RESULTADOS : 7 días hábiles LIMITACIONES : No puede ser orina parcial. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 191 INMUNOGLOBULINA IgA – IgM – IgG Inmunología USO DE LA PRUEBA : Las inmunoglobulinas son producidas por las células plasmáticas como respuesta inmuno humoral al contacto inmunitario con un antígeno. Después del contacto inicial, en la reacción primaria, se forman los anticuerpos de clase IgM, seguidos posteriormente por anticuerpos IgG e IgA. Concentraciones bajas de inmunoglobulinas en sueros se presentan en estados de inmunodeficiencia primarios, como también en inmunodeficiencias secundarias, por ejemplo tumores malignos avanzados, leucemia linfática, mieloma múltiple y macroglobulinemia de Waldenström. Concentraciones elevadas de Igs en el suero, son ocasionadas por aumentos policlonales y oligoclonales de las Igs como por ejemplo, en enfermedades del hígado (hepatitis, cirrosis hepática), infecciones agudas y crónicas, enfermedades auto inmunitarias, como también en el cordón umbilical de recién nacidos con infecciones intrauterinas y perinatales. : IgG: 850 – 1850 mg/dL RANGOS DE REFERENCIA IgA: 47 – 520 mg/dL IgM: 50 – 236 mg/dL : Determinación cuantitativa de las inmunoglobulinas (IgG, IgA e IgM) en METODO suero humano y IgG Humana en orina y LCR, mediante Inmuno nefelometría (BN ProSpec) INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS : Sangre ( Suero) TIPO DE MUESTRA Sangre ( Plasma con Heparina o EDTA) LCR TIPO DE TUBO : Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) : Tubo tapa lila (EDTA) LCR VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS ENTREGA RESULTADOS : : : : : Tubo Estéril 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 2 horas desde tomada la muestra Muestras lipémicas o hemolizadas 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 192 IgE TOTAL Inmunología USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : La Inmunoglobulina IgE es el responsable del cuadro de una alergia de tipo inmediato. En las enfermedades alérgicas como dermatitis atópica o asma la concentración de IgE en el suero está, por lo general, correlacionada con la intensidad de la exposición al alergeno y la severidad de los síntomas alérgicos. En enfermedades por parásitos se encuentra igualmente un aumento notorio de la concentración de IgE en el suero. En casos aislados de mielomas – IgE, aparecen concentraciones extremadamente altas. 0 – 100 UI/mL Determinación cuantitativa de las inmunoglobulina IgE en suero humano, mediante Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS ENTREGA RESULTADOS : : : : : Tubo tapa lila (EDTA) 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 2 horas desde tomada la muestra Muestras lipémicas o hemolizadas 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 193 INSULINA Bioquímica USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : Los niveles de insulina son usados con mayor frecuencia para la evaluación de hipoglicemia. Las muestras para la determinación de insulina en estos pacientes deberían tomarse cuando la glucosa sanguínea sea ≤ 50 mg/dL. Los niveles de Insulina en estos pacientes deberían estar bajo 20 μU/mL. Niveles más altos sugiere una neoplasia secretora de insulina. 2.7 – 10.4 mg/dl (rango establecidos en individuos con 8 hrs. de ayuno y glucosa basal <140 mg/dl ) Enzimoinmunoensayo quimioluminiscente de micropartículas. Una vez tomada la muestra se debe dejar en hielo y enviar inmediatamente al laboratorio. No requiere instrucciones específicas. Sangre Sangre : Tubo tapa roja o amarilla 4 mL Los tubos se deben transportar a temperatura ambiente, tapados, en posición vertical, en un recipiente y dentro de un contenedor sólido a prueba de derrames. 30 minutos desde la toma de muestra. Muestra hemolizadas, mal rotulada durante el día Los resultados se afectan si el paciente está en terapia con Insulina. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 194 INSULINEMIA, CURVA DE (2 MUESTRAS) Bioquímica USO PREFERENTE DE LA : Los valores de insulina aislada o basal son usados con mayor frecuencia PRUEBA para la evaluación de hipoglicemia. Las muestras para la determinación de insulina en estos pacientes deberían tomarse cuando la glucosa sanguínea sea 50 mg/dL. Los niveles de insulina en estos pacientes deberían estar bajo 20 UI/mL. Niveles más altos sugiere una neoplasia secretora de insulina. Los niveles de insulina, correlacionados simultáneamente con los de glucosa, a diferentes tiempos después de la carga de glucosa, se utilizan para el diagnóstico de trastornos en el metabolismo de la glucosa, principalmente en la diabetes mellitus. La respuesta a insulina es dependiente de la edad. Se recomienda interpretar las concentraciones de insulina del plasma en relación a los valores de glucosa determinadas simultáneamente. RANGOS DE REFERENCIA : Insulina basal: 2.7 – 10.4 Uu/ml en adultos. Insulina post carga : <60 uU/ml METODO : Enzimoinmunoensayo quimioluminiscente de micropartículas. ARCHITEC i 2000 INSTRUCCIONES AL PACIENTE : Ver instrucciones de test de sobrecarga de glucosa en página 39. INSTRUCCIONES AL PERSONAL : Respete los tiempos de toma de muestra indicado por el médico. DE TOMA DE MUESTRAS La curva de insulinemia no debe realizarse a pacientes que tengan una glicemia basal ≥ 140 mg/dL. Primero se debe obtener la muestra basal; inmediatamente después el paciente debe ingerir la dosis de glucosa, la cual debe disolverse en agua sin que sobrepase los 300mL e ingerirse en un tiempo máximo de 5 minutos, desde aquí se debe comenzar a tomar el tiempo para las demás muestras. Se toma una muestra basal y a los 120 minutos post ingesta de glucosa oral en agua. Cantidad de azúcar a ingerir: Adultos: 75 g en 300 mL de agua. Niños: 1.75 g por Kg de peso (máximo 75 g) Rotular cada tubo con el nombre y dos apellidos del paciente indicar en cada uno claramente el tiempo al que corresponde. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : 2 tubos con 4 mL de sangre cada uno. Los tubos se deben transportar a temperatura ambiente, tapados, en posición vertical, en un recipiente y dentro de un contenedor sólido a prueba de derrames. Máximo 30 minutos desde la toma de muestra. Muestra hemolizadas, mal rotulada 1 día hábil. Los resultados se afectan si el paciente está en terapia con Insulina. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 195 ION CLORO Serologia USO PREFERENTE RANGOS DE REFERENCIA : : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADO : : : : : LIMITACIONES : Confirmación de Fibrosis Quística. Negativo: < 40 mEq/L Limítrofe: 40 – 60 mEq/L Positivo: > 60 mEq/L Coulometría (Cloridómetro digital: titula concentración de ión cloro) Profesional Enfermera/o a cargo de la toma de muestra, explicará el procedimiento a los padres o apoderado del paciente (ejemplo: venir hidratado, no presentar edema, no tener erosiones o sarpullidos en la piel, etc). Toma de muestra a cargo de un profesional capacitado (Enfermero/a) para manejar la toma de muestra con sistema Macroduct® Sudor (obtenida por estimulación de la sudoración en el antebrazo por iontoforesis con pilocarpina). Sistema Macroduct® 15 µL Una vez tomada la muestra, enviar inmediatamente al laboratorio. Inmediato Se realizan los días lunes y miércoles. 24 horas desde su recepción en el laboratorio. Volumen inferior a 15 µL. LACTATO DESHIDROGENASA (LDH) Bioquímica USO DE LA PRUEBA : La LDH se mide principalmente para diagnosticar condiciones en las cuales hay daño tisular. Se puede encontrar elevada principalmente en hepatitis, mononucleosis infecciosa, tumores malignos, linfomas, anemias distrofia muscular, infarto agudo al miocardio, pancreatitis, cirrosis y necrosis del hígado. Los niveles disminuidos no son clínicamente importantes. RANGOS DE REFERENCIA : <5 días : 290 – 775 U/L 5-10 días : 545 – 2000 U/L >10 días a 2 años:180 -430 > 2 a 12 años : 110 – 295 >12 y < 60 años : 100 - 190 METODO : Lactato/piruvato estandarización IFCC. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas antes de la prueba INSTRUCCIONES AL : Evitar la hemólisis de la muestra. PERSONAL TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADO : : : 4 mL para pacientes adultos adulto y pediátrico. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra. Muestra hemolizada aunque sea leve. 1 día hábil. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 196 LACTATO DESHIDROGENASA (LDH) LIQUIDOS BIOLOGICOS Bioquímica USO DE LA PRUEBA : La LDH se mide principalmente para diagnosticar condiciones en las cuales hay daño tisular. Se puede encontrar elevada principalmente en hepatitis, mononucleosis infecciosa, tumores malignos, linfomas, anemias distrofia muscular, infarto agudo al miocardio, pancreatitis, cirrosis y necrosis del hígado. Los niveles disminuidos no son clínicamente importantes. RANGOS DE REFERENCIA : Exudado > 300 - Transudado < 300 U/L METODO : Lactato/piruvato estandarización IFCC. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas antes de la prueba INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Líquido biológico TIPO DE TUBO : Tubo estéril. VOLUMEN MINIMO : 4 mL para pacientes adultos adulto y pediátrico. CONDICIONES TRANSPORTE : Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. TIEMPO DE TRANSPORTE : 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : Muestras coaguladas ENTREGA RESULTADOS : 1 días hábil LIMITACIONES : Una leve hemólisis invalida la prueba. Oxalatos y salicilatos inhiben la LDH. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 197 LH, HORMONA LUTEINIZANTE Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : La determinación de los niveles de LH es esencial para la predicción de la ovulación, en la evaluación de infertilidad, en el diagnostico de desordenes gonadal-pituitarios. Los niveles normales en la mujer varían a lo largo del ciclo reproductor. La elevación de LH en la mujer se observa en casos de hipofunción ovárica primaria (Síndrome de Turner), ovario poliquístico y en la Menopausia, en el hombre elevaciones de la LH se asocia a hipogonadismo primario o secundario. Hombres : 1.14 a 8.75 mIU/mL Mujeres Fase Folicular : 2.39 a 6.60 mIU/mL Peak Medio Ciclo : 9.06 a 74.24 mIU/mL Fase Lútea : 0.90 a 9.33 mIU/mL Posmenopáusicas : 10.39 a 64.57 mIU/mL. Inmunoensayo de Micropartículas Quimioluminiscentes. INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Ayuno de 8 horas antes de la prueba Evitar la hemólisis de la muestra. : : Sangre Sangre VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : Tubo tapa roja o amarilla 4 mL para pacientes adultos adulto y pediátrico. Temperatura ambiente. 1 hora desde la toma de muestra. RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : Muestra hemolizadas, mal rotulada, ictericia , lipémico Durante el día El clomifeno y la espironolactona provocan aumento de LH. La digoxina, megestrol, noretindrona, progesterona disminuyen los niveles de LH. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 198 LIPASA Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA : La lipasa sérica aumenta rápidamente en pacientes con pancreatitis aguda y recurrente, absceso pancreático o pseudoquístico, trauma pancreático, cáncer pancreático, obstrucción del ducto biliar común e ingestión de drogas tóxicas al páncreas. También aumenta por varias condiciones inflamatorias de la cavidad abdominal, enfermedades del tracto biliar, absceso abdominal y falla renal. Se describe que la lipasa es más específica que la amilasa total en el diagnóstico de pancreatitis aguda. 8 – 78 U/L METODO : Colorante de quinona. INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : No requiere ayuno. No requiere instrucciones específicas. : : Sangre Sangre VOLUMEN MINIMO : 4 mL para pacientes adultos adulto y pediátrico. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente. 4 horas desde la toma de muestra. RECHAZO DE MUESTRA ENTREGA RESULTADOS : : Muestra hemolizadas, mal rotulada. 1 día hábil. : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 199 LÍQUIDO ASCÍTICO, CITOQUÍMICO DE Bioquímica USO DE LA PRUEBA : Establecer la causa de acumulación de líquido anormal en el abdomen, cuya presencia ha sido determinada por el examen físico o radiografía. RANGOS DE REFERENCIA : Aspecto : Transparente. Color : Amarillo pálido. Proteínas : Exudado > 20 – 25 g/L. Transudado : < 20 – 25 g/L. Glucosa : hombres : 40 – 70mg/dl Mujeres : 40 – 70mg/dl Niños : 60-80 mg/dl Recuento celular: hasta 300/µL. Recuento diferencial: hasta 25% de polimorfonucleares. METODO : Macroscópico Microscópico Espectrofotométrico (glucosa y proteínas) INSTRUCCIONES AL PACIENTE : Ayuno de 12 horas previo al examen. Vaciar la vejiga inmediatamente antes de la prueba. INSTRUCCIONES AL PERSONAL : La paracentesis o punción de la cavidad abdominal, debe ser realizada por DE TOMA DE MUESTRAS un médico, en estrictas condiciones de esterilidad, en jeringa heparinizada. Una vez extraída la muestra se debe trasvasijar a los contenedores mencionados más adelante. TIPO DE MUESTRA : Líquido ascítico. TIPO DE TUBO : Tubo de cultivo VOLUMEN MINIMO : 5 a 10 mL. CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Menos de 1 hora de tomada la muestra. RECHAZO DE MUESTRA : Líquidos coagulados, hemorrágicos. ENTREGA RESULTADOS LIMITACIONES : : Dentro del día. 2 horas en caso de muestras de servicios de urgencia. La bilis, orina, materia fecal, o sangre del sitio de la punción o de los vasos sanguíneos puede interferir con el análisis de la muestra. Los líquidos coagulados o hemorrágicos no se deben procesar. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 200 LÍQUIDO CEFALORRAQUIDEO, CITOQUÍMICO DE Bioquímica USO DE LA PRUEBA : Herramienta útil en el diagnóstico de meningitis bacteriana, micótica, micobacteriana y amebiana, procesos malignos, hemorragia subacarnoidea, esclerosis múltiple y trastornos desmielinizantes. RANGOS DE REFERENCIA : Aspecto: Claro. Color: Incoloro. Proteínas: 15 – 40 mg/dl Glucosa: hombres: 40-70mg/dl mujeres: 40-80mg/dl niños: 60 - 80mg/dl. Recuento celular: 0 – 5 leucocitos/µL en adultos. 0 – 30 leucocitos/µL en RN. Recuento diferencial: 0 – 8% polimorfonucleares. 92 – 100% mononucleares. METODO : Macroscópico Microscópico Espectrofotométrico (glucosa y proteínas) INSTRUCCIONES AL PACIENTE : Sin indicaciones especiales. INSTRUCCIONES AL PERSONAL : La punción lumbar debe ser realizada por un médico, en estrictas DE TOMA DE MUESTRAS condiciones de esterilidad, en jeringa heparinizada. Una vez extraída la muestra se debe trasvasijar a los contenedores mencionados más adelante. TIPO DE MUESTRA : Líquido cefalorraquídeo. TIPO DE TUBO : Tubo de cultivo VOLUMEN MINIMO : 3 – 10 mL en cada tubo. CONDICIONES TRANSPORTE : Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Si se tarda más de 1 hora en llegar al laboratorio, la muestra se debe refrigerar y transportar en estas condiciones. TIEMPO DE TRANSPORTE : Transportar inmediatamente al laboratorio. RECHAZO DE MUESTRA : Lipemia ENTREGA RESULTADOS : Dentro del día. 2 horas en caso de muestras de servicios de urgencia. LIMITACIONES : No se pueden procesar las muestras, con lipemia severa, con hiperproteinemia o hiperglicemia debido a que estas arrojan pseudohiponatremia. Muestras hemolizadas alteran los resultados del Potasio. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 201 LÍQUIDO PLEURAL, CITOQUÍMICO DE Bioquímica USO PREFERENTE DE LA : Estudio etiológico del derrame pleural. El exudado resulta de la PRUEBA enfermedad pleural, siendo dos los mecanismos de formación del derrame pleural: aumento en la permeabilidad de los capilares (como en la neumonía) y obstrucción linfática (como en el linfoma). El transudado resulta de la alteración en los mecanismos de homeostasis que gobiernan la formación y absorción del líquido pleural. Ocurre en la disminución de la presión coloidosmótica del plasma o en el aumento de la presión hidrostática en la circulación mayor o menor. Ante un Transudado la actitud debe dirigirse sólo hacia la patología casual (insuficiencia cardiaca, cirrosis, nefrosis, etc.). Ante un exudado se ha de intentar aclarar la etilogía de la enfermedad pleural. RANGOS DE REFERENCIA : Aspecto: Claro Color: Amarillo pálido Proteínas: g/dl Glucosa: 60-100 mg/dl Recuento celular: hasta 1000/mm3 Recuento diferencial: hasta 25% de Polimorfonucleares METODO : Macroscópico Microscópico Glucosa : Hexoquinasa Proteína cloruro bencetonio INSTRUCCIONES AL PACIENTE : No requiere indicaciones especiales. INSTRUCCIONES AL PERSONAL : La punción pleural o toracocentesis, debe ser realizada por un médico, en DE TOMA DE MUESTRAS estrictas condiciones de esterilidad, en jeringa heparinizada. Una vez extraída la muestra se debe trasvasijar a los contenedores mencionados más adelante y llevar inmediatamente al laboratorio. TIPO DE MUESTRA : Líquido pleural TIPO DE TUBO : Tubo de cultivo VOLUMEN MINIMO : 3 – 10 mL en cada tubo. CONDICIONES TRANSPORTE : Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. TIEMPO DE TRANSPORTE : Una vez extraída la muestra, ésta se debe transportar inmediatamente al laboratorio. RECHAZO DE MUESTRA : Líquido coagulado y muy hemorrágico ENTREGA RESULTADOS : Dentro del día. 2 horas en caso de muestras de servicios de urgencia. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 202 LÍQUIDO PLEURAL, pH Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS : : : : TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : RECHAZO DE MUESTRA ENTREGA RESULTADOS : : La determinación del valor de pH en líquido pleural es muy útil en la evaluación de los derrames pleurales. En ausencia de acidosis sanguínea, el descenso del pH pleural se correlaciona, bien con la disminución de la glucosa o con el incrementode LDH. Tiene así una gran utilidad en el diagnóstico diferencial de los exudados, además permite estimar la evolución y el pronóstico del proceso subyacente. La acidosis del líquido pleural (pH<7,3) se ha encontrado en la ruptura esofágica (incidencia del 100 % después de 24 h, pH=6,00), empiema (pH=5,5-7,29), pleuresía reumática (pH=7,00) y con un pH entre 7,00 y 7,29 las pleuresías pronósticas y terapéuticas en los derrames paraneumónicos y neoplásicos. En los primeros, un pH<7,10 asociado a glucosa menor de 40 mg/dL y LDH mayor de 1 000 U/L, es indicación de drenaje para su adecuada resolución. En los segundos, un pH<7,3 predice una supervivencia corta, elevada rentabilidad de la biopsia pleural y la citología, y respuesta pobre a la pleurodesis química. pH ≥ 7.3 Tira reactiva No requiere indicaciones especiales. La punción pleural o toracocentesis, debe ser realizada por un médico, en estrictas condiciones de esterilidad, en jeringa heparinizada. Una vez extraída la muestra se debe trasvasijar a los contenedores mencionados más adelante y llevar inmediatamente al laboratorio. Líquido pleural Tubo de cultivo Jeringa heparinizada. 1 a 3 mL. Las jeringas se deben transportar tapadas herméticamente, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a 4°C. Una vez extraída la muestra, ésta se debe transportar inmediatamente al laboratorio. Líquido coagulado o muy hemorrágico Dentro del día. 2 horas en caso de muestras de servicios de urgencia. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 203 LÍQUIDO SINOVIAL, CITOQUÍMICO DE Bioquímica USO DE LA PRUEBA : Su estudio proporciona información útil para el diagnóstico de artritis supurativa aguda, artritis por ácido úrico (gota) o pirofosfato cálcico (pseudogota). También es útil en el diagnóstico diferencial de las artritis: traumática, reumática, tuberculosa, bacteriana aguda, fiebre reumática, LES, etc. RANGOS DE REFERENCIA : Aspecto: Claro a ligeramente turbio. Color: Amarillo pálido. Glucosa: 60 – 100 mg/dL. Recuento celular: hasta 200 x µL. Recuento diferencial PMN: 0 – 20%, MN: 75 – 100%. METODO : Macroscópico Microscópico Espectrofotométrico (glucosa y proteínas). INSTRUCCIONES AL PACIENTE : Idealmente ayuno de 6 horas o más para permitir el equilibrio de la glucosa entre el líquido y el plasma. INSTRUCCIONES AL PERSONAL : La punción articular o artrocentésis, debe ser realizada por un médico, en DE TOMA DE MUESTRAS estrictas condiciones de esterilidad, en jeringa heparinizada. Una vez extraída la muestra se debe trasvasijar a los contenedores mencionados más adelante. TIPO DE MUESTRA : Líquido articular. TIPO DE TUBO : Tubo de cultivo Jeringa heparinizada. VOLUMEN MINIMO : 5 a 10 mL. CONDICIONES TRANSPORTE : Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. TIEMPO DE TRANSPORTE : Transportar inmediatamente al laboratorio. RECHAZO DE MUESTRA : Líquidos contaminados Líquido coagulado o muy hemorrágico ENTREGA RESULTADOS : Dentro del día 2 horas en caso de muestras de servicios de urgencia. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 204 LITIO, NIVELES PLASMÁTICOS DE Bioquímica USO DE LA PRUEBA : La medición de niveles de Litio se utiliza en la evaluación de la terapia con este medicamento. Se ha observado que la respuesta a la terapia ha mejorado en 2 a 3 veces con la aplicación de una adecuada monitorización terapéutica. Una baja relación dosis/respuesta y un rango terapéutico estrecho hacen de esta droga un excelente candidato para aumentar la eficacia terapéutica a través de la monitorización de sus niveles. RANGOS DE REFERENCIA : Terapia de mantenimiento: 0.6 – 1.2 mEq/L Concentración tóxica: > 1.5 mEq/L METODO : Colorimétrico INSTRUCCIONES AL PACIENTE : 12 horas post dosis. INSTRUCCIONES AL PERSONAL : Se debe indicar en la orden la hora de toma de muestra, edad del paciente, DE TOMA DE MUESTRAS dosis diaria (mg.), última dosis (hora y mg.). Tiempo habitual de muestreo: 10 – 12 horas después de la última dosis. Evite la hemólisis. Una vez tomada la muestra se debe enviar inmediatamente al laboratorio. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : : 4 mL para pacientes adultos adulto. Temperatura ambiente. 4 horas desde la toma de muestra. RECHAZO DE MUESTRA : ENTREGA RESULTADOS : Muestra hemolizadas, mal rotulada. Muestra tomada en tubo de tapa verde con Heparina de Litio. Se realizan los días miércoles de cada semana. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 205 MAGNESIO Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : : VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : : : Evaluación de alteraciones por malabsorción, pancreatitis, desórdenes de la depuración renal y control del tratamiento de la toxemia del embarazo. Valores aumentados se pueden encontrar en la deshidratación, insuficiencia renal aguda o crónica, diabetes mellitus descompensada, insuficiencia adrenocortical, enfermedad de Addison, trauma tisular, hipotiroidismo, LES, mieloma múltiple, pacientes con ingesta de antiácidos que contienen Magnesio, mujeres en tratamiento con sulfato de Magnesio por pre-eclampsia o eclampsia. Valores disminuidos se asocian con una ingesta inadecuada y/o una absorción anómala, pancreatitis aguda, hipoparatiroidismo y alcoholismo crónico. 1.3 – 2.1 mEq/L Arsenazo Ayuno de al menos 8 horas. Evitar la hemólisis de la muestra y el uso prolongado del torniquete. No tomar la muestra durante la hemodiálisis. Sangre Sangre : Tubo tapa roja o amarilla 4 mL para pacientes pediátricos, pacientes adultos (servicios de UPC, Diálisis y transplante renal adulto y pediátrico. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra. Muestra hemolizadas, mal rotulada. Dentro del día hábil. Fármacos que interfieren: Aspirina (terapia prolongada), Litio, Progesterona, Triamtereno, Vitamina D y sales de Magnesio (antiácidos y laxantes), provocan un aumento de Magnesio en el suero. Salbutamol, Aldosterona, Aminoglicósidos, sales de Calcio, Cisplatino, Ciclosporina, Digoxina, Furosemida, diuréticos Tiazídicos, Etanol, Glucagón, Insulina (altas dosis en coma diabético) Anticonceptivos orales y Fenitoina, provocan una disminución de Magnesio en el suero. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 206 MAGNESIO ORINA AISLADA Bioquímica USO PREFERENTE DE LA : Evaluación de alteraciones por malabsorción, pancreatitis, desórdenes de PRUEBA la depuración renal y control del tratamiento de la toxemia del embarazo. Valores aumentados se pueden encontrar en la deshidratación, insuficiencia renal aguda o crónica, diabetes mellitus descompensada, insuficiencia adrenocortical, enfermedad de Addison, trauma tisular, hipotiroidismo, LES, mieloma múltiple, pacientes con ingesta de antiácidos que contienen Magnesio, mujeres en tratamiento con sulfato de Magnesio por pre-eclampsia o eclampsia. Valores disminuidos se asocian con una ingesta inadecuada y/o una absorción anómala, pancreatitis aguda, hipoparatiroidismo y alcoholismo crónico. RANGOS DE REFERENCIA : 3.4 - 11.4 mEq/L METODO : Arsenazo INSTRUCCIONES AL PACIENTE : Ver instructivo para pacientes para toma de muestra de orina, página 39. INSTRUCCIONES AL PERSONAL : Preguntar a la paciente sobre su período menstrual o presencia de DE TOMA DE MUESTRAS leucorrea al momento de recolectar la orina. En ambos casos se deberá cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Verificar correcta identificación de la muestra. TIPO DE MUESTRA : orina TIPO DE TUBO : Frasco orina tapa roja VOLUMEN MINIMO : 10 mL para pacientes pediátricos, pacientes adultos (servicios de UPC, Diálisis y transplante renal adulto y pediátrico. CONDICIONES TRANSPORTE : Los frascos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente TIEMPO DE TRANSPORTE : 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : ENTREGA RESULTADOS : 1 día hábil. LIMITACIONES : La hemólisis invalida la prueba. Fármacos que interfieren: Aspirina (terapia prolongada), Litio, Progesterona, Triamtereno, Vitamina D y sales de Magnesio (antiácidos y laxantes), provocan un aumento de Magnesio en el suero. Salbutamol, Aldosterona, Aminoglicósidos, sales de Calcio, Cisplatino, Ciclosporina, Digoxina, Furosemida, diuréticos Tiazídicos, Etanol, Glucagón, Insulina (altas dosis en coma diabético) Anticonceptivos orales y Fenitoina, provocan una disminución de Magnesio en el suero. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 207 MAGNESIO ORINA 24 HORAS Bioquímica USO DE LA PRUEBA : Evaluación de alteraciones por malabsorción, pancreatitis, desórdenes de la depuración renal y control del tratamiento de la toxemia del embarazo. Valores aumentados se pueden encontrar en la deshidratación, insuficiencia renal aguda o crónica, diabetes mellitus descompensada, insuficiencia adrenocortical, enfermedad de Addison, trauma tisular, hipotiroidismo, LES, mieloma múltiple, pacientes con ingesta de antiácidos que contienen Magnesio, mujeres en tratamiento con sulfato de Magnesio por pre-eclampsia o eclampsia. Valores disminuidos se asocian con una ingesta inadecuada y/o una absorción anómala, pancreatitis aguda, hipoparatiroidismo y alcoholismo crónico. RANGOS DE REFERENCIA : 6 - 10 mEq/día METODO : Arsenazo INSTRUCCIONES AL PACIENTE : Ver instructivo para paciente de recolección de orina 24 horas, página 40. INSTRUCCIONES AL PERSONAL : Verificar correcta identificación de la muestra. DE TOMA DE MUESTRAS Si se envía una alícuota de orina, se debe registrar en solicitud de examen la diuresis total en ml. TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO O FRASCO : Contenedor de 5 litros que contiene HCl 6 mol/l, por lo que DEBE ser solicitado al laboratorio. VOLUMEN MINIMO : Entregar TODA la orina colectada. CONDICIONES TRANSPORTE : Los contenedores se deben transportar tapados en posición vertical y a temperatura ambiente. TIEMPO DE TRANSPORTE : 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : Mal rotulado Contenedor no apropiado. ENTREGA RESULTADOS : 2 días hábiles. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 208 MICROHEMAGLUTINACIÓN ANTI Treponema pallidum (MHA TP) Serología USO DE LA PRUEBA : Detección de anticuerpos contra el Treponema pallidum. RANGOS DE REFERENCIA : No Reactivo METODO : Hemoaglutinación pasiva. Test Treponémico. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre. TIPO DE TUBO : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS ENTREGA RESULTADOS LIMITACIONES : : : Adultos: 5 mL. RN y lactantes: 2 mL. Los tubos se deben transportar verticalmente a temperatura ambiente en un contenedor o gradilla y enviarla inmediatamente al laboratorio. Si las muestras no son enviadas el mismo día al laboratorio, deberán ser centrifugadas, enviar el suero y guardarlas en refrigerador hasta su envío, dentro de las 72 horas siguientes. Si las muestras se envían por correo, los tubos plásticos deben estar sellados herméticamente y conservar la cadena de frío. Inmediato Muestras hemolizadas y lipémicas El examen se realiza el día martes de cada semana. La técnica de TPHA puede dar lugar a reacciones cruzadas con otras enfermedades de infecciones treponémicas y a reacciones falsamente positivas con muestras de pacientes afectos de mononucleosis, lepra, drogadictos o enfermedades autoinmunes. Ocasionalmente, en estados iniciales de sífilis, los anticuerpos específicos no pueden ser detectados por esta técnica. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 209 MIELOGRAMA Hematología USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL TIPO DE MUESTRA TIPO DE TUBO : : : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADO LIMITACIONES : : : : Diagnóstico de patologías hematológicas o descarte de patologías hematológicas no definidas en exámenes de rutina. Rangos de acuerdo a criterio del hematólogo. Punción esternal o cresta ilíaca de médula ósea, aspirado y tinción de la muestra obtenida. No requiere ayuno. La punción debe ser realizada por un médico hematólogo. Médula ósea. Láminas de vidrio (portaobjeto). 4 láminas con el extendido de médula ósea. Las láminas se deben transportar a temperatura ambiente y adosadas al formulario de solicitud de exámenes. Durante el día. No aplica Depende de médico hematológo responsable del informe. Depende del operador, cantidad de muestra y extensión del frotis. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 210 MICROALBUMINURIA AISLADA Bioquímica USO PREFERENTE DE LA : Constituye un marcador de enfermedad renal temprana que permite PRUEBA actuar a fin de evitar la progresión de la enfermedad hacia estados más avanzados. Las complicaciones en el paciente con diabetes pueden tener consecuencias graves como la ceguera, infarto del miocardio, amputaciones y diálisis renal. Todas estas complicaciones pueden detectarse y tratarse a tiempo si se realizan exámenes periódicos de microalbuminuria. La microalbuminuria en muestra aislada de orina debe relacionarse con la creatininuria RANGOS DE REFERENCIA : Razón microalbuminuria(ug)/creatininuria(mg) >30 METODO : Inmunoturbidimétrico. INSTRUCCIONES AL PACIENTE : Adulto ver Instructivo de toma de muestra orina, página 39. INSTRUCCIONES AL PERSONAL : TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADO LIMITACIONES : : : : : : Preguntar a la paciente sobre su período menstrual o presencia de leucorrea al momento de recolectar la orina. En ambos casos se deberá cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Lactante femenino colocar la bolsa colectora sobre la zona del periné fijando la parte adhesiva a la piel. Lactante masculino, colocar la bolsa colectora alrededor del pene. Es necesario revisar periódicamente la bolsa colectora para verificar su correcta posición (podría salirse y perder la esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, ya que la contaminación con microbiota fecal es un problema bastante frecuente. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa colectora frecuentemente. Verificar la correcta rotulación de la muestra. Si se envía una alícuota de orina, se debe registrar en solicitud de examen la diuresis total en ml. Primera orina de la mañana, segundo chorro Contenedor con una capacidad de 5 litros otorgado por el laboratorio, que debe estar limpio y seco. Para la alícuota usar Tubo estéril de vidrio con tapón de algodón hidrófobo. 10 mL Los tubos, frascos y botellas se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Máximo 2 horas desde la toma de muestra. Mal rotulado. 1 día hábil Para interpretar los resultados se deben considerar factores que pueden modificar los niveles de albúmina en la orina, tales como el ejercicio físico, la infección urinaria, fiebre, etc. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 211 MICROALBUMINURIA DE 24 HORAS Bioquímica USO DE LA PRUEBA : Constituye un marcador de enfermedad renal temprana que permite actuar a fin de evitar la progresión de la enfermedad hacia estados más avanzados. Las complicaciones en el paciente con diabetes pueden tener consecuencias graves como la ceguera, infarto del miocardio, amputaciones y diálisis renal. Todas estas complicaciones pueden detectarse y tratarse a tiempo si se realizan exámenes periódicos de microalbuminuria. Cuantificación en orina de 24 horas en mejor marcador en comparación con microalbuminuria en orina aislada. RANGOS DE REFERENCIA : 0 – 30 mg/24hrs METODO : Inmunoturbidimétrico. INSTRUCCIONES AL PACIENTE : Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Ver instructivo para pacientes para recolección orina 24 horas, página 40. INSTRUCCIONES AL PERSONAL : Verificar la correcta rotulación de todos los recipientes antes de enviar la DE TOMA DE MUESTRAS muestra al laboratorio. Si el volumen de orina es medido en la Toma de muestra, se debe anotar el valor en el formulario de solicitud de exámenes. TIPO DE MUESTRA : Orina de 24 horas TIPO DE TUBO : Contenedor Frasco orina tapa roja VOLUMEN MINIMO : Toda la orina recolectada en 24 horas o una alícuota de 10 mL. CONDICIONES TRANSPORTE : Los tubos, frascos y botellas se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 2 horas desde la toma de muestra. CONDICIONES DE RECHAZO DE : Mal rotulado. MUESTRA ENTREGA RESULTADOS : 1 día hábil LIMITACIONES : Para interpretar los resultados se deben considerar factores que pueden modificar los niveles de albúmina en la orina, tales como el ejercicio físico, la infección urinaria, fiebre, etc. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 212 MYCOPLASMA, ANTICUERPOS IgM –IgG Inmunología USO PREFERENTE DE LA : El Mycoplasma pneumoniae es un patógeno del tracto respiratorio que se PRUEBA adhiere a través de secreciones respiratorias de personas infectadas y con enfermedades del tracto respiratorio inferior. Produce principalmente infección respiratoria grave en niños mayores y adultos jóvenes (neumonía "atípica"), aunque la enfermedad más leve aparece en lactantes menores y niños pequeños, situación que dificulta en ocasiones el diagnóstico y por ende el manejo de la misma. RANGOS DE REFERENCIA : Negativo METODO : ELISA (Ensayo por inmuno absorción ligado a enzimas) para la determinación cualitativa y semicuantitativa de anticuerpos IgG e IgM de Mycoplasma pneumoniae en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. TIPO DE MUESTRA : Sangre (Suero) TIPO DE TUBO : Sangre (Suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorios) RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADO : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 2 horas desde tomada la muestra Centrifugar y separar la muestra si no será procesada en el día. Refrigerar a 2-8°C por máximo 48 horas o congelar a -20°C o a temperatura inferior hasta su análisis. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 2 días hábiles MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 213 NITROGENO UREICO SANGUINEO (BUN) Bioquímica USO PREFERENTE DE LA : Constituye una ayuda diagnóstica para diferenciar entre las diversas causas PRUEBA de insuficiencia renal. Indicador muy útil de función de hígado y riñón. La concentración aumenta con la edad y es mayor en hombres que en mujeres. Valores aumentados se observa en la insuficiencia renal cuando el valor del filtrado glomerular se ha reducido 1/5 del normal, en insuficiencia cardíaca congestiva, shock, hemorragias gastrointestinales, stress, IAM, enfermedad renal intrínsica aguda o crónica, dieta con alto contenido proteico. Valores disminuidos se observan en el embarazo, acromegalia, infancia, daño hepático severo, dieta baja en proteínas y alta en carbohidratos. RANGOS DE REFERENCIA : 8.9 – 25.7 mg/dl METODO : Enzimático glutamato deshidrogenada (UV) INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla Sangre VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES : : : : : Tubo tapa verde (anticoagulante heparina de litio), llenar hasta la marca para los servicios de UPC. 4mL para pacientes pediátricos, 4mL para pacientes adultos (tubo tapa roja), 4 mL (tubo tapa verde) para servicios de UP Critico. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 4 horas desde la toma de muestra. Muestra hemolizadas, Lipémicas, mal rotulada. 2 horas para pacientes de urgencia. Pacientes hospitalizados y ambulatorios durante el día. Hemólisis y lipemia invalidan la prueba. Fármacos que interfieren: Alopurinol, aminoglicósidos, cefalosporinas, cisplatino, furosemida, indometacina, metotrexato, metildopa, aspirina, anfotericina B, bacitracina, neomicina, probenecid, vancomicina, rifanpicina, propnolol, espironolactona, tetraciclina, diuréticos triazídicos, aumentan el BUN. Cloranfenicol, estreptomicina, disminuyen el BUN. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 214 ORINA COMPLETA Orinas USO DE LA PRUEBA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADO : LIMITACIONES : : : : : : : : Afecciones de las vías urinarias y renales, afecciones cardiovasculares, desequilibrio hidrosalino, trastornos metabólicos y afecciones hepáticas. Aspecto: Transparente Urobilinógeno: 0-1 mg/d) Densidad: 1016 – 1.022 g/ml pH: 4.8 – 7.4 Glucosuria: 0-15 mg/dL Nitritos: Negativo C. Cetónicos: 0-5 mg/dL eritrocitos 0-5Eri/µl Proteína: 0 – 10 mg/dl leucocitos 0-10 Leu/µl Bilirrubina: 0-0.2mg/dL) Hemoglobina: Negativo (0-5 eri/µL) Incluye la determinación físico-química mediante una tira reactiva y la observación microscópica. Principios de la tira reactiva: pH indicadores rojo de metilo, fenolftaleína y azul de bromotimol. Leucocitos: esterasas. Nitritos: ensayo de Griess. Glucosa: GOD/POD. Cuerpos cetónicos: nitroprusiato. Urobilinógeno: metoxibenceno sal de diazonio. Bilirrubina: diclorobenceno sal de diazonio. Sangre: hemoglobina y mioglobina actúan como peroxidasa sobre indicador pH produciendo cambio de coloración. En adultos ver instructivo para paciente en página 39. Lactante femenino: Colocar la bolsa recolectora sobre la zona del periné, fijando la parte adhesiva a la piel. Lactante masculino: Colocar la bolsa recolectora alrededor del pene. Revisar periódicamente la bolsa recolectora para verificar su correcta posición (podría salirse y perder esterilidad). Si antes de media hora no se ha recogido la muestra o la bolsa colectora se ensucia, hay que sustituirla, para evitar contaminación fecal. Se puede colocar el pañal para asegurar la integridad de la bolsa, revisando la presencia de orina en la bolsa recolectora frecuentemente. Si la muestra es llevada a Toma de Muestras y rotulada por el paciente, asegurarse que correspondan los datos del paciente en el rótulo. Primera orina de la mañana, segundo chorro. Frasco Estéril 10 mL Temperatura ambiente Máximo 2 horas desde la toma de muestra. Frasco mal rotulado, Derrame 2 horas para pacientes de urgencia. Pacientes hospitalizados y ambulatorios durante el día. Uso de frascos desinfectados con amonios cuaternarios produce falsos positivos de proteínas, al igual que algunos medicamentos como captopril, produce falsos positivos en cuerpos cetónicos o meropenem en leucocitos. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 215 PARASITOLÓGICO SERIADO DE DEPOSICIONES Parasitología USO PREFERENTE DE LA : Sospecha de cualquier parasitosis intestinal o elementos parasitarios que PRUEBA se eliminen con las deposiciones. RANGOS DE REFERENCIA : Ausencia de quistes, trofozoitos, ooquistes y huevos de parásitos. METODO : PAF-Burrows. INSTRUCCIONES AL PACIENTE : No debe ingerir en los últimos días antibióticos, purgantes, oleosos, antiparasitarios, carbón ni bario. Ver instructivo para paciente en página Nº 42) La cantidad de muestra no debe ser superior al volumen del fijador. INSTRUCCIONES AL PERSONAL : Verificar que la rotulación de las muestras esté correcta y corresponda al DE TOMA DE MUESTRAS paciente. TIPO DE MUESTRA : Deposición, sin contaminación con orina. TIPO DE TUBO : Frasco plástico con tapa hermética entregado por el laboratorio con fijador PAF. VOLUMEN MINIMO : 5 gr. cada muestra. CONDICIONES DE : Los frascos se deben transportar tapados en posición vertical, en un TRANSPORTE contenedor a temperatura ambiente. TIEMPO DE TRANSPORTE : Hasta 24 horas desde la obtención de la última muestra. TIEMPO ENTREGA : 3 días hábiles RESULTADOS LIMITACIONES : Para la búsqueda de huevos de Fasciola hepática se deben recolectar 10 muestras seriadas, recolectadas en 10 días seguidos, en lo posible en dos frascos diferentes. PARASITOLÓGICO EN CONTENIDO DUODENAL Parasitología USO PREFERENTE DE LA : Búsqueda de huevos de Fasciola hepática y trofozoitos de Giardia lamblia PRUEBA RANGOS DE REFERENCIA : No se observa elementos parasitarios. METODO : Concentración por centrifugación y observación microscópica. INSTRUCCIONES AL PACIENTE : No aplica. INSTRUCCIONES AL PERSONAL : Enviar todo el contenido recolectado, procurando no perder muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sondeo duodenal. TIPO DE TUBO : Tubo tapa roja. : VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADO LIMITACIONES : : : 10 mL. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. 4 horas. 2 días hábiles No se observan MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 216 PARATOHORMONA INTACTA (PTH INTACTA) Bioquímica USO PREFERENTE DE LA : La determinación de la PTH intacta permite discriminar entre pacientes PRUEBA con hiperparatiroidismo primario y pacientes hipercalcémicos no paratiroideo. RANGOS DE REFERENCIA : 15.0 – 68.3 pg/mL. METODO : Enzimoinmunoensayo Quimioluminiscentes INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Una vez tomada la muestra se debe dejar en un recipiente con agua/hielo DE TOMA DE MUESTRAS y enviar inmediatamente al laboratorio. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE DE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADO LIMITACIONES : : : : PERFIL CRITICO Bioquímica USO PREFERENTE DE PRUEBA LA : RANGOS DE REFERENCIA : 4mL para pacientes pediátricos, 4mL para pacientes adultos (tubo tapa roja), 4 mL (tubo tapa verde) para servicios de UP Critico. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 30 minutos desde la toma de muestra. Muestra hemolizada, Lipémica, mal rotulada. 2 días hábiles La lipemia, ictericia la hemólisis interfieren con el ensayo. Evaluación de la función respiratoria, metabólica, porcentaje de glóbulos rojos y nivel de hemoglobina. Incluye un conjunto de parámetros; PH, PCO2, PO2, Saturación de O2, Hematocrito, Hemoglobina, Sodio, Potasio, Cloro, Calcio iónico y Glucosa. pH: Hombres: 7,35 – 7,45 Mujeres: 7,35 – 7,44 Niños: 7,34 – 7,44 PCO2: Hombres: 22– 26 mm/Hg Mujeres: 32– 45 mm/Hg Niños: 35- 45 mm/Hg PO2: 75–100 m/Hg Saturación de O2:95 – 98 % Hematocrito: Hombres: 38 – 52 % Mujeres: 35 – 47 % Niños: 32 – 42 % Hemoglobina: Hombres: 14 – 17,5 gr/dl Mujeres: 12,3–15,3 gr/dl Niños: 11 – 15 gr/dl Sodio: 136–145 mmol/L Potasio: 3,4 – 4,7 mml/L Cloro: 98 – 107 mmol/L Calcio iónico: 4,36 – 5,2 mg/dl MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 217 Glucosa: METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA : : TIEMPO RESULTADOS : : ENTREGA : Hombres: 40 – 70 mg/dl Mujeres: 40 – 70 mg/dl Niños: 60 – 80 mg/dl Amperometría en PO2 y electrodos de ión selectivo para Sodio, Potasio, Cloro, Calcio iónico, pH y PCO2. EL pH es medido usando una membrana de vidrio de ión selectivo de hidrógeno. El PCO2 es medido con un sensor de pH modificado. El PO2 es medido amperométricamante por la generación de una corriente a la superficie del sensor. Hematocrito se obtiene por la resistencia eléctrica de la medición de la muestra de sangre. La hemoglobina es medida por la combinación de la conductividad y una medición fotométrica. La medición de glucosa está basada en el nivel de H2O2 producido durante la reacción enzimática entre las moléculas de glucosa y las de oxígeno en presencia de la enzima glucosa oxidasa. Debe reposar durante 30 minutos antes de la recolección de la muestra. Las arterias frecuentemente utilizadas para la toma de muestra son la cubital y radial. Una vez localizada la arteria por palpación, se elimina la protección de la aguja de la jeringa y se realiza la punción, extraer entre 0,6 y 1,0 ml de sangre. Al finalizar la punción retirar la aguja de la jeringa y tapar con el tapón especial que trae la jeringa, agitar suavemente la jeringa para mezclar la sangre con el anticoagulante. Presionar por unos segundos el lugar de punción con una gasa o con algodón para detener la salida de sangre. Dejar un pequeño aposito en la zona de punción. Si se observan burbujas de aire en la jeringa deben ser eliminadas lo antes posible. Enviar inmediatamente la muestra al Laboratorio en un medio refrigerado (gel refrigerante). Sangre arterial Sangre : Jeringa heparinizada de 1ml. Debe ser solicitada al Laboratorio. Entre 0,6ml y 1,0 ml de sangre Transportar la jeringa sellada con tapa de goma (o plástica), sin aguja, en un contenedor refrigerado a 4 grados Celsius. Menos de 30 minutos desde que se toma la muestra. Se rechazará y se solicitará nueva muestra en caso de: - Muestra coagulada - Jeringa con volumen insuficiente - Jeringa con burbuja de aire - Jeringa con aguja - Jeringa con manguera de mariposa amarrada y cortada - Jeringa manchada con sangre - Jeringa sin rotular o mal rotulada. Pabellón 30 minutos. Paciente de otros servicios criticos, urgencia y otros servicios clínicos; 60 minutos. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 218 PERFIL LIPIDICO Bioquímica USO PREFERENTE DE PRUEBA LA : RANGOS DE REFERENCIA : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Evaluación de riesgo de enfermedad cardiaca y vascular. Los parámetros que incluidos en el estudio son; Colesterol Total, Colesterol HDL, Colesterol LDL, Colesterol VLDL, Triglicéridos e índice Colesterol Total / HDL. Colesterol Total: Hombres 0 – 200 mg/dl Mujeres 0 – 170 mg/dl Niños 0 – 170 mg/dl Colesterol HDL: > 39 mg/dl Colesterol LDL: 0 – 130 mg/dl Colesterol VLDL: 0 – 30 mg/dl Triglicéridos: 0 – 200 mg/dl Indice Colest.T/Colest.HDL <6 Colesterol Total; Método enzimático- colorimétrico CHOD-PAP Colesterol HDL; Método enzimático-colorimétrico CHOD – PAP post precipitación con Fosfotungstato. Trigliceridos: Método de Glycerol fosfato oxidasa Colesterol LDL:Es obtenido mediante la siguiente fórmula; Colesterol LDL=Colesterol total –((Trig./5)+Colesterol HDL)). Colesterol VLDL; Es obtenido mediante la siguiente fórmula; Colesterol VLDL= Triglicéridos/5 Ayuno de 12 a 14 horas antes de la prueba. No ingerir alcohol 24 horas antes de la prueba. Consumir una dieta estable en contenido graso tres semanas antes de la prueba. La cena anterior a la prueba debe ser con bajo contenido graso. Evitar la hemólisis de la muestra, si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. Sangre Sangre : Tubo tapa roja o amarilla TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : 2ml para pacientes pediátricos, 2 a 5 ml para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 2 horas desde que se extrae la muestra. RECHAZO DE MUESTRA : Se rechazarán las muestras con hemólisis, con ictericia o lipémicas. ENTREGA RESULTADOS : 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 219 pH y BENEDICT EN DEPOSICIONES Parasitología USO PREFERENTE DE LA : Diagnóstico de intolerancia a carbohidratos, estudio del síndrome PRUEBA diarreico de evolución prolongada. RANGOS DE REFERENCIA : pH: Mayor de 5. Benedict: Ausencia de sustancias reductoras. METODO : pH: Colorimétrico. Benedict: Benedict INSTRUCCIONES AL PACIENTE : Se debe recolectar 1 muestra de deposición, sin contaminación con orina, de aproximadamente 2 gr. INSTRUCCIONES AL PERSONAL : Verificar que la rotulación de la muestra esté correcta y corresponda al DE TOMA DE MUESTRAS paciente. TIPO DE MUESTRA : Deposición fresca recién emitida, sin contaminación con orina. TIPO DE TUBO : Frasco boca ancha con tapa, limpio y seco. VOLUMEN MINIMO : 2 gr. de muestra. CONDICIONES TRANSPORTE : El frasco se debe transportar tapado en posición vertical, en un contenedor a temperatura ambiente. TIEMPO DE TRANSPORTE : Máximo 4 horas. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) ENTREGA RESULTADOS : 48 horas desde su llegada al laboratorio. LIMITACIONES : Cualquier sustancia reductora que se encuentre en las heces puede causar falsos positivos para Test de Benedict. PRE ALBUMINA Inmunología USO PREFERENTE DE PRUEBA LA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : La prealbúmina y la RbP se sintetizan en el hígado. La prealbúmina actúa como proteína ligadora de tiroxina y de RbP. La RbP es la proteína transportadora de retinol (vitamina A). las concentraciones en suero y plasma de ambas proteínas refleja la capacidad de síntesis del hígado, y disminuyen notablemente en caso de malnutrición y otros estados. Gracias a su corta vida media (aprox. 2 días y doce horas respectivamente), la prealbúmina y la RbP son idóneas para el seguimiento del estado nutricional y la eficacia de la nutrición parenteral. 25 – 45 mg/dL Determinación cuantitativa de prealbúmina (transtirretina) y proteína ligadora de retinol (RbP) en suero humano, mediante Inmuno nefelometría (BN ProSpec) Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 220 Sangre (Plasma) VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA RESULTADOS LIMITACIONES 0,5 mL (tubo de 4mL) Temperatura ambiente. : Máximo 2 horas desde tomada la muestra Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil : : : METODO : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE : : : DE : TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES Tubo tapa lila (EDTA) : : PROGESTERONA TOTAL Bioquímica USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. Deben asimismo evitarse las muestras lipémicas o hemolizadas. La evaluación clínica de la Progesterona confirma ovulación y función lútea normal en mujeres no embarazadas. Una inadecuada producción de progesterona por el cuerpo lúteo puede indicar insuficiencia lútea, lo que está asociado a infertilidad y a aborto espontáneo. Hombres <0,1 – 0,2 ng/ml Mujeres en fase folicular: <0,1-0,3 ng/mL. Mujeres fase lutea: 1,2-15,9 ng/mL. Mujeres postmenopáusicas: 0,1 – 0,2 ng/ml Embarazadas primer trimestre: 2,8 – 147,3 ng/ml Embarazadas segundo trimestre: 22,5 – 95,3 ng/ml Embarazadas tercer trimestre 27,9 – 242,5 ng/ml Inmuno análisis Quimioluminiscentes de micropartículas (CMIA). No requiere preparación especial. Evitar la hemólisis de la Muestra. Si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. Sangre Sangre : Tubo tapa roja o amarilla : : 5 mL. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y con unidad refrigerante. La estabilidad de la muestra es de 1 hora a temperatura ambiente. 1 hora desde la toma de la muestra Se rechazarán las muestras lipémicas, con hemólisis y con ictericia : 2 días hábiles : Muestras muy ictéricas (Bilirrubina > 20 mg/dL) no se deben procesar. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 221 PROTEINA C REACTIVA (PCR) Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : La PCR es miembro de la clase de proteínas de fase aguda y su nivel aumenta dramáticamente durante los procesos inflamatorios que ocurren en el cuerpo. Este incremento se debe a un aumento en la concentración plasmática de IL-6, que es producida por macrófagos, células endoteliales y linfocitos T, como también lo hacen los adipocitos. Además se ha demostrado que sus niveles se incrementan en los episodios agudos coronarios (síndromes coronarios agudos), significando un mal pronóstico tanto a corto como a largo plazo. 0 - 10 mg/L Determinación cuantitativa de la Proteína C Reactiva (PCR) en suero humano, mediante Inmunoturbidimetría (Architect). Ayuno de al menos 8 horas. Evitar hemólisis de la muestra de sangre. Sangre ( Suero) Sangre ( Plasma con Heparina o EDTA) Sangre ( Suero) : Tubo tapa roja o amarilla Sangre (Plasma) : Tubo tapa lila (EDTA) VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra RECHAZO DE MUESTRA : Muestra con hemólisis Muestras Lipémicas Refrigerar la muestra a 2-8°C. por un máximo de 48 horas, en caso contrario congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. ENTREGA RESULTADOS : LIMITACIONES : Dentro del día para pacientes pediátricos 1 día hábil para adultos No deben utilizarse muestras contaminadas, tratadas por calor o que contengan partículas visibles. CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorio) MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 222 PROTEÍNAS TOTALES SÉRICAS Bioquímica USO DE LA PRUEBA : Se utiliza principalmente para evaluar el estado nutricional, síntesis hepática y la pérdida proteica renal. Valores elevados se encuentran en mieloma múltiple, deshidratación, hiperglobulinemia, enfermedades granulomatosas, del colágeno. Valores disminuidos se observan en dietas bajas en proteínas, desnutrición, malabsorción, enfermedad hepática severa, quemaduras extensas, alcoholismo crónico, falla cardiaca, neoplasias, sobrehidratación y enfermedad renal. RANGOS DE REFERENCIA : 6,4 – 8,3 mg/dL METODO : Colorimétrico (Biuret). INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar la aplicación prolongada del torniquete durante la extracción de la DE TOMA DE MUESTRAS muestra. Evitar hemólisis de la muestra, si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : ENTREGA RESULTADOS LIMITACIONES : : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos (tubo tapa roja). Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra. Se rechazarán las muestras en caso de hemólisis y lipemia Dentro del día Fármacos que interfieren: Esteroides anabólicos, corticosteroides, corticotropina, epinefrina, insulina, progesterona, provocan un aumento en la concentración sérica. Alopurinol, estrógenos provocan una disminución. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 223 PROTEINURIA AISLADA Bioquímica USO DE LA PRUEBA : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS La proteinuria se presenta generalmente en la patología renal que cursa con un aumento de la permeabilidad del glomérulo como por ejemplo en las glomérulo nefritis, síndrome nefrótico, píelo nefritis, hipertensión arterial, carcinomas, proteinuria ortostática, tuberculosis renal, toxemia del embarazo, diabetes mellitus, gota, estados febriles agudos, quemaduras por corrientes eléctricas, etc. Normalmente puede aparecer la llamada proteinuria transitoria de causa extrarenal, como por ejemplo exceso de ingestión proteica, exposición prolongada al frío, estados emocionales intensos y después de actividades físicas excesivas. 0,01 – 0,14g/L. Turbidimétrica. Ver Instructivo para pacientes sobre toma de muestra de orina en página 39. Verifique la correcta rotulación de la muestra antes del envío al Laboratorio. RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : TIPO DE MUESTRA : Primera orina de la mañana, segundo chorro. TIPO DE TUBO : Orina VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS LIMITACIONES : : : : 10 mL. Los tubos o frascos deben ser trasladados a la brevedad posible al laboratorio, bien tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. 1 hora desde la toma de muestra. Se rechazarán las muestras en caso de contaminación con sangre. 1 día hábil. Falsos positivos pueden deberse a la contaminación con secreción vaginal, semen, pus, o sangre. : Tubo o frasco de orina proporcionado por el laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 224 PROTEINURIA DE 24 HORAS Bioquímica USO PREFERENTE DE LA : La proteinuria se presenta generalmente en la patología renal que cursa PRUEBA con un aumento de la permeabilidad del glomérulo como por ejemplo en las glomérulo nefritis, síndrome nefrótico, píelo nefritis, hipertensión arterial, carcinomas, proteinuria ortostática, tuberculosis renal, toxemia del embarazo, diabetes mellitus, gota, estados febriles agudos, quemaduras por corrientes eléctricas, etc. Normalmente puede aparecer la llamada proteinuria transitoria de causa extra renal, como por ejemplo exceso de ingestión proteica, exposición prolongada al frío, estados emocionales intensos y después de actividades físicas excesivas. RANGOS DE REFERENCIA : 0 – 0,15 g/24 horas METODO : Turbidimétrico. INSTRUCCIONES AL PACIENTE : Para la correcta valoración de los resultados de un análisis efectuado sobre orina de 24 horas es sumamente importante que la recogida de la orina sea completa. Ver instrucciones para pacientes de muestra de orina 24 horas, página 40. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : Verifique la correcta rotulación de la muestra antes del envío al Laboratorio. Si el volumen de orina es medido en la Toma de Muestra o en el servicio clínico, se debe anotar el valor de la diuresis en el formulario de solicitud de exámenes. Orina de 24 horas o una alícuota de 10 mL. Orina : Contenedor con una capacidad de 5 litros otorgado por el laboratorio, que debe estar limpio y seco. Para la alícuota usar Tubo estéril de vidrio con tapón de algodón hidrófobo. Toda la orina recolectada en 24 horas o una alícuota de 10 mL. Mantener la orina que se va recolectando refrigerada. Una vez finalizada la recolección identificar cada uno de los envases. Los tubos o frascos deben ser trasladados a la brevedad posible al laboratorio, bien tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : Se rechazarán las muestras en caso de contaminación con sangre. ENTREGA RESULTADOS : 1 día hábil LIMITACIONES : Falsos positivos pueden deberse a la contaminación con secreción vaginal, semen, pus, o sangre. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 225 PROLACTINA Bioquímica USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS La deficiencia de prolactina tiene importancia clínica en test adicionales de función hipofisiaria en pacientes ya diagnosticados de enfermedad hipofisiaria. Valores aumentados de prolactina pueden observarse en pacientes que presentan alteraciones en la fertilidad como anovulación con o sin irregularidades menstruales, amenorrea y galactorrea. El exceso de prolactina en varones podría provocar oligoespermia, impotencia o ambas. 3,46 - 19,4 ng/mL. Inmunoensayo de Micropartículas Quimiluminiscentes (CMIA) TIPO DE MUESTRA TIPO DE TUBO : : Ayuno de al menos 8 horas. Evitar hemólisis de la muestra. Si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. Sangre Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : : : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos. Temperatura ambiente 1 hora desde la toma de muestra Se rechazarán las muestras en caso de hemólisis, lipemia e ictericia ENTREGA RESULTADOS LIMITACIONES : : 1 día hábil La prolactina se encuentra elevada en pacientes con tratamiento con estrógeno, antidepresivos triciclitos, fenotiacianas, haloperidol, metildopa, butirofenonas cimetidina, metoclopramida, reserpina, y en pacientes con hipotiroidismo primario. La secreción de prolactina es episódica y se incrementa con el estrés. La prolactina puede existir en formas estructurales alternativas (Macroprolactinas) las cuales pueden presentar niveles variables de actividad fisiológica de la Prolactina. La presencia de Anticuerpos Heterófilos puede interferir en la determinación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 226 PRUEBA DE TOLERANCIA A LA GLUCOSA ORAL (PTGO) Bioquímica USO DE LA PRUEBA : Diagnóstico de diabetes mellitus, intolerancia a la glucosa y diabetes gestacional. RANGOS DE REFERENCIA : Glicemia basal: Embarazadas < 105 mg/dL Hombres, mujeres y niños < 126 mg/dl Glicemia 120 min: < 140 mg/dL METODO : Enzimático (Hexoquinasa). INSTRUCCIONES AL PACIENTE : Ver instructivo para paciente en página 39. INSTRUCCIONES AL PERSONAL : Respete los tiempos de toma de muestra indicado por el médico. DE TOMA DE MUESTRAS La prueba PTGO no debe realizarse a pacientes que tengan una glicemia basal ≥ 140 mg/dL. Primero se debe obtener la muestra basal; inmediatamente después el paciente debe ingerir la dosis de glucosa, la cual debe disolverse en agua sin que sobrepase los 300mL e ingerirse en un tiempo máximo de 5 minutos, desde aquí se debe comenzar a tomar el tiempo para las demás muestras. Dosis de glucosa: Adultos y embarazadas 75 gr. de glucosa Niños: 1.75 grs/Kg de glucosa sin sobrepasar los 75 grs. Rotular cada tubo con el nombre y dos apellidos del paciente indicar en cada uno claramente el tiempo al que corresponde. TIPO DE MUESTRA : Sangre (Plasma y Suero). TIPO DE TUBO : Plasma : Tapa ploma (EDTA fluoruro) para glicemia basal y Suero : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : Tubo tapa ploma; llenar hasta la marca indicada en el tubo. Tubo tapa roja; entre 2 y 5 ml de muestra. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 30 minutos. Se rechazarán las muestras en caso de hemólisis o lipemia ENTREGA RESULTADOS LIMITACIONES : : Dentro del día hábil Muestras muy hemolizadas y lipémicas invalidan la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 227 RECUENTO RETICULOCITOS Hematología USO DE LA PRUEBA : Evaluación de la actividad eritropoyética de la médula ósea RANGOS DE REFERENCIA METODO : : INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : ENTREGA RESULTADOS : LIMITACIONES : 0.2 – 2.0% Tinción de glóbulos rojos con colorante azul de cresil brillante y observación microscópica. :Ayuno de 8 horas. Una vez extraída la muestra, se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. Sangre. Tubo tapa lila (anticoagulante EDTA). 4 mL para pacientes adultos, 2 mL para pacientes pediátricos y 0.5 mL para RN (tubo minicollect). Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Máximo 4 horas desde la toma de muestra Muestra coagulada 2 horas para pacientes de los servicios críticos, urgencia. 1 día hábil para pacientes hospitalizados y ambulatorios. Se debe corregir el recuento en pacientes con anemias severas y además aumentar el volumen de sangre para realizar la tinción. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 228 ROTAVIRUS, DEPOSICIONES PARA BUSQUEDA DE Inmunología USO DE LA PRUEBA : El Rotavirus es la causa más frecuente de gastroenteritis en niños y jóvenes, también se ha observado en adultos. Este virus se transmite por contacto fecal-oral. Los principales síntomas de esta gastroenteritis vírica son diarrea acuosa y vómitos. También puede presentarse dolor de cabeza, fiebre y dolor de estómago. Por lo general, los síntomas comienzan 1 o 2 días después de infectarse y pueden durar 3 días. RANGOS DE REFERENCIA : Negativa METODO : Prueba cualitativa inmunocromatográfica para la determinación de Rotavirus en muestras de heces. INSTRUCCIONES AL PACIENTE : Ver instructive para pacientes, página 41. INSTRUCCIONES AL PERSONAL : Evitar mezclar muestra con otro fluidos biológicos (orina, etc.) TIPO DE MUESTRA : Heces TIPO DE TUBO VOLUMEN MINIMO : : Heces 0,5 mL o 500 mg : Tubo o frasco esteril CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente. Debe realizarse los más pronto posible después de la recogida TIEMPO ENTREGA RESULTADO LIMITACIONES : : 1 día hábil Muestras con más de 24 horas de la recogida. Es recomendable que las muestras sean recogidas durante la fase aguda de la gastroenteritis, debido al alto numero de partículas y antígenos virales excretados durante este periodo. No recolectar las muestras en recipientes que contengan suero humano, detergente o preservativos, ya que puede causar interferente en la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 229 RUBEOLA, ANTICUERPOS IgG Inmunología USO PREFERENTE DE LA : Tradicionalmente se considera que la infección primaria posnatal de la PRUEBA rubéola es una enfermedad leve y autolimitada, que se caracteriza por un exantema maculo-papuloso, fiebre, decaimiento y linfadenopatías. A diferencia de las infecciones postnatales, las infecciones primarias prenatales pueden tener efectos devastadores. RANGOS DE REFERENCIA : 0 – 5 UI/Ml METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para determinación cualitativa de anticuerpos IgG frente al Virus Rubeola en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE : CONDICIONES DE ALMACENAMIENTO (uso exclusivo de laboratorios) RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADO : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 2 horas desde tomada la muestra Centrifugar y separar la muestra si no será procesada en el día. Refrigerar a 2-8°C por máximo 48 horas o congelar a -20°C o a temperatura inferior hasta su análisis. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 2 días hábiles RUBEOLA, ANTICUERPOS IgM Inmunología USO PREFERENTE DE LA : Tradicionalmente se considera que la infección primaria posnatal de la PRUEBA rubéola es una enfermedad leve y autolimitada, que se caracteriza por un exantema maculo-papuloso, fiebre, decaimiento y linfadenopatías. A diferencia de las infecciones postnatales, las infecciones primarias prenatales pueden tener efectos devastadores. RANGOS DE REFERENCIA : < 0,6 UI/mL METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para determinación cualitativa de anticuerpos IgM frente al Virus Rubeola en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL TIPO DE MUESTRA TIPO DE TUBO : : : VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE CONDICIONES DE : ALMACENAMIENTO (uso Evitar hemólisis de la muestra de sangre. Sangre (suero) Sangre (suero) : Tubo tapa roja o amarilla 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 2 horas desde tomada la muestra Si el ensayo no se va completar en 8 horas, refrigerar la muestra a 2-8°C. por máximo de 48 horas, o para enviar las muestras, congelar a -20°C o a MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 230 exclusivo laboratorio) RECHAZO DE MUESTRAS TIEMPO ENTREGA RESULTADO : SCREENING METABÓLICO Serología USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. Muestras lipémicas o hemolizadas. 2 días hábiles Alteraciones metabólicas Negativo Positivo METODO : INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADOS LIMITACIONES : : Test de FeCl3 (aminoácidos aromáticos) Test de benedict (azúcares reductores) Test 2,4 Dinitrofenilhidrazina (2,4-DNFH) (alfa-cetoácidos) Primera orina de la mañana. Tomado por la enfermera en el servicio de pediatría. : : : : Orina fresca Frasco de orina : 5 mL Una vez tomada la muestra, enviar inmediatamente al laboratorio. : : Inmediato 1 día hábil : No tiene. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 231 SEDIMENTO URINARIO Orinas USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA : : ENTREGA RESULTADOS : LIMITACIONES : Excelente reflejo del parénquima renal y las vías urinarias. Leucocitos: hasta 5 por campo Glóbulos rojos hasta 3 por campo Bacterias: escasas Células: escasas Cilindros hialinos: No se observa Observación microscópica. Antes de la toma de muestra, el paciente se debe realizar un cuidadoso aseo de la zona genital con abundante agua y jabón: Paciente mujer: lavar los genitales, separando cuidadosamente los labios mayores, con un algodón embebido en agua jabonosa y limpiando de adelante hacia atrás una sola vez. Elimine el algodón y repita el procedimiento con otro algodón. Enjuagar con agua eliminando totalmente el resto de jabón y secar la zona con un paño seco y limpio. En lo posible evitar recolectar la muestra si está en el período menstrual, en caso contrario cubrir la zona vaginal con un tapón de algodón para evitar que la orina se contamine. Paciente hombre: Retraer la piel anterior del pene (prepucio) y lavar la zona con algodón embebido en agua jabonosa. Enjuagar con agua y no tocar la zona aseada. Secar con un paño seco y limpio. Luego del aseo genital, eliminar el primer chorro de orina y sin cortar la micción, recolectar el segundo chorro de orina en un frasco, tubo o botella. Llenar hasta la mitad, tapar el frasco o tubo y rotular con su nombre y dos apellidos. Si la muestra es llevada a Toma de Muestra y rotulada por el paciente, se debe asegurar la correspondencia de los datos del paciente en el rótulo. Primera orina de la mañana, segundo chorro. Orina : Tubo o frasco de orina proporcionado por el laboratorio, frasco limpio, botellas limpias o bolsa colectora (lactantes sin control de esfínter). 10 mL. Los tubos, frascos y botellas se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. 1 hora desde la toma de muestra. Se rechazarán las muestras en los siguientes casos: - Muestras sin rotular - Muestras mal rotuladas - Muestras derramadas Servicios críticos 2 horas desde su llegada al laboratorio, Hospitalizados: 6 horas, ambulatorios: 8 horas. Contaminación de la muestra debido al inadecuado aseo genital. Las muestras con contaminación vaginal alteran el resultado observándose generalmente gran cantidad de mucus y células epiteliales. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 232 T3 HORMONA TRIYODOTIRONINA Bioquímica USO DE LA PRUEBA : Las mediciones de T3 tienen un importante rol en diagnostico de pacientes con desordenes de función tiroidea, como también en condiciones de deficiencia de yodo. Los niveles de T3 son mucho menores que las concentraciones de T4. En general las elevaciones de niveles de T3 se encuentran en la mayoría de los estados de hipertiroídeos, el estrés y el ayuno prolongado producen disminución en los niveles de T3 los que caen rápidamente en el transcurso de 24 a 48 horas. Desde el punto de vista clínico, las mediciones de la concentración de T3 en suero son especialmente útiles para el diagnóstico de hipertiroidismo y para el seguimiento de la terapia para este trastorno. RANGOS DE REFERENCIA : Adultos: 0,58 – 1,59 ng/ml METODO : Inmunoensayo de Micropartículas Quimiluminiscentes INSTRUCCIONES AL PACIENTE : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : Ayuno de 8 horas Evitar hemólisis de la muestra. Si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. Sangre Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : Temperatura ambiente 1 hora desde la toma de muestra RECHAZO DE MUESTRA : Se rechazarán las muestras hemolizadas, muy ictéricas o lipémicas ENTREGA RESULTADOS LIMITACIONES : : 1 día hábil Las anfetaminas incrementan los niveles de T3. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 233 T4 LIBRE, HORMONA TETRAYODOTIRONINA LIBRE Bioquímica USO DE LA PRUEBA : Los valores de T4 libre son el mejor indicador de una disfunción tiroidea, desde que esta prueba es menos sensible a los cambios de proteínas de unión en el suero. RANGOS DE REFERENCIA : Adultos: 0.70 a 1.48 ng/dL. METODO : Inmunoensayo de Microparticulas Quimiluminiscentes. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra. Si el tubo es al vacío y no se cuenta con DE TOMA DE MUESTRAS sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO MUESTRA : : : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos (tubo tapa roja). Temperatura ambiente 1 hora desde la toma de muestra Se rechazarán las muestras hemolizadas, ictéricas o lipémicas ENTREGA RESULTADO LIMITACIONES : : 1 día hábil. Anticuerpos circulantes anti-T4 pueden interferir en la determinación. TSH, HORMONA TIROESTIMULANTE Bioquímica USO PREFERENTE DE LA : Esta hormona regula la producción de hormonas tiroideas T3 y T4, por lo PRUEBA tanto es de gran utilidad en él diagnostico diferencial de hipotiroidismo y como ayuda en el monitoreo de terapia tiroídea. Se encuentra disminuida e incluso indetectable en los hipertiroídeos, En el hipertiroidismo secundario a tumores se encuentra elevada, Se encuentran valores elevados en el hipotiroidismo primario y bajo o normal en el hipotiroidismo pituitario RANGOS DE REFERENCIA : Adultos: 0.35 a 4.94 µUI/mL METODO : Inmunoensayo de Micropartículas Quimiluminiscentes. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra. Si el tubo es al vacío y no se cuenta con DE TOMA DE MUESTRAS sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. TIPO DE MUESTRA : Sangre TIPO DE TUBO : Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADO LIMITACIONES : : : : : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos (tubo tapa roja). Temperatura ambiente 1 hora desde la toma de muestra Se rechazarán las muestras hemolizadas, ictéricas o lipémicas 1 día hábil La presencia de auto anticuerpos anti-TSH interfiere en la determinación de TSH MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 234 TEST DE GRAHAM Parasitología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : Para el diagnóstico de Enterobius vermicularis. : : : VOLUMEN MINIMO : Ausencia de huevos de Enterobius vermicularis. Graham. Al paciente se le entregará 5 portaobjetos con una cinta adhesiva tipo “scotch” pegada a lo largo de cada portaobjeto. El paciente no se debe lavar la zona perianal antes de la obtención de las muestras (en la mañana). Debe realizar tocaciones perianales con la cinta scotch (por el lado engomado) sin contaminar con deposiciones, talco o pomadas. Luego debe colocar la cinta por su lado engomado hacia el portaobjeto y adherirla a él. Se debe obtener 5 muestras, 1 muestra cada día por 5 días. Debe envolver cada placa en papel y escribir su nombre y apellidos sobre éste. (ver instructivo para paciente, página 41) Verificar que la rotulación de las muestras esté correcta y corresponda al paciente. Tocaciones perianales. Cintas de scotch pegadas sobre las láminas de vidrio (portaobjetos) entregadas por el laboratorio. 5 láminas. CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE : : A temperatura ambiente 24 desde la obtención de la última muestra. ENTREGA RESULTADOS LIMITACIONES : : 3 días hábiles. No colocar cremas ni talco en la zona perianal. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 235 TEST DE MUCOPOLISACARIDOSIS (TEST DE BERRY) Serología USO PREFERENTE DE LA : Para diagnóstico de enfermedad metabólica PRUEBA RANGOS DE REFERENCIA : METODO : Cualitativo INSTRUCCIONES AL PACIENTE : No requiere INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : Orina TIPO DE TUBO : Frasco de orina VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADOS LIMITACIONES TEST DE NITROPRUSIATO Serología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADOS LIMITACIONES : : 3 mL Una vez tomada la muestra, enviar inmediatamente al laboratorio. : : Inmediato 1 día hábil. : No tiene. : Determinar cistinurias, homocistinurias y mercaptolactato. : : : : Cualitativo No requiere : : : : Orina Frasco de orina : 15 mL Una vez tomada la muestra, enviar inmediatamente al laboratorio. : : Inmediato 1 día hábil. : No tiene. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 236 TEST DEL SUDOR Serología USO PREFERENTE DE PRUEBA RANGOS DE REFERENCIA LA : METODO INSTRUCCIONES AL PACIENTE : : : : Normal: < 50 mmol/L Límite: 50 – 80 mmol/L Alterado: > 80 mmol/L Screening por Conductividad (Wescor sweat – check) Profesional Enfermera/o a cargo de la toma de muestra, explicará el procedimiento a los padres o apoderado del paciente (ejemplo: venir hidratado, no presentar edema, no tener erosiones o sarpullidos en la piel, etc) Toma de muestra a cargo de un profesional capacitado (Enfermero/a) para manejar la toma de muestra con sistema Macroduct® Sudor (obtenida por estimulación de la sudoración en el antebrazo por iontoforesis con pilocarpina). Sistema Macroduct® : 15 uL Una vez tomada la muestra, enviar inmediatamente al laboratorio. : : Inmediato 3 días hábiles. Se realizan los días lunes y miércoles. : Volumen inferior a 15 µL. Se debe tener presente que puede haber valores falsos negativos por; falla técnica; primer mes de vida; edema e hipoproteinemia (baja de proteínas en la sangre) entre otros. Valores falsos positivos por: hipotiroidismo, desnutrición, diabetes insípida etc. : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE TIEMPO ENTREGA RESULTADOS LIMITACIONES Para diagnóstico de fibrosis Quística MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 237 TESTOSTERONA TOTAL Bioquímica USO PREFERENTE PRUEBA DE LA : RANGOS DE REFERENCIA : Hombres < 50 años Hombres ≥50 años Mujeres en edad fértil Mujeres con anticonceptivos orales Mujeres post menopáusica METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL TIPO DE MUESTRA TIPO DE TUBO : : : Inmuno ensayo de Micropartículas Quimiluminiscentes No requiere preparación especial Se debe indicar en el formulario de solicitud de examen la edad y sexo del paciente. Sangre Sangre : Tubo tapa roja o amarilla VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA : : TIEMPO RESULTADo LIMITACIONES : : : : ENTREGA : : En hombres se utiliza principalmente en la evaluación de; hipogonadismo, fallo testicular, esterilidad, hipopituitarismo e hiperprolactinemia. En las mujeres trastornos como; síndrome del ovario poliquístico, hiperplásia suprarrenal, esterilidad, Hirsutismo, amenorrea, obesidad y virilización pueden causar cambios en la concentración de testosterona en suero. La Testosterona circula mayoritariamente unida a proteínas transportadoras (SHBG) y solo la fracción libre es fisiológicamente activa. Por lo tanto, condiciones y medicamentos que afectan los niveles de SHBG modifican también los niveles de Testosterona Total. 1,66 – 8,77 ng/ml 1,56 – 5,63 ng/ml 0,09 – 1,09 ng/ml 0,13 – 0,83 ng/ml 0,12 – 1,30 ng/ml 2- 5 mL. de suero Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Hasta 1 hora desde la toma de muestra. Se rechazarán las muestras en los siguientes casos: - Muestras sin rotular - Muestras mal rotuladas - Muestras derramadas o manchadas 1 día hábil. No tiene. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 238 TIEMPO DE PROTROMBINA (PT) Coagulación USO PREFERENTE DE LA : Evaluación de la integridad de la vía extrínseca del sistema de coagulación, PRUEBA monitorización de la terapia anticoagulante oral (TAC), control de la función hepática RANGOS DE REFERENCIA : Adultos y niños: 70 – 110%. METODO : Óptico-mecánico. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : La punción debe ser atraumática, evitando la formación de hematomas, DE TOMA DE MUESTRAS ligadura prolongada y la hemólisis. Se debe evitar la aspiración de burbujas de aire y la contaminación con líquido tisular. Si en la toma de muestra un paciente necesita más de un tubo, usar en 2º o 3º lugar el tubo para las pruebas de coagulación. Si la toma de muestra es única, desechar la primera porción. Si la extracción se efectúa a través de un catéter, descartar los primeros 20 mL de sangre antes de vaciar al tubo. Se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. TIPO DE MUESTRA : Sangre. TIPO DE TUBO : Tubo tapa celeste (anticoagulante citrato de sodio) VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES : : : : 2 mL o según la cantidad que indique el tubo (llenar hasta la marca). Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Máximo 2 horas desde la toma de muestra. Muestras sobre o bajo nivel no pueden ser procesadas Las muestras hemolizadas, lipémicas y coaguladas invalidan la prueba. Pabellón: 30 minutos. Servicios de urgencia 2 horas. Dentro del día para otros servicios clínicos. Pacientes ambulatorios 1 día hábil El consumo excesivo de vegetales verdes, la diarrea y los vómitos pueden acortar los tiempos de coagulación. El alcoholismo o ingesta excesiva de alcohol puede prolongar los tiempos de coagulación. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 239 TIEMPO DE SANGRÍA Coagulación USO PREFERENTE DE LA : PRUEBA RANGOS DE REFERENCIA : METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES DE TRANSPORTE TIEMPO DE TRANSPORTE CONDICIONES DE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES : : : : : : : : : : : Esta prueba se utiliza para valorar principalmente el número y la función de las plaquetas, así como la función capilar (vasoconstricción). El tiempo de sangría puede estar alargado en trombocitopenias, púrpuras trombocitopénicas tanto centrales como periféricas, trombopatías hereditarias, afibrinogemia, insuficiencia hepática grave con síndrome hemorrágico, en la enfermedad de Von Willebrand y en tratamientos con aspirina y antiinflamatorios no esteroidales Niños: Hasta 9 minutos Adultos: Hasta 8 minutos Método de Ivy modificado. No es necesario el ayuno. Se recomienda tomar un desayuno liviano. Requiere recuento de plaquetas normal. Este procedimiento es realizado por profesionales de la Unidad. Sangre. No procede. No procede. No procede. No procede Trombocitopenia. Terapia con aspirina y antiinflamatorios no esteroidales durante últimos 7 días Al término del examen. La técnica se puede realizar en niños mayores de 4 años. Los antiinflamatorios, aspirinas, antihistamínicos (antialérgicos) pueden aumentar el Tiempo de Sangría MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 240 TIEMPO DE TROMBOPLASTINA PARCIAL ACTIVADA (TTPA) Coagulación USO PREFERENTE DE LA : Evaluación de la integridad de la vía intrínseca del sistema de coagulación. PRUEBA Se encuentra alargado en coagulación intravascular diseminada, disfibrinogenemias, afibrinogenemias, hepatopatías severas, deficiencia de vitamina K, etc. Monitorización de la terapia con heparina. RANGOS DE REFERENCIA : 23-35 segundos METODO : Óptico-mecánico. INSTRUCCIONES AL PACIENTE : Ayuno de 8 horas. INSTRUCCIONES AL PERSONAL : La punción debe ser atraumática, evitando la formación de hematomas, DE TOMA DE MUESTRAS ligadura prolongada y la hemólisis. Se debe evitar la aspiración de burbujas de aire y la contaminación con líquido tisular. Si en la toma de muestra un paciente necesita más de un tubo, usar en 2º o 3º lugar el tubo para las pruebas de coagulación. Si la toma de muestra es única, desechar la primera porción. Si la extracción se efectúa a través de un catéter, descartar los primeros 20 mL de sangre antes de vaciar al tubo. Se debe realizar una inversión completa y suave del tubo 10 veces, para mezclar adecuadamente la sangre y el anticoagulante. TIPO DE MUESTRA : Sangre. TIPO DE TUBO : Tubo tapa celeste (anticoagulante citrato de sodio) VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : CONDICIONES DE RECHAZO DE : MUESTRA TIEMPO ENTREGA : RESULTADOS 2 mL o según la cantidad que indique el tubo (llenar hasta la marca). Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Máximo 2 horas desde la toma de muestra. Muestras sobre o bajo nivel no pueden ser procesadas Muestras hemolizadas, lipémicas y coaguladas. Pabellón: 30 minutos. Servicios de urgencia 2 horas. Dentro del día para otros servicios clínicos. Pacientes ambulatorios 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 241 TOXOPLASMA GONDII, ANTICUERPOS IgG Inmunología USO PREFERENTE DE LA : Toxoplasma gondii es un parásito obligatoriamente intracelular, capaz de PRUEBA infectar a una amplia variedad de huéspedes intermediarios, entre ellos, al ser humano. La infección en el adulto sano es frecuentemente asintomática. En aquello casos con manifestaciones clínicas, el síntoma más común es la linfadenopatía, que puede estar acompañada de una serie de otros síntomas que dificultan el diagnóstico diferencial.4,5 En adultos inmunodeprimidos debido a quimioterapias contra el cáncer o tratamiento inmunosupresivo y en pacientes con SIDA, se producen infecciones graves o mortales. La transmisión transplacentaria del parásito trae como consecuencia la toxoplasmosis congénita, la cual puede ocurrir durante la infección aguda adquirida por la madre. La toxoplasmosis congénita trae como consecuencia una enfermedad grave generalizada o neurológica en aproximadamente entre el 20% y el 30% de los bebés infectados intrauterinamente; aproximadamente, el 10% presenta solamente una infección ocular y el resto (aprox. el 70%) son asintomáticos al nacer. La infección subclínica puede producir un parto prematuro y los defectos neurológicos, intelectuales y los auditivos subsiguientes. RANGOS DE REFERENCIA : 0 – 2 UI/mL METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para determinación cuantitativa de anticuerpos IgG frente al Toxoplasma gondii en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS CONDICIONES DE : ALMACENAMIENTO (uso exclusivo de laboratorio TIEMPO ENTREGA RESULTADO : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra. Muestras lipémicas o hemolizadas. Guardar las muestras a temperatura ambiente no más de 8 horas. Si el ensayo no se va completar en 8 horas, refrigerar la muestra a 2-8°C. Si el ensayo no se va completar entre 48 horas, o para enviar las muestras, congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 242 TOXOPLASMA GONDII, ANTICUERPOS IgM USO PREFERENTE DE LA : Toxoplasma gondii es un parásito obligatoriamente intracelular, capaz de PRUEBA infectar a una amplia variedad de huéspedes intermediarios, entre ellos, al ser humano. Los ensayos serológicos específicos para detectar anticuerpos IgM frente al T. gondii constituyen una ayuda útil para el diagnóstico de la toxoplasmosis congénita y de la toxoplasmosis aguda adquirida. Las concentraciones de anticuerpos IgM aumentan rápidamente después de la infección aguda adquirida y descienden al cabo de varios meses, pero pueden permanecer en concentraciones detectables durante un año o más. Debido a que es posible detectar concentraciones persistentes de IgM durante un largo período de tiempo después del comienzo de la infección adquirida, la interpretación de un resultado aislado debe efectuarse con cautela en aquellos casos en que sea decisivo establecer la fecha de la infección. Esto se aplica al diagnóstico de la infección aguda por T. gondii durante el embarazo. No es recomendable determinar la fecha de la infección bas_ndose solamente en los resultados de anticuerpos IgM detectables frente al T. gondii. RANGOS DE REFERENCIA : 0 – 0,5 INDEX METODO : Inmunoanálisis quimioluminiscente de micropartículas (CMIA) para determinación cuantitativa de anticuerpos IgM frente al Toxoplasma gondii en suero humano. INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar hemólisis de la muestra de sangre. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Sangre (suero) TIPO DE TUBO : Sangre (suero) : Tubo tapa roja o amarilla VOLUMEN MINIMO : CONDICIONES DE : TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS CONDICIONES DE : ALMACENAMIENTO (uso exclusivo de laboratorio) TIEMPO ENTREGA RESULTADO : 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra. Muestras lipémicas o hemolizadas. Guardar las muestras a temperatura ambiente no más de 8 horas. Si el ensayo no se va completar en 8 horas, refrigerar la muestra a 2-8°C. Si el ensayo no se va completar entre 48 horas, o para enviar las muestras, congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 1 día hábil. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 243 TRANSAMINASA GLUTÁMICO OXALOACÉTICO (GOT), TRANSAMINASA GLUTÁMICO PIRÚVICO (GPT) Bioquímica USO PREFERENTE DE LA : Para el diagnóstico, pronóstico y valoración de afecciones hepáticas. Estas PRUEBA enzimas se elevan significativamente en afecciones agudas, como en hepatitis y necrosis hepática de diferente etiología y en menor nivel en cirrosis, ictericia obstructiva, carcinoma metastásico, congestión hepática y colestasia intrahepática. Puede haber elevación ligera en IAM y pancreatitis aguda, aunque la elevación de la GOT en el IAM es más significativa. RANGOS DE REFERENCIA : GOT Hombres: 5 - 34U/L, Mujeres:5 – 34 U/L GPT Hombres < 55 U/L Mujeres : <55 U/L METODO : Con medición de NADH a 340 nm sin fosfato de peridoxal INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : Evitar el uso prolongado del torniquete y la hemólisis de la muestra. DE TOMA DE MUESTRAS TIPO DE MUESTRA : Suero TIPO DE TUBO : Suero : Tubo tapa roja o amarilla Suero VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA TIEMPO ENTREGA RESULTADOS LIMITACIONES : : : : : Tubo tapa verde (anticoagulante Heparina de Litio), para los servicios de urgencia, diálisis y transplante renal adulto y pediátrico. 3 mL para pacientes pediátricos, 4mL para pacientes adultos. Los tubos se deben transportar tapados, en posición vertical, en un recipiente o gradilla, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. Máximo 4 horas desde la toma de muestra. Muestra mal rotulada, hemolizadas, Lipémicas. 2 horas para pacientes de los servicios de urgencia, durante el día para pacientes hospitalizados y ambulatorios. Fármacos que interfieren: Isoniazida, fenotiazinas, eritromicina, esteroides anabólicos opiáceos y salicilatos producen un aumento de GOT en el suero. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 244 TRIGLICÉRIDOS Bioquímica USO PREFERENTE DE PRUEBA LA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Evaluación de riesgo de enfermedad cardiaca y vascular. Valores aumentados se encuentran en las Hiperlipoproteinemias, obesidad, hepatitis viral, alcoholismo, cirrosis alcohólica, biliar, pancreatitis aguda y crónica, síndrome nefrótico, falla renal crónica, IAM, trombosis cerebral, hipotiroidismo, diabetes mellitus, embarazo, stress. Valores disminuidos se observan en enfermedad pulmonar obstructiva crónica, hipertiroidismo, lactosuria, malnutrición, síndrome de mala absorción. 0 - 200 mg/dL (Adultos). Glicerol Fosfato Oxidasa Ayuno de 12 a 14 horas antes de la prueba. No beber alcohol 24 horas antes de la toma de muestra. Evitar la hemólisis de la muestra. Si el tubo es al vacío y no se cuenta con sistema adecuado de agujas sacar la tapa y vaciar lentamente la muestra recolectada. Sangre Sangre : Tubo tapa roja o amarilla TIPO DE MUESTRA TIPO DE TUBO : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE : 2 mL para pacientes pediátricos, 2 a 5 mL para pacientes adultos. Los tubos se deben transportar tapados en posición vertical, en un contenedor o gradilla a temperatura ambiente. Evitar la agitación para prevenir la hemólisis. 1 hora desde la toma de muestra. RECHAZO DE MUESTRA : Se rechazarán las muestras en caso de hemólisis. ENTREGA RESULTADOS LIMITACIONES : : 1 día hábil. La ingesta calórica excesiva y la dieta rica en carbohidratos aumentan los niveles de triglicéridos séricos. Fármacos que interfieren: ácido ascórbico, catecolaminas, corticosteroides, ciclosporina, diazepan, diuréticos, estrógenos, anticonceptivos orales, etanol, retinol, aumentan los niveles séricos. Ácido ascórbico (en altas dosis), ácido aminosalicílico, asparaginasa, heparina, niacina disminuyen los niveles séricos. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 245 UROCULTIVO Bacteriología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO VOLUMEN MINIMO CONDICIONES TRANSPORTE TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADO : Diagnóstico de infección. Necesidad de orientar tratamiento antibiótico. : Sin desarrollo bacteriano : Cultivo bacteriano en placas con medio de cultivo : Ver instructivo, página 39. : Según tipo de muestra, ver instrucciones en página 68. : : : : Orina Frasco estéril tapa rosca 5 ml Transportar tapados, en posición vertical, dentro de un contenedor sólido a prueba de derrames y a temperatura ambiente. : Inmediato al laboratorio. Frasco mal sellado, derrame de muestra : 3 días hábiles VARICELLA – ZOSTER, VIRUS Inmunología USO PREFERENTE DE LA : Determinación del estado inmune, en individuos con alto riesgo en la PRUEBA exposición al VZV. RANGOS DE REFERENCIA : Negativo METODO : IFI (Ensayo por inmunofluorescencia indirecta) para la determinación y valoración de anticuerpos VZV IgG en suero humano INSTRUCCIONES AL PACIENTE : Ayuno de al menos 8 horas. INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS TIPO DE MUESTRA : TIPO DE TUBO : Evitar hemólisis de la muestra de sangre. VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRAS CONDICIONES DE : ALMACENAMIENTO (uso exclusivo de laboratorio) 0,5 mL (tubo de 4mL) Temperatura ambiente. Máximo 4 horas desde toma de muestra Muestras lipémicas o hemolizadas. Guardar las muestras a temperatura ambiente no más de 8 horas. Si el ensayo no se va completar en 8 horas, refrigerar la muestra a 2-8°C. Si el ensayo no se va completar entre 48 horas, o para enviar las muestras, congelar a -20°C o a temperatura inferior. Una vez descongeladas las muestras deben agitarse bien antes de utilizarse. 7 días hábiles ENTREGA RESULTADOS : Sangre (suero) Sangre (suero) : Tubo tapa roja o amarilla MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 246 VDRL EN SUERO Serología USO PREFERENTE DE LA PRUEBA RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE INSTRUCCIONES AL PERSONAL DE TOMA DE MUESTRAS TIPO DE MUESTRA TIPO DE TUBO : : : : : : : VOLUMEN MINIMO CONDICIONES TRANSPORTE : DE : TIEMPO DE TRANSPORTE : ENTREGA RESULTADO : LIMITACIONES : Detección de anticuerpos reagínicos IgG e IgM contra el Treponema pallidum. No Reactivo Floculación en lámina, test no treponémico. Ayuno de 8 horas. Aplicar medidas de bioseguridad, utilizar material desechable y estéril (jeringas, agujas y tubos de recolección), evitar la hemólisis de la muestra. Rotular tubo con los nombres y los dos apellidos del paciente (norma ISP). En el caso de los controles sanitarios o epidemiológicos, debe exigirse cédula de identidad, el cual será anotado en la identificación de la muestra. Sangre : Tubo tapa roja o amarilla Adulto: 5 mL de sangre RN y Lactantes: 2 mL de sangre Los tubos se deben transportar verticalmente a temperatura ambiente en un contenedor o gradilla y enviarla inmediatamente al laboratorio. Si las muestras no son enviadas el mismo día al laboratorio, deberán ser centrifugadas, enviar el suero y guardarlas en refrigerador hasta su envío, dentro de las 72 horas siguientes. Si las muestras se envían por correo, los tubos plásticos deben estar sellados herméticamente y conservar la cadena de frío. 24 horas desde la recepción en el laboratorio.Se realizan de lunes a viernes. 1 día hábil Examen confidencial. Para visualizar resultado en web debe ingresar el profesional con clave personal autorizada. (ver página 16) Muestras hemolizadas, lipémicas o contaminadas invalidan la prueba. No se puede utilizar muestras de plasma. Reacciones falsas positivas pueden producirse en poblaciones de usuarios de drogas intravenosas, embarazadas y enfermedades autoinmunes como artritis y lupus. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 247 VDRL EN LCR Serología USO DE LA PRUEBA : RANGOS DE REFERENCIA METODO INSTRUCCIONES AL PACIENTE : : : INSTRUCCIONES AL PERSONAL : DE TOMA DE MUESTRAS Detección de anticuerpos reagínicos IgG e IgM contra el Treponema pallidum. No Reactivo Floculación en lámina, test no treponémico. Explicar al paciente el procedimiento de extracción de muestra, los riesgos potenciales, beneficios y las actividades posteriores al procedimiento. No se requiere ayuno. Toma de muestra a cargo de un profesional médico. Rotular tubo con los nombres y los dos apellidos del paciente (norma ISP). TIPO DE MUESTRA : LCR TIPO DE TUBO VOLUMEN MINIMO : : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE ENTREGA RESULTADOS : : LIMITACIONES : Tubo estéril de 10 mL : Adulto: 1 - 2 mL de LCR RN y Lactantes: 0.5 mL de LCR Los tubos se deben transportar verticalmente a temperatura ambiente en un contenedor o gradilla. Si las muestras no son enviadas el mismo día al laboratorio, guardarlas en refrigerador hasta su envío, dentro de las 72 horas siguientes. Inmediato 1 día hábil Examen confidencial. Para visualizar resultado en web debe ingresar el profesional con clave personal autorizada. (ver página 16) Las muestras que estén visiblemente contaminadas se deben descartar. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 248 VELOCIDAD DE SEDIMENTACIÓN GLOBULAR (VHS) Hematología USO PREFERENTE DE LA : Indicador de amplio espectro en patologías inflamatorias, inmunológicas, PRUEBA infecciosas y tumorales. La VHS se encuentra elevada en situaciones fisiológicas como el embarazo, menopausia, crecimiento y envejecimiento, y en patologías como infecciones agudas y crónicas, neoplasias, gamapatías monoclonales, procesos inflamatorios agudos y crónicos, anemias intensas, insuficiencia renal, infarto agudo al miocardio, presencia de crioaglutininas. Se observa una disminución de la VHS en la policitemia vera, alteraciones congénitas eritrocitarias, hipofibrinogenemia, insuficiencia cardiaca congestiva, etc. Es útil en el seguimiento del curso evolutivo de una patología y para evaluar la respuesta a tratamientos de ciertas patologías (neoplasias). RANGOS DE REFERENCIA : 5 – 15 mm/hora METODO : Westergreen modificado INSTRUCCIONES AL PACIENTE : Ayuno de 12 horas. INSTRUCCIONES AL PERSONAL : Una vez extraída la muestra, se debe realizar una inversión completa y DE TOMA DE MUESTRAS suave del tubo varias veces (10 veces), de tal forma de mezclar adecuadamente la sangre y el anticoagulante. TIPO DE MUESTRA : Sangre. TIPO DE TUBO : Tubo citrato tapa negra VOLUMEN MINIMO : CONDICIONES TRANSPORTE : TIEMPO DE TRANSPORTE RECHAZO DE MUESTRA ENTREGA RESULTADOS : : : 4 mL para pacientes adultos, 2 mL para pacientes pediátricos y 0.5 mL para RN. Los tubos se deben transportar en posición vertical, tapados, en un contenedor o gradilla a temperatura ambiente. 4 horas desde la toma de la muestra. No se procesan muestras coaguladas y microcoaguladas. Dentro del día para pacientes hospitalizados y ambulatorios. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 249 VIRUS RESPIRATORIOS, ANTIGENOS POR IFI ADV, VRS, IA, IB, PI-1, PI-2, PI-3, METAPNEUMOVIRUS Inmunología USO DE LA PRUEBA : Enfermedad respiratoria aguda en niños, normalmente hace acto de presencia con la aparición repentina de fiebre, escalofríos, cefalea, mialgias y tos no productiva. Este examen, es un análisis diferenciado, que permite distinguir los antígenos virales de los 7 virus más frecuente de nuestra población, a partir de una misma muestra procesada, sirviendo para ayuda diagnostica de la infección por unos de los virus. RANGOS DE REFERENCIA : Negativo METODO : IFI (Ensayo por inmunofluorescencia indirecta) para la detección e identificación de infecciones virales respiratorias. INSTRUCCIONES AL PACIENTE : Requiere Ayuno INSTRUCCIONES AL PERSONAL : Evitar recogida de muestras sanguinolentas o con contenido de leche u DE TOMA DE MUESTRAS otra sustancia alimenticia. TIPO DE MUESTRA : Aspirado Nasofaríngeo TIPO DE TUBO : Aspirado Nasofaríngeo : Tubo o frasco estéril con 5 ml de PBS VOLUMEN MINIMO CONDICIONES TRANSPORTE : : TIEMPO DE TRANSPORTE ENTREGA RESULTADOS LIMITACIONES : : : 3,0 mL (aspiración minima) Debe realizarse los más pronto posible después de la recogida, con medio de transporte PBS. 4 horas con refrigeración 1 día hábil Muestras con más de 24 horas de la recogida, sin que sean adecuadamente refrigeradas. No recolectar las muestras en recipientes que contengan suero humano, detergente o preservativos, ya que puede causar interferente en la prueba. MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 250 DOCUMENTACIÓN DE REFERENCIA 1. Manual del Estándar General de Acreditación para Prestadores Institucionales deAtención Cerrada. 2. Régimen de Garantías Explícitas en Salud Garantía de Calidad. Estándares mínimos de acreditación para Laboratorios Clínicos Ministerio de Salud Chile Abril 2007. 3. Manual de Normas de Prevención y Control de Infecciones Intrahospitalarias Hospital Dr. Hernan Henríquez. Actualización agosto 2008 4. Manual de toma de muestras para enfermedades metabólicas http://www.inta.cl/cedinta/labmeta/toma_de_muestras.pdf 5. Manual para el diagnóstico bacteriológico de la Tuberculosis normas y guía técnica, Organización Mundial de la Salud 2008. 6. Samples: from the patient to the Laboratory, WG Guder, 3rd edition 7. Rochester 2010 Test Catalog Laboratory Reference Edition. Mayo Clinic, Mayo Medical Laboratories. 8. References ranges for Adults and children. Preanalytical considerations. Dr Heil, V, Ehrhardt Novena Edición, 2008 9. Guide to Lab and Diagnostic Test, Tracey B. Hopkins 2005 10. Insertos técnicas instaladas Architect C8000 Abbott, Architect i2000 Abbott, Axsym Abbott, Ca 1500 Bering, BN Prospec Bering, MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 251 Código: APL 1.2 Edición: Segunda Fecha : 15 junio 2012 Página: 252 de 252 LABORATORIO CLÍNICO Vigencia: Junio 2014 Corrección Fecha Descripción de Modificación Se modifica solicitud de examenes Publicado en LC-PEB-01-01 Pag 11 22/06/2012 Pag 14 22/06/2012 Se agregan cualitativos críticos LC-PEB-01-01 22/06/2012 Se saca indicador preanalitico rechazo muestras lipemicas LC-PEB-01-01 22/06/2012 Se eliminan Laboratorios de referencias muestras derivadas LC-PEB-01-01 22/06/2012 Agregan laboratorios de derivacion LC-PEB-01-01 22/06/2012 Se elimina Toma de muestra orina LC-PEB-01-01 22/06/2012 Cambia método de AFP LC-PEB-01-01 Cambia método anti-TPO LC-PEB-01-01 22/06/2012 Cambia método anti-TG LC-PEB-01-01 22/06/2012 Cambia método CA-125 LC-PEB-01-01 22/06/2012 Cambia método CA19-9 LC-PEB-01-01 Pag. 17 Pag. 25 a 32 valores Nº documento Pag. 32 Pag 58 Pag. 97 Pag 112 22/06/2012 Pag. 113 Pag 115 Pag 116 22/06/2012 Cambia método CEA LC-PEB-01-01 Pag. 117 Pag 118 22/06/2012 Cambia método PSA libre LC-PEB-01-01 Pag 119 22/06/2012 Cambia método PSA total LC-PEB-01-01 Pag 150 22/06/2012 Cambia método Digoxina LC-PEB-01-01 Pag 180 22/06/2012 Cambia método Hepatitis B LC-PEB-01-01 Pag 182 22/06/2012 Cambia método Hepatitis C LC-PEB-01-01 22/06/2012 Cambia método HIV LC-PEB-01-01 Pag 186 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 252 MANUAL DE LABORATORIO CLÍNICO HOSPITAL HERNÁN HENRÍQUEZ ARAVENA DE TEMUCO 2012 253