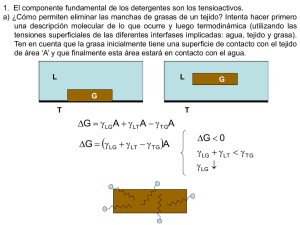
Evaluación de la biodegradabilidad y
Anuncio

Facultad de Ciencias del Mar y Ambientales Departamento de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente TESIS DOCTORAL EVALUACIÓN DE LA BIODEGRADABILIDAD Y ECOTOXICIDAD DE TENSIOACTIVOS EN EL MEDIO ACUÁTICO MARINO Miguel Ángel Sibila Lores Cádiz, Abril de 2008 EVALUACIÓN DE LA BIODEGRADABILIDAD Y ECOTOXICIDAD DE TENSIOACTIVOS EN EL MEDIO ACUÁTICO MARINO Memoria presentada por el Licenciado D. Miguel Ángel Sibila Lores para optar al Grado de Doctor en Ingeniería Química por la Universidad de Cádiz LA PRESENTE TESIS DOCTORAL HA SIDO DIRIGIDA POR LOS PROFESORES DOCTORES DE LA UNIVERSIDAD DE CÁDIZ D. JOSE MARÍA QUIROGA ALONSO, CATEDRÁTICO DEL ÁREA DE TECNOLOGÍAS DEL MEDIO AMBIENTE, Y D. JOSE ANTONIO PERALES-VARGAS MACHUCA, PROFESOR TITULAR DE UNIVERSIDAD DEL ÁREA DE TECNOLOGÍAS DEL MEDIO AMBIENTE AGRADECIMIENTOS “Es de bien nacido ser agradecido” Quisiera agradecer a todas y cada una de las personas, que no son pocas, que, de una manera u otra, han contribuido a la elaboración de esta Tesis. Quien me conoce sabe que la escritura no es mi fuerte, entre otras muchas cosas. Si bien, espero poder reflejar lo mejor posible la importancia de cada una de ellas en la finalización de este doctorado. Especial agradecimiento a mis directores de Tesis, Jose María Quiroga y Jose Antonio Perales, a quienes no sólo les debo gran parte de este trabajo, sino también una parte importante de todo mi aprendizaje y formación. Gracias por todo el apoyo y esfuerzo mostrado, fruto del cual se ha llevado a cabo la elaboración de diversas publicaciones internacionales, una de ellas recientemente publicada. Gracias por vuestra paciencia (en algunos momentos, infinita), por todas esas “horas extras” de correcciones, planificación de ensayos, etc., y en general, por vuestra motivación y afecto durante todos estos años. A D. Diego Sales Márquez, director del Grupo de Investigación de Tecnología del Medio Ambiente y actual Rector Magnífico de la Universidad de Cádiz, por su confianza y apoyo, en mayor medida, en los inicios de mi doctorado. A la Consejería de Innovación, Educación y Empresa de la Junta de Andalucía, por la financiación del presente trabajo a través de una ayuda para la Formación de Doctores en Centros de Investigación y Universidades de Andalucía. A todos y cada uno de los profesores del Área de Tecnologías del Medio Ambiente, y en especial a la profesora Carmen Garrido, por su dedicación y ayuda en los ensayos de ecotoxicidad así como en los “aspectos estéticos” de trabajos presentados en diferentes congresos. Sus enseñanzas en todo lo relacionado con la Toxicología marina constituyen una pieza clave tanto en la elaboración de este trabajo como en las publicaciones realizadas. A Isabel Cumbreras (Beli), secretaría del Departamento de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente, por el apoyo mostrado en todos los aspectos administrativos. A mi “segunda familia”, Antonio Liñeiro, Alberto, Abel, Txomin y Mohammed (Mou), con quienes tuve el placer de “crecer” en este mundillo, compartir tantas horas de laboratorio, lamentar ensayos fallidos, disfrutar de momentos “lúdico-festivos” inolvidables (y los que aún quedan por venir) y con los que siempre he podido confiar. Mis más dulces recuerdos se los debo a ellos. A los antiguos compañeros del grupo TMA, Natalia, Esther, Inma, Carlos, Álvaro, etc, quienes durante varios años compartieron conmigo “las penas y alegrías” y quienes me ofrecieron su cariño y apoyo. A la nueva generación de investigadores y doctorandos, Jesús, Pablo, Elisa, Santiago, Manolo, Andalucía, Cristina, María José (mi “cencerrito” favorito), Julia, Juana, etc., quienes consiguen transmitirme ese entusiasmo, dedicación y energía que desprenden, y a los ya veteranos Dani, Youssef, Liboeiro, etc., por su amistad y por aliviar, quizás sin saberlo, mis amargos momentos en el laboratorio (unas lecciones de guitarra, un cigarrito o un cafelito). A Jose Ignacio Lores, por su colaboración en el diseño gráfico del presente trabajo. A Beatriz Muñoz, por su ayuda en las traducciones tanto de la presente Tesis como en las publicaciones realizadas. A los doctores Walter Giger y Hans-Peter Kohler del Instituto Federal Suizo de Ciencias Acuáticas y Tecnología (EAWAG), por brindarme la oportunidad de realizar una estancia bajo sus tutelas, y complementar así mi formación. A mis compañeros del Instituto Federal Suizo, Simón, Darío, Patricia, Enrique, Tobias, Holger, Andreas, Christopher, Marius, Vishaka, etc., quienes hicieron de mi estancia una experiencia única e inolvidable. A mis amigos Esteban, Juanqui, Javi, Lladó, Manolo, Miguelito, Iván, etc. por su amistad y por regalarme unas sonrisas de vez en cuando. A mis padres y hermanos, quienes de una manera indirecta pero constante han sufrido los dulces y amargos momentos que uno atraviesa cuando se aventura en un trabajo de este calibre. Gracias por vuestro cariño, paciencia, apoyo y comprensión, del que he podido disfrutar en todo momento. A Rafa, quien además de ser de la familia considero uno de mis mejores amigos. Gracias por esos inolvidables momentos, viajes, marchitas, etc., que me permitieron “desconectar” un poco del trabajo. Finalmente, quisiera extender mi agradecimiento a todas esas personas, que aún no estando presentes en esta lista, han aportado su granito de arena, contribuyendo así a la finalización de este trabajo. A todos, Gracias A mi Familia A Santiago Santiago González, quien merecía algo mejor ÍNDICE Resumen Summary R-1 S-1 Introducción y objetivos Referencias IO-1 IO-5 Capítulo 1. Antecedentes bibliográficos 1. Tensioactivos y Medio Ambiente 2. Biodegradabilidad en el medio acuático 3. Toxicidad en el medio acuático Referencias I-2 I-6 I-12 I-17 Capítulo 2. Metodología 1. Diseño experimental 2. Medio de ensayo y punto de muestreo 3. Metodología para el estudio de la biodegradabilidad 4. Metodología para el estudio de la toxicidad aguda estándar 5. Metodología para el estudio de la evolución de la toxicidad durante la biodegradación Referencias Capítulo 3. Sales de alquil trimetil amonio 1. Introducción 2. Materiales 3. Resultados y discusión 3.1. Ensayos de biodegradación 3.2. Ensayos de toxicidad aguda estándar 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación 4. Conclusiones Referencias Capítulo 4. Nonilfenoles etoxilados 1. Introducción 2. Materiales 3. Resultados y discusión 3.1. Ensayos de biodegradación 3.2. Ensayos de toxicidad aguda estándar 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación II-2 II-7 II-8 II-12 II-16 II-17 III-2 III-7 III-8 III-14 III-19 III-24 III-25 IV-2 IV-8 IV-9 IV-15 IV-20 i 4. Conclusiones Referencias Capítulo 5. Alquil etoxisulfatos 1. Introducción 2. Materiales 3. Resultados y discusión 3.1. Ensayos de biodegradación 3.2. Ensayos de toxicidad aguda estándar 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación 4. Conclusiones Referencias Capítulo 6. Alcoholes etoxilados 1. Introducción 2. Materiales 3. Resultados y discusión 3.1. Ensayos de biodegradación 3.2. Ensayos de toxicidad aguda estándar 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación 4. Conclusiones Referencias IV-23 IV-24 V-2 V-9 V-10 V-15 V-20 V-23 V-24 VI-2 VI-11 VI-12 VI-18 VI-23 VI-26 VI-27 Capítulo 7. Estudio comparativo de la biodegradabilidad y ecotoxicidad de los tensioactivos 1. Biodegradabilidad de los tensioactivos estudiados en el medio acuático marino 2. Toxicidad aguda de los tensioactivos estudiado sobre organismos marinos 3. Evolución de la toxicidad del medio de ensayo durante la biodegradación de los diferentes tensioactivos estudiados VII-2 VII-5 Conclusiones generales General conclusions CG-1 GC-1 ii VII-9 RESUMEN El medio marino está constituido por una amplia diversidad de ecosistemas tales como los arrefices de coral, manglares, sistemas litorales rocosos y arenosos, etc. Cada uno de estos sistemas contiene una biota característica representada por miles de especies que con excesiva frecuencia están expuestas a gran variedad de contaminantes derivados, generalmente, de la actividad humana. Más allá de los detergentes, cuya aplicación es la más común, los tensioactivos poseen numerosas aplicaciones dada sus propiedades emulsionantes, humectantes, dispersantes, así como de solubilidad y resistencia a la dureza del agua. Su elevado y creciente consumo ha hecho de estas sustancias uno de los contaminantes más frecuentes en el medio acuático. Al objeto de evaluar los posibles riesgos ambientales de estos compuestos, resulta imprescindible el conocimiento de su distribución, comportamiento, destino y efectos tóxicos en el medio natural. La presente Tesis Doctoral tiene como objetivo fundamental el estudio de la biodegradabilidad y ecotoxicidad de diferentes familias de tensioactivos (catiónicos, noiónicos y aniónicos) en el medio acuático marino. En el capítulo 1 se lleva a cabo una revisión general de los aspectos fundamentales tratados en este trabajo. En primer lugar se resumen las características físico-químicas más importantes de los tensioactivos así como sus principales efectos adversos en el medio ambiente y la normativa vigente al respecto. Los principales modelos cinéticos de biodegradación y los aspectos más relevantes relacionados con el estudio de la toxicidad en el medio acuático marino son también presentados en este capítulo. El capítulo 2 describe la metodología utilizada durante el desarrollo del trabajo experimental. Se han realizado tres tipos de ensayos: ensayos de biodegradación, ensayos de toxicidad aguda estándar sobre organismos marinos y ensayos combinados de toxicidad y biodegradación. Todos los ensayos de biodegradación y toxicidad se realizaron en agua de mar natural procedente de la zona litoral de Sancti Petri (Cádiz, España). Las principales características físico-químicas de cada tensioactivo y medio de ensayo aparecen descritas en los capítulos correspondientes. Los capítulos 3, 4, 5 y 6 exponen los resultados obtenidos en los ensayos de biodegradación y ecotoxicidad de los diferentes tensioactivos estudiados así como en los ensayos combinados de biodegradación y toxicidad de los medios de ensayo. Así, en el capítulo 3 se lleva a cabo el estudio de la biodegradabilidad y ecotoxicidad de una sal de alquil trimetil amonio, en particular del cloruro de dodecil trimetil amonio (DTMAC), perteneciente a la familia de los tensioactivos catiónicos. El R-1 porcentaje de eliminación de carbono orgánico disuelto (COD) fue elevado, con un valor promedio del 91%. Los valores de tiempo de latencia y vida media fueron de 15,17 y 26,95 días, respectivamente. La toxicidad del tensioactivo dependió significativamente del organismo ensayado, siendo el crustáceo marino A. franciscana el menos sensible al mismo. En el caso de las microalgas, los valores de IC50 estuvieron comprendidos entre 0,69 y 6,34 mg L-1 DTMAC. El tensioactivo presenta una biodegradabilidad ambientalmente aceptable, ya que durante su biodegradación no se aprecia un aumento de la toxicidad del medio. En el capítulo 4 se muestran los resultados obtenidos para el tensioactivo no-iónico Tergitol®NP9, perteneciente al grupo de los nonilfenol etoxilados. Éstos indican la existencia de un potencial para la degradación del tensioactivo en el medio marino (porcentaje de biodegradación final superior al 80%). El modelo cinético que mejor describió la biodegradación final de Tergitol®NP9 bajo las condiciones ensayadas fue el modelo cinético de primer orden. Las microalgas presentaron una mayor toxicidad que el crustáceo A. franciscana, siendo las especies I. galbana y C. gracilis las más sensibles al tensioactivo. Los resultados parecen indicar que el tensioactivo no presenta una biodegradación ambientalmente aceptable dado que durante el proceso degradativo tuvo lugar la formación de metabolitos más tóxicos que el compuesto original. El capítulo 5 está dedicado a la biodegradabilidad y ecotoxicidad del tensioactivo aniónico Empicol®ESB 70/SP, perteneciente al grupo de los alquil etoxisulfatos. El porcentaje de eliminación de COD fue alto, aunque a una baja velocidad de degradación (>96,5% biodegradación al cabo de 124 días). Durante el proceso degradativo se distinguieron dos etapas, una primera que podría corresponder con la ruptura hidrolítica de la molécula, y otra en la que la degradación ocurre principalmente vía ω- y β-oxidaciones. En relación a la toxicidad, la microalga D. salina se mostró como la más sensible al tensioactivo. No se detectaron metabolitos más tóxicos durante la biodegradación del tensioactivo, lo cual indica que el tensioactivo presenta una biodegradabilidad ambientalmente aceptable. En el capítulo 6 se exponen los resultados obtenidos con un tensioactivo no-iónico alcohol etoxilado, conocido comercialmente como Findet®1214N/23. Los ensayos de biodegradación mostraron un elevado porcentaje de biodegradación final en agua de mar (>95%), aunque a una baja velocidad de biodegradación (tiempo de vida media= 56,8 días). El modelo de orden cero fue seleccionado para el cálculo del tiempo de latencia y vida media. Los valores de toxicidad para las microalgas (EC50) estuvieron comprendidos entre 5,0 mg L-1 para C. gracilis y 35,03 mg L-1 para el alga verde T. chuii, mientras que el crustáceo A. franciscana presentó un valor de LC50 (72-h) de 23,33 mg L-1. Los resultados obtenidos del experimento combinado de toxicidad y biodegradación indicaron una biodegradabilidad del tensioactivo ambientalmente aceptable. R-2 El capítulo 7 proporciona una síntesis y comparación de los resultados obtenidos en los estudios de esta investigación. Finalmente, se enumeran las principales conclusiones generales y se apunta por dónde deberían dirigirse las futuras investigaciones en este campo. R-3 SUMMARY The marine environment is made up of complex and diverse ecosystems such as coral reefs, mangrove forests, rocky and sandy shores, etc. These systems are composed of a specific biota represented by thousands of species which are often exposed to different pollutants generally derived from the human activities. Despite the fact that surfactants are mainly used in household detergent, they also have a large number of applications due to their physicochemical properties such as good foaming, high water solubility, low hardness sensitivity and dispersant properties. Since their high and increasing worldwide consumption, they have been identified as one of the major pollutants of the aquatic environment. In order to assess their environmental risks, the distribution, behaviour, fate and biological effects of these surfactants in the environment should be considered. The aim of the present Doctoral Thesis is to study the biodegradability and ecotoxicity of different families of surfactants (cationic, non-ionic and anionic) in the marine aquatic environment. Chapter 1 shows a revision of the fundamental concepts related to this work. Firstly, the main physico-chemical characteristics of the surfactants are summarised as well as their adverse effects in the environment and the recent legislation. The major biodegradation kinetic models, as well as the most relevant aspects related to the study of the toxicity in marine environments, are also presented in this chapter. Chapter 2 describes the methodology used in the present work. Three different types of studies have been carried out: biodegradation tests using commercial surfactants, toxicity tests of surfactants on marine organisms and studies concerning the evolution of testing medium toxicity during the biodegradative process of the surfactants. Pristine natural sea water samples collected from the coastal area of Sancti Petri (Cadiz, Spain) were used as test medium in the biodegradation and toxicity tests. Main physico-chemical characteristics of each surfactant and tested medium are shown in the corresponding chapters. Chapters 3, 4, 5 and 6 show the results obtained from the biodegradability and ecotoxicity tests of the different commercial surfactants as well as the combined toxicity and biodegradation tests of the test media. Chapter 3 studies the biodegradability and ecotoxicity of an alkyl trimethyl ammonium salt (DTMAC), a cationic surfactant. A high dissolved organic carbon (DOC) removal percentage was observed, showing a mean value of 91%. Lag and half-life times were 15.17 and 26.95 days, respectively. Toxicity of the cationic surfactant depended S-1 significantly on the tested organism, being the marine invertebrate A. franciscana the least sensitive species. In the case of microalgae, IC50 values ranged between 0.69 and 6.34 mg L-1 DTMAC. During the surfactant biodegradation process no increase of toxicity of the test medium with respect to the initial medium toxicity was observed, indicating that the surfactant shows an environmental acceptable biodegradability. Chapter 4 shows the results obtained for the non-ionic surfactant Tergitol®NP9, which belongs to the well known group of nonylphenol ethoxylates. The results indicated that there is a potential for the biodegradation of Tergitol®NP9 in sea water (ultimate biodegradation percentage >80%). The kinetic model which best described the ultimate biodegradation of the surfactant under the tested conditions was the first-order model. Microalgae showed a higher toxicity than the marine invertebrate A. franciscana, being the species I. galbana and C. gracilis the most sensitive. Biodegradation intermediates showed a higher toxicity than the parent compound, which means that the surfactant does not seem to show an environmental acceptable biodegradability. Chapter 5 studies the biodegradability and ecotoxicity of the commercial anionic Empicol ESB 70/SP, an alkyl ethoxysulphate surfactant. DOC removal percentage was relatively high, although at a slow biodegradation rate (biodegradation percentage >96.5% in 124 days). Two different stages were observed during the biodegradation process; the first stage would correspond with the breakdown of the molecule by means of hydrolytic reactions meanwhile the second stage may be characterized by the final degradation via ωand β-oxidations of the intermediates resulting from the first stage. Regarding the toxicity, the microalga D. salina was the most sensitive species. No toxic metabolites were detected during the biodegradation process, indicating that the surfactant shows an environmental acceptable biodegradability. ® Chapter 6 provides the biodegradability and ecotoxicity of the alcohol ethoxylate Findet®1214N/23, a non-ionic surfactant. The results obtained from the biodegradation tests indicated a high ultimate biodegradation percentage in sea water (>95%) although at a very slow rate (half-life time = 56.8 days). Zero-order kinetic model was the most appropriate model describing the surfactant kinetic under the conditions tested. Lag and half-life times were calculated from the selected kinetic model. EC50 values for microalgae ranged from 5.0 mg L-1 for C. gracilis to 35.03 mg L-1 for T. chuii meanwhile the marine invertebrate A. franciscana showed a 72-h LC50 value of 23.33 mg L-1. The results obtained from the study of the evolution of the test medium toxicity indicate that the surfactant shows an environmental acceptable biodegradability. Chapter 7 provides a synthesis and comparison of the results obtained from all the experiments and studies conducted during this investigation. Finally, the main general conclusions are listed and suggestions for future researches are provided. S-2 INTRODUCCIÓN Y OBJETIVOS Introducción y objetivos El medio marino constituye uno de los ecosistemas más importante del planeta, cubriendo un 71% de la superficie de la Tierra (361 x 106 km2) (Millero, 2006). Además, representa un 99% del espacio vital disponible y contiene un 90% de la biosfera, es decir, posee una mayor diversidad biológica que los ecosistemas terrestres y de agua dulce (CE, 2005). Incluye océanos, estuarios, salinas, lagunas saladas, y ecosistemas submareales, costeros y tropicales tales como arrecifes de coral y manglares. El medio ambiente marino desempeña un papel determinante en las condiciones climáticas y meteorológicas y resulta un elemento imprescindible para nuestra vida. Así, constituye nuestra principal fuente de oxígeno, albergando al mayor productor de oxígeno atmosférico, el fitoplancton marino, cuya producción supone alrededor del 90% de la producción mundial de oxígeno. Desde un punto de vista socio-económico, el medio acuático marino representa, sin lugar a dudas, un factor importante para la prosperidad económica, el bienestar social y la calidad de vida. A lo largo de la Historia, la distribución de los asentamientos del hombre no ha sido uniforme por toda la superficie terrestre, sino que ha tendido a concentrarse en las regiones más ricas, las cuales ofrecen un mayor número de posibilidades económicas y sociales. Se estima que, en la actualidad, la población litoral alberga de forma directa o indirecta el 50,3% de la población mundial, con una densidad de población media de 80 personas por km2, es decir, 2,5 veces superior al promedio total de la que habita en el interior de los continentes. Estas cifras indican la clara tendencia del hombre a desplazarse a estas zonas dada la ventaja que representa la riqueza de sus recursos, posicionándolas como áreas estratégicas y de gran relevancia para su estudio. Asimismo, entre los años 2000 y 2030, se prevé un aumento de la población urbana mundial del 72%, mientras que en el caso de la superficie del territorio ocupado por las ciudades de más de 100.000 habitantes se estima un aumento del 175%, lo que supone un importante incremento en la ocupación de las zonas costeras (Meléndez, 2007). Como consecuencia del aumento demográfico y de la industrialización, urbanización y turismo en las zonas costeras, el medio ambiente marino se encuentra sometido a un progresivo deterioro. Las aguas residuales constituyen, por volumen, la principal fuente de contaminación del medio marino y costero. Las descargas de aguas residuales costeras han aumentado de manera considerable en los tres últimos decenios. Estas aguas, además de nutrientes (nitrógeno y fósforo, principalmente) y materia orgánica fácilmente biodegradable, también contienen cantidades significativas de compuestos xenobióticos, es decir, compuestos orgánicos cuya única fuente en el medio ambiente es de origen antropogénica. Los tensioactivos constituyen, por volumen, uno de los principales compuestos xenobióticos presentes en las aguas residuales urbanas. Su producción anual mundial IO-2 Introducción y objetivos alcanza los 12,5 millones de toneladas por año, con un incremento anual estimado de 500.000 toneladas (Edser, 2006). Sin embargo, desde un punto de vista ambiental, existe una incertidumbre generalizada sobre el comportamiento de estos compuestos en el medio acuático y terrestre. La preocupación por la conservación del medio ambiente marino ha aumentado considerablemente en los últimos años. Una de las consecuencias más directas consiste en la implantación de nuevas restricciones para el uso de determinados compuestos así como reglamentaciones que limiten sus vertidos. La Comisión Europea (2003), basándose en el Reglamento Nº 1488/94 y las Directivas 93/67/EEC y 98/8/EC, elaboró una guía técnica para la evaluación de los posibles riesgos generados por la presencia de compuestos químicos en los diferentes compartimentos ambientales, entre ellos, el medio acuático marino. La evaluación de riesgo ambiental comprende el estudio del destino final de un determinado compuesto tras ser vertido al medio así como de los posibles efectos adversos sobre los organismos pertenecientes a los diferentes compartimentos ambientales receptores. El riesgo ambiental se calcula mediante la comparación de la concentración ambiental estimada (PEC) y la concentración estimada de no efecto (PNEC) para cada compartimento. Al objeto de evaluar el destino final de un determinado compuesto resulta sumamente necesario el conocimiento de los múltiples procesos y transformaciones físicoquímicas y biológicas a los que se puede ver sometido. La biodegradación constituye uno de los procesos degradativos más importantes, desempeñando un papel fundamental en la eliminación de compuestos en el medio receptor. Debido a que se ve influenciada por un gran número de factores ambientales, el estudio de la biodegradabilidad de un compuesto en un determinado compartimento ambiental supone una ardua tarea que no es posible abordar en un solo trabajo experimental. Se requiere el análisis de los resultados de múltiples trabajos realizados bajo diferentes condiciones que se puedan dar en el medio de estudio (naturaleza del medio, concentración del compuesto, temperatura, etc.) El estudio de la toxicidad constituye otro de los factores clave en la evaluación del riesgo ambiental pues nos permite establecer la concentración umbral de un determinado compuesto por encima de la cual se pueden producir efectos adversos en la biota y, en consecuencia, garantizar la integridad del ecosistema. A partir de las concentraciones de efectos calculadas para diferentes organismos (NOEC, LOEC, E(L)C50, etc.) se puede establecer un valor pronóstico de concentración ambiental que no produciría ningún efecto sobre la comunidad biológica (PNEC). IO-3 Introducción y objetivos Objetivos Objetivo general La presente Tesis Doctoral tiene como objetivo fundamental el estudio de la biodegradabilidad y ecotoxicidad de tensioactivos correspondientes a diferentes familias (sales de alquil trimetil amonio, nonilfenol etoxilados, alquil etoxisulfatos y alcoholes etoxilados) en el medio acuático marino. Objetivos específicos Para alcanzar este objetivo general, se han formulado diferentes objetivos específicos: • Estudiar la biodegradación final o mineralización de diferentes familias de tensioactivos mediante el método estandarizado de frasco agitado (OPPTS 835.3160 “Biodegradabilidad en agua de mar”), propuesto por la Agencia de Protección Ambiental de los Estados Unidos (USEPA). • Modelizar la cinética de biodegradación de los diferentes tensioactivos en agua de mar natural bajo condiciones ambientales controladas. • Estudiar la toxicidad aguda de los tensioactivos sobre diferentes organismos marinos: microalgas (Nannochloropsis gaditana, Isochrysis aff. galbana, Chaetoceros gracilis, Dunaliella salina y Tetraselmis chuii) y crustáceos marinos (Artemia franciscana). • Estudiar la evolución de la toxicidad de los diferentes medios de ensayos durante el proceso de biodegradación, al objeto de detectar la presencia de intermediatos de biodegradación que pueden resultar más tóxicos que el tensioactivo original. • Comparar los resultados obtenidos en los ensayos de biodegradación y ecotoxicidad para los diferentes tensioactivos ensayados. Estos objetivos proporcionan la base para el desarrollo del trabajo experimental, cuyos resultados son discutidos en los sucesivos capítulos. En el último apartado se resumen las conclusiones más relevantes de la presente Tesis Doctoral. IO-4 Introducción y objetivos Referencias CE, Comisión Europea, 1993. Directiva 93/67/EC de la Comisión, de 20 de julio de 1993,por la que se fijan los principios de evaluación del riesgo, para el ser humano y el medio ambiente, de las sustancias notificadas de acuerdo con la Directiva 67/548/CEE del Consejo. Official J. L., 227: 9-18. CE, Comisión Europea, 1994. Reglamento (CE) nº 1488/94 de la Comisión, de 28 de junio de 1994, por el que se establecen los principios de evaluación del riesgo para el ser humano y el medio ambiente de las sustancias existentes de acuerdo con el Reglamento (CEE) nº 793/93 del Consejo.Official J. L., 161: 3-11 CE, Comisión Europea, 1998. Directiva 98/8/CE del Parlamento Europeo y del Consejo de 16 de febrero de 1998 relativa a la comercialización de biocidas. Official J. L., 123: 1-63. CE, Comisión Europea, 2003. Guía Técnica Europea para la evaluación de riesgos basada en la Directiva 93/67/EC de la Comisión, de 20 de julio de 1993, el Reglamento (CE) nº 1488/94 de la Comisión, de 28 de junio de 1994, y la Directiva 98/8/CE del Parlamento Europeo y del Consejo de 16 de febrero de 1998. Agencia Europea de Sustancias Químicas, Italia. CE, Comisión Europea, 2005. Comunicación de la Comisión al Consejo y al Parlamento Europeo: Estrategia temática sobre la protección y la conservación del medio ambiente marino SEC(2005)1290. COM(2005)504 final. Bruselas, Bélgica. Edser, C., 2006. Latest market analysis. Focus on surfactants. An international newsletter monitoring technical and commercial developments for all surface active agents, Ed. Elsevier, Mayo, 2006. Meléndez, G., 2007. Liberar el potencial del crecimiento urbano. Informe sobre el Estado de la Población Mundial 2007. Fondo de Población de las Naciones Unidas (UNFPA). República Dominicana. Millero, F. J., 2006. Chemical Oceanography. (Eds) Kennish, M. J. Marine Science Series. CRC Press. Miami, Florida, USA. IO-5 Capítulo 1 ANTECEDENTES BIBLIOGRÁFICOS Resumen En el presente capítulo se lleva a cabo una breve revisión bibliografía de los aspectos más relevantes de la Tesis Doctoral. En primer lugar se resumen las características más importantes de los tensioactivos así como los posibles problemas que éstos pueden generar sobre el medio ambiente y la legislación vigente al respecto. Posteriormente, se describen los principales modelos cinéticos de biodegradación descritos en la bibliografía. Finalmente, se abordan aspectos relacionados con la toxicidad de compuestos en el medio acuático, en particular en el medio acuático marino. Capítulo 1 1. Tensioactivos y Medio Ambiente Los tensioactivos, también conocidos como agentes de superficie, constituyen un amplio grupo de compuestos químicos con un gran número de aplicaciones debido a sus propiedades de solubilidad, detergencia, resistencia a la dureza del agua, así como emulsionantes, dispersantes y humectantes. Estos compuestos, de naturaleza anfifílica, constan de dos partes estructurales o grupos bien diferenciados, uno hidrófilo y otro hidrófobo. La presencia de ambos grupos en su molécula le confieren diversas propiedades tales como la capacidad para disminuir la tensión superficial del agua, la formación de monocapas de esparcimiento ó de absorción en la interfase agua/aire, la formación de emulsiones y/ó microemulsiones, la formación de micelas, etc. En función del carácter iónico del grupo hidrófilo, los tensioactivos se dividen en cuatro grandes familias: aniónicos, cuando presentan una carga eléctrica negativa, catiónicos, cuando es positiva, anfóteros, cuando presentan propiedades aniónicas o catiónicas según el pH del medio y no-iónicos cuando aún presentando una ionicidad ésta no está definida netamente como negativa o positiva. En la Tabla I.1 se muestran los principales tipos de tensioactivos utilizados así como sus acrónimos. Tabla I.1. Acrónimos de los principales tipos de tensioactivos (Ying, 2006). Clase Tensioactivos aniónicos Tensioactivos No-iónicos Tensioactivos catiónicos I-2 Nombre común Acrónimo Lineal alquilbenceno sulfonatos LAS Alcanos sulfonatos secundarios SAS Alcoholes éter sulfatos (alquil etoxisulfatos) AES Alcoholes sulfatos (alquil sulfatos) AS Alquilfenoles etoxilados APE ó APEO Nonilfenoles etoxilados NPE ó NPEO Octilfenoles etoxilados OPE ó OPEO Alcoholes etoxilados AE ó AEO Sales de amonio cuaternario QAC Haluros de alquil trimetil amonio TMAC Haluros de alquil dimetil amonio DMAC Haluros de alquil bencil dimetil amonio BDMAC Haluros de dialquil dimetil amonio DADMAC Cloruro de bi(alquil grasa hidrogenada) dimetil amonio DTDMAC Cloruro de bi(alquil grasa hidrogenada) trimetil amonio DTTMAC Cloruro de dietil éster dimetil amonio DEEDMAC Antecedentes bibliográficos Desde un punto de vista comercial, los tensioactivos más utilizados han sido los lineal alquilbenceno sulfonatos (LAS), alquil etoxisulfatos (AES), alquil sulfatos (AS), alquilfenoles etoxilados (APE), alcoholes etoxilados (AE), y las sales de amonio cuaternario (QAC). Desde un punto de vista científico, los lineal alquilbenceno sulfonatos (LAS), alquil etoxisulfatos (AES) y las sales de amonio cuaternario (QAC) constituyen los tensioactivos más estudiados (Ying, 2006). Dada la gran versatilidad de tensioactivos, estos compuestos encuentran aplicación en numerosos campos tecnológicos. Entre éstas destacan: formulaciones de detergentes, productos de higiene corporal, cosméticos, aplicaciones alimentarias, pinturas y barnices, aplicaciones agrícolas, farmacéuticas, emulsiones de asfalto, tratamiento de cueros y/ó flotación de minerales. Producción y consumo de tensioactivos La producción mundial de tensioactivos alcanza unos 12,5 millones de toneladas por año, con un incremento anual estimado de 500.000 toneladas (Edser, 2006). Considerando la producción total de tensioactivos, alrededor del 60% corresponde a tensioactivos utilizados en detergentes domésticos, mientras que un 30% es empleado en aplicaciones técnicas e industriales, un 7% en limpieza industrial y 6% en productos de higiene corporal (Edser, 2006). En la Figura I.1 se representa el consumo total de tensioactivos para el año 2006 en las principales regiones del mundo. África 8,6% 6,9% Estados Unidos/Canadá 4,2% 2,8% 26,7% Europa Occidental China Centro Europa/Europa Oriental 11,4% Latino América 15,6% 23,9% Japón Oriente Medio Figura I.1. Consumo mundial de tensioactivos durante el año 2006 (Janshekar y col., 2006). En Europa, los datos más recientes encontrados estimaban una producción total de tensioactivos de 2,48 millones de toneladas para el año 2000, de los cuales un 49,6% corresponde a no iónicos, un 40,2% a tensioactivos aniónicos, un 8,3% a catiónicos y un 1,8 % a la producción de anfóteros (UMSICHT, 2003). I-3 Capítulo 1 En las Figuras I.2A y I.2B se representan la evolución del consumo de tensioactivos (excluidos los jabones) en España, durante los años 1996-2006. Existe un claro un aumento del consumo total de tensioactivos durante los últimos años, pasando de un valor de 240 a 388 millones de Kg, lo que supone un aumento total del 61% (INE, 2006). Asimismo, se observa un consumo fluctuante para los tensioactivos aniónicos, sin apenas incremento en valores absolutos durante la última década (Fig. I.2B). Para el resto de tensioactivos el consumo aumenta claramente, siendo más acusado en el caso de los tensioactivos catiónicos, superando ligeramente el consumo de aniónicos a partir del año 2002 (INE, 2006). 500 200 400 160 Cationicos Anionicos Otros 6 Consumo (10 Kg) Consumo (106 Kg) No-ionicos 300 200 100 0 1994 A 1996 1998 2000 2002 Año 2004 2006 2008 120 80 40 0 1994 B 1996 1998 2000 2002 2004 2006 2008 Año Figura I.2. Evolución del consumo de tensioactivos en España durante los años 19962006. (A) consumo total de tensioactivo, (B) consumo de tensioactivos por tipo (INE, 2006). Implicaciones ambientales A pesar del gran número de aplicaciones y de las numerosas ventajas que presentan los tensioactivos tanto en el ámbito industrial como económico y sanitario, desde un punto de vista ambiental, éstos son considerados como un importante contaminante del medio acuático. Una vez utilizados, estos compuestos llegan a las estaciones depuradoras a través de las aguas residuales urbanas e industriales y en determinados casos son vertidos directamente a las aguas superficiales. Durante el tratamiento de las aguas residuales, un elevado porcentaje de estos compuestos es eliminado mediante procesos de biodegradación y adsorción en el material particulado, mientras que los metabolitos generados son dispersados en los diferentes compartimentos ambientales (Ying, 2006). Los principales efectos atribuibles a los tensioactivos como consecuencia de su presencia en el medio acuático son: (1) producción de efectos tóxicos adversos sobre los organismos que habitan en el medio receptor, (2) producción de espumas tanto en ríos I-4 Antecedentes bibliográficos como en estaciones depuradoras de aguas residuales, (3) efectos sobre la aireación, coagulación y sedimentación en estaciones depuradoras de aguas residuales, y (4) contaminación de acuíferos (no es muy frecuente y suele ser consecuencia de otro tipo de contaminación mas importante). Normativa sobre tensioactivos y medio ambiente El creciente consumo de tensioactivos así como sus posibles repercusiones ambientales constituyen las principales razones por las que diferentes instituciones y organismos públicos hayan promulgado normas para el control y uso de estas sustancias. En el ámbito europeo, se han establecido diversas directivas relativas a la biodegrabilidad, control y uso de sustancias tensioactivas. Así, por ejemplo, la Directiva del Consejo 82/243/CEE regula la aspectos relacionados con la biodegradación de tensioactivos utilizados en formulaciones detergentes. También cabe destacar la incorporación legislativa en materia de calidad de agua de la Directiva Marco de Aguas (Directiva 60/2000/CE), la cual incluye a los compuestos 4-p-nonilfenol y p-ter-octifenol, derivados de los tensioactivos nonilfenoles etoxilados y octilfenoles etoxilados, respectivamente, en la lista de sustancias prioritarias en el ámbito de la política de aguas. En el ámbito estatal, la reglamentación técnico-sanitaria para la elaboración, circulación y comercio de detergentes y limpiadores es regulada mediante el Real Decreto 770/1999, de 7 de Mayo mientras que en el ámbito autonómico andaluz la Consejería de Medio Ambiente en 1997 publicó la Orden de de 14 de Febrero, por la que se clasifican las aguas litorales andaluzas y se establecen los objetivos de calidad de las aguas afectadas directamente por los vertidos. I-5 Capítulo 1 2. Biodegradabilidad en el medio acuático La biodegradación constituye uno de los principales procesos de transformación de los compuestos xenobióticos en el medio acuático. Durante dicho proceso, los microorganismos utilizan los tensioactivos como fuente de energía (procesos catabólicos) y/ó sustrato (procesos anabólicos) (Ying, 2006). En el proceso de biodegradación de compuestos orgánicos intervienen numerosas variables tales como las características físico-químicas del medio (oxígeno disuelto, temperatura, pH, luz, concentración de nutrientes, etc.), las características físico-químicas del compuesto (solubilidad, concentración, etc.) y/ó los microorganismos presentes (tipos, concentración, etc.). Modelos cinéticos de biodegradación El conocimiento de la cinética de biodegradación de un determinado contaminante orgánico resulta esencial a la hora de evaluar su persistencia en el medio y valorar los posibles riesgos que pueden suponer para la biota. Asimismo, nos permite conocer la concentración de tensioactivo en cualquier instante, predecir los niveles más probables, y evaluar si el compuesto será eliminado antes de ser transportado a un comportamiento ambiental determinado (Alexander, 1994). Modelo cinético de Monod La mayoría de los modelos cinéticos para el crecimiento celular y el consumo de sustrato se encuentran basados en el modelo cinético Monod (1949), cuya ecuación viene dada por la siguiente expresión: μ= μ max ·S Ks + S (1) donde μ es la velocidad específica de crecimiento, μmax es la máxima velocidad específica de crecimiento, S es la concentración de sustrato limitante del crecimiento celular, y Ks es una constante que representa la concentración de sustrato a la cual la velocidad de crecimiento es la mitad de la velocidad máxima. En la Figura I.3 se representa gráficamente la expresión correspondiente al modelo cinético de Monod. I-6 Antecedentes bibliográficos μ (T-1) μmax μmax/2 Ks Concentración de Sustrato (M V-1) Figura I.3. Evolución de la velocidad específica de crecimiento en función de la concentración de sustrato. Existen determinadas limitaciones a la hora de aplicar el modelo cinético de Monod a la biodegradación de compuestos en el medio acuático. En primer lugar, el modelo esta concebido para un cultivo bacteriano puro, el cual utiliza el sustrato como fuente de carbono y energía. En segundo lugar, el modelo considera el sustrato en cuestión como la única fuente de carbono. Finalmente, asume que el compuesto orgánico es totalmente soluble en agua y no presenta ningún efecto tóxico sobre los microorganismos, que los organismos se encuentran en un medio líquido bien aireado y que los nutrientes inorgánicos y factores de crecimiento necesarios están presentes en exceso. A pesar de que el modelo de Monod no es aplicable a determinados procesos degradativos, existen muchas otras situaciones en las que este modelo proporciona una buena aproximación para modelizar el crecimiento de cultivos mixtos y consumo de sustrato limitante del crecimiento (Simkins y Alexander, 1984). Simplificaciones del modelo cinético de Monod Simkins y Alexander (1984), a partir de simplificaciones del modelo cinético de Monod, obtuvieron seis modelos cinéticos de mineralización, incluyendo exclusivamente las variables concentración de sustrato y densidad celular. En la Tabla I.2 se recogen los diferentes modelos cinéticos propuestos por Simkins y Alexander, así como las condiciones necesarias para su aplicación. I-7 Capítulo 1 Tabla I.2. Modelos cinéticos de biodegradación usando solamente las variables concentración de sustrato y biomasa (Simkins y Alexander, 1984). Modelo Condiciones necesarias Ecuación -dS/dt = A) Primer Orden B0 >> S0 S0 << KS K1 · S B) Logístico S0 << KS K3 · S · (S0 + B0 - S) B0 >> S0 K0 • S ( KS + S ) C) Monod (sin crecimiento) D) Monod (con crecimiento) E) Orden Cero F) Logarítmico Ninguna B0 >> S0 S0 >> KS S0 >> KS Constantes Unidades de las constantes μmax • B0 K1 = h-1 KS μmax K3 = KS mg · L-1 · h-1 K0 = μmax · B0 mg · L-1 · h-1 μmax h-1 K0 K0 = μmax · B0 mg · L-1 · h-1 μmax · (S0 + B0 - S) μmax h-1 μmax • S • ( S0 + B0 − S ) ( KS + S ) S0= concentración inicial de sustrato; S= concentración de sustrato; Ks= constante que representa la concentración de sustrato a la cual la velocidad de crecimiento es la mitad de la velocidad máxima; B0= cantidad de sustrato requerido para producir una concentración inicial de microorganismos X0; μmax= máxima velocidad específica de crecimiento, S es la concentración de sustrato limitante del crecimiento celular En la Figura I.4 se resume gráficamente las diferentes condiciones (columna 2 de la Tabla I.2) bajo las cuales son aplicables los modelos cinéticos propuestos por Simkins y Alexander (1984). Log10 X0 A PRIMER ORDEN C MONOD (sin crecimiento) E ORDEN CERO F D MONOD (con crecimiento) LOGARÍTMICA B LOGÍSTICA Concentración de Sustrato Figura I.4. Modelos cinéticos en función de la concentración de sustrato y biomasa (Simkins y Alexander, 1984). I-8 Antecedentes bibliográficos Las curvas de biodegradación correspondientes a los diferentes modelos cinéticos de Simkins y Alexander se representan en la Figura I.5. Al igual que ocurre con la cinética de Monod, estos modelos presentan una serie de limitaciones que deberían tenerse en cuenta a la hora de su aplicación. En primer lugar, estos modelos cinéticos asumen una producción constante de células en el tiempo así como un rendimiento constante biomasasustrato. Por otro lado, estos modelos no son aplicables cuando influye de manera decisiva determinados factores ambientales tales como la presencia de otros sustratos, depredación por protozoos, presencia de compuestos inhibidores, etc. 100 90 Sustrato remanente (%) 80 70 C B 60 E F 50 40 A D 30 20 10 0 Tiempo Figura I.5. Curvas de biodegradación de compuestos de acuerdo con los modelos cinéticos mostrados en la Tabla I.2. (Alexander, 1985). Modelo cinético de Quiroga-Sales y Romero Para salvar estos inconvenientes, Quiroga y Sales (1988) desarrollaron un modelo cinético en el que la velocidad de degradación viene dada por un polinomio de segundo grado, el cual es sólo función de la concentración de sustrato, y cuya ecuación viene dada por la siguiente expresión: - dS = K2 • ST2 + K1 • ST + K0 dt (7) donde K0, K1 y K2 corresponden a los coeficientes del polinomio de segundo grado y ST es la concentración de sustrato en un tiempo T. Separando variables e integrando la ecuación 7 obtenemos la expresión para la concentración de tensioactivo, la cual viene dada por la siguiente ecuación: I-9 Capítulo 1 S= h • ( S0 − q ) − q • ( S0 − h) • e p •t ( S0 − q ) − ( S0 − h) • e p •t (8) siendo: p= K12 − 4 • K2 • K0 q= ( − K1 + p) 2 • K2 h= ( − K1 − p) 2 • K2 S0 = concentración inicial de sustrato. De la ecuación 8 se sigue que la velocidad de consumo de sustrato se anula cuando la concentración de sustrato presente en el medio es igual a "q" o "h", ya que éstas serían las soluciones de dicha ecuación. El hecho de que la velocidad de consumo de sustrato se anule para el valor de concentración de materia orgánica S = q, implica que q es el valor mínimo alcanzable de concentración de materia orgánica y, por tanto, representa el nivel de materia orgánica no biodegradable para este tipo de microorganismos. Romero (1991), estudiando el comportamiento de procesos de degradación en discontinuo, obtuvo una ecuación basada en un polinomio de segundo grado respecto a la concentración de sustrato presente en el medio, similar a la ecuación empírica propuesta por Quiroga y Sales (1988). La ecuación viene dada por la siguiente expresión: St = S 0 • ( S t 0 − S nb ) + S nb • ( S t 0 − S 0) • e μ max •t ( S t 0 − S nb ) + ( S t 0 − S 0) • e (9) μ max • t donde St es la concentración total de sustrato en un instante t, Sto es la concentración inicial total de sustrato, S0 es la máxima concentración de sustrato invertible en formación de biomasa, Snb es la concentración de sustrato no biodegradable, y µmax es la máxima velocidad específica de crecimiento de los microorganismos. Romero (1991) da una interpretación física a los parámetros cinéticos p, h y q obtenidos por Quiroga y Sales (1988) a partir de las expresiones matemáticas utilizadas. Así, p tendría el significado de una velocidad máxima ya que es el producto de la constante de velocidad observada por la concentración máxima de microorganismos alcanzable en el medio. Es decir, supondría aquella velocidad máxima alcanzable cuando el término K2 = 0. El término h tiene dimensiones de sustrato y corresponde a la máxima cantidad disponible I-10 Antecedentes bibliográficos en el medio para formar biomasa e incluye el término relativo a la concentración inicial de microorganismos. Finalmente, el término q representa la concentración de sustrato no metabolizable por los microorganismos. Lógicamente, la velocidad de degradación en procesos discontinuos se anula para los valores de h y q (cuando aún no han comenzado a degradar al sustrato, S=S0=h, y cuando no existe sustrato biodegradable en el medio, S=Snb=q, respectivamente). Este modelo ha sido aplicado con éxito tanto a la degradación de tensioactivos en aguas naturales (Perales y col., 1999; Quiroga y col., 1999; Manzano y col., 1998, 1999) como a otros sustratos orgánicos (vinazas y FORSU) (Romero, 1991; Fernández, 2008). I-11 Capítulo 1 3. Toxicidad en el medio acuático El incremento de la producción y uso de sustancias potencialmente tóxicas, y el papel del medio acuático como sumidero de muchas de ellas ha hecho que cada vez sea más necesario poder valorar los efectos de tales compuestos, no sólo sobre el hombre, sino también sobre los organismos y ecosistemas. La experiencia muestra que es menos costoso, económica y ambientalmente, prevenir la posible contaminación de un ecosistema que su posterior recuperación (Van Leewen, 1990). La presencia de compuestos xenobióticos en el medio natural puede generar efectos considerables sobre otros compuestos que existen de manera natural en el medio, sobre componentes físicos y biológicos y/ó sobre determinados procesos claves para la supervivencia del ecosistema. La magnitud de tales efectos depende de las propiedades físico-químicas del contaminante y sus metabolitos, la concentración de compuesto en el medio, la frecuencia de descarga y las propiedades de los propios ecosistemas (Ramamoorthy y Baddaloo, 1995). Además, dada la singularidad de cada medio, un ecosistema nunca resulta representativo de otro (Koyman, 1987; Van Leewen, 1990). Así, ecosistemas aparentemente similares pueden ser afectados de manera diferente por una misma concentración de un determinado compuesto. Por lo tanto, a la hora de evaluar los posibles efectos de un determinado compuesto en el medio natural resulta imprescindible considerar todas y cada una de las condiciones que caracterizan al ecosistema en cuestión. Un factor determinante en el efecto de un contaminante es el periodo de exposición. Así, en función del tipo de exposición, se distinguen dos tipos de efectos: efectos agudos, aquellos debidos a exposiciones de una elevada concentración de compuesto durante un periodo de tiempo relativamente corto, y efectos crónicos, aquellos generados por la exposición prolongada a una baja concentración de un determinado compuesto (Ramamoorthy y Baddaloo, 1995). Evaluación de la toxicidad acuática. Tipos de ensayos de toxicidad La toxicología acuática estudia los posibles efectos adversos de compuestos químicos y sus mezclas sobre organismos acuáticos en diferentes niveles de organización, desde el subcelular y organismos individuales hasta comunidades y ecosistemas (Rand, 1995). La toxicología acuática se centra, básicamente, en aquellos efectos agudos y crónicos considerados como adversos tales como mortalidad, efectos sobre el crecimiento, reproducción, etc., así como de los procesos de recuperación de la biota cuando la exposición cesa. Una relativamente reciente rama de la toxicología consiste en el estudio de la relación entre los efectos tóxicos y la estructura molecular, y es conocida por las siglas en inglés QSAR (Quantitative Structure Activity Relationship), y tiene como objetivo final I-12 Antecedentes bibliográficos tener una cierta capacidad de predicción de efecto de los compuestos sobre los organismos en función de sus propiedades estructurales (Rand, 1995). La evaluación de los efectos potenciales toxicológicos de compuestos en organismos acuáticos, es decir, la concentración de un compuesto y el tiempo de exposición necesario para producir un determinado efecto, se lleva a cabo mediante ensayos de toxicidad acuática. En función del tipo de exposición al que el organismo es sometida, distinguimos tres tipos de ensayos de toxicidad: aguda, subcrónica, y crónica. Los ensayos de toxicidad aguda están diseñados para determinar la concentración de compuesto que produce efectos adversos en los organismos expuestos durante un corto periodo de tiempo en un medio controlado (Ramamoorthy y Baddaloo, 1995). Los criterios de efecto más utilizados en este tipo de ensayos son la mortalidad, inmovilidad, pérdida de equilibrio, e inhibición del crecimiento. Generalmente, su duración suele estar comprendida entre las 24 y 96 horas, aunque en algunos casos este periodo no está predeterminado (Rand, 1995). Los ensayos de toxicidad crónica permiten evaluar los posibles efectos adversos de compuestos bajo unas condiciones de exposición a largo plazo y empleando concentraciones subletales (Rand, 1995). En este tipo de ensayos, la respuesta tóxica observada puede ser el resultado de los efectos directos del compuesto en cuestión, de una forma alterada del compuesto, de una redistribución de los metabolitos en el organismo, y/ó efectos en órganos diana, y en sistemas enzimáticos y hormonales. Su duración suele ser variable; en un ensayo crónico completo el organismo es expuesto al compuesto durante un ciclo de vida reproductivo completo. Los procedimientos de toxicidad subcrónica están diseñados generalmente para evaluar los efectos adversos de compuestos administrados a organismos durante repetidas exposiciones en una dosis diaria desde un periodo de varios días hasta 3 o 4 meses. Son considerados ensayos de exposición prolongada y sus dosis de efecto son inferiores a las empleadas en los ensayos de toxicidad aguda. El periodo de estudio suele variar entre los 21 y 30 días, con un incremento en el nivel de dosis al final del periodo y una prolongación del tratamiento por un periodo adicional si los efectos son cuestionables. En general, los ensayos de toxicidad deben de cumplir una serie de requerimientos mínimos. Así, por ejemplo, la respuesta de un determinado ensayo debe ser repetible; no sería válido un ensayo que cada vez que se realizase los resultados difirieran entre sí, aunque siempre existe una variabilidad en la respuesta debido al factor de manipulación que deberá minimizarse lo máximo posible. Además, dada la gran variabilidad que introducen los propios organismos, se deben buscar aquellos cuyo tamaño permita que cada ensayo se lleve a cabo con un gran número de especies. Por otro lado, la Directiva 2000/60/CE, I-13 Capítulo 1 Marco de Aguas, recomienda la obtención de datos de toxicidad, tanto puntuales (agudos) como correspondientes a un periodo prolongado en el tiempo (crónicos), a partir de diferentes taxones acuáticos (algas y /o macrófitos, invertebrados, peces, etc.). Un factor a tener en cuenta en los ensayos de toxicidad es la homogeneidad de los ensayos con respecto a la heterogeneidad de los ecosistemas. Esto se puede reflejar en la intervención de variables que no son tenidas en cuenta en estudios puntuales (Van Leewen, 1990). Como ejemplo no deben olvidarse los posibles efectos de una desviación de la temperatura media para determinada una época pudiendo acentuar la toxicidad del compuesto en cuestión. El ciclo de vida del organismo ensayado constituye otro de los factores a tener en cuenta, ya que la toxicidad puede verse acentuada o mitigada en función de la “edad” del organismo. Asimismo, también resulta importante realizar estudios exhaustivos que nos permitan comprobar la representatividad de las especies seleccionadas con respecto al compartimento que estamos estudiados. Parámetros ambientales Al objeto de establecer las concentraciones admisibles para un determinado organismo expuesto y comparar los efectos producidos en individuos procedentes de diferentes niveles de organización, resulta necesario medir y expresar la toxicidad de forma cuantitativa. Los valores generados en los ensayos de toxicidad nos permite determinar la concentración más alta del compuesto ensayado que no produce ningún efecto estadísticamente significativo en organismos de ensayos en comparación con los organismos control (NOEC, “no-observed-effect concentration”) así como la concentración más baja a la que se observa un efecto estadísticamente significativo (LOEC, “lowestobserved-effect concentration”). Sin embargo, el concepto de “no efecto” se encuentra poco definido y es específico para cada especie, ya que considera cualquier efecto subletal que difícilmente será generalizable para toda la comunidad biológica. Por ello y al objeto de facilitar la comparación entre los resultados obtenidos en ensayos de toxicidad bien de un mismo compuesto sobre diferentes organismos, o bien la de diferentes compuestos sobre el mismo organismo, se emplea preferentemente los valores de LC50, concentración en la cual se observa un 50% de mortalidad de los organismos ensayados, o EC50, concentración en la que se observa un efecto determinado (por ejemplo, inhibición de crecimiento) en el 50% de los organismos después de un cierto tiempo de exposición (Rand, 1995). La mayoría de los estudios de toxicidad van dirigidos a la obtención de información para calcular el riesgo ambiental. La evaluación del riesgo ambiental se basa en el cálculo de la concentración ambiental que no produciría efecto alguno sobre la comunidad ecológica (PNEC, “predicted no effect concentration”), la cual es obtenida a partir de las parámetros ambientales de los correspondientes ensayos de toxicidad (NOEC, LC50, EC50, etc.). I-14 Antecedentes bibliográficos Ensayos de toxicidad en agua de mar Son numerosos los ensayos de toxicidad que se han llevado a cabo con diferentes organismos acuáticos marinos correspondientes a diferentes grupos taxonómicos. Sin embargo, tan sólo un reducido número de estos ensayos han sido desarrollados formalmente y considerados como ensayos normalizados para incorporarlos a los procedimientos regulativos de las normativas o textos legislativos. La gran mayoría de los procedimientos de los ensayos de toxicidad en agua de mar se limitan a una respuesta aguda o un ensayo a corto plazo no superior a 4 días, y generalmente utilizando como especies de ensayo a peces e invertebrados para determinar la concentración letal media (LC50) o la concentración efectiva media (EC50) del compuesto en cuestión. De hecho, basándose en la limitada información que existe actualmente acerca del cultivo en laboratorio, sobre los ciclos de vida, la dieta y las posibles enfermedades de un gran número de las especies estudiadas en agua de mar, tan sólo un pequeño número de estos ensayos podrían considerarse como estándares (Garrido, 2002). En la Tabla I.3 se muestran los principales ensayos toxicidad en agua de mar encontrados en la bibliografía (Rand, 1995). En la actualidad, también es posible encontrar una extensa bibliografía acerca de protocolos de ensayos de toxicidad estandarizados en las paginas web de organismos oficiales gubernamentales y ambientales tales como USEPA (Agencia de Protección Ambiental de los Estados Unidos), ECETOC (Centro Europeo de Ecotoxicología y Toxicología de Compuestos Químicos), OCDE (Organización para la Cooperación y el Desarrollo Económico), etc. I-15 Capítulo 1 Tabla I.3. CÓDIGO 8111 8112 8310 8410 8510 8610 8710 8712 8720 8910 E-1191-90 E-729-88a E-1241-92 E-1440-91 E-724-89 E-1463-92 E-1367-92 E-1192-88 E-1218-90 1004 1005 1006 1007 1008 1009 797.1050 797.1075 797.1400 y 40 797.1520 y 60 797.1600 797.1800 797.1930 y 50 797.1970 I-16 Ensayos de toxicidad de agua de mar (Rand, 1995, modificado por Garrido, 2002). TÍTULO Métodos Normalizados, Parte 8000 (APHA y col., 1992) Bioestimulación (Productividad algal) Procedimiento de ensayo de toxicidad para fitoplancton Procedimiento de ensayo de toxicidad para protozoos ciliados Procedimiento de ensayo de toxicidad de corales escleroactínidos Procedimiento de ensayo de toxicidad de anélidos Procedimiento de ensayo de toxicidad de moluscos Procedimiento de ensayo de toxicidad de microcrustáceos Procedimiento de ensayo de toxicidad de acartia Procedimiento de ensayo de toxicidad de macrocrustáceos Procedimiento de ensayo de toxicidad de peces ASTM (ASTM, 1993) Guía para realizar ensayos de toxicidad durante el ciclo de vida en mísidios Guía para realizar ensayos de toxicidad aguda con peces, macroinvertebrados, y anfibios Guía para realizar ensayos de toxicidad durante estadios tempranos de vida de Peces Guía para realizar ensayos de toxicidad aguda con el rotífero del género Brachionus Guía para realizar ensayos de toxicidad agudos de tipo estáticos y de flujo continuo con embriones de cuatro especies de moluscos bivalvos de agua de mar Guía para realizar ensayos de toxicidad agudos estáticos y de flujo continuo con mísidios de la Costa Oeste de EEUU Guía para realizar ensayos de toxicidad en sedimentos de 10 días de duración con anfípodos marinos y estuáricos Guía para realizar ensayos de toxicidad aguda en efluentes acuosos con peces, macroinvertebrados y anfibios Guía para realizar ensayos de toxicidad estática de 96-horas con microalgas Test Agudos en Efluentes de la EPA (USEPA, 1991) Ensayos de toxicidad aguda en efluentes con Mysidopsis bahía Ensayos de toxicidad aguda en efluentes con Cyprinodon variegatus Ensayos de toxicidad aguda en efluentes con Menidia sp. Test Crónicos en Efluentes de la EPA (USEPA, 1991) Método de supervivientes larvarios y ensayos de crecimiento de Cyprinodon variegatus Método de supervivientes embrio-larvales y ensayo de teratogeneicidad de Cyprinodon variegatus Método de supervivientes larvarios y crecimiento de Menidia Beryllina Método de supervivencia, crecimiento y ensayo de fecundidad de Mysidopsis bahia Método del ensayo de fertilización del erizo de mar Arbacia punctulata Método del ensayo de reproducción sexual algal de Champia parvulata EPA TSCA Procedimientos de toxicidad del Código de regulación Federal (TSCA, 1990) Ensayo de toxicidad aguda en algas Ensayo de toxicidad aguda en algas de agua dulce y marina Ensayo de toxicidad aguda en peces Ensayo de bioconcentración en peces Ensayo de toxicidad con estadios tempranos de peces Ensayo de toxicidad aguda en ostras Ensayo de toxicidad aguda con mísidios (camarones) Ensayo de toxicidad aguda con pendidos EPA-FIFRA Procedimientos de toxicidad (USEPA, 1985, 1986) Procedimiento de Evaluación Estándar: Ensayos de toxicidad aguda para organismos marinos y estuáricos: - Ensayo de toxicidad de 96-horas para peces estuáricos (EPA-540/9-85-009, 1985) - Test de Toxicidad de 96 horas para camarones (EPA-540/9-85-010, 1985) - Procedimiento de Evaluación Estándar: Test de Toxicidad Aguda para organismos marinos y estuáricos (Estudio de deposición de concha en moluscos de 96 horas y flujo abierto) (EPA- 540/1-85-011, 1985) - Procedimiento de Evaluación Estándar: Test de Toxicidad Aguda para organismos marinos y estuáricos (Estudio de embriones y larvas en moluscos de 48 horas) (EPA-540/9-86-012, 1986) - Procedimiento de Evaluación Estándar: Estadios tempranos de vida en peces (EPA-540/9-86-138, 1986) - Procedimiento de Evaluación Estándar: Test de Toxicidad durante el ciclo de vida en peces (EPA-540/9-86-137, 1986) - Procedimiento de Evaluación Estándar: Plantas no-vasculares: Crecimiento y Reproducción en Plantas Acuáticas -Nivel 1 y 2 (EPA 540/9-86-134, 1986) OECD Test Guidelines No especifica procedimientos de ensayos de toxicidad en agua salada Medioambiente Canadá (Environment Canada, 1992) Test de toxicidad aguda en sedimentos usando anfípodos marinos y de estuario Ensayo de fertilización con equinoideos Antecedentes bibliográficos Referencias Alexander, M., 1985. Biodegradation of organic chemicals. Env. Sci. Technol. 18, 106-111. Alexander, M., 1994. Biodegradation and biorremediation. Academic Press, Inc. Londres. APHA, AWWA, WPCF, 1992. Standard Methods for the Examination of Water and Wastewater. American Public Health Association, Washington DC. ASTM, 1993. En: ASTM (Ed.). Annual Book of ASTM Standards. ASTM, Philadelphia, PA. BOE, 1999. Real Decreto 770/1999 de 7 de Mayo por el que se aprueba la reglamentación técnico-sanitaria para la elaboración, circulación y comercio de detergentes limpiadores. BOE nº 118 de 18 de Mayo de 1999. BOJA, 1997. Orden de 14 de Febrero de 1997 por la que se clasifican las aguas litorales andaluzas y se establecen los objetivos de calidad de las aguas afectadas directamente por los vertidos. BOJA nº 27 de 1997 de 4 de Marzo de 1997. CE, Comisión Europea, 1982. Directiva 82/243/CE referente a la aproximación de las legislaciones de los estados miembros relativas a los métodos de control de la biodegradabilidad de los tensioactivos aniónicos. Bruselas, Bélgica, DO L 109/18 de 1982. CE, Comisión Europea, 2000. Directiva 2000/60/CE del parlamento Europeo y del Consejo, de 23 de octubre de 2000, por la que se establece un marco comunitario de actuación en el ámbito de la política de aguas DOCE 327/l de 2000. Edser, C., 2006. Latest market analysis. En: Elsevier (Ed.). Focus on surfactants. Environment Canada, 1992. Biological Test Methods. Environment Canada, Conservation and Protection, Ottawa, Ontario, Canada. Fernández, L. A., 2008. Caracterización cinética de la degradación anaerobia termofílica seca de la FORSU. Efecto de diferentes pretratamientos sobre la biodegradabilidad del residuo. Tesis Doctoral. Dpto. Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. Garrido, M.C., 2002. Criterios de calidad ambiental. Aplicación a aguas limitadas del Golfo de Cádiz. Tesis Doctoral. Dpto. Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. INE, 2006. Instituto Nacional de Estadística. http://www.ine.es/pls/nomen/eip_entrada. Janshekar, H., R.J. Chang, R.J., Yokose, K., Ma, X., 2006. Surfactants In: Consulting, S. (Ed.). http://www.sriconsulting.com/SCUP/Public/Reports/SURFA000/, China. Koyman, S.A.L.M., 1987. A safety factor for IC50 values allowing for differences among species. Water Res 21, 269-276. Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1998. Effect of concentration on the biodegradation of a nonylphenol polyethoxylate in river water. Bull Environ Contam Toxicol 61, 489-496. I-17 Capítulo 1 Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1999. The effect of temperature on the biodegradation of a nonylphenol polyethoxylate in river water. Water Res 33, 2593-2600. Monod, J., 1949. The growth of bacterial cultures. Ann. Rev. Microbiol. 3, 371-380. Perales, J.A., Manzano, M.A., Sales, D., Quiroga, J.M., 1999. Biodegradation kinetics of LAS in river water. International Biodeterioration & Biodegradation 43, 155-160. Quiroga, J. M. y Sales, D., 1988. Degradación de Tensioactivos aniónicos por las bacterias presentes en el agua de mar. Ingeniería Química, vol. agosto, 103-106. Quiroga, J.M., Perales, J.A., Romero, L.I., Sales, D., 1999. Biodegradation kinetics of surfactants in seawater. Chemosphere 39, 1957-1969. Ramamoorthy, S. y Baddaloo, E. G., 1995. Handbook of chemical toxicity profiles of biological species. Vol. I.: Aquatic species. CRC Press, Inc., Florida, USA. Rand, G.M., 1995. Fundamentals of aquatic toxicology. Effects, Environmental Fate and Risk Assessment. Taylor & Francis, Washington. Romero, L.I., 1991. Desarrollo de un modelo matemático general para los procesos de fermentación: cinética de la biodegradación anaerobia. Tesis Doctoral. Dpto. Ing. Qca., Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. Simkins, S., Alexander, M., 1984. Models for mineralization kinetics with the variables of substrate concentration and population density. Appl Environ Microbiol 47, 1299-1306. TSCA, 1990. Environmental effects testing guidelines. 40 CFR. UMSICHT, F.I., 2003. Anaerobic Biodegradation of Detergent Surfactants. Oberhausen. USEPA, 1985. Toxic substances control act test guidelines; final rules. Federal Register 50: 797.1050, 797.1075 y 797.1060. USEPA, 1986. Quality Criteria for Water. EPA 440/5-86-001.Washington DC. USEPA, 1991. Pre-draft technical guidance on the application of sediment quality criteria for the protection of aquatic life. Office of Science and Technology Washington, Distrito de Colombia. Van Leewen, K., 1990. Ecotoxicological effects assessment in the Netherland: recent development. Environmental Managament 14(6). Ying, G.G., 2006. Fate, behavior and effects of surfactants and their degradation products in the environment. Environ Int 32, 417-431. I-18 Capítulo 2 METODOLOGÍA Resumen El capítulo que a continuación se presenta recoge la metodología empleada durante la realización del trabajo experimental. En primer lugar se detalla el diseño experimental seguido para el estudio de la biodegradabilidad y toxicidad de los diversos tensioactivos así como las condiciones de cada ensayo realizado. A continuación se describen los métodos de ensayo de biodegradación en agua de mar, de toxicidad aguda estándar con microalgas y crustáceos marinos, y finalmente, la metodología seguida en los ensayos de toxicidad durante la biodegradación de los tensioactivos. Capítulo 2 1. Diseño experimental En el siguiente apartado se describen las condiciones de los ensayos de biodegradación, toxicidad aguda estándar y los ensayos combinados de toxicidad y biodegradación. Ensayos de biodegradación Al objeto de estudiar la biodegradabilidad final ó mineralización de los diferentes tensioactivos en el medio acuático marino, se han llevado a cabo diversos ensayos de biodegradación. El método empleado fue el de frasco agitado, propuesto por la USEPA (1998a). En las Tablas II.1, II.2, II.3 y II.4 aparecen recogidas las condiciones de cada uno de estos ensayos para los diferentes tensioactivos: tipo de ensayo, identificación, concentración inicial de tensioactivo, concentración de benzoato sódico (sustancia de referencia) y concentración de HgCl2. Todos los medios de ensayos estuvieron basados en una matriz de agua de mar natural. La localización del punto de toma de muestra así como las condiciones de ensayo aparecen recogidas en los apartados 2 y 3 del presente capítulo, respectivamente. Las principales características físico-químicas de los medios de ensayo así como de los tensioactivos empleados se detallan en los correspondientes capítulos (capítulos 3, 4, 5 y 6). Tabla II.1. Diseño de experimentos para el estudio de la biodegradabilidad del tensioactivo catiónico cloruro de dodecil trimetil amonio (DTMAC). Ensayo Código Control Referencia Abiótico Tensioactivo Tensioactivo Tensioactivo CO1 REF1 AB1 C1 C2 C3 DTMAC (mg L-1 COD) 18 18 18 18 Benzoato sódico (mg L-1 COD) 15 - HgCl2 (mg L-1) 100 - Tabla II.2. Diseño de experimentos para el estudio de la biodegradabilidad del tensioactivo no-iónico nonilfenol etoxilado (NPEO). II-2 Ensayo Código Control Referencia Abiótico Tensioactivo Tensioactivo Tensioactivo CO2 REF2 AB2 N1 N2 N3 NPEO (mg L-1 COD) 12 12 12 12 Benzoato sódico (mg L-1 COD) 20 - HgCl2 (mg L-1) 100 - Metodología Tabla II.3. Diseño de experimentos para el estudio de la biodegradabilidad del tensioactivo aniónico alquil etoxisulfato (AES). Ensayo Código Control Referencia Abiótico Tensioactivo Tensioactivo Tensioactivo CO3 REF3 AB3 AES1 AES2 AES3 AES (mg L-1 COD) 18 18 18 18 Benzoato sódico (mg L-1 COD) 15 - HgCl2 (mg L-1) 100 - Tabla II.4. Diseño de experimentos para el estudio de la biodegradabilidad del tensioactivo no-iónico alcohol etoxilado (AE). Ensayo Código Control Referencia Abiótico Tensioactivo Tensioactivo Tensioactivo CO4 REF4 AB4 AE1 AE2 AE3 AE (mg L-1 COD) 16 16 16 16 Benzoato sódico (mg L-1 COD) 15 - HgCl2 (mg L-1) 100 - Ensayos de toxicidad aguda estándar En las Tablas II.5, II.6, II.7 y II.8 se indican los ensayos realizados para el estudio de la toxicidad aguda estándar (TE) de los diferentes tensioactivos. En ellas se recogen el grupo taxonómico del organismo usado, la especie, su identificación y la respuesta estudiada. Todos los ensayos se llevaron a cabo en agua de mar natural (véase apartado 2). Las principales características físico-químicas y biológicas del medio de ensayo empleado para cada tensioactivo se recogen en los correspondientes apartados de posteriores capítulos (capítulos 3, 4, 5 y 6). La metodología empleada para la realización de los ensayos de inhibición de crecimiento y mortalidad aparece detallada en el apartado 3 del presente capítulo. II-3 Capítulo 2 Tabla II.5. Diseño de experimentos para el estudio de la toxicidad estándar (TE) del tensioactivo catiónico cloruro de dodecil trimetil amonio (DTMAC). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TE1 TE2 TE3 TE4 TE5 TE6 Efecto Inhibición crecimiento(IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Mortalidad, 48 y 72-h Tabla II.6. Diseño de experimentos para el estudio de la toxicidad estándar (TE) del tensioactivo no-iónico nonilfenol etoxilado (NPEO). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TE7 TE8 TE9 TE10 TE11 TE12 Efecto Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Mortalidad, 48 y 72-h Tabla II.7. Diseño de experimentos para el estudio de la toxicidad estándar (TE) del tensioactivo aniónico alquil etoxisulfato (AES). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TE13 TE14 TE15 TE16 TE17 TE18 Efecto Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Mortalidad, 48 y 72-h Tabla II.8. Diseño de experimentos para el estudio de la toxicidad estándar (TE) del tensioactivo no-iónico alcohol etoxilado (AE). Grupo Algas Algas Algas Algas Algas Crustáceos II-4 Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TE19 TE20 TE21 TE22 TE23 TE24 Efecto Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Inhibición crecimiento (IC), 96-h Mortalidad, 48 y 72-h Metodología Ensayos de evolución de la toxicidad del medio de ensayo durante el proceso de biodegradación Los siguientes ensayos tuvieron como objetivo comprobar si a lo largo del proceso de biodegradación no tienen lugar transformaciones en la molécula de tensioactivo que conlleven la formación de subproductos más tóxicos, esto es, que presenta una biodegradabilidad ambientalmente aceptable. Para ello, se llevaron a cabo ensayos de toxicidad sobre microalgas y crustáceos marinos de muestras procedentes de los ensayos de biodegradación tomadas en diferentes estadíos del proceso. En las Tablas II.9, II.10, II.11 y II.12 se recogen los diferentes ensayos realizados así como las condiciones empleadas en cada uno de ellos. Se indican el grupo taxonómico del organismo usado, la especie, su identificación, los porcentajes de biodegradación a las que se tomaron las, y finalmente, el efecto estudiado. Tabla II.9. Diseño de experimentos para el estudio de la toxicidad durante el proceso de biodegradación (TB) del tensioactivo catiónico cloruro de dodecil trimetil amonio (DTMAC). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TB1 TB2 TB3 TB4 TB5 TB6 Biodegradación (%) 0, 17, 40, 55, 70, 81, 95 0, 17, 40, 55, 70, 81, 95 0, 17, 40, 55, 70, 81, 95 0, 17, 40, 55, 70, 81, 95 0, 17, 40, 55, 70, 81, 95 0, 17, 40, 55, 70, 81, 95 Efecto IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h Mortalidad, 48 y 72-h Tabla II.10. Diseño de experimentos para el estudio de la toxicidad durante el proceso de biodegradación (TB) del tensioactivo no-iónico nonilfenol etoxilado (NPEO). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TB7 TB8 TB9 TB10 TB11 TB12 Biodegradación (%) 0, 16, 28, 36, 45, 50, 64, 80, 93 0, 16, 28, 36, 45, 50, 64, 80, 93 0, 16, 28, 36, 45, 50, 64, 80, 93 0, 16, 28, 36, 45, 50, 64, 80, 93 0, 16, 28, 36, 45, 50, 64, 80, 93 0, 16, 28, 36, 45, 50, 64, 80, 93 Efecto IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h Mortalidad, 48 y 72-h Tabla II.11. Diseño de experimentos para el estudio de la toxicidad durante el proceso de biodegradación (TB) del tensioactivo aniónico alquil etoxisulfato (AES). Grupo Algas Algas Algas Algas Algas Crustáceos Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TB13 TB14 TB15 TB16 TB17 TB18 Biodegradación (%) 0, 18, 36, 55, 78, 91 0, 18, 36, 55, 78, 91 0, 18, 36, 55, 78, 91 0, 18, 36, 55, 78, 91 0, 18, 36, 55, 78, 91 0, 18, 36, 55, 78, 91 Efecto IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h Mortalidad, 48 y 72-h II-5 Capítulo 2 Tabla II.12. Diseño de experimentos para el estudio de la toxicidad durante el proceso de biodegradación (TB) del tensioactivo no-iónico alcohol etoxilado (AE). Grupo Algas Algas Algas Algas Algas Crustáceos II-6 Organismo N. gaditana I. galbana C. gracilis D. salina T. chuii A. franciscana Código TB19 TB20 TB21 TB22 TB23 TB24 Biodegradación (%) 0, 20, 37, 53, 63, 77, 94 0, 20, 37, 53, 63, 77, 94 0, 20, 37, 53, 63, 77, 94 0, 20, 37, 53, 63, 77, 94 0, 20, 37, 53, 63, 77, 94 0, 20, 37, 53, 63, 77, 94 Efecto IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h IC, 72 y 96-h Mortalidad, 48 y 72-h Metodología 2. Medio de ensayo y punto de muestro El medio de ensayo empleado tanto en los ensayos de biodegradación como de toxicidad contenía como matriz principal agua de mar natural procedente de la zona externa de la desembocadura del Caño de Sancti Petri (área litoral de Sancti Petri, Cádiz). Se trata de un canal de 17 km de longitud de flujo-reflujo de mareas que comunica la Bahía interior de Cádiz con el océano Atlántico (Figura II.1). El canal presenta una gran importancia desde el punto de vista económica debido a las actividades que soporta (con los puertos deportivos de Gallineras y Sancti Petri y el astillero militar de la Carraca), a las que se le suman la presencia de núcleos urbanos (San Fernando y Chiclana de la Frontera) y un alto valor ecológico (Vidal y Tejedor, 2005). El punto de toma de muestra está localizado en la parte más externa de la desembocadura del caño, una zona con fuerte influencia mareal y muy poco antropizada, como muestran los resultados de los análisis realizados al agua tomada en esta zona (capítulos 3, 4, 5 y 6). N Punto de muestro Figura II.1. Situación geográfica del Caño de Sancti Petri y fotografías de la zona de muestreo. II-7 Capítulo 2 3. Metodología para el estudio de la biodegradabilidad En este apartado se expone la metodología seguida para el estudio de la biodegradabilidad de los diversos tensioactivos, así como una breve descripción del material común empleado en los ensayos. Método de ensayo Los ensayos de biodegradación realizados en el presente trabajo siguieron la directriz OPPTS 835.3160 “Biodegradabilidad en agua de mar”, propuesta por la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 1998a). Esta directriz contempla dos posibles métodos de ensayo: el método de frasco cerrado y el método de frasco agitado. En este trabajo, se optó por emplear el método de frasco agitado dado que este método permite, entre otras, tomar muestras periódicas para realizar el análisis cuantitativo de los tensioactivos y de parámetros analizados (oxígeno disuelto, temperatura y pH) así como para los ensayos de toxicidad. El método de frasco agitado consiste en una variante en agua de mar del ensayo homólogo de la Organización para la Cooperación y Desarrollo Económico (OECD, 1992), desarrollado por el Instituto Danés de Calidad del Agua (Nyholm y Kristensen, 1987). Los resultados de este ensayo no deben tomarse como indicadores de fácil biodegradabilidad, pero pueden usarse específicamente para obtener información acerca de la biodegradabilidad de compuestos en ambientes marinos. Así, un resultado positivo en el ensayo (eliminación del carbono orgánico disuelto (COD) >70% en menos de 60 días) indicaría la existencia de un potencial para su degradación en el medio marino estudiado. Por el contrario, un resultado negativo no descartaría tal potencial aunque sería necesario llevar a cabo nuevos estudios, por ejemplo, empleando concentraciones inferiores, para corroborar esta hipótesis. Descripción del método Las muestras de agua de mar fueron tomadas con ayuda de una botella oceanográfica tipo Ruttner a 0,5 m de profundidad y posteriormente, filtradas mediante filtros de fibra de vidrio de 1 μm de tamaño de poro nominal, para eliminar partículas gruesas. A continuación las muestras fueron enriquecidas con 1 mL L-1 de diferentes soluciones stock de nutrientes (Tabla II.13) y finalmente, aclimatadas durante 24 horas en oscuridad a 20 ± 1ºC, al objeto de permitir el pre-acondicionamiento de los microorganismos a las condiciones de ensayo. Los reactores empleados en los ensayos de biodegradación eran de borosilicato de color ámbar con una capacidad de 2,5 L, con objeto de que el proceso tuviese lugar bajo luz II-8 Metodología difusa. A cada reactor se le adicionó un volumen de 1,5 L de agua de mar aclimatada, dejando así un espacio vacío suficiente para permitir la correcta re-oxigenación del medio. Los experimentos se llevaron a cabo en una cámara termostatizada en oscuridad y a 19 ± 2ºC. La agitación del medio de ensayo se llevó a cabo de forma periódica mediante la inyección de un pequeño flujo de aire, el cual además de agitar la disolución, permitió la aireación de la misma (Figura II.2). En el caso del tensioactivo no-iónico NPEO la agitación se llevó a cabo mediante un agitador magnético para evitar a la formación de espuma, y por tanto, la disminución de su biodisponibilidad. Tabla II.13. Composición química de las soluciones stock de nutrientes empleadas en los ensayos de biodegradación (USEPA, 1998). Solución stock de nutrientes Solución stock I Solución stock II Solución stock III Solución stock IV Figura II.2. Compuesto Concentración (g L-1) KH2PO4 8,5 K2HPO4 21,75 Na2HPO4 · 2H2O 33,3 NH4Cl CaCl2 MgSO4 FeCl3 · 6H2O 0,5 27,5 22,5 0,25 Cámara termostatizada empleada para los ensayos de biodegradación. Los experimentos de biodegradación estaban constituidos por: (a) un ensayo control, el cual contenía exclusivamente agua de mar aclimatada, (b) un ensayo referencia, formado por agua de mar aclimatada y una concentración de 15-20 mg L-1 de COD de II-9 Capítulo 2 benzoato sódico, (c) un ensayo abiótico, el cual contenía una concentración aproximada de tensioactivo de 15 mg L-1 COD y 100 mg L-1 de HgCl2, y finalmente (d) un triplicado, formado por agua de mar aclimatada y una concentración aproximada de tensioactivo de 15 mg L-1 COD. El objetivo del ensayo abiótico fue comprobar si durante el experimento tuvo lugar algún proceso de pérdida de concentración por mecanismos no biológicos tales como hidrólisis, adsorción, volatilización, etc., mientras que el ensayo de referencia tuvo como fin comprobar la actividad de la flora microbiana natural contenida en el agua de mar empleada. Así, un resultado negativo en los ensayos de biodegradación, incluido el ensayo de referencia, indicaría que éstos son debidos a una baja actividad microbiana del agua de mar empleada y no a razones estructurales del compuesto ensayado, y, por lo tanto, habría que repetir el experimento con agua procedente de otra zona. La concentración de sustrato en los ensayos de biodegradación fue determinada mediante medidas de carbono orgánico disuelto (COD). Estas medidas se realizaron de acuerdo con el método estándar de combustión infrarroja 5310B (APHA y col., 1992) con la ayuda de un analizador Shimadzu TOC-5050A. Previo a su análisis, las muestras fueron filtradas a través de filtros de fluoruro de polivinilideno de 0,22 μm de tamaño de poro nominal (Millipore, S.A.). La determinación de los parámetros de control (pH, oxígeno disuelto y temperatura) se llevó a cabo periódicamente, al objeto de garantizar que el proceso degradativo estuviera transcurriendo bajo condiciones no limitantes. La determinación del oxígeno disuelto se realizó mediante un oxímetro portátil con electrodo selectivo de membrana, corrector de salinidad y compensador de temperatura (WTW Gmb, Prod. nº Oxi 330). La determinación del pH fue potenciométrica, empleándose un pHmetro portátil (Crison Instruments, S.A., Prod. nº 507) dotado de un electrodo combinado de vidrio Ag/AgCl y un compensador automático de temperatura con una resolución de 0,01 unidades de pH. Modelización cinética Los valores de concentración de sustrato obtenidos a lo largo de los ensayos de biodegradación fueron ajustados a diferentes modelos cinéticos propuestos por diversos autores (Simkins y Alexander, 1984; Quiroga y col., 1999) mediante técnicas de regresión no lineal, con la ayuda del programa estadístico Sigma Plot 8.0. La selección del modelo cinético más apropiado se llevó a cabo en función de la simplicidad de los modelos que presentan un mejor ajuste. Para determinar la bondad del ajuste del modelo cinético a los datos experimentales se han considerado: (a) el coeficiente de determinación (R2), (b) el significado físico de los parámetros cinéticos calculados, y (c) los resultados obtenidos en el análisis estadístico de la Chi-cuadrado (χ2). II-10 Metodología El análisis de la χ2 nos permite evaluar de una manera fácil y rápida la bondad del ajuste de los datos experimentales a un determinado modelo matemático (Press y col., 1986). Básicamente, consiste en el cálculo del parámetro estadístico Q, probabilidad de que la Chi-cuadrado exceda al azar un determinado valor χ2 teórico, y el cual nos da una medida cuantitativa de la bondad de ajuste del modelo. Así, valores Q muy próximos a cero indicarían que las diferencias aparentes entre los datos experimentales y los datos correspondientes al modelo teórico no son debidas a fluctuaciones experimentales y por tanto, el modelo podría ser estadísticamente rechazado. Por el contrario, valores Q próximos a la unidad indicarían que tales diferencias pueden ser debidas a variaciones casuales, indicando así un buen ajuste del modelo. Sin embargo, valores muy próximos a la unidad indicarían un excelente ajuste entre los datos experimentales y teóricos, demasiado bueno literalmente para ser cierto, y suele ser debido, normalmente, a una sobreestimación de los errores de medidas. En general, un valor aceptable de χ2 para un ajuste relativamente bueno es aquel en el que χ2 ≅ ν, siendo ν el número de grados de libertad (ν = N - M, N es el número de datos y M el número de parámetros del modelo ajustado). A partir de las ecuaciones y parámetros cinéticos se calcularon los valores del tiempo de latencia (tL ó t10), t50 y el de vida media (t1/2), considerando tL el tiempo transcurrido hasta alcanzar un 10% de biodegradación, t50 el tiempo transcurrido en alcanzar un 50% de biodegradación, a partir del tiempo de latencia y t1/2 el transcurrido hasta alcanzar el 50% de biodegradación, considerando el tiempo de latencia (Figura II.3). Biodegradación (%) 100 t50 50 10 tL t1/2 Tiempo (T-1) Figura II.3. Típica curva de biodegradación empleando el método de frasco agitado (USEPA, 1998). II-11 Capítulo 2 4. Metodología para el estudio de la toxicidad aguda estándar A continuación se describe la metodología empleada para el estudio de toxicidad aguda estándar con microalgas y crustáceos marinos. Ensayos de toxicidad con microalgas marinas Se han empleado un total de cinco especies de microalgas marinas: Nannochloropsis gaditana (clase Eustigmatophyceae), Isochrysis aff. galbana (clase Primnesiophyceae), Chaetoceros gracilis (clase Bacillariophyceae), Dunaliella salina (clase Chlorophyceae) y Tetraselmis chuii (clase Prasinophyceae) (Figura II.4). Todas las especies procedían de la colección de cepas de microalgas del Instituto de Ciencias Marinas de Andalucía (ICMAN-CSIC) (Lubian y Yufera, 1989). A Figura II.4. B C D E Algas usadas: (A) N. gaditana, (B) I. galbana, (C) C. gracilis, (D) D. salina y (E) T. chuii. Para el estudio de la toxicidad aguda sobre las microalgas marinas se llevaron a cabo ensayos de inhibición del crecimiento. El procedimiento seguido estuvo basado en diversos métodos estándares propuestos por la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 1996, 1998b, 2002a, 2002b), la Asociación de la Salud Pública Americana (APHA y col., 1992), la Organización para la Cooperación y el Desarrollo Económico (OECD, 1998) y otros autores (Rand, 1995; Kooijman y col., 1996; Garrido, 2002). La preparación de los inóculos se realizó en dos etapas. En una primera etapa, los inóculos fueron cultivados en agua de mar sintética esterilizada, al objeto de sanear los cultivos y evitar cualquier fuente de contaminación. Una vez alcanzada una determinada concentración, estos inóculos fueron cultivados en agua de mar natural esterilizada. Todos los inóculos de microalgas fueron cultivados en frascos Erlenmeyer de borosilicato de 500 mL a 20 ± 1ºC e iluminación continua (220 µmol m-2 sec-1), conteniendo 100 mL de agua de mar sintética (USEPA, 2002a) o natural esterilizada, y un suplemento de nutrientes y vitaminas, de acuerdo con el medio f/2 (Guillard y Ryther, 1962), el cual fue modificado empleando una concentración doble de nitrato y fosfato (Huertas y col., 2000) y silicatos (Garrido, 2002) (Tabla II.14). La concentración de biomasa fue estimada a partir de la II-12 Metodología densidad óptica del cultivo (DO) medida mediante un colorímetro (Nannocolor PT-3 MACHEREY-NAGEL) a una longitud de onda de 690 nm (DO, 690 nm). Tabla II.14. Composición del medio nutritivo, modificado del f/2, empleado en los ensayos de toxicidad con microalgas (Garrido, 2002). Compuesto f/2 (g L-1) Medio nutritivo (mg L-1) Elemento Medio nutritivo (mg L-1) Macronutrientes NaNO3 150,0 150,0 N 10,0 10,0 P NaPO4H2·2H2O 3,15 3,15 Fe FeCl3· 6H2O 0,5 0,5 Si (*) Na2O3Si Metales traza 0,010 0,010 Cu CuSO4· 5H2O 0,022 0,022 Zn ZnSO4· 7H2O 0,010 0,010 Co CoCl2· 6H2O 0,180 0,180 Mn MnCl2· 4H2O 0,006 0,006 Mo Na2MoO4· 2H2O Vitaminas 0,100 0,100 Vitamina B1 0,005 0,005 Vitamina B12 Otros componentes 4,36 4,36 (**) EDTA-Na2· 2H2O (*) No incluido en la composición inicial de f/2. Sólo necesario para diatomeas. (**) Suprimir este compuesto en ensayos con metales. 24,724 1,985 0,651 0,121 0,003 0,005 0,002 0,050 0,002 Los ensayos de inhibición de crecimiento fueron realizados en tubos de vidrio de borosilicato de 10 mL, conteniendo 2 mL de inóculo y 2 mL de una solución conocida de tensioactivo, ambos preparados en agua de mar natural y enriquecidos con medio de nutrientes f/2 modificado. La densidad de biomasa inicial óptima en los cultivos de microalgas fue de 0,200-0,300 unidades de absorbancia, concentración a la cual el cultivo se encuentra en fase de crecimiento exponencial (Perales, 2001). Los cultivos fueron incubados a 20 ± 1ºC, con un foto-período de 24 horas y una intensidad de luz de 220 µmol m2 sec, utilizando una incubadora de precisión modelo Hot-Cold GL 4000700 (J. P. Selecta, S.A.) (Figura II.5). Todas las concentraciones empleadas, así como los controles, fueron ensayadas por triplicado. La concentración de biomasa fue medida inicialmente y a las 24, 48, 72 y 96 horas de incubación. Las velocidades de crecimiento de las microalgas fueron analizadas estadísticamente mediante interpolación lineal para determinar los valores 96-h IC50 (concentración que produce un 50% de inhibición de crecimiento en los cultivos de microalgas al cabo de 96 horas de exposición), utilizando para ello el programa informático ICp (Norberg-King, 1988, 1993). Los parámetros LOEC (concentración más baja ensayada II-13 Capítulo 2 que produce efecto) y NOEC (concentración más elevada ensayada que no produce efecto) fueron calculados mediante el test de Dunnet o Steel, dependiendo de los resultados obtenidos previamente en los test Shapiro-Wilk de normalidad y test de Bartlett de homogeneidad de la varianza (USEPA, 2002a). Para el cálculo de dichos parámetros se empleo el programa estadístico ToxStat (West y Gulley, 1996). Figura II.5. Incubadora modelo Hot-Cold GL 4000700 utilizada en los ensayos de toxicidad estándar con microalgas marinas. Ensayos de toxicidad con Artemia franciscana Para la realización de los ensayos de toxicidad con crustáceos marinos se empleó la especie Artemia franciscana (código 1301), cuyos quistes fueron proporcionados por el Instituto de la Artemia en Bélgica (Artemia Reference Center, State University of Ghent and Laboratory of Biological Research in Aquatic Pollution, Bélgica) (Figura II.6A). La medida de toxicidad se ha basado en la mortalidad del crustáceo marino después de un determinado tiempo de exposición al tensioactivo en comparación con un control no tóxico. A Figura II.6. II-14 B Ensayo de toxicidad estándar con crustáceos marinos. (A) Fotografía del crustáceo Artemia sp. (B) Preparación de las placas Petri empleadas en los ensayos. Metodología La metodología empleada en los ensayos de toxicidad con crustáceos ha seguido las directrices propuestas por la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 1992, 1996, 1998b, 2002a, 2002b), la Organización para la Cooperación y el Desarrollo Económico (OECD, 1998), la Sociedad Americana para el Ensayos de Materiales (ASTM, 2004) y diversos autores (Rand, 1995; Garrido, 2002). Para la eclosión de los quistes de A. franciscana se emplearon frascos Erlenmeyer de borosilicato de 250 mL, conteniendo 100 mL de agua de mar sintética esterilizada (USEPA, 2002a). Los quistes fueron incubados a 20 ± 1ºC, iluminación constante y aireación suave. Bajo estas condiciones, el tiempo de eclosión requerido fue de aproximadamente 24 horas. Los nauplios eclosionados fueron transferidos con la ayuda de una pipeta Pasteur a agua de mar sintética fresca. Los experimentos fueron realizados en placas Petri de borosilicato (55mm de diámetro) (Figura II.5), conteniendo un número total de 10 individuos por placa. Estos individuos eran transferidos en un volumen inferior a 50 µL con la ayuda de una pipeta Pasteur. Posteriormente se añadieron 8 mL de la concentración del tóxico a ensayar y se incubaron a 20 ± 1ºC y en oscuridad. Todas las concentraciones de tensioactivos así como el control fueron ensayados por quintuplicado. Al cabo de 24, 48 y 72 horas se contó, con ayuda de una lupa, el número de individuos muertos (inmovilidad durante 10 segundos y color blanquecino) y vivos. La determinación de los valores LC50 (concentración que provoca la mortalidad de un 50% de la población de individuos) a las 48 y 72 horas de exposición al tensioactivo se llevo a cabo siguiendo el procedimiento propuesto por la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 2002b). En aquellos casos en los que los datos no reunían las condiciones necesarias para aplicar el método Probit (Finney, 1962), se empleó el método Trimmed Spearman-Karber ó Spearman-Karber, dependiendo de los porcentajes de mortalidad observados a las concentraciones máximas y mínimas ensayadas (USEPA, 2002b). La determinación de los parámetros LOEC (concentración más baja ensayada que produce efecto) y NOEC (concentración más elevada ensayada que no produce efecto) se llevó a cabo siguiendo el mismo procedimiento que en el caso de las microalgas. II-15 Capítulo 2 5. Metodología para el estudio de la evolución de la toxicidad durante la biodegradación. Durante el proceso de biodegradación de los tensioactivos se analizó la evolución de la toxicidad del medio de ensayo. Los porcentajes de biodegradación a los que fueron tomadas las muestras de toxicidad se recogen en el apartado 1 del presente capitulo (Tablas II.9, II.10, II.11 y II.12). La metodología empleada para los ensayos de toxicidad con aguas procedentes de diferentes estadíos del ensayo de biodegradación ha sido análoga a la metodología descrita para los ensayos de toxicidad aguda estándar con microalgas y crustáceos marinos (apartado 4). En el caso de las microalgas, se realizó una modificación de la metodología de los ensayos estándares de toxicidad al objeto de evitar la dilución de las concentraciones de tensioactivo. En este caso, los inóculos de microalgas fueron centrifugados, una vez alcanzada la densidad óptima. Posteriormente, se procedió a la eliminación del sobrenadante y, finalmente, a la re-suspensión de las microalgas en 4 mL de muestra procedente de los diferentes estadíos de biodegradación (enriquecidas con medio nutritivo f/2 modificado) hasta alcanzar una concentración de biomasa optima (0,200-0,300 unidades de absorbancia). II-16 Metodología Referencias APHA, AWWA, WPCF, 1992. Standard Methods for the Examination of Water and Wastewater. American Public Health Association, Washington DC. ASTM, 2004. Standard guide for conducting static and flow-through acute toxicity tests with mysids from the west coast of the United States. E1463-92. En: ASTM (Ed.). Annual Book of ASTM Standards. ASTM, Philadelphia, PA. Finney, D.J., 1962. Probit analysis. Cambridge University Press, Cambridge. Garrido, M.C., 2002. Criterios de calidad ambiental. Aplicación a aguas limitadas del Golfo de Cádiz. Tesis Doctoral. Dpto Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. Guillard, R.R., Ryther, J.H., 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt, and Detonula confervacea (cleve) Gran. Can J Microbiol 8, 229-239. Huertas, E., Montero, O., Lubián, L.M., 2000. Effects of dissolved inorganic carbon availability on growth, nutrient uptake and chlorophyll fluorescence of two species of marine microalgae. Aquacultural Engineering 22, 181–197. Kooijman, S.A.L.M., Hanstveit, A.O., Nyholm, N., 1996. No effect concentrations in algal growth inhibitions tests. Water Res 30, 1625-1632. Lubian, L.M., Yufera, M., 1989. Colección de cepas de microalgas del Instituto de Ciencias Marinas de Andalucía (CSIC). Instituto de Ciencias Marinas, Cádiz. Norberg-King, T.J., 1988. An interpolation estimate for chronic toxicity: the ICp approach. NETAC Technical Report 05-88. United States Environmental Protection Agency, Duluth, MN. Norberg-King, T.J., 1993. A linear interpolation method for sub-lethal toxicity: The inhibition concentration (ICp) approach. NETAC Technical Report 03-93. United States Environmental Protection Agency, Duluth, MN. Nyholm, N., Kristensen, P., 1987. Screening methods for assessment of biodegradability of chemical substances in seawater. Final report of the ring test programme. Commission of the European Communities. Nyholm, N., Kristensen, P., 1992. Screening methods for assessment of biodegradability of chemicals in seawater results from a ring test. Ecotoxicol Environ Saf 23, 161-172. OECD, 1992. OECD guidelines for the testing of the chemicals. 301: Ready biodegradability. OECD, Paris. OECD, 1998. Series on testing and assessment. Number 10-Report of the OECD workshop on statistical analysis of aquatic toxicity data. ENV/MC/CHEM(98)18. OECD, Paris. Perales, J.A., 2001. Variabilidad de la biodegradación y toxicidad de compuestos xenobióticos en el medio marino. Aplicación a lineal alquilbenceno sulfonatos en aguas del Golfo de Cádiz. Tesis Doctoral. Dpto. de Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. II-17 Capítulo 2 Press, W.A., Flannery, B.P., Teukolsky, S.A., Vetterling, W.T., 1986. Numerical recipes, the art of scientific computing. Cambridge University Press, Cambridge. Quiroga, J.M., Perales, J.A., Romero, L.I., Sales, D., 1999. Biodegradation kinetics of surfactants in seawater. Chemosphere 39, 1957-1969. Rand, G.M., 1995. Fundamentals of aquatic toxicology. Effects, Environmental Fate and Risk Assessment. Taylor & Francis, Washington. Simkins, S., Alexander, M., 1984. Models for mineralization kinetics with the variables of substrate concentration and population density. Appl Environ Microbiol 47, 1299-1306. USEPA, 1992. 797.1930 Mysid shrimp acute toxicity test. Toxic Substances Control Act. Environmental Effects Testing Guidelines. US Code of Federal Regulations, Washington DC. USEPA, 1996. Algal toxicity Tiers I and II. Series 850-Ecological effects test guidelines. OPPTS 850.5400. EPA/712/C-96/164. USEPA, Washington DC. USEPA, 1998a. Fate, transport and transformation test guidelines. OPPTS. "Biodegradability in Sea Water" 835.3160. EPA 712–C–98–351. The Federal Bulletin Board. U.S. Government Printing Office Washington, DC. USEPA, 1998b. Guidance for data quality assessment. Practical methods for data analysis. EPA/600/R-96/084. USEPA, Washington DC. USEPA, 2002a. Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. EPA-821-R-02-012 USEPA, Washington DC. USEPA, 2002b. Short-term methods for estimating the chronic toxicity of effluents and receiving waters to freshwater organisms. EPA-821-R-02-013. USEPA, Washington DC. Vidal, J., Tejedor, B., 2005. Study of the dynamic behaviour of the Sancti Petri channel, southwest coast of Spain. Ciencias Marinas 31, 617-626. West, I., Gulley, 1996. Toxstat version 3.5. Western Ecosystems Technology, Inc. Cheyenne, WY. II-18 Capítulo 3 SALES DE ALQUIL TRIMETIL AMONIO Resumen Dentro de la gran familia de los tensioactivos catiónicos, las sales de alquil trimetil amonio destacan por sus numerosas aplicaciones tanto domésticas como industriales. Sin embargo, la bibliografía existente acerca del comportamiento ambiental de estos tensioactivos en el medio marino es, hasta la fecha, muy escasa. El siguiente capítulo presenta los resultados del estudio de la biodegradabilidad y ecotoxicidad del tensioactivo catiónico cloruro de dodecil trimetil amonio (DTMAC) en agua de mar natural procedente de la zona costera de Sancti Petri (Cádiz). El método de ensayo para el estudio de la biodegradación final del tensioactivo se ha basado en la directriz OPPTS 835.3160 “Biodegradabilidad en agua de mar”, propuesta por la Agencia de Protección Ambiental de los Estados Unidos (USEPA). El estudio de la toxicidad se ha llevado a cabo mediante ensayos de inhibición del crecimiento de diversas especies de microalgas así como ensayos de mortalidad del crustáceo marino Artemia sp. Finalmente, se ha estudiado la evolución de la toxicidad del medio de ensayo a lo largo del proceso degradativo sobre estos organismos marinos. Los resultados indican un elevado porcentaje de biodegradación final del tensioactivo (>90%). Asimismo, la microalga C. gracilis constituye la especie más sensible al tensioactivo. Dado que no se observa un incremento de la toxicidad del medio se puede concluir que el tensioactivo presenta una biodegradabilidad ambientalmente aceptable. Capítulo 3 1. Introducción Sales de alquil trimetil amonio. Características y usos Las sales de alquil trimetil amonio constituyen un importante grupo dentro de la amplia gama de tensioactivos catiónicos con numerosas aplicaciones industriales y domésticas (Huber, 1984; García y col., 1999; Nalecz-Jawecki y col., 2003). Así, cabe destacar su utilización en productos cosméticos, tales como acondicionadores ó colorantes para el cabello, así como en otros productos de cuidado personal (Madsen y col., 2001). Su estructura química se compone de una parte hidrófoba constituida por una cadena alquílica, generalmente lineal, con un número de átomos de carbono comprendido, normalmente, entre 12 y 18, y una parte hidrófila, formada por un átomo de nitrógeno cuaternario con tres radicales metilo. En función del tipo de contraión presente en la molécula (anión Cl- ó Br-) se diferencian dos tipos de sales: cloruros de alquil trimetil amonio (ATMAC) y bromuros de alquil trimetil amonio (ATMAB) (Figura III.1). CH3 R N+ CH3 X- CH3 Figura III.1. Estructura química del tensioactivo catiónico sal de alquil trimetil amonio (R= CxH2x+1, x= 12-18; X- = Cl- ó Br-). Niveles de alquil trimetil amonio en el medio acuático La determinación de sales de alquil trimetil amonio y, en general de tensioactivos catiónicos, en diferentes compartimentos acuáticos ha sido objeto, sorprendentemente, de muy pocos estudios. Tan sólo se han encontrado datos referentes a la presencia del tensioactivo cloruro de bi(alquil grasa hidrogenada) dimetil amonio (DTDMAC) en efluentes de estaciones depuradoras de aguas residuales (Versteeg y col., 1992) y en agua de río (Leuwen y col., 1992), con concentraciones de 62 y 2-34 μg L-1 DTDMAC, respectivamente. Debido a su naturaleza anfifílica, durante el tratamiento de las aguas residuales los tensioactivos catiónicos son adsorbidos con gran facilidad en la superficie del material particulado. Esto hace que las concentraciones esperadas de estos compuestos en la fase acuosa sean, en principio, relativamente bajas. Kupfer (1982) y Topping y Waters (1982) III-2 Sales de alquil trimetil amonio observaron una reducción del 95% de la concentración total de tensioactivos catiónicos en un sistema de lodos activos, siendo gran parte de esta eliminación debida a procesos de adsorción sobre los flóculos biológicos. Además, Huber (1987) encontró una eliminación de entre el 20 y 40% de tensioactivos catiónicos en el decantador primario de una estación depuradora de aguas residuales debido a procesos de adsorción en los sólidos sedimentables. Biodegradabilidad de las sales de alquil trimetil amonio Hasta la fecha, pocos son los estudios que se han llevado a cabo sobre la biodegradación de sales de alquil trimetil amonio en ambientes aerobios ó anaerobios. Mackrell y Walter (1978) propusieron tres posibles rutas metabólicas para la degradación de estos tensioactivos bajo condiciones aerobias (Figura III.2). Una primera ruta consiste en la ruptura del enlace C-N de la cadena alquílica (N-desalquilación) dando lugar a un aldehído y a una amina terciaria, la cual a su vez se degradaría mediante sucesivas rupturas del enlace C-N de los grupos metilos (N-desmetilación). Otra posible ruta de degradación sería la ruptura del enlace C-N de uno de los grupos metilo, dando lugar a formaldehído y una amina terciaria, la cual se degradaría mediante N-desalquilación y/ó N-desmetilaciones. El ataque microbiano sobre la cadena alquílica de la molécula mediante ω-β oxidaciones constituye la tercera posible ruta de biodegradación de estos compuestos. Para condiciones anaerobias, no se ha encontrado bibliografía en la que se describa las posibles rutas de biodegradación de estos compuestos. El acortamiento de la cadena alquílica mediante ω-β oxidaciones ha sido demostrado por Dean-Raymond y Alexander (1977) en estudios de degradación del tensioactivo C10TMAC con Xanthomonas sp. Sin embargo, estudios llevados a cabo con lodos activos procedentes de una estación depuradora de aguas residuales urbanas sugieren que el mecanismo de biodegradación de las sales de alquil trimetil amonio consiste en una N-desalquilación, seguida de N-desmetilaciones (Nishiyama y col., 1995). En esta ruta, la sal de alquil trimetil amonio sería inicialmente degradada a trimetil-amina mediante una Ndesalquilación y posteriormente transformada en dimetil-amina, y a su vez, en metil-amina. Sin embargo, este último compuesto raramente ha sido detectado (Nishiyama y col., 1995). En general, las sales de amonio cuaternaria son consideradas biológicamente degradables bajo condiciones aerobias (Ying, 2006). Games y col. (1982) demostraron que durante el proceso degradativo no se generan metabolitos recalcitrantes y describieron un tiempo de vida media de 2,5 horas para la biodegradación primaria del tensioactivo cloruro de octadecil trimetil amonio (C18TMAC) en un sistema de lodos activos. Asimismo, estudios llevados a cabo sobre diferentes homólogos de sales de alquil trimetil amonio (bromuros de dodecil, tetradecil y hexadecil trimetil amonio) y empleando agua de mar III-3 Capítulo 3 inoculada indicaron una completa biodegradación primaria bajo condiciones aerobias (García y col., 2001). Sal de amonio cuaternario CH3 R N+ CH3 X- CH3 N-desalquilación ω-oxidación N-desmetilación O R C H Aldehído H3C + CH3 N H O + H CH3 Trimetil amina C R Formaldehído CH3 N CH3 Amina terciaria CH3 O C N+ R1 HO CH3 CH3 Amina cuaternaria β- oxidación N-desalquilación N-desmetilación CO2, H2O, NH3 /NH4+ N-desmetilación O N-desalquilación HO CH3 C N+ R2 CH3 CH3 Amina cuaternaria + O H3 C C OH Ácido acético Figura III.2. Rutas de biodegradación de las sales de aquil trimetil amonio (Mackrell y Walter, 1978) (R=C12-C18; R1=R-1, R2=R-2). La elevada mineralización que presentan estos tensioactivos también ha sido puesta de manifiesto en diversas experiencias. Así, por ejemplo, Games y col (1982) observaron un alto grado y velocidad de mineralización para el tensioactivo C18TMAC a concentraciones iniciales de ensayo comprendidas entre 0,1 y 1 mg L-1. Larson y Vashon (1983) estimaron un tiempo de vida media de 2,2 días para dicho tensioactivo empleando agua de río previamente aclimatada. En estudios de mineralización en agua de río y mediante14C del tensioactivo C18TMAC (10 μg/l) también se ha observado una elevada biodegradación final, obteniéndose porcentajes de 14CO2 superiores al 60% y 75% al cabo III-4 Sales de alquil trimetil amonio de 7 y 21 días, respectivamente (Boethling, 1984). En un medio de ensayo constituido por agua de mar inoculada, García y col. (2001) observaron una completa mineralización para diferentes homólogos de sales de alquil trimetil amonio (bromuros de dodecil, tetradecil y hexadecil trimetil amonio) en un periodo comprendido entre 7 y 11 días de ensayo. Por otro lado, diversos estudios han demostrado un aumento del grado de mineralización del tensioactivo catiónico cloruro de alquil trimetilamonio (ATMAC) cuando se combina con el tensioactivo aniónico lineal alquil benceno sulfonato (LAS). Games y col. (1982) encontraron que una concentración de 20 mg L-1 de C18TMAC inhibía la producción endógena de CO2 en un sistema de lodos activos, descartando por tanto su biodegradación, mientras que para una mezcla de C18TMAC y LAS (ambos en una concentración de 20 mg L-1) se alcanzó un porcentaje de mineralización del 81% al cabo de 25 días de ensayo. Aunque pocos son los estudios que se han llevado a cabo sobre la biodegradabilidad de tensioactivos catiónicos en condiciones anaerobias, se considera que las sales de alquil trimetil amonio, y en general, los tensioactivos catiónicos no son anaeróbicamente biodegradables. García y col. (1999) describieron una pobre biodegradación primaria y la ausencia de mineralización de diversos compuestos de alquil trimetil amonio bajo condiciones anaerobias. Por otro lado, Janicke y Hilge (1979) encontraron una mínima y/ó inexistente disminución de la concentración de sales de amonio cuaternario en digestores anaerobios. Los estudios de biodegradación de las sales de alquil trimetil amonio llevados a cabo por diversos autores muestran que la biodegradabilidad de los diferentes homólogos disminuye, en general, a medida que aumenta la longitud de cadena alquílica. En estudios realizados por Masuda y col. (1976) los porcentajes de biodegradación para diferentes homólogos de ATMAC al cabo de 10 días de ensayos fueron del 73% para C8, 63% para C10, 59% para C12, 35% para C14 y 0% para C16 y C18. Por otro lado, García y col. (2001) encontraron una completa biodegradación primaria del C12TMAB y C14TMAB al cabo de 3 días mientras que para C16TMAB ésta no se alcanzó hasta los 6 días de ensayo. Asimismo, se observó una mineralización total de estos tensioactivos al cabo de 6 días para C12 y C14 y 11 días para C16. Toxicidad de las sales de alquil trimetil amonio en el medio acuático La bibliografía existente en relación a la toxicidad acuática de las sales de alquil trimetil amonio (ATMAC y ATMAB) sobre diferentes grupos taxonómicos (algas, invertebrados, peces, etc.) es abundante, aunque cabe destacar que generalmente se tratan de organismos acuáticos no marinos. Para el caso específico de las algas, los datos de toxicidad aportados en la bibliografía parecen indicar que se tratan de un grupo de organismos muy sensible a los III-5 Capítulo 3 tensioactivos catiónicos, encontrándose valores de EC50 generalmente inferiores a 1 mg L-1. Así, Utsunomiya y col. (1997a) para una sal de alquil trimetil amonio con una cadena alquílica comprendida entre 16 y 18 átomos de carbono (C16-18TMAC) encontraron valores de EC50 (24-h, formación de 13C-Glicerol) de 0,79 mg L-1 para la microalga marina Dunaliella sp., mientras que para la especie de agua dulce Chlorella pyrenidosa el valor de IC50 (96-h) fue de 0,28 mg L-1 (Utsunomiya y col., 1997b). Lewis y Hamm (1986) investigaron los efectos de diversos tensioactivos ATMAC sobre el crecimiento de diversas especies de algas. Para las microalgas Selenastrum capricornutum y Microcystis aeruginosa, los valores de IC50 (96-h) hallados para el tensioactivo C16TMAB fueron de 0,09 mg L-1 y 0,03 mg L-1, respectivamente. Para el caso de C12TMAC, los valores de IC50 (96-h) estuvieron comprendidos entre 0,12 mg L-1 para Microcystis aeruginosa y 0,20 mg L-1 para Navicula pelliculosa. Los valores encontrados en la bibliografía de toxicidad aguda de las sales de alquil trimetil amonio sobre invertebrados acuáticos son, en todos los casos, inferiores a 1 mg L-1, al igual que ocurre con las microalgas. Estudios de toxicidad aguda con bromuros de dodecil, tetradecil y hexadecil trimetil amonio mostraron, concentraciones de efecto (EC50, 24-h, movilidad) comprendidas entre 0,13 y 0,18 mg L-1 sobre el crustáceo D. magna (García y col., 2001). Lewis y Suprenant (1983) encontraron efectos tóxicos (LC50, 48-h) sobre el crustáceo Gammarus sp. a una concentración media de 0,1 mg L-1 de C16TMAC. La toxicidad de las sales de alquil trimetil amonio sobre peces ha sido objeto de estudio de pocos autores. En un estudio realizado por Boethling y Lynch (1992) para una serie de sales de alquil trimetil amonio, mostraban valores de EC50 comprendidos entre 0,86 y 8,6 mg L-1 para la carpa Idus melanotus. Asimismo, Singh y col. (2002), para el C16TMAC, determinaron los valores de EC50 (movilidad, 48-h) para tres especies de peces de agua dulce, siendo ésta de 1,21 mg L-1 para la trucha arco iris (Salmo gairdneri), 8,24 mg L-1 para el pez mosquito (Gammbusia affinis) y 3,58 mg L-1 para la carpa dorada (Carassius auratus). De forma general, la toxicidad de los tensioactivos catiónicos aumenta con la longitud de la cadena alquílica como consecuencia del aumento de la hidrofobicidad de la molécula (García y col., 2001). Sin embargo, en ensayos de toxicidad realizados sobre el crustáceo D. magna y la fotobacteria P. phosphoreum, García y col. (2001) no observaron diferencias significativas en la toxicidad de diferentes homólogos. Esto puede ser atribuido a la baja biodisponibilidad de los homólogos de cadena alquílica más largas como consecuencia de su menor solubilidad. III-6 Sales de alquil trimetil amonio 2. Materiales En el siguiente apartado se describen las principales características físico-químicas del tensioactivo catiónico, objeto del presente estudio, así como del medio de ensayo empleado tanto en los ensayos de biodegradación como de toxicidad sobre organismos marinos. Tensioactivo ensayado El tensioactivo catiónico empleado en el presente estudio fue el cloruro de dodecil trimetil amonio (DTMAC), CAS 112-00-5 y suministrado por Sigma Aldrich, S.A. (Barcelona). Se trata de un homólogo puro constituido por una cadena alquílica de 12 átomos de carbono y fórmula empírica C15H34ClN. Posee un peso molecular de 263,89 g mol-1, una solubilidad en agua de 50 g L-1 y una pureza superior al 99% de materia activa. Medio de ensayo En la Tabla III.1 se recogen las principales características físico-químicas y biológicas del agua de mar empleada en los ensayos de biodegradación y toxicidad. Como puede observarse las concentraciones de nitrito, nitrato, amonio y fosfato se encuentran por debajo del límite de detección del método. Por otro lado, el análisis microbiológico desvela la ausencia de microorganismos indicadores de influencia de aguas residuales urbanas. Además, se aprecia una baja concentración de carbono orgánico disuelto, similar a las descritas en aguas oceánicas (USEPA, 1998). Estos resultados indican que se trata de un agua de excelente calidad y con muy bajo nivel ó nulo de contaminación. Tabla III.1. Características del agua de mar empleada en los ensayos de biodegradación y toxicidad del tensioactivo catiónico (valor medio ± desviación estándar, n=3). Parámetro Unidades Valor Parámetro Unidades Valor -1 - < 0,020 Oxígeno disuelto % saturación 89,9 ± 1,8 Nitrato mg L NO3 Temperatura ºC 21,0 ± 0,3 Amonio mg L-1 NH4+ < 0,007 Conductividad mS cm-1 51,1 ± 0,2 Fosfato mg L-1 PO43- < 0,015 pH - 8,25 ± 0,04 Silicato mg L-1 Si 0,046 ± 7·10-4 Salinidad 38,7 ± 0,2 -1 Dureza total -1 2+ mg L Ca -3 316 ± 45 Carbono Total mg L C 26,5 ± 0,5 Clorofila a mg m Carbono inorgánico mg L-1 C 25,6 ± 0,5 Estreptococos fecales UFC 100mL-1 No detectado Carbono orgánico mg L-1 C 0,97 ± 0,01 Coliformes fecales UFC 100mL-1 No detectado < 0,015 Enterococos UFC 100mL-1 No detectado Nitrito -1 mg L NO2 - Cl a 0,85 ± 0,10 III-7 Capítulo 3 3. Resultados y discusión Los resultados de los distintos ensayos realizados con DTMAC durante el trabajo experimental se discuten en este apartado. En primer lugar, se resume el análisis de los parámetros de control medidos en el proceso de biodegradación. Posteriormente, se exponen los resultados correspondientes al estudio cinético del proceso de mineralización del tensioactivo estudiado. A continuación, se discuten los valores de toxicidad aguda obtenidos a partir de los ensayos de inhibición de crecimiento y mortalidad sobre microalgas y crustáceos marinos. Finalmente, se comentan los resultados obtenidos en los ensayos de toxicidad con muestras procedentes de diferentes estadíos del ensayo de biodegradación. 3.1. Ensayos de biodegradación Parámetros de control En la Figura III.3 se recogen la evolución del pH y oxígeno disuelto en los ensayos de biodegradación (C1, C2 y C3) y en el control (CO1). 8,4 100 O2 (%saturación) pH 8,3 8,2 CO1 C1 C2 C3 8,1 8,0 80 60 40 CO1 C1 C2 C3 20 0 0 10 20 30 Tiempo (d) 40 50 0 10 20 30 40 50 Tiempo (d) Figura III.3. Evolución del pH y oxígeno disuelto en el ensayo control (CO1) y los ensayos de biodegradación con DTMAC (C1, C2 y C3). Como puede observarse en la Figura III.3, los valores de pH permanecen prácticamente constantes a lo largo del experimento de biodegradación, sin diferencias significativas entre los ensayos de biodegradación y el ensayo control, mostrando valores medios de pH (valor medio ± DE) de 8,2 ± 0,1. III-8 Sales de alquil trimetil amonio Respecto a la concentración de oxígeno disuelto, se aprecia en general un descenso inicial de los niveles de oxígeno, los cuales se mantienen durante el resto del experimento. No obstante, la concentración de oxígeno disuelto en los ensayos de biodegradación y ensayo control permanece dentro de un intervalo que garantiza el desarrollo apropiado de los microorganismos aerobios, mostrando valores medios de 73,7 ± 3,1 y 78,3 ± 3,7 % de saturación para los ensayos de biodegradación y control, respectivamente. En el caso del ensayo de referencia los valores de pH y oxígeno disuelto estuvieron comprendidos entre 8,3 ± 0,1 y 76,9 ± 13,7 % de saturación, respectivamente. Los valores medios de temperatura en los ensayos control, referencia y biodegradación con tensioactivos fueron de 20,0 ± 0,1ºC, 19,9 ± 0,2ºC y 20,0 ± 0,1°C, respectivamente. A la vista de estos resultados se puede concluir que las condiciones experimentales durante el proceso de biodegradación del tensioactivo fueron no limitantes para un desarrollo óptimo de la microbiota responsable de la actividad degradativa. Evolución del carbono orgánico disuelto en los ensayos control, referencia y abiótico Concentración (mg COD L-1) En la Figura III.4 se muestra la evolución del carbono orgánico disuelto (COD) en los ensayos control, referencia (benzoato sódico) y abiótico (HgCl2). 20 15 10 REF1 AB1 CO1 5 0 0 10 20 30 40 50 Tiempo (d) Figura III.4. Evolución del carbono orgánico disuelto en los ensayos control (CO1), referencia (REF1) y abióticos (AB1) a lo largo del proceso de biodegradación. Se puede observar como la concentración de COD en el ensayo control permanece constante a lo largo del experimento, alcanzando valores medios de 0,9 ± 0,7 mg L-1 COD. III-9 Capítulo 3 Asimismo, los valores de COD en el medio abiótico, en presencia de HgCl2, permanecen en torno al valor inicial a lo largo del ensayo, mostrando un porcentaje medio de mineralización del 1,1 ± 0,8 %. Este resultado viene a descartar la contribución de procesos abióticos tales como adsorción, precipitación, etc. en la eliminación del tensioactivo DTMAC en los ensayos de biodegradación realizados. En cuanto al ensayo de referencia, puede observarse como el benzoato sódico es degradado en una extensión superior al 50% al cabo de 5 días de ensayo, mientras que al cabo de 9 días el porcentaje de degradación es superior al 90%. Estos valores son acordes a los hallados por otros autores (Nyholm y Kristensen, 1992; Staples y col., 2001; Perales y col., 2007) para el mismo sustrato y medio de ensayo (tiempo de vida media comprendido entre 1 y 7 días), indicando la adecuada actividad de la población microbiana presente en el medio. Evolución del carbono orgánico disuelto en los ensayos con tensioactivo -1 Concentración (mg COD L ) En la Figura III.5 se representan los valores de concentración residual de DTMAC (mg L-1 COD) a lo largo del experimento para los tres ensayos realizados. Los puntos indican los valores medios experimentales, mientras que las barras de error denotan la desviación estándar (n=3). 20 15 10 5 0 0 10 20 30 40 50 Tiempo (d) Figura III.5. Evolución de la concentración residual de DTMAC (mg COD L-1) en los ensayos de biodegradación. La línea continua corresponde a la curva obtenida del ajuste de los valores experimentales a un modelo cinético logístico. III-10 Sales de alquil trimetil amonio Se puede observar como la concentración de COD se mantiene prácticamente constante durante los primeros días de ensayo (fase de latencia) para posteriormente comenzar el proceso metabólico, alcanzándose porcentajes de mineralización superiores al 55% (8,3 mg L-1 COD) y 91% (1,6 mg L-1 COD) al cabo de unos 28 y 40 días de ensayo, respectivamente. De acuerdo con la directiva OPPTS 835.3160 “Biodegradabilidad en agua de mar” (USEPA, 1998), los resultados obtenidos en los ensayos de biodegradabilidad con DTMAC (más de un 90% de biodegradación al cabo de 40 días de ensayo) manifiestan la existencia de un potencial para la biodegradación del tensioactivo en el medio acuático marino. La presencia de una fase de adaptación de los microorganismos responsables de la degradación del tensioactivo (fase de latencia, aclimatación o inducción) ha sido también puesta de manifiesto por diversos autores para otros tensioactivos y medios de ensayo (Shimp, 1989; Manzano y col., 1998; Perales y col., 1999; Staples y col., 2001; Perales y col., 2007). Así, Manzano y col. (1998) establecieron que la presencia de esta fase puede ser debida bien a una baja concentración de microorganismos con capacidad para degradar el tensioactivo en el medio ó bien a que la microbiota presente en el medio empleado no ha estado expuesta anteriormente al tensioactivo en cuestión, y por tanto, ha de aclimatar su sistema enzimático a la nueva fuente de sustrato (inducción enzimática). Otros autores defienden que este comportamiento puede ser consecuencia del efecto tóxico o bacteriostático generado por la presencia de altas concentraciones de sustrato sobre las poblaciones bacterianas presentes en el medio (García y col., 1999). Por otro lado, Wiggings y Alexander (1988a, 1988b) establecieron como posibles causas, además de las ya mencionadas, la falta de nutrientes, predación por protozoos ó la mutación de especies. En nuestro caso, podemos descartar estas últimas como posibles causas del periodo de aclimatación dado que el medio de ensayo fue previamente enriquecido con un medio de nutrientes y filtrado (eliminación de protozoos). Además, dado que no se observa una fuerte variabilidad en el tiempo de latencia entre los diferentes ensayos replicados de biodegradación podemos considerar que la mutación de especies no tuvo lugar. En conclusión, la presencia de esta fase de aclimatación puede ser debida a una baja concentración de microorganismos en el medio, a que la microbiota presente en el medio empleado no haya estado expuesta anteriormente al tensioactivo DTMAC y/ó al efecto bacteriostático generado por la presencia del tensioactivo. Modelización cinética Los ensayos de biodegradación actuales propuestos por la Organización para la Cooperación y el Desarrollo Económico (OCDE), así como otros organismos, por ejemplo, la Agencia de Protección Ambiental de los Estados Unidos (USEPA), no recogen un tratamiento cinético preciso de los datos experimentales; tan sólo se limitan al cálculo, mediante métodos gráficos, de los parámetros cinéticos tiempo de latencia (tL), t50 (tiempo III-11 Capítulo 3 transcurrido hasta alcanzar un 50% de biodegradación, sin considerar la fase de latencia) y tiempo de vida media (t1/2). Con el fin de conocer la cinética de biodegradación del tensioactivo en el medio marino, bajo las condiciones ensayadas, y calcular de una manera rigurosa los parámetros cinéticos tL, t50 y t1/2, se han ajustado los valores experimentales obtenidos a diferentes modelos cinéticos de consumo de sustrato propuestos por Simkins y Alexander (1984) y Quiroga y col. (1999). En la Tabla III.2 se recogen los valores de los parámetros cinéticos y estadísticos estimados para cada uno de los modelos aplicados. Se puede observar como sólo los modelos logístico y de Quiroga, Sales y Romero (Q-S-R) muestran un buen ajuste a los datos experimentales, con coeficientes de determinación (R2) muy próximos a la unidad en ambos casos (R2 > 0,98). Además, en ambos casos se obtienen parámetros cinéticos con un coherente significado físico. Sin embargo, el análisis de la chi-cuadrada (χ2) desvela que sólo en el caso de aplicar un modelo logístico a los resultados experimentales, se obtiene un valor del parámetro estadístico Q próximo a la unidad (χ2 ~ ν), lo que viene a indicar que las diferencias aparentes entre los datos experimentales y los datos generados por el modelo se deben principalmente a fluctuaciones experimentales y no a una falta de ajuste de los datos experimentales al modelo. Estos resultados indican que el modelo cinético logístico es el que mejor describe la cinética de mineralización del tensioactivo DTMAC en agua de mar y bajo las condiciones ensayadas. En la Figura III.5 se representa mediante una línea continua los valores obtenidos al ajustar los valores experimentales a un modelo cinético logístico. Tabla III.2. Parámetros cinéticos y estadísticos correspondientes a los resultados de biodegradación de DTMAC en agua de mar. Modelo Primer-orden (Simkins y Alexander, 1984) Logístico (Simkins y Alexander, 1984) Q-S-R (Quiroga y col., 1999) a Parámetro cinético -1 S0 (mg COD L ) 24,09 ± 9,82 K1 (d-1) 0,039 ± 0,022 S0 (mg COD L-1) 19,16 ± 2,39 B0 (mg COD L-1) 0,146 ± 0,032 KLg (mg COD L-1 d-1) 0,0094 ± 0,044 S0 (mg COD L-1) 19,03 ± 2,23 Sto (mg COD L-1) 19,10 ± 2,33 Snb (mg COD L-1) 0,957 ± 2,62 μmax (d-1) 0,209 ± 0,087 Datos presentados como valor medio ± DE (n=3) III-12 Valora Parámetros estadísticos R2 χ2 ν Q 0,80 8642,5 49 0 0,98 55,96 48 0,200 0,98 100,05 47 1,05E-05 Sales de alquil trimetil amonio A partir de los parámetros cinéticos obtenidos del ajuste del modelo logístico a los datos experimentales, y al objeto de poder comparar los resultados con los obtenidos por otros autores, se ha calculado el tiempo de latencia (tL), t50 y el tiempo de vida media (t1/2). Para ello se emplearon las siguientes ecuaciones cinéticas obtenidas a partir de un modelo logístico por Perales y col. (2007): ⎡1 ⎛ S ⎞⎤ Ln ⎢ • ⎜⎜ 0 + 10 ⎟⎟⎥ 9 B ⎝ 0 ⎠⎦ tL = ⎣ K Lg • (S 0 + B0 ) t 50 ⎡⎛ 9 • (S 0 + 2 • B 0 ) ⎞⎤ ⎟⎟⎥ Ln ⎢⎜⎜ ⎣⎢⎝ (S 0 + 10 • B 0 ) ⎠⎦⎥ = K Lg • (S 0 + B 0 ) t1 / 2 = t 50 + t L (1) (2) (3) Sustituyendo los valores de los parámetros cinéticos por los obtenidos anteriormente para el modelo logístico (Tabla III.2), se obtiene un valor medio de tiempo de latencia (tL) de 15,17 días, un valor de t50 de 11,78 días y un tiempo de vida media (t1/2) de 26,95 días. Diversos son los estudios que han abordado la mineralización de las sales de alquil trimetil amonio en diferentes medios; si bien la mayoría de ellos emplean condiciones experimentales muy dispares. Como consecuencia, resulta difícil realizar comparaciones con los resultados mostrados en el presente trabajo. Así, por ejemplo, Madsen (2001) para el tensioactivo C16TMAC y empleando una concentración inicial de 10 mg L-1 obtuvo un porcentaje de mineralización del 40% al cabo de 28 días en un medio mineral inoculado. Por el contrario, Boethling (1984) usando una concentración 1000 veces menor (10 μg L-1) y otro medio de ensayo (agua de río) obtuvo valores comparables (75% mineralización al cabo de 21 días). Sin embargo, Larson y Vishon (1983) empleando un medio pre-expuesto al tensioactivo, hallaron velocidades de degradación 10 veces más bajas (50% mineralización al cabo de 2,2 días). En el caso de agua de mar, tan sólo se ha encontrado un estudio llevado a cabo por García y col. (2001), los cuales obtuvieron tiempos de vida media comprendidos entre 6 y 11 días, usando una concentración de 5 mg L-1 de tensioactivo y un inóculo de microorganismos. Como conclusión no podemos afirmar que la velocidad de degradación en el medio marino de estos compuestos sea mayor o menor que en otros ambientes. Si bien, se puede establecer que los datos obtenidos son análogos a los encontrados por Boethling (1984) y Madsen (2001), comparables a los obtenidos por García y col. (2001) en agua de mar inoculada, y muy diferentes a los descritos por Larson y Vishon (1983) en agua de río aclimatada. III-13 Capítulo 3 3.2. Ensayos de toxicidad aguda estándar Ensayos de toxicidad con microalgas marinas En la Figura III.6 se muestra la evolución temporal de la concentración neta de biomasa (densidad óptica neta, DOn = DOt=t – DOt=0) para diferentes concentraciones de exposición de DTMAC (mg L-1) en los ensayos estándar de toxicidad con microalgas. Se pueden observar diferentes efectos tóxicos dependiendo de la especie de microalga ensayada. Así, para las microalgas I. galbana y C. gracilis se observan porcentajes de inhibición del crecimiento superiores al 15%, incluso para la mínima concentración ensayada (1 mg DTMAC L-1). Por el contrario, el crecimiento de las microalgas N. gaditana y T. chuii es inhibido a concentraciones iguales o superiores a 4 y 5 mg DTMAC L-1, respectivamente. Un caso intermedio es el de la microalga D. salina, la cual presenta efectos tóxicos a concentraciones iguales o superiores a 2 mg DTMAC L-1. Por otro lado, podemos observar que el tensioactivo DTMAC muestra efectos letales para todas las microalgas. En el caso de I. galbana y C. gracilis, se aprecia una mortalidad de los cultivos (valores negativos de densidad óptica neta) al cabo de 24 horas de ensayo a concentraciones superiores a 3 mg DTMAC L-1, mientras que la mortalidad de los cultivos N. gaditana, D. salina y T. chuii tiene lugar a concentraciones superiores de 6 y 8 mg DTMAC L-1, respectivamente. III-14 Sales de alquil trimetil amonio 0,6 N. gaditana 0,6 0 2 4 6 8 0,4 10 mg L-1 0,2 I. galbana 0 1 2 3 4 0,5 0,4 DOn (690 nm) DOn (690 nm) 0,8 0,3 5 mg L-1 0,2 0,1 0,0 0,0 -0,1 -0,2 0 20 40 60 80 -0,2 100 0 20 Tiempo (h) 0,5 60 80 100 80 100 C. gracilis 0 1 2 3 4 0,4 DOn (690 nm) 40 Tiempo (h) 0,3 5 mg L-1 0,2 0,1 0,0 -0,1 0 20 40 60 80 100 Tiempo (h) 1,0 0,6 10 mg L-1 0,4 0,2 0,0 T. chuii 0 5 10 20 30 0,5 DOn (690 nm) DOn (690 nm) 0,8 0,6 D. salina 0 2 4 6 8 0,4 40 mg L-1 0,3 0,2 0,1 0,0 -0,2 -0,1 0 20 40 60 Tiempo (h) 80 100 0 20 40 60 Tiempo (h) Figura III.6. Evolución de la concentración neta de biomasa (DOn, 690 nm) en el ensayo de toxicidad estándar con microalgas. Las barras de error denotan las desviaciones estándares (n=3). III-15 Capítulo 3 Los valores medios de las concentraciones de inhibición del crecimiento (IC50), NOEC (concentración más elevada a la que no se observan efectos adversos) y LOEC (concentración más baja a la que se observan efectos adversos) calculadas para cada una de las microalgas ensayadas y un periodo de exposición de 96 horas se recogen en la Tabla III.3. Se puede observar como los valores de IC50 (inhibición del crecimiento) están comprendidos entre 0,69 y 6,34 mg DTMAC L-1, dependiendo de la especie. Por otro lado, los resultados mostrados en la tabla muestran que los valores de NOEC son inferiores a la mínima concentración ensayada en todos los casos, a excepción de la microalga T. chuii. De acuerdo con los valores IC50 obtenidos, podemos establecer el siguiente orden de sensibilidad de las diferentes microalgas al tensioactivo: C. gracilis > I. galbana ≈ D. salina > N. gaditana > T. chuii, siendo esta última la más tolerante al tensioactivo catiónico. Tabla III.3. Valores de IC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con microalgas marinas y el tensioactivo DTMAC. Organismo Efecto tóxico Concentración (mg L-1) N. gaditana 96-h IC50 4,01 (3,36-4,55)a 96-h NOEC 3,04b 96-h LOEC 4,06b 96-h IC50 1,45 (1,23-1,61)a 96-h NOEC < 1,02b 96-h LOEC 1,02b 96-h IC50 0,69 (0,59-0,73)a 96-h NOEC < 1,02b 96-h LOEC 1,02b 96-h IC50 1,24 (1,16-1,38)a 96-h NOEC < 2,08b 96-h LOEC 2,08b 96-h IC50 6,34 (5,36-7,33)a 96-h NOEC < 5,07b I. galbana C. gracilis D. salina T. chuii 96-h LOEC 5,07b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Como ya se ha comentado en el apartado de introducción, la bibliografía existente en torno a la toxicidad de estos compuestos sobre microalgas marinas es muy limitada. Esto hace que la comparación de los resultados obtenidos en el presente estudio con los resultados descritos en la bibliografía no resulte sencilla. Tan sólo se han encontrado datos de toxicidad del tensioactivo C16-18TMAC sobre la especie Dunaliella sp., obteniéndose un III-16 Sales de alquil trimetil amonio valor de EC50 (24-h, formación de 13C-Glicerol) de 0.79 mg L-1 (Utsunomiya y col., 1997a). Como puede apreciarse en la Tabla III.3 los valores obtenidos en los ensayos de toxicidad con microalgas para DTMAC resultan del mismo orden de magnitud que el obtenido por Utsunomiya y col. (1997a). Sin embargo, si se comparan los valores obtenidos en el presente trabajo con los valores de toxicidad descritos para diferentes sales de alquil trimetil amonio en microalgas de agua dulce, se observan que éstos difieren significativamente en uno o varios órdenes de magnitud, dependiendo de la especie ensayada. Así, por ejemplo, Lewis y Hamm (1986) encontraron valores de IC50 (96-h) comprendidos entre 0,03 y 0,2 para las especies S. capricornutum y M. aeruginosa, lo que supone una toxicidad de 10-100 órdenes de magnitud mayor que las encontradas en especies marinas. En un estudio de toxicidad realizado por Utsunomiya y col. (1997b) sobre la microalga Chlorella pyrenoidosa se muestran valores de toxicidad ligeramente inferiores (EC50= 0,28 mg L-1) que los observados en el presente trabajo para las microalgas marinas. Estos resultados parecen indicar que los efectos tóxicos agudos generados por la presencia de sales de alquil trimetil amonio son más acusados en especies de microalgas de agua dulce que en especies marinas. Si bien sería deseable contar con un mayor número de datos para poder afirmar esta observación. Ensayos de toxicidad con Artemia franciscana En este apartado se muestran los resultados de toxicidad obtenidos para el crustáceo A. franciscana expuesto a concentraciones crecientes de DTMAC. La siguiente gráfica muestra el porcentaje de supervivientes obtenidos para periodos de exposición de 48 y 72 horas. A. franciscana Supervivientes (%) 100 80 60 40 20 48h 72h 0 0 20 40 60 80 100 Concentración (mg L-1) Figura III.7.Efecto de DTMAC sobre A. franciscana a las 48 y 72 horas de exposición. Los datos se representan como valor medio ± DE (n=5). III-17 Capítulo 3 Se puede observar un aumento de la mortalidad de la población de artemias como consecuencia del efecto tóxico del tensioactivo, alcanzando el valor máximo (100% mortalidad) a una concentración de DTMAC de 75 mg L-1 tanto a las 48 como a las 72 horas de exposición. Asimismo, se aprecia un aumento de la toxicidad del tensioactivo al aumentar el periodo de exposición, disminuyendo así el porcentaje de supervivencia. Por otro lado, cabe destacar que para un periodo de exposición de 48 horas prácticamente no se observan efectos letales sobre la población de crustáceos a concentraciones inferiores de 30,5 mg DTMAC L-1, mientras que al cabo de 72 horas de exposición el porcentaje de mortalidad fue inferior al 20% a concentraciones inferiores de 22,5 mg DTMAC L-1. Los valores de los parámetros de toxicidad LC50 (concentración que produce la mortalidad del 50% de la población), NOEC y LOEC calculados para un periodo de exposición de 48 y 72 horas se recogen en la Tabla III.4. Tabla III.4. Valores de LC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con crustáceos y el tensioactivo DTMAC. Organismo Efecto tóxico Concentración (mg L-1) A. franciscana 48-h LC50 46,74 (44,62-48,87)a 72-h LC50 34,19 (31,89-36,66)a 48-h NOEC 31,5b 48-h LOEC 50,0b 72-h NOEC 22,5b 72-h LOEC 27,0b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a De manera similar a lo que ocurre con las microalgas marinas, no se han encontrado en la bibliografía valores de toxicidad de las sales de alquil trimetil amonio sobre artemias ni otros crustáceos marinos, limitándose los datos de toxicidad hallados en la bibliografía a especies agua dulce. Sin embargo, si comparamos los valores obtenidos anteriormente (Tabla III.4) con los aportados por otros autores para diferentes sales de alquil trimetil amonio y especies de agua dulce se aprecian diferencias significativas entre ambos. En un estudio llevado a cabo por Lewis y Suprenant (1983) sobre el crustáceo Gammarus sp. se mostraba un valor de LC50 (48-h) de 0,1 mg L-1. Por otro lado, García y col. (2001) obtuvieron valores de EC50 (24-h) comprendidos entre 0,13 y 0,38 mg L-1 para el crustáceo D. magna. Estos resultados parecen indicar que, al igual que ocurre con las microalgas marinas, los efectos adversos de estos tensioactivos sobre crustáceos marinos son menos acusados que en especies de agua dulce. No obstante, sería necesario realizar más ensayos de toxicidad con estos tensioactivos utilizando un mayor número de especies III-18 Sales de alquil trimetil amonio tanto de agua dulce como marinas al objeto de obtener un conjunto de datos más homogéneos y corroborar así esta hipótesis. 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación El presente apartado tiene como objetivo el estudio de la evolución de la toxicidad del medio de ensayo a lo largo del proceso degradativo, con el fin de determinar si durante la biodegradación del tensioactivo se generan metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original o si por el contrario, el tensioactivo presenta una biodegradación ambientalmente aceptable, disminuyendo así la toxicidad del medio de ensayo a medida que es degradado. En la Figura III.8 se representa la evolución temporal de la toxicidad del medio de ensayo (% inhibición del crecimiento/mortalidad) y grado de mineralización (%) durante el ensayo de biodegradación del tensioactivo catiónico DTMAC. III-19 Capítulo 3 60 60 IC, 96-h (%) Biodegradación (%) 40 20 20 0 0 10 20 30 60 60 IC, 96-h (%) Biodegradación (%) 40 20 20 0 0 40 0 10 Tiempo (días) 100 60 60 IC, 96-h (%) Biodegradación (%) 40 20 20 0 0 10 20 30 Inh. crecimiento, 96-h (%) 80 0 80 60 IC, 96-h (%) Biodegradación (%) 40 20 20 0 0 0 10 40 20 20 0 0 20 30 40 Mortalidad, 72-h (%) 60 IC, 96-h (%) Biodegradación (%) Biodegradación (%) Inh. crecimiento, 96-h (%) 60 Tiempo (días) 20 30 40 A. franciscana 100 100 80 10 40 Tiempo (días) 80 0 100 80 60 40 T. chuii 40 40 D. salina Tiempo (días) 100 30 100 Biodegradación (%) Inh. crecimiento, 96-h (%) 80 40 20 Tiempo (días) C. gracilis 100 40 Biodegradación (%) 0 80 100 80 80 60 60 40 40 LC,72-h (%) Biodegradación (%) 20 20 0 Biodegradación (%) 40 80 100 Biodegradación (%) 80 I. galbana 100 Inh. crecimiento, 96-h (%) Inh. crecimiento, 96-h (%) 80 100 Biodegradación (%) N. gaditana 100 0 0 10 20 30 40 Tiempo (días) Figura III.8. Evolución del efecto tóxico del medio de ensayo (%) y porcentaje de mineralización (%) durante el experimento de biodegradación de DTMAC. III-20 Sales de alquil trimetil amonio Desde un punto de vista teórico, la evolución de la toxicidad del medio durante el proceso degradativo puede seguir cuatro patrones de comportamiento: (a) La toxicidad del medio de ensayo disminuye a medida que se degrada el compuesto, esto es, se produce una detoxificación del medio, lo que viene a indicar que el sustrato inicial no sólo constituye la única fuente de toxicidad del medio sino que durante su biodegradación no se están generando metabolitos más tóxicos (en cantidad y/ó naturaleza) que el compuesto original. En este caso la representación tendría una forma análoga a la que se muestra en la Figura III.9A. Efecto tóxico (%) Biodegradación (%) Tiempo (días) Tiempo (días) D C Efecto tóxico (%) Biodegradación (%) 40 20 0 80 60 Efecto tóxico (%) Biodegradación (%) 40 20 Biodegradación (%) 80 Efecto tóxico (%) 100 Biodegradación (%) Efecto tóxico (%) 100 60 Biodegradación (%) Efecto tóxico (%) Biodegradación (%) Efecto tóxico (%) B Biodegradación (%) Efecto tóxico (%) A 0 Tiempo (días) Tiempo (días) Figura III.9. Curvas modelo de evolución del efecto tóxico del medio de ensayo (%) y porcentaje de biodegradación final (%) durante el experimento de biodegradación de un sustrato. (b) La toxicidad del medio de ensayo aumenta durante la biodegradación del tensioactivo como consecuencia de la generación de metabolitos más tóxicos que el compuesto original (Figura III.9B) III-21 Capítulo 3 (c) La toxicidad inicial del medio de ensayo es inferior al 100% y dicho valor se mantiene constante durante los primeros estadíos del proceso de biodegradación, lo que vendría a indicar que se está generando metabolitos de toxicidad similar (en cantidad y naturaleza) a la del tensioactivo original (Figura III.9C) (d) La toxicidad inicial del medio de ensayo es del 100% y dicho valor se mantiene constante, incluso una vez superada la fase de latencia del proceso de biodegradación. En este caso no podemos garantizar que durante la biodegradación del tensioactivo se ha producido metabolitos más o menos tóxicos (en cantidad y naturaleza) que el compuesto original, puesto que partimos del valor máximo de efecto al inicio del ensayo (Figura III.9D). Observando los resultados mostrados en la Figura III.8 se puede apreciar que en el caso de las microalgas N. gaditana, I. galbana, C. gracilis y D. salina la toxicidad inicial del medio de ensayo (0% biodegradación del DTMAC) fue del 100%, permaneciendo constante durante los primeros 25-30 días de ensayo (40-70% biodegradación del DTMAC). Este hecho se debe a la alta sensibilidad que presentan estas especies de microalgas en comparación con la elevada concentración inicial de tensioactivo empleado en el ensayo de biodegradación y no nos permite evaluar si durante la biodegradación del tensioactivo se están generando metabolitos más ó menos tóxicos que el tensioactivo original (caso D). En el caso de T. chuii y A. franciscana se puede observar una detoxificación del medio a medida que transcurre la biodegradación del tensioactivo alcanzando niveles de detoxificación del medio del 90% al cabo de 44 y 36 días, respectivamente (caso A). Si consideramos los valores de efectos tóxicos obtenidos cuando se alcanza aproximadamente un 50% de mineralización del tensioactivo (día 28, 55% de mineralización) podemos apreciar que éstos varían significativamente dependiendo de la especie. Así, en el caso de las microalgas I. galbana y C. gracilis el porcentaje de efecto observado es del 100% mientras que para D. salina resulta ligeramente inferior (90%). Por el contrario N. gaditana y T. chuii presentan los menores valores de efectos, mostrando porcentajes de inhibición del crecimiento del 38 y 11%, respectivamente. En el caso del crustáceo A. franciscana, se puede observar un efecto toxico del 20% al cabo de 28 días de ensayo (55% biodegradación). A la vista de estos resultados podemos establecer el siguiente orden de sensibilidad al medio de ensayo: C. gracilis ≈ I. galbana ≈ D. salina > N. gaditana > T. chuii ≈ A. franciscana, siendo las microalgas C. gracilis, I. galbana y D. salina las más sensibles. Si comparamos estos resultados con los obtenidos anteriormente en los ensayos de toxicidad estándar con DTMAC podemos observar que el grado de sensibilidad de las especies al tensioactivo catiónico es bastante similar a la que presentan al medio de ensayo, a excepción del crustáceo el cual muestra una sensibilidad ligeramente III-22 Sales de alquil trimetil amonio mayor al medio de ensayo. No obstante, estos resultados parecen indicar que el tensioactivo (y no los metabolitos) constituyen la principal fuente de toxicidad del medio de ensayo. Atendiendo a los resultados obtenidos por T. chuii y A. franciscana podemos concluir que durante la biodegradación del tensioactivo se produce una clara detoxificación del medio sin formación de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original y por lo tanto, que el tensioactivo DTMAC presenta una biodegradación ambientalmente aceptable. III-23 Capítulo 3 4. Conclusiones Las principales conclusiones obtenidas en el presente capítulo son las siguientes: • El tensioactivo catiónico DTMAC presenta una elevada biodegrabilidad en el medio acuático marino bajo las condiciones ensayadas, alcanzando porcentajes de mineralización superiores al 91% al cabo de 40 días de ensayo, lo que viene a indicar la existencia de un potencial para la biodegradación de estos tensioactivos en el medio acuático marino. • La cinética de biodegradación final o mineralización del tensioactivo catiónico DTMAC puede ser explicada mediante un modelo cinético logístico, en el que la concentración residual de sustrato depende exclusivamente de la concentración inicial de tensioactivo y microorganismos. • La toxicidad del tensioactivo catiónico estudiado depende significativamente del organismo ensayado. Así, de las diferentes especies de microalgas estudiadas, C. gracilis representa la especie más sensible al tensioactivo. Respecto al crustáceo marino A. franciscana, a pesar de que los efectos estudiados han sido diferentes a los de las microalgas, se obtienen valores de toxicidad muy superiores, lo que parece indicar una mayor resistencia del crustáceo al tensioactivo estudiado. • El estudio de la evolución de la toxicidad del medio de ensayo indica que durante el proceso de biodegradación tiene lugar la detoxificación del medio sin producción de intermediatos más tóxicos (en cantidad y naturaleza) que el tensioactivo original. Estos resultados permiten clasificar al DTMAC como un compuesto de biodegradabilidad ambientalmente aceptable. III-24 Sales de alquil trimetil amonio Referencias Boethling, R.S., 1984. Environmental fate and toxicity in wastewater treatment of quaternary ammonium surfactants. Water Research 18, 1061-1076. Boethling, R.S., D.G. Lynch. 1992. Quaternary ammonium surfactants, pp. 145-177. En: N.T. de Oude (ed.), detergents, The Handbook of Environmental Chemistry, Vol. 3. Parte F. Anthropogenic compounds. Springer-Verlag, Berlin Heidelberg, Alemania (review). Dean-Raymond, D., Alexander, M., 1977. Bacterial metabolism of quaternary ammonium compounds. Appl. Environ. Microbiol. 33, pp. 1037–1041 Games, L.M., King, J.E., Larson, R.J., 1982. Fate and distribution of a quaternary ammonium surfactant, octadecyltrimethylammonium chloride (OTAC), in wastewater treatment. Environ. Sci. Technol. 16, 483-488. García, M.T., Campos, E., Sanchez-Leal, J., Ribosa, I., 1999. Effect of the alkyl chain length on the anaerobic biodegradability and toxicity of quaternary ammonium based surfactants. Chemosphere 38, 3473-3483. García, M.T., Ribosa, I., Guindulain, T., Sanchez-Leal, J., Vives-Rego, J., 2001. Fate and effect of monoalkyl quaternary ammonium surfactants in the aquatic environment. Environ Pollut 111, 169-175. Huber, L.H., 1984. Ecological behavior of cationic surfactants from the fabric softeners in the aquatic environment. JAOCS 61, 377-382. Huber, L.H., 1987. Ecological behaviour of cationic surfactants from fabric softeners in the aquatic environment. J. Am. Oil Chem. Soc. 61, 377-382. Janicke W, Hilge G, 1979. Biodegradability of anionic/cationic surfactant complexes under aerobic and anaerobic conditions of waste water and sludge treatment. Tenside Surfact Det 16, 472–482. Kupfer, W., 1982. Spurenanalytik von kationischen Tensiden unter den speziellen Bedingungen im Wasser und Abwasser. Tenside Surfactant Deterg 19, 158-161. Larson, R.J. and Vashon, R.D., 1983. Biodegradation of cationic surfactants in laboratory and environmental systems. Dev. Ind. Microbiol. 24, 425–434. Leuwen, K.v., Carla Roghair, C., Nijs, T.d., Greef, J.d., 1992. Ecotoxicological risk evaluation of the cationic fabric softener DTDMAC. III. Risk assessment. Chemosphere 24, 629-639. Lewis, M.A., Hamm, B.G., 1986. Environmental modification of the photosynthetic response of lake plankton to surfactants and significance to a laboratory - field comparison. Water Res. 20, 1575-1582. Lewis, M.A., Suprenant, D., 1983. Comparative acute toxicities of surfactants to aquatic invertebrates. Ecotoxicol Environ Saf 7, 313-322. Mackrell, J. y Walker, J.R.L., 1978. The biodegradation of quaternary ammonium compounds. Int. Biodeterior. Bull. 14, 77–83. III-25 Capítulo 3 Madsen, T., Boyd, H.B., Nylén, D., Pedersen, A.R., Petersen, G.I., Simonsen, F., 2001. Environmental and health assessment of substances in household detergents and cosmetic detergents and cosmetic detergent products. DK-EPA, Denmark. Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1998. Effect of concentration on the biodegradation of a nonylphenol polyethoxylate in river water. Bull Environ Contam Toxicol 61, 489-496. Masuda, F, S. Machida y M. Kanno, 1976. Studies on the biodegradability of some cationic surfactants. En: Proceeding of the 7th international congress of surface active agents, Moscow, USSR, 129-138. Nalecz-Jawecki, G., Grabinska-Sota, E., Narkiewicz, P., 2003. The toxicity of cationic surfactants in four bioassays. Ecotoxicol Environ Saf 54, 87-91. Nishiyama, N., Toshima, Y., Ikeda, Y., 1995. Biodegradation of alkyltrimethylammonium salts in actived sludge. Chemosphere 30, 593-603. Nyholm, N., Kristensen, P., 1992. Screening methods for assessment of biodegradability of chemicals in seawater results from a ring test. Ecotoxicol Environ Saf 23, 161-172. Perales, J.A., Manzano, M.A., Sales, D., Quiroga, J.M., 1999. Biodegradation kinetics of LAS in river water. International Biodeterioration & Biodegradation 43, 155-160. Perales, J.A., 2001. Variabilidad de la biodegradación y toxicidad de compuestos xenobióticos en el medio marino. Aplicación a lineal alquilbenceno sulfonatos en aguas del Golfo de Cádiz. Tesis Doctoral. Dpto. de Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. Perales, J.A., Manzano, M.A., Garrido, M.C., Sales, D., Quiroga, J.M., 2007. Biodegradation kinetics of linear alkylbenzene sulphonates in sea water. Biodegradation 18, 63-70. Quiroga, J.M., Perales, J.A., Romero, L.I., Sales, D., 1999. Biodegradation kinetics of surfactants in seawater. Chemosphere 39, 1957-1969. Scott, M.J., Jones, M.N., 2000. The biodegradation of surfactants in the environment. Biochim Biophys Acta 1508, 235-251. Shimp, R., 1989. LAS biodegradation in estuaries. Tenside Surfactant Deterg 26, 390-393. Simkins, S., Alexander, M., 1984. Models for mineralization kinetics with the variables of substrate concentration and population density. Appl Environ Microbiol 47, 1299-1306. Singh, R. P., Gupta, N., Singh, S., Singh, A., Suman, R., Annie, K., 2002. Toxicity of ionic and non-ionic surfactants to six microbes found in Agra, India. Bull Environ Contam Toxicol 69, 265–70. Staples, C.A., Naylor, C.G., Williams, J.B., Gledhill, W.E., 2001. Ultimate biodegradation of alkylphenol ethoxylate surfactants and their biodegradation intermediates. Environ Toxicol Chem 20, 2450-2455. Topping, B.W., Waters, J., 1982. The monitoring of cationic surfactants in sewage treatment plants. Tenside Surfactant Deterg 19, 164-169. III-26 Sales de alquil trimetil amonio USEPA, 1998. Fate, transport and transformation test guidelines. OPPTS. "Biodegradability in Sea Water" 835.3160. EPA 712–C–98–351 The Federal Bulletin Board. U.S. Government Printing Office Washington, DC. Utsunomiya, A., Watanukii, T., Matsusi-fita, K., Nishina, M., Tomita, I., 1997a. Assessment of the toxicity of linear alkylbenzene sulfonate and quaternary alkylammonium chloride by measuring 13C-glycerol in Dunaliella sp. Chemosphere 35, 2479-2490. Utsunomiya, A., Watanuki, T., Matsushita, K., Tomita, I., 1997b. Toxic effects of linear alkylbenzene sulfonate, quaternary alkylammonium chloride and their complexes on Dunaliella sp. and Chlorella pyrenoidosa. Environ. Toxicol. Chem. 16, 1247-1254. van de Plassche, E.J., De Bruijn, J.H.M., Stephenson, R.R., Marshall, S.J., Feijtel, T.C.J., Belanger, S.E., 1999. Predicted no-effect concentrations and risk characterization of four surfactants: linear alkyl benzene sulfonate, alcohol ethoxylates, alcohol ethoxylated sulfates, and soap. Environmental Toxicology and Chemistry 18, 2653–2663. Versteeg, D.J., Feijtel, T.C., Cowanl, C.E., Ward, T.E., Rapaport, R.A., 1992. An environmental risk assessment for DTDMAC in the Netherlands. Chemosphere 24, 641-662. Wiggins, B. A., Alexander, M., 1988a. Role of chemical concentration and second carbon sources in acclimation of microbial communities for biodegradation. Appl. Environ. Microbiol. 54(11), 2803-2807. Wiggins, B. A., Alexander, M., 1988b. Role of protozzoa in microbial acclimation for mineralization of organic chemicals in sewage. Can. J. Microbiol. 34, 661-666. Ying, G.G., 2006. Fate, behavior and effects of surfactants and their degradation products in the environment. Environ Int 32, 417-431. III-27 Capítulo 4 NONILFENOLES ETOXILADOS Resumen El presente capítulo muestra los resultados obtenidos en los ensayos de biodegradación, ecotoxicidad y ensayos combinados de toxicidad y biodegradación del tensioactivo comercial no-iónico Tergitol®NP9, perteneciente a la familia de los nonilfenoles etoxilados. Los resultados obtenidos indican la existencia de un potencial para la degradación del tensioactivo en el medio marino, siguiendo la mineralización del tensioactivo Tergitol®NP9 una cinética de primer orden. En relación a la toxicidad, las microalgas son más sensibles a la presencia del tensioactivo que el crustáceo A. franciscana, y dentro de éstas las especies I. galbana y C. gracilis. Los resultados obtenidos en los ensayos combinados de toxicidad y biodegradación demuestran que el tensioactivo Tergitol®NP9 no presenta una biodegradación ambientalmente aceptable, puesto que durante el proceso degradativo la toxicidad del medio de ensayo aumenta debido a la formación de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original. Capítulo 4 1. Introducción Nonilfenoles etoxilados. Características y usos Dentro de la amplia gama de tensioactivos no-iónicos empleados actualmente, los alquilfenoles etoxilados (APEOs), y en particular los nonilfenoles etoxilados (NPEOs) constituyen uno de los agentes de superficie más consumidos en el mundo. Los datos más recientes de producción apuntaron un consumo total de 77.000 toneladas de NPEOs en Europa occidental para el año 2001 (OSPAR, 2001). Su estructura química está formada por una cadena alquílica con 9 átomos de carbono, un grupo aromático y una cadena etoxilada con un número variable de unidades etoxiladas (Figura IV.1). Convencionalmente, cada NPEO se describe mediante el número medio de unidades etoxiladas, el cual puede variar entre 1 y 100, aunque generalmente suele estar comprendida entre 1 y 20 unidades en función de la formulación. En general, a medida que incrementa la longitud de la cadena etoxilada, su peso específico, viscosidad y solubilidad en agua también lo hacen, siendo los NPEOs con un número medio de unidades etoxiladas superior a seis fácilmente solubles en agua. O OH O n R Figura IV.1. Estructura química del tensioactivos no-iónico nonilfenol etoxilado (R= CxH2x+1, x= 9; n= 0-19). Los NPEOs han sido utilizados ampliamente desde hace más de 40 años en diferentes aplicaciones tanto domésticas como industriales. Tradicionalmente, estos tensioactivos se han empleado en formulaciones de detergentes domésticos. No obstante, los NPEOs también desempeñan un papel fundamental en la formulación de determinados productos utilizados en diversos procesos industriales tales como: procesos de fabricación de papel, pinturas, resinas y revestimientos de protección, aceros y/ó plaguicidas así como en proceso de recuperación de aceites y gas, etc. Niveles de nonilfenoles etoxilados en el medio acuático Son numerosos los autores que han centrado sus esfuerzos en la monitorización de los nonilfenoles etoxilados en el medio acuático, incluido el medio marino. Como consecuencia existe una amplia bibliografía en relación a la presencia de estos tensioactivos en el medio acuático. IV-2 Nonilfenoles etoxilados En aguas continentales, Ahel y col. (1994b) describieron concentraciones máximas de 45 μg L-1 para NP1EC (ácido nonilfenoxiacético), 71 μg L-1 para NP2EC (ácido nonilfenoxietoxiacético), 69 μg L-1 para NP1EO (nonilfenol monoetoxilado), 30 μg L-1 para NP2EO (nonilfenol dietoxilado) y 45 μg L-1 para NP (nonilfenol) en muestras de aguas procedentes del río Glatt (Suiza), siendo la concentración de ambos grupos (NPEC y NPEO) generalmente superior a 10 μg L-1. Además, encontraron la presencia de NPEOs con un número de unidades etoxiladas comprendido entre 3 y 5, aunque a bajas concentraciones. Por otro lado, estudios realizados en agua de río por el Centro de Investigación del Agua (Water Research Center, WRc, 1991) describieron concentraciones de diferentes homólogos de APEOs comprendidas entre 1 y 80 μg L-1. Asimismo, estudios de monitorización llevados a cabo en diversos ríos en los Estados Unidos observaron concentraciones del metabolito NP de 2 μg L-1 en el río Delaware (Philadelphia), 10 μg L-1 en el río Rin y 1000 μg L-1 en un afluente del río Savannah (BUA, 1991). Los estuarios y océanos también se encuentran expuestos a los nonilfenoles etoxilados y sus metabolitos bien por el aporte de ríos contaminados ó bien debido a descargas directas de aguas residuales. Así, por ejemplo, Marcomini y col. (1990, 2000) encontraron diversos nonilfenoles etoxilados en la laguna de Venecia, la cual ha sido sometida a numerosas descargas de vertidos urbanos e industriales. Los resultados obtenidos mostraban niveles de NPEOs de 4,5 μg L-1, siendo los oligómeros de entre 5 y 10 unidades etoxiladas los más frecuentes. Por otro lado, Kvestak y col. (1994) examinaron la distribución de NPEOs en el efluente de una estación depuradora de aguas residuales y en el estuario del río Krka, un estuario fuertemente estratificado en la región adriática. Los niveles encontrados en las aguas residuales variaron entre 70 y 2960 μg NPEO L-1, mientras que en el estuario estuvieron comprendidos entre 1,1 y 6 μg L-1 en el agua salobre y 0,1-0,7 μg L-1 en la capa salina. Biodegradabilidad de los nonilfenoles etoxilados La biodegradabilidad de los alquilfenoles etoxilados (APEOs), y en particular de los nonilfenoles etoxilados (NPEOs), tanto en ensayos en laboratorios con aguas continentales como en estaciones depuradoras de aguas residuales ha sido objeto de estudio de diversos autores (Yoshimura, 1986; Maki y col., 1994; Manzano y col., 1998, 1999; Mann y Boddy, 2000). La ruta de biodegradación de los NPEOs más aceptada es la propuesta por Yoshimura (1986), la cual aparece recogida en la Figura IV.2. IV-3 Capítulo 4 Nonilfenol etoxilado (NPnEO) O OH O n R Hidrólisis (mecanismo a) O OH O n-1 O Hidrólisis (mecanismo a) R Oxidación (mecanismo b) Nonilfenol etoxilado NP(n-1)EO O OH OH O O O R ω-oxidación (mecanismo c) Ácido nonilfenoxietoxiacético NP2EC R Nonilfenol dietoxilado NP2EO Hidrólisis (mecanismo a) O O OH ω-oxidación (mecasnismo c) O OH R R Ácido nonilfenoxiacético NP1EC Nonilfenol monoetoxilado NP1EO Reducción (mecanismo b) OH Hidrólisis (mecanismo a) R Nonilfenol NP Figura IV.2. Rutas de biodegradación de los nonilfenoles etoxilados (Yoshimura, 1986) (R=C9H19). La biodegradación primaria consiste, primeramente, en un ataque hidrolítico sobre los grupos etoxilados de la cadena polietoxilada dando lugar a NPEOs de cadena más corta (mecanismo a; Swisher, 1987), que puede conllevar a la producción de metabolitos tales IV-4 Nonilfenoles etoxilados como nonilfenol dietoxilado (NP2EO) y monoetoxilado (NP1EO) y/ó nonilfenol (NP); si bien este último sólo ha sido observado en condiciones anaerobias (Ahel y Giger, 1994a). Por otro lado, Swisher (1987) propuso la carboxilación del grupo alcohol terminal de la cadena polietoxilada como otra de las posibles rutas de biodegradación (mecanismo b). Sin embargo, otros autores establecen que esta carboxilación sólo es dominante después del acortamiento de la cadena etoxilada a una o dos unidades etoxiladas (mecanismo c; Ahel y col., 1987; Ball y col., 1989). Rudling y Solyom (1974) y Maki y col (1994) propusieron la formación de NP2EC y NP1EC a partir de NPEO de cadena etoxilada corta (mecanismo b) bajo condiciones aerobias, mientras que la formación de NP2EO y NP1EO tendrían lugar bajo condiciones anaerobias (mecanismo a). Por otro lado, no contemplan la transformación de NP2EO y NP1EO a NP2EC y NP1EO, respectivamente, tal y como propone Yoshimura (1986). Otra posible reacción consiste en la oxidación de la cadena alquílica, cuya existencia ha sido puesta de manifiesto por diversos autores (Osburn y Benedict, 1966). Schobert y col. (1981) encontraron alquilfenol dietoxilado con grupos carboxílicos en la parte hidrófoba en mayor proporción que el compuesto sin oxidar. Pese a este resultado, no parece ser un mecanismo principal de degradación debido al grado de ramificación que suele presentar la cadena alquílica. La degradación total implica la completa mineralización de la estructura aromática de los NP/ NPEC (Swisher, 1987), aunque la mayoría de los estudios indican que mientras que la biodegradación primaria parece ser particularmente rápida (pérdida de las unidades etoxiladas), la metabolización de los biointermediatos NP, NP1EO, NP2EO, NP3EO y carboxilados NP1EC y NP2EC resulta extremadamente lenta (Talmage, 1994; Field y Reed, 1996; Potter y col., 1999; Staples y col., 1999). La biodegradabilidad de los NPEOs viene determinada principalmente por la estructura de la cadena alquílica, obteniéndose porcentajes de biodegradación y velocidades de degradación menores en el caso de cadenas alquílicas ramificadas (Kravetz, 1990). La posición del anillo bencénico en la cadena alquílica también influye en la velocidad de degradación. Así, los NPEOs en los que la unión del grupo aromático a la cadena alquílica tiene lugar en el carbono primario, presentan velocidades de biodegradación mayores (Little, 1977). Otro factor determinante en la velocidad de degradación de los NPEOs consiste en el número de unidades etoxiladas, obteniéndose velocidades de degradación menores a medida que aumenta el número de unidades etoxiladas (Little, 1977; Sivak y col., 1982). IV-5 Capítulo 4 Toxicidad de los nonilfenoles etoxilados en el medio acuático Como se ha podido apreciar en el apartado anterior, la ruta metabólica de los NPEOs conduce a la formación de biointermediatos, muchos de los cuales resultan ser persistentes, y más tóxicos que el compuesto original (Naylor y col., 1992; Jobling y Sumpter, 1993; Ahel y col., 1994a; White y col., 1994; Ahel y col., 1996). Estos metabolitos pueden ser hidrófobos, como es el caso de NP, NP1EO y NP2EO (Giger y col., 1984; Ahel y Giger, 1985; Brown, 1988) o hidrófilos, NP1EC y NP2EC (Giger y col., 1984; Ahel y col., 1987). Estudios realizados sobre diversas especies de peces encontraron una mayor toxicidad de estos metabolitos (NP1EO, NP2EO, NP1EC, NP2EC y NP) sobre peces de agua dulce (Yoshimura, 1986) y estuáricos (Hall y col., 1989) que el tensioactivo original. Por otro lado, Kravetz y col. (1991) y Maguire (1999) demostraron que la persistencia de estos compuestos es mayor que la de otros tensioactivos tales como lineal alquilbenceno sulfonatos (LAS) y alcoholes etoxilados (AE). Además, estudios llevados a cabo por diversos autores han demostrado que algunos de estos metabolitos tales como los NP exhiben efectos estrogénicos (Jobling y Sumpter, 1993; White y col., 1994). Debido a la elevada capacidad de bioacumulación en organismos (Ekelund y col., 1990), persistencia en el medio, y toxicidad, se han llevado a cabo, en diversos países, diferentes medidas para limitar el uso de estos tensioactivos. Así, por ejemplo, en la Directiva 60/2000/CE, Marco de Aguas, de la Comunidad Europea se han incorporado los metabolitos 4-para-nonilfenol y para-ter-octilfenol a la lista de sustancias prioritarias (UE, 2001). Además, existen otros acuerdos nacionales e internacionales que restringen la utilización de los nonilfenoles y nonilfenoles etoxilados tales como: Recomendación PARCOM 92/8 (resultado de la Convención OSPAR para la Protección del Medio Marino del Nordeste atlántico) sobre Nonilfenoles Etoxilados (PARCOM, 2002), el Reglamento 793/93/CE sobre la evaluación y control de sustancias existentes (CE, 1993), el programa “Existing Chemicals Programme” de la OCDE (Organización para la Cooperación y el Desarrollo Económico) (OECD, 1987), etc. De manera general, la toxicidad de los nonilfenoles etoxilados incrementa a medida que lo hace la longitud de la cadena alquílica (McLeese y col., 1981). Este hecho también ha sido observado por Hall y col. (1989) en ensayos de toxicidad sobre el camarón (Mysidopsis bahia) mostrando valores de LC50 (48-h) de 0,9-2 mg L-1 para el tensioactivo NP9EO, 2,5 mg L-1 para NP15EO y >100 mg L-1 para NP40EO y NP50EO. Por otro lado, estudios llevados a cabo por Yoshimura (1986) han puesto de manifiesto la disminución de la toxicidad de estos tensioactivos a medida que aumenta el número de unidades etoxiladas. En la actualidad, la bibliografía existente en torno a la toxicidad de NPEOs en organismos marinos es relativamente escasa, en comparación con los estudios realizados con organismos de agua dulce. En el caso de microalgas marinas, tan sólo se han IV-6 Nonilfenoles etoxilados encontrado dos referencias bibliográficas, siendo los valores obtenidos muy dispares. Ukeles (1965) estudió el efecto de estos tensioactivos sobre doce especies de microalgas marinas, mostrando una inhibición total del crecimiento a concentraciones superiores a 100 mg L-1 para una serie de NPEOs comerciales ramificados (Igepal). Por otro lado, Moreno y col. (2001) encontraron un valor de IC50 de 1,0 mg L-1 para el tensioactivo NP10EO y la microalga C. gracilis. Respecto a la toxicidad en crustáceos marinos, Hall y col. (1989) y Patoczka y Pulliam (1990) encontraron valores similares de efectos tóxicos sobre el camarón (Mysidopsis bahia) y el tensioactivo NP9EO, con valores de LC50 (48-h) de 0,9-2 y 1,23 mg L-1, mientras que estudios posteriores llevados a cabo por Dorn y col. (1993) mostraron valores muy superiores (LC50= 12-50 mg L-1 NP9EO) para un periodo de exposición de 96-h y el mismo organismo. En el caso de microalgas de agua dulce, los valores de toxicidad encontrados en la bibliografía para el tensioactivo NP9EO suelen oscilar entre 12 y 50 mg L-1 (Lewis, 1986; Dorn y col., 1993). Respecto a la toxicidad en invertebrados en agua dulce, la bibliografía descrita en relación a la toxicidad de estos tensioactivos es muy extensa, encontrándose una gran variabilidad de los valores de toxicidad en función del tensioactivo y especie ensayada. Así, se han descrito valores de EC50 comprendidos entre 19,3 y >100 mg L-1 para el tensioactivo NP12EO (Portmann y Wilson, 1971; van Emden y col., 1974; Waldock y Thain, 1991) y superiores a 10 mg L-1 para NP10EO (Swedmark y col., 1971, 1976) sobre diferentes especies de crustáceos y moluscos. Para el tensioactivo NP9EO, se han observado diferencias significativas en el grado de sensibilidad de los crustáceos Daphnia sp. Mientras que para la especie Daphnia magna los valores de LC50 (48-h) descritos en la bibliografía son de 14 mg L-1 para NP9EO (Kravetz y col., 1991; Naylor, 1995), para la especie Daphnia pulex estos valores resultan ligeramente inferiores, mostrando una LC50 (48-h) de 2,9 mg L-1 (Salanitro y col., 1988). Asimismo, se ha observado una elevada toxicidad de los metabolitos NP1EO y NP2EO con valores de LC50 (24-h) de 0,39 y 0,56 mg L-1, respectivamente (Sun y col., 2005). Por otro lado, un estudio realizado por Isidoro y col. (2006) mostraba valores de EC50 (48-h, movilidad) comprendidos entre 0,07 y 10 mg L-1 sobre el crustáceo Ceriodaphnia dubia. Respecto a la toxicidad de estos tensioactivos sobre peces de agua dulce, se han encontrado efectos tóxicos letales (LC50, 96-h) sobre el pez carpa (Pimephales promelas) a concentraciones comprendidas entre 1,6 y 46 mg L-1 NP9EO (OECD, 1997; Dorn y col., 1993; Talmage, 1994) mientras que para las carpas Carassius auratus y Leuciscus idus los valores de toxicidad descritos (LC50, 48-h) son de 18 y 7 mg L-1 NP9EO, respectivamente (OECD, 1997). IV-7 Capítulo 4 2. Materiales A continuación se detallan las principales características físico-químicas del tensioactivo ensayado así como del medio empleado en los ensayos de biodegradación y toxicidad. Tensioactivo ensayado El tensioactivo no-iónico estudiado consistió en un nonilfenol etoxilado comercialmente conocido como Tergitol®NP9 ó IGEPAL CO-630, CAS 127087-87-0, y fue suministrado por Fluka Chemie A.G. (Barcelona). Concretamente se trata de un poli(oxi-1,2-etanodiol),α-(4-nonilfenil)-ω–hidroxi, con fórmula empírica C33H60O10. El tensioactivo posee una cadena alquílica ramificada de 9 átomos de carbono y está formado por una mezcla de homólogos de diferente longitud de cadena etoxilada, con un grado medio de etoxilación de 9,3. Es soluble en agua, posee un peso molecular de 616 g mol-1 y una pureza del 99,7% de materia activa. Medio de ensayo En la Tabla IV.1 se recogen las principales características físico-químicas y biológicas del agua de mar empleada en los ensayos de biodegradación y toxicidad. Dado que las muestras de agua de mar fueron tomadas en el mismo punto que en el estudio anterior (capítulo 3, apartado 2), los valores obtenidos para los distintos parámetros son muy similares a los obtenidos con el tensioactivo DTMAC. De manera análoga al estudio anterior, podemos concluir que se trata de un agua de excelente calidad correspondiente a una zona costera muy poco antropizada. Tabla IV.1. Características del agua de mar empleada en los ensayos de biodegradación y toxicidad del tensioactivo no-iónico Tergitol®NP9 (valor medio ± desviación estándar, n=3). Parámetro Unidades Valor Parámetro Unidades Oxígeno disuelto % saturación 91,4 ± 1,2 Nitrato mg L-1 NO3- < 0,020 Temperatura ºC 19,5 ± 0,3 Amonio mg L-1 NH4+ < 0,007 Conductividad mS cm-1 35,6 ± 0,2 Fosfato mg L-1 PO43- < 0,015 pH - 8,10 ± 0,04 Silicato mg L-1 Si 0,018 ± 0,002 Salinidad - 36,8 ± 0,4 Dureza total mg L-1 Ca2+ 320 ± 20 Carbono Total mg L-1 C 27,4 ± 0,5 Clorofila a mg m-3 Cl a 0,85 ± 0,10 26,2 ± 0,5 Estreptococos fecales UFC 100mL-1 1,0 ± 1,5 1,17 ± 0,02 Coliformes fecales UFC 100mL-1 No detectado -1 No detectado -1 Carbono inorgánico mg L C Carbono orgánico mg L-1 C Nitrito IV-8 -1 mg L NO2 - < 0,015 Enterococos UFC 100mL Valor Nonilfenoles etoxilados 3. Resultados y discusión 3.1. Ensayos de biodegradación Parámetros de control En la Figura IV.3 se representa la evolución de los parámetros de control pH y oxígeno disuelto en los ensayos de biodegradación (N1, N2 y N3) y en el control (CO2). Como puede observarse en dicha figura los valores de pH sin presencia de substrato (ensayo control) oscilan entre 8 y 8,3 presentando un valor medio de 8,2 ± 0,1 (valor medio ± DE). Para todos los demás ensayos de biodegradación se obtiene un comportamiento similar al ensayo control, con un valor medio de 8,25 ± 0,1. 100 O2 (%saturación) 8,4 pH 8,2 8,0 7,8 CO2 N1 N2 N3 7,6 80 60 40 CO2 N1 N2 N3 20 0 0 10 20 30 Tiempo (d) 40 50 0 10 20 30 40 50 Tiempo (d) Figura IV.3. Evolución del pH y oxígeno disuelto en el ensayo control (CO2) y los ensayos de biodegradación con NPEO (N1, N2 y N3). Respecto a la concentración de oxígeno disuelto, se puede apreciar en la Figura IV.3 como los valores de oxigeno disuelto, tanto en el ensayo control como en los ensayos de biodegradación, fueron prácticamente constantes a lo largo del experimento, mostrando porcentajes medios de saturación del 76,1 ± 2,6 y 77,2 ± 0,5 %, respectivamente En el caso del ensayo de referencia, los valores de pH y oxígeno disuelto se encuentran comprendidos entre 8,1 ± 0,1 y 77,8 ± 9.51 % de saturación, respectivamente. Los valores medios de temperatura en los ensayos de biodegradación, ensayo referencia y control fueron de 18,1 ± 0,1ºC, 18,5 ± 0,9 ºC, y 18,46 ± 0,2°C, respectivamente. IV-9 Capítulo 4 A la vista de estos resultados podemos afirmar que durante el experimento de biodegradación las condiciones de pH, oxígeno y temperatura fueron no limitantes para el desarrollo de la microbiota responsable de la actividad degradativa y, por tanto, de la mineralización del substrato ensayado. Evolución del carbono orgánico disuelto en los ensayos control, referencia y abiótico Concentración (mg COD L-1) En la Figura IV.4 se muestran la evolución del carbono orgánico disuelto (COD) en los ensayos control, referencia (benzoato sódico) y abiótico (HgCl2). REF2 AB2 CO2 20 15 10 5 0 0 10 20 30 40 50 60 Tiempo (d) Figura IV.4. Evolución del carbono orgánico disuelto en los ensayos control (CO2), referencia (REF2) y abiótico (AB2) a lo largo del proceso de biodegradación. Tal y como se muestra en la Figura IV.4 el contenido de carbono orgánico disuelto (mg L-1) en los ensayos control y abiótico permaneció prácticamente constante a lo largo del experimento, con valores medios de COD de 1,6 ± 0,6 mg L-1 y 12,5 ± 0,6 mg L-1, respectivamente. En el caso del ensayo abiótico (con presencia de HgCl2), se alcanzó un porcentaje medio de mineralización del tensioactivo del 1,7 ± 2,7 %, por lo que parece que los procesos abióticos tales como adsorción, precipitación, etc. no contribuyen en la eliminación del tensioactivo. En el caso del ensayo referencia, la Figura IV.4 muestra como la concentración de carbono orgánico disuelto disminuye drásticamente durante los primeros 9 días de ensayo, siendo degradado en una extensión superior al 50% al cabo de 5 días de ensayo; si bien el IV-10 Nonilfenoles etoxilados benzoato sódico fue degradado en un porcentaje superior al 85% al cabo de 9 días. Estos valores están en consonancia con los descritos por diversos autores para el mismo sustrato (Nyholm y Kristensen, 1992; Staples y col., 2001; Perales y col., 2007), lo que viene a indicar la adecuada actividad de la población microbiana presente en el medio de ensayo. Evolución del carbono orgánico disuelto en los ensayos con tensioactivo -1 Concentración (mg COD L ) En la Figura IV.5 se recoge la evolución de la concentración de carbono orgánico disuelto (mg COD L-1) a lo largo del experimento de biodegradación del tensioactivo noiónico Tergitol®NP9. 14 12 10 8 6 4 2 0 0 10 20 30 40 50 Tiempo (d) Figura IV.5. Evolución del carbono orgánico disuelto (mg COD L-1) durante la biodegradación del tensioactivo Tergitol®NP9 para los tres ensayos de biodegradación con tensioactivos. Los datos experimentales se expresan como el valor medio ± DE (n=3). La línea continua corresponde a la curva obtenida del ajuste de los valores experimentales a un modelo cinético de primer orden. La Figura IV.5 muestra una disminución de la concentración de COD a lo largo del experimento, alcanzando valores de 5,2 mg L-1 COD (55% de mineralización) y 2,4 mg L-1 COD (80% de mineralización) al cabo de 29 y 53 días de ensayo, respectivamente. Atendiendo al criterio establecido por la directriz OPPTS 835.3160 “Biodegradabilidad en agua de mar” (USEPA, 1998), estos resultados (porcentaje de biodegradación superior al 70% en un tiempo inferior a 60 días) ponen de manifiesto la existencia de un potencial para la biodegradación del tensioactivo en el medio acuático marino. Cabe destacar la ausencia de una fase de aclimatación o adaptación de la población microbiana a la nueva fuente de sustrato. Ensayos de biodegradación del nonilfenol IV-11 Capítulo 4 etoxilado NP15EO en agua de río prístina también han mostrado una fase de adaptación muy corta o casi inexistente (tiempo de latencia entre 1 y 3 días), sugiriendo como posibles causas la presencia en el medio de una significativa concentración de microorganismos capaces de degradar primariamente (hidrólisis) el tensioactivo (Manzano y col., 1998). Por el contrario, estudios llevados a cabo por Perales y col. (2007) en el que empleaba como medio de ensayo agua de mar de la misma procedencia que la empleada en el presente trabajo, obtuvieron una importante fase de aclimatación (tiempo de latencia entre 6,06 y 7,27 días) para la biodegradación primaria del tensioactivo aniónico lineal alquil benceno sulfonato (LAS). Si comparamos los resultados obtenidos por Perales y col. (2007) con los resultados hallados en el presente trabajo, ambos con la misma matriz, observamos diferencias significativas en la fase de aclimatación del proceso de degradación. Estas diferencias pueden ser atribuidas a las características de las enzimas responsables de la biodegradación del tensioactivo. En el caso del tensioactivo aniónico LAS, el mecanismo inicial de biodegradación consiste en el acortamiento de la cadena alquílica mediante ω- y β-oxidaciones llevadas a cabo por enzimas oxidativas tales como alcano monooxigenasa y dehidrogenasa (Scott y Jones, 2000). Por el contrario, durante la etapa inicial de biodegradación de los NPEOs tiene lugar la ruptura hidrolítica de la cadena etoxilada dando lugar a NPEOs de cadena más corta. Esta ruptura tiene lugar gracias a enzimas hidrolíticas, las cuales podrían ser más frecuentes en el sistema enzimático de la microbiota natural o bien ser sintetizadas más rápidamente que las correspondientes enzimas oxidativas. Modelización cinética Al objeto de conocer la cinética de mineralización del Tergitol®NP9 en agua de mar, los valores experimentales de concentración en el tiempo se ajustaron a diferentes modelos cinéticos. En la Tabla IV.2 se recogen los valores de los parámetros cinéticos y estadísticos calculados para los diferentes modelos cinéticos aplicados. Se puede apreciar, en un primer análisis, que todos los modelos cinéticos presentan un buen ajuste a los datos experimentales (R2 = 0,97). Sin embargo, un análisis más detallado demuestra que sólo en el caso de aplicar un modelo cinético de primer orden se obtienen parámetros cinéticos con un significado físico coherente. Así, por ejemplo, en el caso del modelo logístico se obtiene un valor de B0 (cantidad de sustrato necesaria para producir la concentración inicial de microorganismos) injustificablemente alto en comparación con los obtenidos por otros autores. A modo de ejemplo, Perales y col. (2007), para el tensioactivo LAS y empleando el mismo medio de ensayo que el presente estudio, estimaron valores de B0 comprendidos 0,267 y 0,565 mg LAS L-1. Por otro lado, para el tensioactivo DTMAC el valor de B0 obtenido en el presente estudio ha sido de 0,146 mg COD L-1 (ver capítulo 3, apartado 3). En el caso del modelo cinético de Quiroga, Sales y Romero se puede apreciar que el valor calculado para el parámetro Sto (concentración inicial de tensioactivo) es muy superior a la concentración real empleada en los ensayos. IV-12 Nonilfenoles etoxilados Por otro lado, el análisis de la chi-cuadrada (χ2) muestra que solamente en el caso del modelo de primer orden, los valores del parámetro Q (probabilidad de que la chi-cuadrado exceda al azar un determinado valor χ2 teórico) alcanza el valor más próximo a la unidad (Q = 0,338), indicando que las diferencias aparentes entre los datos experimentales y teóricos se deben probablemente a fluctuaciones casuales y no a una falta de ajuste de los datos experimentales al modelo (véase capítulo 2, apartado 3). A la vista de los resultados obtenidos, podemos concluir que el modelo que mejor describe la cinética de mineralización del tensioactivo Tergitol®NP9 en agua de mar bajo las condiciones estudiadas es el modelo de primer orden, descrito por Simkins y Alexander (1984). Los valores teóricos de concentración de COD en el tiempo obtenidos a partir del modelo cinético de primer orden se representan mediante línea continua en la Figura IV.5. Tabla IV.2. Parámetros cinéticos y estadísticos correspondientes a los resultados de biodegradación del Tergitol®NP9 en agua de mar. Modelo Primer-orden (Simkins y Alexander, 1984) Logístico (Simkins y Alexander, 1984) Q-S-R (Quiroga y col., 1999) a Valor a Parámetro cinético -1 S0 (mg COD L ) 11,91 ± 1,28 K1 (d-1) 0,03 ± 0,006 S0 (mg COD L-1) 11,82 ± 2,12 B0 (mg COD L-1) 131,6 ± 605,1 KLg (mg COD L-1 d-1) 0,0002 ± 0,001 S0 (mg COD L-1) 21,74 ± 92,35 -1 Sto (mg COD L ) 15200 ± 20E+06 Snb (mg COD L-1) 1,23 ± 8,13 μmax (d-1) 0,050 ± 0,147 Parámetros estadísticos R2 χ2 ν Q 0,97 21,07 10 0,338 0,97 179,5 9 6,40E-34 0,97 105,02 8 3,98E-19 Datos presentados como valor medio ± DE (n=3) Una vez seleccionado el modelo cinético que mejor describe la mineralización del tensioactivo en el medio marino, se procede a calcular el tiempo de latencia (tL), t50 (el tiempo necesario para alcanzar un 50% de biodegradación, sin considerar el tiempo de latencia), y el tiempo de vida media (t1/2). Sustituyendo los valores obtenidos anteriormente para el modelo cinético de primer orden en las ecuaciones (1), (2) y (3), obtenidas a partir del modelo de primer orden por Perales y col. (2007), obtenemos un valor medio de tiempo de latencia (tL), t50 y tiempo de vida media (t1/2) de 3,51, 19,59 y 23,10 días, respectivamente. tL = − Ln(0.9) K1 (1) IV-13 Capítulo 4 t 50 = Ln(0.9 / 0.5) K1 t1 / 2 = t 50 + t L (2) (3) La bibliografía encontrada acerca de la biodegradación de los nonilfenoles etoxilados en diferentes medios de ensayos (agua de río, agua estuáricas, lodos activos y sedimento) muestra un amplio intervalo de velocidades de biodegradación. Así, por ejemplo, Staples y col. (2001), estudiando la mineralización del tensioactivo NP9EO en un sistema de lodos activos, mostraron valores de tiempo de vida media comprendidos entre 7 y 13,6 días, empleando una concentración inicial de 10 mg L-1, mientras que en sedimento y agua de río, los tiempos de vida media fueron de 18,2 y 18,6 días, respectivamente. En el caso de agua de río, Manzano y col. (1998) encontraron porcentajes de mineralización comprendidos entre el 30 y 70% al cabo de 30 días para el tensioactivo NP15EO y una concentración inicial de 5 mg L-1. Similares porcentajes de mineralización han sido obtenidos por Potter y col. (1999) en aguas estuáricas al cabo de 183 días de ensayos; si bien el proceso de biodegradación primaria se completó al cabo de 24 días. Por el contrario, estudios llevados a cabo por Jonker y col. (2001) en agua de río mostraron valores de velocidad de degradación primaria más rápida, con porcentajes del 99% al cabo de 4 días de ensayos. Estos valores están en consonancia con los obtenidos por Yoshimura (1986), el cual describió un tiempo de vida media para la degradación primaria de un NPEO de 4 días en agua de río y 10 días en sedimentos. Si comparamos los valores obtenidos en el presente apartado con los valores descritos anteriormente, observamos que difieren significativamente. Estas diferencias pueden ser debidas a la concentración inicial de tensioactivo empleada, al tipo de biodegradación medida (primaria o final) y/o a la estructura química del NPEO (longitud y ramificación de cadena alquílica y número de unidades etoxiladas). No obstante, a pesar de estas diferencias, los valores obtenidos en el presente estudio, son comparables a los obtenidos por Staples y col. (2001) y Manzano y col. (1998) en agua de río. IV-14 Nonilfenoles etoxilados 3.2. Ensayos de toxicidad aguda estándar Ensayos de toxicidad con microalgas marinas En la Figura IV.6 se muestra la evolución temporal de la concentración neta de biomasa (densidad óptica neta, DOn = DOt=t – DOt=0) para diferentes concentraciones de exposición de Tergitol®NP9 (mg L-1). En todas las microalgas ensayadas se observan efectos tóxicos sobre el crecimiento de los cultivos, aunque a diferentes concentraciones de ensayo. En el caso de las microalgas I. galbana y C. gracilis se aprecian efectos inhibitorios a concentraciones superiores a 3 mg L-1 Tergitol®NP9 al cabo de 24 horas de exposición. Por otro lado, para concentraciones iguales o superiores a 4 mg L-1 las microalgas N. gaditana y T. chuii muestran una drástica disminución del crecimiento al cabo de 24 y 48 horas, respectivamente. Asimismo, se puede observar como en algunos casos no sólo ha tenido lugar una inhibición del crecimiento sino un descenso de la concentración inicial de biomasa (mortalidad). En el caso de las microalgas N. gaditana, I. galbana y C. gracilis esta mortalidad tiene lugar a concentraciones superiores a 8 mg L-1 tras 24 horas de exposición. Por el contrario, las microalgas D. salina y T. chuii mostraron efectos letales sólo durante la primera etapa de exposición (24 horas) y a concentraciones superiores a 14 y 20 mg L-1, respectivamente. Transcurrido este periodo, se observa una recuperación de los cultivos, incluso a la concentración más alta de tensioactivo estudiada. IV-15 Capítulo 4 0,8 0,4 10 mg L-1 0,2 I. galbana 0 3 4 6 8 0,5 0,4 DOn (690 nm) DOn (690 nm) 0,6 0,6 N. gaditana 0 2 4 6 8 0,3 10 mg L-1 0,2 0,1 0,0 0,0 -0,1 -0,2 -0,2 0 20 40 60 80 100 0 20 Tiempo (h) 0,6 60 80 100 80 100 C. gracilis 0 1 3 5 7 0,5 DOn (690 nm) 40 Tiempo (h) 0,4 0,3 9 mg L-1 0,2 0,1 0,0 -0,1 -0,2 0 20 40 60 80 100 Tiempo (h) 1,0 0,6 16 mg L-1 0,4 0,2 T. chuii 0 4 20 40 60 0,6 DOn (690 nm) DOn (690 nm) 0,8 0,8 D. salina 0 4 8 10 14 0,4 90 mg L-1 0,2 0,0 0,0 -0,2 -0,2 0 20 40 60 Tiempo (h) 80 100 0 20 40 60 Tiempo (h) Figura IV.6. Evolución de la concentración neta de biomasa (DOn, 690 nm) en el ensayo de toxicidad estándar con microalgas. Las barras de error denotan las desviaciones estándares (n=3). IV-16 Nonilfenoles etoxilados Los valores de las concentraciones de inhibición del crecimiento (IC50), NOEC y LOEC calculadas para cada una de las microalgas ensayadas y un periodo de exposición de 96 horas se reflejan en la Tabla IV.3. Tabla IV.3. Valores de IC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con microalgas marinas y el tensioactivo Tergitol®NP9. Organismo Efecto Concentración (mg L-1) N. gaditana 96-h IC50 5,41 (4,99-5,73)a 96-h NOEC 2,92b 96-h LOEC 3,99b 96-h IC50 4,57 (4,32-4,84)a 96-h NOEC 2,12b 96-h LOEC 2,92b 96-h IC50 3,45 (2,79-4,87)a 96-h NOEC 2,12b 96-h LOEC 2,92b 96-h IC50 13,95 (11,25-15,06)a 96-h NOEC 7,98b 96-h LOEC 10,1b 96-h IC50 25,82 (22,76-29,84)a 96-h NOEC < 4,72b I. galbana C. gracilis D. salina T. chuii 96-h LOEC 4,72b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Tal y como se muestra en la Tabla IV.3, los valores de IC50 se encuentran comprendidos entre 3,45 mg L-1 para el caso de C. gracilis y 13,95 mg L-1 para la microalga T. chuii. Por otro lado, se puede observar como los valores NOEC varían entre 2,12 mg L-1 para I. galbana y C. gracilis y 7,98 mg L-1 para la microalga D. salina. De acuerdo con los valores IC50 obtenidos, podemos establecer el siguiente orden de sensibilidad de las diferentes microalgas al Tergitol®NP9: C. gracilis ≈ I. galbana > N. gaditana > D. salina > T. chuii, siendo esta última la más tolerante. Estos resultados son comparables a los encontrados por otros autores (Moreno y col., 2001) para NP10EO y la microalga marina C. gracilis (IC50= 1 mg L-1); si bien la menor toxicidad puede ser debida a la mayor longitud de cadena etoxilada que presenta el tensioactivo. En relación con especies de agua dulce, se obtienen órdenes de magnitud similares a los obtenidos con otras especies. Así, por ejemplo, para el homólogo de NPEO IV-17 Capítulo 4 de longitud de cadena etoxilada de 9 unidades etoxiladas (NP9EO), los valores de EC50 (96h) oscilan entre 12 y 50 mg L-1 para la microalga Selenastrum capricornutum (Lewis, 1986; Dorn y col., 1993). Ensayos de toxicidad con Artemia franciscana En el presente apartado se muestran los resultados de toxicidad obtenidos para el crustáceo A. franciscana expuesto a crecientes concentraciones de Tergitol®NP9. La Figura IV.7 recoge el porcentaje de supervivientes obtenidos para periodos de exposición de 48 y 72 horas. A. franciscana Supervivientes (%) 100 80 60 40 20 48h 72h 0 0 20 40 60 80 100 Concentración (mg L-1) Figura IV.7. Efecto del Tergitol®NP9 sobre A. franciscana a las 48 y 72 horas de exposición. Los datos se representan como valor medio ± DE (n=5). Se puede observar un aumento del efecto tóxico a medida que aumenta la concentración de tensioactivo, alcanzando valores máximos de efecto del 78 y 92% al cabo de 48 y 72 horas, respectivamente. Por otro lado, se aprecia una disminución del porcentaje de supervivientes al aumentar el periodo de exposición, como consecuencia de un aumento del efecto tóxico del tensioactivo. A concentraciones inferiores a 15 mg L-1 no se observan efectos tóxicos significativos para ambos periodos de exposición. Los valores de los parámetros de toxicidad LC50, NOEC y LOEC calculados para un periodo de exposición de 48 y 72 horas se recogen en la Tabla IV.4. IV-18 Nonilfenoles etoxilados Tabla IV.4. Valores de LC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con crustáceos y el tensioactivo Tergitol®NP9. Organismo Efecto tóxico Concentración (mg L-1) A. franciscana 48-h LC50 41,2 (34,43-47,99)a 72-h LC50 30,34 (26,06-33,84)a 48-h NOEC 15,18b 48-h LOEC 30,36b 72-h NOEC 15,18b 72-h LOEC 30,36b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Si se comparan los resultados obtenidos en la Tabla IV.4 con los recogidos en la bibliografía (véase capítulo de introducción) para los NPEOs con otras especies de invertebrados, nos encontramos con una amplia variabilidad de efectos adversos dependiendo del tensioactivo y organismo en cuestión. Para el caso del tensioactivo NP9EO, los valores obtenidos en el presente estudio resultan muy superiores a los descritos para el camarón marino Mysidopsis bahia (LC50, 48-h= 0,9-2 mg L-1), mientras que para el crustáceo D. magna estas diferencias no son tan acusadas (LC50 = 14 mg L-1). Otros parámetros importantes a considerar a la hora de estudiar la toxicidad son los valores de la mínima concentración que provoca un efecto observable (LOEC) y la máxima concentración que no presenta efecto observable (NOEC). Si comparamos las concentraciones de NPEOs en el medio acuático natural (excluyendo las aguas residuales) descritas en la bibliografía (véase capítulo de introducción), en todos los casos inferiores a 80 µg NPEO L-1, con los valores del parámetro NOEC obtenidos, tanto para las microalgas como invertebrados marinos (Tabla IV.3), estos últimos resultan ser 3 ó 4 órdenes de magnitud mayores (dependiendo de la especie) que las concentraciones ambientales. Estos resultados parecen indicar, en un principio, que el tensioactivo estudiado NP9EO no supone un riesgo ambiental para el medio acuático marino. No obstante, cabe indicar que existe una diferencia importante entre la naturaleza del tensioactivo utilizado en los ensayos de toxicidad (Tergitol®NP9) y los NPEOs hallados en aguas naturales. En el caso de éstos últimos estamos hablando de homólogos de cadena alquílica corta, y por lo tanto más tóxicos (Yoshimura, 1986; Hall y col., 1989) que los NP9EO. Por todo esto, hay que considerar que a la hora de evaluar el riesgo ambiental de un compuesto no sólo hay que referirse al sustrato original sino también a los subproductos de la transformación del mismo en el compartimento estudiado, pues de lo contrario se corre el peligro de subestimar su riesgo ambiental. IV-19 Capítulo 4 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación En el presente apartado se lleva a cabo el estudio de la evolución del medio de ensayo durante la biodegradación del tensioactivo no-iónico Tergitol®NP9 sobre diversas especies de microalgas marinas y un crustáceo marino. En la Figura IV.8 se representa la evolución temporal de la toxicidad del medio de ensayo (% de inhibición del crecimiento/mortalidad) y grado de mineralización (%) durante el ensayo de biodegradación del tensioactivo no-iónico Tergitol®NP9. Se puede observar como en el caso de las microalgas N. gaditana, I. galbana y C. gracilis el porcentaje inicial de efecto (0% de biodegradación del tensioactivo) es del 100%, permaneciendo constante durante los primeros 34 días de ensayos, momento en el que el tensioactivo se ha mineralizado un 64%. Esto puede ser debido a la elevada sensibilidad de estas tres microalgas al tensioactivo junto a la elevada concentración inicial empleada en los ensayos de biodegradación. Como consecuencia de ello, no podemos determinar si durante la biodegradación del tensioactivo Tergitol®NP9 tiene lugar la formación de metabolitos más o menos tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original para estas tres especies de microalgas. Estaríamos pues ante un caso tipo D (véase capítulo 3, apartado 3.3). En el caso de las microalgas D. salina y T. chuii observamos un porcentaje inicial de efecto (0% biodegradación) inferior al 80%. Asimismo, se aprecia un incremento de la toxicidad del medio durante la fase inicial de biodegradación, alcanzando valores máximos (100% inhibición del crecimiento) al cabo de 6 días de ensayo, momento en el cual el tensioactivo Tergitol®NP9 alcanza un porcentaje de biodegradación del 16%, aproximadamente. Al cabo de 34 días de ensayo (64% biodegradación), y tal como se observa para el resto de las microalgas se produce una disminución de la toxicidad del medio como consecuencia del proceso de mineralización. En el caso del crustáceo A. franciscana, se puede observar un comportamiento análogo, esto es, un aumento inicial de la toxicidad del medio al biodegradarse el tensioactivo. En la Figura IV.8 vemos como el porcentaje inicial de efecto tóxico (10% mortalidad) es relativamente bajo, en comparación con el observado para las microalgas (80-100% inhibición del crecimiento), pero a continuación la toxicidad del medio aumenta drásticamente, alcanzando valores máximos de efecto (100%) al cabo de 11 días de ensayos (alrededor del 40% de mineralización). Una vez alcanzado este máximo efecto adverso del medio de ensayo (entre el día 15 y 23 de ensayo), la toxicidad disminuye paulatinamente a medida que avanza el proceso de mineralización. IV-20 Nonilfenoles etoxilados IC, 96-h (%) Biodegradación (%) 40 20 20 0 0 0 20 40 60 80 80 60 60 40 40 20 0 0 100 20 80 60 60 40 40 20 20 IC, 96-h (%) Biodegradación (%) 20 40 60 Biodegradación (%) Inh. crecimiento, 96-h (%) 80 0 60 60 40 40 20 20 IC, 96-h (%) Biodegradación (%) 0 20 40 40 20 20 IC, 96-h (%) Biodegradación (%) Figura IV.8. 80 0 100 Mortalidad, 72-h (%) 60 Biodegradación (%) Inh. crecimiento, 96-h (%) 60 60 60 80 100 A. franciscana 100 100 80 40 40 0 Tiempo (días) 80 Tiempo (días) 100 80 0 0 T. chuii 20 100 80 80 100 0 80 D. salina Tiempo (días) 0 60 100 100 Inh. crecimiento, 96-h (%) C. gracilis 0 40 0 Tiempo (días) Tiempo (días) 100 20 IC, 96-h (%) Biodegradación (%) Biodegradación (%) 40 60 80 100 80 80 60 60 40 40 20 20 LC, 72-h (%) Biodegradación (%) 0 0 20 40 60 Biodegradación (%) 60 100 Biodegradación (%) 80 Biodegradación (%) Inh. crecimiento, 96-h (%) 80 I. galbana 100 100 Inh. crecimiento, 96-h (%) N. gaditana 100 0 80 100 Tiempo (días) Evolución del efecto tóxico del medio de ensayo (%) y porcentaje de mineralización (%) durante el experimento de biodegradación de Tergitol®NP9. Los resultados obtenidos para las microalgas D. salina y T. chuii y el crustáceo A. franciscana parecen confirmar que durante la mineralización del tensioactivo no-iónico Tergitol®NP9 en agua de mar tiene lugar un aumento de la toxicidad del medio como IV-21 Capítulo 4 consecuencia de la formación de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original y por tanto, el tensioactivo no presenta una biodegradación ambientalmente aceptable. Si tenemos en cuenta la ruta de biodegradación aerobia de los NPEOs podemos apreciar que este aumento de la toxicidad probablemente sea debido a la presencia de biointermediatos hidrófobos, tales como NP1EO, NP2EO y NP3EO, e, hidrófilos, principalmente NP1EC y NP2EC, los cuales han sido identificados como más tóxicos que los NPEOs (Yoshimura, 1986; Hall y col., 1989; Kravetz y col., 1991; Jobling y Sumpter, 1993; White y col., 1994; Maguire, 1999). Los resultados obtenidos en el presente apartado están en consonancia con los descritos por otros autores (Naylor y col., 1992; Jobling y Sumpter, 1993; Ahel y col., 1994a; White y col., 1994; Ahel y col., 1996), quienes muestran que durante el proceso de degradación de los alquilfenoles etoxilados tiene lugar la formación de biointermediatos, muchos de los cuales resultan ser más tóxicos y persistentes que el compuesto original. IV-22 Nonilfenoles etoxilados 4. Conclusiones Las principales conclusiones obtenidas en el presente capítulo son las siguientes: • El tensioactivo no-iónico Tergitol®NP9 presenta una elevada biodegrabilidad en el medio acuático marino bajo las condiciones ensayadas, alcanzando porcentajes de mineralización superiores al 80% al cabo de 53 días de ensayo, lo que indica la existencia de un potencial para la biodegradación de estos tensioactivos en el medio acuático marino. • La biodegradación final o mineralización del tensioactivo no-iónico en agua de mar bajo las condiciones ensayadas sigue una cinética de primer orden, caracterizada por la ausencia de una fase inicial de aclimatación de los microorganismos responsables de la degradación del Tergitol®NP9. • La toxicidad del tensioactivo Tergitol®NP9 experimenta una gran variabilidad dependiendo del organismo ensayado. Así, de las diferentes especies de microalgas estudiadas, las microalgas marinas I. galbana y C. gracilis se muestran como las más sensibles. Respecto al crustáceo marino A. franciscana, a pesar de que los efectos estudiados han sido diferentes a los de las microalgas, se obtienen valores de toxicidad superiores, lo que parece indicar una mayor resistencia del crustáceo al tensioactivo estudiado. • Los resultados obtenidos en los ensayos de toxicidad aguda con microalgas y crustáceos marinos junto con los datos disponibles de niveles ambientales de esta familia de tensioactivos parecen indicar que las concentraciones de NP9EO presentes en el medio acuático marino, como tal, no suponen un riesgo ambiental. No obstante, dada la elevada toxicidad que presentan los intermediatos generados durante su degradación (principalmente NPE1EO, NPE2EO, NPE1EC y NPE2EC), sería preciso disponer de los valores de concentración de no efecto (NOEC) de estos metabolitos y no del compuesto original para evaluar el riesgo ambiental del NP9EO en su conjunto, esto es incluyendo sus subproductos. • El estudio de la evolución de la toxicidad del medio de ensayo indica que durante el proceso de biodegradación del Tergitol®NP9 tiene lugar un aumento de la toxicidad del medio como consecuencia de la formación de intermediatos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original. Estos resultados permiten clasificar al tensioactivo Tergitol®NP9 como un compuesto de biodegradabilidad ambientalmente no aceptable. IV-23 Capítulo 4 Referencias Ahel, M., Conrad, T., Giger, W., 1987. Persistent organic chemicals in sewage effluents. Environ Sci Technol 21, 697-703. Ahel, M., Giger, W., 1985. Determination of Alkylphenols-ethoxylate surfactants in mechanical-biological sewage treatment. Water Sci. Technol. 19, 449-360. Ahel, M., Giger, W., Koch, M., 1994a. Behavior of alkylphenol polyethoxylate surfactants in the aquatic environment. I. Occurrence and transformation in seawage treatment. Water Res 28, 1131-1142. Ahel, M., Giger, W., Schaffner, C., 1994b. Behaviour of alkylphenol polyethoxylate surfactants in the aquatic environment. II. Occurrence and transformation in rivers. Water Res. 28, 1143-1152. Ahel, M., Schaffner, C., Giger, W., 1996. Behavior of alkylphenol polyethoxylate surfactants in the aquatic environment. III. Occurrence and elimination of their persistent metabolites during infiltration of river water to groundwater. Water Res 30, 37-46. Ball, H.A., Reinhard, M., McCarthy, P.L., 1989. Biotransformation of halogenated and nonhalogenated octylphenol polyethoxylate residues under aerobic and anaerobic conditions. Environ Sci Technol 23, 951-961. Brown, D., 1988. Alkylphenol ethoxylates: an environmental impact assessment. 2nd World Surfactant Congress, 352-360. BUA, 1991. Nonylphenol. VCH, Weinheim, Germany. Calamari, D. and R. Marchetti. 1973. The toxicity of metals and surfactants to rainbow trout (Salmo gairdneri Rich.). Water Res. 7, 1453–1464. CE, 1993. Council Regulation 793/93/EEC of March 1993 on the evaluation and control of risks of existing substances. Official Journal of the European. Dorn, P.B., Salanitro, J.P., Evans, S.H., Kravetz, L., 1993. Assessing the aquatic hazard of some branched and linear non-ionic surfactants by biodegradation and toxicity. Toxicol Chem 12, 1751-1762. Dwyer, D.F., Tiedje, J.M., 1986. Metabolism of polyethylene glycol by two anaerobic bacteria, Desulfovibrio desulfuricans and a Bacteroides sp. App.Environ.Microbiol. 52, 852-856. Ekelund, R., Bergman, A., Granmo, A., Berggren, M., 1990. Bioaccumulation of 4-nonylphenols in marine animals. Environ.Pollut. 79, 107-120. Ferreira, C.S., Nunes, B.A., Henriques-Almeida, J.M., Guilhermino, L., 2007. Acute toxicity of oxytetracycline and florfenicol to the microalgae Tetraselmis chuii and to the crustacean Artemia parthenogenetica. Ecotoxicol Environ Saf 67, 452-458. Field, J.A., Reed, R.L., 1996. Nonylphenol polyethoxy carboxylate metabolites of non-ionic surfactants in U.S. paper mill effluents, municipal sewage treatment plant effluents and river waters. Environ Sci Technol 30, 3544-3550. IV-24 Nonilfenoles etoxilados Giger, W., Brunner, P.H., Schaffner, C., 1984. 4-Nonylphenol in sewage sludge: accumulation of toxic metabolites from nonionic surfactants. Science 225, 623-625. Giger, W., Stephanou, E., Schaffner, C., 1981. Persistent organic chemicals in sewage effluents. I. Identifications of nonylphenols and nonylphenol ethoxylates by glass capillary gas chromatography/mass spectrometry. Chemosphere 10, 1253-1263. Granmo, A., Ekelund, R., Magnusson, K., Bergrenn, M., 1989. Lethal and sublethal toxicity of 4-nonylphenol to the common mussel. Environmental pollution 59, 229-239. Guerra, R., 2001. Ecotoxilological and chemical evaluation of phenolic compounds in industrial effluents. Chemosphere 44, 1737-1747. Hall, W.S., Patoczka, J.B., Mirenda, R.J., Porter, B.A., Miller, E., 1989. Acute toxicity of industrial surfactants to Mysidopsis bahia. Arch Environ Contam Toxicol 18, 765-772. Isidori, M., Lavorgna, M., Nardelli, A., Parrella, A., 2006. Toxicity on crustaceans and endocrine disrupting activity on Saccharomyces cerevisiae of eight alkylphenols. Chemosphere 64, 135-143. Jobling, S., Sumpter, J.P., 1993. Detergent components in sewage effluent are weakly estrogenic to fish: An in vitro study using rainbow trout (Oncorhynchus mykiss) hepatocytes. Aquatic Toxicology 27, 361-372. Jonkers, N., Knepper, T.P., de Voogt, P., 2001. Aerobic biodegradation studies of nonylphenol ethoxylates in river water using liquid chromatography-electrospray tandem mass spectrometry. Environ Sci Technol 35, 335-340. Kravetz, L., 1990. Biodegradation pathways of non-ionic ethoxylates. Influence of the hydrophobe structure. ACS Symp. Ser. 433, 96-109. Kravetz, L., Salanitro, J.P., Dorn, P.B., Guin, K.F., 1991. Influence of hydrophobe type and extent of branching on environmental response factors on nonionic surfactants. J Am Oil Chem Soc 68, 610-618. Kvestak, R., Terzic, S., Ahel, M., 1994. Input and distribution of alkylphenol polyethoxylates in a stratified estuary. Marine Chem. 46, 89-100. Lechuga, M.M., 2005. Biodegradación y toxicidad de tensioactivos comerciales. Tesis Doctoral. Dpto. de Ingeniería Química. Universidad de Granada, Granada. Lewis, M.A., 1986. Comparion of the effects of surfactants on freshwater phytoplankton communities in experimental enclosures and on algal growth in the laboratory. Environmental Toxicology and Chemistry 5, 319-322. Little, A.D., 1977. Human safety and environmental aspect of major surfactants. En: Service, N.T.I. (Ed.). Documento PB 301 193/9ST, Springfield, Virginia. Maguire, R.J., 1999. Review of the persistence of nonylphenol and nonylphenol ethoxylates in aquatic environments. Water Qual Res J Canada 34, 37-78. Maki, H., Masuda, N., Fujiwara, Y., Ike, M., Fujita, M., 1994. Degradation of alkylphenol ethoxylates by Pseudomonas sp. strain TR01. Appl Environ Microbiol 60, 2265-2271. IV-25 Capítulo 4 Mann, R.M., Boddy, M.R., 2000. Biodegradation of a nonylphenol ethoxylate by the autochthonous microflora in lake water with observations on the influence of light. Chemosphere 41, 1361-1369. Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1998. Effect of concentration on the biodegradation of a nonylphenol polyethoxylate in river water. Bull Environ Contam Toxicol 61, 489-496. Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1999. The effect of temperature on the biodegradation of a nonylphenol polyethoxylate in river water. Water Res 33, 2593-2600. Marchetti, R. 1965. The toxicity of Nonylphenol ethoxylate to the developmental stages of the rainbow trout, Salmo gairdneri Richardson. Ann. Appl. Biol. 55, 425–430. Marcomini, A., Pavoni, B., Sfriso, A., Orio, A., 1990. Persistent metabolites of alkylphenol polyethoxylates in the marine environment. Marine Chem. 29, 307-323. Marcomini, A., Lojana, G., Sfriso, A., Quiroga, J. M., 1990. Behavior of anionic and nonionic surfactants and their persistent metabolites in the Venice lagoon, Italy. Environmental Toxicology and Chemistry 19(8), 2000-2007. McLeese, D.W., Zitko, V., Sergeant, D.B., Burridge, L., Metcalfe, C.D., 1981. Lethality and accumulation of alkylphenols in aquatic fauna. Chemosphere 10, 723-730. Moreno-Garrido, I., Hampel, M., Lubian, L. M., Blasco, J., 2001. Marine microalgae toxicity test for linear alkylbenzene sulfonate (LAS) and alkylphenol ethoxylate (APEO). Fresenius J. Anal. Chem. 371(4), 474-478. Naylor, C.G., 1995. Environmental fate and safety of nonylphenol ethoxylates. American Association of Textile Chemists and Colourists 27, 29-33. Naylor, C.G., Mieure, J.P., Adams, J.A., Weeks, J.A., Ctaldi, F.J., Ogle, L.E., Romano, R.R., 1992. Alkylphenol ethoxylates in the environment. J Am Oil Chem Soc 59, 695-703. Nyholm, N., Kristensen, P., 1992. Screening methods for assessment of biodegradability of chemicals in seawater results from a ring test. Ecotoxicol Environ Saf 23, 161-172. OECD, 1987. Decision-Recommendation of the Council on the Systematic Investigation of Existing Chemicals. En: Publications, O. (Ed.). C(87)90. OECD, Paris. OECD (1997). SIDS initial assessment report for 6th SIAM. Prepared by M. Thomas, Environmental Agency, National Centre for Ecotoxicology and Hazardous Substances, Londres. Okamura, H., Aoyama, I., Liu, D., Maguire, R.J., Pacepavicius, G.L., Lau, Y.L., 2000. Fate and ecotoxicity of the new antifouling compound Irgarol 1051 in the aquatic environment. Water Res 34, 3523-3530. Osburn, Q.H., Benedict, J.H., 1966. Polyethoxylates alkylphenol: relationship of structure biodegradation mechanism. J Am Oil Chem Soc 43, 141-146. OSPAR, 2001. Strategy with regard to hazardous substances. En: Commision, O. (Ed.). OSPAR, London. PARCOM, 2002. Recommendation 92/8 on Nonylphenol-ethoxylates.En: Comission, O. (Ed.). OSPAR, London. IV-26 Nonilfenoles etoxilados Patoczka, J., Pulliam, G.W., 1990. Biodegradation and secondary effluent toxicity of ethoxylated surfactants. Water Res 24, 965-972. Perales, J.A., Manzano, M.A., Garrido, M.C., Sales, D., Quiroga, J.M., 2007. Biodegradation kinetics of linear alkylbenzene sulphonates in sea water. Biodegradation 18, 63-70. Potter, T.L., Simmons, K., Wu, J., Kostecki, P., Calabrese, E., 1999. Static die-away of a nonylphenol ethoxylate surfactant in estuarine water samples. Environ Sci Technol 33, 113-118. Quiroga, J.M., Perales, J.A., Romero, L.I., Sales, D., 1999. Biodegradation kinetics of surfactants in seawater. Chemosphere 39, 1957-1969. Routledge, E.J., Sumpter, J.P., 1996. Estrogenic activity of surfactants and some of their degradation products assessed using a recobinant yeast screen. Environ Sci Technol 15, 241-248. Rudling, L., Solyom, P., 1974. The investigation of biodegradability of branched nonylphenol ethoxylates. Water Res 8, 115-119. Salanitro, J.P., Langston, G.C., Dorn, P.B., Kravetz, L., 1988. Activated sludge treatment of ethoxylate surfactants at high industrial use concentrations. Presented at the International Conference on Water and Wastewater Microbiology, Newport Beach, Calif., February 8-11. Scott, M.J., Jones, M.N., 2000. The biodegradation of surfactants in the environment. Biochim Biophys Acta 1508, 235-251. Schobert, P., Kunkel, E., Espeter, K., 1981. Comparative investigations on the microbial metabolism of a nonylphenol and an oxoalcohol ethoxylate. Tenside Surf. Det. 18, 64-72. Sheldon, L.S., Hites, R.A., 1978. Organic compounds in the Delaware River. Environ. Sci. Technol. 12, 11881194. Simkins, S., Alexander, M., 1984. Models for mineralization kinetics with the variables of substrate concentration and population density. Appl Environ Microbiol 47, 1299-1306. Sivak, A., Goyer, M., Perwak, J., 1982. Environmental and human aspects of commerciallly important surfactants. Solution behaviour of surfactants. Ed. Plenum Publishing Corp 1, 161-188. Staples, C.A., Naylor, C.G., Williams, J.B., Gledhill, W.E., 2001. Ultimate biodegradation of alkylphenol ethoxylate surfactants and their biodegradation intermediates. Environ Toxicol Chem 20, 2450-2455. Staples, C.A., Williams, J.B., Blessing, R.L., Varineau, P.T., 1999. Measuring the biodegradability of nonylphenol ether carboxylates, octylphenol ether carboxylates and nonylphenol. Chemosphere 38, 2029-2039. Sun, H., Gu, X., 2005. Comprehensive toxicity study of nonylphenol and short-chain nonylphenol polyethoxylates on Daphnia magna. Bull. Environ. Contam. Toxicol. 75(4), 677-83. Swedmark, M., Braaten, B., Emanuelsson, E., Granmo., Å., 1971. Biological effects of surface active agents on marine animals. Mar. Biol. 9, 183–201. Swedmark, M., Granmo, Å., Kollberg. S., 1976. Toxicity testing at Kristinberg Marine Biology Station. En: Pollutants in the aquatic environment. Food and Agriculture Organization of the United Nations, Rome (FAO/SIDA/TF 108, Supplement 1). IV-27 Capítulo 4 Swisher, R.D., 1987. The analytical methods in surfactants biodegradation. Surfactant biodegradation, 2nd Edition, 47, M. Dekker, New York. Talmage, S.S., 1994. Environmental and human safety of major surfactants: alcohol ethoxylates and alkylphenol ethoxylates. A Report to the Soap and Detergent Association. Boca Raton, FL: Lewis Publishers. UE, 2001. Decisión Nº 2455/2001/CE del parlamento europeo y del consejo de 20 de noviembre de 2001, que establece la lista de sustancias prioritarias de la política de aguas y la directiva 2000/60/CE. Official J. L 249, 27-30. Ukeles, R., 1965. Inhibition of unicellular algae by synthetic surface-active agents. J. Phycol. 1, 102–110. USEPA, 1998. Fate, transport and transformation test guidelines. OPPTS. "Biodegradability in Sea Water" 835.3160. EPA 712–C–98–351 The Federal Bulletin Board. U.S. Government Printing Office Washington, DC. White, R., Jobling, S., Hoare, S.A., Sumpter, J.P., Parker, M.G., 1994. Environmentally persistent alkylphenolic compounds are estrogenic. Endocrinology 135, 175-182. WRc, 1991. Foaming in Rivers, Water Research Centre. Xie, L., Thrippleton, K., Irwin, M.A., Siemering, G.S., Mekebri, A., Crane, D., Berry, K., Schlenk, D., 2005. Evaluation of estrogenic activities of aquatic herbicides and surfactants using an rainbow trout vitellogenin assay. Toxicol Sci 87, 391-398. Yoshimura, K., 1986. Biodegradation and fish toxicity of non-ionic surfactants. J. Am. Oil. Chem. Soc. 63, 15901596. IV-28 Capítulo 5 ALQUIL ETOXISULFATOS Resumen En los últimos años, el consumo de los tensioactivos aniónicos alquil etoxisulfatos (AES) se ha visto fuertemente incrementado debido a sus propiedades, las cuales los hacen ideales en múltiples aplicaciones. En el presente capítulo se exponen los resultados obtenidos en los experimentos de biodegradación y ecotoxicidad del alquil etoxisulfato Empicol®ESB 70/SP en agua de mar natural procedente de la zona costera de Sancti Petri (Cádiz). Los valores obtenidos indican la existencia de un potencial para la degradación del tensioactivo Empicol®ESB 70/SP en el medio marino, aunque a baja velocidad de biodegradación. Durante la mineralización del tensioactivo se distinguen dos etapas, las cuales siguen una cinética de primer orden y logístico, respectivamente. En relación a la toxicidad del tensioactivo aniónico, los resultados obtenidos señalan a la microalga D. salina como la más sensible, mientras que el tensioactivo experimenta menores efectos adversos sobre el crustáceo marino A. franciscana. Los resultados obtenidos en los ensayos combinados de toxicidad y biodegradación no indican la presencia de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original, por lo que parece que el tensioactivo presenta una biodegradabilidad ambientalmente aceptable. Capítulo 5 1. Introducción Alquil etoxisulfatos. Características y usos Los alquil etoxisulfatos (AES), también conocidos como alcoholes éter sulfato ó alcoholes etoxilados sulfato, son tensioactivos aniónicos utilizados en muy diversos sectores industriales y domésticos. Aunque históricamente los lineal alquilbenceno sulfonatos (LAS) han sido los tensioactivo sintéticos aniónicos por excelencia, en cuanto a su producción y uso así como probablemente el agente de superficie cuyo comportamiento ambiental (ecotoxicidad y biodegradabilidad) ha sido más estudiado (Perales, 2001), la importancia y el consumo de los AES se ha visto incrementado en los últimos años. Así, por ejemplo, para el año 2003 el consumo de AES estimado en América del Norte fue de 491.238 toneladas, mientras que en el caso del LAS se estimó un consumo de 317.513 toneladas para ese mismo año (Modler y col., 2004). Por otro lado, se ha estimado un consumo anual de AES en Europa de 276.000 toneladas, de las cuales 108.000 toneladas son empleadas en detergentes domésticos y productos de limpieza (HERA, 2002). Los AES son obtenidos mediante reacciones de sulfatación de alcoholes etoxilados de longitud de cadena alquílica y número de unidades etoxiladas variable, utilizando para ello trióxido de azufre ó ácido clorosulfónico seguida de una inmediata neutralización con una base, produciéndose generalmente sal de sodio y menos comúnmente sal de amonio. La mayoría de los AES comerciales están constituidos por complejas mezclas de homólogos (Feijtel y van de Plassche, 1995) con un número de átomos de carbono en la cadena alquílica comprendido entre 12 y 18 y de 1 a 5 unidades etoxiladas (Fendinger y col., 1994) y suelen constituir disoluciones acuosas con una pureza aproximada del 25-30% ó 68-70% de materia activa. Los AES de sodio se caracterizan por contener, generalmente, aproximadamente un 2-4% de alcohol etoxilado desulfatado, 1-2% alcohol sin reaccionar y 1-45% de alcohol sulfato y opcionalmente cantidades traza de compuestos inorgánicos tampones de pH, dependiendo del contenido de materia activa y del grado de etoxilación. La Figura V.1 recoge la estructura química de los alquil etoxisulfatos. R O O O n S O- O Figura V.1. Estructura molecular del tensioactivo aniónico aquil etoxisulfato (R= CxH2x+1, x= 12-18; n = 1-5). V-2 Alquil etoxisulfatos Niveles de alquil etoxisulfatos en el medio acuático Hasta el momento, pocos son los autores que han enfocado sus esfuerzos en la determinación de las concentraciones de AES en el medio acuático, y ninguno en el medio marino. Tan sólo se han encontrado datos referentes a las concentraciones de estos compuestos en efluentes de estaciones depuradoras de aguas residuales urbanas y ríos. Así, por ejemplo, Matthijs y col. (1999) describieron concentraciones medias de 6,5 µg L-1 de alquil etoxisulfatos de cadena alquílica comprendida entre 12 y 15 átomos (C12-15AES) en efluentes de diversas estaciones depuradoras de aguas residuales (EDAR) de los Países Bajos. Por otro lado, en un estudio reciente llevado cabo en Estados Unidos por Sanderson y col., (2006) se hallaron concentraciones totales de alcohol sulfato (AS) y alquil etoxisulfatos (AES) de 10 y 172 ng L-1, correspondientes a aguas arriba y abajo de un punto de vertido a un río, respectivamente, mientras que en el influente y efluente de la EDAR se determinaron concentraciones de 162,3-200,2 mg L-1 y 0,24-2,85 mg L-1, respectivamente. Biodegradabilidad de los alquil etoxisulfatos (AES) Steber y Berger (1995) establecieron tres posibles rutas/mecanismos de biodegradación de los alquil etoxisulfatos en condiciones aerobias, las cuales parecen tener lugar simultáneamente. En la Figura V.2 se representan los posibles mecanismos aerobios de biodegradación de los alquil etoxisulfatos (Steber y Berger, 1995). La primera de estas posible rutas de biodegradación consiste en una ω-oxidación de la cadena alquílica del AES seguida de β-oxidaciones que provocan un sucesivo acortamiento de la cadena alquílica, dando lugar a AES carboxilados (mecanismo a). Un segundo mecanismo de biodegradación consiste en la ruptura enzimática del grupo sulfato (desulfatación) dando lugar a la formación de un alcohol graso etoxilado (mecanismo b). Posteriormente, el alcohol etoxilado generado es degradado mediante la ruptura del enlace central ó bien mediante ω- y β-oxidación de cualquiera de los extremos de la molécula (véase capítulo 6, apartado 1). Otro posible mecanismo de biodegradación consiste en la hidrólisis del enlace central éter (enlace entre la cadena alquílica y etoxilada) dando lugar a un alcohol y un polietilenetilenglicol sulfato (mecanismo c). El alcohol generado es oxidado danto lugar a un ácido graso, mientras que el polietilenglicol sulfato es transformado a etilenglicol mediante desulfatación y sucesivas hidrólisis. Finalmente, un cuarto posible mecanismo consiste la hidrólisis de un enlace éter no central dando lugar a la formación de un alcohol etoxilado y etilenglicol sulfato (mecanismo d). Posteriormente, el alcohol etoxilado es degradado bien mediante la V-3 Capítulo 5 hidrólisis del enlace central éter ó bien ω- y β-oxidación de cualquiera de los extremos de la molécula (véase capítulo 6, apartado 1), mientras que el polietilenglicol es eliminado mediante desulfatación y sucesivas hidrólisis dando lugar a etilenglicol. Alquil etoxisulfato (AES) O R1 O ω-oxidación (mecanismo a) O S O- O n Desulfatación (mecanismo b) O O HO R2 O O O O S O- R1 O n Alcohol etoxilado (capítulo 6, apartado 1) Alquil etoxisulfato carboxilado β-oxidación Hidrólisis no central (mecanismo d) O HO R3 O O O OH O O n O S O- O O n R1 Alquil etoxisulfato carboxilado O OH + HO O S O- O O n-1 Hidrólisis central (mecanismo c) Alcohol etoxilado (capítulo 6, apartado 1) Polietilénglicol sulfato Desulfatación Hidrólisis O R 1 OH Alcohol + HO O O S O- Polietilenglicol sulfato OH O Ácido graso HO HO O OH Etilénglicol Desulfatación Hidrólisis Oxidación R1 O n O OH Etilénglicol Figura V.2. Rutas de biodegradación aerobia propuesta para los tensioactivos aniónicos AES (R1=CxH2x+1, R2= Cx-1H2x, R3= Cx-2H2x-1, x= 12-18; n=1-5) (Steber y Berger, 1995). V-4 Alquil etoxisulfatos En general, los AES son considerados fácilmente biodegradables en condiciones aerobias, independientemente de la longitud de cadena etoxilada (Painter, 1992; BKH, 1994; Madsen y col., 2001), alcanzando velocidades de degradación primaria y final similares a la de los alcoholes sulfatos (AS) (Scott y Jones, 2000). Así, por ejemplo, Fischer (1982), empleando el método de frasco cerrado, obtuvo porcentajes de biodegradación primaria del 96% al cabo de 30 días de ensayo para diferentes AES. Asimismo, Painter (1992) encontró porcentajes de biodegradación primaria para el tensioactivo alquil etoxisulfato de cadena alquílica entre 12 y 14 átomos de carbono y 3 unidades etoxiladas (C12-14 AE3S) comprendidos entre el 90 y 100% al cabo de 1-5 días de ensayo. Por otro lado, estudios realizados por Schröder (1995) en agua de río describieron un tiempo de vida media de aproximadamente 1 hora para diferentes AES. La biodegradación final o mineralización de los AES también ha sido estudiada por diversos autores (Swisher, 1987; Holt y col., 1992); si bien la mayoría de estos estudios han sido realizados en aguas continentales De manera general, los AES se caracterizan por presentar una elevada biodegradabilidad final. Así, por ejemplo, estudios llevados a cabo sobre diversos AES mostraron la completa degradación de los metabolitos generados durante el proceso degradativo, tales como los etilenglicoles sulfatos, conduciendo a la formación de sulfato inorgánicos y dióxido de carbono (Griffith y col., 1986; White y Russell, 1988). Por otro lado, en ensayos de simulación de lodos activos con C12-14AE2S y C12-15oxo-AE3S se han observado porcentajes de eliminación de COD del 58-100% y 96100%, respectivamente, al cabo de 28 días de ensayo (Schöberl y col., 1988). Asimismo, Steber y Berger (1995) encontraron una completa mineralización (100% de eliminación de la demanda teórica de oxígeno) del tensioactivo C12-18AE8,5S en ensayos de biodegradación de frasco cerrado. La biodegradación de AES bajo condiciones anaerobias también ha sido objeto de estudio de diversos autores, observándose altos porcentajes de biodegradación (Itoh y col., 1987; Nuck y Federle, 1996; Painter, 1992; Steber, 1991; Steber y Berger, 1995). En un estudio de biodegradabilidad anaerobia del tensioactivo C12-14AEO2S (ensayos ECETOC), Steber (1991) encontró una producción de biogás del 75% al cabo de un período de incubación de 41 días. Asimismo, Painter (1992), operando en condiciones anaerobias, encontró una eliminación del 64% de sustancia activa al azul de metileno (MBAS) para el tensioactivo C12-14AE3S al cabo de 28 días de ensayo y del 70% MBAS para el tensioactivo C16AE1S en 17días. Por otro lado, estudios llevados a cabo en un digestor a escala de laboratorio mostraron una mineralización anaerobia (basado en la formación de 14C-gas) del tensioactivo C14AE3S comprendida entre 88,4% y 87,6% al cabo de 17 días de incubación, dependiendo de la concentración de inóculo utilizado (Nuck y Federle, 1996). A diferencia de otros tensioactivos, estudios realizados por Painter (1992) parecen indicar que el porcentaje de biodegradabilidad de estos compuestos no se ve afectado por V-5 Capítulo 5 la longitud de la cadena alquílica; si bien su grado de ramificación puede dificultar la biodegradación primaria de estos tensioactivos, encontrando porcentajes de eliminación para un AES lineal del 97% al cabo de 3 días, un 90% para un oxo-AES lineal, y 50% para un AES de cadena ramificada. Toxicidad de los alquil etoxisulfatos en el medio acuático Se han encontrado numerosos datos de toxicidad aguda de los AES sobre un total de 17 especies marinas y de agua dulce correspondientes a diferentes grupos taxonómicos (algas, invertebrados y peces), aunque la mayoría de estos estudios corresponden a especies de agua dulce, y en ocasiones no se especifican bien las condiciones de ensayo. En la Tabla V.1 se resumen algunos de los valores de toxicidad aguda de diversos AES sobre diferentes organismos acuáticos marinos y de agua dulce recogidos en la bibliografía. De manera general, los valores de toxicidad (EC50) de los AES se encuentran comprendidos entre 0,37 y 450 mg L-1, lo que demuestra una gran variabilidad de la toxicidad en función del taxón, la especie, condiciones de ensayo y tipo de alcohol etoxilado ensayado. Con respecto al taxón se observan diferencias significativas entre ellos, estando los valores de EC50 comprendidos entre 0,37 y 65 mg L-1 en el caso de las algas, 0,78 y 167,3 mg L-1 en el caso de los invertebrados y, 0,8 y 450 mg L-1 en el caso de los peces (Tabla V.1). Asimismo, en un estudio realizado por la consultora BKH (1994), en el que se recopilan datos de toxicidad de diversos AES sobre organismos acuáticos, se mostraban valores de EC50 comprendidos entre 3,5 y 10, 4,2 y 350 y, 0,39 y 94,4 mg L-1 en el caso de algas, crustáceos y peces, respectivamente. Otra de las fuentes de variabilidad de la toxicidad de los AES consiste en la especie ensayada. Así, por ejemplo, en el caso de algas marinas, Pavlic y col. (2005) obtuvieron valores similares de toxicidad (EC50, 72-h) para dos especies de diatomeas, mientras que para especies de algas de agua dulce estas diferencias fueron algo más acusadas (Tabla V.1). Respecto a la variabilidad en peces de agua dulce, Reiff y col. (1979) encontraron una toxicidad similar del tensioactivo C12-15AE3S sobre dos especies diferentes. Sin embargo, estudios realizados por Singh y col. (2002) encontraron diferencias significativas entre los peces R. heteromorpha e I. idus melanotus, con valores de IC50 (48h) comprendidos entre 7, 20 y 13,64 mg L-1 de lauril etersulfato sódico (C12AES). En relación a las condiciones de ensayos (tipo de respuesta, periodo de exposición, etc.) no se ha encontrado ningún trabajo en el que se compare la toxicidad de los AES a diferentes condiciones experimentales, aunque en general se asume que cambios en las condiciones de ensayo (tiempo de exposición, temperatura, etc.) puede influir de manera significativa en los resultados de los ensayos de toxicidad aguda (Rand, 1995). V-6 Alquil etoxisulfatos Tabla V.1. Resumen de algunos valores de toxicidad aguda de AES sobre organismos acuáticos recogidos en la bibliografía. Grupo Especie AES Efecto Algas marinas Phaeodactylum tricornutum C12AES 72-h EC50 Toxicidad (mg L-1) 0,50 Skeletonema costatum C12AES Algas de agua dulce Selenastrum capricornutum C10-15AE3S 48-h EC50 65 C12-14AES 72-h EC50 32 Verge y col., 1996 3,5 Pavlic y col., 2005 Pseudokirchneriella subcapitata Referencia Pavlic y col., 2005 0,37 C12AES Yamane y col., 1984 Scenedesmus subspicatus C12AES Invertebrados marinos Artemia salina C12-14AE3S 24-h LC50 11,97 Liwarska y col., 2005 Invertebrados de agua dulce Daphnia magna C13,67AE2,25S 96-h EC50 1,17 Maki, 1979 Ceriodaphnia dubia C12AE1S 48-h LC50 9,55 Dyer y col., 2000 0,50 C12AE2S Peces de agua dulce 55,98 C12AE4S 118,26 C12AE8S 43,46 C13AE2S 7,18 C14AE1S 4,08 C14AE2S 4,24 C14AE4S 43,97 C15AE1S 0,78 C15AE2S 18,96 C15AE4S 66,4 C15AE8S 167,31 Salmo gairdneri C12AES Gammbusia affinis C12AES Carassius auratus C12AES 12,35 Cirrhina mrigala C12AES 7,20 Pimephales promelas C12AE2S Oncorhynchus mykiss 48-h IC50 10,84 24-h LC50 1,5 C14AE2S 1,8 C16AE2S 1,0 C18AE2S 8,0 C11AE4S 17,0 C14AE4S 4,0 C16AE4S 0,9 C18AE4S 15 C14AE6S 9,3 C16AE6S 0,8 C18AE6S 2,1 C9-10AE2,5S Singh y col., 2002 13,64 96-h LC50 C12-13AE2S Painter, 1992 400-450 28 C12-15AE3S 8,9 Salmo trutta C12-15AE3S 1,0-2,5 Rasbora heteromorpha C12-15AE3S Idus idus melanotus C12-15AE3S 48-h LC50 Reiff y col., 1979 3,9 3,95 V-7 Capítulo 5 Respecto a la estructura química del alquil etoxisulfato, estudios llevados a cabo por diversos autores (Little, 1981; Painter, 1992; Dyer y col., 2000; Madsen, 2001) mostraron que la toxicidad de los AES depende principalmente de la longitud de cadena alquílica y en menor medida del número de unidades etoxiladas. Así, Little (1981) encontró que la toxicidad aguda de varios AES (C8-C19.6 y 1-3 EO) sobre el pez Lepomis macrochirus aumentaba a medida que lo hacia la longitud de la cadena alquílica, con valores de LC50 superiores a 250 mg L-1 para C8, 375 mg L-1 para C10, 24 mg L-1 para C13, 4-7 mg L-1 para C14, 2 mg L-1 para C15 y 0,3 mg L-1 para C16. Asimismo, Painter (1992) encontró para una serie de AES que la toxicidad sobre la carpa Pimephales promelas aumentaba a medida que lo hacía la longitud de la cadena alquílica, hasta un máximo de 16 átomos de carbono, a partir del cual la toxicidad experimentaba un descenso debido a su baja solubilidad, y por tanto, biodisponibilidad. Posteriormente, Dyer y col. (2000) observaron dos tendencias; en aquellos AES con idéntica cadena alquílica los efectos tóxicos disminuían a medida que aumentaba el número de unidades etoxiladas, mientras que para aquellos con igual número de unidades etoxiladas la toxicidad incrementaba a medida que aumentaba la longitud de la cadena hidrocarbonada (Tabla V.1). A pesar de la alta toxicidad que presentan algunos AES sobre determinadas especies acuáticas (Painter, 1992; Pavlic y col., 2005), no se ha descrito en la bibliografía la formación de metabolitos tóxicos persistentes durante el proceso de biodegradación de los AES. V-8 Alquil etoxisulfatos 2. Materiales A continuación se detallan las principales características del tensioactivo así como del medio de ensayo empleado para los estudios de biodegradación y ecotoxicidad. Tensioactivo ensayado El tensioactivo aniónico utilizado fue un alquil etoxisulfato conocido comercialmente como Empicol® ESB 70/SP, CAS 68585-34-2 y suministrado por Huntsman Surface Science Iberica S.L. (Barcelona). Está constituido por una mezcla de homólogos de cadena alquílica entre 10 y 16 átomos de carbono (predominando C12 y C14) y dos unidades etoxiladas. Presenta una pureza del 70,0 ± 1,0 % de materia activa, una densidad (20ºC) de 1,10 g cm-3 y una elevada solubilidad en agua. Medio de ensayo Las principales características físico-químicas y biológicas del agua de mar empleada en los ensayos de biodegradación y ecotoxicidad se reflejan en la Tabla V.2. De manera análoga a los anteriores capítulos (capítulo 3 y 4), los resultados obtenidos en el análisis del agua de mar demuestran su bajo grado ó nulo de contaminación. Tabla V.2. Características del agua de mar empleada en los ensayos de biodegradación y toxicidad del tensioactivo aniónico Empicol® ESB 70/SP (valor medio ± desviación estándar, n=3). Parámetro Unidades Valor Parámetro Unidades Oxígeno disuelto % saturación 92,7 ± 1,8 Nitrato mg L-1 NO3- Valor 0,033 ± 0,009 Temperatura ºC 12,5 ± 0,3 Amonio mg L-1 NH4+ < 0,007 Conductividad mS cm-1 50,9 ± 0,2 Fosfato mg L-1 PO43- < 0,015 -1 pH - 8,14 ± 0,04 Silicato mg L Si 0,021 ± 0,003 Salinidad - 38,5 ± 0,5 Dureza total mg L-1 Ca2+ 418 ± 14 Carbono total mg L-1 C 26,9 ± 0,5 Clorofila a mg m-3 Cl a 0,73 ± 0,12 26,4 ± 0,5 Estreptococos fecales UFC·100mL-1 No Detectado 0,50 ± 0,01 Coliformes fecales UFC·100mL-1 No Detectado -1 Carbono inorgánico mg L C Carbono orgánico mg L-1 C Nitrito -1 mg L NO2 - < 0,015 Enterococos UFC·100mL -1 No detectado V-9 Capítulo 5 3. Resultados y discusión En el siguiente apartado se presentan y discuten los resultados obtenidos en los diferentes ensayos de biodegradación y ecotoxicidad realizados con el tensioactivo aniónico Empicol® ESB 70/SP. 3.1. Ensayos de biodegradación Parámetros de control La Figura V.3 muestra la evolución de los parámetros de control pH y oxígeno disuelto en los ensayos de biodegradación (AES1, AES2 y AES3), abiótico (AB3) y control (CO3) a lo largo del experimento de biodegradación. 8,5 100 O2 (%saturación) pH 8,0 7,5 CO3 AES1 AES2 AES3 AB3 7,0 6,5 80 60 40 CO3 AES1 AES2 AES3 AB3 20 0 0 20 40 60 80 Tiempo (d) 100 120 0 20 40 60 80 100 120 Tiempo (d) Figura V.3. Evolución del pH y oxígeno disuelto en el ensayo control (CO3), abiótico (AB3) y los ensayos de biodegradación con AES (AES1, AES2 y AES3). Como puede observar en dicha figura el parámetro pH muestra valores similares en los ensayos control, abiótico y de biodegradación, alcanzando valores medios (valor medio ± DE) de 7,90 ± 0,15, 8,05 ± 0,15 y 7,95 ± 0,1, respectivamente. Respecto a la concentración de oxigeno disuelto, se observa una disminución inicial de los niveles de oxígeno disuelto en los ensayos de biodegradación que posteriormente se recupera, alcanzándose valores similares a los ensayos control y abióticos. A pesar de este descenso inicial, los valores de oxígeno disuelto en todos los ensayos realizados permanecen dentro de un rango que garantizan que éste no ha sido un factor limitante del proceso degradativo. Los porcentajes de saturación medios obtenidos en V-10 Alquil etoxisulfatos los ensayos control, abiótico y de biodegradación fueron del 87,4 ± 2,8%, 87,8 ± 2,9%, y 81,8 ± 6,96%, respectivamente. Respecto al ensayo de referencia (benzoato sódico), los valores medios de pH y oxígeno disuelto estuvieron comprendidos entre 7,96 ± 0,14 y 75,6 ± 7,58% de saturación, respectivamente. Los valores medios de temperatura encontrados en los ensayos control, abiótico, referencia y de biodegradación fueron de 19,4 ± 0,5ºC, 20,2 ± 0,19ºC, 19,7± 0,2 ºC, y 19,83 ± 0,11°C, respectivamente. Los resultados obtenidos en el presente apartado indican que durante el experimento de biodegradación las condiciones experimentales de pH, oxígeno y temperatura no fueron limitantes para el desarrollo de la población microbiana responsable del proceso biodegradativo. Evolución del carbono orgánico disuelto en los ensayos control, referencia y abiótico Concentración (mg COD L-1) En la Figura V.4 se muestran la evolución seguida por el sustrato residual, concentración de carbono orgánico disuelto, en los ensayos control, referencia (benzoato sódico) y abiótico (HgCl2) a lo largo del ensayo de biodegradación. 20 15 10 REF3 AB3 CO3 5 0 0 20 40 60 80 100 120 Tiempo (d) Figura V.4. Evolución del carbono orgánico disuelto en los ensayos control (CO3), referencia (REF3) y abiótico (AB3) a lo largo del proceso de biodegradación. Se puede observar como en el caso del ensayo control y abiótico la concentración de carbono orgánico permanece prácticamente constante a lo largo del experimento de biodegradación, con valores medios de 1,09 ± 0,80 y 18,59 ± 0,56 mg DOC L-1, respectivamente. El porcentaje de mineralización alcanzado en el ensayo abiótico fue del V-11 Capítulo 5 1,82 ± 3,32 %, descartando, por lo tanto, la contribución de procesos abióticos (tales como precipitación, absorción, etc.) en la eliminación del tensioactivo. Por el contrario, se puede apreciar como el benzoato sódico (sustancia de referencia) fue rápidamente degradado, con porcentajes medios de degradación superiores al 50 y 90 % al cabo de 6 y 9 días, respectivamente. Estos resultados están en consonancia con los obtenidos por diversos autores (Nyholm y Kristensen, 1992; Staples y col., 2001; Perales y col., 2007) para el mismo substrato (tiempo de vida media comprendido entre 1 y 7 días), indicando así una apropiada actividad microbiológica del agua de mar usada. Evolución del carbono orgánico disuelto en los ensayos con tensioactivo En la Figura V.5 se recoge la evolución temporal de la concentración residual de Empicol ESB 70/SP (mg L-1 COD) presente en el medio de ensayo para los tres ensayos de biodegradación realizados. Los puntos indican los valores medios experimentales, mientras que las barras de error denotan la desviación estándar (n=3). -1 Concentración (mg COD L ) ® 20 Etapa A Etapa B 15 10 5 0 0 20 40 60 80 100 120 Tiempo (d) Figura V.5. Evolución de la concentración residual de Empicol®ESB 70/SP (mg COD L-1) en los ensayos de biodegradación. La línea continua roja corresponde a la curva obtenida del ajuste de los valores experimentales a un modelo cinético de primer orden, mientras que la línea continua azul representa el ajuste correspondiente a un modelo logístico. En primer lugar, se observa como al cabo de 120 días de ensayo el tensioactivo Empicol®ESB 70/SP es mineralizado casi en su totalidad, alcanzando porcentajes de degradación del 25, 60 y 97% al cabo de 9, 60 y 124 días de ensayo, respectivamente. Cabe V-12 Alquil etoxisulfatos destacar un descenso de la concentración inicial de carbono orgánico disuelto en el primer día de ensayo, la cual se corresponde con una acusada disminución de la concentración de oxígeno disuelto, tal y como observamos en la Figura V.3. Atendiendo al criterio establecido por la directriz OPPTS, estos resultados (eliminación de COD inferior al 70% al cabo de 60 días de ensayo) no descartan la capacidad del medio acuático marino para degradar el tensioactivo aniónico estudiado, aunque sería necesario realizar ensayos adicionales de biodegradación, por ejemplo, empleando concentraciones iniciales de tensioactivo inferiores (USEPA, 1998). Sin embargo, los resultados obtenidos tras un periodo de experimentación de 124 días indican un alto grado de mineralización del tensioactivo estudiado (97% al cabo de 124 días). Este elevado porcentaje de biodegradación parece indicar que, efectivamente, existe un potencial para la mineralización de estos tensioactivos en el medio marino, si bien a una baja velocidad de degradación si la comparamos con otros tensioactivos o el sustrato de referencia. Por otro lado, se puede apreciar la existencia de dos etapas durante el proceso de mineralización del tensioactivo aniónico (Figura V.5). La primera etapa (etapa A) se encuentra comprendida entre el momento inicial de ensayo hasta el día 45, aproximadamente, y se caracteriza por una rápida velocidad de degradación y la ausencia de una fase de adaptación de los microorganismos responsables de la biodegradación. La segunda etapa (etapa B) abarca aproximadamente desde el día 46 hasta el final del ensayo y, a diferencia de la primera etapa (etapa A), se puede observar una acusada fase de adaptación de la población bacteriana y una velocidad de degradación más lenta. La presencia de estas dos etapas durante la mineralización del Empicol®ESB 70/SP puede justificarse atendiendo al mecanismo de biodegradación de estos tensioactivos propuestos por Steber y Berger (1995) (Figura V.2) y a los resultados obtenidos por Manzano y col. (1998) y Perales y col. (2007). Así, Steber y Berger (1995) establecieron varias posibles rutas de biodegradación que incluyen procesos de hidrólisis y ω-β oxidaciones, entre otras. Por otro lado, en un estudio llevado a cabo por Manzano y col. (1998) se mostraba que la degradación del tensioactivo no-iónico NPEO, cuyo principal mecanismo inicial de ruptura consiste en la hidrólisis de la cadena etoxilada, presentaba una fase de aclimatación relativamente corta (tiempo de latencia = 1-3 días). Por el contrario, Perales y col. (2007) mostraron la presencia de una larga fase de adaptación (tiempo de latencia = 6,67 ± 0,6 días) durante la degradación del tensioactivo aniónico LAS, cuyo mecanismo inicial de degradación consiste en ω-β oxidaciones (Schöberl, 1989; Scott y Jones, 2000). Teniendo en cuenta estas consideraciones, los resultados obtenidos en el presente experimento parecen indicar que durante la primera etapa (etapa A) predomina la ruptura hidrolítica de los enlaces éter (corto periodo de aclimatación) mientras que en una segunda etapa (etapa B), estos metabolitos son degradados vía ω-β oxidaciones (largo periodo de aclimatación). V-13 Capítulo 5 Con el fin de conocer la cinética de mineralización del tensioactivo en el medio de ensayo, y al igual que se ha realizado en los anteriores capítulos, se ajustaron los valores experimentales obtenidos para ambas etapas (etapas A y B) a diferentes modelos cinéticos de consumo de sustrato propuestos por Simkins y Alexander (1984) y Quiroga y col. (1999). Los resultados obtenidos a partir del análisis estadístico demuestran que el tensioactivo Empicol®ESB 70/SP muestra una cinética de primer orden durante la primera etapa del proceso (etapa A) mientras que durante la segunda etapa (etapa B) el modelo cinético logístico es el que mejor se ajusta a los datos experimentales. En las Tablas V.3 y V.4 se recogen los valores de los parámetros cinéticos y estadísticos correspondientes al modelo cinético de mejor ajuste para cada una de las etapas. Tabla V.3. Parámetros cinéticos correspondientes a los resultados de biodegradación de Empicol®ESB 70/SP en agua de mar. Parámetros cinéticos a Modelo S0 (mg COD L-1) K1 (d-1) Primer orden b 16,05 ± 1,48 0,016 ± 0,005 (etapa A) b Logístico 8,23 ± 1,46 -(etapa B) a Datos presentados como valor medio ± DE (n=3) b Simkins y Alexander (1984) Tabla V.4. B0 (mg COD L-1) KLg (mg COD L-1 d-1) -- -- 0,001 ± 0,004 0,012 ± 0,009 Parámetros estadísticos correspondientes a los resultados de biodegradación de Empicol®ESB 70/SP en agua de mar. Parámetros estadísticos Modelo R2 b χ2 Primer orden 0,93 36,65 (etapa A) b Logístico 0,95 24,03 (etapa B) b Simkins y Alexander (1984) ν Q 21 0,050 26 0,574 Al objeto de determinar la velocidad de mineralización del tensioactivo Empicol®ESB 70/SP bajo las condiciones ensayadas, esto es, los valores del periodo de latencia y de vida media, se han sustituido los valores de los parámetros cinéticos obtenidos en la Tabla V.3 en las expresiones propuestas por Perales y col. (2007) para el modelo de primer orden y logístico (véase capítulos 3 y 4). Así, los valores de tiempo de latencia (tL), t50 (el tiempo necesario para alcanzar un 50% de biodegradación, sin considerar el tiempo V-14 Alquil etoxisulfatos de latencia) y tiempo de vida media (t1/2), calculados para la etapa A fueron de 3,3, 15,3 y 18,6 días, respectivamente. En el caso de la etapa B, los valores de tL, t50 y t1/2 obtenidos fueron 26,5, 23,3 y 49,8 días, respectivamente. La velocidad de degradación obtenida en el presente trabajo para el tensioactivo Empicol®ESB 70/SP (C12-14AE2S) resulta inferior a las mostrados por otros autores para diversos AES y empleando un medio mineral inoculado (50% mineralización al cabo de 35 días de ensayos). Así, por ejemplo, Schöberl y col. (1988), en un ensayo de fácil biodegradabilidad (OECD 301), mostraron porcentajes de mineralización del 58-100% y 96-100% al cabo de 28 días de ensayo para los tensioactivos C12–14AE2S y C12–15oxo-AE3S, respectivamente. Por otro lado, Painter (1992) para un alquil etoxilado de similar estructura química (C12–14AE3S) encontró porcentajes de biodegradación primaria del tensioactivo C1214AE3S comprendidos entre el 90 y 100% al cabo de 1-5 días de ensayo. Steber y Berger (1995), empleando el método de frasco cerrado, también observaron una completa mineralización del tensioactivo C12–18AE8.5S en un periodo inferior a 28 días. 3.2. Ensayos de toxicidad aguda estándar Ensayos de toxicidad con microalgas marinas En la Figura V.6 se muestra la evolución temporal de la concentración neta de biomasa (densidad óptica neta, DOn = DOt=t – DOt=0) para diferentes concentraciones de exposición de Empicol®ESB 70/SP (mg L-1) en los ensayos estándar de toxicidad con microalgas. Se puede apreciar como la toxicidad del tensioactivo aniónico varía considerablemente dependiendo de la especie ensayada. En general, se observa una inhibición del crecimiento con respecto al control para todas las microalgas y concentraciones ensayadas al cabo de 24 horas de exposición. Asimismo, se aprecia como al cabo de las 96 horas de exposición estos efectos son más acusados, especialmente en las microalgas N. gaditana, C. gracilis y D. salina. Por otro lado, se pueden observar valores negativos de DOn al cabo de las 24 horas en todas las microalgas menos N. gaditana, indicando efectos tóxicos letales sobre las microalgas. Sin embargo, al cabo 48 horas de ensayo se produce una recuperación de los cultivos para casi todas las concentraciones ensayadas. Se aprecia como en el caso de I. galbana y T.chuii esta recuperación del crecimiento tiene lugar para todas las concentraciones ensayadas, mientras que en las especies C. gracilis y D. salina ésta sólo tuvo lugar a concentraciones iguales o inferiores a 22,4 y 7 mg L-1 Empicol®ESB 70/SP, respectivamente. V-15 Capítulo 5 1,2 0,8 28 mg L-1 0,6 0,4 0,2 0,0 I. galbana 0 17 20 22 25 1,0 DOn (690 nm) DOn (690 nm) 1,0 1,2 N. gaditana 0 6 11 17 22 0,8 28 mg L-1 0,6 0,4 0,2 0,0 -0,2 -0,2 0 20 40 60 80 100 0 20 Tiempo (h) 0,6 60 80 100 80 100 C. gracilis 0 11 14 17 20 0,5 DOn (690 nm) 40 Tiempo (h) 0,4 0,3 22 mg L-1 0,2 0,1 0,0 -0,1 -0,2 0 20 40 60 80 100 Tiempo (h) DOn (690 nm) 1,2 1,0 0,8 1,4 D. salina 0 1 3 4 6 7 mg L-1 0,6 0,4 1,0 0,8 T. chuii 0,6 0,4 0,2 0,2 0,0 0,0 -0,2 -0,2 0 20 40 60 Tiempo (h) Figura V.6. V-16 0 7 14 28 35 42 mg L-1 1,2 DOn (690 nm) 1,4 80 100 0 20 40 60 Tiempo (h) Evolución de la concentración neta de biomasa (DOn, 690 nm) en el ensayo de toxicidad estándar con microalgas. Las barras de error denotan las desviaciones estándares (n=3). Alquil etoxisulfatos En la Tabla V.5 se recogen los valores de las concentraciones de inhibición del crecimiento (IC50), NOEC y LOEC calculadas para cada una de las microalgas ensayadas y un periodo de exposición de 96 horas. Tabla V.5. Valores de IC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con microalgas marinas y el tensioactivo Empicol®ESB 70/SP. Organismo Efecto tóxico Concentración (mg L-1) N. gaditana 96-h IC50 22,05 (21,10-28,66)a 96-h NOEC 8,40b 96-h LOEC 11,20b 96-h IC50 24,02 (21,39-27,73)a 96-h NOEC 16,80 b 96-h LOEC 19,60 b 96-h IC50 20,83 (20,56-21,07)a 96-h NOEC 16,80 b 96-h LOEC 19,40 b 96-h IC50 4,68 (4,09-4,93)a 96-h NOEC 2,80 b 96-h LOEC 4,20 b 96-h IC50 23,10 (20,46-24,55)a 96-h NOEC 7,00 b I. galbana C. gracilis D. salina T. chuii 96-h LOEC 14,00 b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Como puede observarse en la Tabla V.5 los valores 96-h IC50 calculados para la microalga D. salina son notablemente más bajos que los calculados para el resto de microalgas. Asimismo, no se aprecian diferencias significativas entre el resto de las microalgas (N. gaditana, I. galbana, C. gracilis y T. chuii). También puede verse como los valores medio NOEC (96-h) están comprendidos entre 4,20 mg L-1 para D. salina y 19,60 mg L-1 para I. galbana y C. gracilis. De acuerdo con los valores IC50 obtenidos, podemos establecer el siguiente orden de sensibilidad de las diferentes microalgas al tensioactivo: D. salina > N. gaditana ≈ I. galbana ≈ C. gracilis ≈ T. chuii. Cabe resaltar la variabilidad de los valores de IC50 obtenidos en el caso de las microalgas N. gaditana e I. gracilis, para las cuales se obtuvieron coeficientes de variación del 24,24 y 20,33%, respectivamente. En el caso de algas marinas, tan sólo se han encontrado datos de toxicidad del tensioactivo aniónico C12AES sobre las diatomeas Phaeodactylum tricornutum (EC50= 0,50 V-17 Capítulo 5 mg L-1) y Skeletonema costatum (EC50= 0,37 mg L-1) (Pavlic y col., 2005; Tabla V.1) aunque resultan muy inferiores a los valores de toxicidad hallados en el presente trabajo (Tabla V.5). La principales diferencias entre el ensayo llevado a cabo por Pavlic y col. (2005) y el realizado en el presente trabajo radica en la estructura química del AES (si bien el Empicol®ESB 70/SP presenta una mayor longitud de cadena alquílica (12-14 átomos de carbono)) y el periodo de exposición empleado (Pavlic y col. emplearon un periodo de 72 horas frente al periodo de 96 horas empleada en el presente trabajo). Atendiendo a estas diferencias cabría esperar una mayor toxicidad del Empicol®ESB 70/SP, sin embargo, precisamente ocurre lo contrario, por lo que la causa sólo puede deberse al diferente grado de sensibilidad de las especies ensayadas. Respecto a las especies de agua dulce, los valores obtenidos son comparables a los encontrados por Verge y col. (1996) para la especie S. capricornutum y el alcohol etoxisulfato C12-14AES (EC50= 32 mg L-1, 72-h). Sin embargo, se observan diferencias significativas con respecto a las microalgas P. subcapitata y S. subspicatus, las cuales presentan una sensibilidad muy superior (EC50= 0,50-3,5 mg L-1, 72-h). Estos resultados ponen de manifiesto, una vez más, la elevada variabilidad que presenta la toxicidad de estos tensioactivos, dependiendo de la especie ensayada. Ensayos de toxicidad con Artemia franciscana A continuación se muestran los resultados de toxicidad obtenidos para el crustáceo A. franciscana expuesto a crecientes concentraciones de Empicol®ESB 70/SP. La siguiente gráfica muestra los porcentajes de artemias supervivientes obtenidos para periodos de exposición de 48 y 72 horas. A. franciscana Supervivientes (%) 100 80 60 40 20 48h 72h 0 0 10 20 30 40 50 60 70 Concentración (mg L-1) Figura V.7. V-18 Efecto del tensioactivo AES sobre A. franciscana a las 48 y 72 horas de exposición. Los datos se representan como valor medio ± DE (n=5). Alquil etoxisulfatos A la vista de la Figura V.7 se puede observar que a medida que aumenta la concentración de ensayo el porcentaje de supervivientes decrece como consecuencia del efecto tóxico del agente de superficie, siendo este efecto más acusado para un periodo de exposición de 72 horas. Por otro lado, cabe destacar una elevada variabilidad de los valores de mortalidad correspondientes a las cinco réplicas. En la Tabla V.6 se recogen los valores de los parámetros de toxicidad LC50 (concentración que produce la mortalidad del 50% de la población), NOEC y LOEC calculados para un periodo de exposición de 48 y 72 horas. Tabla V.6. Valores de LC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con crustáceos y el tensioactivo AES. Organismo Efecto tóxico Concentración (mg L-1) A. franciscana 48-h LC50 38,30 (34,15-42,45)a 72-h LC50 23,92 (19,59-28,26)a 48-h NOEC 4,90 b 48-h LOEC 9,80 b 72-h NOEC 4,90 b 72-h LOEC 9,80 b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Se puede apreciar como, a pesar de que el efecto tóxico fue más acusado tras 72 horas de exposición, las concentraciones máximas de efectos observables (NOEC) y concentraciones mínimas de efectos observables (LOEC) mostraron los mismos valores para ambos periodos (NOEC = 4.90 mg L-1; LOEC = 9.80 mg L-1). Estos resultados son comparables con lo obtenidos por Liwarska-Bizukojc y col. (2005) para el crustáceo marino A. salina y el tensioactivo C12-14EO3S (LC50= 11,97 mg L-1). Dentro del conjunto de datos hallados en la bibliografía para invertebrados de agua dulce (Tabla V.1), encontramos que los valores hallados en el presente trabajo resultan inferiores a los obtenidos por Dyer y col. (2000) para la crustáceo C. dubia y el tensioactivo C12AE2S (LC50= 55,98, 48-h) mientras que por el contrario presentan menores efectos tóxicos que los observados por Maki y col. (1979) para la especie D. magna y el tensioactivo de similar estructura química C13,67AE2,25S (LC50= 1,17, 96-h). En el primer caso, estas diferencias pueden ser debidas a la menor longitud de cadena de cadena alquílica del tensioactivo C12AE2S con respecto al tensioactivo ensayado en este trabajo (C12-14AE2S) así como el menor tiempo de exposición empleado. Por el contrario, en el segundo caso, dado que la estructura química de ambos tensioactivos y el tiempo de exposición son similares, estas diferencias podrían ser debidas a los diferentes grados de sensibilidad que presentan los organismos ensayados. V-19 Capítulo 5 Dado que no se han encontrado datos de concentración de alquil etoxisulfatos en el medio acuático marino, no es posible evaluar el riesgo que supone la presencia de estos tensioactivos en este medio. Sin embargo, si tenemos en cuenta los niveles de alquil etoxisulfatos encontrados en agua de río por Sanderson y col. (2006) (10-172 ng L-1) podemos apreciar como los valores de concentración de no efecto (NOEC) calculados para las microalgas y el crustáceo marino (NOEC= 2,8-16,8 mg L-1) son muy superiores a las concentraciones ambientales encontradas. Partiendo de que las concentraciones de estas sustancias en el medio marino serían incluso inferiores que en agua de río dado la gran capacidad de dilución del medio, podemos afirmar que la presencia de estos compuestos no supone, en principio, un riesgo ambiental para las poblaciones de estas microalgas y crustáceo marino. No obstante, para corroborar esta hipótesis sería necesario llevar a cabo un mayor número de estudios de toxicidad aguda y crónica incluyendo un mayor número de especies así como un programa de monitoreo ambiental de estas sustancias en zonas costeras. 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación En el siguiente apartado se presenta y discuten los resultados del estudio de la evolución de la toxicidad del medio de ensayo a lo largo del proceso biodegradativo del Empicol®ESB 70/SP. La evolución temporal de la toxicidad del medio de ensayo (%) y grado de mineralización (% inhibición del crecimiento y mortalidad) durante el ensayo de biodegradación del tensioactivo se recogen en la Figura V.8. V-20 Alquil etoxisulfatos 80 60 60 40 40 20 20 IC, 96-h (%) Biodegradación (%) 20 40 60 80 100 80 60 60 40 40 IC, 96-h (%) Biodegradación (%) 20 0 120 0 0 20 Tiempo (días) 100 60 60 IC, 96-h (%) Biodegradación (%) 20 40 20 0 Biodegradación (%) 80 0 0 20 40 60 80 100 60 60 40 40 20 20 IC, 96-h (%) Biodegradación (%) 0 20 40 20 20 0 0 60 80 100 120 Mortalidad, 72-h (%) 60 IC, 96-h (%) Biodegradación (%) Tiempo (días) 40 60 80 0 100 120 A. franciscana 100 100 Biodegradación (%) Inh. crecimiento, 96-h (%) 60 40 100 80 0 80 20 120 Tiempo (días) 80 0 100 80 120 T. chuii 40 80 D. salina Tiempo (días) 100 60 100 Inh. crecimiento, 96-h (%) Inh. crecimiento, 96-h (%) 80 40 40 Tiempo (días) C. gracilis 100 20 Biodegradación (%) 0 0 80 100 80 80 60 60 40 LC,72-h (%) Biodegradación (%) 20 0 40 20 Biodegradación (%) 0 100 Biodegradación (%) 80 I. galbana 100 Biodegradación (%) Inh. crecimiento, 96-h (%) 100 Inh. crecimiento, 96-h (%) N. gaditana 100 0 0 20 40 60 80 100 120 Tiempo (días) Figura V.8. Evolución del efecto tóxico del medio de ensayo y porcentaje de mineralización durante el experimento de biodegradación del tensioactivo. De manera general, se observa una disminución del efecto toxico del medio a lo largo del proceso de mineralización del Empicol®ESB 70/SP, esto es, una detoxificación del medio de ensayo. En el caso de D. salina se puede apreciar un efecto tóxico máximo (100% inhibición del crecimiento) durante los primeros estadíos de biodegradación (40 días, aprox.). Este hecho se debe a la alta sensibilidad que presenta esta especie de V-21 Capítulo 5 microalga (como se pudo comprobar en el apartado 3.2) en comparación con la elevada concentración inicial de tensioactivo usado en el experimento de biodegradación. Por el contrario, para el resto de organismos ensayados se puede observar niveles de detoxificación del 100% al cabo de 96 días (77% biodegradación) en el caso de I. galbana, C. gracilis, T. chuii y A. franciscana y de 124 días (100% biodegradación) en el caso de N. gaditana y D.salina (caso A, véase capítulo 3, apartado 3.3). Si consideramos los valores de efectos tóxicos obtenidos cuando se alcanza aproximadamente un 50% de mineralización del tensioactivo (día 41 de ensayo), podemos observar que éstos varían notablemente dependiendo de la especie ensayada. Así, por ejemplo, en el caso de D. salina se observa un porcentaje de efecto del 100%, mientras que las microalgas N. gaditana, I. galbana, C. gracilis, y T. chuii muestran porcentajes de efectos similares, estando comprendidos entre el 10 y 36%. En el caso del crustáceo marino A. franciscana el efecto tóxico inicial (100% mortalidad) se ve reducido un 90% al cabo de 41 días de ensayos (50% biodegradación, aprox.). Teniendo en cuenta los valores de toxicidad alcanzados al inicio del experimento de biodegradación (0% mineralización) así como los efectos tóxicos observados al alcanzar aproximadamente un 50% de mineralización (día 41 de ensayo), podemos establecer el siguiente orden de sensibilidad al medio de ensayo: D. salina > N. gaditana ≈ I. galbana ≈ C. gracilis ≈ T. chuii > A. franciscana, siendo la microalga D. salina la más sensible. Si comparamos estos resultados con los obtenidos anteriormente en los ensayos de toxicidad estándar con Empicol®ESB 70/SP podemos observar que la sensibilidad de las especies al tensioactivo aniónico es similar a la que presentan al medio de ensayo, a excepción del crustáceo, el cual se mostró ligeramente más resistente al medio de ensayo que la microalga T. chuii. Esta similitud entre los resultados obtenidos en ambos experimentos parece indicar que el tensioactivo (y no los metabolitos) constituyen la principal fuente de toxicidad del medio de ensayo. Atendiendo a los resultados obtenidos para la mayoría de las especies de microalgas y el crustáceo marino, podemos concluir que durante la biodegradación del tensioactivo se produce una clara detoxificación del medio sin formación de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original y por lo tanto, que el tensioactivo aniónico Empicol®ESB 70/SP presenta una biodegradación ambientalmente aceptable. V-22 Alquil etoxisulfatos 4. Conclusiones Las principales conclusiones obtenidas en el presente capítulo son las siguientes: • El tensioactivo aniónico Empicol®ESB 70/SP presenta una elevada biodegrabilidad (porcentaje de mineralización superior al 97%) en el medio acuático marino bajo las condiciones ensayadas, aunque a una baja velocidad de biodegradación. • La biodegradación final o mineralización del tensioactivo en agua de mar presenta dos etapas bien diferenciadas. Los resultados parecen indicar que la primera etapa corresponde a la ruptura hidrolítica del tensioactivo, mientras que en la segunda etapa tiene lugar la eliminación de los metabolitos generados durante la etapa anterior mediante ω- y β-oxidaciones. La cinética de biodegradación del tensioactivo aniónico durante la primera etapa sigue un modelo cinético de primer orden, mientras que durante la segunda etapa, el modelo cinético que mejor describe la biodegradación final del xenobiótico es el logístico. • La toxicidad del tensioactivo Empicol®ESB 70/SP depende significativamente del tipo de organismo ensayado. Así, de las diferentes especies de microalgas estudiadas, la microalga D. salina constituye, con una amplia diferencia entre las otras cuatro especies, la más sensible al tensioactivo. Respecto al crustáceo marino A. franciscana, a pesar de que los efectos tóxicos estudiados han sido diferentes a los de las microalgas, se obtienen un grado similar de sensibilidad que para el resto de las microalgas estudiadas. • Los resultados obtenidos en los ensayos de toxicidad con organismos acuáticos junto con los datos disponibles de niveles ambientales de AES parecen indicar que las concentraciones de AES presentes en el medio acuático marino no suponen un riesgo ambiental. • Las medidas de toxicidad obtenidas en los ensayos combinados de toxicidad con el experimento de biodegradación indican una clara detoxificación del medio durante el proceso de mineralización del tensioactivo aniónico Empicol®ESB 70/SP sin producción de intermediatos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original. Estos resultados permiten clasificar al tensioactivo ensayado como un compuesto de biodegradabilidad ambientalmente aceptable. V-23 Capítulo 5 Referencias BKH, C.E., 1994. Environmental data review of alkyl ether sulphates (AES). Final Report. The Dutch Soap Association, Delft, The Netherlands. Cardellini, P., Ometto, L., 2001. Teratogenic and Toxic Effects of Alcohol Ethoxylate and Alcohol Ethoxy Sulfate Surfactants on Xenopus laevis Embryos and Tadpoles. Ecotoxicology and Environmental Safety 48, 170177. Dyer, S.D., Stanton, D.T., Lauth, J.R., Cherry, D.S., 2000. Structure–activity relationships for acute and chronic toxicity of alcohol ether sulfates. Environmental Toxicology and Chemistry 19, 608–616. Feijtel, T.C.J., Van de Plassche, E.J., 1995. Environmental risk characterisation of 4 major surfactants used in The Netherlands. NVZ report, The Netherlands. Fendinger, N.J., Versteeg, D.J., Weeg, E., Dyer, S., Rapaport, R.A., 1994. Environmental behaviour and fate of anionic surfactants. En: Baker, L.A. (Ed.). Environmental Chemistry of Lakes and Reservoirs. ACS Advances in Chemistry Series No. 237. American Chemical Society, Washington DC, United States, pp. 528-557. Fischer, W.K., 1982. The important aspects of ecological evaluation of fatty alcohols and their derivatives. En: Henkel (Ed.). Fatty alcohols - Raw materials methods and uses, Dusseldorf, pp. 122-187. Gerike, P., Jasiak, W., 1986. How completely are surfactants biodegraded? Tenside Deterg. 23, 300-304. Griffith, E.T., Hales, S.G., Russell, N.J., Watson, G.K., 1986. Metabolite production during the biodegradation of the surfactant sodium dodecyltriethoxy sulphate under mixed-culture die-away conditions. J. Gen. Microbiol. 132, 963-972. HERA, 2002. Alcohol ethoxysulphates (AES): Environmental Risk Assessment. Human and Environmental Risk Assessment on ingredients of European household cleaning products. Holt, M.S., Mitchell, G.C., Watkinson, R.J., 1992. The environmental chemistry, fate and effects of nonionic surfactants. En: Oude, N.T.d. (Ed.). Detergents, The Handbook of Environmental Chemistry. SpringerVerlag, Berlin Heidelberg, Germany, pp. 89-144. Itoh, S., Naito, S., Unemoto, T., 1987. Comparative studies on anaerobic biodegradation of anionic and non-ionic surfactants. Eisei Kagaku 33, 415-422. Lee, D.M., Guckert, J.B., Belanger, S.E., Feijtel, T.C.J., 1997. Seasonal temperature declines do not decrease periphytic surfactant biodegradation or increase algal species sensitivity. Chemosphere 35, 1143-1160. Little, A.D., 1981. Human safety and environmental aspects of major surfactants (supplement). En: Service, N.T.I. (Ed.). A report to the Soap and Detergent Association, ADL. Reference 84048, Springfield, Virginia. Liwarska-Bizukojc, E., Miksch, K., Malachowska-Jutsz, A., Kalka, J., 2005. Acute toxicity and genotoxicity of five selected anionic and nonionic surfactants. Chemosphere 58, 1249-1253. Madsen, T., Boyd, H.B., Nylén, D., Pedersen, A.R., Petersen, G.I., Simonsen, F., 2001. Environmental and health assessment of substances in household detergents and cosmetic detergents and cosmetic detergent products. DK-EPA, Denmark. V-24 Alquil etoxisulfatos Maki, A.W., 1979. Correlations between Daphnia magna and fathead minnow (Pimephales promelas) chronic toxicity values for several classes of test substances. J. Fish Res. Board Can. 36, 411-421. Matthijs, E., Holt, M.S., Kiewiet, A.T., Rijs, G.B., 1999. Environmental monitoring for linear alkylbenzene sulfonate, alcohol ethoxylate, alcohol ethoxy sulfate and soap. Environ Toxicol Chem 18, 2634-2644. Modler, R.F., Gubler, R., Inoguchi, Y., 2004. Detergent Alcohols. Chemical Economics Handbook Marketing Research Report. SRI International, Menlo Park, CA Nuck, B.A., Federle, T.W., 1996. A batch test for assessing the mineralisation of 14C-radiolabeled compounds under realistic conditions. Envir. Science Technol. 30, 3597-3603. Nyholm, N., Kristensen, P., 1992. Screening methods for assessment of biodegradability of chemicals in seawater results from a ring test. Ecotoxicol Environ Saf 23, 161-172. Painter, H.A., 1992. Anionic surfactants. En: Oude, N.T., Huntzinger, O. (Eds.). Anthropogenic Compounds. Detergents. Springer, Berlin, Germany, pp. 1-88. Pavlic, Z., Vidakovic-Cifrek, Z., Puntaric, D., 2005. Toxicity of surfactants to green microalgae Pseudokirchneriella subcapitata and Scenedesmus subspicatus and to marine diatoms Phaeodactylum tricornutum and Skeletonema costatum. Chemosphere 61, 1061-1068. Perales, J.A., 2001. Variabilidad de la biodegradación y toxicidad de compuestos xenobióticos en el medio marino. Aplicación a lineal alquilbenceno sulfonatos en aguas del Golfo de Cádiz. Tesis Doctoral. Dpto. de Ingeniería Química, Tec. Alimentos y Tec. Medio Ambiente. Universidad de Cádiz, Cádiz. Perales, J.A., Manzano, M.A., Garrido, M.C., Sales, D., Quiroga, J.M., 2007. Biodegradation kinetics of linear alkylbenzene sulphonates in sea water. Biodegradation 18, 63-70. Rand, G.M., 1995. Fundamentals of aquatic toxicology. Effects, Environmental Fate and Risk Assessment. Taylor & Francis, Washington. Reiff, B., Lloyd, R., How, M.J., Brown, D., Alabaster, J.S., 1979. The acute toxicity of eleven detergents to fish: Results of an interlaboratory exercise. Water Research 13, 207-210. Sanderson, H., Dyer, S.D., Price, B., Nielsen, A.M., Compernolle, R.V., Selby, M., Stanton, K., Evans, A., Ciarlo, M., Sedlak, R., 2006. Ocurrence and weight-of-evidence risk assessment of alkyl sulfates, alkyl ethoxysulfates, and linear alkylbenzene sulfonates (LAS) in river water and sediments. Science of the Total Environment 368, 695-712. Scott, M.J., Jones, M.N., 2000. The biodegradation of surfactants in the environment. Biochim Biophys Acta 1508, 235-251. Schöberl, P., 1989. Basic principles of LAS biodegradation. Tenside surfactants 26, 86-94. Schöberl, P., Bock, K.J., Huber, L., 1988. Ökologisch relevanten Daten von Tensiden in Wasch- und Reinigungsmitteln (en alemán) [Ecologically relevant data for surfactants in laundry detergents and cleaning agents]. Tenside Surfactants Detergents 25, 86-98. Schröder, F.R., 1995. Concentrations of anionic surfactants in receiving riverine water. Tenside Surf. Det. 32, 492497. V-25 Capítulo 5 Simkins, S., Alexander, M., 1984. Models for mineralization kinetics with the variables of substrate concentration and population density. Appl Environ Microbiol 47, 1299-1306. Singh, R.P., Gupta, N., Singh, S., Singh, A., Suman, R., Annie, K., 2002. Toxicity of ionic and nonionic surfactants to six macrobes found in Agra, India. Bull Environ Contam Toxicol 69, 265-270. Staples, C.A., Naylor, C.G., Williams, J.B., Gledhill, W.E., 2001. Ultimate biodegradation of alkylphenol ethoxylate surfactants and their biodegradation intermediates. Environ Toxicol Chem 20, 2450-2455. Steber, J., 1991. Wie vollständig sind Tenside abbaubar? . Textilveredlung 26, 348-354. Steber, J., Berger, H., 1995. Biodegradability of anionic surfactants. En: Karsa, D.R., R., P.M. (Eds.). Biodegradability of Surfactants. Blackie Academic & Professional, Glasgow, United Kingdom, pp. 134182. Swisher, R.D., 1987. The analytical methods in surfactants biodegradation. Surfactant biodegradation, 2nd Edition, 47, M. Dekker, New York. Temara, A., Carr, G., Webb, S., Versteeg, D., Feijtel, T., 2001. Marine risk assessment: linear alkyl benzene sulponates (LAS) in the North Sea. Mar Pollut Bull 42, 635-642. USEPA, 1998. Fate, transport and transformation test guidelines. OPPTS. "Biodegradability in Sea Water" 835.3160. EPA 712–C–98–351 The Federal Bulletin Board. U.S. Government Printing Office Washington, DC. Verge, C., Moreno, A., Roque, S., 1996. Toxicity of anionic surfactants to green microalgae "Scenedesmus subspicatus" and "Selenastrum capricornutum". Tenside Surfantants Detergents 33, 166-169. White, G.F., Russell, N.J., 1988. Mechanisms of bacterial biodegradation of alkyl sulphate and alkyl-polyethoxy sulphate surfactants. En: D.L. Houghton, R.N.S., H.O.W. Eggins (Ed.). 7th Int. Biodeterioration Symp. Elsevier, Barking, UK, pp. 325-332. Yamane, A.N., Okada, M., Sudo, R., 1984. The growth inhibition of planktonic algae due to surfactants used in washing agents. Water Res. 8, 1101-1105. Ying, G.G., 2006. Fate, behavior and effects of surfactants and their degradation products in the environment. Environ Int 32, 417-431. Yoshimura, K., Masuda, F., 1982. Biodegradation of Sodium Alkyl Poly(oxyalkylene)sulfates. J. Am. Oil Chem. Soc. 59, 328-332. V-26 Capítulo 6 ALCOHOLES ETOXILADOS Resumen Los alcoholes etoxilados (AE) constituyen una de las principales familias de tensioactivos no-iónicos y destacan por su baja-moderada capacidad de formación de espumas, resistencia a la dureza del agua y biodegradabilidad. El siguiente capítulo está dedicado al estudio de la biodegradabilidad y ecotoxicidad del alcohol etoxilado comercial Findet®1214N/23 en agua de mar. Los resultados obtenidos muestran un elevado grado de mineralización bajo las condiciones ensayadas, aunque a baja velocidad (>90% al cabo de 108 días de ensayo). El modelo cinético que mejor describe la cinética de mineralización del tensioactivo en el medio de ensayo consiste en un modelo de orden cero, obteniéndose valores de tiempo de latencia (tL) y tiempo de vida media (t1/2) de 11,5 y 56,8 días, respectivamente. En lo que respecta a la toxicidad, los valores de IC50 (96-h) para las microalgas se encuentran comprendidos entre 5 mg L-1 para C. gracilis y 35,03 mg L-1 para T. chuii, mientras que en el caso del crustáceo marino el valor de LC50 (72-h) calculado es de 23,33 mg L-1. Los ensayos de toxicidad combinados con el experimento de biodegradación muestran una clara detoxificación del medio del ensayo a lo largo del proceso de mineralización del tensioactivo, lo que viene a indicar que el tensioactivo presenta una biodegradación ambientalmente aceptable. Capítulo 6 1. Introducción Alcoholes etoxilados. Características y usos Los alcoholes etoxilados (AE) constituyen una de las familias de tensioactivos noiónicos más utilizadas en productos de limpieza domésticos e industriales, así como en diversos sectores tales como la agricultura, industria textil, industria del papel, etc. Estos tensioactivos fueron desarrollados como una alternativa ambientalmente más lábil que los tensioactivos no iónicos alquilfenoles etoxilados (Scott y Jones, 2000), dada la elevada toxicidad que presentan los metabolitos de degradación de estos últimos (Naylor y col., 1992; Jobling y Sumpter, 1993; Ahel y col., 1994; White y col., 1994; Ahel y col., 1996). Entre sus principales características destacan la baja-moderada capacidad de formación de espumas, resistencia a la dureza del agua y biodegradabilidad. Estas propiedades, tan deseables desde un punto de vista industrial, han provocado el incremento de su producción y consumo en los últimos años. Para el año 2002, el volumen de consumo de AE estimado (empleados exclusivamente en productos domésticos de limpieza) ha sido de 275.000 toneladas (HERA, 2007), mientras que otras estimaciones establecen una producción mundial anual de 1,1 millones de toneladas (Hauthal, 2004). Los alcoholes etoxilados son obtenidos a partir de alcoholes de cadena lineal derivados principalmente de aceite de coco, de grasa animal o sintéticos, a los que se une un número variable de moles de oxido de etileno. En la Figura VI.1 se recoge la estructura química general de los AE (n = número de unidades etoxiladas). R O O OH n Figura VI.1. Estructura molecular del tensioactivo no-iónico alcohol etoxilado (R = CxH2x+1, x= 8-18, n = 0-19). De manera general, las formulaciones de alcoholes etoxilados de uso comercial están compuestas por una mezcla compleja de oligómeros, con una longitud media de cadena etoxilada comprendida entre 1 y 20 unidades, mientras que la cadena hidrocarbonada suele contener entre 8 y 18 átomos de carbono (Mezzanotte y col., 2002). En función del tipo de cadena alquílica presente en la molécula se puede distinguir entre: los alcoholes etoxilados de cadena alquílica lineal y los alcoholes etoxilados de cadena alquílica ramificada. La proporción de oligómeros (número de unidades etoxiladas) generalmente adopta una distribución de Poisson (Swisher, 1987) y afecta a las propiedades VI-2 Alcoholes etoxilados físico-químicas, biodegradabilidad en el medio y uso final (Wang y Fingas, 1993; Ahel y col., 2000; Mezzanotte y col., 2002; Wind y Belanger, 2006). Niveles de alcoholes etoxilados en el medio acuático Tradicionalmente, la determinación de alcoholes etoxilados en influentes y efluentes de estaciones depuradoras de aguas residuales (EDARs) se ha llevado a cabo mediante métodos analíticos cualitativos juntos con otros métodos empleados para el análisis del contenido global en tensioactivos no-iónicos, como por ejemplo el método BiAs (método de la sustancia activa al bismuto). En la actualidad, los esfuerzos están directamente dirigidos hacia el desarrollo de nuevos métodos para la determinación específica de AE a bajas concentraciones en muestras ambientales. Diversos son los estudios que analizan el comportamiento de estos compuestos durante el tratamiento de aguas residuales. Así, por ejemplo, Holt y col. (1992), para una concentración de 3,4 mg L-1 AE en el influente de una EDAR, encontraron concentraciones en el efluente de 40 µg L-1, lo que supone una eliminación del 99%, aproximadamente. Por otro lado, Madsen y col. (2001), encontraron porcentajes de eliminación de los alcoholes etoxilados durante el tratamiento de aguas residuales del 97,5%, con valores de 6-20 µg L-1 AE en el efluente. En un estudio de monitorización llevado a cabo en diferentes EDARs de los Países Bajos se mostraban altos porcentajes de eliminación de los alcoholes etoxilados, siendo la concentración media de AE en los efluentes de 6,2 µg L-1 (Matthijs y col., 1999). La presencia de AE en el medio acuático natural también ha sido objeto de estudio por parte de diversos autores, aunque solamente se han encontrado valores de concentraciones ambientales en agua de río. No obstante, los estudios realizados en agua de río indican una baja presencia de estos compuestos en el medio acuático natural. Así, por ejemplo, Holt y col. (1992) encontraron concentraciones medias de 4 µg L-1 del alcohol etoxilado C14-15 en el río Ohio (EEUU). Por otro lado, estudios llevados a cabo en un río en Japón no encontraron presencia alguna de AE en el compartimento acuático (límite de detección del método ≤ 5 µg L-1), mientras que en muestras de sedimentos las concentraciones variaron entre 0 y 1 mg kg-1 (HERA, 2007). Biodegradabilidad de los alcoholes etoxilados La ruta de biodegradación aerobia de los alcoholes etoxilados (AE) ha sido seguida en numerosos estudios (Osburn, 1966; Patterson, 1970; Swisher, 1987), siendo la más aceptada la propuesta por Marcomini y col. (2000a, 2000b). En la Figura VI.2 se representan los posibles mecanismos aerobios de biodegradación de los alcoholes etoxilados (Marcomini y col., 2000a, 2000b). VI-3 Capítulo 6 Alcohol etoxilado R1 O R2 O Hidrólisis central (mecanismo a) OH n Hidrólisis oxidativa (mecanismo c) ω-oxidación (mecanismo b) O R1 OH R2 + HO Alcohol O R1 OH HO n Polietilenglicol R1 O R3 O O R2 n Alcohol etoxilado carboxilado O OH Hidrólisis oxidativa O Ácido graso HO O O OH HO n-m PEG monocarboxilado R1 R3 O O OH n O Alcohol etoxilado dicarboxilado + Acortamiento no oxidativo β-oxidación Hidrólisis O HO ω-oxidación Hidrólisis oxidativa R1 R2 OH O O Alcohol etoxilado carboxilado β-oxidación Hidrólisis Oxidación OH O PEG OH n-m HO O O O OH n-m PEG dicarboxilado Figura VI.2. Rutas de biodegradación aerobia propuesta para los tensioactivos no-iónicos alcoholes etoxilados (AE) (R1= -H para alcoholes lineales, cadena alquílica lineal o ramificada de 1-6 átomos de carbono para alcoholes ramificados; R2= cadena alquílica lineal de 10 átomos de carbono; R3= cadena alquílica lineal de 9 átomos de carbono; m= número par) (Marcomini y col., 2000a, 2000b). Un posible mecanismo consiste en la ruptura central de la molécula (mecanismo a), dando lugar a la formación de polietilenglicol con la misma longitud que la cadena etoxilada, y los correspondientes alcoholes. Posteriormente, las moléculas de polietilenglicol son degradadas mediante un mecanismo hidrolítico y/ó hidrolítico oxidativo con la consiguiente formación de polietilenglicol mono y/ó dicarboxílico. Por otro lado, los alcoholes son transformados en los correspondientes ácidos grasos y posteriormente incorporados a las rutas metabólicas comunes de los ácidos grasos. VI-4 Alcoholes etoxilados Otro posible mecanismo consiste en una oxidación del carbono terminal de la cadena alquílica (ω-oxidación) originando la formación de alcoholes etoxilados carboxilados y en última instancia (vía β-oxidaciones) una serie de polietilenglicoles carboxilados (mecanismo b). Finalmente, una tercera posibilidad consiste en un ataque primario al carbono terminal de la cadena polietoxilada mediante un proceso hidrolítico similar al que muestran los tensioactivos no iónicos del tipo alquilfenol polietoxilado (mecanismo c), dando lugar a alcoholes etoxilados carboxilados de cadenas más cortas y finalmente, tras un proceso de ω- y β-oxidaciones e hidrólisis, polietilenglicol dicarboxilado. A pesar de las diferentes posibles vías de degradación, estudios realizados sobre diversos AE parecen indicar que, en el caso de AE lineales y la mayoría de los monoramificados, el principal mecanismo de biodegradación consiste en la ruptura del enlace central (mecanismo a), mientras para el resto de alcoholes etoxilados ramificados el mecanismo principal propuesto consiste en la biodegradación primaria a través de una ωoxidación a la cadena polietoxilada (mecanismo b) (Marcomini y col., 2000a, 2000b). Por el contrario, en condiciones anaerobias, la ruptura del grupo terminal etoxi parece ser la fase inicial del ataque microbiano (mecanismo c; Huber et al., 2000). Numerosos son los estudios que se han encontrado en la bibliografía en relación a la biodegradabilidad primaria y final de los AE en el medio acuático. No obstante, la mayoría de estos estudios emplean como medio de ensayo agua continental o bien un medio mineral. De manera general, los alcoholes etoxilados son considerados fácilmente biodegradables bajo condiciones aerobias y anaerobias (Ying, 2006), alcanzando altos porcentajes de biodegradación primaria en unidades de lodos activos y otros ambientes acuáticos, aunque su mineralización presenta valores significativamente más bajos (Reynolds y col., 1997). En las Tablas VI.1 y VI.2 se recogen algunos de los resultados de mineralización de los alcoholes etoxilados, tanto lineales como ramificados, encontrados en la bibliografía. VI-5 Capítulo 6 Tabla VI.1. Resumen de los datos de biodegradación final o mineralización de alcoholes etoxilados lineales (Madsen y col., 2001). Compuesto Tipo de ensayo Resultado C9-11 EO8 Frasco cerrado, 28 d 80% DTO Referencia Madsen y col., 1994 C16-18 EO5 Frasco cerrado, 28 d 65-75% DTO Schöberl y col., 1988 27% DTO C16-18 EO30 Frasco cerrado, 28 d C12-18 EO10-14 Frasco cerrado, 28 d 69-86% DTO C12-15 EO7 BOD, 30 d 92% DTO C14-15 EO7 BOD, 30 d 83% DTO C12-15 EO7 Evolución CO2, 28 d 82% DTCO2 Madsen y col., 1996 C12-15 EO9 Evolución CO2, 28 d 64-79% DTCO2 Kravetz y col., 1991 C12-14 EO7-8 Ensayo de agua de río, 28 d 100% COD Kaluza y Taeger, 1996 C13 EO7-8 Ensayo de agua de río, 28 d 100% COD C13-15 EO7-8 Ensayo de agua de río, 28 d 100% COD Kravetz y col., 1991 Ensayo de agua de río, 28 d 100% COD C15 EO7-8 *DTO= demanda teórica de oxígeno; DTCO2=demanda teórica de dióxido de carbono; COD= carbono orgánico disuelto Tabla VI.2. Resumen de los datos de biodegradación final o mineralización de alcoholes etoxilados ramificados (Madsen y col., 2001). Compuesto Tipo de ensayo Resultado Oxo-C13-15 EO3-12 Ensayo OECD, 28 d 75% COD Referencia Schöberl y col., 1988 C10-14 EO7 (átomo de C cuaternario) BOD, 30 d 40% DTO Kravetz y col., 1991 Oxo-C12 EO5 Evolución CO2, 28 d C11-15 EO7 (átomo de C cuaternario) Evolución CO2, 28 d > 60% DTCO2 Marcomini y col., 2000a 40-50% DTO Kravetz y col., 1991 Iso-C10 EO7-8 Ensayo de agua de río, 28 d 90% COD Oxo-C11 EO7-8 Ensayo de agua de río, 28 d 100% COD Iso-C13 EO7-8 (3 grupos –CH3) Ensayo de agua de río, 28 d 100% COD Iso-C13 EO7-8 (4 grupos –CH3) Ensayo de agua de río, 28 d 62% COD C13 EO7-8 (10% ramificación) Ensayo de agua de río, 28 d 95% COD C13 EO7-8 (25% ramificación) Ensayo de agua de río, 28 d 95% COD C13 EO7-8(46% ramificación) Ensayo de agua de río, 28 d 50% COD Oxo-C13-15 EO7-8 Ensayo de agua de río, 28 d 100% COD Oxo-C14-15 EO9-20 Ensayo de agua de río, 28 d 65-75% COD Kaluza y Taeger, 1996 Schöberl y col., 1988 Kaluza y Taeger, 1996 C15 EO7-8 Ensayo de agua de río, 28 d 100% COD DTO= demanda teórica de oxígeno, DTCO2=demanda teórica de dióxido de carbono; COD= carbono orgánico disuelto VI-6 Alcoholes etoxilados La biodegradabilidad de los AE depende principalmente de la estructura de la cadena alquílica y, en menor medida, de su longitud así como del número de unidades etoxiladas presentes en la molécula (Dorn y col., 1993). De manera general, los alcoholes grasos lineales presentan un mayor grado de biodegradabilidad que los alcoholes ramificados (Tabla VI.1, Tabla VI.2). En el caso de alcoholes etoxilados ramificados, uno de los principales factores que afectan a la biodegradabilidad de estos compuestos es el número de ramificaciones presentes en la cadena alquílica. Kaluza y Taegar (1996), usando alcoholes etoxilados ramificados de similar número de átomos de carbono en la cadena alquílica pero con diferente grado de ramificación (C13 EO7-8), encontraron porcentajes de mineralización menores para aquellos que presentaban mayor grado de ramificación (Tabla VI.2). También observaron una disminución de la biodegradabilidad de los AE ramificados (Iso-C13 EO7-8) a medida que aumentaba el número de grupos metilos en la cadena alquílica. Por otro lado, la ramificación de la cadena alquílica no sólo se ha demostrado afectar a la extensión de la biodegradación sino también a su velocidad, siendo más lenta cuanto mayor es el grado de ramificación (Holt y col., 1992; Balson y Felix, 1995). También se ha demostrado que la presencia de átomos de carbono cuaternarios en la molécula afecta negativamente a la biodegradabilidad de estos tensioactivos. Así, por ejemplo, estudios realizados por Kravetz y col. (1991) encontraron porcentajes de mineralización muy bajos (40-50%) para los alcoholes etoxilados que presentan átomos de carbono cuaternarios en la cadena alquílica en comparación con otros alcoholes etoxilados ramificados (Tabla VI.2). En lo que respecta a la longitud de la cadena etoxilada, ésta influye en la hidrofobicidad del AE influyendo así en la biodegradabilidad en términos de biodisponibilidad. Así, a medida que aumenta la longitud de la cadena etoxilada disminuye la biodisponibilidad del tensioactivo como consecuencia de un descenso de la hidrofobicidad y un aumento del tamaño molecular, limitando el transporte de la molécula a través de la pared celular (Balson y Felix, 1995). En aquellos alcoholes etoxilados compuestos por más de 20 unidades etoxiladas, se ha observado una disminución de su velocidad de degradación (Scharer y col., 1979; Holt y col., 1992), mientras que en aquellos con más de 50 unidades etoxiladas se ha encontrado un aumento del porcentaje de biodegradación primaria (Birch, 1984). Toxicidad de los alcoholes etoxilados en el medio acuático La evaluación de la toxicidad, tanto aguda como crónica, de los alcoholes etoxilados ha sido objeto de estudio de diversos autores. Existe una amplia bibliografía acerca de la toxicidad de estos compuestos sobre diferentes grupos taxonómicos: bacterias, VI-7 Capítulo 6 algas, insectos, moluscos, crustáceos, peces y plantas acuáticas. No obstante, cabe destacar que la mayoría de estos estudios se han llevado a cabo sobre especies de agua dulce, siendo, por lo tanto, bastante limitada la bibliografía existente en relación a la toxicidad de estos tensioactivos sobre especies marinas. El mecanismo de toxicidad de los AE consiste en una narcosis de tipo no polar, caracterizado por la interacción entre el tensioactivo y las membranas biológicas de los organismos (Roberts, 1991; Boeije y col., 2006). Sin embargo, el efecto tóxico de estos contaminantes está claramente relacionado con su hidrofobicidad. En general, los homólogos de AE de mayor cadena alquílica y, por tanto más hidrófobos, pueden penetrar en la pared celular con mayor eficiencia, siendo, por lo tanto, más tóxicos (Boeije y col., 2006). Sin embargo, estos homólogos deben de ser, a su vez, lo suficientemente solubles para permitir entrar en contacto con el organismo (biodisponibilidad). Así, por ejemplo, en el caso de alcoholes etoxilados con cadena alquílica igual o superior a 15 átomos de carbono, para los cuales cabe esperar una toxicidad elevada, ésta disminuye como consecuencia de su baja solubilidad (SIAR, 2006). Los datos recogidos en la bibliografía en torno a la toxicidad de los AE, tanto lineales como ramificados, sobre organismos acuáticos, en general, presentan una elevada variabilidad inter- e intra-especifica (Tablas VI.3 y VI.4). Van de Plassche y col. (1999) establecieron que esta elevada variabilidad puede ser debido a la heterogeneidad que presentan la mayoría de las formulaciones de los AE de uso comercial, las cuales suelen estar constituidos por mezclas de varias longitudes de cadena alquílica y número de unidades etoxiladas. Otra posible fuente de variabilidad en los datos de toxicidad radica en la presencia de un 2-5 % de alcohol no etoxilado y entre un 0,5 y 2 % de polietilenglicol en muchas de las formulaciones comerciales (Van de Plassche y col., 1999). Otros autores defienden que estas diferencias también pueden deberse a las diferentes condiciones usadas en los ensayos (HERA, 2007). En general, los valores de toxicidad (EC50) de los AE sobre microalgas varían entre 0,05 y 50 mg L-1, mientras que para el caso de invertebrados los valores de efectos tóxicos agudos (EC50) suelen estar comprendidos entre 0,1 y >100 mg L-1, para AE lineales y, entre 0,5 y 50 mg L-1, para el caso de AE ramificados (D. EPA, 2001). Asimismo, Lewis y Suprenant (1983), para el caso de invertebrados, obtuvieron para un mismo alcohol etoxilado valores de toxicidad (LC50, 48-h) comprendidos entre 0,29 y 270 mg L-1, dependiendo de la especie ensayada. VI-8 Alcoholes etoxilados Tabla VI.3. Resumen de datos de toxicidad aguda (EC50) de alcoholes etoxilados lineales y ramificados sobre microalgas. Especie AE Selenastrum capricornutum C12-14 EO4 Scenedesmus subspicatus Microcystis aeruginosa EC50 (mg L-1) 2-4 Periodo Referencia 48 h Yamane y col., 1984 C12-14 EO9 4-8 48 h C12-14 EO13 10 48 h C12-15 EO9 0,7 96 h C13 EO7 7,5 96 h C11-15 EO7 10,0 96 h C12-15 EO7 0,85 72 h C14-15 EO6 0,09 96 h Lewis y Hamm, 1986 C13 EO7-8 0,5 72 h Kaluza y Taeger, 1996 C15 EO7-8 0,05 72 h C12-14 EO7 0,5 72 h Iso-C10 EO7-8 50 72 h Iso-C13 EO7-8 5 72 h C13-15 EO7-8 0,5 72 h Oxo-C13-15 EO7-8 0,5 72 h C12-14 EO9 10-50 72 h Dorn y col., 1993 Madsen y col., 1996 Yamane y col., 1984 C14-15 EO6 0,60 96 h Lewis y Hamm, 1986 Nitzschia fonticola C12-14 EO9 5-10 48 h Yamane y col., 1984 Navicula pelliculosa C14-15 EO6 0,28 96 h Lewis y Hamm, 1986 Estudios realizados por Yamane y col. (1984) sobre la microalga S. capricornutum y AE lineales de igual longitud de cadena alquílica (C12-14) mostraron que la toxicidad de los alcoholes etoxilados lineales disminuye a medida que aumenta el numero de unidades etoxiladas (Tabla VI.3). En el caso de crustáceos, este hecho ha sido puesto de manifiesto en los ensayos realizados por Maki y Bishop (1979) y posteriormente Wong y col. (1997) sobre la especie D. magna (Tabla VI.4). Por otro lado, Kaluza y Taeger (1996), en ensayo de toxicidad con S. subspicatus obtuvieron valores de EC50 de 0,5 y 0,05 mg L-1 para los tensioactivos C13 EO7-8 y C15 EO78, lo cual supone un aumento de la toxicidad a medida que aumenta la longitud de la cadena hidrocarbonada (Tabla VI.3). Sin embargo, para el crustáceo D. magna estos autores (Kaluza y Taeger, 1996) no observaron diferencias significativas en los efectos adversos producidos por ambos tensioactivos (Tabla VI.4). En el caso de alcoholes etoxilados ramificados también se ha observado un incremento de la toxicidad sobre microalgas al aumentar el número de átomos de carbono de la cadena hidrocarbonada (Kaluza y Taeger, VI-9 Capítulo 6 1996). Estudios llevado a cabo por la Agencia de Protección Ambiental de Dinamarca (D. EPA, 2001) mostraron que un aumento en el grado de ramificación de la cadena alquílica de los AE provoca una disminución de la toxicidad de estos tensioactivos tanto en microalgas como en invertebrados acuáticos. Tabla VI.4. Resumen de datos de toxicidad aguda (LC50/EC50 a las 48 horas) de alcoholes etoxilados lineales y ramificados sobre invertebrados. AE Mysidopsis bahia C10 EO4 C13 EO10 2,2 Daphnia magna C12-13 EO5 0,46 C12-13 EO4.5-6 0,59 C12-13 EO6.5 0,74 C14-15 EO13 1,2 Daphnia pulex VI-10 EC50 (48-h) (mg L-1) 5,6 Especie C15 EO7-8 0,5 C12-14 EO7-8 0,5 Referencia Hall y col., 1989 Wong y col., 1997 Kaluza y Taeger, 1996 C13 EO7-8 0,5 C13-15 EO7-8 0,5 C12-15 EO7 1,0-2,0 C12-15 EO9 1,3 Dorn y col., 1993 C14-15 EO7 0,29-0,4 Lewis y Perry, 1981 C14 EO1 0,83 Maki y Bishop, 1979 C14 EO2 1,53 C14 EO3 0,73 C14 EO4 1,76 C14 EO6 4,17 C14 EO9 10,07 C16-18 EO18 20 C16-18 EO30 18 Madsen y col., 1996 Talmage, 1994 C12-15 EO7 0,76 Salanitro y col., 1988 C14 EO1 0,10 Maki y Bishop, 1979 C14 EO4 0,21 Paratanytarus parthenogenica Gammarus sp. C14-15 EO7 23 C14-15 EO7 3,3 Asellus sp. C14-15 EO7 270 Lewis y Suprenant, 1983 Alcoholes etoxilados 2. Materiales A continuación se detallan las principales características del tensioactivo así como del medio de ensayo empleado en los estudios de biodegradación y ecotoxicidad. Tensioactivo ensayado El tensioactivo no-iónico ensayado fue un alcohol etoxilado conocido comercialmente como Findet®1214N/23 y suministrado por Kao Corporation, S. A. (Barcelona). El tensioactivo consiste en una mezcla de homólogos de cadena alquílica lineal de entre 12 y 14 átomos de carbono, en una proporción aproximada de 70% y 30%, respectivamente, y un valor medio de 11 unidades etoxiladas. Posee una pureza aproximada del 100 %, una densidad de 1,007 g cm-3 y una elevada solubilidad en agua. El peso molecular medio estimado es de 630 g mol-1 (Sabahi, 2004). Medio de ensayo El medio de ensayo empleado en los ensayos de biodegradación y toxicidad del alcohol etoxilado fue el mismo que el utilizado en los ensayos con el tensioactivo alquil etoxisulfato (capítulo 5). No obstante, al objeto de facilitar la lectura del presente trabajo se resumen las principales características físico-químicas y biológicas del agua de mar empleada en los ensayos de biodegradación y toxicidad (Tabla VI.5). Tabla VI.5. Características del agua de mar empleada en los ensayos de biodegradación y toxicidad del tensioactivo no-iónico Findet®1214N/23. Parámetro Unidades Valor Parámetro Unidades -1 Valor - Oxígeno disuelto % saturación 92,7 ± 1,8 Nitrato mg L NO3 Temperatura ºC 12,5 ± 0,3 Amonio mg L-1 NH4+ < 0,007 Conductividad mS cm-1 50,9 ± 0,2 Fosfato mg L-1 PO43- < 0,015 pH - 8,14 ± 0,04 Silicato mg L-1 Si 0,021 ± 0,003 Salinidad - 38,5 ± 0,5 Dureza total mg L-1 Ca2+ 418 ± 14 Carbono total mg L-1 C 26,9 ± 0,5 Clorofila a mg m-3 Cl a 0,73 ± 0,12 Carbono inorgánico mg L-1 C 26,4 ± 0,5 Estreptococos fecales UFC·100mL-1 No detectado -1 0,033 ± 0,009 Carbono orgánico mg L C 0,50 ± 0,01 Coliformes fecales UFC·100mL-1 No detectado Nitrito mg L-1 NO2- < 0,015 Enterococos UFC·100mL-1 No detectado VI-11 Capítulo 6 3. Resultados y discusión En el siguiente apartado se exponen los resultados obtenidos en los ensayos de biodegradación, de toxicidad con microalgas y crustáceos marinos y en los ensayos combinados de toxicidad durante el experimento de biodegradación. 3.1. Ensayos de biodegradación Parámetros de control Al objeto de comprobar que durante el ensayo se daban unas condiciones no limitantes para la proliferación y desarrollo de las poblaciones bacterianas originarias, se llevó a cabo un control de los parámetros físico-químicos pH, oxígeno disuelto y temperatura en los ensayos de biodegradación, referencia, abiótico y control. En la Figura VI.3 se recogen la evolución del pH y oxígeno disuelto en los ensayos de biodegradación y en el control. 100 8,2 80 O2 (%saturación) 8,4 pH 8,0 7,8 CO4 AE1 AE2 AE3 7,6 7,4 60 40 CO4 AE1 AE2 AE3 20 0 0 20 40 60 Tiempo (d) 80 100 120 0 20 40 60 80 100 120 Tiempo (d) Figura VI.3. Evolución del pH y oxígeno disuelto en el ensayo control (CO4) y los ensayos de biodegradación con AE (AE1, AE2 y AE3). Se puede apreciar como los valores de pH se mantienen prácticamente constantes a lo largo del experimento tanto en los ensayos de biodegradación como en el ensayo control, alcanzando valores medios similares (valor medio ± DE) de 8,03 ± 0,1 y 8,05 ± 0,1, respectivamente. Por otro lado, se observa que los valores de oxígeno disuelto en los ensayos de biodegradación y el control se encuentran, de manera general, por encima de un 80% de saturación, mostrando porcentajes medios de 87,76 ± 0,26% y 87,9 ± 3,2%, respectivamente. VI-12 Alcoholes etoxilados En el caso de la temperatura, los valores medios registrados durante el experimento fueron de 19,9 ± 0,15 °C y 19,8 ± 0,4 ºC, para los ensayos de biodegradación y control, respectivamente. Respecto al ensayo de referencia (benzoato sódico), los valores de pH, temperatura y oxígeno disuelto estuvieron comprendidos entre 8,00 ± 0,1; 20,5 ± 0,05 ºC y 85,5 ± 13,97 % de saturación, respectivamente. Los resultados obtenidos en este apartado indican claramente que el experimento de biodegradación del tensioactivo no-iónico Findet®1214N/23 se llevó a cabo bajo condiciones experimentales no limitantes para el desarrollo óptimo de la microbiota responsable de la actividad degradativa. Evolución del carbono orgánico disuelto en los ensayos control, referencia y abiótico Concentración (mg COD L-1) La evolución del carbono orgánico disuelto (COD) en los ensayos control, referencia (benzoato sódico) y abiótico (Findet®1214N/23 + HgCl2) se representa gráficamente en la Figura VI.4. 20 15 10 REF4 AB4 CO4 5 0 0 20 40 60 80 100 120 Tiempo (d) Figura VI.4. Evolución del carbono orgánico disuelto en los ensayos control (CO4), referencia (REF4) y abiótico (AB4) a lo largo del proceso de biodegradación. Se puede apreciar como en el caso del ensayo control y abiótico, la concentración de COD permanece prácticamente constante a lo largo del experimento, alcanzando valores medios de 0,72 ± 0,3 y 16,27 ± 0,6 mg L-1 COD (valor medio ± DE), respectivamente. En el caso del ensayo abiótico, estos valores suponen una mineralización del tensioactivo del VI-13 Capítulo 6 2,3 ± 2,5%, lo que viene a indicar que la aportación de procesos no biológicos en la eliminación del tensioactivo no iónico Findet®1214N/23 es prácticamente despreciable. En el caso del ensayo de referencia, cabe destacar que se emplearon los resultados obtenidos para el tensioactivo alquil etoxisulfato (capítulo 5), dado que las muestras de agua de mar fueron tomadas al mismo tiempo y en el mismo lugar. Al objeto de facilitar la lectura del presente capítulo se han representado los datos en la Figura VI.4, observándose porcentajes de biodegradación superiores al 50% y 90% al cabo de 6 y 9 días de ensayo, respectivamente. Tal y como se comentó en el capítulo anterior, estos valores indican que la población microbiana presente en el medio de ensayo presenta una actividad dentro de la normalidad. Evolución del carbono orgánico disuelto en los ensayos con tensioactivo En la Figura VI.5 se representan los valores de concentración de Findet®1214N/23 (mg L COD) a lo largo del proceso de mineralización para los tres ensayos de biodegradación realizados. Los puntos indican los valores medios experimentales, mientras que las barras de error denotan la desviación estándar (n=3). -1 Concentración (mg COD L ) -1 16 14 12 10 8 6 4 2 0 0 20 40 60 80 100 120 Tiempo (d) Figura VI.5. Evolución de la concentración residual de Findet®1214N/23 (mg COD L-1) en los ensayos de biodegradación. La línea continua corresponde al ajuste de los valores experimentales a un modelo cinético de orden cero. En la Figura VI.5, se observa una disminución de la concentración de carbono orgánico disuelto (COD) a lo largo del experimento, alcanzando valores medios de COD de 11,5, 7,5 y 0,81 mg L-1 al cabo de 22, 60 y 108 días de ensayo, respectivamente, esto es, porcentajes de mineralización del 25, 55 y 90%. Atendiendo a los criterios establecido en la VI-14 Alcoholes etoxilados directriz OPPTS 835.3160 “Biodegradabilidad en agua de mar” (USEPA, 1998), los valores obtenidos en el presente experimento (eliminación de COD inferior al 70 % al cabo de 60 días de ensayo) no descartan la existencia de un potencial para la mineralización de estos compuestos en el medio ambiente marino, aunque sugieren la realización de nuevos experimentos de biodegradación (por ejemplo, empleando concentraciones más próximas a las ambientales) para corroborar esta hipótesis. Sin embargo, los altos niveles de biodegradación alcanzados en el medio, hacen pensar que realmente existe un potencial para la degradación de estos tensioactivos, aunque a una baja velocidad de degradación. Otro de los aspectos importantes que se desprende de la Figura VI.5 es la ausencia de una fase de adaptación o inducción por parte de los microorganismos responsables del proceso biodegradativo a la nueva fuente de carbono. Esto puede ser debido a que, dado que se trata de un alcohol etoxilado de cadena alquílica lineal, las enzimas que intervienen en el mecanismo de degradación son fundamentalmente de tipo hidrolíticas (mecanismo a, Figura VI.2), las cuales podrían ser más frecuentes en el sistema enzimático de la microbiota natural o bien ser sintetizadas rápidamente (Manzano y col., 1998). Modelización cinética Siguiendo el planteamiento seguido en los anteriores capítulos, se ha modelizado la cinética de mineralización del tensioactivo Findet®1214N/23 en los tres ensayos de biodegradación, empleando diversos modelos cinéticos de consumo de sustrato recogidos en la bibliografía (Simkins y Alexander, 1984; Quiroga y col., 1999). Los parámetros cinéticos y estadísticos calculados para cada uno de los modelos estudiados se recogen en la Tabla VI.6. En primer lugar se comprueba que todos los modelos estudiados presentan un buen ajuste, si bien en el caso del modelo de primer orden se obtiene un valor del coeficiente de determinación ligeramente inferior (R2= 0,9186). Sin embargo, un estudio más detallado de los valores de los parámetros cinéticos obtenidos demuestra que sólo en el caso de los modelos cinéticos de orden cero, primer orden y logístico, se obtiene parámetros con valores coherentes de S0 (concentración inicial de substrato). Así, por ejemplo, en el caso del modelo de Quiroga, Sales y Romero (Q-S-R), se obtiene un valor negativo de concentración de substrato no biodegradable (Snb), mientras que el valor de la concentración inicial estimada (S0) es muy superior a la concentración real ensayada. En el caso del modelo logístico, a pesar de obtener una buena correlación con los datos experimentales y un valor coherente de S0, el valor calculado de B0 (cantidad de sustrato necesaria para producir la concentración inicial de sustrato) resulta injustificablemente alto en comparación con los obtenidos por otros autores (Perales y col., 2001). Estos resultados parecen razonables ya que dichos modelos contemplan una fase de latencia o aclimatación, la cual no ha sido observada en nuestro estudio. VI-15 Capítulo 6 Al objeto de seleccionar cual de los dos modelos restantes (orden cero o primer orden) es el más apropiado para describir la cinética de mineralización del tensioactivo se recurre al análisis de la chi-cuadrada (χ2). Si atendemos a los valores obtenidos para el parámetro estadístico Q (probabilidad de que la chi-cuadrado exceda al azar un determinado valor χ2 teórico) se observa que en el caso del modelo de orden cero el valor de Q se encuentra más próximo a la unidad, lo que viene a indicar que las posibles variaciones entre los valores experimentales y los obtenidos por el modelo pueden estar debidos a fluctuaciones experimentales y no a una falta de ajuste de los datos experimentales al modelo. Se puede concluir, por tanto, que el modelo cinético que mejor describe la mineralización del tensioactivo no-iónico AE en el medio marino y bajo las condiciones ensayadas es el modelo de orden cero. En la Figura VI.5 se representa mediante una línea continua los valores obtenidos al ajustar los valores experimentales al modelo cinético de orden cero. Tabla VI.6. Parámetros cinéticos y estadísticos correspondientes a los resultados de biodegradación de AE en agua de mar. Modelo Orden cero (Simkins y Alexander, 1984) Primer-orden (Simkins y Alexander, 1984) Logístico (Simkins y Alexander, 1984) Q-S-R (Quiroga y col., 1999) a Parámetro cinético -1 Valor a S0 (mg COD L ) 14,48 ± 1,92 K0 (mg COD L-1 d-1) 0,12 ± 0,03 S0 (mg COD L-1) 15,76 ± 2,95 -1 K1 (d ) 0,016 ± 0,06 S0 (mg COD L-1) 14,43 ± 2,81 B0 (mg COD L-1) -1 3,66 ± 0,94 -1 KLg (mg COD L d ) 0,002 ± 0,002 S0 (mg COD L-1) 46,33 ± 415 Sto (mg COD L-1) 23,03 ± 72,06 Snb (mg COD L-1) -3,23 ± 37,41 μmax (d-1) 0,022 ± 0,101 Parámetros estadísticos R2 χ2 ν Q 0,94 55,37 50 0,279 0,92 152,81 50 2,4E-12 0,94 67,16 49 0,043 0,94 860,85 48 1,8E-149 Datos presentados como valor medio ± DE (n=3) El tiempo de latencia (tL), t50 (el tiempo necesario para alcanzar un 50% de biodegradación, sin considerar el tiempo de latencia), y el tiempo de vida media (t1/2) se calcularon a partir de la ecuación integrada del modelo cinético de orden cero (véase capítulo 1). Los valores obtenidos fueron 11,5, 43,5 y 56,8 días, respectivamente. Cabe destacar que aunque desde un punto de vista cualitativo en la Figura VI.5 no se observa una fase inicial de aclimatación o latencia, con fines comparativos frente a otros tensioactivos, VI-16 Alcoholes etoxilados se ha tomado como valor del tiempo de latencia, el periodo transcurrido hasta lanzar una degradación del 10%, si bien este valor es tan elevado (11,5 días) debido a la lentitud del proceso. Lechuga (2005), empleando un medio mineralizado inoculado con microorganismos procedente de una EDAR, encontró un elevado grado de biodegradación primaria (>80%) y velocidad de degradación (t1/2 entre 19,7 y 30,7 horas) para el mismo tensioactivo que en el presente estudio (Findet®1214N/23, C12EO11) y utilizando concentraciones iniciales comprendida entre 5 y 50 mg L-1. Por el contrario, estudios llevados a cabo por Kravetz y col. (2001) mostraron velocidades de mineralización muy inferiores para el tensioactivo C12EO9 y el mismo medio de ensayo (inóculo procedente de una unidad de lodos activos). Dependiendo de si el inoculo estaba previamente aclimatado o no al tensioactivo, estos autores, empleando una concentración inicial de 10-20 mg C L-1, obtuvieron valores de mineralización superiores al 80% al cabo de 30 días de ensayo (inóculo aclimatado) y comprendidos entre un 64 y 79% al cabo de 28 días (inóculo sin aclimatar). Estos valores resultan similares a los obtenidos por Madsen (1996) en una unidad de lodos activos y en el efluente secundario de una EDAR. Así, para el tensioactivo C12-15EO7 y en la unidad de lodos activos, obtuvo una mineralización del 82% al cabo de 28 días mientras en el efluente el porcentaje de mineralización alcanzado para el mismo tensioactivo fue del 60% al cabo de 28 días. En el caso de agua de río, también se ha puesto de manifiesto una elevada biodegradabilidad de estos compuestos, con velocidades de biodegradación comparables a los obtenidos en medios minerales inoculados. Así, por ejemplo, Kaluza y Taeger (1996), en ensayos de biodegradación realizados en agua de río y empleando una concentración inicial superior a 10 mg L-1, obtuvo una completa mineralización del tensioactivo C12-14EO7-8 al cabo de 28 días de ensayos. La comparación de estos datos con los obtenidos en el presente capítulo (90% mineralización en 108 días, tiempo de vida media= 56,8 días) parecen indicar que el medio de ensayo juega un papel fundamental en la velocidad de degradación de los AE, siendo ésta muy inferior en el medio marino. Diversos estudios también han puesto de manifiesto la menor velocidad de degradación de diferentes compuestos en el medio acuático marino en comparación con medios de agua dulce. Así, por ejemplo, Perales y col. (2007), obtuvieron una menor biodegradación primaria del tensioactivo aniónico lineal alquil benceno sulfonatos (LAS) en agua de mar que en agua de río bajo las mismas condiciones experimentales. Jeong-Hun y Fusao (2005) mostraron también diferencias significativas en la velocidad de degradación del compuesto fenólico bisfenol A, siendo menor en agua de mar. Resultados similares se han obtenido para otras sustancias químicas tales como la benzo(a)pirina (Kot-Wasik y col., 2004) y el homopolímero (poli-3-hidroxibutirato) (Kasuya y col., 1998). VI-17 Capítulo 6 3.2. Ensayos de toxicidad aguda estándar Ensayos de toxicidad con microalgas marinas En la Figura VI.6 se muestra la evolución temporal de la concentración neta de biomasa (densidad óptica neta, DOn = DOt=t – DOt=0) para diferentes concentraciones de exposición de Findet®1214N/23 en los ensayos estándar de toxicidad con microalgas. Como puede observarse en dicha figura, los cultivos de microalgas respondieron de manera diferente a la presencia del tensioactivo Findet®1214N/23. De manera general, se aprecia una disminución de la biomasa de microalgas con respecto al ensayo control a medida que aumenta la concentración de tensioactivo. Así, la microalga D. salina experimenta efectos sobre el crecimiento a concentraciones superiores a 12 mg L-1, mientras que T. chuii e I. galbana muestran diferencias significativas con respecto al ensayo control a concentraciones superiores de 8 mg L-1. Por el contrario, se puede observar como el tensioactivo tiene un mayor efecto tóxico sobre las microalgas N. gaditana y C. gracilis, para las cuales se observan efectos inhibitorios sobre el crecimiento a concentraciones iguales o superiores a 4 y 6 mg L-1, respectivamente. Por otro lado, se puede observar que en el caso de las microalgas I. galbana, C. gracilis y D. salina se obtienen valores de DOn (690 nm) negativos a concentraciones superiores a 10 y 14 mg L-1, respectivamente, lo indica no sólo efectos inhibitorios sino letales sobre estos cultivos de microalgas. Sin embargo, podemos apreciar como I. galbana y C. gracilis después de un periodo de 48-h experimentan una recuperación del cultivo para los ensayos realizados con 10 y 6 mg L-1 de tensioactivo, respectivamente. VI-18 Alcoholes etoxilados 1,0 0,6 10 mg L-1 0,4 0,2 0,0 I. galbana 0 2 4 6 8 1,0 DOn (690 nm) DOn (690 nm) 0,8 1,2 N. gaditana 0 2 4 6 8 0,8 10 mg L-1 0,6 0,4 0,2 0,0 -0,2 -0,2 0 20 40 60 80 100 0 20 Tiempo (h) 0,4 60 80 100 80 100 C. gracilis 0 2 4 6 8 0,3 DOn (690 nm) 40 Tiempo (h) 0,2 10 mg L-1 0,1 0,0 -0,1 -0,2 0 20 40 60 80 100 Tiempo (h) 2,5 1,5 14 mg L-1 1,0 0,5 0,0 T. chuii 0 4 8 16 28 1,2 DOn (690 nm) DOn (690 nm) 2,0 1,4 D. salina 0 4 8 10 12 1,0 0,8 36 mg L-1 0,6 0,4 0,2 0,0 -0,5 -0,2 0 20 40 60 Tiempo (h) 80 100 0 20 40 60 Tiempo (h) Figura VI.6. Evolución de la concentración de biomasa normalizada en el ensayo estándar. Las barras de error denotan las desviaciones estándares (n=3) VI-19 Capítulo 6 En la Tabla VI.7 se recogen los valores de las concentraciones de inhibición del crecimiento (IC50), NOEC y LOEC para cada una de las microalgas ensayadas y un periodo de exposición de 96 horas. Tabla VI.7. Valores de IC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con microalgas marinas y el tensioactivo Findet®1214N/23. Organismo Efecto tóxico Concentración (mg L-1) N. gaditana 96-h IC50 5,84 (5,52-6,19)a 96-h NOEC 2,0b 96-h LOEC 4,0b 96-h IC50 9,08 (8,69-9,42)a 96-h NOEC 6,0b 96-h LOEC 8,0b 96-h IC50 5,00 (4,70-5,42)a 96-h NOEC 4,0b 96-h LOEC 6,0b 96-h IC50 11,58 (8,84-13,42)a 96-h NOEC 10,0b 96-h LOEC 12,0b 96-h IC50 35,03 (33,16-36,44)a 96-h NOEC 4,0b I. galbana C. gracilis D. salina T. chuii 96-h LOEC 8,0b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a A la vista de los valores mostrados en la Tabla VI.7, se puede comprobar la existencia de distintas sensibilidades hacia el tensioactivo no-iónico Findet®1214N/23 por las distintas especies de microalgas. Así, se puede observar como las especies N. gaditana y C. gracilis resultan especialmente sensibles a la presencia del agente de superficie, con valores similares de IC50. Por el contrario, I. galbana y D. salina presentan una toxicidad ligeramente menor que las microalgas anteriores. Finalmente, la microalga T. chuii presenta una resistencia mucho mayor que el resto. Sin embargo, atendiendo a los valores de concentración de no efecto (NOEC), podemos observar como el rango de sensibilidades varía ligeramente. Así, N. gaditana resulta la especie con una menor concentración de no efecto; le sigue C. gracilis y T. chuii, ambas mostrando valores similares de NOEC. Por el contrario, el crecimiento de las microalgas I. galbana y D. salina se ve afectado a mayores concentraciones de tensioactivos que el resto. VI-20 Alcoholes etoxilados No se han encontrado referencias bibliográficas relativas a la toxicidad del tensioactivo Findet®1214N/23 y, en general, de los alcoholes etoxilados sobre especies de microalgas marinas. Respecto a especies de agua dulce, se han encontrado datos de toxicidad relativas a otros alcoholes etoxilados, algunos con semejantes longitud de cadena alquílica y número de unidades etoxiladas que el tensioactivo estudiado. Comparando los valores obtenidos en el presente trabajo con los encontrados para otros alcoholes etoxilados de semejante estructura química, los datos resultan del mismo orden de magnitud a los obtenidos con otras especies de agua dulce. Así, por ejemplo, Yamane y col. (1984) encontraron valores de EC50 de 4-8, 5-10 y 10-50 mg L-1 C12-14EO9 para las microalgas de agua dulce S. capricornutum, N. fonticola y M. aeruginosa, respectivamente. Por otro lado, estudios de toxicidad aguda del alcohol etoxilado lineal C12-15EO9 sobre Selenastrum capricornutum describieron valores de EC50 de 7,5 mg L-1 (Dorn et al., 1993). Ensayos de toxicidad con Artemia franciscana En este apartado se muestran los resultados de toxicidad obtenidos para el crustáceo A. franciscana expuesto a crecientes concentraciones de Findet®1214N/23. La Figura VI.8 recoge el porcentaje de supervivientes obtenidos para periodos de exposición de 48 y 72 horas. A. franciscana Supervivientes (%) 100 80 60 40 20 48h 72h 0 0 10 20 30 40 Concentración (mg L-1) Figura VI.8. Efecto del alcohol etoxilado Findet®1214N/23 sobre A. franciscana a las 48 y 72 horas de exposición. Los datos se representan como valor medio ± DE (n=5). Se puede apreciar un drástico aumento de la mortalidad de la población de nauplios en un rango de concentraciones comprendido entre 20 y 30 mg L-1 Findet®1214N/23. Cabe hacer notar que las primeras concentraciones de tóxico y el control VI-21 Capítulo 6 presentaron una mortalidad inferior al 15%, si bien en el ensayo control no se observó mortalidad alguna en ninguna de las réplicas al cabo de 72 horas. Por el contrario, a concentraciones superiores a 30 mg L-1 el efecto letal observado fue del 100% en todas las replicas ensayadas. Por otro lado, de la Figura VI.8 se desprende que los efectos letales observados a periodos de exposición de 48 y 72 horas son prácticamente similares. Los valores de los parámetros de toxicidad LC50, NOEC y LOEC calculados para un periodo de exposición de 48 y 72 horas se recogen en la Tabla VI.8. Tabla VI.8. Valores de LC50, NOEC y LOEC obtenidos en el ensayo de toxicidad estándar con crustáceos y el tensioactivo Findet®1214N/23. Organismo Efecto tóxico Concentración (mg L-1) A. franciscana 48-h LC50 23,82 (23,04-24,60)a 72-h LC50 23,33 (22,52-24,13)a 48-h NOEC 20,0b 48-h LOEC 24,0b 72-h NOEC 20,0b 72-h LOEC 24,0b Concentración, valor medio (Intervalo de confianza, 95%) b Concentración de efecto basado en concentraciones experimentales a Comparando estos resultados con los datos bibliográficos (Tabla VI.4) se obtienen valores ligeramente superiores a los obtenidos con otros crustáceos marinos y alcoholes etoxilados de semejante estructura química (longitud de cadena alquílica y número de unidades etoxiladas). En relación con el camarón Mysidopsis bahia, Hall y col. (1989) determinaron un valor de EC50 (48-h) de 2,2 mg L-1 para el alcohol etoxilado C13EO10, mientras que para C10EO4 obtuvieron un valor de de EC50 de 5,6 mg L-1. En el caso de especies de agua dulce, los valores obtenidos en el presente estudio resultan significativamente superiores a los encontrados en la bibliografía. Así, por ejemplo, Kaluza y Taeger (1996) determinaron valores de EC50 (48-h) para el crustáceo Daphnia magna de 1,2 mg L-1 para el tensioactivo C12-15EO7-8, mientras que para el alcohol etoxilado C12-1 15EO7-8 fue de 1,3 mg L (Kravetz y col., 1991; Dorn y col., 1993). Por otro lado, Wong y col. (1997), para el mismo crustáceo y el alcohol etoxilado C14-15EO13 obtuvieron valores de EC50 (48-h) de 0,5 mg L-1. No obstante, estudios realizados por Lewis y Suprenant (1983) sobre la toxicidad de alcoholes etoxilados en diversas especies de invertebrados de agua dulce, obtuvieron un rango de concentraciones EC50 comprendido entre 0,29 y 270 mg L-1, lo que viene a indicar la gran variabilidad inter-específica que presentan estos tensioactivos. VI-22 Alcoholes etoxilados Respecto a las concentraciones de no efecto (NOEC), esto es, la máxima concentración que no provoca un efecto observable, en nuestro caso inhibición del crecimiento y mortalidad, se puede apreciar que los valores calculados en el presente estudio, tanto para las microalgas como para el crustáceo marino (NOEC= 2-20 mg L-1), resultan 3-4 órdenes de magnitud superior a las concentraciones ambientales encontradas en la bibliografía (<40 µg L-1 en efluentes de EDARs y <4 µg L-1 en ríos). Atendiendo a estos resultados, podemos concluir que las concentraciones de alcoholes etoxilados presentes en el medio acuático no plantean, en principio, un riesgo ecológico para estos organismos. Sin embargo, al igual que ocurre con los otros tensioactivos estudiados, son escasos los datos disponibles, por lo que sería necesario realizar un mayor número estudios de toxicidad incluyendo un mayor número de especies así como un programa de monitoreo costero para poder corroborar esta suposición. 3.3. Evolución de la toxicidad del medio de ensayo durante la biodegradación El presente apartado tiene como objetivo el estudio de la evolución de la toxicidad del medio de ensayo a lo largo del proceso degradativo, con el fin de determinar si el tensioactivo estudiado presenta una biodegradación ambientalmente aceptable, esto es, que durante la biodegradación del tensioactivo se produce una detoxificación como consecuencia de la formación de metabolitos menos tóxicos (en naturaleza y/ó cantidad) al tensioactivo original. En la Figura VI.9 se representa la evolución temporal de la toxicidad del medio de ensayo (% inhibición del crecimiento/mortalidad) y grado de mineralización (%) durante el ensayo de biodegradación del tensioactivo no-iónico Findet®1214N/23. VI-23 Capítulo 6 80 60 60 IC, 96-h (%) Biodegradación (%) 0 20 20 40 60 80 60 60 40 IC, 96-h (%) Biodegradación (%) 20 0 0 0 80 20 80 80 60 60 40 40 IC, 96-h (%) Biodegradación (%) 0 20 0 0 20 40 60 80 80 60 60 40 IC, 96-h (%) Biodegradación (%) 20 0 20 40 40 IC, 96-h (%) Biodegradación (%) 0 20 0 80 100 Mortalidad, 72-h (%) 60 Biodegradación (%) Inh. crecimiento, 96-h (%) 60 60 40 60 80 20 100 A. franciscana 100 100 80 40 40 0 0 80 Tiempo (días) 100 80 100 T. chuii 20 100 Tiempo (días) 100 0 80 D. salina Tiempo (días) 20 60 100 Inh. crecimiento, 96-h (%) Inh. crecimiento, 96-h (%) 100 Biodegradación (%) C. gracilis 20 40 Tiempo (días) Tiempo (días) 100 20 0 0 100 40 Biodegradación (%) 20 40 80 100 80 80 60 60 40 40 LC,72-h (%) Biodegradación (%) 20 0 20 Biodegradación (%) 40 100 Biodegradación (%) 80 I. galbana 100 Biodegradación (%) Inh. crecimiento, 96-h (%) 100 Inh. crecimiento, 96-h (%) N. gaditana 100 0 0 20 40 60 80 100 Tiempo (días) Figura VI.9. Evolución del efecto tóxico del medio de ensayo (%) y porcentaje de mineralización (%) durante el experimento de biodegradación de Findet®1214N/23. Observando los resultados mostrados en la Figura VI.9, se puede apreciar como durante la mineralización del tensioactivo ensayado tiene lugar una clara detoxificación del medio de ensayo (caso a, ver capítulo 3, apartado 3.3). Así, en el caso de las microalgas N. VI-24 Alcoholes etoxilados gaditana e I. galbana tiene lugar una detoxificación del medio de ensayo del 100% al cabo de 36 días de ensayo. Por el contrario, en el caso de C. gracilis y D. salina esta disminución (100% detoxificación) tiene lugar al cabo de 17 días. Respecto a la microalga T. chuii y el crustáceo A. franciscana, para los que se observaron una toxicidad inicial (0% biodegradación) del 20 y 70%, respectivamente, se observa también una completa detoxificación al cabo de 17 días de ensayos. Para la mayoría de las especies ensayadas se observa una completa detoxificación del medio cuando se ha alcanzado tan sólo un 20% de mineralización del tensioactivo. Como consecuencia, resulta difícil establecer un grado de sensibilidad al medio de ensayo; si bien N. gaditana e I. galbana resultan las más sensibles al medio de ensayo mostrando una completa detoxificación a porcentajes de mineralización iguales o superiores al 37%. Podemos concluir, por lo tanto, que durante el proceso de mineralización del tensioactivo no-iónico Findet®1214N/23 tiene lugar una clara detoxificación del medio sin formación de metabolitos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original y por lo tanto, que el tensioactivo ensayado presenta una biodegradación ambientalmente aceptable. VI-25 Capítulo 6 4. Conclusiones Las principales conclusiones obtenidas en el presente capítulo son las siguientes: • El tensioactivo no-iónico Findet®1214N/23 presenta una elevada biodegrabilidad (porcentaje de mineralización superior al 90%) en el medio acuático marino bajo las condiciones ensayadas, aunque a una velocidad de biodegradación inferior a la observada en aguas continentales y otros medios sintéticos. • La cinética de biodegradación final o mineralización del tensioactivo no-iónico en agua de mar bajo las condiciones ensayadas sigue un modelo cinético de orden cero. • La toxicidad del tensioactivo Findet®1214N/23 depende significativamente del tipo de organismo ensayado. Así, de las diferentes especies de microalgas estudiadas, C. gracilis y N. gaditana son las más sensibles al tensioactivo, mientras que T. chuii se muestra como la especie más resistente. En el caso del crustáceo marino A. franciscana, a pesar de que los efectos estudiados han sido diferentes a los de las microalgas, los valores de efecto obtenidos resultan inferiores a los obtenidos para la microalga T. chuii, lo cual podría indicar una mayor sensibilidad al AE. • Los resultados obtenidos en los ensayos de toxicidad con microalgas y crustáceos marinos junto con los datos disponibles de niveles ambientales de AE parecen indicar que las concentraciones de AE presentes en el medio acuático marino no suponen un riesgo ambiental. • Las medidas de toxicidad obtenidas en los ensayos combinados de toxicidad con el experimento de biodegradación indican una clara detoxificación del medio durante el proceso de mineralización del tensioactivo no-iónico Findet®1214N/23 sin producción de intermediatos más tóxicos (en cantidad y/ó naturaleza) que el tensioactivo original. Estos resultados permiten clasificar al tensioactivos ensayado como un compuesto de biodegradabilidad ambientalmente aceptable. VI-26 Alcoholes etoxilados Referencias Ahel, M., Giger, W., Koch, M., 1994. Behavior of alkylphenol polyethoxylate surfactants in the aquatic environment. I. Occurrence and transformation in seawage treatment. Water Res 28, 1131-1142. Ahel, M., Schaffner, C., Giger, W., 1996. Behavior of alkylphenol polyethoxylate surfactants in the aquatic environment. III. Occurrence and elimination of their persistent metabolites during infiltration of river water to groundwater. Water Res 30, 37-46. Ahel, M., Giger, W., Molnar, E., Ibric, S., 2000. Determination of nonylphenol polyethoxylates and their lipophilic metabolites in sewage effluents by normal-phase high-performance liquid chromatography and fluorescence detection. Croatica Chemica Acta 73, 209-227. Balson, T., Felix, M.S.B., 1995. Biodegradability of non-ionic surfactants. En: Porter, D.R.K.a.M.R. (Ed.). Biodegradability of Surfactants. Blackie Academic & Professional, Glasgow, United Kingdom, pp. 204230. Birch, R.R., 1984. Biodegradation of nonionic surfactants. J. Am. Oil Chem. Soc. 62. Boeije, G.M., Cano, M.L., Marshall, S.J., Belanger, S.E., Van Compernolle, R., Dorn, P.B., Gumbel, H., Toy, R., Wind, T., 2006. Ecotoxicity quantitative structure-activity relationships for alcohol ethoxylate mixtures based on substance-specific toxicity predictions. Ecotoxicol Environ Saf 64, 75-84. Dorn, P.B., Salanitro, J.P., Evans, S.H., Kravetz, L., 1993. Assessing the aquatic hazard of some branched and linear non-ionic surfactants by biodegradation and toxicity. Toxicol Chem 12, 1751-1762. Hall, W.S., Patoczka, J.B., Mirenda, R.J., Porter, B.A., Miller, E., 1989. Acute toxicity of industrial surfactants to Mysidopsis bahia. Arch Environ Contam Toxicol 18, 765-772. Hauthal, H.G., 2004. CESIO 2004-dynamic surfactants and nanostructured surfaces for an innovative industry. SÖFW J. 130, 3-17. HERA, 2007. Alcohol ethoxylates (AE). Human and Environmental Risk Assessment on ingredients of European household cleaning products. http://www.heraproject.com/files/34-F-HERA-AEHH+ENV%20Final%20Draft%20Report_01-05-07.pdf. Holt, M.S., Mitchell, G.C., Watkinson, R.J., 1992. The environmental chemistry, fate and effects of nonionic surfactants. En: Oude, N.T.d. (Ed.). Detergents, The Handbook of Environmental Chemistry. SpringerVerlag, Berlin Heidelberg, Germany, pp. 89-144. Huber, M., Ulrich, M., Rys, P., 2000. Biodegradation Mechanisms of Linear Alcohol Ethoxylates under Anaerobic Conditions. Environ. Sci. Technol. 34, 1737-1741. Jeong-Hun, K., Fusao, K., 2005. Bisphenol A degradation in sea water is different from that in river water. Chemosphere 60(9), 1288–1292. Jobling, S., Sumpter, J.P., 1993. Detergent components in sewage effluent are weakly estrogenic to fish: An in vitro study using rainbow trout (Oncorhynchus mykiss) hepatocytes. Aquatic Toxicology 27, 361-372. VI-27 Capítulo 6 Kaluza, U., Taeger, K., 1996. Einfluss der chemischen Struktur auf ökotoxikologische Eigenschaften von AlkanolEthoxylaten (en alemán). [Effect of chemical structure on the ecotoxicological properties of alcanol ethoxylates]. Tenside Surfactants Detergents 33, 46-51. Kasuya, K., Takagi, K., Ishiwatari, S., Yoshida, Y., Doi, Y., 1998. Biodegradabilities of various aliphatic polyesters in natural waters. Polym. Degrad. Stab. 59(1–3), 327–332. Kot-Wasik, A., Dbrowska, D., Namienik, J., 2004. Photodegradation and biodegradation study of benzo(a)pyrene in different liquid media. J. Photochem. Photobiol. A, Chem. 168(1–2), 109–115. Kravetz, L., Salanitro, J.P., Dorn, P.B., Guin, K.F., 1991. Influence of hydrophobe type and extent of branching on environmental response factors on nonionic surfactants. J Am Oil Chem Soc 68, 610-618. Lechuga, 2005. Biodegradación y toxicidad de tensioactivos comerciales. Tesis Doctoral. Departamento de Ingeniería Química. Universidad de Granada. Lewis, M.A., Hamm, B.G., 1986. Environmental modification of the photosynthetic response of lake plankton to surfactants and significance to a laboratory - field comparison. Water Res. 20, 1575-1582. Lewis, M.A., Perry, R.L., 1981. Acute toxicities of equimolar and ecotoxic surfactant mixtures to Daphnia magna and Lepomis macrochirus. En: Aquatic Toxicology and Hazard Assessment. American Society for Testing and Materials, United States, pp. 401-418. Lewis, M.A., Suprenant, D., 1983. Comparative acute toxicities of surfactants to aquatic invertebrates. Ecotoxicol Environ Saf 7, 313-322. Madsen, T., Boyd, H.B., Nylén, D., Pedersen, A.R., Petersen, G.I., Simonsen, F., 2001. Environmental and health assessment of substances in household detergents and cosmetic detergents and cosmetic detergent products. DK-EPA, Denmark. Madsen, T., Damborg, A., Rasmussen, H.B., Seiero, C., 1994. Evaluation of methods for screening surfactants. Ultimate aerobic and anaerobic biodegradability. En: Danish Environmental Protection Agency (Ed.). Working Report No. 38. Ministry of Environment, Copenhagen, Denmark. Madsen, T., Petersen, G., Seiero, C., Torslov, J., 1996. Biodegradability and aquatic toxicity of glycoside surfactants and a nonionic alcohol ethoxylate. J. Am. Oil Chem. Soc. 73, 929-933. Maki, A.W., Bishop, W.E., 1979. Acute toxicity studies of surfactants to Daphnia magna and Daphnia pulex. Arch Environ Contam Toxicol 8, 599-612. Manzano, M.A., Perales, J.A., Sales, D., Quiroga, J.M., 1998. Effect of concentration on the biodegradation of a nonylphenol polyethoxylate in river water. Bull Environ Contam Toxicol 61, 489-496. Marcomini, A., Pojana, G., Carrer, C., Cavalli, L., Cassani, G., Lazzarin, M., 2000a. Aerobic biodegradation of monobranched aliphatic alcohol polyethoxylates. Environ. Toxicol. Chem. 19, 555-560. Marcomini, A., Zanette, M., Pojana, G., Suter, M.J.F., 2000b. Behaviour of aliphatic alcohol polyethoxylates and their metabolites under standardized aerobic biodegradation conditions. Environ. Toxicol. Chem. 19, 549-554. VI-28 Alcoholes etoxilados Matthijs, E., Holt, M.S., Kiewiet, A.T., Rijs, G.B., 1999. Environmental monitoring for linear alkylbenzene sulfonate, alcohol ethoxylate, alcohol ethoxy sulfate and soap. Environ Toxicol Chem 18, 2634-2644. Mezzanotte, V., Bolzacchini, E., Orlandi, M., Rozzi, A., Rullo, S., 2002. Anaerobic removal of linear alcohol ethoxylates. Bioresour Technol 82, 151-156. Naylor, C.G., Mieure, J.P., Adams, J.A., Weeks, J.A., Ctaldi, F.J., Ogle, L.E., Romano, R.R., 1992. Alkylphenol ethoxylates in the environment. J Am Oil Chem Soc 59, 695-703. Nyholm, N., Kristensen, P., 1992. Screening methods for assessment of biodegradability of chemicals in seawater-results from a ring test. Ecotoxicol Environ Saf 23, 161-172. Osburn, Q.H., Benedict, J.H., 1966. Polyethoxylates alkylphenol: relationship of structure biodegradation mechanism. J Am Oil Chem Soc 43, 141-146. Patterson, S. J., Scott, C. C., Tucker, B. E., 1970. Nonionic detergent degradation: III. Initial mechanism of the degradation. The journal of the American Oil Chemists’s Society 47, 37-41. Perales, J.A., Manzano, M.A., Sales, D., Quiroga, J.M., 1999. Biodegradation kinetics of LAS in river water. International Biodeterioration & Biodegradation 43, 155-160. Perales, J.A., Manzano, M.A., Garrido, M.C., Sales, D., Quiroga, J.M., 2007. Biodegradation kinetics of linear alkylbenzene sulphonates in sea water. Biodegradation 18, 63-70. Pollard, P.C., 2006. A quantitative measure of nitrifying bacterial growth. Water research 40, 1569 – 1576. Reynolds, P.J., Young, W., Mascarenhas, R., 1997. Study on the possible problems for the aquatic environment related to surfactants in detergents. ECC report No. EC 4294, 66. Roberts, D.W., 1991. QSAR issues in aquatic toxicity of surfactants. Sci Total Environ 109-110, 557-568. Sabahi, N., 2004. Caracterización de tensioactivos: poder espumante y tensiones superficiales. Tesis Doctoral. Departamento de Ingerniería Química. Universidad de Granada Salanitro, J.P., Langston, G.C., Dorn, P.B., Kravetz, L., 1988. Activated sludge treatment of ethoxylate surfactants at high industrial use concentrations. Presented at the International Conference on Water and Wastewater Microbiology, Newport Beach, Calif., February 8-11. Scott, M.J., Jones, M.N., 2000. The biodegradation of surfactants in the environment. Biochim Biophys Acta 1508, 235-251. Scharer, D.H., Kravetz, L., Carr, J.B., 1979. Biodegradation of nonionic surfactants. Tappi 62, 75-78. Schöberl, P., Bock, K.J., Huber, L., 1988. Ökologisch relevanten Daten von Tensiden in Wasch- und Reinigungsmitteln (en alemán) [Ecologically relevant data for surfactants in laundry detergents and cleaning agents]. Tenside Surfactants Detergents 25, 86-98. Shimp, R., 1989. LAS biodegradation in estuaries. Tenside Surfactant Deterg 26, 390-393. SIAR, 2006. SIDS Initial Assessment Report for Long Chain Alcohols. Versión final: 15 May 2006. Staples, C.A., Naylor, C.G., Williams, J.B., Gledhill, W.E., 2001. Ultimate biodegradation of alkylphenol ethoxylate surfactants and their biodegradation intermediates. Environ Toxicol Chem 20, 2450-2455. VI-29 Capítulo 6 Swisher, R.D., 1987. The analytical methods in surfactants biodegradation. Surfactant biodegradation, 2nd Edition, 47, M. Dekker, New York. Talmage, S.S., 1994. Environmental and human safety of major surfactants: alcohol ethoxylates and alkylphenol ethoxylates. A Report to the Soap and Detergent Association. Boca Raton, FL: Lewis Publishers. USEPA, 1998. Fate, transport and transformation test guidelines. OPPTS. "Biodegradability in Sea Water" 835.3160. EPA 712–C–98–351 The Federal Bulletin Board. U.S. Government Printing Office Washington, DC. Van de Plassche, E.J., De Bruijn, J.H.M., Stephenson, R.R., Marshall, S.J., Feijtel, T.C.J., Belanger, S.E., 1999. Predicted no-effect concentrations and risk characterization of four surfactants: linear alkyl benzene sulfonate, alcohol ethoxylates, alcohol ethoxylated sulfates, and soap. Environmental Toxicology and Chemistry 18, 2653–2663. Wang, Z., Fingas, M., 1993. Rapid separation of non-ionic surfactants of polyethoxylated octylphenol and determination of ethylene oxide oligomer distribution by C1 column reversed-phase liquid chromatography Journal of Chromatography 673, 145-156. White, R., Jobling, S., Hoare, S.A., Sumpter, J.P., Parker, M.G., 1994. Environmentally persistent alkylphenolic compounds are estrogenic. Endocrinology 135, 175-182. Wind, T., Belanger, S.E., 2006. Acute and chronic toxicity of alcohol ethoxylates to the green alga, Desmodesmus (=Scenedesmus) subspicatus, and the subsequent development of structure activity relationships. Bull Environ Contam Toxicol 76, 218-225. Wong, D.C.L., Dorn, P.B., Chai, E.Y., 1997. Acute toxicity and structure–activity relationships of nine alcohol ethoxylate surfactants to fathead minnow and Daphnia magna. Environmental Toxicology and Chemistry 16, 1970–1976. Yamane, A.N., Okada, M., Sudo, R., 1984. The growth inhibition of planktonic algae due to surfactants used in washing agents. Water Res. 8, 1101-1105. Ying, G.G., 2006. Fate, behavior and effects of surfactants and their degradation products in the environment. Environ Int 32, 417-431. VI-30 Capítulo 7 ESTUDIO COMPARATIVO DE LA BIODEGRADABILIDAD Y ECOTOXICIDAD DE LOS TENSIOACTIVOS Resumen En el siguiente capítulo se realiza un análisis comparativo de los resultados obtenidos en los ensayos de biodegradación y ecotoxicidad con los diferentes tensioactivos. Capítulo 7 1. Biodegradabilidad de los tensioactivos estudiados en el medio acuático marino En el siguiente apartado se compara la biodegradabilidad en agua de mar de los diferentes tensioactivos estudiados en los capítulos anteriores, esto es, sal de alquil trimetil amonio (ATMAC), nonilfenol etoxilado (NPEO), alquil etoxisulfato (AES) y alcohol etoxilado (AE). En la Figura VII.1A se ha representado la evolución del porcentaje de substrato residual (100% de biodegradación) a lo largo del ensayo de biodegradación para los 4 tensioactivos. Los puntos representan los porcentajes medios experimentales, mientras que las líneas continuas representan los valores obtenidos a partir de los modelos cinéticos correspondientes. 100 A 100 80 80 ATMAC NPEO AES AE 60 40 20 Tiempo (días) Concentración residual (%) La Figura VII.1B muestra los valores medios del tiempo de latencia (tiempo necesario para alcanzar un 10% de biodegradación, t10), t50 (tiempo transcurrido hasta alcanzar un 50% de biodegradación, sin considerar la fase de latencia) y t70 (tiempo transcurrido hasta alcanzar un 70% de biodegradación, considerando la fase de latencia). B t10 t50 t70 60 40 20 0 0 0 20 40 60 80 100 120 ATMAC NPEO AES AE Tiempo (d) Figura VII.1. Comparación de los resultados obtenidos en los experimentos de biodegradación de los diferentes tensioactivos estudiados: (A) evolución del porcentaje medio de tensioactivo residual (%), (B) tiempos de latencia (t10), t50 y t70 (ATMAC, sal de alquil trimetil amonio; NPEO, nonilfenol etoxilado; AES, alquil etoxisulfato; AE, alcohol etoxilado). Cabe hacer notar que los valores de t70 han sido calculados análogamente a los valores de t10 y t50, esto es, a partir de los modelos de mejor ajustes obtenidos en cada caso. En el caso del AES, donde la curva de biodegradación presenta dos etapas (A y B), se han VII-2 Estudio comparativo… calculado los valores de t10, t50 y t70 del proceso global. Así, para el cálculo de t10 y t50 se ha empleando el modelo cinético correspondiente a la etapa A (modelo de primer orden, 060% biodegradación) mientras que, para t70 se ha utilizado el modelo cinético correspondiente a la etapa B, esto es, el modelo logístico (60-95% biodegradación). Se puede apreciar en la Figura VII.1A como sólo el tensioactivo catiónico ATMAC presenta una fase previa de aclimatación de los microorganismos (t10= 15,17 días, Figura VII.1.B) mientras que para el resto de tensioactivos el proceso de biodegradación comienza rápidamente, mostrando bajos tiempos de latencia (t10= 3,51 días para NPEO y 3,33 días para AES, Figura VII.1.B). En el caso del tensioactivo no-iónico AE, a pesar de que en la Figura VII.1A no se observa una fase de aclimatación, de manera cuantitativa obtenemos un tiempo de latencia de 11,5 días (Figura VII.1B), fruto de la baja velocidad de degradación que presenta el tensioactivo. Estas diferencias pueden justificarse atendiendo a la estructura química de los diferentes tensioactivos, la cual determina el mecanismo del proceso biodegradativo de los mismos. Si bien, todos los tensioactivos se caracterizan por presentar una cadena alquílica de longitud variable (grupo hidrófobo), sólo los tensioactivos NPEO, AES y AE presentan cadena etoxilada, y son éstos precisamente los que presentan unas curvas de biodegradación sin aclimatación inicial (Fig. VII.1A), siendo los modelos cinéticos que mejor describen estos procesos de orden cero (AE) y primer orden (NPEO, AES). Por el contrario, el único tensioactivo que no presenta unidades etoxiladas en su estructura (ATMAC) es el que presenta un modelo cinético de biodegradación logístico con una marcada fase de latencia. Este hecho parece indicar que cuando en el proceso de biodegradación no se aprecia una fase de latencia (NPEO, AES y AE), el número de microorganismos inicialmente presentes en el medio con capacidad para llevar a cabo estas reacciones (hidrólisis) es mayor que aquellos con sistemas enzimáticos capacitados para realizar ω-β oxidaciones (ATMAC). Estos resultados están acordes a los descritos por otros autores para diversos tensioactivos y medios de ensayo. Así, por ejemplo, Manzano y col. (1998), para un tensioactivo NPEO, en los que la principal ruta de biodegradación consiste en el acortamiento hidrolítico de la cadena etoxilada, encontraron tiempos de latencia comprendidos entre 1 y 3 días en agua de río prístina y empleando concentraciones iniciales de tensioactivos de entre 2,5 y 10 mg L-1. Por el contrario, Perales y col. (2007), obtuvieron valores de tiempo de latencia muy superiores (tiempo de latencia entre 6,06 y 7,27 días) en agua de mar prístina y a una concentración inicial de tensioactivo de 20 mg L-1. Al objeto de analizar y comparar la velocidad del proceso de los diferentes tensioactivos, se ha calculado el parámetro t50 (tiempo transcurrido hasta alcanzar un 50% de biodegradación, sin considerar la fase de latencia) para cada uno de los tensioactivos. Atendiendo al histograma y la gráfica de biodegradación representadas en las Figuras VII-3 Capítulo 7 VII.1A y VII.1B, podemos observar como los tensioactivos DTMAC y NPEO son los que se degradan a mayor velocidad, si bien el catiónico DTMAC parece degradarse ligeramente mas rápido (menor t50, mayor pendiente de la curva), mostrando valores de t50 de 12 y 17 días, respectivamente. Por el contrario, los tensioactivos AES y AE presentan bajas velocidades de degradación en el medio marino, mostrando valores de t50 de 30 y 41 días, respectivamente. Debido a que la directriz OPPTS 835.3160 “Biodegradabilidad en agua de mar” (USEPA, 1998) establece como criterio para determinar la existencia de un potencial para la biodegradación de un determinado substrato en el medio ambiente marino su biodegradación en un porcentaje superior al 70% en un periodo de tiempo inferior a 60 días, en la Figura VII.1B se han representado los valores de tiempo estimado en alcanzar un 70% de mineralización, incluyendo el periodo de latencia (t70). Asimismo, se indica mediante una línea horizontal el valor límite establecido por dicha directriz. Se puede apreciar que en el caso de los tensioactivos DTMAC y NPEO existe un potencial para la biodegradabilidad de estos tensioactivos en el medio marino. Por el contrario, los tensioactivos AES y AE muestran valores muy superiores a este límite, lo cual no descarta la posibilidad de que existan un potencial para su biodegradabilidad pero se precisan nuevos estudios, por ejemplo, empleando concentraciones de tensioactivos inferiores, para poder afirmar que existe este potencial (USEPA, 1998). Sin embargo, si atendemos a los resultados obtenidos en la Figura VII.1A se puede observar que a pesar de estas bajas velocidades de biodegradación se alcanzan altos porcentajes de biodegradación final, lo cual parece indicar que efectivamente existe un potencial para la biodegradabilidad de estos tensioactivos en el medio marino. VII-4 Estudio comparativo… 2. Toxicidad aguda de los tensioactivos estudiados sobre organismos marinos Los valores de las concentraciones de inhibición del crecimiento (IC50, 96-h) ó mortalidad (LC50, 72-h) y de no efectos observables (NOEC) para los diferentes organismos marinos ensayados se presentan en la Figura VII.2. Observamos como el crustáceo A. franciscana presenta los valores más bajos de toxicidad para todos los tensioactivos, a excepción del alcohol etoxilado (AE). A pesar de que el efecto tóxico estudiado en el crustáceo (mortalidad) es diferente al empleado para las microalgas (inhibición de crecimiento), estos resultados parecen indicar que el crustáceo es, en general, más tolerante a estos tensioactivos que las microalgas. Por otro lado, los valores de IC50 obtenidos muestran como, dentro del grupo de las microalgas, la especie T. chuii parece ser la más resistente al tensioactivo, mostrando valores de efecto superiores al resto de las microalgas para todos los tensioactivos estudiados, a excepción del AES donde se obtuvieron valores similares a las microalgas N. gaditana e I. galbana. En cuanto a la sensibilidad de los tensioactivos ensayados y a la vista de los resultados mostrados en la Figura VII.2, no podemos afirmar que exista una especie claramente más sensible que el resto, pues la toxicidad varía significativamente en función del tensioactivo. Así, por ejemplo, la microalga D. salina es claramente más sensible que el resto a la exposición del tensioactivo aniónico AES, mientras que por el contrario para el tensioactivo no-iónico NPEO experimenta una toxicidad menor que N. gaditana, I. galbana y C. gracilis. No obstante, se puede apreciar un comportamiento análogo en las microalgas N. gaditana, I. galbana y C. gracilis, las cuales no sólo presentan el mismo orden de sensibilidad a los tensioactivos (ATMAC > NPEO > AE > AES) sino que la relación entre ellos también es similar, siendo la toxicidad del tensioactivo AES muy inferior a los otros tres. Al igual que no hay un comportamiento general en cuanto a la sensibilidad de los organismos frente a los cuatro tensioactivos estudiados, tampoco se puede realizar de forma categórica una ordenación de los tensioactivos acorde a su toxicidad. Así, se puede apreciar como el tensioactivo catiónico ATMAC presenta un evidente mayor efecto tóxico que el resto de los tensioactivos para todos los organismos ensayados, a excepción del crustáceo marino, para el que sorprendentemente muestra una menor toxicidad que el resto de tensioactivos (Figura VII.2). Por el contrario, el tensioactivo AES experimenta una baja toxicidad para cuatro de las microalgas estudiadas, mientras que para D. salina el efecto tóxico es muy acusado. VII-5 30 IC50 NOEC 20 10 0 Concentración tensioactivo (mg L-1) ATMAC 40 AES IC50 NOEC 20 10 0 40 AES 30 IC50 NOEC 20 10 0 ATMAC NPEO AES 30 AE IC50 NOEC 20 10 0 40 NPEO AES AE D. salina 30 IC50 NOEC 20 10 0 AE T. chuii I. galbana ATMAC 30 NPEO 40 AE C. gracilis ATMAC Concentración tensioactivo (mg L-1) NPEO Concentración tensioactivo (mg L-1) N. gaditana Concentración tensioactivo (mg L-1) 40 ATMAC Concentración tensioactivo (mg L-1) Concentración tensioactivo (mg L-1) Capítulo 7 40 NPEO AES AE A. franciscana LC50 NOEC 30 20 10 0 ATMAC NPEO AES AE Figura VII.2. Valores de IC50 (96-h), LC50 (72-h) y NOEC para diferentes organismos marinos. Las barras de los histogramas muestran los valores medios, mientras que las barras de error denotan el intervalo de confianza al 95% (ATMAC, sal de alquil trimetil amonio; NPEO, nonilfenol etoxilado; AES, alquil etoxisulfato; AE, alcohol etoxilado). VII-6 Estudio comparativo… Variabilidad de los valores de efectos (EC50/LC50) En las Figuras VII.3A y VII.3B se han representado los valores de los coeficientes de variación (porcentaje que supone la desviación estándar de una muestra frente al valor medio), de los datos de toxicidad (IC50 o LC50), agrupados de diferente forma. En la Figura VII.3A se recoge el grado de dispersión para cada organismo de los datos de toxicidad de los cuatro tensioactivos ensayados, mientras que en la Figura VII.3B se presentan los coeficientes de variación para cada tensioactivo de los datos de toxicidad obtenidos con los diferentes organismos. Cabe destacar que en este caso, se ha representado la variabilidad considerando los valores de efectos obtenidos para las microalgas y crustáceos (color verde oscuro) así como considerando exclusivamente los valores obtenidos para las microalgas (color verde claro). A 120 100 80 60 40 20 0 NG IG CG DS TC AF 180 Coeficiente de variación (%) Coeficiente de variación (%) 140 B 160 140 Microalgas + crustáceo Microalgas 120 100 80 60 40 20 0 ATMAC NPEO AES AE Figura VII.3. Coeficiente de variación (%) de los valores de efectos (IC50 para las microalgas y LC50 para el crustáceo) obtenidos para los diferentes tensioactivos y especies. (A) Variabilidad por especie ensayada (NG= N. gaditana, IG= I. galbana, CG= C. gracilis, DS= D. salina, TC=. T. chuii, AF= A. franciscana); (B) variabilidad por tensioactivo estudiado (ATMAC, sal de alquil trimetil amonio; NPEO, nonilfenol etoxilado; AES, alquil etoxisulfato; AE, alcohol etoxilado). Los resultados presentados en la Figura VII.3A muestran como las diferencias encontradas en la toxicidad de los diferentes tensioactivos estudiados depende en gran medida del taxón y/o del efecto estudiado. Como se puede observar en la Figura VII.3A, la artemia presenta una variabilidad muy inferior al de las microalgas, esto es, que el efecto de los diferentes tensioactivos sobre el crustáceo ha sido muy similar. En el caso de las microalgas, se observa asimismo que la variabilidad de los resultados no es homogénea, siendo la microalga C. gracilis la que muestra mayores diferencias entre los efectos entre los tensioactivos (120%) y la microalga T. chuii la que menos (53%). Este hecho parece VII-7 Capítulo 7 indicar que la especie utilizada en los ensayos no sólo ha de ser considerada a la hora de ordenar los tensioactivos en función de su toxicidad, como se ha visto anteriormente, sino que las diferencias entre las toxicidades de los compuestos también dependen del organismo usado y/o del efecto medido. Respecto a la Figura VII.3B, se puede apreciar, en primer lugar, como la variabilidad obtenida considerando ambos taxones resulta muy similar en todos casos a los obtenidos considerando exclusivamente el taxón algas, a excepción del tensioactivo catiónico ATMAC. Si bien esto es debido a la elevada diferencia observada en los valores de efectos de las microalgas (IC50 entre 0,69 y 6,34 mg L-1) y el crustáceo (LC50= 34,19 mg L-1). Por otro lado, se observa como, de manera análoga a la Figura VII.3A, el coeficiente de variabilidad no presenta valores homogéneos. Así, las diferencias entre los valores de toxicidad de las diversas microalgas cuando se ensayó la toxicidad con AES, resultan ser menores que la de los efectos observados para el resto de tensioactivos, que presenta una variabilidad similar en torno al 80%. Este resultado parece sugerir que el compuesto ensayado también, en ocasiones, puede influir en las diferencias observadas entre los diferentes organismos ensayados, aunque no en sus sensibilidades, esto es, que no sólo para cada tensioactivo se ha observado un orden de sensibilidades que no necesariamente ha sido el mismo, sino que además en el caso del AES, las diferencias entre las sensibilidades de las diferentes microalgas han sido menores. Si se analizan en su conjunto los resultados obtenidos se puede observar que tanto como para el organismo más tolerante (Artemia franciscana) como para el tensioactivo que con mayor frecuencia ha sido el menos tóxico (AES), la dispersión de resultados obtenida es mucho menor que en el caso de la microalga que con mayor frecuencia ha sido la más sensible (C. gracilis) y el tensioactivo que con mayor frecuencia ha sido el más tóxico (ATMAC). Como conclusión de este apartado se puede afirmar que las diferencias encontradas entre los efectos tóxicos para los tensioactivos y especies estudiadas no solamente se deben a la naturaleza del compuesto ensayado, sino también al amplio grado de sensibilidad que muestran los diferentes organismos cuando son expuestos a estos agentes de superficie. VII-8 Estudio comparativo… 3. Evolución de la toxicidad del medio de ensayo durante la biodegradación de los diferentes tensioactivos estudiados La evolución de la toxicidad del medio de ensayo (% efecto) para las diferentes especies ensayadas (N. gaditana, I. galbana, C. gracilis, D. salina, T. chuii y A. franciscana) a lo largo de los experimentos de biodegradación realizados se muestran en la Figura VII.4. Se puede observar como para todos los tensioactivos tiene lugar una detoxificación del medio de ensayo a medida que avanza el proceso biodegradativo, a excepción del tensioactivo no-iónico NPEO para el que se observa un claro aumento de la toxicidad del medio en la fase inicial del experimento para el crustáceo y las microalgas D. salina y T. chuii. Este comportamiento no se ha observado para las microalgas N. gaditana, I. galbana y C. gracilis dada la elevada sensibilidad de estas tres microalgas al tensioactivo y a la elevada concentración inicial empleada en los ensayos de biodegradación. Por otro lado, la Figura VII.4 muestra una completa detoxificación del medio de ensayo para los tensioactivos AES y AE, mientras que para el tensioactivo NPEO la detoxificación es del 100% en todos lo casos, a excepción de las microalgas I. galbana y D. salina (75% de detoxificación, aproximadamente). Asimismo, en el caso del tensioactivo catiónico ATMAC se observa un porcentaje residual de efecto comprendido entre el 20 y 10% para todas las especies, a excepción de D. salina y A. franciscana para la que se obtiene una completa detoxificación. Si se comparan los valores de velocidad de detoxificación de los diferentes medios de ensayos para cada una de las especies, se observa que éstas siguen un patrón común. Así, se puede apreciar como en todos los organismos el orden de detoxificación es el siguiente: AE > ATMAC > NPEO ≈ AES, siendo el medio de ensayo correspondiente al tensioactivo no–iónico AE el primero en detoxificarse. En términos de porcentajes de mineralización, se obtiene que en el caso del alcohol etoxilado (AE) se produce una completa detoxificación cuando se alcanza porcentajes de mineralización comprendidos entre el 19 y 37%, mientras que para el tensioactivo catiónico (ATMAC) la máxima detoxificación tiene lugar a porcentajes de biodegradación del 81-95%. Respecto al NPEO y AES la detoxificación del medio tiene lugar cuando el tensioactivo ha sido mineralizado un 92 y 78-98%, respectivamente. VII-9 Capítulo 7 N. gaditana 80 60 ATMAC NPEO AES AE 40 20 100 I. galbana 80 Efecto tóxico (%) Efecto tóxico (%) 100 60 ATMAC NPEO AES AE 40 20 0 0 0 20 40 60 80 100 120 0 20 40 Tiempo (d) C. gracilis 80 100 120 60 ATMAC NPEO AES AE 40 20 D. salina 80 60 ATMAC NPEO AES AE 40 20 0 0 0 20 40 60 80 100 120 0 20 40 Tiempo (d) 60 80 100 120 Tiempo (d) T. chuii 80 60 ATMAC NPEO AES AE 40 20 0 100 Efecto tóxico (%) 100 Efecto tóxico (%) 80 100 Efecto tóxico (%) Efecto tóxico (%) 100 60 Tiempo (d) A. franciscana 80 60 ATMAC NPEO AES AE 40 20 0 0 20 40 60 80 Tiempo (d) 100 120 0 20 40 60 80 100 120 Tiempo (d) Figura VII.4. Evolución del efecto tóxico del medio de ensayo (%) de cada uno de los organismos ensayados a lo largo del experimento de biodegradación de los diferentes tensioactivos (ATMAC, sal de alquil trimetil amonio; NPEO, nonilfenol etoxilado; AES, alquil etoxisulfato; AE, alcohol etoxilado). VII-10 Estudio comparativo… En la Tabla VII.1 se muestran los valores de tiempo de vida media del proceso de mineralización (t1/2), esto es el tiempo necesario para alcanzar un porcentaje de mineralización del 50%, y tiempo de vida media del proceso de detoxificación (t1/2*), es decir, el tiempo necesario para alcanzar un porcentaje de detoxificación del 50%, para cada uno de los tensioactivos estudiados. Tabla VII.1. Valores de tiempo de vida media del proceso biodegradativo (t1/2) y de detoxificación (t1/2*) para los diferentes tensioactivos estudiados (ATMAC, sal de alquil trimetil amonio; NPEO, nonilfenol etoxilado; AES, alquil etoxisulfato; AE, alcohol etoxilado). Tensioactivo ATMAC a Tiempo de vida media mineralización (t1/2) (días) 26,9 Tiempo de vida media detoxificación (t1/2*) (días) 18-35 NPEO 23,1 43-61 AES 35,0 25-35 (70a) AE 56,8 Valor obtenido para la microalga D. salina 10-23 Los resultados mostrados en la Tabla VII.1 reflejan tres comportamientos diferentes. Así, en el caso del tensioactivo AE, a pesar de presentar un elevado valor de t1/2 (56,8 días) se obtiene el menor valor de t1/2* (10-23 días), lo que viene a indicar una rápida velocidad de detoxificación del medio de ensayo con formación de metabolitos menos tóxicos que el tensioactivo original. Por el contrario, se puede apreciar como NPEO, a pesar de presentar el menor valor de t1/2 (23,10 días), alcanza tiempos de vida media de detoxificación muy superiores (t1/2*= 43-61 días), lo cual indica que la velocidad de detoxificación del proceso es muy inferior a la de mineralización. Este hecho puede deberse a la formación de metabolitos más tóxicos durante la biodegradación del tensioactivo, tal y como se comentó en el capítulo 4, indicando así su biodegradabilidad ambientalmente no aceptable. Por otro lado, el tensioactivo ATMAC presenta tiempos de vida media de mineralización y detoxificación similares, lo que implica una detoxificación del medio de ensayo con formación de metabolitos menos tóxicos o de igual toxicidad que el tensioactivo original. Cabe resaltar el amplio intervalo de tiempos de vida media observados para el tensioactivo AES y los diferentes organismos (t1/2*= 25-70 días); si bien para todas las especies estos valores están comprendidos entre 25 y 35 días a excepción de la microalga D. salina. VII-11 CONCLUSIONES GENERALES Conclusiones generales En los capítulos anteriores aparecen recogidas las conclusiones más importantes obtenidas a partir de los ensayos de biodegradación, toxicidad y estudios combinados de toxicidad y biodegradación para cada uno de los tensioactivos estudiados. En este apartado, se enumeran las conclusiones generales más relevantes obtenidas a partir de los resultados mostrados y de las consideraciones realizadas a lo largo del desarrollo de la presente Tesis Doctoral. 1. Para la evaluación del riesgo ambiental de tensioactivos en el medio marino resulta necesario realizar ensayos de biodegradación en agua de mar puesto que se han encontrado diferencias en las velocidades de biodegradación obtenidas en este medio frente a las aportadas por otros autores para otros medios de ensayo, si bien los datos bibliográficos disponibles para poder realizar comparaciones son escasos. 2. La modelización cinética del proceso biodegradativo se muestra como una alternativa válida frente al procedimiento tradicional propuesto por diferentes organismos tales como la Agencia de Protección Ambiental de los Estados Unidos (USEPA), la Organización para la Cooperación Económica y el Desarrollo (OECD), etc. El uso de modelos no sólo permite caracterizar la cinética de biodegradación del compuesto sino también calcular de una forma más rigurosa los valores que definen la cinética del proceso, como por ejemplo, el tiempo de latencia y vida media. 3. El uso de forma generalista del periodo necesario en alcanzar una biodegradación del 10% como tiempo de latencia puede inducir en ocasiones a error, indicando la presencia de una fase de aclimatación en procesos degradativos lentos en los que claramente ésta no se observa. Por ello se propone una modificación del tratamiento de datos consistente en el cálculo del periodo de latencia solo en aquellos casos en los que el modelo cinético de mejor ajuste contemple esta fase. 4. En aquellos casos en los que no se cumpla el criterio establecido por la Agencia de Protección Ambiental de los Estados Unidos (biodegradación superior al 70% en un tiempo inferior a 60 días) pero se observe una clara tendencia descendente en la concentración residual de substrato transcurridos 60 días, se propone prolongar la duración del ensayo. En estos casos, si la curva de biodegradación se asintotiza en valores superiores o iguales al 70%, se puede afirmar que existe un potencial para la biodegradación del compuesto en el medio marino, mientras que valores inferiores requerirían estudios adicionales. 5. Su facilidad de cultivo, disponibilidad, relevancia ecológica y sensibilidad hacen de las microalgas marinas N. gaditana, I. galbana, C. gracilis, D. salina y T. chuii especies recomendables en ensayos ecotoxicológicos estándares en el medio acuático marino. CG-2 Conclusiones generales 6. La elevada tolerancia observada en los ensayos con Artemia franciscana ponen en entredicho la utilización de ensayos de mortalidad del crustáceo para la evaluación del riesgo ambiental de los tensioactivos en el medio marino. No obstante, dada las numerosas ventajas que presentan estos organismos (fácil manipulación, disponibilidad, etc.) resultaría conveniente desarrollar ensayos de toxicidad estándar a nivel subletal empleando estos crustáceos. 7. Los resultados obtenidos en los ensayos de toxicidad presentan diferencias importantes dependiendo del taxón, especie y efecto estudiado, lo que pone de manifiesto la necesidad de realizar múltiples ensayos empleando diversas especies correspondientes a diferentes taxones para poder tomar decisiones sobre criterios de calidad y/o limitaciones de utilización, tal y como contempla la Directiva Marco de Aguas y la Guía Técnica para la Evaluación de Riesgos de la Comisión Europea. 8. En los protocolos de evaluación de riesgo ambiental los ensayos combinados de toxicidad y biodegradación constituyen una herramienta útil pues permiten determinar de manera rápida y sencilla, si durante el proceso de biodegradación se generan metabolitos más tóxicos que el compuesto ensayado, o si por el contrario, éste presenta una biodegradabilidad ambientalmente aceptable. Como consecuencia de los resultados obtenidos, se han generado nuevas líneas de actuación que deberían ser consideradas en futuros trabajos: * Realización de ensayos de biodegradación primaria y mineralización de los diferentes tensioactivos empleando concentraciones iniciales de tensioactivos reales, al objeto de conocer la cinética real del proceso biodegradativo. * Realización de ensayos de toxicidad aguda estándar a nivel letal y subletal empleando un mayor número de especies así como organismos pertenecientes a otros grupos taxonómicos, como por ejemplo, peces y anfibios. * Realización de un programa de monitoreo ambiental para establecer las concentraciones de estos tensioactivos en aguas residuales que permitan, en un primer nivel, estimar las concentraciones ambientales (PEC), y si esto no fuese suficiente, determinar los niveles de estos tensioactivos en el medio marino. * Determinación de los valores de no efecto (NOEC) para diferentes estadíos del proceso biodegradativo. CG-3 GENERAL CONCLUSIONS General conclusions The general conclusions obtained from the present Doctoral Thesis are: 1. Conducting biodegradation studies using natural sea water is extremely necessary in order to assess the risk of surfactants in the marine aquatic environment. Although literature concerning the biodegradation of these compounds in natural environment is very scarce, significant differences have been found between the biodegradation rates obtained in this work and those described by several authors in other test media. 2. Kinetic modelling of the biodegradative process is a scientifically valid alternative to the traditional procedure included in the guidelines proposed by different organisations such as the United States Environmental Protection Agency (USEPA) and Organisation for Economic Co-operation and Development (OECD). These models not only make it possible to characterise the chemical biodegradation kinetic but also to estimate the kinetic parameters such as the lag and half-life times accurately. 3. The general use of the parameter lag time (time needed to reach 10% of biodegradation) may be inappropriate in certain cases, as in some processes with a very slow biodegradation rates where this phase does not really exist. For this reason, we propose a modification consisting of the calculation of this parameter only in those cases where the fitted kinetic model considers it. 4. In cases where a negative result (<70% DOC removal before 60 days) and a clearly decreasing tendency of the residual substrate concentration are observed, we propose to increase the maximum test duration (60 days). Whether the biodegradation percentage is equal or higher than 70%, it may be concluded that there is a potential fro biodegradation in the marine environment. However, a negative result (<70%) does not preclude such potential but indicates that further study is necessary. 5. We recommend using the marine microalgae N. gaditana, I. galbana, C. gracilis, D. salina and T. chuii as standard toxicity tests organisms in the marine environment because of their ease of culture, commercial availability, ecological relevance and sensitivity. 6. Since the high surfactant tolerance of the marine crustacean A. franciscana, mortality tests using these organisms are not suitable in the assessment of the environmental risk of surfactants in the marine environment. Nevertheless, their numerous advantages (ease of culture, short generation time, cosmopolitan distribution and commercial availability of the cysts) suggest considering these organisms as a test species in sub-lethal toxicity tests. GC-2 General conclusions 7. The results obtained from the acute toxicity tests show significant differences depending on the taxonomic group, species and effects tested. These results support the Water Framework Directive and the Technical Guidance Document of the European Commission, indicating the necessity of carrying out multiple toxicity tests using several species from different taxonomic groups in order to establish quality criteria or phase out the use of these compounds. 8. Combined toxicity and biodegradation tests are a useful tool for the assessment of the environmental risk procedures. These tests make it possible to determine whether during the biodegradation process, generated metabolites are more toxic than the parent compound or the compound shows an acceptable environmental biodegradability. Based on the results obtained from this investigation, the following recommendations should be considered for further researches: * Conduct additional primary and ultimate biodegradation tests of different surfactants using real environmental concentrations in order to determine the real kinetic of the biodegradative process. * Conduct additional lethal and sub-lethal acute toxicity tests including different species as well as organisms from other taxonomic groups such as fishes or amphibious. * Conduct an environmental monitoring program in order to estimate the environmental predicted concentration (PEC). In a first tier, the concentrations should be determined in wastewater treatment plants, and if it were necessary (tier 2) an additional monitoring should be carried out in the marine environment. * Estimate no-effect-observed concentration values (NOEC) at different stages of the biodegradative process. GC-3