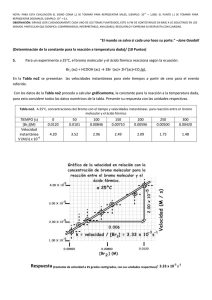
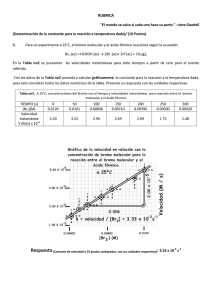
HETEROCÍCLICOS AROMÁTICOS
Anuncio

HETEROCÍCLICOS AROMÁTICOS Bibliografía sugerida: ORGANIC CHEMISTRY. Marc Loudon and David Allen 2nd. Edition. Editorial Benjamin ORGANIC CHEMISTRY Jonathan Clayden,Nick Greeves, Stuart Warren, and Peter Wothers, Ed 2000 Oxford University Press. QUÍMICA ORGÁNICA Seyhan Ege. Ed. Reverté, 1997. QUÍMICA DE FURANO, PIRROL Y TIOFENO Sustitución electrofílica. Principalmente en la posición 2. H3C O CH3 O BF3 O O CH3COOH CH3COOH O O CH3 Acilación de Fridel - Crafts 75% de rendimiento NO2 HNO3 Ac2O S S NO2 S 70% 5% NO2 HNO3 N H Ac2O 20ºC N H 50% NO2 N H 15% El peso de las formas canónicas para pirrol: I II III IV V VI N N N N N N H H H H H H 62% 1% 4% 4% 14.5% 14.5% Entonces: 1.Estabilización adicional del anillo. 2.Anillo π excesivo susceptible al ataque electrofílico. 3.Formas iónicas III y IV más estables. Posiciones α más susceptible al ataque electrofílico. Estabilidad relativa del intermedio. Sustitución en la posición 2: NO2 NO2 N H H N H NO2 NO2 N H H N H H N H H NO2 Sustitución en la posición 3: H H No2 H NO2 NO2 NO2 N H N H N H N H “La reacción que involucra al intermedio más estable procede más rápidamente” (Postulado de Hammond) E E ∆G* ∆G* Progreso de la reacción Progreso de la reacción VELOCIDADES RELATIVAS DE SUSTITUCIÓN (en bromación) PIRROL > FURANO > TIOFENO > BENCENO Además el orden de reactividad de los anillos heterocíclicos hacia la sustitución aromática electrofílica es paralela al orden de los siguientes derivados de benceno: LA REACTIVIDAD ES PARALELA A LA CAPACIDAD DEL HETEROÁTOMO PARA DISPERSAR LA CARGA POSITIVA EN EL CARBOCATIÓN INTERMEDIO > N H3C > O CH3 S CH3 CH3 No existe paralelismo entre el carácter aromático y la reactividadfrente a SEA FURANO PIRROL TIOFENO Eres (Kcal/mol) 16 21-22 29 INFLUENCIA DE LOS SUSTITUYENTES PRESENTES EN LA ACTIVACIÓN Y DIRECCIÓN DE SUSTITUYENTES AROMÁTICOS EN LOS HETEROCICLOS •1. Influencia del sustituyente según las reglas usuales en SE Ar. •2. Influencia directriz del heteroátomo O O O meta (1,3) C C OH C OH OH Br2 AcOH S Br Br S Rend. 69% Procede según 1 y 2 S No observado Sólo según 2 INFLUENCIA DE LOS SUSTITUYENTES PRESENTES EN LA ACTIVACIÓN Y DIRECCIÓN DE SUSTITUYENTES AROMÁTICOS EN LOS HETEROCICLOS •1. Influencia del sustituyente según las reglas usuales en SE Ar. •2. Influencia directriz del heteroátomo para (1,4) O CH3 COH N(CH3)2 C POCl3 O H CH3 O Rend. 96% Mecanismo Reacción de Vilsmeier metadirectriz O2N HNO3 NO2 NO2 ø S heteroátomo dirige posición α O2N NO2 S S 56% 44% 60% Cuando ambas posiciones están ocupadas: O C H3C C H3C CH3 BF3 O O AcOH C H3C CH3 O O AcOH H3C CH3 O Imidazol también da SEAr Equilibrio tautomérico El tautomerismo puede frenarse por alquilación de uno de los Nitrógenos con un electrófilo Ejemplo Sustituciones en anillos benzofusionados La SEAr en indol se da en posición 3 Ataque en 3 Ataque en 2 Intermedio con el anillo bencénico no aromático REACCIONES DE ADICIÓN Se presentan en furano, debido a que posee menor carácter aromático. Br Br Br2 O H O CH3OH MeO OMe SN1 rápido H H O H REACCIONES DE ADICIÓN Se presentan en furano, debido a que posee menor carácter aromático. O O Reacciones de Diles-Alder O O O O O O Dieno Dienófilo Rend. > 90% O O O O N N H H O O REACCIONES DE ADICIÓN Se presentan en furano, debido a que posee menor carácter aromático. Reacciones de Diels-Alder Br Na amalgama O O F Mecanismo: Reacción de Diles-Alder con bencino como dienófilo: Br Na Na amalgama F F F O O La gran aromaticidad hace que tiofeno no sea reactivo frente a dienos en reacción de Diels-Alder Puede oxidarse a sulfona para que pierda aromaticidad N LUMO HOMO Benceno Piridina SUSTITUCIÓN ELECTROFÍLICA NO2 HNO3, H2SO4 270ºC N N Rend. 5% CH3 CH3 NO2 HNO3, H2SO4(fum) 100ºC, 5hs H3 C N CH3 H3 C N CH3 Rend. 93% SO3H H2SO4(conc.) HgSO4,230ºC N N Rend. 78% Etapa lenta de la SEAr en: Sustitución en C-3 H H H H NO2 NO2 NO2 NO2 N N N I II III N Sustitución en C-2 NO2 N NO2 NO2 N H N H N H H II I Estructura III: ión nitronioà Desfavorable Comparar con: H N H NO2 NO2 III N deficitario en electrones H N H NO2 H N H NO2 Aquí N posee una carga positiva pero no es deficiente en electrones Tanto la estabilidad relativa de intermedios como los desplazamientos electrónicos sobre el sustrato justifican la orientación a C-3 en las SE aromáticas. ¿A qué se debe la baja reactividad de piridina frente a SEAr? •Tanto las estructuras resonantes como el valor de µ muestran el anillo deficitario de electrones. •En el medio ácido de las SE Ar, piridina se encuentra protonada. H3O N N H N H N H NO2 N H NO2 H N H Dos cargas positivas muy próximas Quinolina: anillo pirídico desactivado. La sustitución, al igual que en naftaleno, tiene lugar en las posiciones α más activas del anillo. NO2 HNO3, H2SO4 0ºC, 30' N N N 52% H H H NO2 NO2 48% NO2 NO2 NO2 H NO2 H NO2 H NO2 2 1 H NO2 H NO2 NO2 5 4 H NO2 H 7 NO2 NO2 1 a 4 con anillo bencénico intacto 6 NO2 H 1 y 2 con anillo bencénico intacto 3 H H H NO2 H Piridina puede actuar como nucleófilo Sal de piridinio La piridina con electrófilos puede actuar como “carrier” SUSTITUCIÓN NUCLEOFÍLICA SOBRE EL ANILLO PIRÍDICO Analogía entre el enlace C de piridina con el grupo N C O H Nu N Nu N H H CH3 CH3 Nu C O H O C H Nu Reacción de Chichibabin Na+ -NH2 1) calor NaOH H2 2) H2O N N NH2 66 - 76% Na+ - Na+ + NH2 Na NH2 N H N Na+ H NH2 NH2 N N H H HNa N NH2 Una alternativa para preparar piridinas 2-sustituidas. ANÁLISIS DE LA FUERZA IMPULSORA DE LA REACCIÓN El hidruro reacciona con los protones acídicos de la amina para dar un anión e hidrógeno gaseoso. H N H Na N N H N Na+ N N Na Na+ + H H Na+ N H2 N N H N H La salida de hidrógeno gaseoso es la fuerza impulsora para completar la reacción. Finalmente: H2O N N Na+ NaOH N NH2 H 2-amino-piridina: aromático y estable à impulso termodinámico. Mecanismo alternativo para la producción de H2 NH2 N Na H H2 H + N H NH2 H N N N N La pérdida de hidruro como grupo migrante puede relacionarse con la expulsión de -:H en la reacción de Cannizzaro sobre grupo carbonilo: C OH R C H R C OH H2O R C C R Salida de hidruro R O H C O Hidrato O H H OH OH O H H Base conjugada Ocasionalmente O OH O O R C R C O H OH OH Oxidación R Reducción H C R H Utilidad de la 2-aminopiridinas como intermedios sintéticos NaNO2 H+ N NH2 HBr N N2 N N2 Br 2-piridinadiazonio H2O -N2 N N H OH 1 2-hidroxipiridina : 340 2-piridona O A pesar de la relación 1:340 PCl5 ∅ N H N O OH N Cl Nuevamente podemos establecer la relación entre: y N OH N Cl O R R C C OH O Cl Cloruro de ácido Piridinas 2-sustituidas por mejores grupos salientes que hidruro: Na+ MeON Cl MeOH ClNa N Condiciones relativamente suaves O CH3 Analogía de esta reacción de desplazamiento nucleofílico con el correspondiente a un cloruro de acilo: Nu -ClN Cl N R R Nu Nu -ClO Cl O Nu Gran diferencia de reactividad O Me OMe N Cl N N Cl OMe N OMe OMe N Cl Cl K= h.[haluro de arilo] . [nucleófilo] - -Cl N OMe Cl En la mayor parte de las SNAr la etapa determinante de la velocidad es el ataque del nucleófilo, no la salida del grupo haluro. La basicidad del grupo saliente no es determinante de la velocidad como lo es en las SN1 y SN2 de los haluros de alquilo. Efecto del grupo migrante sobre la velocidad de reacción: En SNAr F- >> Cl- » Br- » IEn SN1 y SN2 Orden inverso F- más pobre grupo saliente Sustituciones Nucleofílicas sobre Piridina SN en C-2: Nu Y Nu N Y N N Nu Y SN en C-4: Y Y Nu Nu Nu Y N N N SN en C-3: Nu Nu Y Y N N Nu Nu Y Y N N En C-2 y C-4 la carga negativa del intermedio se deslocaliza sobre el N electronegativo. En C-3 no puede hacerlo. En consecuencia solo se produce sustitución en C-2 y C-4. Otros ejemplo de SNAr En reacción con organometálicos: comportamiento similar a la reacción de Chichibabin Tolueno ∅Li N LiH ∅ N H Cl HN H2N HN HCl N N N H Cl ∅ Obtención de piridinas 2, 4 y 6-sustituidas Piridina N-óxidos reactivos frente a nucleófilos y elctrófilos en las mismas posiciones (2, 4 y 6) AcOH H2O2 N H2O Piridina N-Óxido N 90% O Analogía: N O Piridina N-óxido Más reactivo que piridina. O Fenóxido Más reactivo que fenol. Ambos sustituyen en la posición 4 y 2 Piridina N-óxido con una carga positiva sobre N es mucho menos reactivo que fenol o fenóxido. N N N N O O O O N N N N O O O O Nu δ+ Nu δ+ N O δ+ Nu SEAr sobre N-óxido de piridina H NO2 H NO2 H NO2 NO2 N O Sustitución en C-4 N N NO2 N III II I O O O H NO2 Sustitución en C-3 N NO2 NO2 N N II I O H H O III O Del análisis de las estructuras resonantes puede verse que: 1. En la C-4 sustitución la carga positiva del carbocatión puede estabilizarse por el N-óxido (estructura III). 2. En la C-3 sustitución las formas canónicas II y III son poco plausibles. Ejemplo: NO2 HNO3 fumante N H2SO4 conc. 90ºc, 14hs. O N O En forma similar: NO2 HNO3 fumante H2SO4 conc. 70ºC. N O N O Rend. 67% Eliminación de la función N-óxido: NO2 NO2 H2, C/Pd EtOH N PCl5 Cl3CH NH2 O POCl3 N N N N O O N O Cl Cl Cl P P Cl Cl Cl Cl Cl Cl P Cl Cl Cl SNAr sobre N-óxidos de piridina δ− H3O Ph Ph Reacción de Grignard Mg N Mg Br H2O Br N + δ H O OH Ac)2O H3C 2 N Recordemos la reacción de Grignard sobre el grupo carbonilo δ+ Br Mg R Me C O δ− R O R C Me Br Mg R R Me C R H O OH2 R Me C R OH Mg Br H2O Ph HO C O Otro ejemplo de SNAr sobre N-oxido de piridina Preparación del ácido niflumínico a partir de ácido nicotínico Paso 1 Mecanismo Paso 2 Sales de Piridinio y sus reacciones: Piridina, base de Lewis y también nucleófilo, con haluros de alquilo o ésteres sulfonatos reacciona en reacciones de sustitución nucleofílica bimolecular (S N2) para dar sales de piridinio. H3C I N Ioduro de metil piridinio N Casi cuantitativo CH3 I Alta Reactividad de las sales de piridinio hacia el desplazamiento nucleofílico: [O] OH N OH H K3Fe(CN) 6 N N O H CH3 CH3 CH3 1.El N+ es mucho más electronegativo que el N neutro de piridina. 2. Cuando los nucleófilos son aniones la carga se neutraliza. Nu N H H Nu N H H Son más reactivas hacia los incorporación de reactivos nucleofílicos en C-2 y C-4 de la misma forma que piridina N-óxido que formalmente es un ión piridio. OBTENCIÓN DE PIRIDINAS 4-SUSTITUÍDAS A PARTIR DE SALES DE PIRIDINIO REACTIVAS SOCl2 2 N Cl S N N Cl H Clorhidrato de cloruro de N-(4-piridilpiridinio) O Mecanismo probable: Cl N N H N Cl N H Cl N Cl O S S Cl O N Cl N S Cl S O Cl N Cl S O ClH N Cl N N H Cl O Utilidad del clorhidrato de N-(4-piridilpiridinio) El grupo 4-piridinio es un mejor grupo saliente que cloruro y puede ser desplazado más fácilmente por nucleófilos. SO3H 1. Na2SO3 2. H2O2 45 - 50 % N H N H Cl Me Cl Me N N Cl Me 1. Me2NH NH2 Cl exceso ∅ N Me 47% N N H Cl Cl 1. Cl3Al 2. H2O 70% N N H Cl