la corteza del átomo. configuración electrónica de un elemento.
Anuncio
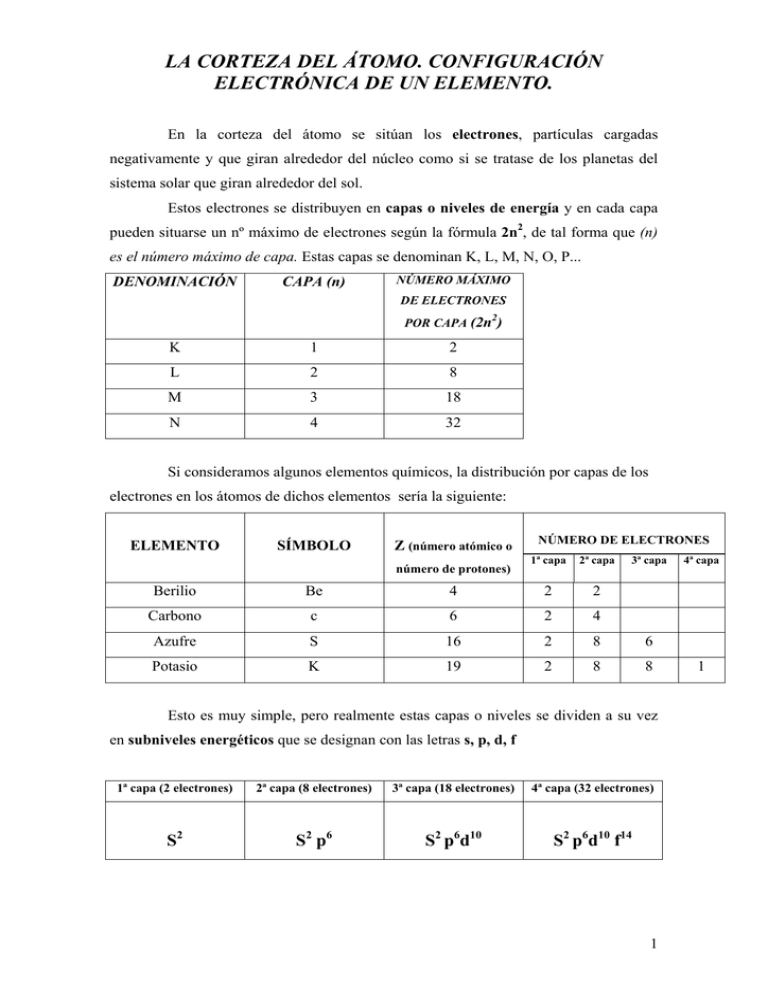
LA CORTEZA DEL ÁTOMO. CONFIGURACIÓN ELECTRÓNICA DE UN ELEMENTO. En la corteza del átomo se sitúan los electrones, partículas cargadas negativamente y que giran alrededor del núcleo como si se tratase de los planetas del sistema solar que giran alrededor del sol. Estos electrones se distribuyen en capas o niveles de energía y en cada capa pueden situarse un nº máximo de electrones según la fórmula 2n2, de tal forma que (n) es el número máximo de capa. Estas capas se denominan K, L, M, N, O, P... DENOMINACIÓN CAPA (n) NÚMERO MÁXIMO DE ELECTRONES 2 POR CAPA (2n ) K 1 2 L 2 8 M 3 18 N 4 32 Si consideramos algunos elementos químicos, la distribución por capas de los electrones en los átomos de dichos elementos sería la siguiente: ELEMENTO SÍMBOLO Z (número atómico o número de protones) NÚMERO DE ELECTRONES 1ª capa 2ª capa 3ª capa Berilio Be 4 2 2 Carbono c 6 2 4 Azufre S 16 2 8 6 Potasio K 19 2 8 8 Esto es muy simple, pero realmente estas capas o niveles se dividen a su vez en subniveles energéticos que se designan con las letras s, p, d, f 1ª capa (2 electrones) 2ª capa (8 electrones) 3ª capa (18 electrones) 4ª capa (32 electrones) S2 S2 p6 S2 p6d10 S2 p6d10 f14 1 4ª capa 1 Recordad el ejemplo de la estantería con 4 huecos (=capas) y que en cada hueco caben un número determinado de libros (2, 8, 18 y 32 respectivamente) que los comparamos con el número de electrones por capa.. Pues bien lo que hemos hecho a continuación es dividir nuestros huecos en otros más pequeños (equivalentes a los subniveles s, p, d y f) y hemos redistribuido los libros (electrones) en estos huecos más pequeños. El orden de llenado de los electrones es siempre de menor a mayor energía y la configuración electrónica se completa mediante el diagrama de möller: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 Seguidamente muestro la configuración electrónica de algunos elementos: Be, Z = 4 : 1s2 2s2 S, Z = 16 : 1s2 2s2 p6 3s2 p4 K, Z = 19 : 1s2 2s2 p6 3s2 p6 4 s1 Ca, Z = 20 : 1s2 2s2 p6 3s2 p6 4 s2 Observad que a partir del calcio los electrones “saltan” a una capa superior (a un nivel energético superior). Fe, Z = 26 : 1s2 2s2 p6 3s2 p6 4 s2 3d6 Las capas marcadas en negrita se corresponden con la capa más externa y sus electrones se denominan electrones de valencia. 2




