249 CARTAS AL DIRECTOR ALTERACIÓN DE LOS NIVELES
Anuncio
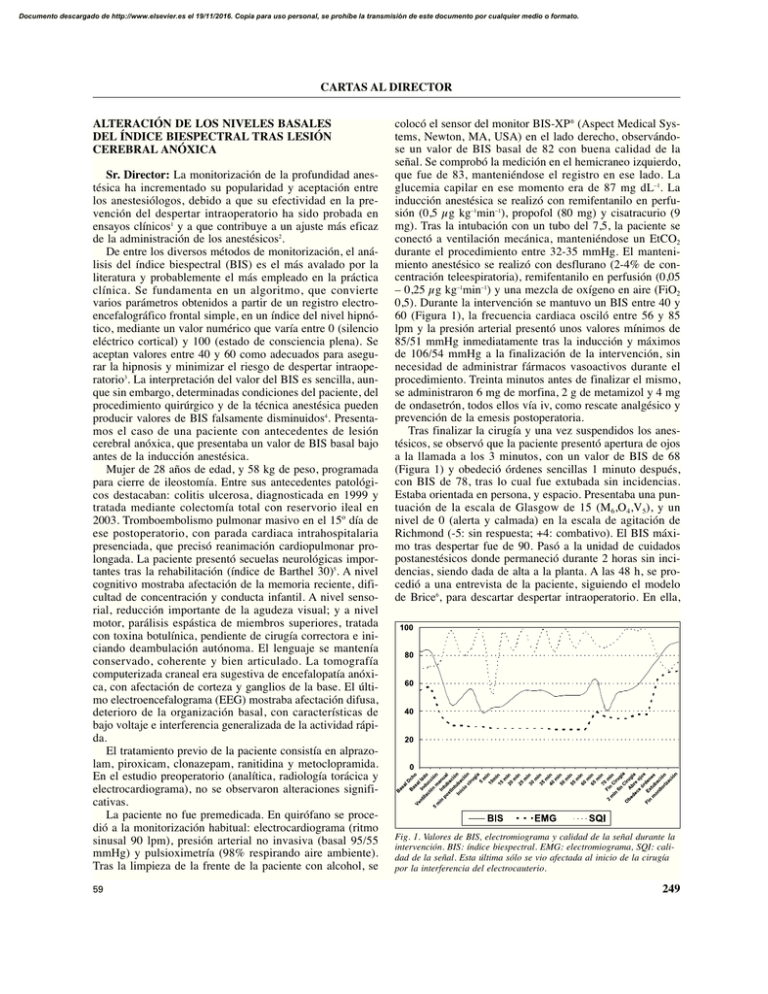
Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR ALTERACIÓN DE LOS NIVELES BASALES DEL ÍNDICE BIESPECTRAL TRAS LESIÓN CEREBRAL ANÓXICA Sr. Director: La monitorización de la profundidad anestésica ha incrementado su popularidad y aceptación entre los anestesiólogos, debido a que su efectividad en la prevención del despertar intraoperatorio ha sido probada en ensayos clínicos1 y a que contribuye a un ajuste más eficaz de la administración de los anestésicos2. De entre los diversos métodos de monitorización, el análisis del índice biespectral (BIS) es el más avalado por la literatura y probablemente el más empleado en la práctica clínica. Se fundamenta en un algoritmo, que convierte varios parámetros obtenidos a partir de un registro electroencefalográfico frontal simple, en un índice del nivel hipnótico, mediante un valor numérico que varía entre 0 (silencio eléctrico cortical) y 100 (estado de consciencia plena). Se aceptan valores entre 40 y 60 como adecuados para asegurar la hipnosis y minimizar el riesgo de despertar intraoperatorio3. La interpretación del valor del BIS es sencilla, aunque sin embargo, determinadas condiciones del paciente, del procedimiento quirúrgico y de la técnica anestésica pueden producir valores de BIS falsamente disminuidos4. Presentamos el caso de una paciente con antecedentes de lesión cerebral anóxica, que presentaba un valor de BIS basal bajo antes de la inducción anestésica. Mujer de 28 años de edad, y 58 kg de peso, programada para cierre de ileostomía. Entre sus antecedentes patológicos destacaban: colitis ulcerosa, diagnosticada en 1999 y tratada mediante colectomía total con reservorio ileal en 2003. Tromboembolismo pulmonar masivo en el 15º día de ese postoperatorio, con parada cardiaca intrahospitalaria presenciada, que precisó reanimación cardiopulmonar prolongada. La paciente presentó secuelas neurológicas importantes tras la rehabilitación (índice de Barthel 30)5. A nivel cognitivo mostraba afectación de la memoria reciente, dificultad de concentración y conducta infantil. A nivel sensorial, reducción importante de la agudeza visual; y a nivel motor, parálisis espástica de miembros superiores, tratada con toxina botulínica, pendiente de cirugía correctora e iniciando deambulación autónoma. El lenguaje se mantenía conservado, coherente y bien articulado. La tomografía computerizada craneal era sugestiva de encefalopatía anóxica, con afectación de corteza y ganglios de la base. El último electroencefalograma (EEG) mostraba afectación difusa, deterioro de la organización basal, con características de bajo voltaje e interferencia generalizada de la actividad rápida. El tratamiento previo de la paciente consistía en alprazolam, piroxicam, clonazepam, ranitidina y metoclopramida. En el estudio preoperatorio (analítica, radiología torácica y electrocardiograma), no se observaron alteraciones significativas. La paciente no fue premedicada. En quirófano se procedió a la monitorización habitual: electrocardiograma (ritmo sinusal 90 lpm), presión arterial no invasiva (basal 95/55 mmHg) y pulsioximetría (98% respirando aire ambiente). Tras la limpieza de la frente de la paciente con alcohol, se 59 colocó el sensor del monitor BIS-XP® (Aspect Medical Systems, Newton, MA, USA) en el lado derecho, observándose un valor de BIS basal de 82 con buena calidad de la señal. Se comprobó la medición en el hemicraneo izquierdo, que fue de 83, manteniéndose el registro en ese lado. La glucemia capilar en ese momento era de 87 mg dL–1. La inducción anestésica se realizó con remifentanilo en perfusión (0,5 μg kg–1min–1), propofol (80 mg) y cisatracurio (9 mg). Tras la intubación con un tubo del 7,5, la paciente se conectó a ventilación mecánica, manteniéndose un EtCO2 durante el procedimiento entre 32-35 mmHg. El mantenimiento anestésico se realizó con desflurano (2-4% de concentración teleespiratoria), remifentanilo en perfusión (0,05 – 0,25 μg kg–1min–1) y una mezcla de oxígeno en aire (FiO2 0,5). Durante la intervención se mantuvo un BIS entre 40 y 60 (Figura 1), la frecuencia cardiaca osciló entre 56 y 85 lpm y la presión arterial presentó unos valores mínimos de 85/51 mmHg inmediatamente tras la inducción y máximos de 106/54 mmHg a la finalización de la intervención, sin necesidad de administrar fármacos vasoactivos durante el procedimiento. Treinta minutos antes de finalizar el mismo, se administraron 6 mg de morfina, 2 g de metamizol y 4 mg de ondasetrón, todos ellos vía iv, como rescate analgésico y prevención de la emesis postoperatoria. Tras finalizar la cirugía y una vez suspendidos los anestésicos, se observó que la paciente presentó apertura de ojos a la llamada a los 3 minutos, con un valor de BIS de 68 (Figura 1) y obedeció órdenes sencillas 1 minuto después, con BIS de 78, tras lo cual fue extubada sin incidencias. Estaba orientada en persona, y espacio. Presentaba una puntuación de la escala de Glasgow de 15 (M6,O4,V5), y un nivel de 0 (alerta y calmada) en la escala de agitación de Richmond (-5: sin respuesta; +4: combativo). El BIS máximo tras despertar fue de 90. Pasó a la unidad de cuidados postanestésicos donde permaneció durante 2 horas sin incidencias, siendo dada de alta a la planta. A las 48 h, se procedió a una entrevista de la paciente, siguiendo el modelo de Brice6, para descartar despertar intraoperatorio. En ella, Fig. 1. Valores de BIS, electromiograma y calidad de la señal durante la intervención. BIS: índice biespectral. EMG: electromiograma, SQI: calidad de la señal. Esta última sólo se vio afectada al inicio de la cirugía por la interferencia del electrocauterio. 249 Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR la paciente refirió que el último recuerdo antes de dormirse fue que alguien le decía que se iba a dormir, el primer recuerdo al despertarse fue el traslado a su cama, no recordaba ensoñaciones y lo peor del proceso quirúrgico fue la espera preoperatoria, seguida del dolor de garganta postoperatorio. Son múltiples las causas que pueden producir valores de BIS basales bajos. En el caso descrito, se descartaron algunas de ellas, como la hipoglucemia, premedicación anestésica, la malposición del sensor, o alteraciones en la calidad de la señal. La paciente tampoco presentó datos hemodinámicos sugestivos de hipovolemia pre ni intraoperatoria. Las lesiones neurológicas isquémicas, hemorrágicas o degenerativas, las parálisis cerebrales o las secuelas graves tras un traumatismo craneal, constituyen situaciones conocidas de afectación del índice biespectral y pueden generar valores basales menores de los habituales4,7. Incluso el BIS ha sido empleado para evaluar la situación neurológica y la expectativa de recuperación en pacientes neurocríticos7,8. También pueden producirse reducciones en los valores de pacientes que presentan electroencefalogramas de bajo voltaje (que aparecen por alteración genética hasta en un 510% de la población, sin que exista disfunción cerebral)4, o secundariamente a patrones electroencefalográficos δ paradójicos (enlentecimiento del EEG durante varios minutos tras la retirada de algunos agentes anestésicos)4, aunque esta última posibilidad no explicaría los valores iniciales bajos. Los niveles más elevados de BIS respecto a los basales durante la recuperación de la anestesia reflejan una actividad cortical global elevada; lo que en un paciente normal se correlaciona con la plena consciencia, pero en un paciente con daño cerebral previo no indica necesariamente actividad cortical integrada4. La entrevista postoperatoria, si bien hay que considerar la discapacidad cognitiva de la paciente, confirmó la ausencia de recuerdo intraoperatorio, tras haber mantenido los niveles de BIS recomendados para la práctica clínica habitual. En conclusión, el caso presentado ilustra una situación de afectación electroencefalográfica y BIS descendido basalmente, en posible relación con el daño cerebral preexistente en la paciente, tras una parada cardiaca, con reanimación prolongada y lesión hipóxica-anóxica. Todas las circunstancias que pueden afectar a los valores del BIS, deben ser conocidas y consideradas por el anestesiólogo para una correcta interpretación de los valores monitorizados. P. Rama-Maceiras, H. Menéndez, Y. Sanduende, N. Molíns Servicio de Anestesiología y Reanimación. Complejo Hospitalario Universitario Juan Canalejo. A Coruña. BIBLIOGRAFÍA 1. Myles PS, Leslie K, Mc Neil J, Forbes A, Chan M for the B-Aware trial group. Bispectral index monitoring to prevent awareness during anaesthesia: the B-Aware randomised controlled trial. Lancet. 2004; 363(9423):1757-63. 2. Añez C, Papaceit J, Sala JM, Fuentes A, Rull M. Repercusión de la monitorización del índice biespectral del electroencefalograma en anestesia intravenosa total con propofol en cirugía sin ingreso. Rev Esp Anestesiol Reanim. 2001;48(6):264-9. 250 3. American Society of Anesthesiologists Task Force on Intraoperative Awareness. Practice advisory for intraoperative awareness and brain function monitoring. Anesthesiology. 2006;104(4):847-64. 4. Dahaba AA. Different conditions that could result in the bispectral index indicating an incorrect hypnotic state. Anesth Analg. 2005;101(1):765-73. 5. Cid-Ruzafa J, Damián-Moreno J. Valoración de la discapacidad física: el índice de Barthel. Rev Esp Salud Pública. 1997;71:127-37. 6. Brice DD, Hetherington RR, Utting JE. A simple study of awareness and dreaming during anaesthesia. Br J Anaesth. 1970;42(6):535-42. 7. Fabregas N, Gambus PL, Valero R, Carrero E, Salvador L, Zavala E, et al. Can bispectral index monitoring predict recovery of consciousness in patients with severe brain injury? Anesth Analg. 2004;101(1):43-51. 8. Gilbert TT, Wagner MR, Halukurike V, Paz HL, Garland A. Use of bispectral electroencephalogram monitoring to asses neurologic status in unsedated, critically ill patients. Crit Care Med. 2001;29(10):19962000. MIOCARDIOPATÍA DE TAKOTSUBO Sr. Director: Presentamos un caso ocurrido en el perioperatorio de una cirugía oftalmológica, que desarrolló un cuadro clínico compatible con Miocardiopatía de Takotsubo (MT). Hay pocos casos descritos en el perioperatorio, no obstante, es habitual que este síndrome sea precedido de un desencadenante de estrés, como puede ser una intervención quirúrgica u hospitalización1. Se trataba de una mujer, 52 años, diabética tipo 2 e hipertensa (no medicada), propuesta para corrección de desprendimiento de retina. Como antecedentes quirúrgicos, varias intervenciones con anestesia general sin complicaciones. La paciente fue premedicada con midazolam, droperidol y dexametasona. Se procedió a la inducción de una anestesia general balanceada con fentanilo, propofol y atracurio. La vía aérea fue asegurada con una mascarilla laríngea. En el mantenimiento anestésico se utilizó sevoflurano, O2 y N2O. Durante el procedimiento, se constató un perfil hipertensivo sin alteraciones electrocardiográficas, interpretado como compatible con la historia clínica. La analgesia intraoperatoria fue suplementada con paracetamol y tramadol. El final de la anestesia cursó sin incidencias. En la Unidad de Recuperación Postanestésica (URPA) y por mantenimiento de hipertensión arterial (170/100mmHg) y taquicardia (110 latidos min–1), se administró un total de 10 mg de labetalol. Veinte minutos después y con mínima respuesta a la terapéutica, la paciente refirió disnea súbita, constatándose desaturación (SpO2 del 92%), taquipnea moderada (24 respiraciones min–1) y crepitantes basales bilaterales. Se interpretó como un edema agudo de pulmón (EAP) iniciando terapéutica con oxígeno, furosemida, nitroglicerina y morfina. El electrocardiograma reveló un ritmo sinusal, con inversión de la onda T de V1-V6, ondas Q de V1-V2 y mala progresión de la onda R de V1-V6. La radiografia de tórax mostró un infiltrado algodonoso bilateral y la gasometría reveló apenas aumento del lactato (3,93 mmol L–1). Analíticamente, presentó una discreta elevación de los marcadores de necrosis miocárdica: Troponina I 0,42 ng mL–1 (normal < 0,07), Mioglobina 34 U L–1 a 37º (normal < 25), CK 39 U L–1 a 37º (valores normales: 24-173). 60