química organica avanzada. tema 10 reacciones de transferencia
Anuncio

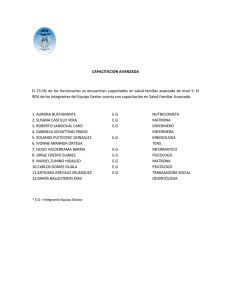
QUÍMICA ORGANICA AVANZADA. TEMA 10 REACCIONES DE TRANSFERENCIA DE CARBANIONES MEDIANTE COMPUESTOS ORGANOMETÁLICOS 1 Química Orgánica Avanzada / Tema 10 / Juan A. Palop QUÍMICA ORGANICA AVANZADA. TEMA 10 REACCIONES DE TRANSFERENCIA DE CARBANIONES MEDIANTE COMPUESTOS ORGANOMETÁLICOS El término ORGANOMETÁLICO comprende todos aquellos compuestos que presentan metales unidos a fragmentos orgánicos: metal-alquilo o arilo, alcóxidos, arilóxidos, sales de ácidos, compuestos de coordinación... Estudiaremos aquí los que presentan enlace C-Metal como potenciales carbaniones para utilizar en la síntesis de nuevos enlaces C-C. 2 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Característica principal: polaridad del enlace C-Metal y su heterolisis. Fórmulas moleculares distintas : R-Mg-X, R-Cd-R, R-Cu. Volúmenes en R y en la molécula total variables (también halógeno) lo que influye en la reactividad por razones estéricas. La capacidad de transferencia del carbanión es variable, depende de varios factores y establece la diferencia principal de reactividad entre ellos. 3 Química Orgánica Avanzada / Tema 10 / Juan A. Palop ORGANOMAGNÉSICOS, MAGNESIANOS O REACTIVOS GRIGNARD R-Mg-X R = alquilo o arilo; X = I, Br, Cl (estabilizante del metal positivo) Preparación: Mg (activo) + éter o THF (seco) + halogenuro alquilo o arilo R-Mg-X + H-OH R-H + OH- + X-Mg+ Estructura en disolución: complejo tetracoordinado por R, X y 2 moléculas de disolvente (O: , N:) o asociaciones de dímeros. Br OEt2 Mg Mg C6H5 OEt2 C6H5 C6H5 Br Et2O Mg Br OEt2 4 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Mecanismo de acción: R Mg X R A B A B MgX H2O H+ R A B H La línea de trazos es un enlace si se ha partido de A==B. HO-Mg-X queda como subproducto. La hidrólisis ácida final de la sal magnésica es una necesidad de todos los procesos con magnesianos que forman intermedios iónicos (a veces se omite aunque se supone). 5 Química Orgánica Avanzada / Tema 10 / Juan A. Palop REACCIONES: R-Mg-I MgBr + + R’-I R-R’ O CH2-CH(OH)-CH3 CH3 R1-CO-R2 + R3-Mg-X R1-C(OH)-R2 R3 R’-COOEt + 2 R-MgX R’-C(OH)-R R 6 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Carbonatación: R-Mg-Cl + CO2 R-COOMgCl R-COOH HIDRÓLISIS ÁCIDA Reacciones con nitrogenados: R’-CH=N-R’’ + R-MgX R’-CN + R-MgX R’-CH(R)-N(MgX)-R’’ R’-C(R)=NMgX R’-C(R)=NH R’-CH(R)-NH-R’’ R’-C(R)=O 7 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Comportamiento básico (interferencia): R’-COOH + R-MgX R’-COOMgX + RH INCOMPATIBILIDAD DE GRUPOS CON MAGNESIANOS: -OH (alcohol y fenol) -SH -CΞCH -CO-NH2 -NH- -NH2 -COOH H2O -SO3H -CO-NH-R ¡¡ TAMPOCO PUEDEN ESTAR PRESENTES CARBONOS ELECTRÓFILOS EN LA MOLÉCULA !! 8 Química Orgánica Avanzada / Tema 10 / Juan A. Palop O REACCIONES COMPETITIVAS (QUIMIOSELECTIVIDAD) Carbonilos α,β- insaturados O O R Controlado por R factores estéricos (+ volumen magnesiano) OH O R R H H H3C O O H3C Química Orgánica Avanzada / Tema 10 / Juan A. Palop 9 ORGANOLÍTICOS: Preparación: 1. Sustitución de halógeno: R-X + 2 Li R-Li + LiX (ausencia agua, O2 y bajas temperaturas) Para haluros poco reactivos (vinilo, arilo): R-Br + n-Bu-Li R-Li + n-Bu-Br 2. Sustitución de hidrógeno ácido (Metalación): R-CΞC-H + R’-Li R-CΞC-Li + R’-H CH2=CH-OCH3 + n-Bu-Li CH2=C(Li)-OCH3 Nucleófilos más potentes que los magnesianos (Li [1.0] más positivo que Mg [1.2] supone más fácil transferencia del carbanión) y menos afectados por los impedimentos estéricos (sin halógeno más fácil aproximación). 10 Química Orgánica Avanzada / Tema 10 / Juan A. Palop O NO reacciona con magnesianos CH3 H3C CH3 SI reacciona con organolíticos CH3 Entra yoduro de fenilmagnesio H O H3C Entra fenillitio 11 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Reaccionan con el anión carboxilato: R’-COOH + 2 R-Li R’-COOLi R’RC(OLi)2 R’-CO-R Alquilación: But CH3CH2CH2CH2-Li O But + OH OH Adición a carbonilo: S H3C O S n-Bu-Li H3C OH S But + S But R OH H3C Ataque más despejado que rinde el estereoisómero más estable con el grupo But en ecuatorial (S,S). 12 Química Orgánica Avanzada / Tema 10 / Juan A. Palop DERIVADOS ORGANOMETÁLICOS DE COBRE Existen con diferentes proporciones y números de coordinación: ORGANOCUPROSOS: R-X + 2Li R-Li [ + 1 CuI ] R-Cu Estructura de complejo de coordinación ORGANOCUPROLÍTICOS: R-X + 2Li R-Li [ + ½ CuI ] ½ Li[R-Cu-R] Estos últimos tienen gran utilidad en la reacción de COREY-HOUSE: Br LiCu(CH3)2 Br Sustitución nucleófila de orden 2 para síntesis de alcanos. 13 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Reaccionan con halogenuros poco reactivos, vinílicos y aromáticos: C6H5-CH=CH-Br + LiCuR2 C6H5-CH=CH-R C6H5-Br + LiCu[CH2=C(CH3)]2 C6H5-C(CH3)=CH2 Reacción con ésteres sulfónicos: C6H5-SO2-O-R’ + LiCuR2 R-R’ Quimioselectividad en carbonilos: O LiCuR2 (-78º C) O Cl REACCIONA NO REACCIONA 14 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Reacción con epóxidos: LiCuR2 R OH O O LiCuR2 OH + R OH R mayoritario Ataque poco favorecido, producto minoritario 15 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Reacciones de adición conjugada: O COOEt O R COOEt CHO 16 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Derivados organocuprosos (más inestables, menos reactivos): R1 R2 H R2 COOH CO2 H Li R1 R1 H R2 CN Cl-CN CuBr R1 H CH2= CH-CH2-Br R1 H R2 Cu H R1 O R2 MgBr R2 R1 CH2-CH=CH2 H R2 OH Se proponen como ejemplo los útiles alquenil-Cu 17 Química Orgánica Avanzada / Tema 10 / Juan A. Palop DERIVADOS ORGANOMETÁLICOS DE CADMIO: Preparación: CdCl2 + 2 R-Li R-Cd-R + 2 LiCl CdCl2 + 2 R-MgX R-Cd-R + 2MgXCl Poco reactivos, sólo reaccionan con carbonilos de haluros de acilo permitiendo QUIMIOSELECTIVIDAD: O O O R-Cd-R O Cl R O O OH R-MgX R R R OH R Comparación de reactividades entre organocádmicos y organomagnésicos 18 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Caso práctico: diseñar la síntesis de 2,4-dimetil-3-hexanona disponiendo de reactivos de cuatro carbonos. O Quimioselectividad: Sí reacciona con cloruros de ácido y no con cetonas Desconexión O SINTONES + - O Cl Cd INTENTE LA SINTESIS DISPONIENDO SÓLO DE REACTIVOS DE 3 CARBONOS. EQIVALENTES SINTÉTICOS TGF Br Objetivo sintético de los reactivos organometálicos: facilitar la transferencia de carbaniones para formación nuevos enlaces C-C. 19 Química Orgánica Avanzada / Tema 10 / Juan A. Palop DERIVADOS ORGANOMETÁLICOS DE CINC Formación: 2 R-I + 2 Zn R-Zn-R + ZnI2 Reactividad: Menor reactividad que magnesianos y similar a derivados de cadmio. REACCIÓN DE REFORMATZKY Reactivos de cinc formados in situ: Br COOEt Zn O-Zn-Br Br-Zn R COOEt R R OEt Sugerencia: Hell-Volhard-Zelinsky Reaccionan con compuestos carbonílicos pero no con ésteres. 20 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Objetivo de la reacción de Reformatzky: síntesis de β-hidroxiésteres o ésteres α,β-insaturados Br-Zn R1 O R2 + R1 OH COOEt R1 COOEt R2 R COOEt R R2 R Desconexiones que permite esta reacción: R1 OH R1 COOEt R2 R COOEt sintón positivo equivalente: cetona R2 R sintón negativo equivalente: reactivo Reformatzky 21 Química Orgánica Avanzada / Tema 10 / Juan A. Palop REACCIÓN DE BLAISE: COOEt R' N + R Br-Zn COOEt R O N Zn-Br COOEt R R' R' Objetivo sintético: β-cetoésteres por adición a insaturación de nitrilo desconexión sintón positivo: nitrilo O R' COOEt R sintón negativo: reactivo cíncico 22 Química Orgánica Avanzada / Tema 10 / Juan A. Palop ENOLATOS DE CINC PROCEDENTES DE α-HALOCETONAS: R-CO-CH2-Br + Zn R-CO-CH2-Zn-Br O O + O OH O H ZnBr Enolatos de cinc estabilizados pueden utilizarse como nucleófilos en la condensación aldólica mixta 23 Química Orgánica Avanzada / Tema 10 / Juan A. Palop ACETILUROS METÁLICOS: Son las sales de alquinos terminales actuando como ácidos. Preparación: R-CΞC-H + NaNH2 / NH3 R-CΞC-Na R-CΞC-H + n-Bu-Li / éter R-CΞC-Li R-CΞC-H + R’-MgCl / THF R-CΞC-MgCl Reactividad: Nucleófilos más débiles que los alquil o aril metales No reaccionan con cetonas (sí con aldehídos) No reaccionan con ésteres (sí con cloruros de ácido). 24 Química Orgánica Avanzada / Tema 10 / Juan A. Palop REACCIONES DE LOS ACETILUROS METÁLICOS: Sustitución nucleófila de orden 2 en halogenuros de alquilo: Br-CH2-CH2-CH2-Br + CH3-CΞCNa CH3-CΞC-CH2-CH2-CH2-CΞC-CH3 Adición a carbonilo (sólo aldehídos): C6H5-CHO + CH3-CH2-CΞCLi C6H5-CH(OH)-CΞC-CH2-CH3 Sustitución en el acilo (haluros): EtOOC-CH2-CH2-COCl + C6H5-CΞC-MgI EtOOC-CH2-CH2-CO-CΞC-C6H5 25 Química Orgánica Avanzada / Tema 10 / Juan A. Palop Fin del Tema 10 26 Química Orgánica Avanzada / Tema 10 / Juan A. Palop 27 Química Orgánica Avanzada / Tema 10 / Juan A. Palop