- El concepto de grupo funcional y de serie homóloga
Anuncio
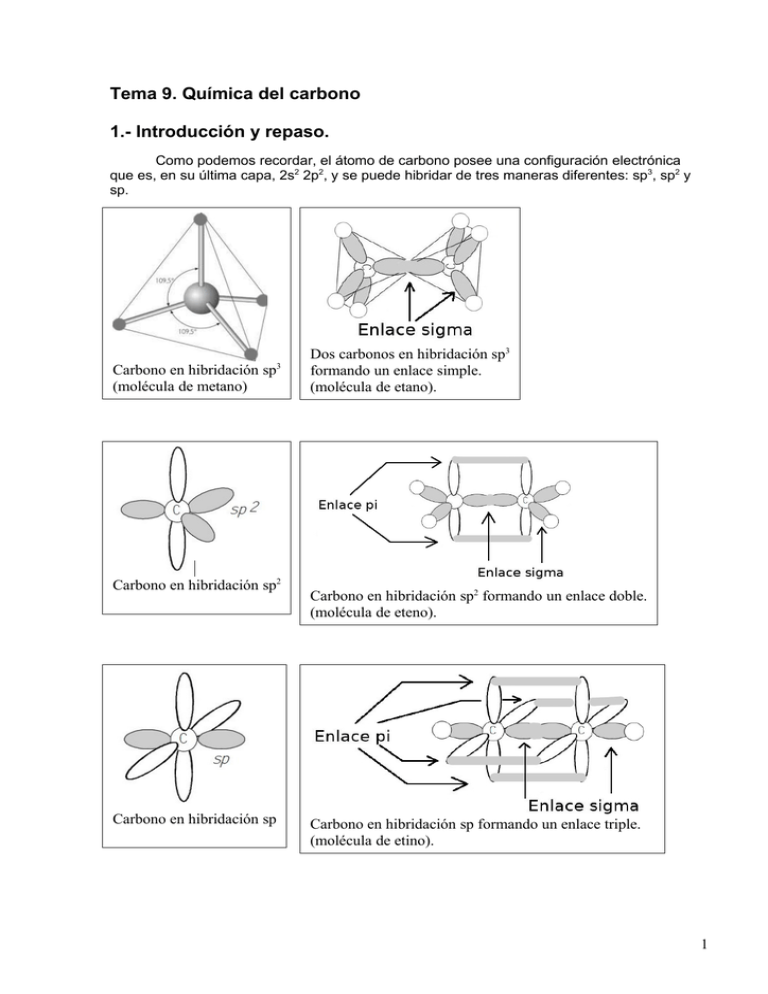
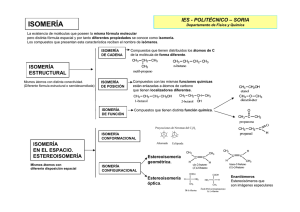
Tema 9. Química del carbono 1.- Introducción y repaso. Como podemos recordar, el átomo de carbono posee una configuración electrónica que es, en su última capa, 2s2 2p2, y se puede hibridar de tres maneras diferentes: sp3, sp2 y sp. Carbono en hibridación sp3 (molécula de metano) Carbono en hibridación sp2 Carbono en hibridación sp Dos carbonos en hibridación sp3 formando un enlace simple. (molécula de etano). Carbono en hibridación sp2 formando un enlace doble. (molécula de eteno). Carbono en hibridación sp formando un enlace triple. (molécula de etino). 1 La hibridación sp3 es la que adopta el carbono para formar enlaces simples C-C, la sp2 es la que adopta para formar enlaces dobles C=C y la sp es la que toma para formar los enlaces triples CC. En todo caso, el resultado es que el carbono tiene cuatro electrones de valencia que residen cada uno en un orbital distinto, de manera que el carbono cuando reacciona, siempre forma cuatro enlaces, ya sean estos sencillos o múltiples. Lo que hace único al carbono entre todos los elementos, y lo que origina que haya toda una rama de la química dedicada a sus compuestos es que, además de tener una alta capacidad de combinación con otros elementos (ya hemos visto que tiene cuatro electrones dispuestos a reaccionar), es que es capaz de combinarse consigo mismo formando larcas cadenas de un número altísimo de átomos, y con una gran cantidad de geometrías y ramificaciones diferentes. 2. El concepto de grupo funcional y de serie homóloga. Se conocen millones de compuestos orgánicos. ¿Se puede hacer un estudio de los mismos, agrupándolos en unos pocos tipos, según su comportamiento químico? La respuesta es sí, fijándonos en ciertas agrupaciones características de átomos que dan las características reactivas de las moléculas, los llamados grupos funcionales. En química orgánica, los grupos funcionales son estructuras submoleculares, caracterizadas por una conectividad y composición elemental específica que confiere reactividad a la molécula que los contiene. Los compuestos orgánicos más sencillos son los hidrocarburos, que están compuestos por carbono e hidrógeno. Dentro de este grupo, los hidrocarburos saturados son las sustancias orgánicas más inertes, pues sus enlaces son sencillos y de polaridad nula (C-C) o casi nula (C-H). El resto de los compuestos orgánicos están formados, fundamentalmente, por una cadena hidrocarbonada y un grupo funcional. De este grupo funcional depende el comportamiento químico de toda la molécula. Así, por ejemplo, el butan-1-ol, CH3CH2CH2CH2OH, se puede considerar que está formado por dos partes: el grupo butilo, CH3CH2CH2CH2-, que no reacciona y el grupo hidroxilo –OH, que es el grupo funcional y es la parte de la molécula que reacciona. 2 De este modo, podemos asegurar que el comportamiento químico del butan-1-ol se repetirá en otros compuestos que también contengan el grupo –OH. Todos ellos se agrupan bajo el nombre general de alcoholes y se representan por R-OH, siendo R, en general, la parte hidrocarbonada de la molécula. Gracias al agrupamiento de las sustancias según sus grupos funcionales, se puede reducir el estudio de los millones de sustancias orgánicas a unos pocos tipos de comportamiento químico similar. Las llamadas series homólogas están formadas por compuestos que contienen un mismo grupo funcional. Los compuestos que pertenecen a la misma serie homóloga difieren entre sí en la longitud de la cadena hidrocarbonada. 3. Reacciones orgánicas. Debido a que lo compuestos orgánicos son covalentes, en la química orgánica son infrecuentes las reacciones iónicas, tan comunes en la química inorgánica. Además, los enlaces de las moléculas orgánicas son muy fuertes, por lo que las energías de activación son elevadas y la velocidad de las reacciones suelen ser lentas. Para acelerarlas, es habitual el uso de catalizadores y la elevación de la temperatura, pero con la elevación de la temperatura 3 hay que ser cuidadoso, debido a la falta de estabilidad térmica de mucho de estos compuestos y su gran tendencia a la combustión, que resultarían en la destrucción del compuesto. Una gran parte de las reacciones en Química Orgánica se pueden clasificar en: 1. Reacciones de Sustitución 2. Reacciones de Adición 3. Reacciones de Eliminación 4. Reacciones de oxidación-reducción 3.1. Reacciones de sustitución: Un átomo o un grupo de átomos de una molécula, sustrato, es sustituido por otro átomo o grupo de átomos de otra, denominada reactivo. El reactivo puede ser un radical libre, un nucleófilo o un electrófilo. En la mayoría de las reacciones de sustitución que experimentan los alcanos, el reactivo es un radical. CH4 + Cl2 ClCH3 +HCl H-Br + CH3-OH CH3-Br + H2O 3.1.1 Sustitución electrófila en compuestos aromáticos. En la sustitución electrófila aromática un átomo, normalmente hidrógeno, unido a un sistema aromático es sustituido por un grupo electrófilo. Esta es una reacción muy importante en química orgánica, tanto dentro de la industria como a nivel de laboratorio. Permite preparar compuestos aromáticos sustituidos con una gran variedad de grupos funcionales según la ecuación general: ArH + EX → ArE + HX El catalizador suele ser AlCl3, X = halógeno El HNO3 actúa como reactivo en la forma OH-NO2. El H2SO4 actúa como catalizador El H2SO4 actúa como catalizador y como reactivo. Como reactivo actúa en la forma OH-HSO3 4 3.2. Reacciones de adición: Una molécula incorpora a su estructura otra molécula. Este tipo de reacciones ocurren sobre sustratos con dobles o triples enlaces originando un producto con mayor grado de saturación. Regla de Markovnikov: La adición de un reactivo del tipo HX (H2O, HCl…) a un doble enlace de un alqueno da lugar a un producto mayoritario en el que el hidrógeno del reactivo se ha unido al átomo de carbono que inicialmente tenía mayor número de átomos de hidrógeno. 3.3 Reacciones de eliminación: Una molécula pierde un grupo de átomos y origina una nueva molécula con un enlace múltiple, doble o triple. Regla de Saytzeff: En las reacciones de eliminación, usualmente predominan los alquenos más sustituidos, como productos de la reacción. 3.4 Reacciones de oxidación-reducción: Entre los procesos de oxidación-reducción que pueden experimentar los compuestos orgánicos se encuentra la combustión, la reacción de oxidación más típica de los hidrocarburos. La combustión es una reacción química muy exotérmica que se produce en presencia de oxígeno, que en cantidad abundante, origina dióxido de carbono y agua como productos. 3.4.1 Reacciones de oxidación-reducción en alcoholes. La oxidación de alcoholes es una reacción orgánica importante. Los alcoholes primarios (R-CH2-OH) pueden ser oxidados a aldehídos (R-CHO) o ácidos carboxílicos (R-COOH), mientras que la oxidación de alcoholes secundarios (R1R2CH-OH), normalmente termina formando cetonas (R1R2C=O) 5 3.5 Reacciones de condensación. Una reacción de condensación, en química orgánica, es aquella en la que dos moléculas se combinan para dar un único producto acompañado de la formación de una molécula de agua. 3.5.1 Reacciones de esterificación: Se denomina esterificación al proceso por el cual se sintetiza un éster. Un éster es un compuesto derivado formalmente de la reacción química entre un ácido carboxílico y un alcohol. Si en vez de usar un alcohol para neutralizar el ácido carboxílico, usamos una base inorgánica obtenemos las sales del ácido: CH3COOH + Ácido etanoico + NaOH hidróxido sódico → → CH3COONa + Acetato sódico + H2O agua. 3. Isomería. Una fórmula inorgánica, por ejemplo, HNO3, corresponde a un solo compuesto, ácido nítrico. Sin embargo, en química orgánica no suele suceder esto, sino que una fórmula puede corresponder a más de un compuesto. Por ejemplo, la fórmula C2H6O puede corresponder a dos compuestos con características químicas totalmente diferentes, como el metanol y el metil-metil-éter: CH3-CH2-OH; CH3-O-CH3. Se dice que dos compuestos son isómeros cuando, siendo diferentes, responden a la misma fórmula molecular. 6 Esto se debe a que los mismos átomos están agrupados de manera diferente y constituyen, por tanto, dos moléculas distintas. Los isómeros son compuestos que tienen igual fórmula molecular, pero distinta fórmula estructural. La isomería pede ser plana y del espacio. La isomería plana se puede explicar mediante fórmulas planas, mientras que para explicar la del espacio tendremos que recurrir a modelos tridimensionales. Hay distintos tipos de isomerías planas y del espacio, que quedan resumidas en el siguiente esquema: De cadena Plana De posición De función Tipos de isomería Geométrica Del espacio Óptica 3.1 Isomería de cadena: Los isómeros de cadena poseen el mismo grupo funcional pero distinta estructura de cadena. Ejemplos: butano y metilpropano o isobutano. CH3-CH2-CH2-CH3 butano C4H10 metilpropano 3.2 Isomería de posición. Los isómeros de posición poseen el mismo grupo funcional colocado en posición diferente en una misma cadena carbonada. Ejemplos pentan-2-ona y pentan-3-ona. CH3-CO-CH2-CH2-CH3 pentan-2-ona C5H10O CH3-CH2-CO-CH2-CH3 pentan-3-ona. 3.3 Isomería de función. Los isómeros de función tienen la misma fórmula molecular pero distintos grupos funcionales. Ejemplos etanol y etil-etil-éter. CH3-CH2-OH etanol C2H6O CH3-O-CH3 etil-etil-éter 7 3.4 Isomería geométrica. Se presenta en compuestos con doble enlace en la que los grupos enlazados a los carbonos que forman el doble enlace se repiten dos a dos. Por ejemplo, el but-2-eno presenta dos isómeros, uno de ellos con los dos grupos metilo al mismo lado (isómero cis) y el otro el los lados opuestos (isómero trans) del doble enlace. Nótese que, con las últimas recomendaciones de la IUPAC, ambos compuestos deben ser nombrados cis-but-2-eno y trans but-2-eno. 3.5. Isomería óptica. Hay algunos isómeros que poseen iguales propiedades tanto físicas como químicas, diferenciándose tan sólo en su distinto comportamiento frente a la luz polarizada. Un isómero desvía el plano de polarización de la luz hacia la derecha (isómero dextro o (+)) y el otro hacia la izquierda (isómero levo o (-)) en igual magnitud. Por eso, a este tipo de isomería se le llama isomería ótica y a los isómeros, isómeros ópticos o enantiómeros. Para explicar la isomería óptica, vamos a estudiar lo que es un carbono asimétrico. Se dice que un carbono es asimétrico si está unido a cuatro átomos o grupos distintos. Aparentemente las dos moléculas representadas arriba son iguales, pero si nos fijamos con atención, veremos que ambas tienen configuraciones diferentes, ya que al tratar de superponerlas no coinciden. Una viene a ser como la imagen especular de la otra, de la misma manera que nuestras manos son imágenes especulares una de la otra y no se pueden superponer una sobre la otra Pues bien, cada estas dos moléculas son isómeros ópticos una de la otra. Una de ellas será el isómero dextro y el otro el levo. Siempre que nos encontremos una molécula quiral (quiros en griego = mano), es decir, con un carbono asimétrico, hallaremos isómeros ópticos. Así, por ejemplo el ácido láctico CH3-CHOH-COOH, posee un carbono asimétrico, el segundo, como puede apreciarse en su fórmula desarrollada: Entonces, podremos encontrar los dos isómeros ópticos, el dextro y el levo. 8 RESOLUCIÓN DE CUESTIONES Cuestión 1 Razone si son verdaderas o falsas las siguientes afirmaciones: a) Recibe el nombre de grupo funcional un átomo o grupo de átomos distribuidos de tal forma que la molécula adquiere unas propiedades químicas características. b) Dos compuestos orgánicos que poseen el mismo grupo funcional siempre son isómeros. c) Dos compuestos orgánicos con la misma fórmula molecular pero distinta función, nunca son isómeros. Cuestión 2 Justifique la veracidad o falsedad de las siguientes proposiciones: a) Los hidrocarburos saturados son mucho más reactivos que los insaturados. b) Grupo funcional es un átomo o grupo de átomos que confiere a la cadena hidrocarbonada unas propiedades químicas características. c) En el metano el carbono presenta hibridación sp3. Cuestión 3 Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del metano es menor que el del 1-butanol. b) La molécula CHCl3 posee una geometría tetraédrica con el átomo de carbono ocupando la posición central. c) El etano es más soluble en agua que el etanol. Cuestión 4 Las fórmulas moleculares de tres hidrocarburos lineales son: C 3H6; C4H10; C5H12. Razone si son verdaderas o falsas las siguientes afirmaciones: a) Los tres pertenecen a la misma serie homóloga. b) Los tres presentan reacciones de adición. c) Los tres poseen átomos de carbono con hibridación sp 3. Cuestión 5 Las fórmulas moleculares de tres hidrocarburos lineales son: C 2H4; C3H8; C4H10. Razone si son verdaderas o falsas las siguientes afirmaciones: a) Los tres pertenecen a la misma serie homóloga. b) Los tres experimentan reacciones de sustitución. c) Sólo uno de ellos tiene átomos de carbono con hibridación sp 2. Cuestión 6 a) Indique los grupos funcionales presentes en las siguientes moléculas: i) CH3CH2CHOHCH3 ii) CH3CHOHCHO iii) CH3CHNH2COOH b) Escriba un isómero de función de la molécula del apartado i). c) Escriba un isómero de posición de la molécula del apartado ii). Cuestión 7 Indique si la estructura de cada pareja representa el mismo compuesto o compuestos diferentes, identificando los grupos funcionales presentes: a) CH3CH2OCH3 y CH3OCH2CH3 b) CH3CH2OCH3 y CH3CHOHCH3 c) CH3CH2CH2OH y CH3CHOHCH3 Cuestión 8 Indique los grupos funcionales de las siguientes moléculas: a) CH3CH2COCH2CH3 b) CH3CH2CHOHCOOH c) CH3CH2CHNH2CHO 9 Cuestión 9 Defina serie homóloga e indique cuáles de los siguientes compuestos pertenecen a la misma serie que CH3OH: a) CH3CH2CH2CH2OH b) CH3CH2OH c) CH3COOH Cuestión 10 Dados los compuestos: butan-2-ol, CH3CHOHCH2CH3, y 3-metilbutanol, CH3CH(CH3)CH2CH2OH, responda, razonadamente, a las siguientes cuestiones: a) ¿Son isómeros entre sí? b) ¿Presenta alguno de ellos isomería óptica? Cuestión 11 a) Defina serie homóloga. b) Escriba la fórmula de un compuesto que pertenezca a la misma serie homóloga de cada uno de los que aparecen a continuación: CH3CH3; CH3CH2CH2OH; CH3CH2NH2. Cuestión 12 Defina los siguientes conceptos y ponga un ejemplo de cada uno de ellos: a) Serie homóloga. b) Isomería de cadena. c) Isomería geométrica. Cuestión 13 Dados los siguientes compuestos: CH3COOCH2CH3 , CH3CONH2 , CH3CHOHCH3 y CH3CHOHCOOH a) Identifique los grupos funcionales presentes en cada uno de ellos. b) ¿Alguno posee átomos de carbono asimétrico? Razone su respuesta. Cuestión 14 Explique uno de los tipos de isomería que pueden presentar los siguientes compuestos y represente los correspondientes isómeros: a) CH3COCH3 b) CH3CH2CH2CH3 c) CH3CHFCOOH Cuestión 15 Las fórmulas moleculares de tres hidrocarburos lineales son: C 2H4; C3H8 y C4H10. Razone si son verdaderas o falsas las siguientes afirmaciones: a) Los tres pertenecen a la misma serie homóloga. b) Los tres experimentan reacciones de sustitución. c) Sólo uno de ellos tiene átomos de carbono con hibridación sp 2. Cuestión 16 Defina los siguientes conceptos y ponga un ejemplo de cada uno de ellos: a) Isomería de función. b) Isomería de posición. c) Isomería óptica. Cuestión 17 Explique por qué el CH3CH2CH2OH es más soluble en agua que el CH3CH2CH2CH3. Cuestión 18 Dados los siguientes compuestos orgánicos: CH3CH2CH3; CH3OH; CH2=CHCH3. Indique razonadamente: a) ¿Cuál es soluble en agua? b) ¿Cuáles son hidrocarburos? c) ¿Cuál presenta reacciones de adición? 10 Cuestión 19 Los compuestos CH3CH2OH y CH3CH2CH3 tienen masas moleculares similares. Indique, justificando la respuesta: a) Cuál tiene mayor punto de fusión. b) Cuál de ellos puede experimentar una reacción de eliminación y escríbala. Cuestión 20 Complete las siguientes reacciones e indique de qué tipo son: 11 Cuestión 21 Indique el tipo a que pertenece cada una de las siguientes reacciones: Cuestión 22 Ponga un ejemplo de cada una de las siguientes reacciones: a) Adición a un alqueno. b) Sustitución en un alcano. c) Deshidratación de un alcohol. d) Reacción de eliminación de HCl en un cloruro de alquilo. 12